β-葡萄糖醛酸苷水解酶简介
β-葡萄糖苷酶

β-葡萄糖苷酶的研究1837年,Liebig和Wohler首次在苦杏仁汁中发现了β-葡萄糖苷酶。
β-葡萄糖苷酶(EC 3.2.1.21)的英文名是β-glucosidase,属于水解酶类,又称β-D-葡萄糖苷水解酶,别名龙胆二糖酶、纤维二糖酶和苦杏仁苷酶。
它可催化水解结合于末端非还原性的β-D-糖苷键,同时释放出配基与葡萄糖体。
β-葡萄糖苷酶广泛存在于自然界中,它可以来源于植物、微生物,也可来源于动物。
β-葡萄糖苷酶的植物来源有人参、大豆等;微生物来源的报道较多,如原核微生物来源的有脑膜脓毒性黄杆菌(Flavobacterium meningosepticum)、约氏黄杆菌(Flavobacterium johnsonae)等,真核生物来源的有清酒酵母(Candida peltata)、黄孢原毛平革菌(Phanerochaete chrysosporium)等;β-葡萄糖苷酶的动物来源有蜜蜂、猪肝和猪小肠等。
鉴于β-葡萄糖苷酶的研究广泛,本文对其一些研究进展进行讨论。
1 β-葡萄糖苷酶的分类β-葡萄糖苷酶按其底物特异性可以分为3类:第一类是能水解烃基-β-葡萄糖苷或芳香基-β-葡萄糖苷的酶,此类β-葡萄糖苷酶能水解的底物有纤维二糖、对硝基苯-β-D-葡萄糖苷等;第二类是只能水解烃基-β-葡萄糖苷的酶,这类β-葡萄糖苷酶能水解纤维二糖等;第三类是只能水解芳香基-β-葡萄糖苷的酶,这类酶能水解对硝基苯-β-D-葡萄糖苷等类似物。
2 β-葡萄糖苷酶的提取、纯化及酶活测定方法2.1 β-葡萄糖苷酶的提取方法不同来源的β-葡萄糖苷酶,其提取方法也有所不同。
动植物体及大型真菌中的糖苷酶一般需要对酶源进行组织捣碎,然后用缓冲液浸提。
常用的缓冲液有磷酸盐缓冲液、醋酸盐缓冲液、柠檬酸盐缓冲液等。
pH值一般选用酶的稳定pH值;提取温度适于低温,一般为4 ℃。
利用微生物发酵法生产β-葡萄糖苷酶是β-葡萄糖苷酶的另一来源,一般微生物发酵都采用液态发酵。
β-葡萄糖醛酸酶和硫酸酯酶

β-葡萄糖醛酸酶和硫酸酯酶β-葡萄糖醛酸酶和硫酸酯酶是两种重要的酶类,在生物化学和生物技术领域有着广泛的应用。
本文将分别介绍这两种酶的功能、特点和应用领域。
一、β-葡萄糖醛酸酶β-葡萄糖醛酸酶(β-glucuronidase)是一种酶类,能够催化葡萄糖醛酸与水分解为葡萄糖和葡萄糖醛酸。
这种酶广泛存在于动植物和微生物中,特别是在人体内,具有重要的生理功能。
β-葡萄糖醛酸酶在人体中参与多种代谢过程,其中最重要的是对药物和毒物的代谢。
许多药物和毒物在体内首先被肝脏细胞内的酶类催化转化为葡萄糖醛酸,然后再被β-葡萄糖醛酸酶催化水解为无活性的代谢产物,从而增加其溶解度和排泄速度,减少对机体的毒性作用。
β-葡萄糖醛酸酶的应用领域非常广泛。
在医学诊断中,β-葡萄糖醛酸酶可以作为一种标志物,用于检测某些疾病的发生和发展。
此外,β-葡萄糖醛酸酶还可以应用于食品工业、生物技术和环境监测等领域。
二、硫酸酯酶硫酸酯酶(sulfatase)是一类酶,能够催化硫酸酯与水分解为硫酸和相应的醇或酚。
这类酶广泛存在于动植物和微生物中,具有重要的生理功能。
硫酸酯酶在生物体内参与多种代谢过程。
在人体中,硫酸酯酶广泛存在于各种组织和器官中,参与物质代谢、药物代谢、激素合成和分解等重要生理过程。
硫酸酯酶还参与胎儿发育、细胞信号传导和免疫应答等生理过程。
硫酸酯酶的应用也非常广泛。
在医学诊断中,硫酸酯酶可以作为一种标志物,用于检测某些疾病的发生和发展。
此外,硫酸酯酶还可以应用于工业生产、环境监测和生物技术等领域。
总结:β-葡萄糖醛酸酶和硫酸酯酶是两种重要的酶类,在生物化学和生物技术领域有着广泛的应用。
β-葡萄糖醛酸酶参与药物和毒物的代谢,具有重要的生理功能和医学应用价值;硫酸酯酶参与物质代谢和重要生理过程,具有医学诊断和生物技术应用的潜力。
这两种酶的研究和应用将为生命科学和医学领域的发展提供重要支持。
β—葡萄糖苷酶及其应用

β—葡萄糖苷酶及其应用
葡萄糖苷酶(glucosidase)是一种酶类,可以催化葡萄糖苷类底物的水解反应。
葡萄糖苷酶广泛存在于动植物体内,也能够通过微生物发酵获得。
它是一种重要的生物催化剂,在食品、制药和农业等领域有广泛的应用。
葡萄糖苷酶可以将葡萄糖苷类物质水解为葡萄糖和其他成分。
葡萄糖是一种重要的糖类,在生物体内作为能量的来源之一,具有重要的生理功能。
葡萄糖苷是由葡萄糖与其他
物质(如植物化合物、药物等)形成的化合物,通过葡萄糖苷酶的作用可以将其水解为葡
萄糖和其他成分。
葡萄糖苷酶在食品工业中有广泛的应用。
它可以用于酿造啤酒的麦芽水解,将麦芽中
的淀粉酶解为葡萄糖,提高酿造过程中的糖化效率。
葡萄糖苷酶还可以用于果汁、食品添
加剂等的生产过程中,提高果汁中葡萄糖的含量,改善食物的口感。
葡萄糖苷酶还可以用于农业领域。
在种植水果的过程中,葡萄糖苷酶可以促进果实的
成熟和葡萄糖的积累,改善果实的品质和甜度。
在植物保护方面,葡萄糖苷酶还可以用于
植物抗病性的研究,通过抑制或激活葡萄糖苷类物质的水解,提高植物对害虫或病原体的
抵抗能力。
葡萄糖苷酶是一种重要的酶类催化剂,在食品、制药和农业等领域有着广泛的应用。
通过利用葡萄糖苷酶的催化作用,可以提高反应效率、改善产品品质,并且具有良好的环
境友好性。
随着生物技术的不断发展,葡萄糖苷酶的研究和应用前景将会更加广阔。
β-葡萄糖苷酶(β-Glucosidase, β-GC)试剂盒说明书
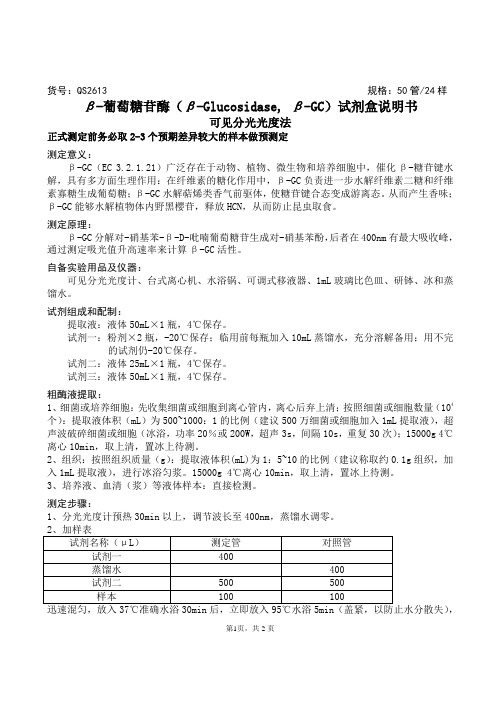
货号:QS2613 规格:50管/24样β-葡萄糖苷酶(β-Glucosidase, β-GC)试剂盒说明书可见分光光度法正式测定前务必取2-3个预期差异较大的样本做预测定测定意义:β-GC(EC 3.2.1.21)广泛存在于动物、植物、微生物和培养细胞中,催化β-糖苷键水解,具有多方面生理作用:在纤维素的糖化作用中,β-GC负责进一步水解纤维素二糖和纤维素寡糖生成葡萄糖;β-GC水解萜烯类香气前驱体,使糖苷键合态变成游离态。
从而产生香味;β-GC能够水解植物体内野黑樱苷,释放HCN,从而防止昆虫取食。
测定原理:β-GC分解对-硝基苯-β-D-吡喃葡萄糖苷生成对-硝基苯酚,后者在400nm有最大吸收峰,通过测定吸光值升高速率来计算β-GC活性。
自备实验用品及仪器:可见分光光度计、台式离心机、水浴锅、可调式移液器、1mL玻璃比色皿、研钵、冰和蒸馏水。
试剂组成和配制:提取液:液体50mL×1瓶,4℃保存。
试剂一:粉剂×2瓶,-20℃保存;临用前每瓶加入10mL蒸馏水,充分溶解备用;用不完的试剂仍-20℃保存。
试剂二:液体25mL×1瓶,4℃保存。
试剂三:液体50mL×1瓶,4℃保存。
粗酶液提取:1、细菌或培养细胞:先收集细菌或细胞到离心管内,离心后弃上清;按照细菌或细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细菌或细胞加入1mL提取液),超声波破碎细菌或细胞(冰浴,功率20%或200W,超声3s,间隔10s,重复30次);15000g 4℃离心10min,取上清,置冰上待测。
2、组织:按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL提取液),进行冰浴匀浆。
15000g 4℃离心10min,取上清,置冰上待测。
3、培养液、血清(浆)等液体样本:直接检测。
测定步骤:1、分光光度计预热30min以上,调节波长至400nm,蒸馏水调零。
β—葡萄糖苷酶及其应用

β—葡萄糖苷酶及其应用葡萄糖苷酶是一种能够降解葡萄糖苷结构的酶类,可以将葡萄糖苷分子中的葡萄糖与其他物质解离,形成葡萄糖与其他官能团的化学键。
它主要存在于植物、微生物和动物体内,广泛应用于食品工业、医药工业、制作酒精等方面。
该酶具有多种应用价值,以下将就葡萄糖苷酶的应用进行探讨。
在食品工业中,葡萄糖苷酶被广泛用于果蔬加工、乳品加工、糖果制作等方面。
在果蔬加工中,葡萄糖苷酶能够降解果蔬中的花青素葡萄糖苷,使得紫色的葡萄糖苷变为无色的花青素,提高果蔬的色泽和风味。
在乳品加工中,葡萄糖苷酶能够降解牛奶中的乳糖,减少乳糖对乳品的影响,提高乳品的品质和口感。
在糖果制作中,葡萄糖苷酶可用于降解糖果中的蔗糖,使糖果更易消化吸收,改善口感。
在医药工业中,葡萄糖苷酶有着重要的应用价值。
它可以被用于制备药物中的活性物质。
某些药物中含有葡萄糖苷结构,葡萄糖苷酶可以通过将葡萄糖与这些活性物质解离,使其具有更好的生物利用度和药效。
葡萄糖苷酶还可以用于生物检测。
它可以将葡萄糖与某些指示剂反应,使乙酰胺开环,导致颜色变化,从而可以通过颜色变化来检测生物样品中的葡萄糖含量。
在制作酒精方面,葡萄糖苷酶也起到了重要的作用。
它可以被用于酿造酒精过程中的淀粉糖化。
在糖化过程中,葡萄糖苷酶能够将淀粉分解为葡萄糖,为后续的酒精发酵提供充足的底料。
葡萄糖苷酶还可以提高酒精的酿造效率和产品品质,使得酒精更加纯净和口感更好。
葡萄糖苷酶具有广泛的应用领域和巨大的应用潜力,它可以被用于食品工业、医药工业和制作酒精等方面。
随着科学技术的不断发展,葡萄糖苷酶的应用还将不断拓展和深化,为人类的生产和生活带来更多的便利和效益。
β—葡萄糖苷酶及其应用

β—葡萄糖苷酶及其应用1. 引言1.1 β—葡萄糖苷酶及其应用β—葡萄糖苷酶是一种重要的酶类,在生物学、食品工业、医药领域和环境工程中都有着广泛的应用。
β—葡萄糖苷酶是一种能够水解β—葡糖苷键的酶,其作用是将底物中的β—葡糖苷键水解成葡萄糖和另一种物质。
在生物学中,β—葡萄糖苷酶起着重要的催化作用,参与碳水化合物的代谢过程,并影响生物的生长和发育。
在食品工业中,β—葡萄糖苷酶可用于酿造啤酒、制作果酱和果汁等食品加工过程中。
在医药领域,β—葡萄糖苷酶可以用于制备药物和诊断试剂,具有广泛的应用前景。
在环境工程中,β—葡萄糖苷酶可以用于废水处理和污染物降解,对环境保护具有重要意义。
β—葡萄糖苷酶的应用将在未来的研究和开发中继续发挥重要作用,为多个领域的发展做出贡献。
2. 正文2.1 β—葡萄糖苷酶的结构与功能β—葡萄糖苷酶是一种重要的酶类,在生物体内发挥着重要的作用。
其结构和功能的研究对于揭示生物体内糖代谢的机制具有重要意义。
β—葡萄糖苷酶通常是由单个蛋白质组成,具有特定的氨基酸序列和空间构象。
其催化活性主要是通过特定的底物结合部位和活性中心实现的。
具体来说,β—葡萄糖苷酶能够催化底物分子中β-葡萄糖苷键的水解反应,将底物分子分解成葡萄糖和另一种残基。
这种水解作用对于生物体内糖类化合物的代谢和利用具有重要意义。
β—葡萄糖苷酶在细胞内参与糖代谢途径的调控,促进了葡萄糖等糖类物质的利用和能量产生。
β—葡萄糖苷酶还参与了一些生物体内的信号传导通路,对于维持细胞内稳态起到了关键作用。
β—葡萄糖苷酶的结构和功能研究不仅有助于深入理解生物体内糖代谢的机制,还为相关疾病的治疗提供了重要的理论基础。
随着对于这类酶的研究不断深入,相信其在生物学及医学领域的应用前景会更加广阔。
2.2 β—葡萄糖苷酶在生物学中的作用β—葡萄糖苷酶在生物学中扮演着非常重要的角色。
它是一种酶类蛋白质,能够催化β—葡萄糖苷键的水解反应,将β—葡萄糖苷水解成葡萄糖和其他产物。
β—葡萄糖苷酶及其应用

β—葡萄糖苷酶及其应用葡萄糖苷酶是一类具有广泛应用前景的酶类,能够催化葡萄糖与其他化合物结合形成葡萄糖苷。
本文将着重介绍葡萄糖苷酶的来源、催化机制以及其在食品工业、医药领域和环境修复中的应用。
葡萄糖苷酶主要存在于微生物、植物和动物中。
在微生物中,葡萄糖苷酶是一类广泛分布的酶,包括细菌、真菌和酵母等。
嗜热菌和极端酸碱环境中的微生物常常产生特殊的葡萄糖苷酶,具有较高的耐受性和催化能力。
而在植物中,葡萄糖苷酶参与植物生长、发育和抗病性的调节,并在果实成熟、种子萌发等过程中发挥重要作用。
在动物中,葡萄糖苷酶主要存在于肠道、肝脏和肾脏等消化系统器官中,参与碳水化合物的消化和代谢。
葡萄糖苷酶的催化机制是通过水解酶解反应将葡萄糖与底物结合形成葡萄糖苷。
一般来说,葡萄糖苷酶的活性中心由催化酶和底物结合部位组成。
催化酶位于蛋白质分子的中心位置,通过与底物的特定结合,使底物的特定键被水解,从而生成葡萄糖苷。
葡萄糖苷酶对不同的底物具有特异性,可以选择性地催化特定的底物生成葡萄糖苷。
在食品工业中,葡萄糖苷酶被广泛应用于食品加工过程中的淀粉糖化、果汁澄清、啤酒酿造等环节。
葡萄糖苷酶可以将淀粉分解成糖类,提高产品的口感和甜度。
在果汁澄清过程中,葡萄糖苷酶可以降解果汁中的不溶性糖类,提高果汁的透明度和口感。
在啤酒酿造中,葡萄糖苷酶可以降解大麦中的非淀粉多糖,减少造成麦芽的粘度和黏稠度,从而提高麦芽在发酵过程中的利用率。
在医药领域中,葡萄糖苷酶被应用于制备药物、草药提取物和生物制剂等方面。
葡萄糖苷酶可以提高药物的溶解度和生物利用率,改善药物的稳定性和药效。
葡萄糖苷酶还可以用于制备天然草药提取物,提高其活性成分的纯度和活性。
在生物制剂领域,葡萄糖苷酶可以用于清除生物试剂中的杂质和残留物,提高试剂的纯度和活性。
葡萄糖苷酶在环境修复中发挥重要作用。
葡萄糖苷酶可以分解有机废弃物中的葡萄糖苷,将其转化为可溶性的葡萄糖和底物,从而促进有机废弃物的降解和去除。
β-葡糖苷醛甙酶-芳基硫酸酯酶

β-葡糖苷醛甙酶-芳基硫酸酯酶
β-葡糖苷醛甙酶-芳基硫酸酯酶是一种酶,它能够加速β-葡糖苷醛甙类化合物和芳基硫酸酯反应的速率。
该酶的催化作用包括将β-葡糖苷醛甙类化合物与芳基硫酸酯结合形成β-葡糖苷醇甙及芳基硫酸酯,同时释放出硫酸根离子。
β-葡糖苷醛甙酶-芳基硫酸酯酶存在于多种生物体中,如微生物、鸟类、爬行动物和哺乳动物等。
它在人体中的功能包括调节胆固醇代谢,参与糖代谢和酒精代谢等。
因此,该酶在药理学和医学研究中有广泛的应用和重要的意义。
纤维素酶的组成及功能主治

纤维素酶的组成及功能主治组成纤维素酶是一种酶类,主要由以下几种成分组成:1.β-葡萄糖苷酶(β-glucosidase):负责将纤维素分解成葡萄糖,是纤维素酶中最重要的成分之一。
2.β-葡萄糖甘醇异构酶(β-glucoside glucohydrolase isomerase):在纤维素酶作用的过程中,参与葡萄糖生成的异构化反应。
3.β-葡萄糖甘醇脱氢酶(β-glucoside glucohydrolase dehydrogenase):在纤维素酶作用的过程中,参与葡萄糖生成的脱氢反应。
4.β-葡糖苷酶(β-glycoside hydrolase):参与纤维素酶反应的酶类,能催化酯水解反应。
5.β-葡糖激酶(β-glycosyl kinase):在纤维素酶反应过程中,催化葡萄糖转化为葡糖激酸。
6.β-葡糖转酶(β-glycosyl-transferase):参与纤维素酶作用的酶类,催化糖基转移。
功能主治纤维素酶是一种重要的酶类,具有以下功能主治:1.有助于消化纤维素:纤维素酶能够分解纤维素,将其转化为可被人体消化吸收的葡萄糖。
纤维素是植物细胞壁中的一种多糖,人体无法自身分解纤维素,而纤维素酶可以帮助人体消化并吸收其中的营养物质。
2.改善胃肠道健康:纤维素酶具有促进胃肠道蠕动的作用,帮助促进消化道的蠕动,从而改善胃肠道功能,减少便秘和腹胀等胃肠道问题。
3.提高营养吸收:由于纤维素酶能够将纤维素分解成可被人体吸收的葡萄糖,因此能提高人体对纤维素的消化吸收效率,进而提高对营养物质的吸收效率。
4.降低血糖水平:纤维素酶通过将纤维素分解成葡萄糖,能够提高人体对葡萄糖的代谢能力,从而降低血糖水平。
5.促进肠道菌群平衡:纤维素酶具有调节肠道菌群平衡的作用,可以帮助提高有益菌的数量,减少有害菌的生长,进而促进肠道健康。
综上所述,纤维素酶是一种重要的酶类,具有多种功能主治,包括消化纤维素、改善胃肠道健康、提高营养吸收、降低血糖水平和促进肠道菌群平衡等。
β-葡萄糖醛酸苷酶的关键loop对其稳定性和活性的调控

β-葡萄糖醛酸苷酶的关键loop对其稳定性和活性的调控β-葡萄糖醛酸苷酶是一种重要的酶,在生物学上具有广泛的应用价值。
本文对其关键loop进行了研究,探究其对酶的稳定性和活性的调控作用。
首先,我们对β-葡萄糖醛酸苷酶的整体结构进行了研究和探索。
通过分子模拟和分析,发现酶的活性中心是由一系列关键loop,特别是N214、G305和Y336 loop 组成。
这些loop直接参与到酶的底物结合和催化作用,因此对酶的稳定性和活性有着至关重要的影响。
接着,我们对这些关键loop进行了系统地变异和分析,发现这些loop的结构以及序列变异都会对酶的稳定性和活性产生不同程度的影响。
其中N214 loop对底物的结构限制起到了至关重要的作用,G305 loop则直接参与到催化反应的过渡态形成,Y336 loop则作为维持整个酶分子结构的重要纽带。
最后,我们通过蛋白质工程手段进行了定向修饰,旨在优化酶分子的结构和性能。
结果显示,通过对关键loop进行适当的修饰和改变,β-葡萄糖醛酸苷酶的稳定性和活性均得到了明显的提高,极大增强了其在实际应用中的价值和意义。
综上所述,本文对β-葡萄糖醛酸苷酶的关键loop对稳定性和活性的调控进行了深入的研究和探究,对优化酶分子的性能具有一定的理论和应用价值。
关键词:β-葡萄糖醛酸苷酶、关键loop、稳定性、活性、蛋白质工程β-葡萄糖醛酸苷酶是一种在生物体内发挥重要作用的酶,在生物代谢中参与了许多关键的反应过程。
因此,对于β-葡萄糖醛酸苷酶的研究和探究,对于深入了解生物代谢和药物开发都具有重要的意义。
通过对β-葡萄糖醛酸苷酶的关键loop进行研究和分析,可以发现这些loop在酶的结构和性能中起到了至关重要的作用。
因此,对于优化酶分子的性能和稳定性,对这些关键loop进行定向的修饰和改变,可以极大增强酶在实际应用中的价值和意义。
未来,我们可以继续深入探究β-葡萄糖醛酸苷酶的结构和性能,研究更多可调控因素对酶的影响,并寻找更加有效的蛋白质工程手段和方法,以进一步优化β-葡萄糖醛酸苷酶的性能和应用价值另外,我们还可以探索β-葡萄糖醛酸苷酶在不同基质或环境下的表现和特性,以了解其在生态系统中的作用和适应能力。
β—葡萄糖苷酶的特性及其应用

等电点 (pI),最适pH及pH稳定性 最适温度及热稳定性
大部分 β-葡萄糖苷酶的pI都在酸性范围, 中国台北学者李约昆等人从 并且变化不大,一般在 3.5-5.5之间, Flavobacterium meningosepticum β-葡萄糖苷酶的最适温度在40一ll0℃之间都有 但最适 pH可以超过 7.0,而且酸碱耐受性强 对于工业应用来说,酶的热稳定性越高越有利, 中分离出的 β-葡萄糖苷酶其 pI 分布。古细菌的β-葡萄糖苷酶其热稳定性和最适 因此,从嗜热细菌中分离出 β一葡萄糖苷酶逐渐 在9.0左右,最适pH 是5.0 。 温度要高于普通微生物来源的 β-葡萄糖苷酶。 引了人们的兴趣。
在青梅脱苦中应用 梅果中有人体所需的多种氨基酸糖苷酶却可以把 苦杏仁苷分解为苯甲醛及氢氰酸和两分子葡萄糖,而使苦 味大大减少。
虽然分解出的氢氰酸可使人食后中毒,但氢氰酸可在加热过程 中蒸发掉,而且据七十年代《美国农业联合会学报》报道, 一定剂量的苯甲醛和氢氰酸混合物具有防癌效果。
葡萄糖苷酶的作用下生成葡萄糖。
作为食品风味酶应用
随着食品工业的发展,风味化学的研究也引人关注, 特别是水果风味及生物技术在风味中的应用有了长 足的进展。近年来,人们着重研究水果风味物质在 水果中存在的前体—一些二级代谢产物,如糖苷类物质。
几乎所有的天然糖苷是β一糖苷,所以可以利用β一葡萄糖 苷酶水解水果中的风味前体物一糖苷,释放出挥发性糖苷 配基,用以增强葡萄酒等果酒、果汁香气。
在水解大豆异黄酮中应用
β一葡萄糖苷酶还可以用来水解大豆异黄酮,制 备高活性的大豆异黄酮苷元产品。酶水解条件温 和,多采用弱酸性的缓冲溶液,大豆异黄酮苷元不易 变性,是工业上制备富含大豆异黄酮苷元产品的十分 有前途的途径。
β—葡萄糖苷酶及其应用

β—葡萄糖苷酶及其应用1. 引言1.1 β—葡萄糖苷酶概述β—葡萄糖苷酶(β-glucosidase)是一种广泛存在于生物体内的酶类,主要催化β—葡萄糖苷的水解反应。
该酶能将底物中的β—葡萄糖苷键水解成葡萄糖和对应的糖苷,参与碳水化合物的代谢和循环。
β—葡萄糖苷酶在生物体内起着重要的催化作用,与多种生理活动密切相关,如糖代谢、生殖、发育等。
β—葡萄糖苷酶也被广泛应用于食品工业、医药工业、生物能源等领域,具有重要的应用价值。
β—葡萄糖苷酶的研究和应用已成为当前生物技术领域的热点之一,对其结构与功能、生物合成与调控机制以及应用领域的探索将有助于拓展其应用前景,推动相关技术的进一步发展。
β—葡萄糖苷酶的独特功能特点和广泛应用前景使其成为当前生物技术领域值得深入研究和开发的重要酶类之一。
2. 正文2.1 β—葡萄糖苷酶的结构与功能β—葡萄糖苷酶是一种重要的酶类,在生物体内起着关键的作用。
它是由一条多肽链组成,通常由数百个氨基酸残基组成。
β—葡萄糖苷酶的结构可以分为四个层次:一级结构、二级结构、三级结构和四级结构。
一级结构是指其氨基酸序列的排列方式,而二级结构是指氨基酸链的折叠方式,通常包括α螺旋和β折叠。
三级结构是指氨基酸链的空间结构,由各个二级结构区域的组合而成。
四级结构是指蛋白质分子的多聚体结构。
β—葡萄糖苷酶的功能主要是在生物体内水解β—葡萄糖苷键,将底物分子催化成葡萄糖和其他物质。
这种酶具有高度的催化效率和特异性,可以在较低的温度和中性的条件下发挥作用。
β—葡萄糖苷酶在食品工业、制药工业和生物能源领域具有广泛的应用前景,是一种非常重要的工业酶类。
通过深入研究其结构和功能,可以为相关产业的发展提供重要的支持和指导。
β—葡萄糖苷酶的结构与功能研究对于提高其催化效率、稳定性和特异性具有重要意义,值得进一步深入研究和探讨。
2.2 β—葡萄糖苷酶的生物合成与调控β—葡萄糖苷酶是一种重要的酶类,在生物体中具有多种生物合成和代谢过程中的关键作用。
β-葡萄醣醛酸酶 linker

β-葡萄醣醛酸酶 linker
β-葡萄糖醛酸酶(β-glucuronidase)是一种酶,它能够水解β-葡萄糖醛酸。
这种酶在生物医学研究和生物技术领域中被广泛应用。
它可以用作标记物,用于检测和测定β-葡萄糖醛酸的存在,也可以用于药物输送系统和治疗方面的研究。
Linker(连接物)是指在生物技术和药物开发中用于连接两个分子的化合物。
在这种情况下,β-葡萄糖醛酸酶linker可能指的是将β-葡萄糖醛酸酶与其他分子(如药物或标记物)连接在一起的化合物。
在研究和应用中,β-葡萄糖醛酸酶linker可以用于制备药物输送系统,其中药物与酶连接,以实现靶向释放。
此外,它还可以用于生物标记和检测方法中,通过连接到其他分子来实现对β-葡萄糖醛酸的特异性检测。
总的来说,β-葡萄糖醛酸酶linker在生物医学研究和生物技术应用中具有重要作用,可以用于药物输送系统、生物标记和检测等领域。
这些技术的发展对于治疗和诊断疾病都具有潜在的重要意义。
β葡聚糖酶的酶解ph

β葡聚糖酶的酶解pH引言β葡聚糖酶是一种重要的酶类,它在生物体内起着关键的作用。
本文将探讨β葡聚糖酶在不同pH值下的酶解特性。
我们将介绍β葡聚糖酶的定义、结构和功能,以及pH对其酶解活性的影响。
此外,我们还将讨论β葡聚糖酶的应用领域和未来的研究方向。
1. β葡聚糖酶的定义β葡聚糖酶是一类能够降解β-葡聚糖的酶。
它能够将β-葡聚糖分解成较短的寡糖或单糖,如葡萄糖。
β葡聚糖酶广泛存在于细菌、真菌、植物和动物中,并且在多种生物过程中起着重要的作用。
2. β葡聚糖酶的结构和功能β葡聚糖酶通常是由多个亚基组成的复合酶。
每个亚基都包含一个活性位点,用于催化β-葡聚糖的降解。
该酶的结构可以分为两类:单域和多域。
单域结构的β葡聚糖酶通常是线性的,而多域结构的β葡聚糖酶则具有更复杂的结构。
β葡聚糖酶的功能是通过催化酶解反应来降解β-葡聚糖。
它通过将底物的β-1,4-葡萄糖键水解,将β-葡聚糖分解成较短的寡糖或单糖。
这个过程是一个关键的碳水化合物降解途径,为生物体提供能量和碳源。
3. pH对β葡聚糖酶酶解活性的影响pH是指溶液的酸碱度,对酶解反应具有重要影响。
β葡聚糖酶的酶解活性也受到pH的调节。
不同的β葡聚糖酶对pH的敏感度不同,但通常在酸性和碱性条件下都能保持一定的酶活性。
在酸性条件下,β葡聚糖酶的酶解活性通常较低。
这是因为酸性条件会导致酶的结构发生变化,使其活性位点的构象发生改变,从而降低酶的催化效率。
然而,一些酸性条件下的β葡聚糖酶具有较高的活性,这可能是由于它们在进化过程中适应了酸性环境。
在中性和碱性条件下,β葡聚糖酶的酶解活性通常较高。
这是因为中性和碱性条件有利于酶的结构稳定性和活性位点的构象。
在这些条件下,β葡聚糖酶能够更有效地与底物结合并催化酶解反应。
4. β葡聚糖酶的应用领域β葡聚糖酶具有广泛的应用领域。
以下是一些常见的应用领域:•食品工业:β葡聚糖酶可以用于生产酵母发酵面包、啤酒和葡萄酒等食品。
β-葡萄糖醛酸苷水解酶简介

β-glucuronidase
β-葡萄糖醛酸苷水解酶是糖苷酶家族中的一员,人体β-葡萄糖醛酸苷水解酶含有653个氨基酸,相对分子量在80KD。
β-葡萄糖醛酸苷水解酶是溶酶体内的酸性水解酶,主要来源于多形核白细胞,也可见于其他细胞和细菌,是细胞外基质主要成分大分子蛋白聚糖降解的酶原之一,直接参与蛋白聚糖和细胞内外基质的降解过程。
β-葡萄糖醛酸苷水解酶具有多种特征结构,决定了其水解活性,包括由氢键连接而成的封闭桶状结构,以及由8个α螺旋体和8个平行的β折叠体组成的保守蛋白结构。
其广泛存在人体组织及体液中,参与内体多方面的调节。
如在肠道中,刷状边缘上的β-葡萄糖醛酸苷水解酶可以使结合型胆红素转变为非结合型胆红素,达到重吸收的作用。
β-葡萄糖醛酸苷水解酶同样存在于母乳中,与新生儿黄疸有密切的关系。
β-葡萄糖醛酸苷酶荧光底物试卤灵葡萄糖醛酸苷的高效制备

β-葡萄糖醛酸苷酶荧光底物试卤灵葡萄糖醛酸苷的高效制备王欣欣;吕侠;葛广波;冯磊;辛红;李耀光;曹云峰;韩冠英;郭斌【摘要】以猴肝微粒体( CyLM)为酶源,采用生物制备法实现了荧光底物试卤灵( Resorufin)向试卤灵葡萄糖醛酸苷(Resorufin β-D-glucuronide)的高效转化,同时借助新型色谱分离材料C18WAX及固相萃取技术实现了Resorufin β-D-glucuronide的高效富集及选择性洗脱,最终获得纯度大于98%的目标产物。
所得产物结构经LC-MS,1 H NMR和13 C NMR等手段进行了表征。
在此基础上,以该葡萄糖醛酸产物为探针底物建立了β-葡萄糖醛酸苷酶活性检测及抑制剂高通量筛选的方法。
%Resorufin-β-O-glucuronide( REG) is a substrate of theβ-glucuronidase enzyme which exhibited al-most no fluorescence, upon addition of β-glucuronidase a high fluorescent compound resorufin will be re-leased. Resorufin, is a fluorescent compound possessing good optical properties. On the basis of the off-on type fluorescent reaction, REG can be served as the good fluorescent substrate of β-glucuronidase. However, commercial available REG is rather expensive due to the difficulty for preparation of REG and the studies on REG are very limited. This study aimed to adopt the mild biosynthesis approach to efficiently prepare REG, based on resorufin can be extensively metabolized to REG by UDP-glucuronosyltransferases( UGTs) . REG was prepared using resorufin as the starting material and liver microsomes from cynomolgus monkeys( CyLM) as the enzyme source. Resorufin( RE, 100 μmol/L) was incubated in Tris-HCl(50 mmol/L, pH=7. 4, with 1%DMSO) with C yLM(0. 5 mg/mL) at 37 ℃ for 4 h. After the optimization of the incubation conditions, the conversionof REG was more than 80%. A unique solid-phase extraction column(SPE) packed with C18WAX was used to enrich and purify the product REG with high yield. The product was then identified by both LC-MS and NMR techniques. Finally, a high throughput screening method forβ-glucuronidase inhibitors was well established, based on the accurate kinetic parameters of REG towardsβ-glucuronidase and the absorption and emission spectrum of REG.【期刊名称】《高等学校化学学报》【年(卷),期】2015(000)007【总页数】7页(P1321-1327)【关键词】试卤灵;试卤灵葡萄糖醛酸苷;固相萃取;β-葡萄糖醛酸苷酶;抑制剂筛选【作者】王欣欣;吕侠;葛广波;冯磊;辛红;李耀光;曹云峰;韩冠英;郭斌【作者单位】辽宁医学院药学院;中国科学院大连化学物理研究所,大连116023;中国科学院大连化学物理研究所,大连116023;中国科学院大连化学物理研究所,大连116023;中国科学院大连化学物理研究所,大连116023;中国科学院大连化学物理研究所,大连116023;中国科学院大连化学物理研究所,大连116023;附属第一医院,锦州121000;附属第一医院,锦州121000【正文语种】中文【中图分类】O625.31+6β-葡萄糖醛酸苷酶荧光底物试卤灵葡萄糖醛酸苷的高效制备王欣欣1,吕侠3,葛广波3,冯磊3,辛红3,李耀光3,曹云峰3,韩冠英2,郭斌2(1.辽宁医学院药学院,2.附属第一医院,锦州121000; 3.中国科学院大连化学物理研究所,大连116023)摘要以猴肝微粒体(CyLM)为酶源,采用生物制备法实现了荧光底物试卤灵(Resorufin)向试卤灵葡萄糖醛酸苷(Resorufin β-D-glucuronide)的高效转化,同时借助新型色谱分离材料C18WAX及固相萃取技术实现了Resorufin β-D-glucuronide的高效富集及选择性洗脱,最终获得纯度大于98%的目标产物.所得产物结构经LC-MS,1H NMR和13C NMR等手段进行了表征.在此基础上,以该葡萄糖醛酸产物为探针底物建立了β-葡萄糖醛酸苷酶活性检测及抑制剂高通量筛选的方法.关键词试卤灵;试卤灵葡萄糖醛酸苷;固相萃取;β-葡萄糖醛酸苷酶;抑制剂筛选中图分类号O625.31+6文献标志码Adoi: 10.7503/cjcu20141107收稿日期: 2014-12-18.网络出版日期: 2015-05-29.基金项目:国家“九七三”计划项目(批准号: 2013CB531800)和国家自然科学基金(批准号: 81473181,81273590)资助.联系人简介:郭斌,男,博士,教授,主要从事海洋药用资源开发研究.E-mail: jyguobin@126.comβ-葡萄糖醛酸苷酶(β-Glucuronidase)是一类重要的水解酶,广泛分布于自然界多种生物体系中,负责催化葡萄糖醛酸结合物的水解反应.研究[1]发现,人体内β-葡萄糖醛酸苷酶的表达与一些炎症及癌症的发生发展过程密切相关,因此它也被认为是一种重要的肿瘤标志物[2].在人体内,肠道中分布的β-葡萄糖醛酸苷酶还可催化多种药物及内源性激素的葡萄糖醛酸苷水解,释放出的甙元可被肠道再次吸收,从而形成药代动力学上的双峰现象[3].值得注意的是,β-葡萄糖醛酸苷酶可催化药物伊立替康代谢产物7-乙基-10-羟基喜树碱葡萄糖醛酸苷(SN-38G)的水解并生成7-乙基-10-羟基喜树碱(SN-38)[4,5],而后者在肠道中累积可引发肠黏膜脱落并导致严重的迟发型腹泻等毒副作用.筛选高效安全的β-葡萄糖醛酸苷酶抑制剂可在一定程度上减缓伊立替康等化学药物导致的腹泻等胃肠副作用.利用荧光探针底物进行β-葡萄糖醛酸苷酶抑制剂筛选具有操作简单、筛选通量高及单位成本低等优势.目前,已报道的多种β-葡萄糖醛酸苷酶的荧光探针底物包括4-甲基伞形酮葡萄糖苷酸苷(4-MUG)[6]、4-硝基苯-D-葡萄糖苷酸苷[7]和荧光素-O-β-D-葡萄糖苷[8]等,这些荧光探针底物的发射波长较短,其产物的荧光强度易受到环境中其它物质的干扰.近年来,试卤灵β-D-葡萄糖醛酸苷(REG)也被作为探针底物用于β-葡萄糖醛酸苷酶的活性检测,REG本身不具有荧光属性,但其在β-葡萄糖醛酸苷酶水解作用下可快速释放出具有优良荧光属性的分子产物试卤灵[9].试卤灵属于氧杂蒽类荧光染料,化学名为7-羟基-3H-吩恶嗪-3-酮,对其基本骨架中的酚羟基进行结构修饰可实现荧光信号的封闭与释放,基于此特征科研人员先后研发了一系列以试卤灵为骨架的荧光探针分子,并将其用于α-葡萄糖苷酶[10]、β-半乳糖苷酶[11]、β-内酰胺酶[12]、单胺氧化酶[13]、羧酸酯酶[14]和β-葡萄糖醛酸苷酶[15]等多种功能蛋白活性的定量测定、酶抑制剂的高通量筛选及生物示踪研究等方面.虽然REG在β-葡萄糖醛酸苷酶活性定量及生物示踪领域显示了良好的应用前景,但其合成工艺复杂、价格昂贵,极大地限制其应用.目前,商业化的REG多由化学合成法制备[16],但由于合成中涉及多步保护和脱保护反应、副产物多、制备工艺繁琐,且部分化学反应的条件较苛刻,导致其制备成本和产物收率均不佳[17,18].与化学法相比,生物法制备葡萄糖醛酸苷产物具有选择性好、副产物少、转化效率高、制备过程简单及产物后处理易操作等优点[19,20].本文首先考察了不同种属肝微粒体催化试卤灵葡萄糖醛酸化反应的催化效率,筛选出能够高效转化试卤灵为相应葡萄糖醛酸苷产物的酶源(如Scheme 1所示).同时,应用固相阴离子交换柱实现了目标产物的高效富集,并利用选择性洗脱方式获得了试卤灵葡萄糖醛酸苷产物单体.在此基础上,将试卤灵葡萄糖醛酸苷作为β-葡萄糖醛酸苷酶的荧光探针底物,构建了β-葡萄糖苷酶活性检测及其抑制剂高通量筛选的荧光分析法.Scheme 1 Biosynthesis of resorufin glucuronide by liver microsome from cynomolgus monkeys(CyLM)1 实验部分1.1试剂与仪器MgCl2、Tris-HCl缓冲液(pH = 7. 4)、磷酸盐缓冲液(pH = 7. 4)、尿苷二磷酸葡萄糖醛酸(UDPGA)、聚氧乙烯醚(Brij 58)、D-葡萄糖二酸-1,4-内酯水合物和试卤灵钠盐(Resorufin sodium)均购自Sigma公司;人肝微粒体、大鼠肝微粒体、小鼠肝微粒体、猴肝微粒体、猪肝微粒体、狗肝微粒体、兔子肝微粒体和豚鼠肝微粒体均购自瑞德肝脏疾病研究(上海)有限公司;β-葡萄糖醛酸苷酶(活性103000U/mL,Lot SDP6783)购自Wako公司; C18WAX固相萃取柱购自华谱新创科技有限公司;甲醇、乙腈和甲酸均为色谱纯;实验用水为Millipore纯化水.Avance 400 MHz超导核磁共振仪(瑞士Brucker公司); HPLC-UV-ESI-MS高效液相色谱-串联质谱仪(日本岛津公司); Beckman Coulter高速离心机(美国贝克曼库尔特有限公司); Millipore纯水仪(美国Millipore公司); SHZ-D(Ⅲ)型循环水式真空泵(巩义市子华仪器有限责任公司); JHN-4F型超声波清洗仪(上海杰恩普超声设备有限公司);金属恒温震荡孵育仪(美国赛默飞世尔科技公司); Synergy H1型全功能微孔板检测酶标仪(美国博腾仪器有限公司); Nicolet 6700型红外分光光度计(美国赛默飞世尔科技公司).1.2实验过程1.2.1试卤灵萄糖醛酸化的种属差异研究了不同种属肝微粒体催化试卤灵葡萄糖醛酸化反应的催化效率差异,选择人肝微粒体(HLM)、大鼠肝微粒体(RLM)、小鼠肝微粒体(MLM)、猴肝微粒体(CyLM)、猪肝微粒体(PLM)、狗肝微粒体(DLM)、兔子肝微粒体(RaLM)及豚鼠肝微粒体(GLM)进行对比实验.首先,在各种属微粒体中加入等体积的表面活性剂Brij58,于冰上反应20 min进行微粒体活化;然后,在反应体系中加入Tris-HCl(50 mmol/L),MgCl2(50 mmol/L)及各种属微粒体(蛋白终浓度为0. 5 mg/mL),加入试卤灵(终浓度为100 μmol/L)后于37℃预先孵育3 min;再加入UDPGA(40 mmol/L)起始反应;反应60 min后加入等体积乙腈终止反应,在4℃及14770 r/min转速下离心20 min,用HPLC-MS检测目标产物的生成量,确定各种属肝微粒体单位时间内催化试卤灵葡萄糖醛酸化的转化率.1.2.2代谢产物的制备与鉴定采用试卤灵钠盐(100 μmol/L)与蛋白浓度为0.5 mg/mL的猴肝微粒体制备目标代谢产物,在37℃下孵育4 h后,底物转化率可达81%.在上述反应体系中加入等体积的乙腈终止反应,于4℃及14770r/min转速下离心20 min后,移取上层清液.采用减压蒸发除去乙腈,残留液采用装填C18WAX的固相萃取柱(SPE)进行富集和选择性洗脱[21,22].洗脱液用HPLC-MS进行目标产物监测,通过HPLC-UV-ESI-MS鉴定产物并分析其纯度.含有目标物REG的洗脱液经旋转蒸发后即得REG单体.所得产物用1H NMR和13C NMR等手段进行结构表征.1.2.3试卤灵β-D-葡萄糖苷水解产物的光谱特性及试卤灵标准曲线的绘制以REG(10 mmol/L)作为水解反应的底物,加入单位浓度为1030 U/mL的β-葡糖糖醛酸苷酶,在磷酸盐缓冲溶液(pH =7. 4,50 mmol/L)中于37℃振荡孵育30 min,使其完全水解,再加入等体积乙腈终止反应.在4℃及14770 r/min转速下离心5 min,取上层清液置于96孔荧光酶标板中,采用荧光酶标仪在300~700 nm波长范围内扫描水解产物试卤灵的吸收和发射光谱.在此基础上,配制一系列不同浓度的试卤灵标准液(0,0. 0002,0. 001,0. 002,0. 01,0. 02,0. 1,0. 2,1,2,4,8,16,32和50 mmol/L),取各浓度标准液2 μL溶于磷酸盐缓冲溶液(pH = 7. 4)中并加入等体积乙腈(200 μL),将荧光酶标仪激发波长设置为577 nm,发射波长设置为620 nm,在此条件下进行荧光值扫描[23],以荧光强度为纵坐标,试卤灵标准液浓度为横坐标,绘制标准曲线.1.2.4 β-葡萄糖醛酸苷酶水解试卤灵β-D-葡萄糖苷的酶动力学测定分别选取8个REG浓度(0,25,40,100,200,400,600和800 μmol/L)绘制其酶反应动力学曲线.在线性反应条件下,将10. 3 U/mL的β-葡萄糖醛酸苷酶加入pH =7. 4磷酸盐缓冲溶液中预孵3 min后,加入底物REG起始反应; 于37℃振荡孵育15 min后,加入等体积乙腈终止反应,在4℃及14770 r/min转速下离心5 min,取上层清液置于荧光酶标仪上进行检测,激发波长577 nm,发射波长620 nm.利用GraphPad Prism 6. 0软件拟合酶动力学参数,获得Km和vmax.1.2.5基于试卤灵β-D-葡萄糖苷的β-葡萄糖醛酸苷酶抑制剂筛选对体外β-葡萄糖醛酸苷酶水解实验中的蛋白浓度和反应时间进行优化,选取蛋白浓度为10.3 U/mL,孵育时间15 min,D-葡萄糖二酸-1,4-内酯(D-Saccharic acid 1,4-lactone)作为β-葡萄糖醛酸苷酶阳性抑制剂.在200 μL反应体系中首先加入不同浓度的该抑制剂(0,1,3,5,10,25,50,75和100 μmol/L)与10. 3 U/mL 的β-葡萄糖醛酸苷酶,在pH =7. 4磷酸盐缓冲液体系下,于37℃孵育15 min,然后加入REG(50 μmol/L)起始反应.以未加入抑制剂的孵育样品中REG的产物生成量记为100%,计算阳性抑制剂对试卤灵葡萄糖醛酸苷水解反应的抑制率,并与文献报道值[26]进行比较,验证该反应体系是否适合进行β-葡萄糖醛酸苷酶抑制剂的高通量筛选.Fig.1 HPLC-UV and MS spectra of resorufin and resorufin β-D-glucuronide(A)HPLC-UV profiles of resorufin and its metabolite in liver microsomes from different species;(B)MS spectrum of resorufin;(C)MS spectrum of resorufin β-D-glucuronide.2 结果与讨论2.1种属差异实验结果不同种属肝微粒体催化试卤灵葡萄糖醛酸化反应的轮廓分析结果如图1(A)所示,8种动物肝微粒体均可将试卤灵转化成葡萄糖醛酸苷产物,但其转化速率不同.当微粒体蛋白浓度为0. 5 mg/mL,反应时间为60 min时,猴肝微粒体的转化速率最快可达到50%,而人肝微粒体的转化速率最慢,仅为3%,PLM,DLM,GLM,MLM,RLM和RaLM的转化速率分别为4%,10%,14%,5%,11%和16%.在此基础上,选择转化率最高的猴微粒体为酶源进行生物转化反应条件的优化及目标代谢产物的制备,并利用HPLC-UV-ESI-MS对代谢产物及底物进行了初步鉴定,结果如图1(B)和(C)所示.其代谢产物准分子离子峰[M-H]+,m/z: 390. 0,表明产物的分子量为389,比底物试卤灵(准分子离子峰[M-H]+,m/z: 213. 9)的分子量增加了176(1分子葡萄糖醛酸基的特征变化).鉴于该生物催化反应体系为典型的葡萄糖醛酸化反应体系,初步确定该产物为试卤灵的单葡萄糖醛酸化产物.2.2试卤灵葡萄糖醛酸苷产物的纯化由液相色谱[图2(A)]可知,以生物转化法优化后的底物制备获得的反应液中试卤灵葡萄糖醛酸苷产物的含量大于80%(试卤灵100 μmol/L,酶浓度0. 5mg/mL,反应时间4 h),但仍有少量试卤灵无法转化为产物.该反应液经阴离子键合的固相萃取SPE柱分离纯化后,通过选择性洗脱,可实现目标物REG与底物及反应液中其它杂质的快速分离,获得了纯度高于98%的试卤灵葡萄糖醛酸苷产物4. 3 mg,实际产率高达73%.以上实验结果表明,通过SPE柱制备试卤灵葡萄糖醛酸苷过程简单、操作方便且目标化合物纯度较高.同时,该代谢产物(保留时间4. 9 min)在含有单位浓度为1030 U/mL 的β-葡萄糖醛酸苷酶反应体系中液相色谱峰消失,在保留时间6. 3 min处可观察到试卤灵色谱峰[见图2(B)].表明该代谢产物在β-葡萄糖醛酸苷酶反应体系中发生了葡萄糖醛酸化的水解反应生成试卤灵,可见该代谢产物为试卤灵的葡萄糖醛苷.Fig.2 LC-UV chromatography of REG before and after purification(A)and hydrolysis(B)(A)LC-UV chromatography of the reaction mixture(a)and the aim metabolite after isolation and purification by SPE(b);(B)LC-UV profiles of REG(100 μmol/L)before(a)and REG(100 μmol/L)was incubated with β-glucosidase(1030 U/mL,complete hydrolysis)in at 37℃for 15 min(b).2.3试卤灵葡萄糖醛酸化产物的结构表征对试卤灵葡萄糖醛酸苷的结构进行了表征.1H NMR(400 MHz,DMSO-d6),δ: 7. 80(d,J = 8. 9 Hz,1H),7. 54(d,J =9. 8 Hz,1H),7.18(d,J =2. 4 Hz,1H),7. 11(dd,J =8. 9,2. 4 Hz,1H),6. 80(dd,J =9. 8,1. 9 Hz,1H),6. 30(d,J = 1. 9 Hz,1H),5. 20(d,J = 8. 0 Hz,1H),3.84(d,J = 8. 6 Hz,1H),3. 31~3. 47(m,1H);13C NMR(100 MHz,DMSO-d6),δ: 185. 87,171. 36,161. 21,150. 17,146. 30,145. 42,135. 43,134. 39,131. 68,129. 01,115. 34,106. 22,102. 99,100. 10,76. 49,75. 17, 73. 33,72. 03.紫外最大吸收波长为456和380 nm,其波谱数据与文献[16,24]报道一致.红外特征波谱数据显示,与底物相比,在3345.41 cm-1处的羟基伸缩振动峰强度明显增强,在1715. 92 cm-1处增加了1个羰基特征峰,915. 31 cm-1处的C—H弯曲振动峰变宽.试卤灵葡萄糖醛酸苷的13C NMR谱如图3所示,可知在试卤灵12个碳信号的基础上出现6个新的葡萄糖醛酸碳信号(δ 100. 10,73. 33,75. 17,72. 03,76. 49,171. 36),同时葡萄糖醛酸的端基碳原子C1'(δ 100. 10)的化学位移大于100,提示其为β构型糖苷.1H NMR中产物的葡萄糖醛酸特征信号端基质子H(δ 5. 20,J = 8. 0 Hz)偶合常数大于7,再次证实其为β构型糖苷键.综合上述信息,确定试卤灵在猴肝微粒体的催化下生成了试卤灵β-D-葡萄糖醛酸苷结合物.2.4水解产物试卤灵标准曲线的绘制Fig.313C NMR spectrum of Resorufin-β-D-glucuronide(400 MHz,DMSO-d6)试卤灵葡萄糖醛酸苷是自身无荧光的橘色化合物,其在β-葡萄糖醛酸水解酶催化下可快速生成具有良好荧光属性的亮粉色化合物试卤灵(Scheme 2).其荧光发射波谱如图4(A)所示,选取500 nm作为激发波长测得其最大发射波长位于606 nm处,与文献[25]报道相吻合.采用荧光法绘制试卤灵的标准曲线如图4(B)所示,可见试卤灵在0~20 μmol/L浓度范围内其荧光强度与浓度呈线性关系,回归方程为y =1079. 8x +287. 08,R2=0. 993.以上结果表明,试卤灵葡萄糖醛酸苷在β-葡萄糖醛酸水解酶的作用下可生成具有较长发射波长的产物试卤灵.通过在单位时间内检测试卤灵荧光信号强度的变化,可实现不同生物体系中葡萄糖醛酸酶活性的快速测定及其抑制剂的高通量筛选.Scheme 2 Hydrolysis of resorufin glucuronide by β-glucosidaseFig.4 Emission spectrum(A)and calibration curve(B)of resorufin(A)Emission spectrum of REG after hydrolysis with β-glucosidase,the excitation wavelength was set at 500 nm;(B)resorufin calibration curve was obtained with a range of resorufin concentration,(0—20 μmol/L)in an equal volume of acetonitrile and PBS(total volume 400 μL),the excitation and emission wavelength were set at 577 and 620 nm,respectively.2.5试卤灵β-D-葡萄糖醛酸苷水解动力学表征及β-葡萄糖醛酸苷酶抑制剂筛选以试卤灵β-D-葡萄糖醛酸苷为底物,在线性反应条件下(反应时间15 min,酶终浓度10. 3 U/mL)测定β-D-葡萄糖醛酸苷酶水解该底物的酶动力学参数,结果如图5(A)所示.试卤灵葡萄糖醛苷水解的动力学类型符合经典米氏动力学(MM),通过米氏方程求得动力学参数,包括酶与底物亲和力常数(Km)及酶促最大反应速率(vmax)分别为(234±22. 37)μmol/L和0. 04 pmol/(min·U).在此基础上,以试卤灵葡萄糖醛苷为底物,借助荧光检测法构建了β-葡萄糖醛酸苷酶抑制剂高通量筛选方法.选择D-葡萄糖二酸-1,4-内酯为阳性抑制剂,进行其对β-葡萄糖醛酸苷酶抑制活性的表征,结果如图5(B)所示.D-葡萄糖二酸-1,4-内酯对该酶表现出了强烈的抑制作用,当抑制剂浓度为100 μmol/L时抑制率高达90%,半数抑制浓度(IC50)为(4. 58±0. 36)μmol/L,与文献[26]使用非荧光探针底物测定的50值基本吻合.Fig.5 Enzymatic kinetic and inhibition effect of REG hydrolysis in β-glucosidase(A)Enzymatic kinetic of REG hydrolysis in β-glucosidase,the abscissa is the concentration of resorufin glucuronide,the ordinate is the generation rate of resorufin.Eadie-Hofstee plot is shown as inset.Each point represents the average of two independent experiments in duplicate;(B)inhibitory effect of D-saccharic acid 1,4-lactone towards β-glucosidase with resorufin as the substrate IC50value was obtained by fitting data to IC50equation of GraphPad Prism 6.0.以上结果表明,以试卤灵葡萄糖醛苷作为底物构建的β-葡萄糖醛酸苷酶抑制剂高通量筛选方法具有准确度高、灵敏度高及可高通量筛选等优点,可用于不同生物体系中β-葡萄糖醛酸苷酶活性的快速测定及抑制剂的高通量筛选.3 结论通过比较不同种属肝微粒体催化试卤灵葡萄糖醛酸化的反应效率,发现猴肝微粒体可作为高效转化酶源,通过优化反应条件实现了试卤灵葡萄糖醛酸苷(REG)的高效转化.同时借助装填有特殊键合材料C18WAX的阴离子固相萃取柱实现了目标产物的富集纯化,并通过选择性洗脱实现了目标物REG与底物及反应液中其它杂质的快速分离.所得产物借助LC-MS及核磁共振技术进行了结构鉴定.该方法操作简单、生物转化效率高且目标化合物纯度高,为试卤灵β-D-葡萄糖醛酸苷的高效制备提供了新方法.此外,还将获得的试卤灵葡萄糖醛酸苷作为β-葡萄糖糖醛酸苷酶的荧光探针底物,构建了β-葡萄糖苷酶活性检测及其抑制剂高通量筛选的荧光分析方法.参考文献[1]Kowalczyk M.C.,Spears E.,Narog M.,Zoltaszek R.,Kowalczyk P.,Hanausek M.,Yoshimi N.,Slaga T.J.,Walaszek Z.,Oncol.Rep.,2011,26(3),551—556[2]Beaud D.,Tailliez P.,Anba-Mondoloni J.,Microbiol-Sgm.,2005,151,2323—2330[3]Matsuura T.,Hosoda K.,Ichihashi N.,Kazuta Y.,Yomo T.,J.Biol.Chem.,2011,286(25),22028—22034[4]Hanioka N.,Ozawa S.,Jinno H.,Ando M.,Saito Y.,Sawada J.,Xenobiotica,2001,31(10),687—699[5]Stringer A.M.,Gibson R.J.,Logan R.M.,Bowen J.M.,Yeoh A.S.J.,Keefe D.M.K.,Cancer Biol.Ther.,2008,7(12),1919—1925[6]Ahmad S.,Hughes M.A.,Lane K.T.,Redinbo M.R.,Yeh L.A.,Scott J.E.,Current Chemical Genomics,2011,5,13—20 [7]Chen X.,Yu T.,Chen Z.,Zhao R.,Mao S.,Xenobiotica,2014,44(9),785—91[8]Schroeder C.,Lutterbach R.,St ckigt J.,Tetrahedron,1996,52(3),925—934[9]Zhao L.,Huimin M.,Chem.J.Imaging Science and Photochemistry,2014,32(1),60—68(李照,马会民.影像科学与光化学,2014,32(1),60—68)[10]Motabar O.,Shi Z.D.,Goldin E.,Liu K.,Southall N.,Sidransky E.,Austin C.P.,Griffiths G.L.,Zheng W.,Anal.Biochem.,2009,390(1),79—84[11]Hofmann J.,Sernetz M.,Anal.Chim.Acta,1984,163,67—72[12]Gao W.,Xing B.,Tsien R.Y.,Rao J.,J.Am.Chem.Soc.,2003,125(37),11146—11147[13]Albers A.E.,Rawls K.A.,Chang C.J.,Chem.Commun.,2007,44,4647—4649[14]Lavis L.D.,Chao T.Y.,Raines R.T.,Chem.Sci.,2011,2(3),521—530[15]Hanif M.,Khan I.,Rama N.H.,Noreen S.,Choudhary M.I.,Jones P.G.,Iqbal M.,Med.Chem.Res.,2012,21(11),3885—3896[16]Schroeder C.,Lutterbach R.,St ckigt J.,Tetrahedron,1996,52(3),925—934[17]Wimmer Z.,Pechová L.,Saman D.,Molecules,2004,9(11),902—912[18]Reiss P.,Burnett D.A.,Zaks A.,Bioorg.Med.Chem.,1999,7(10),2199—2202[19]Chen X.,Yu T.,Chen Z.,Zhao R.,Mao S.,Xenobiotica,2014,44(9),785—91[20]Tian M.L.,Lee Y.R.,Park D.W.,Row K.H.,Chem.Res.Chinese Universities,2013,29(4),663—666[21]Yang G.,Zhu L.L.,Lü X.,Wu D.C.,Xia Y.L.,Ma X.C.,Xin Y.,Hou J.,Chem.J.Chinese Universities,2014,35(2),314—318(杨刚,朱亮亮,吕侠,吴大畅,夏杨柳,马骁驰,辛毅,侯洁.高等学校化学学报,2014,35(2),314—318)[22]Rao W.,Yin Y.L.,Long F.,Zhang C.H.,Chem.J.Chinese Universities,2015,36(3),449—455(饶维,尹玉立,龙芳,张朝辉.高等学校化学学报,2015,36(3),449—455)[23]Liebherr R.B.,Renner M.,Gorris H.H.,J.Am.Chem.Soc.,2014,136(16),5949—5955[24]Magro G.,Bain R.E.S.,Woodall C.A.,Matthews R.L.,Gundry S.W.,Davis A.P.,Environ.Sci.Technol.,2014,48(16),9624—9631[25]Zhou M.J.,Diwu Z.J.,Panchuk Voloshina N.,Haugland R.P.,Anal.Biochem.,1997,253(2),162—168[26]Narita M.,Nagai E.,Hagiwara H.,Aburada M.,Yokoi T.,Kamataki T.,Xenobiotica,1993,23(1),5—10Highly Efficient Preparation of Resorufin-β-D-glucuronideSupported by the National Basic Research Program ofChina(No.2013CB531800)and the National Natural Science Foundation of China(Nos.81473181,81273590).WANG Xinxin1,L Xia3,GE Guangbo3,FENG Lei3,XIN Hong3,LI Yaoguang3,CAO Yunfeng3,HAN Guanying2,GUO Bin2*(1.Department of Medicine,Liaoning Medical University,2.The First Affiliated Hospital of Liaoning Medical University,Jinzhou 121000,China; 3.Dalian Institute of Chemical Physics,Chinese Academy of Sciences,Dalian 116023,China)Abstract Resorufin-β-O-glucuronide(REG)is a substrate of the β-glucuronidase enzyme which exhibited almost no fluorescence,upon addition of β-glucuronidase a high fluorescent compound resorufin will be released.Resorufin,is a fluorescent compound possessing good optical properties.On the basis of the off-on type fluorescent reaction,REG canbe served as the good fluorescent substrate of β-glucuronidase.However,commercial available REG is rather expensive due to the difficulty for preparation of REG and the studies on REG are very limited.This study aimed to adopt the mild biosynthesis approach to efficiently prepare REG,based on resorufin can be extensively metabolized to REG by UDP-glucuronosyltransferases(UGTs).REG was prepared using resorufin as the starting material and liver microsomes from cynomolgusmonkeys(CyLM)as the enzyme source.Resorufin(RE,100 μmol/L)was incubated in Tris-HCl(50 mmol/L,pH = 7. 4,with 1% DMSO)with CyLM(0.5 mg/mL)at 37℃for 4 h.After the optimization of the incubation conditions,the conversion of REG was more than 80%.A unique solid-phase extraction column(SPE)packed with C18WAX was used to enrich and purify the product REG with high yield.The product was then identifiedby both LCMS and NMR techniques.Finally,a high throughput screening method for β-glucuronidase inhibitors was well established,based on the accurate kinetic parameters of REG towards β-glucuronidase and the absorption and emission spectrum of REG.Keywords Resorufin; Resorufin-β-O-glucuronide; Solid-phase extraction;β-Glucuronidase; Inhibitor screening(Ed.: P,H,D,K)。
β葡萄糖醛酸酶水解条件

β葡萄糖醛酸酶水解条件
β-葡萄糖醛酸酶(β-Glucuronidase)是一种水解酶,可以将葡
萄糖醛酸(GlcUA)从化合物中水解出来。
水解条件可以根据
具体的实验目的来确定,但一般需要满足以下条件:
1. pH:β-葡萄糖醛酸酶在中性或弱碱性条件下最活跃,pH范
围一般在6.5-8.5之间。
在不同的实验设置中,选择最适宜的
pH值进行反应,可以提高酶的活性和反应速率。
2. 温度:β-葡萄糖醛酸酶的最适温度一般在37°C左右。
根据
实验需要,可以在较低或较高温度下进行反应。
较低温度可以减缓反应速率,利于分析和观察结果;较高温度可以加快反应速率,缩短反应时间。
3. 存活因子:β-葡萄糖醛酸酶的活性受到一些辅助因子的影响,例如金属离子(如镁离子)、辅酶(如辅酶A)等。
根据实验所需,可以添加这些活性辅助因子来提高酶的活性。
4. 反应时间:β-葡萄糖醛酸酶的反应时间可以根据实验目的来
确定。
一般情况下,需要将样品与酶在适宜的pH和温度条件
下反应一段时间,以确保酶能够充分地水解目标物质。
需要注意的是,β-葡萄糖醛酸酶的水解条件可能因不同的实验
目的、反应物和实验设置而有所差异,因此在具体实验中需根据需要进行优化和调整。
β-葡萄糖醛酸酶 底物 4-甲基伞形酮-β-d-葡萄糖醛酸苷

β-葡萄糖醛酸酶底物4-甲基伞形酮-β-d-葡萄糖醛
酸苷
β-葡萄糖醛酸酶是一种酶,它催化底物的转化反应。
在这种情况下,底物是4-甲基伞形酮-β-d-葡萄糖醛酸苷(4-methylumbelliferyl-β-D-glucuronide)。
β-葡萄糖醛酸酶将4-甲基伞形酮-β-d-葡萄糖醛酸苷转化为4-甲基伞形酮(4-methylumbelliferone)和β-D-葡萄糖醛酸(β-D-glucuronic acid)。
这个反应可以通过水解作用或者酶促反应来实现。
具体反应方程式如下:
4-甲基伞形酮-β-d-葡萄糖醛酸苷+ H2O →4-甲基伞形酮+ β-D-葡萄糖醛酸
这个反应通常被用作测定β-葡萄糖醛酸酶的活性。
由于4-甲基伞形酮是一种荧光分子,它会发出可见光,因此可以通过测量产生的荧光信号来确定酶的活性水平。
1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
β-glucuronidase
β-葡萄糖醛酸苷水解酶是糖苷酶家族中的一员,人体β-葡萄糖醛酸苷水解酶含有653个氨基酸,相对分子量在80KD。
β-葡萄糖醛酸苷水解酶是溶酶体内的酸性水解酶,主要来源于多形核白细胞,也可见于其他细胞和细菌,是细胞外基质主要成分大分子蛋白聚糖降解的酶原之一,直接参与蛋白聚糖和细胞内外基质的降解过程。
β-葡萄糖醛酸苷水解酶具有多种特征结构,决定了其水解活性,包括由氢键连接而成的封闭桶状结构,以及由8个α螺旋体和8个平行的β折叠体组成的保守蛋白结构。
其广泛存在人体组织及体液中,参与内体多方面的调节。
如在肠道中,刷状边缘上的β-葡萄糖醛酸苷水解酶可以使结合型胆红素转变为非结合型胆红素,达到重吸收的作用。
β-葡萄糖醛酸苷水解酶同样存在于母乳中,与新生儿黄疸有密切的关系。
