羰基化合物的亲核加成反应
高等有机10羰基的加成反应

光化学方法在羰基加成中应用
01
直接光激发羰基化 合物
通过紫外光或可见光激发,使羰 基化合物与亲核试剂发生加成反 应。
02
光敏剂参与的光化 学反应
利用光敏剂吸收光能后,与羰基 化合物和亲核试剂发生电子转移, 从而引发加成反应。
03
光催化羰基加成反 应
利用光催化剂在光照条件下,活 化羰基化合物,使其与亲核试剂 发生加成反应。
离子液体在羰基加成中应用
离子液体作为绿色溶剂和催化剂,在羰基加成反应中具有潜在应用价 值。
超临界流体在羰基加成中应用
超临界流体具有独特的物理和化学性质,可作为绿色反应介质和催化 剂载体,在羰基加成反应中发挥重要作用。
微波辅助羰基加成反应
微波辐射具有快速、高效、环保等特点,可用于促进羰基加成反应的 进行,提高反应速率和产率。
可见光催化羰基加成反应
利用可见光作为光源,结合光催化剂的使用,实现温和条件下的羰基 加成反应,具有绿色、环保的特点。
06 总结与展望
各类羰基加成反应特点比较
醛酮加成反应
醛酮是最常见的羰基化合物,其加成反应通常通过亲核试剂进攻羰基碳原子实现。这类反应具有条件温和、 产率较高等特点,但选择性较差。
羧酸及其衍生物加成反应
有机合成
医药领域
羰基加成反应是有机合成中的重要反应之 一,可用于构建碳-碳键和碳-杂原子键。
许多药物分子中都含有羰基结构,羰基加 成反应在药物合成中具有广泛应用。
材料科学
前景展望
羰基化合物可用于制备高分子材料、液晶 材料等,羰基加成反应在这些材料的合成 中发挥重要作用。
随着绿色化学的发展,羰基加成反应将更加 注重环境友好性和原子经济性,实现高效、 绿色的有机合成。
第五章羰基亲核加成及相关反应

羟醛缩合反应历程
碱催化历程
至少要有两个α-氢才可失水,失水后形成共轭 体系α,β-不饱和酮稳定
亲核试剂:
含氧试剂:H2O、ROH、RO 含碳试剂:RC≡C-,C≡N-,R 含氮试剂:NH3,NH2,NH2NH2及NH2OH等
醛与酮:
醛与酮是较强的亲电试剂,易进行亲核加成,醛可与弱亲核 试剂反应(如NH3,CN-)
羧酸及其衍生物:
较弱的亲电试剂(+C) 只与强亲核试剂反应(如:R-,RO-等) 不与弱亲核试剂(如氨)反应
基本上不发生亲核取代反应
CH3 120o C CH3
O
HCN
CH3 C
CN CH3OH, H2SO4
71%~80% CH3109.5oOH
90%
CH3 CH2=C COOCH3
试剂的亲核性越强越易反应
带负电荷的亲核试剂,比其共轭酸亲核性强: OH->H2O
极性大的分子比极性小的分子亲核性强: HCN> H2O (pH)
亲核试剂可从醛(酮)所在平面的上面或下面进攻,新形 成一个手性中心,产物为外消旋体(对映异构体各占 50%)。
亲核试剂从空阻小的一边进攻羰基
换用仲丁基硼氢化锂,内侧进攻产物99.6%, 外侧产物0.4%
醛酮的简单亲核加成
强酸强碱
仅限醛、脂肪甲基酮及<8个碳原子的环酮
可极化性及亲核性:
Wittig试剂(磷叶立德):
内鎓(Onium)正盐(中性分子)R3P+
CHR'
(碳的电负性大于磷),具有相反的电荷在
相邻两个原子上。
硫叶立德:
磷酸 膦酸 氨 胺(C-N) 铵 磷 膦(C-P) 鏻
硫( )锍
醛、酮的亲核加成反应

H
加成
OH H
-H2O
C O+ HN Y
C NY
C NY
上式也可以直接写成:
CO +H 2NY
CNY+H 2 O
反应的结果是在醛和酮与氨的衍生物分子间脱去一 分子水,生成含有C=N双键的化合物。这一反应又叫 做醛和酮与氨的衍生物的缩合反应。
H2 N OH
O+
H2 N NH2 H2 N NH
NH2 NH O2N
2-戊醇 2-戊酮 苯甲醚
卢卡斯试剂
出现混浊 X X
2,4-二 硝基苯肼
生成晶体 X
Backmann重排 酮与羟胺作用生成的酮肟在强酸作用下发生重排,生成取代的 酰胺。这种由肟变为酰胺的重排,叫贝克曼(Backmann)重排。
反应历程:
特点:(1) 在不对称的酮肟中,处于羟基反位的基 团重排到氮上;
1.与氢氰酸加成
C O + HCN
OH C
CN
α 羟基睛
在少量碱催化下,醛和脂肪族甲基酮与氢氰酸加成生成氰醇(或叫
羟基醇)。
应用范围:醛、甲基脂肪酮、C8以下环酮
H2O
(C3H)2CCN H2O/H
OH
H
练习:
CH 3 CH 3OH
C H 3
CH 2=C-CN H CH 2=C-CO3OCH
(C3H)2C C O O H
C H 3 C H O +2 C 2 H 5 O H
利用这一性质在有机合成中常用来保护羰基。
例题: HO 2 CH CHO O HOOC CHO
必须要先把醛基保护起来后再氧化。
HOC 2 H HOOC
CHOCHH 3O CH l HOC 2 H
(完整版)羰基的亲核加成及相关反应

羰基的亲核加成及相关反应羰基化合物包括醛、酮、羧酸及衍生物和CO 2。
5.1 羰基的结构CO δ+δ-亲电中心羰基碳的活性较大,易被亲核试剂进攻而发生亲核加成反应和亲核取代反应。
5.2 亲核加成反应的历程及影响因素 5.2.1 HCN 的加成 反应为碱催化。
]CN ][CO [k v ->=OH -+HCNCN -+ H 2O快-COδ+δ-CO -CNCOHCN+OH - 反应的平衡位置受电子效应和空间效应的影响。
酮正向反应的趋势较小(空阻大)。
二、亲核加成反应的一般特点 1.反应可以被酸或碱催化酸催化可提高羰基的亲电活性。
CO +H ++OH碱催化提高亲核试剂的亲核性。
NuH +OH --+H 2ONu H ->2.多数醛酮的亲核加成为可逆反应,用于分离与提纯。
5.2.2 影响羰基亲核加成反应活性的因素 一、羰基化合物的结构 1.电子效应羰基碳的正电性越大,亲核加成速度越大,反应活性越大。
羰基碳所连的吸电基(-I ,-C )使其亲核加成反应的活性增加,而供电基(+I ,+C )则使其活性降低。
活泼顺序:ClCHO > HCHO > RCHO > CH 3COR > RCOOR' > RCONR'2 > RCOO --I > +C(+C)(+C,空阻)( +C > -I)(+C)CO RR'活性极低(1)π-π共轭效应(增加其稳定性);(2)+C 效应(降低羰基碳的正电性);(3)加成产物失去共轭能,反应活化能高;(4)产物的张力大幅增加。
2.立体效应CO -sp 2活性:O CHH OC CH 3H OC CH 3CH 3O OC CH 3CH 2CH 2CH 3OC Ph Ph>>>>>二、试剂的亲核性对同一羰基化合物,试剂的亲核性越大,平衡常数越大,亲核加成越容易。
1.带负电荷的亲核试剂比起共轭酸(中性分子)的亲核性强。
羰基化合物的反应

碱性溶液中:
.. ..
..
O R C CHR
H
.. + .O.H
..
..
..
O slow
R C C R + H2O H
OH R C CHR + OH
烯醇式
烯醇负离子中存在共振稳定化作用:
..
O RCCR
H
O ..
R C CHR
卤仿反应就是历经烯醇负离子(即碳负离子)完成的。
O R(H)CCH3 Br2, NaOH
R
R' OA C
R Nu
影响羰基活性的主要因素是电子效应和空间效应。取代基的+C、+I 效应都
使羰基碳电正性减小,不利于亲核剂进攻;另外,羰基加成,反应中心碳由 SP2
杂化变为 SP3 杂化,空间因素是重要的。取代基体积越大,空间位阻越大,不利
于亲核进攻。因此,羰基活性或亲核加成速度有:
O O H C H > RCH >
β-不饱和酸的反应。
OO
OO
C6H5CHO + CH3 C O CCH3 CH3COONa C6H5CH=CHCOCCH3 + H2O
C6H5CH=CHCOOH + CH3COOH
5.曼尼赫反应,含活泼 α-H 的化合物和甲醛(有时采用其它醛)及胺(伯或仲 胺)缩合生成 β-氨基(或取代氨基)的羰基化合物(曼尼赫碱)。
第七章 羰基化合物的反应
学习要求: 1.掌握羰基化合物(醛、酮、羧酸及其衍生物)的重要亲核加成反应历程、立
体化学、影响活性的因素及酸碱催化作用; 2.理解负碳离子化学,掌握其在有机合成中的作用。
羰基化合物的反应可归纳为两个基本过程:(1)亲核试剂对羰基的加成;(2)
简述羰基法的基本原理

简述羰基法的基本原理羰基法是有机合成中常用的一种反应方法。
它的基本原理是利用羰基化合物(包括酮和醛)与亲核试剂发生加成或取代反应,从而得到新的有机化合物。
羰基化合物是指含有碳氧双键的有机化合物,最常见的就是酮和醛。
酮的结构中有两个碳原子与氧原子通过双键相连,而醛则只有一个碳原子与氧原子相连。
这种碳氧双键的存在使得羰基化合物具有一定的活性,容易与其他化合物发生反应。
羰基法的基本原理是利用亲核试剂的亲核性,通过攻击羰基化合物的羰基碳原子,从而打开碳氧双键,形成新的化学键。
亲核试剂可以是含有活泼氢原子的化合物,如醇、胺等;也可以是含有亲核性的阴离子,如氢氧根离子、碱金属离子等。
在羰基法中,亲核试剂与羰基化合物发生反应后,羰基碳原子上的氧原子会成为一个亲核试剂的官能团,而亲核试剂的官能团则会连接到羰基碳原子上,形成一个新的化学键。
这个过程通常需要在适当的温度和溶剂条件下进行。
羰基法在有机合成中有着广泛的应用。
通过选择不同的亲核试剂,可以合成不同类型的有机化合物。
例如,醛和胺反应可以得到相应的胺化合物;酮和醇反应可以得到醚化合物;酮和硫醇反应可以得到硫醚化合物等等。
羰基法的优点在于反应条件温和,反应选择性高,产率较高。
同时,羰基法也存在一些局限性,例如需要选择合适的亲核试剂和反应条件,需要考虑立体化学效应等。
此外,羰基法还可以和其他反应方法(如还原、氧化、羟醛化等)结合使用,从而实现更复杂的有机合成。
羰基法是一种常用的有机合成方法,基于羰基化合物与亲核试剂的加成或取代反应。
通过合理选择亲核试剂和反应条件,可以合成多样化的有机化合物。
在有机合成中,羰基法起着重要的作用,为合成出具有特定结构和功能的化合物提供了可行的途径。
加成反应的四种类型

加成反应的四种类型
化学反应中常见的一种类型就是加成反应。
这种反应会将两个或多个分子结合成一个较大的分子。
加成反应可以分为四类:氢化加成反应、卤代烃加成反应、烯烃加成反应和羰基化合物加成反应。
1. 氢化加成反应
氢化加成反应是指通过加氢反应,在不影响反应物分子结构的前提下将两个或多个分子合并成一个较大的分子。
氢化加成反应通常在光下或加热条件下发生。
举个例子,醛和酮可以与氢气反应,生成醇。
2. 卤代烃加成反应
卤代烃加成反应是指在存在较强的亲核试剂下,卤代烃和亲核试剂之间发生加成反应。
在这种反应中,卤代烃中的卤素原子被替换成亲核试剂中的原子或基团。
一个常见的例子是溴化烷和氢氧化钠反应形成乙醇。
3. 烯烃加成反应
烯烃加成反应是指在存在较强电荷云的烯烃分子中间发生加成反应。
这种反应通常会在添加特定催化剂条件下发生。
例如,苯乙烯在存在硫酸中进行加成反应,得到苯乙醇。
4. 羰基化合物加成反应
羰基化合物加成反应是指在存在羟胺、肼等亲核试剂时,羰基化合物之间发生加成反应,形成新的分子。
一个常见的例子是醛和肼反应生成肼醛。
总体来说,加成反应是一种常见的化学反应,可以产生新的化合物和物质。
这四种类型的加成反应在实际应用中也有很广泛的用途。
例如在生产化妆品、医药中都经常使用这些反应类型的化学方法,进一步推进了化学领域的发展和进步。
第六章羰基化合物的--烷基化和亲核加成反应

一.羰基化合物的α-烷基化(芳基化)反应1.1 手性底物或辅助基团诱导的不对称烷基化反应(1) 金属配位型手性辅基传递---螯合的手性诱导从Evans试剂出发可以合成各种烷基酸和相应的化合物试剂)缺点是:制备困难,价格较高。
手性辅基切除困难∙以手性肼为为辅助基,生成腙手性腙体系∙与手性胺辅基不同,没有生成金属-烯胺,而是直接金属化(d) 手性磺内酰胺体系亲电试剂从氮原子的孤对电子方向相反的Re MLn R”X(3)“手性记忆”又称:“手性中心的自我再生”手性季碳原子的构建是有机合成化学中的难点之一∙利用不对称烷基化反应构筑手性季碳中心Seebach, Angew , 1996,35,2708∙“手性记忆”策略的应用base: LiHMDSJACS ,2013,13294Up to 99%ee♣不对称α-芳基化反应(芳基重排)构筑手性季碳中心手性配体(L*)1.2. 试剂控制的不对称α-烷基化反应∙手性锂试剂及手性胺配体的应用添加剂无手性配体:产率:<1%, 86%回收原料20 mol% L*: 产率:1%,(52%ee )20 mol% L* + 乙二胺:产率:83%,92% eeF idi 会使催化剂中毒∙Ni 催化的吡啶鎓离子的芳基化反应Doyle Angew ,2013,9153∙Free pyridine 会使催化剂中毒。
∙选择4-methoxypyridine 是因为在低温下,可以与氯甲酸酯成盐。
∙在Nigishi 反应中,第一次以Ni 活化亚胺离子,并高对映选择性地生成C-C 键。
Proposed mechanismMX n2.2 手性辅基的Michael 加成反应举例:格氏试剂为亲核试剂(2) 有机硼试剂的共轭加成反应COOEt COOEtPh+PhB(OH)2Rh(acac)(C 2H 4)2(S)-BINAP100o C, 1,4-dioxane/H 2O>99%, 90% eeOORh(acac)(C 2H 4)2(S)-BINAP BINAP-Rh 催化剂(S)BINAP+∙手性sulfuro-olefin 配体-Rh 催化剂Du, OL ,2011, 3300Sulfer 和olefin 与Rh 的配位被1HNMR 和络合物单晶分析证明。
第 六章羰基化合物的反应(共137张PPT)

与亚硫酸氢钠的加成
O CH3 + NaHSO3
O CH3 SO3Na
O
O
应用:a 鉴别化合物(2-戊酮和3-戊酮) b 分离和提纯醛、酮
分离3-戊酮和2-戊酮的混合物
=
= =
=
= =
O
C H3 C H2 C C H2 C H3
b p :102℃
O
NaHSO3
C H3 C H2 C H2 C C H3
O 2 N
O 2 N
CO + H 2 N NHN 2O H 2 O CN NHN 2O 2,4-二硝基苯腙
O
O
CO + H 2 NNC H N 2H H 2 O
缩氨脲
CNNC H N 2H
应用:鉴别醛酮
与格氏试剂的加成
加成产物水解后生成醇,用于制备各种醇。
δ- δ+
δ+δ-
R M g X+ CO
RCO M g XH 2O
Nu
R CO
R'
sp2杂化 平面三角型
键角:120° 109°28 ′
产物中基团拥挤程度增大。
R 越大,妨碍Nu:进攻C原子。
R
O
C Nu
R'
sp3杂化 四面体
缓解角张力
OH C N
O H C NK = 1 0 0 0 0
O + H C N
C O N HK = 1 0 0 0
角张力缓解程度不大
醛、酮羰基碳原子所连的基团空间位阻或空间张力愈大, 则羰基的反应活性愈小。这一方面是由于大的位阻会阻 碍亲核试剂的进攻;另一方面醛、酮羰基碳原子为sp2杂 化,键角为1200,而加成产物原羰基碳原子变成了sp3杂化, 键角接近109028’,基团体积大,加成后必然张力增加 也大,使亲核加成难以发生。
羰基的亲核加成及相关反应

O H CCCR (H )
a-炔基醇
•进一步应用
H OH C CC CR
炔基醇
H2 Lindlar催化剂
Na / NH3
H2O/ Hg++ H C
R=H
OH
C
R
CC
H
H
cis-烯基醇
OH
C
H
CC
trans-烯基醇
H
R
OH O
H+
C C CH3
O
C
CC
CH3
a-羟基酮
羰基的亲核加成及相关反应
a, b-不饱和酮
醛酮与金属试剂加成的立体化学 —— Cram规则
手性碳
2.5
1
•Cram的解释
Small
Medium
O
H
Et CH3MgBr
Br
Mg
O
H3C H
Et
OH
H
Et
HPh
Large
HPh
位阻大
Cram规则:羰基氧在S与M 之间,试剂从S一边进攻。
羰基的亲核加成及相关反应
H3C
H
Ph
主要产物
1.3 醛酮与LiAlH4 或 NaBH4 还原反应
N H 2
H 2 O /H +
CC N
o r O H
a-氨基腈
羰基的亲核加成及相关反应
N H 2 CC O O H
a-氨基酸
Strecker反应机理
O
H NH3
OH
OH
C
C
C
CN C
NH2
亚胺正离子
NH3 NH2 C CN
NH3 H2O/ H+ or OH
羰基化合物的反应与合成

羰基化合物的反应与合成羰基化合物是一类含有C=O官能团的有机化合物,具有广泛的应用和重要的化学性质。
它们不仅在有机合成中扮演着重要角色,也在生物化学和药物化学中具有重要的地位。
本文将通过介绍羰基化合物的反应和合成方法,展示其在有机化学中的重要性。
一、烷醛和烷酮的制备方法1. 氧化反应:烷醛和烷酮可以通过醇的氧化反应制备。
例如,乙醇可以通过氧化反应制备乙醛,反应中常用醛酮试剂如氧化铜和铬酸。
氧化反应是一种常用的烷醛和烷酮制备方法,反应条件温和,产率较高。
2. 氧化还原反应:醛酮可以通过氧化还原反应制备。
常用的氧化还原试剂有铝饼、亚磷酸和硼氢化钠等。
氧化还原反应可实现烷醛到烷醇的还原,或烷酮到烷醇的氢化反应。
二、羰基化合物的加成反应1. 羰基亲核加成反应:羰基化合物可以与亲核试剂发生加成反应,生成新的化合物。
常见的亲核试剂有胺、醇和卤化物等。
以醇为例,醇与醛反应生成醇醚,与酮反应生成醇酮。
羰基亲核加成反应是合成醇、醚和酮的重要方法。
2. 羰基电子亲加成反应:碱性条件下,互变异构体的羰基酮酸可以通过自身内酯化反应发生电子亲加成,生成环状酮。
该反应被广泛应用于天然产物的合成。
三、羰基化合物的氧化反应1. 羰基氧化反应:羰基化合物可以发生氧化反应。
常见的氧化试剂有过氧化氢和氧气等。
氧化反应可将醛氧化为酸,或酮氧化为酸酐。
2. 羰基脱氢反应:羰基化合物在氧化杂化试剂(如碱性高碘酸盐)作用下发生脱氢反应,生成羧酸。
四、羰基化合物的还原反应1. 半醛与醇反应:半醛与醇反应可生成醇、醚和酯等化合物。
该反应可通过还原剂(如氢气和金属还原剂)催化进行。
2. 羰基还原反应:烷醛和烷酮可以通过羰基还原反应还原为醇和醛。
常用的羰基还原剂有硼氢化钠和氢气等。
综上所述,羰基化合物的反应与合成方法多种多样,涵盖了氧化、加成、还原等多个方面。
这些反应不仅在有机合成中发挥着重要作用,也推动了生物化学和药物化学的发展。
深入理解羰基化合物的反应机理和应用,对于有机化学领域的研究和实践具有重要意义。
羰基化合物的亲核加成和取代反应

含C亲核试剂
¯CN
二、羰基的亲核加成
含C亲核试剂 ¯C≡CR
二、羰基的亲核加成
4. 含C亲核试剂 (3) 有机金属试剂 格氏试剂、有机锂试剂等 广泛用于合成各级醇及羧酸等有机物 格氏试剂的应用---由醛酮合成各级醇
格氏试剂的应用---由羧酸衍生物合成醇 格氏试剂的应用---其他
格氏试剂的应用总览
低温和空间位阻作用以及使用不活泼的金属试剂可能将反应控制在酮的阶段
格氏试剂的应用---由醛酮合成各级醇
二、羰基的亲核加成
1
含C亲核试剂
2
Ylide试剂
3
Ylide 试剂是一类化合物,其中两个相邻原子具有完整的八隅体电子构型,而这两个原子却分别带有不同的电荷,典型的ylide 试剂有磷ylide试剂( phosphonium ylide):
影响 1,2- 和 1,4- 加成的因素:
亲核试剂的碱性
Explanation:
-- Direct addition is irreversible (不可逆, strong base) or reversible (可逆, weak base).
-- Conjugated addition is irreversible.
R2NH 经历亲核加成和脱水两个步骤 脱水发生在羰基的a-C上,形成烯胺(enamine)
1
2
R2NH
思考题:写出2-甲基环己酮与仲胺反应的产物
二、羰基的亲核加成
含N亲核试剂 R2NH 反应可逆,经酸水解可得回醛酮。
醛酮可以通过烯胺进行α-烷基化和α-酰基化反应,合成上应用广泛(见第十四章)
二、羰基的亲核加成
二、羰基的亲核加成
含O, S亲核试剂 包括H2O, ROH, RSH和NaHSO3。可逆反应。 H2O(水合反应)
羰基的亲核加成
上述构型中双键碳上所连的两个大的基团处在反位比较稳定(即 构型以反式为主)。 当分子中含有两个羰基时(二醛、二酮、或一种醛与一种酮),
在碱催化作用下,也可发生分子内羟醛缩合生成五元环或六元环 的不饱和醛酮。
高等有机化学
O
OH
CH3 C CH2CH2CH2CHO
(2)Knoevenagel缩合 不含a氢的醛酮与含活泼的a氢的化合物的合成
高等有机化学
O
O
O
O
* R CH2 C H
OH
*
RCH2CHO
*
R CH C H
R CH2 C CH C H
Step 1
Step 2
HR
O * R CH C H
H2O Step 3
OH
O
*
R CH2 C CH C H
HR
H2O Step 4
O * R CH2 C C C H
HR
如果用两种不同的具有α-H的醛缩合时为混合物,其产物复杂, 合成上意义不大。但无α-H的醛可以与有α-H 的醛发生羟醛
CZ
C Z + CH3CH CHCOOEt
CH3CH CHCOOEt CZ
CH3CH CHCOOEt CZ
BH CH3CH CH2COOEt
CZ
O CH3CH CH COEt
CZ
BH
OH
CH3CH CH COEt
CZ
高等有机化学
例1
CH3CH CHCOOEt + CH2(COOEt)2
C2H5ONa C2H5OH
CHCN + CH2 CH CN C2H5
KOH
OCHCH2CH2CN C2HC5H2CH2COOEt
第十三章羰基化合物的亲核加成和亲核取代反应(07)

● 与羧羰基碳的电正性及空间位阻有关; ● 与反应物稳定化程度及中间体稳定性化程度有关; ● 与离去基团(Y)的离去能力有关。
O R C Nu + Y-
离去基团的离去能力: X- > RCOO- > RO- > H2N羧酸衍生物亲核取代反应活性顺序:
O O O RCOOR RCOOH O > RCNH2
O2N NNH NO2
环己酮-2,4-二硝基苯腙
常用的氨衍生物 (H2N-Y): P581
H2NNH2(肼) H2NOH(羟胺) H2NNHCONH2(氨基尿)
O2N H2NNH (苯肼) H2NNH 2,4-二硝基苯肼 NO2
H CHO NH2OH HO (Z)-苯甲醛肟 C N HCl C6H6 , hv C N
醛酮化合物发生亲核加成反应的活性顺序:
HCHO > RCHO > R2CO > ArCHO > ArCOR > Ar2CO
1. (A)
CHO (B)
COCH3 (C)
CHO
2. NO2 (A) O 3. (A)
COCH3
CH3O (B)
COCH3
O
(B)
13.1.3 羧酸衍生物中羰基的亲核取代与反应活性 P571, 599
R R'
O CH3CH2CCH2CH3 + 2CH3CH2SH H+ H2 Raney Ni CH3(CH2)3CH3
H+
R
(R')H SCH2CH3 缩硫醛(酮)
C S S H2 Raney Ni R R' CH2
C
羰基化合物的亲核加成反应

p-MeOC6H4 H
p-NO2C6H4 H
CH3
CH3
C2H5 t-Bu
CH3 CH3
rate
220 110 32.7 182 33 38
32
Substrates rate
O O O O
O Ph Me
48 1000 Why? 7.8 1.17
0.77
16
17
特点: (1)+I,+C 效应使k值减小;-I, -C效应使k值增大; (2)亲核加成反应中,醛比酮更活泼; (3)环酮的k值相差较大
NaHSO3 是一种含硫的亲核试剂
可逆反应
α- 羟基磺酸钠
53
α- 羟基磺酸钠一般为白色晶体,遇酸或碱被分解成 原来的醛酮。(可逆反应)
应用:用于分离提纯醛、脂肪族甲基酮和8个碳原子以下的环酮。 例如:
54
8.2.3 氮原子作为亲核试剂的加成(消除)反应
55
56
加成-消除产物的应用
1)在稀酸中加热水解,重新生成醛、酮。可用于分离、提纯:
68
有人研究了LiAlH4在不同溶剂中的形态 1) 在低浓度的Et2O溶液中,以自由离子的形式存在:
Li+ AlH4而在高浓度的Et2O溶液中,以二聚体的形式存在 :
(LIAlH4)2
2) 在低浓度的THF溶液中,以紧密离子对的形式存在: Li+ ||AlH4-
而在高浓度的THF溶液中,以二聚体的形式存在 : (LIAlH4)2
31
2、Wittig-Horner反应
32
33
34
35
O + Ph3P=CHOCH3
金刚
利用此结构可制醛
CHOCH3 H2O H+
羰基的加成反应在有机合成中的应用

一、概述羰基的加成反应是有机化学中一种重要的反应类型,具有广泛的应用价值。
本文将探讨羰基的加成反应在有机合成中的应用。
二、羰基的加成反应基本原理1. 羰基的结构特点羰基是含有碳氧双键的有机化合物官能团,一般表示为“C=O”。
羰基通常分为醛、酮和羧酸三种类型,它们具有较强的电性,是有机合成中常见的反应物和产物。
2. 羰基的加成反应羰基的加成反应是指具有亲核试剂(如胺、醇等)与羰基发生亲核加成反应,形成加成产物的过程。
这种反应通常在碱性或酸性条件下进行,产物可以是醇、醛、酮、羧酸等化合物。
三、羰基的加成反应在有机合成中的应用1. 羰基的还原羰基的加成反应可用于醛酮的还原反应,常见的还原试剂有金属氢化物(如氢化钠、氢化铝锂等)和还原醇(如醇、胺等)等。
借助该反应,可以将醛酮还原为相应的醇,扩大有机合成的应用范围。
2. 羰基的羟化反应在羰基的加成反应中,羟胺(氨和水的混合物)可以与醛酮发生羟化反应,形成羟醇。
这种反应被广泛应用于药物合成和其他有机合成领域,具有重要的化学和生物活性。
3. 羰基的羟胺加成在温和的酸性条件下,羟胺可以与羰基形成加成产物。
该反应常用于合成β-羟基酮或β-羟基醛的过程中,产物可以进一步转化为药物分子或生物活性分子。
4. 羰基的羟胺甲酰化在适当的反应条件下,羰基与羟胺发生甲酰化反应,生成羰基甲酰胺。
这种反应在药物合成和有机合成中具有重要的应用价值,可以构建含氨基酰胺结构的化合物。
5. 羰基的醇加成在碱性条件下,醇可以与羰基形成加成产物。
这种反应常用于合成醛醇或酮醇的过程中,产物在有机合成中具有重要的应用价值。
6. 羰基的氧化反应在适当的氧化条件下,羰基可以与氧化剂发生氧化反应,形成羧酸。
这种反应在生物活性分子或有机合成中具有重要的应用价值。
7. 羰基的胺加成在适当的酸性条件下,胺可以与羰基形成加成产物。
这种反应在合成酰胺类化合物中具有重要的应用价值,是有机合成中一种有效的方法。
四、结论羰基的加成反应在有机合成中具有广泛的应用价值,可以用于合成各种类型的有机化合物,包括醇、醛、酮、羧酸等。
羰基的亲核加成

OH
H
R
H
+
OH R
CH3
H
Ph
H Ph CH3
2~4
:
1
2.5
:
1
1.0~1.9
:
1
基团的大小顺序为L>M>S,无分子内氢键。
高等有机化学
Cram规则二 羰基邻位的不对称碳原子上有一OH,一NH2等能与羰基氧 形成氢键的基团时,亲核试剂从含氢键环的空间阻碍小的 一边对羰基加成。
Z
O
O
C R
Y
C R''L
高等有机化学
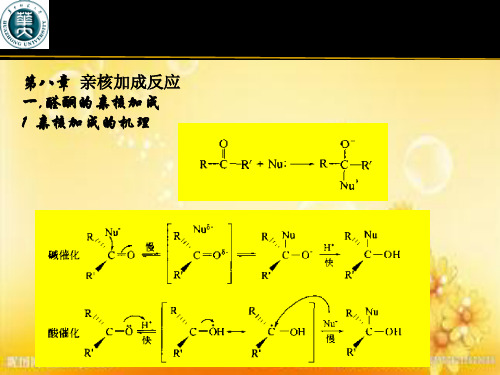
第八章 亲核加成反应 一,醛酮的亲核加成 1 亲核加成的机理
高等有机化学
第八章 亲核加成反应 一,醛酮的亲核加成 2 羰基的活性 ①电子因素*当羰基碳上连有给电子基团(如烷基、芳基等)时,由 于中心碳原子的电正性减小,从而降低了它的亲电能力,使反应活 性下降。相反,若羰基碳上连有吸电子基团(如F3C-等)时,则会使 反应速率加快。 ②空间因素,由于从反应物到过渡态及产物,羰基碳由sp2 杂化变为sp3杂化,反应中存在着明显的空间特性。在反应过程中, R基会被越来越近地挤在一起,非键张力使过渡态内能增加,不利 于反应的进行之故:R基的体积增大时,反应速率迅速下降。Nu体 积增大,同样也会降低反应速率。综合上述两方面的影响,可以得 出一般醛、酮亲核加成反应的话性次序:
CH3CH2
C O + RNHR'
CH3
R' N
R
CH3 C CHCH3
(4)与其它亲核试剂加成
高等有机化学
高等有机化学 三,羰基加成的立体化学
R
C O + Nu A
R'
羰基化合物的反应

O
O
O
O > RCCH3 > RCR' > ArCR
羰基具有平面结构,亲核剂可从平面的两边进攻羰基碳原子。如果羰基平面
两边的空间条件不同,进攻试剂将主要从空间阻碍较小的一边进攻。
樟脑分子中的桥环不能翻转,有碳桥的一边位阻很大。因此,负氢从位阻小
的碳桥对面进攻羰基碳。
O
1.NaBH4 2.H3O
H
OH +
OH H
(主)
若 Nu 体积很小时,3,5-位碳上直立氢的干扰趋于缓解,但加成过程中新生成的
C-O 单键与 2,6-位平伏 C-H 健之间产生的张力则转化为主要的影响因素。二者的
距离越接近,产生的张力越大。
b
HO
t-Bu
+ HBH3Na H
a
H3O a t-Bu
H3O t-Bu b
OH H
H (次) H
曼尼赫反应在合成上的重要性是由于曼尼赫碱受热立即分解生成 α、β-不饱和羰
NaOH
O CH
+ H2O
HCH=O + CH3CHO (过量 )
无 a-H 羰基活性大
OH
HCHO
(HOCH2)3C-CHO
C(CH2OH)4 + HCOOH
歧化反应
三次羟甲基化
季戊四醇
按碰撞理论,容易理解分子内的羟醛缩合进行得更快。特别重要的是鲁宾逊扩环 反应,它包括麦克尔加成和分子内的羟醛缩合两步:
C O + ROH
OH C
OR
ROH / H3O
半缩醛(酮)
缩羰在有机合成中是重要的保护基。例如(1):
OR C
OR
羰基化合物的亲核加成和取代反应

OH
2.H3O
酮
R
R C R'
O
低温和空间位阻作用 3°醇
R''
R CR' 使用不活泼的金属试剂
3°醇
酮 可能将反应控制在酮的阶段
二、羰基的亲核加成
4. 含C亲核试剂
(4) Ylide试剂 An ylide is a compound that has opposite charges on adjacent, covalently bonded atoms with complete octets of valence electrons, for example, a phosphonium ylide:
O CH CH C
1.
MgBr
2.H3O
O CH CH2 C
1,4-加成 92%
O
1.
MgBr
CH CH C CH3
2.H3O
O CH CH2 C CH3 +
OH CH CH C H
1,4-加成 12%
1,2-加成 80%
三、羧酸及其衍生物的亲核取代反应
1. Mechanism for nucleophilic substitution
关于亲核加成的小结 1. 概述 —— 结构、机理、反应活性、立体化学 2. 含O, S亲核试剂 包括H2O, ROH, RSH, 和NaHSO3
羰基的保护 醛酮的分离纯化
3. 含N亲核试剂 (1) RNH2 and YNH2 (2) R2NH
亚胺及其衍生物的形成 烯胺的形成
4. 含C亲核试剂 —— C-C键的形成
第十三章
羰基化合物的亲核加成和取代反应
Nucleophilic Additions and Substitutions of Carbonyl Compounds
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1) 1,2-addition (direct addition)
2) 1,4-addition (conjugated addition)
63
影响 1,2-加成和 1,4-加成的主要因素
(1)亲核试剂的碱性
亲核试剂是强碱,如RLi,LiAlH4,有利于1,2-加成; 亲核试剂是弱碱,如-CN, amines, thiols and X-, 有利于1,4加成;
C
Nu L
H
+
O R1
+ L C Nu
共同点:经历四面体的中间体
6
◆ 简单亲核加成反应(simple addition)
R1 C R2 O +H X C OH X
水合反应及缩醛(酮)形成反应
R1 C R
2
O + H2O
C
OH OH
7
1、 酸催化水合反应--加成反应机理
R1 C R2 R1 C R2 R OH C + A+ 2 R OH2
第八章 羰基化合物的亲核加成及相关反应
1
内容提要
一、羰基化合物的结构及反应活性 1.1羰基化合物的结构及分类 1.2羰基化合物参与的主要反应类型 1.3简单亲核加成反应的机理 1.4羰基化合物反应的立体化学 二、羰基化合物的亲核加成(消除)反应 2.1以碳原子为亲核试剂 2.2以硫原子为亲核试剂 2.3以氮原子为亲核试剂 三、金属氢化物对羰基的亲核加成 四、,-不饱和羰基化合物的亲核加成反应 五、其他有机金属化合物与羰基化合物的反应
NaHSO3 是一种含硫的亲核试剂
可逆反应
α- 羟基磺酸钠
53
α- 羟基磺酸钠一般为白色晶体,遇酸或碱被分解成 原来的醛酮。(可逆反应)
应用:用于分离提纯醛、脂肪族甲基酮和8个碳原子以下的环酮。 例如:
54
8.2.3 氮原子作为亲核试剂的加成(消除)反应
55
56
加成-消除产物的应用
1)在稀酸中加热水解,重新生成醛、酮。可用于分离、提纯:
8.2.1 碳原子作为亲核试剂的加成(消除)反应 8.2.2 硫原子作为亲核试剂的加成(消除)反应
8.2.3 氮原子作为亲核试剂的加成(消除)反应
25
8.2.1 碳原子作为亲核试剂的加成(消除)反应
1、Wittig反应
Ph3P
C
CR2
CR2
R C R'
Ph3P
C
CR2
CR2 + Ph3P
R Ph3P O C R' C
aldehyde
Carboxyla te salt alcohol
amine or alcohol
NaAlH(O- -t-Bu)3
AlH3 --
aldehyde
alcohol
alcohol
alcohol
alcohol (slow)
alcohol
amine (slow)
amine
-alcohol
70
Disiobutylaluminum Hydride (DIBAL): i-Bu2AlH
31
2、Wittig-Horner反应
32
33
34
35
O + Ph3P=CHOCH3
CHOCH3 H2O H+ 醚水解
CHO
金刚
利用此结构可制醛
Ph3P
DMSO CHCH2CH2CH2COPh 88% Ph
36
3、醇醛缩合反应
在催化剂的作用下,含有-氢原子的醛或酮相互作用, 生成羟基醛或羟基酮。 这类反应被碱或酸所催化。 碱催化
16
H H H H CH3 CH3 CH3
17
特点: (1)+I,+C 效应使k值减小;-I, -C效应使k值增大;
(2)亲核加成反应中,醛比酮更活泼;
(3)环酮的k值相差较大 反应活性:RCHO > RCOCH3 > RCOR’ > C6H5COR
环酮的k值相差较大,其中环己酮的k值最大, 这是由 于环己酮加成反应后,形成最稳定的椅式构像,而其他 酮加成时,由于空间位阻较大,k值变小。
反应通式:
反应机理:
O + Ph3P
O
C
O + Ph3P
R Ph3P O C C R'
R C C
R' + Ph3P O
氧磷环丁烷
Ph3P=CH2,
Ph3P=CHC2H5,
26 Ph3P=CHCN
27
28
影响因素
• 醛、酮和酯都可反应,但醛最快而酯最慢。底物分子中 的烯、炔、羟基、芳香族硝基、卤素、酰胺基等官能团 不受影响。 • Wittig试剂上的吸电子基, 如酯基、氰基和磺酰基等可 提高其稳定性,但反应活性降低。 • 使用的碱可以是丁基锂、氨基钠、氢化钠、醇钠和叔胺 等。 • 非质子极性溶剂利于反应进行,常用的有THF、 DMSO、DMF等。
易被氧化
(二)羧酸及其衍生物
4
8.1.2 羰基上的反应类型
亲核加成
羰基氧被氮取代 羰基氧被碳取代 亲核取代
5
8.1.3 羰基参与反应机理
(1)加成反应机理
O R
1
Nu R (H)
2
_
OR1 C
C
Nu R (H)
2
H
+
OH R1 C
Nu R2(H)
(2)加成消除反应机理
O R
1
Nu L
_
OR1 C
AlH3Li H H3C (CH3)2CO CH3 H3C CH3 O H OAlH3Li
LiH3Al
O
CH(CH3)2
LiH2Al[O
CH(CH3)2]2
(CH3)2CO
LiHAl[O
CH(CH3)2]3
(CH3)2CO
LiAl[O
CH(CH3)2]4
思考:LiAlH4中的锂原子能有何作用?
68
有人研究了LiAlH4在不同溶剂中的形态 1) 在低浓度的Et2O溶液中,以自由离子的形式存在: Li+ AlH4而在高浓度的Et2O溶液中,以二聚体的形式存在 : (LIAlH4)2
2
8.1 羰基化合物的结构及反应活性 8.1.1 羰基化合物的结构及分类
◆羰基化合物的结构
1) 极性加成
2) -烷基化
O R
1
OH R H
2
R1
R2
潜在的不对称中心, 广泛应用于不对称 合成反应中 3
◆羰基化合物的分类 (一)醛和酮
α -H的反应
C H (R) H δ+ δ C O 受亲核试剂进攻 亲核加成反应
18
为什么苯乙酮的活性极低?
19
8.1.3 羰基参与反应的立体化学
Stereochemistry
Cram规则一:如果醛或酮的α-碳原子上连有三个大小不同
的基团(L、M、S分别代表大、中、小三个基团)时,其 优势构象为羰基键处在两个较小基团之间的构象,试剂优 先从空间阻碍较小的一边进攻羰基。
次要产物 M O S Nu
substitutes R1 C6H5 p-MeC6H4 p-MeOC6H4 p-NO2C6H4 CH3 C2H5 t-Bu R
2
rate 220 110 32.7 182 33 38 32
Substrates O O O O O Ph Me
rate 48 1000 Why? 7.8 1.17 0.77
-
主要产物
LR
20
21
22
8.1.3 羰基参与反应的立体化学
Cram规则二:当醛或酮的α-碳原子上连有羟基或胺基等
可以和羰基氧原子形成氢键的基团时,试剂将从含氢键
环的空间阻碍较小的一边对羰基进行加成。
H O NCH3 H2 H C6H5 CH3 H H
H NCH3 OH C6H5 CH3
23
Cornforth规则:如果在羰基的α-碳原子上结合着一个卤原
子,由于卤原子和羰基氧原子的电负性都很大,两者互相
排斥,这时的优势构象是卤原子与羰基处于对位交叉位。
反应时,试剂也是从空间位阻较小的一边进攻羰基。
O CH3 Cl CH3 H
1)n- C4H9MgBr 2) H2O
C4H9-n CH3 HO Cl
24
H CH3
8.2
羰基化合物的亲核加成(消除)反应
2)肟、苯腙、缩氨脲等,大多数是固体。可用于鉴定、鉴别。 常用的试剂:2,4-二硝基苯肼
57
3)对甲苯磺酰腙
58
4)Beckmann重排 (酮肟在酸作用下重排成酰胺)
59
5)与二级胺(仲胺)反应,可得到烯胺:
烯胺在有机合成上是重要的试剂(中间体)
60
6)、Mannich反应
61
62
8.3 ,-不饱和羰基化合物的亲核加成反应
1
R1 O + HA R2 O H A
+
பைடு நூலகம்
C R1
O
H
A
H2O R1 R2
OH C + + R2 OH2 OH OH
A-
C
+ HA
Problem: 哪一步是决速步?如何判别?
8
2、 碱催化水合反应历程--加成反应机理
Problem: 哪一步是决速步?如何判别?
9
主要考察亲核试剂的强弱
1)亲核试剂的亲核能力强,第一步为决速步,表现 为无酸催化反应; 2)亲核试剂的亲核能力弱,则形成的中间体不够稳 定,第二步为决速步,表现为普通酸催化反应; 3)亲核试剂的亲核能力一般,则亲核进攻和质子转移 速率相同,表现为普通酸催化反应,有可能发生协同
