元素周期表 经典
元素周期表和原子结构

元素周期表和原子结构元素周期表是化学中最重要的工具之一,它以有序的方式展示了所有已知的化学元素。
而原子结构则是解释元素周期表的基础,它涉及到原子的内部构造,包括电子、质子和中子的排列方式。
元素周期表发展历史元素周期表的发展始于19世纪中期。
最初,元素是按照它们的物理和化学性质进行分类的。
然而,随着更多元素的发现,这种分类方法变得混乱不堪。
1869年,俄国化学家门捷列夫提出了现代元素周期表的初步版本,他按照原子量将元素排列成一行,并注意到一些元素具有相似的化学性质。
结构特点现代元素周期表有7个横行,称为周期,和18个纵列,称为族。
周期表中的元素按照原子序数递增的顺序排列。
每个周期代表了一个主能级的电子,而每个族则代表了具有相同价电子数的元素。
周期表中的每个周期都反映了原子核外电子的能级。
第一周期有2个元素,因为它们只具有一个电子层;第二周期有8个元素,因为它们具有两个电子层,依此类推。
第7周期是目前周期表中的最后一个周期,它包含了超过100个元素。
族,也称为族群或列,代表了具有相同价电子数的元素。
价电子是原子中最外层电子,它们参与化学反应。
族可以分为主要族、过渡族和镧系元素。
主要族元素包括1A到8A族,它们分别有1到8个价电子。
过渡族元素位于d区,它们具有不完整的d轨道。
镧系元素位于f区,它们具有不完整的f轨道。
周期表中的元素还可以根据它们的电子排布分为s块、p块、d块和f块。
s块元素包括第1A和2A族,它们的最外层电子属于s轨道。
p块元素包括第13A到18A族,它们的最外层电子属于p轨道。
d块元素包括第3B到12B族,它们的最外层电子属于d轨道。
f块元素包括镧系元素和锕系元素,它们的最外层电子属于f轨道。
原子结构原子是构成物质的基本单元。
它由原子核和核外电子组成。
原子核位于原子的中心,由质子和中子组成,质子带正电,中子不带电。
核外电子则绕着原子核运动,它们带有负电。
电子是原子的最小带电粒子,它们具有负电。
门捷列夫和他的元素周期表

CULTURE文化·赏心门捷列夫和他的元素周期表■高荣伟 /文为纪念俄国化学家德米特里·门捷列夫发明的元素周期表诞生150周年,联合国大会宣布2019年是“国际化学元素周期表年”(IYPT 2019)。
是的,念初中时那张你怎么也背不下来的经典化学元素周期表今年已经150岁啦!那么,你知道吗,当年,门捷列夫是怎么发现和制作出世界上第一张元素周期表的?他是否是像有些人所言,在梦中发现了元素周期表的?抑或是,门老先生坐在实验室里,经过了一阵苦思冥想,于是向全世界宣告:“俺发现了化学元素根据原子量的大小而呈周期性变化的规律”?事实上,任何科学真理的发现,都不会是一帆风顺的。
门捷列夫生活在化学界探索元素规律艰苦卓绝的时期,他在探索化学元素变化的内在联系规律方面,同样经历了艰辛的探索。
德米特里·门捷列夫,1834年2月7日出生于俄国西伯利亚的托博尔斯克。
他出生不久,父亲就因双目失明出外就医,失去了得以维持家人生活的教员职位。
然而,祸不单行。
门捷列夫14岁那年父亲去世,接着火灾又吞没了他家中的所有财产。
1850年,家境困顿的门捷列夫藉着微薄的助学金,进入彼得堡师范学院学习化学。
1857年,门捷列夫担任彼得堡大学化学系副教授。
当时,各国化学家都在探索已知的几十种化学元素的内在联系规律。
虽然现代化学早就诞生,但那个时代没有权威的化学教科书,人们对于元素的认识支离破碎,原子量的精确测量更是难题,这些问题都限制了人们对于元素整体关系的探索。
作为化学老师,门捷列夫也以惊人的洞察力,毫无畏惧地投入到了这个领域。
门捷列夫担任化学副教授以后,负责讲授《化学基础》课。
在课堂上,老师应该讲明:自然界到底有多少元素?元素之间有什么异同和存在什么内部联系?新的元素应该怎样去发现?然而,在理论化学里,这些问题尚处在探索阶段。
攀登科学高峰的路,注定是一条艰苦而又曲折的路。
门捷列夫立志当一名好老师。
年轻的门捷列夫在探索元素周期律这条路上,吃尽了苦头。
日语元素周期表

69 Tm 铥(diū) ツリウム(thulium)
70 Yb 镱(yì) イッテルビウム(ytterbium)
71 Lu 镥(lǔ) ルテチウム(lutetium)
72 Hf 铪(hā) ハフニウム(hafnium)
52 Te 碲(dì) テルル(tellurium)
53 I 碘(diǎn) 沃素(ようそ,iodium)
54 Xe 氙(xiān) キセノン(xenon)
55 Cs 铯(sè) セシウム(cesium)
56 Ba 钡(bèi) バリウム(barium)
57 La 镧(lán) ランタン(lanthanum)
32 Ge 锗(zhě) ゲルマニウム(germanium)
33 As 砷(shēn) 砒素(ひそ,arsenium)
34 Se 硒(xī) セレン(selenium)
35 Br 溴(xiù) 臭素(しゅうそ,bromium)
36 Kr 氪(kè) ケリプトン(krypton)
58 Ce 铈(shì) セリウム(cerium)
59 Pr 镨(pǔ) プラセオジム(praseodymium)
60 Nd 钕(nǚ) ネオジム(neodymium)
61 Pm 钷(pǒ) プロメチウム(promethium)
62 Sm 钐(shàn) サマリウム(samerum)
11 Na 钠(nà) ナトリウム(sodium)
12 Mg 镁(měi) マグネシウム(magnesium)
13 Al 铝(lǚ) アルミニウム(aluminium)
14 Si 硅(guī) 珪素(けいそ,silicium)
元素周期律和元素周期表 经典习题(含详解)

元素周期律和元素周期表经典习题组1.中国科学院近代物理研究所人员成功合成了新核素295Ac,主要用于宇航飞行器的热源。
205AC可由207AC转化而成,下列有关205AC、207Ac的说法中正确的是()A.核外电子数分别为116、118B.205Ac、207Ac化学性质相同C.205AC、207AC在周期表中的位置不同D.物质的量相等的205Ac、207AC质量相同答案B解析205Ac、207Ac为同位素,核外电子数都是89个,A项错误;205Ac、207Ac的核外电子排布相同,故二者的化学性质相同,B项正确;205Ac、207Ac互为同位素,在元素周期表中的位置相同,C项错误;205Ac、207Ac的质量数不同,则相同物质的量的二者质量不同,D项错误。
2.下列有关元素的性质及其递变规律的说法正确的是()A.第I A族与第皿A族元素间可形成共价化合物或离子化合物B.第二周期元素从左到右,最高正价从+1递增到+7C.同主族元素的简单阴离子还原性越强,水解程度越大D.同周期金属元素的化合价越高,其原子失电子能力越强答案A解析A项,第I A族的氢元素可以与第皿A族元素形成共价化合物,钠等金属元素可以与第皿A族元素形成离子化合物,正确;B项,第2周期中,O元素无最高正价,F元素无正价,错误;C项,同主族元素的简单阴离子还原性与其水解能力无直接联系,错误;D项,同周期金属元素的化合价越高,其原子失电子能力越弱,如失电子能力:Na>Mg>Al,错误。
3.元素周期表和元素周期律可以指导人们进行规律性的推测和判断。
下列说法不合理的是()A.由水溶液的酸性:HCl>HF,不能推断出元素的非金属性:Cl>FB.人们可以在周期表的过渡元素中寻找催化剂和耐腐蚀、耐高温的合金材料C.短周期元素正化合价数值和其族序数相同D.短周期元素形成的微粒X2-和Y2+核外电子排布相同,离子半径:X2->Y2+答案C解析根据最高价含氧酸酸性推断元素的非金属性,故A正确;短周期元素正化合价数值和其族序数相同(O、F除外),故C错误;核外电子排布相同时,质子数越多离子半径越小,故D正确。
2023届高中化学人教版二轮专题复习第4讲-元素性质与元素周期律(表)(学案)

第4讲元素性质与元素周期律(表)学案一、知识重构1.元素周期律(表)推断必备知识熟记元素周期表的结构及核素的表示形式:①若为①A、①A族元素,差值等于上周期元素所在周期的元素种类数。
①若为①A族至①A族元素,差值等于下周期元素所在周期的元素种类数。
第2、3周期没有过渡元素,相差1第4、5周期各有10种过渡元素,相差11第6、7周期各有24种过渡元素,相差25。
2.掌握元素推断中常用的两条规律 (1)最外层电子规律(2)“阴上阳下”规律电子层结构相同的离子,若电性相同,则位于同周期,若电性不同,则阳离子位于阴离子的下一周期———“阴上阳下”规律.如 O 2-、F - 、Na + 、Mg 2+、Al 3+电子层结构相同,则 Na 、Mg 、Al 位于 O 、F 的下一周期.3.“等电子”微粒推断方法 ①“10电子”微粒①“18电子”微粒还有CH 3-CH 3、H 2N -NH 2、HO -OH 、F -F 、F -CH 3、CH 3-OH……4.牢记单质或化合物具有“特性”的元素 H 「单质密度最小、原子半径最小」Li 「①单质密度最小的金属元素;①元素的单质在常温下能与水反应放出气体的短周期元素」C 「①形成化合物种类最多的元素;①对应的某种单质是自然界中硬度最大的物质的元素;①某种氧化物可产生“温室效应”的元素①形成化合物种类最多」N 「①空气中含量最多的元素;①气态氢化物的水溶液呈碱性的元素;①元素的气态氢化物和它的最高价氧化物对应的水化物能发生化合反应的元素;①常见氢化物可作制冷剂;①某一氢化物可作气态燃料 O 「①地壳中含量最多的元素;①简单氢化物在通常情况下呈液态的元素;①某一单质可杀菌、消毒、漂白①简单气态氢化物的沸点最高」F 「①最活泼的非金属元素;①无正化合价的元素;①无含氧酸的非金属元素;①无氧酸可腐蚀玻璃的元素;①气态氢化物最稳定的元素;①阴离子的还原性最弱的元素;①元素的单质在常温下能与水反应放出气体的短周期元素」Na「①焰色反应呈黄色的元素;①短周期中金属性最强的元素;①元素的单质在常温下能与水反应放出气体的短周期金属元素;①两种常见氧化物的水化物均呈碱性的短周期元素;①短周期中原子半径最大的元素」Al「①地壳中含量最多的金属元素;①最高价氧化物及其水化物既能与强酸反应,又能与强碱反应的元素;①氧化物可作耐火材料;①氧化物是刚玉、宝石主要成分的元素」Si「①单质为常见的半导体材料;①最高价非金属氧化物对应的水化物难溶于水①无机非金属材料主角」P「①组成骨骼和牙齿的必要元素;①某一单质和其氢化物都能自燃」S「①元素的气态氢化物和它的最高价氧化物对应的水化物能发生氧化还原反应的元素;①元素的气态氢化物能和它的氧化物在常温下反应生成该元素的单质的元素」Cl「单质是黄绿色气体、氧化物用做饮用水的消毒」K「焰色反应呈紫色(透过蓝色钴玻璃观察)的元素」Ge「单质为常见的半导体材料」Br「常温下单质呈液态的非金属元素」Cs「①最活泼的金属元素;①最高价氧化物对应水化物的碱性最强的元素;①阳离子的氧化性最弱的元素」5.牢记“原子结构特点凸显”的元素(短周期元素)(1)原子核内无中子的原子:氢(H)。
高考化学 元素周期表和周期律(一)考点讲解试题

冠夺市安全阳光实验学校19 元素周期表和周期律(一)【考情报告】【考向预测】1、掌握元素周期律的实质。
元素周期律一直是高考改基本概念、基本理论内容的考查,从“位-构-性”三者的关系等多方面对学生进行考查,在近几年高考中出现频率达100%。
题型相对稳定,多为选择题。
围绕元素周期律,利用信息背景,将元素周期律知识迁移应用,同时考查学生对信息的处理和归纳总结的能力。
2、了解元素周期表(长式)的结构(周期、族)及其应用。
元素同期表是元素周期律的具体体现,是中学化学最重要的基本理论之一,也是学习化学的法。
通过编排元素周期表考查的抽象思维能力和逻辑思维能力;通过对元素原子结构、位置间的关系的推导,培养学生的分析和推理能力。
从近几高考试题看,元素周期律与元素周期表是中学化学的重要理论基础,是无机化学的核心知识是高考中每年必考的的重点内容。
此类题目考查空间很大,知识面很广。
高考中该类型题主要是通过重大科技成果(化学科学的新发展、新发明等)尤其是放射性元素、放射性同位素、农业、医疗、考古等方面的应用为题材,来考查粒子的个微粒的相互关系;元素“位”“构”“性”三者关系的题型会继续以元素及其化合物知识为载体,用物质结构理论,解释现象、定性推断、归纳总结相结合。
可集判断、实验、计算于一体,题型稳定。
试题虽然计算难度不大,但规律性强、区分度好,今后会继续保持。
【经典在线】1.知识梳理一、元素周期表(一).原子序数1、对于一个原子:原子序数=核电荷数=质子数=核外电子数=质量数-中子数。
2.1~20号元素的特殊的电子层结构(1)最外层有1个电子的元素:H、Li、Na、K;(2)最外层电子数等于次外层电子数的元素:Be、Ar;(3)最外层电子数是次外层电子数2倍的元素:C;(4)最外层电子数是次外层电子数3倍的元素:O;(5)最外层电子数是内层电子数总数一半的元素:Li、P;(6)最外层电子数是次外层电子数4倍的元素:Ne;(7)次外层电子数是最外层电子数2倍的元素:Li、Si;(8)次外层电子数是其他各层电子总数2倍的元素:Li、Mg;(9)次外层电子数与其他各层电子总数相等的元素Be、S;(10)电子层数与最外层电子数相等的元素:H、Be、Al。
化学顺口溜最经典十首诗

化学顺口溜最经典十首诗在化学的奇妙世界里,顺口溜就像是一把把神奇的钥匙,能轻松地打开知识的大门。
今天我就给大家分享化学顺口溜最经典的十首诗。
第一首,关于元素周期表的:“氢氦锂铍硼,碳氮氧氟氖。
钠镁铝硅磷,硫氯氩钾钙。
”这就像是化学世界的字母表。
我记得我刚学化学的时候,我的化学老师就像一个魔法师一样,在黑板上写着这些元素,嘴里念着这个顺口溜。
当时我同桌还打趣说:“这就像是化学的咒语啊。
”可不是嘛,只要记住了这个顺口溜,元素周期表的前二十号元素就轻松搞定了。
你想啊,如果没有这个顺口溜,要记住这些元素得多费劲啊。
这就好比让你记住一堆没有规律的电话号码,那不得把人愁死?第二首,化合价顺口溜:“一价钾钠氯氢银,二价氧钙钡镁锌。
三铝四硅五价磷,二三铁,二四碳。
二四六硫都齐全,铜汞二价最常见。
”我那时候为了背化合价,脑袋都大了。
后来发现了这个顺口溜,就像找到了救星。
有一次考试,考到化合价的题目,我旁边的同学愁眉苦脸的,我就小声地跟他说这个顺口溜。
他听了之后,眼睛都亮了,就像黑暗中看到了一盏明灯。
这顺口溜就像是化合价的导航仪,有了它,在化合价的海洋里就能顺利航行。
第三首,关于金属活动性顺序的:“钾钙钠镁铝,锌铁锡铅氢。
铜汞银铂金,活动性递减。
”这顺口溜可重要了。
就像是武林中的武功排行榜一样。
金属们按照它们的活动性排好了队。
我和我的化学小组伙伴们还做过一个有趣的实验。
我们把不同的金属放到酸溶液里,按照这个顺口溜的顺序,那些活动性强的金属就像一个个急性子,反应可剧烈了,气泡不停地冒。
而活动性弱的金属呢,就慢悠悠的,有的甚至都不反应。
这让我们更加深刻地理解了这个顺口溜的含义。
第四首,化学实验操作顺口溜:“固体需匙或纸槽,一斜二送三竖立。
块固还是镊子好,一横二放三慢竖。
液体应盛细口瓶,手贴标签再倾倒。
读数要与切面平,仰视偏低俯视高。
滴管滴加捏胶头,垂直悬空不玷污。
不平不倒不乱放,用完清洗莫忘记。
”这个顺口溜简直就是化学实验的操作指南。
化学元素周期表

化学元素周期表第三章原⼦结构和元素周期表3.1 原⼦核外电⼦的运动状态⼀、玻尔的原⼦结构理论1913年,丹麦青年物理学家玻尔(N.Bohhr)在氢原⼦光谱和普朗克(M.Planck)量⼦理论的基础上提出了如下假设:(1)原⼦中的电⼦只能沿着某些特定的、以原⼦核为中⼼、半径和能量都确定的轨道上运动,这些轨道的能量状态不随时间⽽改变,称为稳定轨道(或定态轨道)。
(2)在⼀定轨道中运动的电⼦具有⼀定的能量,处在稳定轨道中运动的电⼦,既不吸收能量,也不发射能量。
电⼦只有从⼀个轨道跃迁到另⼀轨道时,才有能量的吸收和放出。
在离核越近的轨道中,电⼦被原⼦核束缚越牢,其能量越低;在离核越远的轨道上,其能量越⾼。
轨道的这些不同的能量状态,称为能级。
轨道不同,能级也不同。
在正常状态下,电⼦尽可能处于离核较近、能量较低的轨道上运动,这时原⼦所处的状态称为基态,其余的称为激发态。
(3)电⼦从⼀个定态轨道跳到另⼀个定态轨道,在这过程中放出或吸收能量,其频率与两个定态轨道之间的能量差有关。
⼆、电⼦的波粒⼆象性光的⼲涉、衍射等现象说明光具有波动性;⽽光电效应、光的发射、吸收⼜说明光具有粒⼦性。
因此光具有波动和粒⼦两重性,称为光的波粒⼆象性。
光的波粒⼆象性启发了法国物理学家德布罗意(de Broglie),1924年,他提出了⼀个⼤胆的假设:认为微观粒⼦都具有波粒⼆象性;也就是说,微观微粒除具有粒⼦性外,还具有波的性质,这种波称为德布罗意波或物质波。
1927年,德布罗意的假设经电⼦衍射实验得到了完全证实。
美国物理学家戴维逊(C.J.Davisson)和⾰末(L.H.Ge rmer) 进⾏了电⼦衍射实验,当将⼀束⾼速电⼦流通过镍晶体(作为光栅)⽽射到荧光屏上时,结果得到了和光衍射现象相似的⼀系列明暗交替的衍射环纹,这种现象称为电⼦衍射。
衍射是⼀切波动的共同特征,由此充分证明了⾼速运动的电⼦流,也具有波粒⼆象性。
除光⼦、电⼦外,其他微观粒⼦如:质⼦、中⼦等也具有波粒⼆象性。
元素周期表主族和副族分别是什么

元素周期表主族和副族分别是什么元素周期表是化学家们根据元素的性质和结构进行分类和排列的一张桌面工具。
在这张周期表上,元素按照从左上到右下的顺序排列,按照原子序数的增加而逐渐增加。
元素周期表中的元素被分为主族和副族两大类别。
那么,主族和副族分别代表着什么呢?下面将为您详细解释。
主族元素是指元素周期表中IA至VIII A族的元素,也称作A族元素或者常规元素。
它们是在元素周期表中位于两侧的18个元素群,分别是IA、IIA、IIIA、IVA、VA、VIA、VIIA和VIIIA。
主族元素的共同特点是它们最外层的电子层中含有相同数量的电子,这个数字决定了它们的化学性质。
例如,位于IA族的锂、钠和钾等元素都只有一个电子存在于最外层的s轨道上,因此它们具有相似的性质,例如在水中剧烈反应产生氢气。
主族元素在自然界中非常常见,并且具有重要的生物和工业价值。
其中,IA、IIA和IIIA族的元素被称为典型元素,因为它们的性质非常经典和典型。
这些元素通常具有较低的电负性,形成阳离子或共价化合物时倾向于失去电子。
主族元素在周期表上的位置也反映了它们的原子结构和电子配置的规律性。
与主族元素相对应的是副族元素,也被称为B族元素或过渡元素。
副族元素位于元素周期表的区域是从IIIB到VIIIB族,以及下面两行的元素。
副族元素的特点是它们的最外层电子数不同,在各个周期中都有较大的变化。
这就使得副族元素的化学性质非常丰富多样,它们可以形成各种不同化合价的化合物。
例如,位于VB族的钒元素可以形成V2O5(五氧化二钒)和VO2(二氧化钒)两种不同化合价的氧化物。
副族元素在化学反应中经常具有多种氧化态,这使得它们在催化剂、电池、合金和材料科学等领域中发挥着重要作用。
副族元素的其它特点是它们通常具有较高的原子质量和较高的熔点。
其中,第一列和最后一列的副族元素被称为过渡金属,它们具有良好的导电性和良好的催化性能。
总结起来,元素周期表中的主族元素和副族元素分别代表了元素的外层电子结构和化学性质的不同。
元素周期表

第一章 第二节 第2课时
成才之路 ·高中新课程 ·学习指导 ·人教版 ·化学 ·必修2
门捷列夫的元素周期表形成了一个基本的构架,现在的许 多工作是完善它。在元素周期表中,从 112 号到 116 号元素的 名字都没有得到承认,第 113、115、117 号三个元素是空白。 曾经有学者声称发现了 118 号元素,但还没有得到国际组织的 认同。随着科学技术的进步和新的研究方法的应用,人们很有 可能发现新的元素。 那么你知道在这些已经发现的元素中都隐藏了那些规律 吗?学完本课时内容,你将明了于心。
成才之路 ·高中新课程 ·学习指导 ·人教版 ·化学 ·必修2
新情境· 激趣入题
第一章 第二节 第2课时
成才之路 ·高中新课程 ·学习指导 ·人教版 ·化学 ·必修2
在科学大道上, 有一块宝石, 它就是元素周期律。 拉瓦锡、 德贝莱纳、纽兰兹、迈耶尔等人从它身边走过,都把它拿起来 看看,然后又把它扔掉。而门捷列夫却吸收前人的经验,苦苦 思索仔细研究它,使之散发出本身的光彩,最后他拿着这块宝 石,登上了化学的高峰,统一了整个无机化学。 自从门捷列夫制订了元素周期表, 人们发现新元素的步伐 在逐渐加快。那么世界上究竟有多少元素,元素周期表有没有 尽头呢?
第一章 第二节 第2课时
成才之路 ·高中新课程 ·学习指导 ·人教版 ·化学 ·必修2
2.原子半径的变化规律 3~ 9 号 元素 原子半 径/nm 变化 趋势 0.152 0.89 0.82 0.77 0.75 0.74 0.71 Li Be B C N O F
0.152―→0.71
逐渐减小
第一章 第二节 第2课时
(2)元素原子半径的周期性变化。
2 规律:随着原子序数的递增,元素的原子半径呈现 □ ________的周期性变化。
元素周期表(经典收藏版)
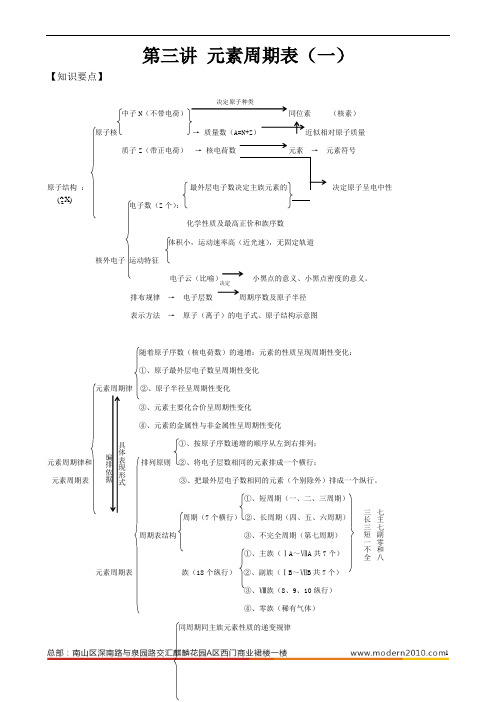
第三讲 元素周期表(一)【知识要点】中子N(核素)原子核质子Z (带正电荷) → 核电荷数 元素 → 元素符号原子结构 : 决定原子呈电中性 电子数(Z 个):化学性质及最高正价和族序数体积小,运动速率高(近光速),无固定轨道核外电子 运动特征电子云(比喻) 小黑点的意义、小黑点密度的意义。
排布规律 → 电子层数 周期序数及原子半径 表示方法 → 原子(离子)的电子式、原子结构示意图随着原子序数(核电荷数)的递增:元素的性质呈现周期性变化: ①、原子最外层电子数呈周期性变化元素周期律 ②、原子半径呈周期性变化③、元素主要化合价呈周期性变化 ④、元素的金属性与非金属性呈周期性变化①、按原子序数递增的顺序从左到右排列; 元素周期律和 排列原则 ②、将电子层数相同的元素排成一个横行; 元素周期表 ③、把最外层电子数相同的元素(个别除外)排成一个纵行。
①、短周期(一、二、三周期)周期(7个横行) ②、长周期(四、五、六周期)周期表结构 ③、不完全周期(第七周期)①、主族(ⅠA ~ⅦA 共7个)元素周期表 族(18个纵行) ②、副族(ⅠB ~ⅦB 共7个)8、9、10纵行) ④、零族(稀有气体)同周期同主族元素性质的递变规律决定编排依据具体表现形式X)(A Z 七主七副零和八三长三短一不全①、核电荷数,电子层结构,最外层电子数②、原子半径性质递变③、主要化合价④、金属性与非金属性⑤、气态氢化物的稳定性⑥、最高价氧化物的水化物酸碱性电子层数:相同条件下,电子层越多,半径越大。
判断的依据核电荷数相同条件下,核电荷数越多,半径越小。
最外层电子数相同条件下,最外层电子数越多,半径越大。
微粒半径的比较 1、同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外)如:Na>Mg>Al>Si>P>S>Cl.2、同主族元素的原子半径随核电荷数的增大而增大。
如:Li<Na<K<Rb<Cs具体规律: 3、同主族元素的离子半径随核电荷数的增大而增大。
元素周期表顺口溜

元素周期表顺口溜导语:元素周期表顺口溜1、我是铊,能脱发,投毒出名看清华;2、锰正二四与六七;碳二四要牢记。
非金属负主正不齐;氯负一正一五七。
3、我是溴,挥发臭,液态非金我来秀;4、我是碳,反应慢,既能成链又成环;5、我是氖,也不赖,通电红光放出来;6、我是锗,可晶格,红外窗口能当壳;7、我是氯,色黄绿,金属电子我抢去;8、我是氟,最恶毒,抢个电子就满足;9、我是铍,耍赖皮,虽是金属难电离;10、氯氮变价要注意一二铜汞一三金二四碳铅二三铁二四六硫三五磷11、我是硼,有点红,论起电子我很穷;12、我是硫,来历久,沉淀金属最拿手;13、我是氢,我最轻,火箭靠我运卫星;14、我是碘,升华烟,遇到淀粉蓝点点;15、化合价要记准,一价钾钠氯氢银,二价氧钙钡镁锌,三硅四铝五价磷;16、我是磷,害人精,剧毒列表有我名;17、我是氡,放射凶,居室污染很严重18、我是砷,颜色深,三价元素夺你魂;19、我是铅,能储电,子弹头里也出现;20、我是镁,最爱美,摄影烟花放光辉;21、我是铁,用途广,不锈钢喊我叫爷;22、氯负一价最常见;硫有负二正四六,正二正三铁可变;23、我是氮,我阻燃,加氢可以合成氨;24、我是铟,软如金,轻微放射宜小心;25、我是金,很稳定,扔进王水影无形;26、一价氟氯溴碘氢还有金属钾钠银二价氧钡钙镁锌铝三硅四都固定27、我是钠,脾气大,遇酸遇水就火大;28、我是钡,不太贵,钡餐焰火我都会;29、氮磷负三与正五;不同磷三氮二四。
硫有负二正四六;边记边用就会熟。
30、我是硅,色黑灰,信息元件把我堆;31、我是氦,我无赖,得失电子我最菜;32、我是锰,价态多,七氧化物爆炸猛;33、我是钾,把火加,超氧化物来当家;34、我是钨,高温度,其他金属早呜呼;35、我是铜,色紫红,投入硝酸气棕红;36、正三是铝正四硅;下面再把变价归。
全部金属是正价;一二铜来二三铁。
37、我是硒,补人体,口服液里有玄机;38、我是氩,活性差,霓虹紫光我来发;39、我是钙,身体爱,骨头牙齿我都在;40、我是镓,易融化,沸点很高难蒸发;41、正一二铜二四碳,单质零价永不变;42、钾钠银氢正一价,钙镁钡锌正二价;铝是正三氧负二,43、我是钛,过渡来,航天飞机我来盖;44、我是汞,有剧毒,液态金属我为独;45、氟氯溴碘负一价;正一氢银与钾钠。
周期律周期表(竞赛辅导用)

5 37 Rb 38 Sr 39 Y 40 Zr 41 Nb 42 Mo 43 Tc 44 Ru 45 Rh 46 Pd 47 Ag 48 Cd 49 In 50 Sn 51 Sb 52 Te 53 I 54 Xe
铷锶 钇 锆铌 钼 锝 钌 铑钯银 镉 铟 锡 锑 碲 碘 氙
变化规律: 主族元素:从左到右 r 减小;
从上到下 r 增大。 过渡元素:从左到右r 缓慢减小;
从上到下r略有增大。
2、 电离能
基态气体原子失去电子成为带一 个正电荷的气态正离子所需要的能量 称为第一电离能,用 I 1表示。
由+1价气态正离子失去电子成为 带+2价气态正离子所需要的能量称为 第二电离能,用 I 2表示。
1
1
主族:族数=ns+np电子数。 例:16号S:最外层结构为3s23p4 ⅥA
17号Cl:最外层结构为3s23p5 ⅦA 副族:ⅢB---ⅦB 族数=(n-1)d+ns电子数。 例:25号Mn: 1s22s22p63s23p63d5 4s2 ⅦB ⅠB、ⅡB族:族数=(n-1)d10后ns的电子数 例:29号Cu: 1s22s22p63s23p63d10 4s1 ⅠB
超铀元素:在锕系元素中92号元素铀U以后各种元素, 多数是人工制得的元素,称之为“超铀元素”
区: 长式周期表的主表从左到右可分
为s区,d区,ds区,p区4个区,有 的教科书把ds区归入d区;副表(镧 系和锕系)是f区元素。
s
p
d
ds
f
周期表中区的划分: 最后一个电子填充在什么类型的轨
道上,就是该元素所在的区。 ⅠA、ⅡA:s区; ⅢA---ⅦA:p区; ⅢB---Ⅶ B 、Ⅷ:d区; ⅠB、ⅡB:ds区; 镧系、锕系(超长周期):f区。
高考化学大一轮复习 第5章 物质结构 元素周期律 51 元素周期表和元素周期律课件

12/12/2021
30
板块一
板块二
板块三第三十页,共五十页。
高考一轮总复习 ·化学 (经典版)
2.用 A+、B-、C2-、D、E、F、G 和 H 分别表示含有 18 个电子的八种微粒(离子或分子),请回答下列问题:
(1)A 元素是___K___、B 元素是__C__l__、C 元素是__S__。 (用元素符号表示)
题组一 等电子粒子的判断与应用 1.A+、B+、C-、D、E 五种粒子(分子或离子)中,每 个粒子均有 10 个电子,已知: ①A++C-===D+E↑;②B++C-===2D。
12/12/2021
28
板块一
板块二
板块第三二十八页,共五十页。
高考一轮总复习 ·化学 (经典版)
请回答: (1)C-的电子式是_____··O_····_··H__]_-______。 (2)分别写出 A+和 D 反应、B+和 E 反应的离子方程式: ________N__H_+ 4__+__H_2_O____N__H_3_·_H_2_O_+__H__+_____、 _________H_3_O__+_+__N_H__3=_=_=__N_H__+ 4 _+__H_2_O_________。
高考一轮总复习 ·化学 (经典版)
第5章 物质结构(jiégòu) 元素周期律
第1节 原子结构
12/12/2021
1
板块一
板块二
板块三第一页,共五十页。
高考一轮总复习 ·化学 (经典版)
考试说明
1.了解原子结构示意图、分子式、结构式和结构简式 的表示方法。
2.了解相对原子质量、相对分子质量的定义,并能进 行有关计算。
12/12/2021
原子结构和元素周期表

1.3 氢原子的结构
4dxy 等值线图
1.3 氢原子的结构
5. 原子轨道的轮廓图
将等值线图围绕对称轴 转动,即可得到原子轨 道的轮廓图。 把波函数的等值面和正负 粗略地在直角坐标系中表 达出来,称原子轨道等值 轮廓图或简称原子轨道图
1s
1.3 氢原子的结构
5. 原子轨道的轮廓图
2px
2pz
1.3 氢原子的结构
a)Pauli原理:一个原子轨迹只能容纳自旋相反的两个电子(波函 数反对称要求); b)能量最低原理:在不违背Pauli原理的前提下,电子优先占据低 能量轨道;(体系总能量最低) c)Hund规则:能量相同的轨道,电子尽可能自旋平行地分占; (总自旋S最大) d)Hund规则的补充规则:对能量相同的轨道,全充满,半充满时 比较稳定。(电子云呈球形)
称为原子质量单位,记为1u。
原子量为X,实际质量为多少?
1.1 原子和元素
元素的原子量:设元素A有n种同位素,第i(i=1,2,…,n)个同位素的原子 量和丰度分别为 wi 和 f i ,则元素A原子量为
wA wi f i
n i 1
丰度:第i种同位素在该元素中所占的原子数百分比 例:氧元素的原子量:15.9994 同位素 丰度 质子量
1.3.2量子数的物理意义 2.轨道角动量量子数l: 亚能级 角动量 M l (l 1)
l 0,1,2,3,...,n 1
s, p, d , f , g , h,...,
1.3 氢原子的结构
1.3.2量子数的物理意义 3.磁量子数m:伸展方向 角动量在z方向的分量
M z m m 0,1,2,...,l
轨道全充满或半充满体系能量 最低,最外层(n-1)dx-1ns1或(n1)dxns0 Cr原子Z=24,Cr:[Ar](3d)5(4s)1 Cu原子Z=29, Cu:[Ar](3d)10(4s)1
元素周期表

Lu Hf Ta Tl Ac Th Pa U
6p Po At Rn Ra No 7s 5f 6d
Np Pu Am Cm Bk Cf Es Fm Md
Lr Rf Db Sg Bh Hs Mt Uun Uuu Uub
113 114 115 116 117 118
7p 8s
119
120
元素周期表
1 氢
3
1 氢H 2 氦He 1s2 3 锂Li [He] 2s1 4 铍Be [He] 2s2 5 硼B [He] 2s22p1 6 碳C [He] 2s22p2 7 氮N [He] 2s22p3 8 氧O [He] 2s22p4 9 氟F [He] 2s22p5 10氖Ne 1s2 2s22p6 11钠Na [Ne] 3s1 12镁Mg [Ne] 3s2 13铝Al [Ne] 3s23p1 14硅Si [Ne] 3s23p2 1s1
87 Fr 88 Ra 89 -103 104Rf 105Db 106Sg 107Bh 108 Hs 109Mt 110 111 112
Rb
38 Sr 39
Tc 44 Ru
45 Rh 46 Pd 47 Ag 48 Cd 49
Ac-Lr
杜 钅 喜 钅 钅 卢 钅 麦 Uun Uuu Uub 波 钅 黑 钅 镨
0
1 2 3 4 5 6 7
1 3 11 1 9 3 7 5 5 8 7
II A
III A
IV A
V A
VI A
VII A
2
1 0 1 8 3 6 5 4 8 6
K
2
4 1 2 2 0 3 8 5 6 8 8
III B IV B V B VI B VIII
元素周期律经典练习题

《元素周期律》习题精选1一、选择题1.元素性质呈周期性变化的原因是A .相对原子质量逐渐增大B .核电荷数逐渐增大C .核外电子排布呈周期性变化D .元素的化合价呈周期性变化2.某电子层当它作为最外层时,最多只能容纳8个电子,当它作为次外层时,最多只能容纳18个电子,该电子层可能是A.M 层B.K 层C.L 层D.P 层3.下列各组元素中,按最高正价递增顺序排列的是A .F 、Cl 、Br 、IB .K 、Mg 、C 、S C .C 、N 、O 、FD .Li 、Na 、K 、Rb4.按Be 、Mg 、Ca 、Sr 、Ba 的顺序而递增的性质是A .氧化性B .还原性C .熔点D .化合价5.1~18号元素的离子中,原子核电荷数和离子最外层电子数相同的是A .Cl —B .Na +C .O 2—D .S2— 6.1~18号元素中,原子的核外电子数与电子层数相同的是A .氢B .铍C .铝D .氯7.下列元素中,原子半径最大的是( )A.锂B.钠C.氟D.氯8.下列各组微粒半径之比大于1的是A .Na Na r /r +B .NaMg /r r C .Cl P /r r D .p N /r r 9、某元素R 的阳离子是R n+,核外共有x 个电子,其质量数为A 则R 核内中子数为( )A 、A-x+nB 、A-x-nC 、A+x+nD 、A-n+x10、某元素的原子,核外有3个电子层;最外电子层与最内电子层的电子数相等,则该元素的核电荷数是( )A 、12B 、16C 、18D 、2011.元素X 的原子核外M 电子层上有3个电子,元素-2Y 的离子核外有18个电子则这两种元素可形成的化合物为A .XY 2B .X 2Y 3C .X 3Y 2D .X 2Y12.A 、B 均为原子序数1~20的元素,已知A 的原子序数为n ,+2A 离子比-2B 离子少8个电子,则B 的原子序数为A .n +4B .n +6C .n +8D .n +1013 X 和Y 两元素的阳离子具有相同的电子层结构,X 元素的阳离子半径大于Y 元素的阳离子半径;Z 和Y 两元素的原子核外电子层次相同,Z 元素的原子半径小于Y 元素的原子半径。
元素周期表顺序

元素周期表是我们能够触摸到的任何东西的总目录。
有一些东西不在元素周期表里,例如光、爱情、逻辑和时间,但是这些东西我们是无法触摸的。
地球、你的脚等任何可以触摸的东西都由元素构成。
你的脚的大部分是由氧构成的,同时还有许多碳和它结合在一起,从而为有机分子赋予了结构,这些有机分子确定了你是以碳为主要成分的生命的一个例子。
化学元素周期表氧是无色透明的气体,但它占据你的体重的2/3。
它怎么做到这一点?化学元素有两张脸:它的纯态以及当和其他元素结合的时候形成的化合物。
纯态的氧的确是气体,但是当它和硅反应以后,它们结合在一起形成了坚硬的硅酸盐矿,构成了地壳的大部分。
当氧与氢和碳结合的时候,结果可以是从水到一氧化碳到糖的任何东西。
无论这些物质看起来多么不像纯态的氧,但在这些化合物中氧原子仍然存在,而且这些氧随时可以被提取出来,回到纯的气态。
但是只要原子核没有瓦解,每个氧原子本身就永远不可能破裂或者拆开变成更简单的东西。
这个不可分割的性质就是使得元素之所以成为元素的原因。
在这里,试图展示每一种元素的这两张脸。
首先,你将会看到纯元素的一幅很大的照片(但是这需要在物理上办得到)。
另外你将会看到这个世界上元素的各种样子的许多例子——各种化合物以及成为这种元素的特征的各种用途。
在我们开始接触各种元素之前,很有必要先从整体上看一下元素周期表,看看这些元素是怎样被组织在一起的。
经典形式的元素周期表已广为人知,就像耐克鞋的微标、泰姬陵或者爱因斯坦的头发那样一眼就可以认出来。
元素周期表是我们文明的图标影像之一。
元素周期表的基本结构不是由艺术、幻想或巧遇来决定的,而是由量子力学的基本的和普遍的法则决定的。
呼吸甲烷的有脚生物可能会用正方形的徽标为它们的鞋子作广告,但它们的元素周期表会有像我们的元素周期表一样能够辨认的逻辑结构。
每一种元素都是用它的原子序数(从1到118的整数)来定义的。
(118是目前的数字,无疑随着时间的推移还会发现更多。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
碳族
氮族 稀有气体
思考:1
、
Cl的位置的描述: 第三周期第VIIA族
第III周期 第3周期 第三周期
第七主族 VII族 VIIA族
2、哪周期元素种类最多?族呢?
【课堂练习】
1、主族元素在周期表中所处的位置,取决 于该元素的 (A)最外层电子数和相对原子质量 (B)相对原子质量和核外电子数 (C)次外层电子数和电子层数 (D)电子层数和最外层电子数
9 1 7 3 5 5 3 8 5
L K
M L k
8 2
18 8 2
3 11 4 5 6 7
1 9 3 7
1 2
2 0 3 8
B
IB 2 8 4 6 7 8
110
II B
1 3 3 1 4 9 8 1
2 1 3 9
57 71
89103
2 2 4 0 7 2
104
2 3 4 1 7 3
105
24 25 26 42 43 44
之和为31,则A、B、C分别为什么元素?
7N 14P 8O 16S
观察,可得 A是氮元素 B是氧元素
C是硫元素
扇形元素周期表
立 式 周 期 表
螺旋式
环式
放射式
层式
透视式
棱 台 型 元 素 周 期 表
展示电子排布的周期表
门捷列夫简介
门捷列夫(1834-1907)俄国化学家。 1834年 2月7日生于西伯利亚托博尔斯克,1907年2月2 日卒于彼得堡(今列宁格勒)。1850年入 彼得 堡师范学院学习化学,1855年毕业后任敖德萨中 学教师。1857年任彼得堡大学副教授。1859年 他到德国海德堡大学深造。1860年参加了在卡尔 斯鲁厄召开的国际化学家代表大会。1861年回彼 得堡从事科学著述工作。1863年任工艺学院教授, 1865年获化学博士学位。1866年任彼得堡大学 普通化学教授,1867年任化学教研室主任。 1893年起,任度量衡局局长。1890年当选为英 国皇家学会外国会员。
门捷列夫的最大贡献是发现了化学元素周期律。他在前人 的基础上,总结出一条规律:元素(以及由它所形成的单 质和化合物)的性质随着原子量(相对原子质量)的递增 而呈周期性的变化,这就是元素周期律。他根据元素周期 律于1869年编制了第一个元素周期表,把已经发现的63 种元素全部列入表里,从而初步完成了使元素系统化的任 务。元素周期律的发现激起了人们发现新元素和研究无机 化学理论的热潮,元素周期律的发现在化学发展史上是一 个重要的里程碑,人们为了纪念他的功绩,就把元素周期 律和周期表称为门捷列夫元素周期律和门捷列夫元素周期 表。1955年科学家们为了纪念元素周期律的发现者门捷 列夫,将101号元素命名为钔。
第六周期第ⅣA 族。
练习与思考:
推算原子序数为6、13、34、53、88的元 素在周期表中的位置。
原子 序数 周期 族
6 13 34 53 88
2
IVA
3
IIIA
4
VIA
5
VIIA
7
IIA
练习与思考:
A、B、C是周期表中相邻的三种元素,
其中A、B是同周期,B、C是同主族。此三
种元素原子最外层电子数之和为17,质子数
A Z
18 27
40 35 3
18 8
O
Al Ar
14
27 13
Ar
Cl H
18
17 1
22
18 2
40 18
35Cl 17 3 1
H
复习 元素的定义:
元素是具有相同核电荷数(质子数)
一类原子的总称。
想一想:原子的质子数相同,中子数 是不是相同呢?
氢元素的三种原子 原子符号 质子数 中子数 氢原子名 称和简称 1 0 氕(H) H 1 1 氘(D) H 1 2 氚(T) H
观察比较1-20号元素的原子结构示意图,你 能发现这些元素之间存在哪些规律吗?
1869年,俄国化学家
门捷列夫将元素按照相对
原子质量由小到大依次排
列,通过分类归纳,制出
了第一张元素周期表,揭 示了化学元素间的内在联 系,使其构成了一个完整 的体系,成为化学发展史
上重要的里程碑之一。
门捷列夫的最大贡献是发现了化学元素周期律。 他在前人的基础上,总结出一条规律:元素(以及 由它所形成的单质和化合物)的性质随着原子量 (相对原子质量)的递增而呈周期性的变化,这就 是元素周期律。 他根据元素周期律于1869年编制了第一个元素 周期表,把已经发现的63种元素全部列入表里,从 而初步完成了使元素系统化的任务。元素周期律的 发现激起了人们发现新元素和研究无机化学理论的 热潮,元素周期律的发现在化学发展史上是一个重 要的里程碑,人们为了纪念他的功绩,就把元素周 期律和周期表称为门捷列夫元素周期律和门捷列夫 元素周期表。1955年科学家们为了纪念元素周期律 的发现者门捷列夫,将101号元素命名为钔。
2 3 4
3 1 1 1 9 3 7 5 5 8 7
5 1 3 2 2 4 0 7 2
10 4
6 1 4 3 2 5 0 8 2
7 1 5 3 3 5 1 8 3
8 1 6 3 4 5 2 8 4
9 1 7 3 5 5 3 8 5
1 0 1 8 3 6 5 4 8 6
L K
M L k
8 2
18 8 2
+
20 2 8 8 2
钾(K) 钙(Ca)
一、元素周期表 1、原子结构
质子(带一个单位的正电荷) 原子核
原子
中子 核外电子(带一个单位的负电荷)
原子序数:按照元素在周期表中的顺序给元素编的号 原子序数=核电荷数=质子数=核外电子数
2、元素周期表 (1)元素周期表编排原则
A、把电子层数相同的元素按原子序 数递增的顺序由左到右排成一个横排。 B、把不同横行中最外层电子数相同 的元素按电子层数递增的顺序由上到 下排成纵行。
第一章
物质结构
第一节
元素周期表
元素周期表
化 学 Ⅱ
(第一课时)
思考:回忆初中所学内容,什么是原子结构示意图? 请画出1-20号元素的原子结构示意图。
+
19 2 8 8 1
+
20 2 8 8 2
钾(K) 钙(Ca)
规律:
(原子的)核电荷数 = 质子数 = 核外电子数 (阳离子的)核电荷数 = 质子数 > 核外电子数 (阴离子的)核电荷数 = 质子数 < 核外电子数
短周期
第二周期:8 种元素 第三周期:8 种元素 第四周期:18 种元素
周期
(横行)
长周期
第五周期:18 种元素 第六周期:32 种元素 (镧系元素) 第七周期:26种元素 (锕系元素)
三长三短一不全
周期的结构
1
1
2
4 1 2 2 0 3 8 5 6 8 8 2 1 3 9
5 77 1
K
2
短周期
2 3 4 1 7 3
10 5
2 4 4 2 7 4
10 6
2 5 4 3
2 6 4 4
2 7 4 5 7 7
10 9
2 8 4 6 7 8
11 0
2 9 4 7 7 9
11 1
3 0 4 8 8 0
11 2
3 1 4 9 8 1
长周期
5
6
7
7 5
10 7
7 6
10 8
89 10 3
不完全 周期
2、族: 不同横行中最外层电子数相同的元素 按电子层数递增的顺序由上到下排成 纵行(除第8、9、10三个纵行叫做第 Ⅷ族外,其余每个纵行为一族)。 主族序数=最外层电子数
2 7 4 5 7 7
109
2 9 4 7 7 9
111
3 0 4 8 8 0
112
5 5
8 7
5 6
8 8
74 75 76
10 8
106
107
族的别称
第ⅠA族称为 第ⅥA族称为 第ⅡA族称为 第ⅦA族称为 第ⅣA族称为 第ⅤA族称为 零族称为 元素 , 元素 元素, 元素 元素, 元素, 元素
碱金属 氧族 碱土金属 卤族
核素
同位素
4、元素、核素、同位素三者之间的关系:
元素 核素 核素 同位素
1.同一种元素,可以有若干种不同的核素; 2.同位素是同一元素的不同核素之间的互称;
课堂练习
6 14 4、在(1) Li 、( 2 ) N 3 14 7 7 Mg、( 6 6) 3 5) Li、(
C中: (5) 互为同位素。 (1)(1) 和 (6) 质量数相等,但不能互称同 (2)(2) 和 位素。 (3) 和 (4) 的中子数相等,但质子数不 (3) 相等,所以不是同一种元素。
D. 电子层数的次外层电子数
3.下列各表为周期表的一部分(表中为 原子序数),其中正确的是( D)
(A) 2 3 11 19 4 (B) 2 10 11 (D) 18 19 6 14 31 32 7
(C)
6 11 12 13 24
练习
推算原子序数为6,13,34,53,88,82的
元素在周期表中的位置。
第6号元素: 6-2=4 第二周期第ⅣA 族。
第13号元素: 13-10=3
第34号元素: 34-18=16
第三周期第ⅢA 族。
第四周期第ⅥA 族。
第53号元素: 53-36=17
第88号元素: 88-86 =2
第五周期第ⅦA 族。
第七周期第ⅡA 族。
第82号元素: 82-54 =28 28-14=14
1 1 2 1 3 1
1、核素: 具有一定数目的质子和一定数目 的中子的一种原子。
