红外光谱IR
红外光谱(IR)分析

4. 空间效应: (1)环状化合物的环张力效应:环张力越大,羰 基C=O频率越高。 环张力 四元环 五元环 六元环 (2)空间位阻效应:空间位阻使羰基与双键之间 的共轭受限制,故使C=O频率增高。 5. 氢键效应:氢键的形成,通常可使伸缩振动 频 率向低波数方向移动。
6. 振动偶合效应:当两个基团靠得很近时,产 生振动相互作用,使吸收峰发生分裂。
第三章 红 外 吸 收 光 谱 法
Infrared Absorption Spectrometry
§1 关于红外光谱
红外光谱在可见光区域微波区之间,其波长范 围约为0.75~1000m。
分为三个区: ◆近红外区 0.75~2.5m; ◆中红外区 2.5~25 m; ◆远红外区 25~1000 m
若分子由N个原子组成,则 需3N个坐标(自由度)确定N个原子位置; 分子自由度总数=平动、振动、转动自由度 总和 故 3N=平动自由度+转动自由度+振动自由度 即 振动自由度=3N-(平度自由度+转动自由度) 问题:怎样确定一个分子的平动自由度和 转动自由度?
(1) 平动自由度:分子的质心可沿x、y、z三 个坐标轴方向移动,故平动自由度=3。
2. 共轭效应(C效应):该效应使共轭体系具有 共平面性,电子云密度平均化,造成双键略有 伸长,单键略有缩短。故双键的吸收峰频率向 低波数方向移动。
例. C=O C=O 1715 cm-1 1685~1665 cm-1
3. 中介效应(M效应): 例. C=O 在1680cm-1附近。 若用诱导效应看,则电负性大的N原子应使 C=O键力常数增加,吸收峰位应大于1715cm-1; 但实际情况相反,这是因中介效应造成的。 即N原子上的孤对电子与C=O的电子发生重 叠(p- 共轭),使电子云密度平均化,造成C=O 键力常数降低,故使吸收峰频率移向低波数。
红外光谱(IR)

k 大,化学键的振动波数高 。
δ
1 2c
K
如:K值:单键4-6×102N/m < 双键8-10×102N/m < 叁键12-18×102 N/m
kCC(2222cm-1) > kC=C(1667cm-1) > kC-C(1429cm-1)(质量相近)
如:
质量m大, μ 增大,化学键的振动波数低 。
远红外
(ΔE=0.05~0.005ev; =25-250μm)
红外光谱区
区域 近红外 中红外 远红外 λ(μm) 0.75~2.5 2.5~50 50~1000 σ(cm-1 ) 13000 ~4000 4000~200 200~10 ν (Hz) 4.0×1014 ~ 1.2×1014 1.2×1014 ~ 6.0×1012 6.0×1012 ~ 3.0×1011 能级跃迁类型
R—C
3
⑥ 费米共振
一基团的倍频或合频与另一基团的基频相近,且具有相同的对称性时,他们可能 产生共振,使谱带分裂,并使强度很弱的倍频或合频谱带变得异常强,这一现象称为 费米共振。 2780cm-1 O 2700cm-1 如: C-H伸缩:2800cm-1
—C—H
C-H的面内弯曲(1400cm-1)的第一倍频:2700~2800cm-1
E c h c
波长:m,cm;h-普朗克常数 波数:σ =1/ ——横坐标 红外吸收谱带的强度——纵坐标 E分子=E电子+E振动+E转动 紫 外 红外
(ΔE=0.05~1ev; =1.252 -125μm)
(ΔE=1~20ev; =0.06-1.25μm)
1942cm-1
‖
O
电负性增强,频率增大
IR

● 外部因素
1.溶剂影响 ——极性基团,如,C=O
伸缩振动波数随溶剂极性增大而减小。
如,羧酸中的νC=0 气体 1780cm-1(游离) 非极性溶剂 1760cm-1(游离) 乙醚 1735cm-1 乙醇 1720cm-1 碱溶液中 νas C=0 1610~1500cm-1 νsC=0 1400cm-1
● 红外光谱谱带强度(峰强)
● 影响红外光谱的内外因素
一、分子振动特性描述(峰位)
● 谐振子模型 —— 描述分子振动特性
力学的Hoocke定律
◆ 谐振子恢复力(f): 谐振子恢复力与质点离开平衡位置的位 移或正比,但方向则与位移的方向相反。
f = - K(dA + dB)2 / 2
式中,K为键力常数(force constant)
药物波谱解析 第二章 红外光谱(IR)
红外光谱(IR)
IR:属于分子的振转光谱 IR光谱特征:指纹性 IR谱图: 横坐标 —— 波数为( )
纵坐标 —— 透光率(T%)
IR光谱分三种
① 近红外光谱:0.8~2.5um 即1250~4000cm-1
——分子中O-H、N-H、C-H振动倍频和组频;
◆ 分子振转能级示意图:
◆ IR 能级跃迁类型: V0→V1:产生的IR谱带 —— 基频峰 V0→ niVi —— 倍频峰 V0→miVi+niVi —— 合频峰 V0→V1- V2 , 2V1- V2 等 —— 差频峰
※ 泛频峰(组频峰):倍频峰、合频
峰与差频峰的总称。
四、影响IR光谱的的其他因素
弯曲振动引起的吸收
如,C—X(X=C,N,O)
—— 指纹区域
ir(红外光谱)的原理

ir(红外光谱)的原理
红外光谱法(IR)的原理是:分子能选择性吸收某些波长的红外线,而引起分子中振动能级和转动能级的跃迁,检测红外线被吸收的情况可得到物质的红外吸收光谱,又称分子振动光谱或振转光谱。
在红外线照射下,当辐射能量与分子振动、转动频率相一致时,被测物质分子会产生其特定的红外光谱,据此可鉴定出化合物中各种原子团。
IR具有测定快速、特征性强、试样用量少、操作简便等优点。
但是,红外光谱一般只提供物质分子中官能团的相关信息,而对于一些复杂化合物,特别是新化合物,单靠IR 检测技术并不能解决问题,需要与其他分析手段互相配合,才能确定分子结构。
如需了解更多关于IR的原理,建议查阅相关文献或咨询专业化学家。
红外吸收光谱法——IR光谱的基本原理

IR光谱法的基本原理:一、红外光谱产生的条件
满足两个条件:
1、辐射应具有能满足物质产生振动跃迁所需的能量;
2、辐射与物质间有相互偶合作用,即物质振动时偶极矩发生改变
= q ·d
IR光谱法的基本原理
(1)红外活性
分子振动引起偶极矩的变化,从而产生红外吸收的性质,称为红
外活性。其分子称为红外活性分子。相关的振动称为红外活性振动。
2)应用范围广,除单原子分子及单核分子外,几乎所有的有机物均有红外吸收;
3)分子结构更为精细的表征:通过波谱的波数位置、 波峰数目及强度确定
分子基团和分子结构;
4)气体、液体、固体样品都可测定;
5)具有用量少;分析速度快;不破坏样品
因此,红外光谱法不仅与其它许多分析方法一样,能进行定性和定量分
析,而且是鉴定化合物和测定分子结构的用效方法之一
3、峰位、峰数与峰强
(1)峰位:
化学键的力常数K越大,原子折合质量越小,键的振动频率越大,
吸收峰将出现在高波数区(短波长区);反之,出现在低波数区(高
波长区)。
例1
水分子
(2)峰数 :理论值为 3n-6(3n-5)
实际峰数不等于此值
苯的简正振动的数目:3×12-6=30,应有30个吸收谱带。
但实际上出现的基频谱带要少于这个数目。其原因是:
激发态( =2)、第三激发态( =3),所产生的吸收峰称为倍频峰
由=0跃迁至=2时, △=2,产生的吸收峰称为二倍频峰
由=0跃迁至=3时, △=3,产生的吸收峰称为三倍频峰。其它类推。
在倍频峰中,二倍频峰还比较强。三倍频峰以上,因跃迁几率很小,一般
都很弱,常常不能测到。
除此之外,还有合频峰(1+2,21+2,),差频峰( 1-2,
红外光谱(IR)分析copy

与红外光谱比较,Raman光谱用于有机化合 物分析有一定优点。
∗因Raman光谱与红外光谱的选择定则不同,
对红外吸收很弱的C≡C、C=C、C-S、S-S等 键的伸缩振动及其它对称振动,都有很强的 Raman散射光。
∗拉曼光谱的另一大优点是不要求样品具有
光透性,可以很容易地得到浑浊样品的拉曼光 谱。 Raman光谱制样简单,很多情况下样品不 需处理,粉、块、薄膜状的固体、液态、溶 液及溶液中的沉淀物均可直接得到散射光谱。 特别是FI-Raman光谱可用作合适的非破 坏现场测试方法,在有机化合物、高分子材 料、医学、文物保护和生物分子研究中的应用 具有其独到之处。
∗特别重要的是:可用水作溶剂。(水是弱的散射
体)因此有利于生物分子、络合物、水污染等问题 的研究。 水分子是一种极性分子,有十分明显的红外吸收 谱带,要得到含水样品的红外吸收光谱却很困难。 相反,水分子的拉曼光谱信号很弱,可以较容易 地得到含水样品的拉曼光谱。因此,拉曼光谱可被 广泛地用于研究含水分的生物体系中,作为一种鉴 别物质结构的分析测试手段。
(问题:键力常数K还表明了红外谱峰位置与什 么因素有密切的关系?)
1-2 多原子分子的振动 在多原子分子中,由于组成原子数目多,以 及分子中原子排布情况不同,故多原子分子的 振动光谱远比双原子分子复杂得多。
1-4 影响峰位变化的因素 虽然基团吸收峰的频率主要由原子的质量和 原子的力常数决定,但基团的特征吸收峰并不 能固定在一个频率位置上,而是在一定范围内 波动。 (为什么?) 分子内部结构和外部环境的改变都可使其频 率发生改变。
4. 空间效应: (1)环状化合物的环张力效应:环张力越大,羰 基νC=O频率越高。 环张力 四元环 > 五元环 > 六元环 (2)空间位阻效应:空间位阻使羰基与双键之间 的共轭受限制,故使νC=O频率增高。 5. 氢键效应:氢键的形成,通常可使伸缩振动 频 率向低波数方向移动。
红外光谱 (IR)

16:13:34
2. 非谐振子:
*真实分子并非严格遵守谐振子规律, 其 势能曲线不是抛物线。
*由量子力学求得非谐振子的能级为:
E振=(V+1/2) ν- -(V+1/2)2Xe ν-
式中V:振动量子数, 其值可取0, 1, 2….
Xe:非谐性修正系数
(二).多原子分子的振动类型
2. 分子振动自由度与峰数
*基本振动的数目称为振动自由度; 由N个原子构成的分子,其总自由度 为3N个。
*分子作为一个整体,其运动状态可 分为:平动、转动和振动。
*分子自由度数(3N)=平动自由度+ 转动自由度+振动自由度
*振动自由度=分子自由度数(3N)(平动自由度+转动自由度)
(1) 伸缩振动: 以ν表示, 又可分: 对称(νs) 不对称(νas)
(2) 弯曲振动:以δ表示, 又可为4种。 面内弯曲振动δ ip:剪式;平面摇摆 面外弯曲振动δ 0.0.p:扭曲;非平面摇摆
νas > νs> δ S > δ 0.0.p
亚甲基的振动模式:
谱图解析——正己烷
在 2962cm-1 处 的 峰 是 CH3 基 团的不对称伸缩振动。这种 不对称伸缩振动范围 2962±10cm-1 , 事 实 上 , 存 在两个简并的不对称伸缩振 动(显示其中一个)。
*振动频率(ν)是键的力常数(K)及两 个原子(mA与mB)的质量的函数。
这些式子表明:双原子分子的振动频率 (波数)随着化学键力常数的增大而 增加, 同时也随着原子折合质量的 增加而降低。
表: 某些键的伸缩力常数(毫达因/埃)
✓ 例: ✓ 例:
第三章红外光谱IR
烷烃吸收峰
正己烷的红外光谱图
2,2,4-三甲基戊烷的红外光谱图
2、不饱和烃
• 烯烃 • 炔烃 • 芳香烃
2、1 烯烃 烯烃双键的特征吸收
影响双键碳碳伸缩振动吸收的因素
• 对称性:对称性越高,吸收强度越低。 • 与吸电子基团相连,振动波数下降,吸
收强度增加。 • 取代基的质量效应:双键上的氢被氘取
代后,波数下降10-20厘米-1。质量效应 • 共轭效应:使波数下降约30厘米-1 。
1-己烯的红外光谱图
~3060cm-1: 烯烃C—H伸缩振动;~1820:910cm-1倍频; ~1650cm-1: C=C伸缩振动;~995,905cm-1: C=CH2 非平面摇摆振动
顺式和反式2,2,5,5-四甲基己烯红外光谱 a 顺式 b 反式
v~
=
1
——
K
2C M
M = m1 m2 m1 + m2
双原子分子红外吸收的频率决定于折合质量和键力常数。
C-H C-C C-O C-Cl C-Br C-I
-1 cm
3000
1200 1100
800
550
500
v cm-1
力常数/g.s-2
CC 2200~2100
12~18105
C=C 1680~1620
C-H面外弯曲振动吸收峰位置(cm-1) 670
770-730,710-690 770-735
810-750,710-690 833-810
780-760,745-705 885-870,825-805 865-810,730-675
810-800 850-840 870-855
870
各类取代苯的倍频吸收和面外弯曲振动吸收
红外光谱(IR)的原理及其谱图的分析

2、电子效应
a. 诱导效应
b. 诱导效应使基团电荷分布发生变化,从而改变
了键的力常数,使振动频率发生变化.
O 例: R C X
X= R/
H
1715 1730
OR/ 1740
Cl
F
1800 1850
精选课件
O
RCX
X= R/
H
1715 1730
OR/ 1740
Cl
F
1800 1850
• 推电子基,C=O电荷中心向O移动,C=O极性增强, 双键性降低,低频移动; • 吸电子基, C=O电荷中心向几何中心靠近, C=O极 性降低,双键性增强,高频移动。
vs (very strong), s (strong), m (medium), w (weak), vw (very weak), b (broad) , sh (sharp) 3 峰形:吸收峰的形状 (尖峰、宽峰、肩峰)
精选课件
1.峰位
分子内各种官能团的特征吸收峰只出现在红外光 波谱的一定范围,如:C=O的伸缩振动一般在1700 cm-1左右。
红外光谱
一、基本原理 二、红外光谱仪及样品制备技术 三、影响振动频率的因素 四、各类有机化合物的红外特征吸收 五、红外谱图解析及应用
精选课件
一、 基本原理
1.1 近红外、中红外和远红外
波段名称 波长 μ
波数(cm-1)
近红外 0.75—2.5
13300-4000
中红外 2.5-25
4000-400
峰的大约2倍处(实际比两倍低)。一般为弱吸收峰。 羰基伸缩振动频率在1715cm-1左右,在3400cm-1附近 倍频峰,通常与羟基的伸缩振动吸收峰重叠。
红外吸收光谱法(IR)

• 3、红外吸收光谱与分子结构的关系 一、基团的特征峰与相关峰 1、特征峰与相关峰 特征峰——具有能代表某基团存在并有较高强 度的特征频率的吸收峰。可用以鉴定官能团。 相关峰——某基团的一组特征峰构成该基团的 相关峰。 2、红外光谱的分区 常见有机物基团在4000~670cm-1有特征基团频 率。红外光谱划分为6个区域:
有些因素使红外吸收峰增多 (1)倍频和组合频的出现 (2)振动耦合 (3)费米(Fermi)共振 振动耦合——当两个基团位置相邻,且振动频率相近,有一个 公用原子连接,相应的特征峰发生分裂形成两个峰。 费米共振——泛频峰与基频峰的耦合 影响吸收峰强弱的因素:分子在振动能级之间的跃迁概率和振 动过程中的偶极矩的变化。 A、分子由基态振动能级(0=0)向第一激发态(1=0)跃迁的 概率较大,因此基频峰较强,倍频峰较弱或很弱。 B、极性基团(O-H、C=O、N-H 等)振动时,偶极矩变化 较大,有较强的吸收峰; 非极性基团(C-C、C=C等)的吸收峰较弱;分子越对称, 吸收峰越弱。
偶极矩() =分子所带电量(q)正负电荷中心距离(d) 非极性双原子分子(N2、O2、H2): 分子完全对称(d=0),无红外吸收。 极性分子( 0): 由于分子中的振动使d的瞬时值不断变化,从而不 断变化,有一个固定的变化频率。当照射的红外光 的频率与分子的偶极矩的变化频率相匹配时,分子 的振动(红外活性振动)与红外光发生振动偶合而 增加振动能,振幅加大,即分子由振动基态跃迁到 激发态。——吸收红外光
• (2).傅里叶变换红外吸收光谱仪(FTIR)简介 原理:检测器得到一个干涉强度对光程差和红外光频率的函 数图,经过电子计算机进行复杂的傅立叶变换,得到普通的 吸光度或透光率随波数变化的红外光谱图。
(2)傅里叶变换红外光谱仪 (FTIR)
红外光谱_百度百科

致基团频率位移的内部因素,迄今已知的有分子中取代基的电性效应:如诱导效应、共轭效应、中 介效应、偶极场效应等;机械效应:如质量效应、张力引起的键角效应、振动之间的耦合效应等。 这些问题虽然已有不少研究报道,并有较为系统的论述,但是,若想按照某种效应的结果来定量地 预测有关基团频率位移的方向和大小,却往往难以做到,因为这些效应大都不是单一出现的。这 样,在进行不同分子间的比较时就很困难。
光谱分类
编辑
红外光谱可分为发射光谱和吸收光谱两类。
物体的红外发射光谱主要决定于物体的温度和化学组成,由于测试比较困难,红外发射光谱 只是一种正在发展的新的实验技术,如激光诱导荧光。将一束不同波长的红外射线照射到物质的分 子上,某些特定波长的红外射线被吸收,形成这一分子的红外吸收光谱。每种分子都有由其组成和 结构决定的独有的红外吸收光谱,它是一种分子光谱。
另外氢键效应和配位效应也会导致基团频率位移,如果发生在分子间,则属于外部因素,若发 生在分子内,则属于分子内部因素。
红外谱带的强度是一个振动跃迁概率的量度,而跃迁概率与分子振动时偶极矩的变化大小有 关,偶极矩变化愈大,谱带强度愈大。偶极矩的变化与基团本身固有的偶极矩有关,故基团极性越 强,振动时偶极矩变化越大,吸收谱带越强;分子的对称性越高,振动时偶极矩变化越小,吸收谱 带越弱。
傅里叶变换光谱仪的主要优点是:
傅里叶变换红外光谱仪
①多通道测量使信噪比提高;
②没有入射和出射狭缝限制,因而光通量高,提高值的精确度可达0.01厘米;
④增加动镜移动距离就可使分辨本领提高;
当外界电磁波照射分子时,如照射的电磁波的能量与分子的 红外光谱 两能级差相等,该频率的电磁波就被该分子吸收,从而引起分子 对应能级的跃迁,宏观表现为透射光强度变小。电磁波能量与分子两能级差相等为物质产生红外吸 收光谱必须满足条件之一,这决定了吸收峰出现的位置。
红外光谱

KK
1 1
m m m m
ν (cm )
-1
-1
C 2150
C
C 1650
C
C 1200
C
b、轨道中S成分越多,键的强度越大,吸收频率越高
ν (cm )
C__H sp 3300
C__H sp2 3100
C__H sp3 2900
1 K 1 c、原子的质量越大,振动吸收频率越低。 m1 m2 2 m1 m2 2 __ __ __ -1 C H C C C O (cm ) 3000 1200 1100
C-H N-H O-H S-H
C=C C=O
C=N
六.各类有机物的红外吸收:
1.烷烃的红外吸收:
正辛烷
甲基: Vas=2960, Vs=2860,δas=1450, 亚甲基: Vas=2930, Vs=2850, δas=1450 4个以上亚甲基: δs =720(cm-1)
δs =1380
2.烯烃的红外吸收
6 9 0 c m-1 6 9 0 c m-1 C=C H C=C H
2
2-甲基-1-丙烯
(E)-2-己烯
(Z)-3-己烯
3.炔烃的红外吸收:
1-己炔
C H 伸缩振动 3300
C C 伸缩振动 2100
C H 弯曲振动 630
2-己炔
HC
CCH2CH2CH2CH2CH2CH3
CH3C
CCH2CH2CH2CH2CH3
H H2 N , O 2 к Ó ìÍ âÎ üÕ Ê
CH3-CH2-C C-H Ð ÓÍ 箭头表示振动方向 O C O Þ Î ì º â ü Î CH -CH -C 3 2 âÎ Í üÊ Õ
红外光谱法(IR)

产生光谱的条件
• 辐射光子具有的能量与发生振动跃迁所需的跃迁能量 相等 . Ev=(v+1/2)hv
• 分子振动必须伴随瞬时偶极矩的变化。 一个分子有多种振动方式,只有能使分子偶极矩发生变 化的振动方式才会吸收特定频率的红外辐射。
分子的振动类型
• 对于多原子分子,由于一个原子可能同时与几个其它
不同基团的某一种振动形式可能会在同一频率范围内都有红外吸收, 如-OH、-NH的伸缩振动峰都在34003200 cm-1但二者峰形状有显著不同。 此时峰形的不同有助于官能团的鉴别。
红外光谱区的划分
根据实验技术要求和应用的不同,将红外区划分为三个区
红外光谱图: 纵坐标为吸收强度, 和波数1/λ 单位:cm-1
2.峰强
红外吸收峰的强度取决于分子振动时偶极矩的变化,振动时分子偶极 矩的变化越小,谱带强度也就越弱。 一般说来,极性较强的基团(如C=O,C-X)振动,吸收强度较大;极性较 弱的基团(如C=C,N-C等)振动,吸收强度较弱;红外吸收强度分别用很强(vs)、 强(s)、中(m)、弱(w)表示。
3.峰形
原子形成化学键,它们的振动相互牵连,不易直观地 加以解释,但可以把它的振动分解为许多简单的基本 振动,即简正振动。 • 伸缩振动
原子沿键轴方向伸缩,键长发生变化而键角不变的振动称为伸缩 振动。它又分为对称伸缩振动和不对称伸缩振动。
• 弯曲振动
基团键角发生周期变化而键长不变的振动称为变形振动。变 形振动又分为面内变形振动和面内变形振动。
红外光谱法(IR)
包欣雨
红外吸收光谱法的定义
• 红外吸收光谱法(infared absorption spectroscopy,简写 为IR)又称红外分光光度法,也是一种分子吸收光谱,当 样品受到频率联系变化的红外光照射时,分子吸收某些频 率的辐射产生分子振动和转动能级的跃迁,使相应于这些 吸收区域的透射光强度减弱。
红外光谱IR

B. Benzaldehyde D. m-Toluic acid
A. Allyl phenyl ether C. o-Cresol
B. Benzaldehyde D. m-Toluic acid
练习九
练习十
练习十一
练习八
A. Allyl phenyl ether C. o-Cresol
B. Benzaldehyde D. m-Toluic acid
A. Allyl phenyl ether C. o-Cresol
B. Benzaldehyde D. m-Toluic acid
A. Allyl phenyl ether C. o-Cresol
第一节 影响振动频率的因素 一.外部因素
红外吸收谱带产生于分子中化 学键的振动,但是测试条件,包括 试样的物理状态、晶型、浓度等均 对谱带的形状、强度及其频率位移 有着一定的影响。
二. 内部因素
(1)诱导效应(inductive effects,I)
O
C X
O
C X
推电子基团使ν↓;吸电子基团使ν↑
O CH3 — C —Cl
vC=O 18 07cm-1
O CH3 — C —H
1731cm-1
O CH3 — C —CH3
1715 cm-1
(2)共轭效应(conjugation effects,C)
共轭效应使νC=O移向低波数。一般
增加一个共轭双键,νC=O↓20-30 cm-
1。
O
O
ν C=O
1718cm-1
1691cm-1
O RC O R'
O R C R'
O R C S R'
红外光谱(IR)(InfraredSpectroscopy)

红外光谱(IR)(InfraredSpectroscopy)红外光谱(I R)(Infrared Spectroscopy)第一节:概述1、红外吸收光谱与紫外吸收光谱一样是一种分子吸收光谱。
红外光的能量(△E=0.05-1.0ev)较紫外光(△E=1-20ev)低,当红外光照射分子时不足以引起分子中价电子能级的跃迁,而能引起分子振动能级和转动能级的跃迁,故红外吸收光谱又称为分子振动光谱或振转光谱。
2、红外光谱的特点:特征性强、适用范围广。
红外光谱对化合物的鉴定和有机物的结构分析具有鲜明的特征性,构成化合物的原子质量不同、化学键的性质不同、原子的连接次序和空间位置不同都会造成红外光谱的差别。
红外光谱对样品的适用性相当广泛,无论固态、液态或气态都可进行测定。
3、红外光谱波长覆盖区域:0.76 mm ~ 1000mm.红外光按其波长的不同又划分为三个区段。
(1)近红外:波长在0.76-2.5mm之间(波数12820-4000cm-1)(2)中红外:波长在2.5-25mm(在4000-400 cm-1)通常所用的红外光谱是在这一段的(2.5-15mm,即4000-660 cm-1)光谱范围,本章内容仅限于中红外光谱。
(3)远红外:波长在25~1000mm(在400-10 cm-1)转动光谱出现在远红外区。
4、红外光谱图:当物质分子中某个基团的振动频率和红外光的频率一样时,分子就要吸收能量,从原来的振动能级跃迁到能量较高的振动能级,将分子吸收红外光的情况用仪器记录,就得到红外光谱图。
5、红外光谱表示方法:(1)红外光谱图红外光谱图以透光率T%为纵坐标,表示吸收强度,以波长l ( mm)或波数s (cm-1)为横坐标,表示吸收峰的位置,现主要以波数作横坐标。
波数是频率的一种表示方法(表示每厘米长的光波中波的数目)。
通过吸收峰的位置、相对强度及峰的形状提供化合物结构信息,其中以吸收峰的位置最为重要。
(2)将吸收峰以文字形式表示:如下图可表示为,3525cm-1(m),3097cm-1(m),1637cm-1(s)。
红外光谱(IR)分析

第二节
基本原理
就吸收一定频率的红外光,产生振动跃迁。如果用连续 改变频率的红外光照射某样品,由于试样对不同频率的 红外光吸收程度不同,使通过试样后的红外光在一些波 数范围减弱,在另一些波数范围内仍然较强,用仪器记 录该试样的红外吸收光谱,进行样品的定性和定量分析。
二、双原子分子的振动
分子中的原子以平衡点为中心,以非常小的振幅 (与原子核之间的距离相比)作周期性的振动,可近似 的看作简谐振动。这种分子振动的模型,以经典力学的 方法可把两个质量为m1和m2的原子看成钢体小球,连接
15
第二节
基本原理
等于分子振动能级的能量差(△Ev)时,则分子将吸收 红外辐射而跃迁至激发态,导致振幅增大。分子振动能 级的能量差为 △Ev = △h 又光子能量为
EL=h L 于是可得产生红外吸收光谱的第一条件为: EL =△Ev 即
L=△
16
第二节
基本原理
因此,只有当红外辐射频率等于振动量子数的差值 与分子振动频率的乘积时,分子才能吸收红外辐射,产 生红外吸收光谱。 分子吸收红外辐射后,由基态振动能级(=0)跃迁 至第一振动激发态(=1)时,所产生的吸收峰称为基频 峰。因为△=1时,L=,所以 基频峰的位置(L)等于 分子的振动频率。 在红外吸收光谱上除基频峰外,还有振动能级由基态 ( =0)跃迁至第二激发态( =2)、第三激发态( =3) ,所产生的吸收峰称为倍频峰。
4
第一节
概述
为若干个J = 0、1、2、3……的转动能级。 物质对不同波长的光线具有不同的吸收能力,物质 也只能选择性地吸收那些能量相当于该分子振动能变 化△Ev 、转动能变化△Er以及电子运动能量变化△Ee总 和的辐射。 由于各种物质分子内部结构的不同,分子的能级 也千差万别,各种能级之间的间隔也互不相同,这样 就 决定了它们对不同波长光线的选择吸收。 如果改变通过某一吸收物质的入射光的波长,并 记录该物质在每一波长处的吸光度(A),然后以波长
红外光谱ir

红外光谱ir
红外光谱(Infrared Spectroscopy, IR) 是一种分析物质分子结构的技术,通过测量分子对红外光的吸收情况来确定分子的振动模式和化学键的信息。
红外光谱仪通常由光源、样品池、检测器和数据处理系统组成。
光源产生的红外光通过样品池,样品池中的分子会吸收特定波长的红外光,从而引起分子振动和转动状态的变化。
检测器会检测到这些变化,并将其转化为电信号,数据处理系统则将这些电信号转化为红外光谱图。
红外光谱图是一种以波长或波数为横坐标,以吸光度或透过率为纵坐标的图谱。
图谱中的吸收峰对应于分子的振动模式和化学键的信息,可以用来确定分子的结构和组成。
红外光谱技术广泛应用于化学、材料科学、生物医学等领域,例如化合物的鉴定、结构分析、反应监测、材料表征等。
它具有快速、准确、无损等优点,是一种非常重要的分析技术。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
著增加。
外在因素
制各样品的方法、溶剂的性质、氢键、样品所处物态、 结晶条件、吸收池厚度、色散系统以及测试温度等
正己酸在液态和气态的红外光谱 a 蒸气(134℃)b 液体(室温)
红外光谱仪及样品制备技术
• 色散型红外光谱仪 • 傅立叶变换红外光谱仪(FTIR) • 红外样品的制备
强度 很强
强 中等
弱 很弱
符号 VS S M W VW
影响红外光谱吸收强度的因素
振动中偶极矩的变化幅度越大,吸收强度越大
• 极性大的基团,吸收强度大 • 使基团极性降低的诱导效应使吸收强度减小,
使基团极性增大的诱导效应使吸收强度增加。 • 共轭效应使π电子离域程度增大,极化程度增
大,吸收强度增加。 • 振动耦合使吸收增大,费米振动使倍频或组频
基团
吸收位置(cm-1)
说明
υO—H δC—O δH—O
3650~3580(游离) 3550~3450(二聚体) 3400~3200(多聚体) 3600-2500(分子内缔合)
1050(伯) 1100(仲) 1150(叔) 1200(酚)
1500~1250 650
尖 中强,较尖
强,宽 宽,散 强,有时发生裂分
面内弯曲,强,宽 面外弯曲,宽
正丁醇的红外光谱
~3450cm-1:缔合O—H伸缩振动;~1350cm-1:O—H面内弯曲振动
苯酚的红外光谱图
乙醇在CCl4中浓度变化对红外吸收的影响
代后,波数下降10-20厘米-1。质量效应 • 共轭效应:使波数下降约30厘米-1 。
1-己烯的红外光谱图
~3060cm-1: 烯烃C—H伸缩振动;~1820:910cm-1倍频; ~1650cm-1: C=C伸缩振动;~995,905cm-1: C=CH2 非平面摇摆振动
顺式和反式2,2,5,5-四甲基己烯红外光谱 a 顺式 b 反式
8~12105
CC 1200~700
4~6105
力常数表示了化学键的强度,其大小与键能、键长有关。
键能大,键长短,K值大,振动吸收频率移向高波数; 键能小,键长长,K值小,振动吸收频率移向低波数。
三.不同官能团的特征吸收频区
红外光谱可分为两个区域
官能团区 4000~1350cm-1 指纹区 1350~650cm-1
O
O
R C R' R C C=C
VC=O ~1715
1685~1670
()
O RC
~1695
()
O
R C NH2 ~1675cm-1
(p)
试比较下列两个化合物中哪一个羰基的振动波数相对较高?
CHO
(CH3)2N
CHO
A
B
共轭效应:共轭效应使不饱和键的波数显著降低
3. 氢键的影响
使基团化学键的力常数减小, 伸缩振动波数降低、峰形变宽。
CH 3100
CH 2900
8. 振动的偶合
分子内两基团位置很近并且振动频率相同或相近时, 它们之 间发生强相互 作用, 结果产生两个吸收峰, 一个向高频移动, 一个向低频移动。
8、振动耦合效应
• 含有若干个相同的化学键的振动频率发生 分裂的现象称为耦合效应。当一个化学键 的伸缩振动与另一个化学键的振动吸收频 率很接近时,就会发生振动耦合。
=CH的面外弯曲振动
烯烃类型 R1CH=CH2 R1R2C=CH2 R1CH=CHR2(顺) R1CH=CHR2(反) R1R2C=CHR3
CH面外弯曲振动吸收位置 (cm-1)
995-985,910-905
895-885
730-650
980-965
840-790
2、2 炔烃
• C-H伸缩振动:3340-3300厘米-1,波数高于烯 烃和芳香烃,峰形尖锐。
• 一个化学键的某一种振动的基频和他自己 或另一个连在一起的化学键的某一种振动 的倍频或组频很接近时,可以发生耦合, 这种耦合成为费米共振。
五. 红外吸收峰的强度
红外吸收强度取决于跃迁的几率:
跃迁几率
ab
2
E
2
o
ab 跃迁偶极矩
E
2
o
红外电磁波的电场矢量
强度决定于振动时偶极矩变化大小。偶极矩变化愈大,吸收 强度愈大;偶极矩变化愈小,吸收强度愈小;没有偶极矩变 化, 则不产生红外吸收。
1、烷烃
• C-H伸缩振动:对称伸缩振动(νs)和反对称 伸缩振动(νas) ,在2800-3000cm-1之间, νas较νs在较高频率。
• C-H弯曲振动:1475-700 cm-1 ,甲基的对称变 形振动出现在1375 cm-1处 ,对于异丙基和叔 丁基,吸收峰发生分裂。
• 碳碳骨架振动:750-720cm-1为-(CH2)2-的骨架 振动,1253-1000cm-1为分叉甲基的骨架振动。
甲苯的红外光谱图
苯乙烯的红外光谱图
~1630cm-1:C=C伸缩振动;~1600,1580,1450cm-1:苯环骨架振动
α-甲基萘的红外光谱图
苯环二取代的红外光谱 (a. 邻位 b. 间位 c. 对位)
3 醇、酚和醚
醇和酚存在三个特征吸收:羟基OH 伸缩振动和弯曲 振动,C-O伸缩振动。
VC=C
1645
H
1610 H
1560 H
υ C=C υ =C H
1645cm-1 3017cm-1
1610cm-1 3040cm-1
1565cm-1 3060cm-1
5、空间位阻
一般共轭使振动频率降低
6、跨环共轭效应
7. 成键碳原子的杂化状态(杂化轨道中S成分越高,其电负性越强)
VC-H
CH 3300
烷烃吸收峰
正己烷的红外光谱图
2,2,4-三甲基戊烷的红外光谱图
2、不饱和烃
• 烯烃 • 炔烃 • 芳香烃
2、1 烯烃 烯烃双键的特征吸收
影响双键碳碳伸缩振动吸收的因素
• 对称性:对称性越高,吸收强度越低。 • 与吸电子基团相连,振动波数下降,吸
收强度增加。 • 取代基的质量效应:双键上的氢被氘取
四. 影响官能团吸收频率的因素 主要讨论分子结构变化时,官能团红外吸收频率的变化。
2. 电子效应
1)诱导效应
O
O
R C R' R C Cl
O RCF
VC=O ~1715
~1800
~1869cm-1
卤原子吸电子诱导效应,使羰基双键极性增强,C=O的力常数 变大,吸收向高波数移动。
1、质量效应
X-H键的伸缩振动波数(cm-1)
v~
=
1
——
K
2C M
M = m1 m2 m1 + m2
双原子分子红外吸收的频率决定于折合质量和键力常数。
C-H C-C C-O C-Cl C-Br C-I
-1 cm
3000
1200 1100
800
550
500
v cm-1
力常数/g.s-2
CC 2200~2100
12~18105
C=C 1680~1620
化学键
波数(cm-1)
化学键
波数(cm-1)
C-H
3000
F-H
4000
Si-H
2150
Cl-H
2890
Ge-H
2070
Br-H
2650
Sn-H
1850
I-H
2310
诱导效应
注意与前面谱图的差别:在3000cm-1附近的峰
2)共轭效应 羰基与双键共轭,C=O键长增加,降低了羰基的双键性, 使吸收频率移向低波数。
二. 基本原理
用一定频率的红外光照射分子,分子发生振动能级的跃迁。 分子的振动分为:伸缩振动()、弯曲振动()。
分子振动
伸缩振动 (键长改变)
弯曲振动
(键角改变)
对称 伸缩振动 不对称 伸缩振动 面内弯曲振动 面外弯曲振动
• 双原子分子振动
多原子分子振动
常见术语
• 基频峰、倍频峰、合频峰、热峰
色散型红外光谱仪
傅立叶变换红外光谱仪
迈克逊干涉仪
干涉图
FTIR光谱仪的优点
• 光学部件简单,只有一个动镜在实验中运动, 不易磨损。
• 测量波长范围宽,其波长范围可达到 45000~6cm-1
• 精度高,光通量大,所有频率同时测量,检测 灵敏度高。
• 扫描速度快,可作快速反应动力学研究,并可 与GC、LC联用。
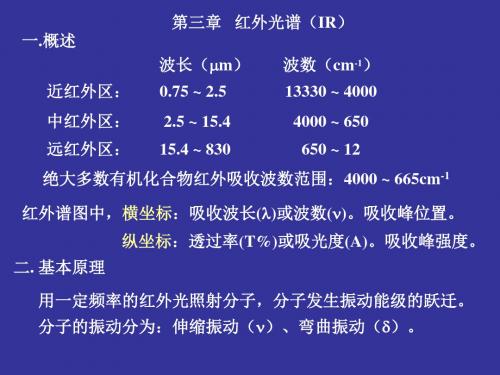
一.概述
第三章 红外光谱(IR) 波长(m) 波数(cm-1)
近红外区: 0.75 ~ 2.5
13330 ~ 4000
中红外区: 2.5 ~ 15.4
4000 ~ 650
远红外区: 15.4 ~ 830
650 ~ 12
绝大多数有机化合物红外吸收波数范围:4000 ~ 665cm-1
红外谱图中,横坐标:吸收波长()或波数()。吸收峰位置。 纵坐标:透过率(T%)或吸光度(A)。吸收峰强度。
• C-C叁键伸缩振动:2100厘米-1 ,峰形尖锐, 强度中到弱。干扰少,位置特征。末端炔基该 吸收强。分子对称性强时,该吸收较弱。
• 腈类化合物,C-N叁键伸缩振动出现在23002220厘米-1,波数比炔烃略高,吸收强度大。
苯基乙炔
~3340cm-1 :叁键上C—H伸缩振动,~3020cm-1: 苯环=C—H伸缩振动 ~2115cm-1: 三键伸缩振动
例:VC=O 吸收强度大于 VC=C 。 对称烯、炔等无吸收峰或吸 收峰很弱。
吸收强度的表示: vs (ε> 200)、s(ε= 75~200)、 m(ε= 25~75)、w(ε= 5~25)、vw(ε< 5)。
