医药行业常用英文缩写释义
医药行业术语英文缩写

医药行业术语英文缩写English:There are numerous abbreviations and acronyms used in the pharmaceutical industry, which serve to simplify communication and documentation. Some common abbreviations include FDA (Food and Drug Administration), which is the regulatory authority in the United States responsible for approving and monitoring the safety and effectiveness of drugs and medical devices. Another frequently used abbreviation is API (Active Pharmaceutical Ingredient), which refersto the biologically active component of a drug. Other abbreviations include OTC (Over-the-Counter), which denotes medications that can be purchased without a prescription, and Rx, which is the symbol for a prescription. Additionally, there are various acronyms for pharmaceutical processes and practices, such as GMP (Good Manufacturing Practice), which outlines the guidelines for ensuring quality and consistency in drug manufacturing. Another important acronym is NDA (New Drug Application), which is the submission made to the FDA seeking approval for a new pharmaceutical product. Other notable acronyms include PMA (Pre-Market Approval), whichis the FDA's process of evaluating and certifying the safety and effectiveness of class III medical devices. Lastly, there are abbreviations for pharmaceutical dosage forms, such as capsule (cap) and tablet (tab). These abbreviations are widely used in prescriptions and medication labels to indicate the form in which a drug should be administered.中文翻译:医药行业中有许多常用的缩写和首字母缩略词,用于简化沟通和文件记录。
医药行业英文缩写

医药行业常用英文缩写释义1.OTC(Over The Counter):非处方药物我国卫生部医政司是这样定义的:它是消费者可不经过医生处方,直接从药房或药店购买的药品,而且是不在医疗专业人员指导下就能安全使用的药品,即不需要凭借执业医师或助理医师的处方即可自行选购、使用的药品。
非处方药英语称Nonprescription Drug,又称之为“可在柜台上买到的药物”(Over The Counter),简称OTC,现已成为国际通用的非处方药简称。
OTC中又分甲类OTC和乙类OTC。
甲类(红色)的可在医院、药店销售,宜遵医嘱服;乙类(绿色)的是可以在医院、药店、超市、宾馆等地方销售,安全性高,不良反应小。
相对于OTC,RX是指必须凭借执业医师或医生开取的处方方可购买的药品。
2.Rx(Receptor,X表示处方的内容):处方药处方药是必须凭执业医师或执业助理医师处方才可调配、购买和使用的药品,英文称Prescription Drug,Ethical Drug。
Rx是国际通用处方药的简称,据说Rx最早是写在一个医学处方前面,是个占星术的一个符号,用来避邪。
后来演变成一个大写的R并且结尾交叉,是拉丁文recipe的缩写,recipe 的意思是请拿、取的意思,是让药房的药剂师按照处方中开的药拿药的意思。
它的写法是一个大写的R,加一撇在它的结尾,打印出来就像Rx。
3.TCM(Traditional Chinese Medicine):中药4.INN(International Nonproprietary Name for Pharmaceutical Substances):国际非专有名称,国际通用名是世界卫生组织给每种药品的一个官方的非专利性名称。
在世界范围内使用不受任何限制,不能取得专利和行政保护。
自1953年WHO的国际非专有名方案实施以来已公布8000个INN,现每年大约要公布150多个INN,目前INN名称已被世界各国采用,任何该药品的生产者都可以使用INN,在药典,科技文献,教材,标签,广告等广泛使用,INN也是药品说明书中标明的有效成分的名称,在复方制剂中只能使用它作为复方组成的使用名称。
生物医药产业研究中常见的90个英文缩写及中文对照分享

生物医药产业研究中常见的90个英文缩写及中文对照分享1. ADME: Absorption, Distribution, Metabolism and Excretion (吸收、分布、代谢和排泄)2. ADR: Adverse Drug Reaction (不良药物反应)3. AE: Adverse Event (不良事件)4. API: Active Pharmaceutical Ingredient (活性药物成分)5. BCRP: Breast Cancer Resistance Protein (乳腺癌耐药蛋白)6. BMD: Bone Mineral Density (骨密度)7. CAR-T: Chimeric Antigen Receptor T-cell (嵌合抗原受体T细胞)8. CDMO: Contract Development and Manufacturing Organization (合同开发与生产组织)9. CRO: Contract Research Organization (合同研究组织)10. CT: Clinical Trial (临床试验)11. DILI: Drug-Induced Liver Injury (药物性肝损伤)12. DMARDs: Disease-Modifying Antirheumatic Drugs (疾病修饰性抗风湿药)13. DNA: Deoxyribonucleic Acid (脱氧核糖核酸)14. ECG: Electrocardiogram (心电图)15. EPO: Erythropoietin (促红细胞生成素)16. ER: Estrogen Receptor (雌激素受体)17. FDA: Food and Drug Administration (美国食品药品监督管理局)18. GMP: Good Manufacturing Practice (良好生产规范)19. HPLC: High-Performance Liquid Chromatography (高效液相色谱)20. ICU: Intensive Care Unit (重症监护室)21. IEC: Institutional Ethics Committee (机构伦理委员会)22. IND: Investigational New Drug (新药申请)23. IPO: Initial Public Offering (首次公开募股)24. IPSC: Induced Pluripotent Stem Cell (诱导多能干细胞)25. IRB: Institutional Review Board (机构审查委员会)26. IVF: In Vitro Fertilization (体外受精)27. LC-MS: Liquid Chromatography-Mass Spectrometry (液相色谱-质谱)28. LPS: Lipopolysaccharide (脂多糖)29. MALDI-TOF: Matrix-Assisted Laser Desorption/Ionization Time-of-Flight (基质辅助激光解吸/飞行时间)30. MD: Medical Doctor (医学博士)31. MHC: Major Histocompatibility Complex (主要组织相容性复合体)32. MRA: Magnetic Resonance Angiography (磁共振血管造影)33. MRI: Magnetic Resonance Imaging (磁共振成像)34. NDA: New Drug Application (新药申请)35. NIH: National Institutes of Health (美国国家卫生研究院)36. NMR: Nuclear Magnetic Resonance (核磁共振)37. NSCLC: Non-Small Cell Lung Cancer (非小细胞肺癌)38. OTC: Over-the-Counter (非处方药)39. PCR: Polymerase Chain Reaction (聚合酶链反应)40. PD: Pharmacodynamics (药效学)41. PK: Pharmacokinetics (药动学)42. PPI: Proton Pump Inhibitor (质子泵抑制剂)43. PR: Progesterone Receptor (孕激素受体)44. PSA: Prostate-Specific Antigen (前列腺特异性抗原)45. R&D: Research and Development (研发)46. RNA: Ribonucleic Acid (核糖核酸)47. RCT: Randomized Controlled Trial (随机对照试验)48. ROIC: Return on Invested Capital (资本投资回报率)49. RT-PCR: Reverse Transcription Polymerase Chain Reaction (逆转录聚合酶链反应)50. SAR: Structure-Activity Relationship (结构-活性关系)51. SAE: Serious Adverse Event (严重不良事件)52. SARS: Severe Acute Respiratory Syndrome (严重急性呼吸综合征)53. SD: Standard Deviation (标准偏差)54. SNP: Single Nucleotide Polymorphism (单核苷酸多形性)55. SPA: Special Protocol Assessment (特殊方案评估)56. SSRI: Selective Serotonin Reuptake Inhibitor (选择性5-羟色胺再摄取抑制剂)57. TBI: Traumatic Brain Injury (创伤性脑损伤)58. TCR: T-cell Receptor (T细胞受体)59. TDM: Therapeutic Drug Monitoring (抗癫痫药物浓度监测)60. VEGF: Vascular Endothelial Growth Factor (血管内皮生长因子)61. WHO: World Health Organization (世界卫生组织)62. 5-HT: 5-Hydroxytryptamine (5-羟色胺)63. AGM: After Goal Meeting (过目散会)64. APAP: Acetaminophen (对乙酰氨基酚)65. ATP: Adenosine Triphosphate (三磷酸腺苷)66. CAGR: Compound Annual Growth Rate (复合年增长率)67. CMO: Contract Manufacturing Organization (合同制造组织)68. CRISPR: Clustered Regularly Interspaced Short Palindromic Repeats (自成簇间隔短回文重复序列)69. CTM: Clinical Trial Material (临床试验材料)70. CVD: Cardiovascular Disease (心血管疾病)71. CYP: Cytochrome P450 (细胞色素P450)72. DMPK: Drug Metabolism and Pharmacokinetics (药物代谢和药动学)73. DSMB: Data Safety Monitoring Board (数据安全监察委员会)74. EMEA: European Medicines Agency (欧洲药品管理局)75. FDA: Food and Drug Administration (食品和药物管理局)76. FISH: Fluorescence In Situ Hybridization (原位荧光杂交技术)77. FY: Fiscal Year (财政年度)78. HIPAA: Health Insurance Portability and Accountability Act (健康保险可移植性和责任法案)79. HTS: High-Throughput Screening (高通量筛选)80. ICU: Intensive Care Unit (重症监护室)81. IHC: Immunohistochemistry (免疫组织化学)82. IND: Investigational New Drug (新药申请)83. KOL: Key Opinion Leader (关键意见领袖)84. MOA: Mode of Action (作用机制)85. NCE: New Chemical Entity (新化学实体)86. NK: Natural Killer (自然杀伤细胞)87. NOAEL: No Observable Adverse Effect Level (无观察到的不良反应水平)88. NDA: New Drug Application (新药申请)89. RCT: Randomized Controlled Trial (随机对照试验)90. RNAi: RNA Interference (RNA干扰)。
医学常用缩写解析

医学常用缩写解析医学领域涵盖的范围非常广,术语和专业缩写常令人头痛,特别是在了解病患的过程中,缩写更是不可或缺的工具。
在这篇文章中,我们将深入浅出地解析一些医学常用缩写,帮助您更好地了解医学术语和缩写的含义。
一、常见缩写解析1. AD:指“右耳”,来自拉丁文“auris dextra”的缩写,常用于描述听力测试结果。
2. AS:指“左耳”,来自拉丁文“auris sinistra”的缩写,与AD相对应。
3. BP:指“血压”,包括收缩压和舒张压两个数值,常用于心脏病和高血压等疾病的诊断和治疗。
4. BMI:指“身体质量指数”,是通过身高和体重计算得出的一个数字,用于评估一个人的体重是否合适。
5. CBC:指“完全血细胞计数”,用于评估血液中的不同种类的细胞数量。
6. CT:指“计算机断层扫描”,是一种医学成像技术,可以在三维空间内生成身体部位的高清影像。
7. ECG:指“心电图”,是一种记录心脏电活动的检查方法。
8. EEG:指“脑电图”,是一种记录大脑电活动的检查方法。
9. ICU:指“重症监护室”,是为病情危急的病患提供高度专注监护的部门。
10. MRI:指“磁共振成像”,是一种医学成像技术,可以通过对身体内部的水分子进行磁共振来生成高清影像。
11. OTC:指“非处方药”,是指可以在不需要医生处方的情况下购买的药品。
12. PT:指“凝血酶原时间”,是一种用于评估血液凝固功能的检查方法。
13. Rx:指“处方药”,需要医生开具处方才能购买的药品。
14. TB:指“结核菌”,是一种可以引发结核病的细菌。
15. UTI:指“尿路感染”,是一种常见的泌尿系统疾病。
二、缩写使用注意事项了解医学常用缩写的含义和用法对于疾病诊断和治疗非常重要,但要注意以下几点:1.避免混淆:有些缩写可能代表多个术语,需要根据上下文来确定其含义。
2. 避免误解:缩写不应该代替完整的术语,医生和患者之间的沟通应该尽量避免使用缩写,以免发生误解。
医药行业专业英语词汇_非常有用_

医药行业专业英语词汇_非常有用_FDA和EDQM术语:QC、QA、IPQC、JQE、DQA、SQE是什么?这些职位的全称都是什么?有什么区别?QC中文全称: 即英文QUALITY CONTROL的简称,中文意义是品质控制,质量检验。
其在ISO8402:1994的定义是“为达到品质要求所采取的作业技术和活动”。
有些推行ISO9000的组织会设置这样一个部门或岗位,负责ISO9000标准所要求的有关品质控制的职能,担任这类工作的人员就叫做QC人员,相当于一般企业中的产品检验员,包括进货检验员(IQC)、制程检验员(IPQC)、最终检验员(FQC)和出货检验员(OQC)。
QA中文全称:即英文QUALITY ASSURANCE 的简称, 中文意思是品质保证,质量保证。
其在ISO8402:1994中的定义是“为了提供足够的信任表明实体能够满足品质要求,而在品质管理体系中实施并根据需要进行证实的全部有计划和有系统的活动”。
有些推行ISO9000的组织会设置这样的部门或岗位,负责ISO9000标准所要求的有关品质保证的职能,担任这类工作的人员就叫做QA 人员。
IPQC:即英文In-process Quality Control 的简称, 中文意思是制程检验,担任这类工作的人员叫做制程检验员。
JQE:即英文Joint Qualit Engineer 的简称, 中文意思是品质工程师或客户端工程师,或客户端品质工程师,即供应商花钱雇用的为客户工作的品质工程师,是客户SQE的眼睛和耳朵。
iDQA:即英文Design Quality Assurance 的简称, 中文意思是设计品质保证,如DQA经理(设计品质认证经理)。
SQE:即英文Supplier Quality Engineer 的简称, 中文意思是供应商品质工程师。
此外,还有DQC:即英文Design Quality Control 的简称, 中文意思是设计品质控制。
医药行业hcp什么意思

医药行业hcp什么意思
医药行业hcp意思如下:
缩写词HCP:HealthCarePractitioner保健医生H CP:HostingContr olPanel(FusionXHost)主机控制面板(FusionXHost)HCP:HabitatConservationPlan栖息地的保护计划。
卫生保健专业人员。
又称医务人员或护士,英文名:medicalper sonnel指卫生事业机构支付工资的全部职工中现任职务为卫生技术工作的专业人员。
包括中医师、西医师、中西医结合高级医师、护师、中药师、西药师、检验师、其他技师、中医士、西医士、护士、助产士、中药剂士、西药剂士、检验士、其他技士、其他中医、护理员、中药剂员、西药剂员、检验员和其他初级卫生技术人员。
制药行业常用英语词汇(缩写、中英文对照)

制药行业常用英语词汇(缩写、中英文对照)制药行业常用英语词汇(缩写、中英文对照)序号中文英文及缩写 1 药品生产质量管理规范 GMP:GoodManufacturingPractice 2 国家食品与药品监督管理局 State Food and Drug Administration 3 总则 GeneralProvisions 4 《中华人民共和国药品管理法》 the DrugAdministration Law of the People"s Republic of China 5 制剂Preparation 6 原料药 API: Active PharmaceuticalIngredient 7 成品finished goods 8 工序 process 9 机构与人员 organization and personnel 10 专业知识 professional knowledge 11 生产经验 production e_perience 12 组织能力 organizational skill 13 技术人员 technical staff 14 实施implementation 15 药品生产 pharmaceutical manufacturing 16 质量管理quality management 17 质量检验 quality inspection 18 专业技术培训professional and technicaltraining 19 基础理论知识 basic theoreticalknowledge 20 实际操作技能 practical operationskills 21 高生物活性 highly potent 22 高毒性 high to_icity 23 污染 contamination 24 考核评估 assessment25 厂房与设施 buildings and facilities 26 生产环境 production environment 27 空气洁净级别 clean air level 28 昆虫 insect 29 洁净室(区)clean room(area) 30 光滑 smooth 31 无裂缝 no cracks 32 无颗粒物脱落no particle shedding 33 耐受 endure 34 消毒 disinfection 35 无菌 sterile 36 交界处 junction, joint 37 弧形 arc 38 灰尘积聚 dues accumulation 39 储存区 store area 40 生产规模 production scale 41 设备 equipment 42 物料material 43 中间产品 intermediate product 44 待验品 quarantined material 45 交叉污染 cross-contamination 46 管道 pipeline, ductwork 47 风口 tuber 48 公用设施, 公用工程 utilities of publicservice 49 照明 lighting 50 照度 illumination 51 应急紧急情况 emergency 52 净化 purification, clean 53 微生物, 微生物学, 微生物 micro-organism,microbiology,microbiologic的 54 监测 monitoring 55 记录 record 56 天棚天花板 ceiling, roof 57 密封 seal 58 静压差 Static DifferentialPressure 59 温度 temperature 60 相对湿度 RH: Relative Humidity 61 低漏地漏 floor drainer 62 青霉素penicillin 63 分装室 separating room, fillingroom 64 相对负压 relative negativepressure 65 废气 waste gas,e_hausted air 66 β-内酰胺结构类药品 β-Lactasestructure drug, drugs of β-Lactic group 67 避孕药品 contraceptives 68 激素类 hormone 69 抗肿瘤类 anti-tumor, oncology 70 放射性药品 Radiopharmaceuticals 71 包装 packing, package 72 循环使用recycling 73 微粒 particles 74 辐射 radiation, irradiation 75 细菌bacteria 76 病毒 virus 77 细胞 cell 78 脱毒前后 pre and postdeto_ification 79 活疫苗与灭活疫苗 activevaccine/inactivatedvaccine 80 人血液制品 blood products 81 预防制品prevention products82 灌装 filling 83 中药 Chinesetraditional medicines 84 前处理pretreatment 85 提取 e_traction 86 浓缩 concentration 87 动物脏器viscera of animal,organ ofanimal 88 蒸、炒、炙、煅 ing, frying,sunburn, testing 89 炮制concocted 90 通风 ventilation 91 除烟 smoke removal 92 除尘 dust removal 93 降温设施 temperature-reducingestablishment,cooling 94 筛选 screening, sift 95 切片 slicing 96 粉碎 grinding 97 压缩空气 pressed air 98 惰性气体 noble gas 99 取样 Sling 100 称量室weighing room, dispensingroom 中药标本 Chinese herbalsle,e_emplar of TCM 102 检定鉴定 verification, identification 103 同位素 Isoe 104 设备 equipment 105 选型 model/type selection 106 耐腐蚀anticorrosion 107 吸附 adsorption, absorption 108 润滑剂, 润滑 lubricant, lubricate 109 冷却剂 coolant 110 流向 flow direction111 纯化水 PW: Purified Water 112 注射用水 WFI: Water for Injection 113 滋生 breeding 114 储罐 tank 115 死角 neglected portion 116 盲管blind pipe 117 纤维 fiber 118 疏水性 hydrophobicity 119 仪表instrumentation 120 量具 measuring tool 121 衡器 weighing instrument 122 精密度 precision 123 维修 maintenance 124 不合格 disqualified reject 125 物料 material 126 购买 purchasing 127 发放 releasing 128 产地 origin 129 入库 loading 130 固体 solid 131 液体 liquid 132 挥发性 volatile 133 净药材 medicine, TCM 134 麻醉药品 narcotics 135 精神药品 psychotropic drug 136 易燃 bustible 137 易爆 e_plosive 138 验收 acceptance 139 使用说明书instruction140 标签 label 141 卫生, 清洁/消毒 sanitation 142 车间, 辅房workshop 143 间隔时间 time interval 144 清洁剂 detergent 145 消毒剂disinfectant 146 废弃物 wastes 147 更衣室 changing room 148 工作服, work clothes 149 颗粒性物质, 颗粒剂 granules 150 耐药菌株 drug-resistantstrain 151 传染病 infectiousdisease 152 皮肤病 dermatitis 153 验证verification, validation 154 确认 qualification 155 安装 installation156 运行 running operation 157 性能 performance 158 原辅料 raw material and incipient 159 文件 document 160 投诉 plaint 161 报废 reject 162 品名product name 163 处方 preion, formula 164 技术参数 technicalparameter165 容器 container 166 半成品 semi-finished product,intermediate 167 申请 lication 168 稳定性 stability169 起草 draft 170 生产管理 production management,manufacturing control.171 事故 accident 172 混淆 mi_-up 173 喷雾 spray 174 合格证certificate 175 清场 clearance 176 质量管理 quality management 177 内控internal control,on-line test 178 滴定液 tartan 179 培养基 medium 180 有效期 validity, e_piry date,shelf life 181 产品销售与收回 product sales andrecovery/recall 182 投诉与不良反应报告 plaints and adversereaction 自检self-inspection 184 附则 schedule endi_ 185 平衡 balance 186 饮用水drinking water, potablewater 187 蒸馏法 distillation 188 离子交换法 ion e_change 189 反渗透法 RO: Reverse Osmosis 190 附加剂添加剂 additives 191 滞留 stranded resort 192 批 batch, lot 193 组分, 组成 ponent 194 无纤维脱落的过滤器 non-fiber-releasingfilter 195 活性成份 Active Ingredient 196 非活性成份 Inactive ingredient 197 中间产品 in-processproduct,intermediate product198 批号 batch number 199 药用物料 medicated feed 20__药用预混合料 medicated premi_ 201 质量控制部门 Quality control department 202 理论产量 Theoretical yield 203 实际产量 Actual yield 204 比率 Percentage, rate 205 验收标准可接受标准 Acceptance criteria 206 代表性样品 Representative sle 207 微粒状的 particulate 208 污染物contaminant 209 石棉 asbestos 210 诊断 diagnosis 211 缓解 mitigation 212 化学变化 chemical change 213 组分 ingredient, ponent 214 制备 fabricate preparation 215 复合 pound 216 混合 blend 217 加工 processing 218 浓度concentration 219 单位剂量 unit dose 220 药品包装容器 drug product containers 221 密封件, 封盖 closure 222 效价 Titer 223 纯度 purity 224 规格 strength 225 监督 supervise, monitor 226 实验室 laboratory 227 无菌操作 aseptic operation,sterileoperation 228 层流 laminar flow 229 湍流 turbulent air flow 230 空气过滤 air filtration 231 空气加热 air heating 232 预过滤器 profiler 233 排气系统 e_haust system 234 管件 plumbing 235 虹吸倒流 back-siphon age 236 污水 sewage 237 废料 refuse 238 盥洗设备 toilet facilities 239 空气干燥器 air drier 240 垃圾 trash 241 有机废料 organic waste 242 杀鼠剂rodenticides 243 杀昆虫剂 insecticides 244 杀真菌剂 fungicides 245 熏蒸剂 fumigating reagents 246 去垢剂 cleaning agents 247 消毒剂 sanitizing agents 248 滂沱剂 lubricant 249 自动化设备 automatic, mechanical,or electronic equipment 250 微型胶卷 microfilm 251 注射剂 injection 252 灭菌设备 sterilization equipment 253 无菌取样技术 aseptic sling techniques 254 显微镜 microscope 255 热, 内毒素 pyrogen, endoto_in 256 偏差 deviation 257 变更 change control 258 进料 charge-in 259 项目代码 item code 260 鉴别 identify 261 片剂 tablet 262 胶囊 capsule 263 颗粒剂 granule 264 溶解时间溶出时间 dissolution time 265 澄明度clarity 266 隔离系统 quarantinesystem, isolation system 267 返工reprocessing 268 发放 issuance, release 269 非处方药 OTC:over-the-counter 270 处方药 preed medicine 271 皮肤科药、牙粉、胰岛素、喉片dermatological,dentifrice,insulin, or throat lozenge product 272 保险包装 ter-resistant package 273 明胶硬胶囊 hard gelatin capsule 274 顺势治疗homeopathic 275 入库 warehousing 276 变质 deteriorate 277 准确性accuracy 278 灵敏性 sensitivity 279 特异性 specificity 280 重复性reproducibility, repeatability 281 变应原提取物 allergenic e_tracts 282 眼膏 ophthalmic ointment 283 粗糙或磨蚀物质 harsh or abrasivesubstances 284 控释制剂 controlled-releasedosage form 285 实验动物 laboratory animals 286 供应商 Supplier 287 光谱 spectrum 288 测量单位 units of measure 289 换算系数 conversion factors 290 试剂 reagent 291 安慰剂placebo 292 明确地 e_plicitly 293 取代 supersede 294 溶液 solution 295 批准 roval 296 (美国)食品药品监督管理局 FDA: Food and DrugAdministration 297 标准操作程序 SOP: StandardOperatingProcedure 298 质量保证 QA: Quality Assurance 299 质量控制QC:Quality Control 300 批生产记录 BPR: Batch ProductionRecord 301 批检验记录 BAR: Batch AnalysisRecord 302 工艺规程 PP: Process Procedure 303 健康,安全,环保 EHS: Environment,Health andSafe 304 美国联邦法规 CFR: Code of FederalRegulation 305 美国药典USP: The UnitedStatesPharmacopeia 306 欧洲药典 EP: European pharmacopeia 307 英国药典 BP: British pharmacopeia 308 药物主文件 DMF: Drug Master File 309 验证主计划 VMP: Validation MasterPlan 310 验证方案 VP: Validation Protocol 311 验证报告 : Validation Report 312 安装确认 IQ: Installation Qualification313 运行确认 OQ: Operation Qualification 314 性能确认 PQ: Performance Qualification 315 超出标准(限度) OOS: Out of Specification 316 冻干产品 freeze-dry product,lyophilizated product 317 工厂主述文件SMF: Site Master File。
医药疾病常见英文缩写

医药疾病常见英文缩写TTD 停药前持续用药时间CAP 社区获得性肺炎TS 胸甘酸合成酶DHFR 二氢叶酸还原酶GARFT 甘氨酰胺核糖核苷酸甲酰基转移酶 FPGS 叶酰多谷氨酸合成酶PBP 青霉素结合蛋白ATS 美国胸科学会IDSA(CID) 美国感染性疾病协会T>MIC% 药物浓度高于最低抑菌浓度的持续时间与给药间隔时间的百分比ENT 耳鼻喉科EPS 锥体外系PRL 泌乳素,又叫催乳素SANS 阴性症状量表SAPS 阳性症状量表QALYs 质量调整生命年CIS 顺铂CAR 卡铂 carboplatin CSCO 中国临床肿瘤学会 Chinese Society of Clinical OncologyASCO 美国临床肿瘤学会 American PFS 无进展生存时间 Progress Free SurvivalTTP 肿瘤进展时间 Time to Progression OS 总生存期 overall survivalPD 疾病进展 progression disease MTD 最大耐受剂量 maximum tolerated dose DCR 疾病控制率 disease control rate ORR 客观缓解率 objective response rate OR 总缓解率 overall responseCR+PR=ORR ORR+SD=DCREGFR 原癌基因或上皮生长因子受体EGFR-TKI 表皮生长因子接收器-酪胺酸激酶抑制剂Epidermal growth factor receptor(EGFR)-tyrosine kinase inhibitors (TKI)FDA 美国食品药品管理局 food and drug administrationqd 每日用药一次bid 每日用药两次tid 每日用药三次qid 每日用药四次qh 每小时一次qn 每晚一次qod 隔日一次po 口服NCCN 美国国立综合癌症网络 national comprehensive cancernetworkJMDB—NSCLC的一线治疗 non-small cell lung cancerJMEN—NSCLC的维持治疗JMEI—NSCLC的二线治疗WBC 白细胞RBC 红细胞Hb 血红蛋白ANC 中性粒细胞绝对计数,也被称为绝对中性粒细胞计数(AGC) FPGS 也算多聚谷氨酸合成酶5-Fu 氟尿嘧啶VP-16 依托泊苷(处方,肿瘤药)TURBT 经尿道膀胱肿瘤电切术BCG 卡介苗(膀胱内灌注)MMC 丝裂霉素NMIBC 中高危复发组非肌层浸润性膀胱癌BAO 简单来说就是胃酸分泌量MAO 最大胃酸分泌量PAO 高峰胃酸分泌量PPI 质子泵抑制剂CYP 细胞色素P450超家族DU 十二指肠溃疡 duodenal ulcerGU 胃溃疡 gastric ulcer GERD 胃-食管返流征HP 幽门螺旋杆菌NSAID 非甾体抗炎药PUD 消化性溃疡FBG 空腹血糖 fasting blood glucose 2.8~7.0mmol/L(126mg) PBG 餐后血糖postprantial 75g葡萄糖负荷2h 11.1mmol/L(200mg)随机血糖大于 11.1mmol/L(200mg)HbA1c 糖化血红蛋白小于6.5%IGT 糖耐量减低 impaired glucose tolerance IFG 空腹血糖受损 impaired fasting glucose DM 糖尿病OGTT 口服葡萄糖耐量PS 功能状态评分 performance status PVD 外围血管病变ECOG PS2 指生活自理但丧失工作能力 the Eastern CooperativeOncology Group scale 美国东部肿瘤协作组WJTOG 西日本胸部肿瘤协作组ECOG 1594是一个大型的随机研究BSC 最佳支持疗法,即患者同时接受地塞米松,叶酸和VB12 ORR 客观缓解率objective response rateCOPD 慢性阻塞性肺病 chronic obstructive pulmonary diseaseEGFR突变和EML4-ALK突变靶向基因治疗AUC 药时曲线下面积CR 完全缓解 complete response PR 部分缓解 partial response 靶病灶最大径之和减少?30%SD 疾病稳定 stable disease 靶病灶最大径之和缩小未达PR,或增大未达PD PD 疾病进展 progressive disease 靶病灶最大径之和至少增加?20%,或出现新病灶DCR 疾病控制率 disease control rate MST 中位生存期 median survive time 又称半数生存期,即当累积生存率为0.5时所对应的生存时间,表示有且只有50%的个体可以活过这个时间。
医药常用英语单词及缩写

FDA(food and drug adminisration):(美国)食品药品监督管理局NDA(new drug application):新药申请ANDA(abbreviated new drug application):简化新药申请EP(export application):出口药申请(申请出口不被批准在美国销售的药品)treatment IND:研究中的新药用于治疗abbreviated(new)drug:简化申请的新药DMF(drug master file):药物主文件(持有者为谨慎起见而准备的保密资料,可以包括一个或多个人用药物在制备、加工、包装和贮存过程中所涉及的设备、生产过程或物品。
只有在DMF持有者或授权代表以授权书的形式授权给FDA,FDA在审查IND、NDA、ANDA时才能参考其内容)holder:DMF持有者CFR(code of federal regulation):(美国)联邦法规PANEL:专家小组batch production:批量生产;分批生产batch production records:生产批号记录post or pre-market surveillance:销售前或销售后监督informed consent:知情同意(患者对治疗或受试者对医疗试验了解后表示同意接受治疗或试验)prescription drug:处方药OTC drug(over—the—counter drug):非处方药U.S. public health service:美国卫生福利部NIH(national institute of health):(美国)全国卫生研究所animal trail:动物试验accelerated approval:加速批准standard drug:标准药物investigator :研究人员;调研人员preparing and submitting:起草和申报submission:申报;递交benefit(s):受益risk(s):受害drug product:药物产品drug substance:原料药established name:确定的名称generic name:非专利名称proprietary name:专有名称;INN(international nonproprietary name):国际非专有名称narrative summary: 记叙体概要adverse effect:副作用adverse reaction:不良反应protocol:方案archival copy:存档用副本review copy:审查用副本official compendium:法定药典(主要指USP、NF).USP(the united state pharmacopeia):美国药典(现已和NF合并一起出版)NF(national formulary):(美国)国家药品集official=pharmacopeial = compendial:药典的;法定的;官方的agency:审理部门(指FDA)sponsor:主办者(指负责并着手临床研究者)identity:真伪;鉴别;特性strength:规格;规格含量(每一剂量单位所含有效成分的量)labeled amount:标示量regulatory specification:质量管理规格标准(NDA提供)regulatory methodology:质量管理方法(FDA用于考核原料药或药物产品是否符合批准了的质量管理规格标准的整套步骤)regulatory methods validation:管理用分析方法的验证(FDA对NDA提供的方法进行验证)Dietary supplement:食用补充品ICH(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use)人用药物注册技术要求国际协调会议ICH:Quality-质量Q1A(R2): Stability Testing of New Drug Substances and Products (Second Revision)新原料药和制剂的稳定性试验(第二版)Q1B: Photostability Testing of New Drug Substances and Products新原料药和制剂的光稳定性试验Q1C: Stability Testing for New Dosage Forms新制剂的稳定性试验Q1D: Bracketing and Matrixing Designs for Stability Testing of DrugSubstances and Drug Products原料药和制剂稳定性试验的交叉和矩阵设计Q1E: Evaluation of Stability Data对稳定性数据的评估处理Q1F: Stability Data Package for Registration Applications in ClimaticZones III and IV在气候带III和IV,药物注册申请所提供的稳定性数据Q2A: Text on Validation of Analytical Procedures分析程序的验证Q2B: Validation of Analytical Procedures: Methodology分析程序的验证:方法学Q3A(R): Impurities in New Drug Substances (Revised Guideline)新原料药中的杂质(修订版)Q3B(R): Impurities in New Drug Products (Revised Guideline)新制剂中的杂质(修订版)Q3C: Impurities: Guideline for Residual Solvents杂质:残留溶剂指南Q3C(M): Impurities: Guideline for Residual Solvents (Maintenance)杂质:残留溶剂指南(修改内容)Q4: Pharmacopoeias药典Q4A: Pharmacopoeial Harmonisation 药典的协调Q4B: Regulatory Acceptance of Pharmacopoeial Interchangeability药典互替在法规上的可接受性Q5A: Viral Safety Evaluation of Biotechnology Products Derived from Cell Lines of Human or Animal Origin来源于人或者动物细胞系的生物技术产品的病毒安全性评估Q5B: Quality of Biotechnological Products: Analysis of the ExpressionConstruct in Cells Used for Production of r-DNA Derived Protein Products 生物技术产品的质量:源于重组DNA的蛋白质产品的生产中所用的细胞中的表达构建分析Q5C: Quality of Biotechnological Products: Stability Testing ofBiotechnological/Biological Products生物技术产品的质量:生物技术/生物产品的稳定性试验Q5D: Derivation and Characterisation of Cell Substrates Used forProduction of Biotechnological/Biological Products用于生产生物技术/生物产品的细胞底物的起源和特征描述Q5E: Comparability of Biotechnological/Biological Products Subject to Changes in Their Manufacturing Process基于不同生产工艺的生物技术产品/生物产品的可比较性Q6: Specifications for New Drug Substances and Products新原料药和制剂的质量规格Q6A: Specifications: Test Procedures and Acceptance Criteria for New DrugSubstances and New Drug Products: Chemical Substances质量规格:新原料药和新制剂的检验程序和可接收标准:化学物质Q6B: Specifications: Test Procedures and Acceptance Criteria forBiotechnological/Biological Products质量规格:生物技术/生物产品的检验程序和可接收标准Q7: Good Manufacturing Practices for Pharmaceutical Ingredients活性药物成份的GMPQ7A: Good Manufacturing Practice Guide for Active PharmaceuticalIngredients活性药物成份的GMP指南Q8: Pharmaceutical Development药物研发Q9: Quality Risk Management质量风险管理ICH:Safety-安全S1A: Guideline on the Need for Carcinogenicity Studies of Pharmaceuticals药物致癌性研究需要的指南S1B: Testing for Carcinogenicity of Pharmaceuticals药物致癌性的检验S1C: Dose Selection for Carcinogenicity Studies of Pharmaceuticals药物致癌性研究之剂量选择S1C(R): Addendum: Addition of a Limit Dose and Related Notes附录:极限剂量和有关注释的的补充S2A: Guidance on Specific Aspects of Regulatory Genotoxicity Tests for Pharmaceuticals受法规管辖的药物基因毒性检验的特定方面的指南S2B: Genotoxicity: A Standard Battery for Genotoxicity Testing forPharmaceuticals基因毒性:药物基因毒性检验的标准S3A: Note for Guidance on Toxicokinetics: The Assessment of Systemic Exposure in Toxicity Studies毒物代谢动力学指南的注释:毒性研究中的全身性暴露量的评估S3B: Pharmacokinetics: Guidance for Repeated Dose Tissue Distribution Studies药物代谢动力学:重复剂量的组织分布研究指南S4: Single Dose Toxicity Tests单剂量毒性检验S4A: Duration of Chronic Toxicity Testing in Animals (Rodent andNon-Rodent Toxicity Testing)动物体内慢性毒性持续时间的检验(啮齿动物和非啮齿动物毒性检验)S5A: Detection of Toxicity to Reproduction for Medicinal Products药物对生殖发育的毒性的检验S5B(M): Maintenance of the ICH Guideline on Toxicity to Male Fertility: An Addendum to the Guideline on Detection of Toxicity to Reproduction forMedicinal Products对男性生殖能力的毒性的指南的变动:药物对生殖发育的毒性的检验指南增加了一个附录S6: Preclinical Safety Evaluation of Biotechnology-Derived Pharmaceuticals生物技术生产的药物的临床前安全评价S7A: Safety Pharmacology Studies for Human Pharmaceuticals人用药的安全药理学研究S7B: The Nonclinical Evaluation of the Potential for Delayed Ventricular Repolarization(QT Interval Prolongation) By Human Pharmaceuticals药物延迟心室复极化(QT间期)潜在作用的非临床评价S8: Immunotoxicology Studies for Human Pharmaceuticals人用药免疫毒理学研究M3(M): Maintenance of the ICH Guideline on Non-Clinical Safety Studies forthe Conduct of Human Clinical Trials for Pharmaceuticals药物的对人临床试验的非临床安全研究指南的变动E-Efficacy(有效)E1: The Extent of Population Exposure to Assess Clinical Safety for Drugs Intended for Long-Term Treatment of Non-Life-Threatening Conditions 对用于无生命危险情况下长期治疗的药物进行临床安全评估的族群暴露量范围E2A: Clinical Safety Data Management: Definitions and Standards forExpedited Reporting临床安全数据管理:速报制度的定义和标准E2B(R): Revision of the E2B(M) ICH Guideline on Clinical Safety DataManagement Data Elements for Transmission of Individual Case Safety Reports个案安全报告送交的临床安全数据管理的数据要素指南(E2B(M))的修订版E2B (M): Maintenance of the Clinical Safety Data Management including: Data Elements for Transmission of Individual Case Safety Reports临床安全数据管理的变动包括:个案安全报告送交的数据要素E2B(M): Maintenance of the Clinical Safety Data Management including Questions and Answers临床安全数据管理的变动,包括问答E2C: Clinical Safety Data Management: Periodic Safety Update Reports forMarketed Drugs临床安全数据管理:已上市药品的周期性安全数据更新报告Addendum to E2C: Periodic Safety Update Reports for Marketed Drugs E2C的附录:已上市药品的周期性安全数据更新报告E2D: Post-Approval Safety Data Management: Definitions and Standards forExpedited Reporting批准后的安全数据管理:速报制度的定义和标准E2E: Pharmacovigilance Planning药物警戒计划E3: Structure and Content of Clinical Study Reports临床研究报告的结构和内容E4: Dose-Response Information to Support Drug Registration支持药品注册的剂量-效应资料E5: Ethnic Factors in the Acceptability of Foreign Clinical Data引入海外临床数据时要考虑的人种因素E6: Good Clinical Practice: Consolidated GuidelineGCP:良好的临床规范:统一的指南E7: Studies in Support of Special Populations: Geriatrics对特定族群的支持的研究:老人病学E8: General Considerations for Clinical Trials对临床试验的总的考虑E9: Statistical Principles for Clinical Trials临床试验的统计原则E10: Choice of Control Group and Related Issues in Clinical Trials临床试验中控制组和有关课题的选择E11: Clinical Investigation of Medicinal Products in the PediatricPopulation小儿科药物的临床调查E12A: Principles for Clinical Evaluation of New Antihypertensive Drugs 新抗高血压药物的临床评价原则E14: The Clinical Evaluation of QT/QTc Interval Prolongation andProarrhythmic Potential for Non-Antiarrhythmic Drugs非抗心率失常药物的QT/QTc 间期和致心率失常潜在作用的临床评价Multidisciplinary Guidelines 多学科兼容的指南M1: Medical Terminology医学术语M2: Electronic Standards for Transmission of Regulatory Information (ESTRI)药政信息传递之电子标准M3: Timing of Pre-clinical Studies in Relation to Clinical Trials (SeeSafety Topics)有关临床试验的临床前研究的时间安排M4: The Common Technical Document (See CTD section for complete Status ofthe guidelines)通用技术文件(见有关CTD章节)M5: Data Elements and Standards for Drug Dictionaries药物词典的数据要素和标准临床试验常用的英文缩略语TTP:time-to-progression 疾病进展时间SAE:severity Adverse Event 严重不良事件AE:Adverse Event 不良事件SOP:Standard Operating Procedure 标准操作规程CRF:Case Report form 病例报告表DLT:剂量限制毒性MTD:最大耐受剂量KPS:Karnofsky Performance Status行为状态评分CR:complete response完全缓解PR:partial response部分缓解SD:病情稳定PD:progressive disease病情进展CTC:常用药物毒性标准IEC:independent ethics committee 独立伦理委员会IRB :institutional review board 伦理委员会CRA:临床研究助理CRO:Contract Research Organization 合同研究组织DFS:Disease Free Survival 无病生存期OS:(Overall Survival)总生存时间IC:Informed consent 知情同意ADR:Adverse Drug Reaction 不良反应GAP:Good Agricultural Practice 中药材种植管理规范GCP:Good Clinical Practice 药物临床试验质量管理规范GLP:Good Laboratory Practice 药品实验室管理规范GMP:Good Manufacturing Practice 药品生产质量管理规范GSP:Good Supply Practice 药品经营质量管理规范GUP:Good Use Practice 药品使用质量管理规范PI :Principal investigator 主要研究者CI:Co-inveatigator 合作研究者SI :Sub-investigator 助理研究者COI :Coordinating investigtor 协调研究者DGMP:医疗器械生产质量管理规范ICF:Informed consent form 知情同意书RCT :randomized controlled trial, 随机对照试验NRCCT:non-randomized concurrent controlled trial, 非随机同期对照试验EBM:evidence-based medicine 循证医学RCD:randomized cross-over disgn 随机交叉对照试验HCT:historial control trial, 历史对照研究RECIST:Response Evaluation Criteria In Solid Tumors. 实体瘤疗效反应的评价标准QC:Quality Control质量控制UADR:Unexpected Adverse Drug Reaction,非预期药物不良反应。
常用制药及GMP英文缩写

常用制药及GMP英文缩写ISO(International Organization for Standardization):国际标准化组织日常办事机构是中央秘书处,设在瑞士日内瓦WHO(World Health Organization):世界卫生组织是联合国属下的专门机构,国际最大的公共卫生组织,总部设于瑞士日内瓦PIC/S(Pharmaceutical Inspection Convention/Pharmaceutical Inspection Cooperation Scheme):国际医药品稽查协约组织由欧洲自由贸易区(EFTA)组建ICH(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use):人用药物注册技术要求国际协调会由欧盟(EU)、欧洲制药工业协会联合会(EFPIA)、日本厚生省(MHW)、日本制药工业协会(JPMA)、美国FDA、美国药物研究生产联合会(PRMA)等机构组成WHO、EFTA、加拿大卫生保健局(CHPB)为观察员ISPE(International Society for Pharmaceutical Engineering):国际制药工程协会是致力于培训制药领域专家并提升制药行业水准的世界最大的非盈利性组织之一,在美国坦帕州设有全球总部,在布鲁塞尔设有欧洲总部,亚洲总部在新加坡HHS(United States Department of Health and Human Services):美国卫生及公共服务部(美国卫生部)FDA(Food and Drug Administration):美国食品药品监督管理局(HHS下属机构)PDA(Parenteral Drug Association):美国注射剂协会EPA(Environmental Protection Agency):美国国家环境保护局CDER(Center for Drug Evaluation and Research):FDA药物评价与研究中心EMEA(The European Agency for the Evaluation of Medicinal Products):欧洲药物评审组织MHW(Ministry of Health and Welfare):日本厚生省,现改为厚生劳动省MHLW (Ministry of Health, Labor and Welfare),负责医疗卫生和社会保障的主要部门D&B(Dun & Bradstreet):邓白氏公司DUNS(DataUniversal Numbering System):邓白氏公司提供的唯一的公司代号,用于信用评级等在SMF文件中会用到GMP(Good Manufacturing Practice):药品良好生产规范cGMP(Current Good Manufacture Practices):动态药品生产管理规范,即现行的GLP(Good Laboratory Practice):药物非临床研究质量管理规范,及优良实验室规范GSP(Good Supplying Practice):药品经营质量管理规范,及良好的药品供应规范GAP(Good Agricultural Practice for Chinese Crude Drugs):中药材生产质量管理规范GDP(Good Documentation Practice):良好文件管理GEP(Good Engineering Practice):工程设计规范GAMP(Good Automated Manufacturing Practice):优良自动化生产规范USP(united states pharmacopeia):美国药典EP(European Pharmacopeia):欧洲药典JP(Japanese Pharmacopoeia):日本药典CFR(Code of Federal Regulations):美国联邦法律CFR 21 Part 11(Code of Federal Registry Part11):联邦法规法律标题21第11部分CEP/COS(C ertificate o f S uitability to the monographs of E uropean P harmacopoeia):欧洲药典适应性认证证书CEP认证,COS证书CTD(Common Technical Document):国际注册用常规技术文件CTD文件是国际公认的文件编写格式,用来制作一个向药品注册机构递交的结构完善的注册申请文件EHS(Environment、Health、Safety):环境-健康-安全管理体系HACCP(Hazard Analysis and Critical Control Point):(保健食品)危害分析和关键控制点REACH(REGULATION concerning the Registration, Evaluation, Authorization and Restriction of Chemicals):欧盟规章《化学品注册、评估、许可和限制》,欧盟建立的,并于2007年6月1日起实施的化学品监管体系ICH-Q1A:新原料药和制剂的稳定性试验ICH-Q1B:稳定性试验:新原料药和制剂的光稳定性试验ICH-Q1C:稳定性试验:新剂型的要求ICH-Q1D:新原料药和制剂的稳定性试验的括号法和矩阵法设计ICH-Q1E:稳定性数据的评价ICH-Q1F:气候带Ⅲ和Ⅳ注册申请的稳定性数据ICH-Q2A:分析步骤验证:正文ICH-Q2B:分析步骤验证:方法学ICH-Q3A:原料药中的杂质ICH-Q3B:新制剂中的杂质ICH-Q3C:杂质;残留溶剂的指导原则ICH-Q4:药典ICH-Q4A:药典的同一化ICH-Q4B:各地区使用的药典正文评估和建议ICH-Q5A:来源于人或动物细胞系的生物技术产品的病毒安全性评价ICH-Q5B:生物技术产品的质量:rDNA衍生蛋白质产品生产细胞的表达构建体分析ICH-Q5C:生物技术产品的质量:生物制品/生物技术产品的稳定性试验ICH-Q5D:用于生物技术产品及生物制品生产的细胞基质的来源和鉴定ICH-Q5E:生物技术产品/生物制品在工艺变更时的可比性ICH-Q6A:质量标准新原料药和制剂的检测以及可接受标准:化学物质ICH-Q6B:质量标准:生物技术产品及生物制品的检测方法和可接受标准ICH-Q7:原料药良好制造规范(ICH-Q7A的新版)ICH-Q7A:原料药的GMP规范ICH-Q8:药物研发指南ICH-Q9:质量风险管理ICH- Q10(PQS):药物质量体系QA(Quality Assurance):质量保证QC(Quality Control):质量控制QRM(Quality Risk Management):质量风险管理IPC(InproceicsQuality Control):制程品质控制/中控OOS(Out of Specification):检验结果超标OOT(Out of Trend):超趋势结果OOL(Out of Limit):超出极限的结果,如温湿度等OOE(Out of Expectation):超期望结果SAL(SterilityAssuranceLevel):无菌保证水平灭菌后微生物的存活概率的负对lgN0数,要求≥6SAL=?lg存活率=F0DD值:杀灭90%的微生物所需要的时间,D值越大,微生物死亡越难,D值与细菌的耐热性成正比Z值:指灭菌时间减少到原来的10%所需要升高的温度或是相同的灭菌时间内杀死99%的微生物所需要提高的温度F值:为一定温度下,给定Z值所产生的灭局效果与参比温度T0下给定Z值所产生的灭菌效果相同时所相当的时间F值用于干热灭菌F0值:为一定温度下,Z值为10℃产生的灭菌效果与120℃,Z 值为10℃时产生的灭菌效果相当的时间,t分钟内的灭菌效果相当于120℃下灭菌F0分钟的效果F0被称为标准灭菌时间,用于热压灭菌LRV:除菌过滤的对数下降值LRV=lgN0-lgNSOP(Standard Operation Procedure):标准操作规程DMF(Drug Master File):药品主文件SMF(Site Master File):工厂主文件URS(User Requirement Specification):用户需求标准FS(Functional Specification):功能标准DS(Design Specification):设计标准DQ(Design Qualification):设计确认IQ(Installation Qualification):安装确认OQ(Operational Qualification):运行确认PQ(Performance Qualification):性能确认RQ(Requalification):再确认CAPA(Corrective Action & Preventive Action):纠正预防系统,Q10的四大要素之一QbD(Quality byDesign):质量源于设计COA(Certificate of Analysis):分析证书/检验报告书/检验报告单BPR(Batch Production Record):批生产记录API(Active Pharmaceutical Ingredients):药物活性成分,通常指的原料药PMC(Product Material Control):生产物料控制PC 生产控制;MC物料控制CMC(Chemistry and manufacture control):生产和化学控制APR(Annual Products Review):年度质量回顾KPI(Key Performance Indicators):关键业绩指标P&ID(Piping and Instrument Diagram):工艺管道仪表流程图PFD(Process Flow Diagram):工艺流程图UFD(Utility Flow Diagram):公用工程流程图CIP(Cleaning in Place):原位清洗(全自动,如针剂配制系统)WIP(Washing in Place):在线清洁(半自动,需要手动的拆卸,如流化床)SIP(Sterilization in Place):在线灭菌WFI(Water for Injection):注射用水HVAC(Heating Ventilation Air Conditioning):供热空气调节净化系统HEPA(High Efficiency Particulate Air Filter):高效过滤器DOP:为邻苯二甲酸二辛酯,HEPA检漏用的气溶胶PAO:聚-α-烯烃,HEPA检漏用的气溶胶IBC(I ntermediateBulkContainer):中型散装容器BFS(Blowing Filling and Sealing):吹-灌-封PAT(Process Analytical Technology):过程分析技术PLC(Programmable Logic Controller):可编程逻辑控制CPP(Critical Process Parameters):关键工艺参数FBD(Fluid Bed Dryer):流化床AHU(Air Handling Unit):空气处理单元SAT(SiteAcceptance Test):现场验收测试FAT(Factory Acceptance Test):工厂验收测试。
医药行业常用英文缩写释义

医药行业常用英文缩写释义1、OTC(Over The Counter):非处方药物我国卫生部医政司是这样定义的:它是消费者可不经过医生处方,直接从药房或药店购买的药品,而且是不在医疗专业人员指导下就能安全使用的药品,即不需要凭借执业医师或助理医师的处方即可自行选购、使用的药品。
OTC中又分甲类OTC和乙类OTC。
甲类(红色)的可在医院、药店销售;乙类(绿色)的是可以在医院、药店、超市、宾馆等地方销售。
买非处方药(OTC)红绿要分清,包装盒上OTC标识为绿色,安全性高,不良反应小,红色宜遵医嘱服。
相对于OTC,RX是指必须凭借执业医师或医生开取的处方方可购买的药品。
2、GSP(Good Supply Practice):《药品经营质量管理规范》GSP是英文Good Supplying Practice缩写,直译为良好的药品供应规范,在我国称为《药品经营质量管理规范》。
它是指在药品流通过程中,针对计划采购、购进验收、储存、销售及售后服务等环节而制定的保证药品符合质量标准的一项管理制度。
其核心是通过严格的管理制度来约束企业的行为,对药品经营全过程进行质量控制,保证向用户提供优质的药品。
GSP是控制医药商品流通环节所有可能发生质量事故的因素从而防止质量事故发生的一整套管理程序,医药商品在其生产、经营和销售的全过程中,由于内外因素作用,随时都有可能发生质量问题,必须在所有这些环节上采取严格措施,才能从根本上保证医药商品质量。
药品经营企业应在药品监督管理部门规定的时间内达到GSP要求,并通过认证取得认证证书。
3、GLP(Good Laboratory Practice):药物非临床研究质量管理规范GLP是英文Good Laboratory Practice 的缩写,中文直译为优良实验室规范。
GLP是就实验室实验研究从计划、实验、监督、记录到实验报告等一系列管理而制定的法规性文件,涉及到实验室工作的所有方面。
医药常用英语单词及缩写

FDA(food and drug adminisration):(美国)食品药品监督管理局NDA(new drug application):新药申请ANDA(abbreviated new drug application):简化新药申请EP(export application):出口药申请(申请出口不被批准在美国销售的药品)treatment IND:研究中的新药用于治疗abbreviated(new)drug:简化申请的新药DMF(drug master file):药物主文件(持有者为谨慎起见而准备的保密资料,可以包括一个或多个人用药物在制备、加工、包装和贮存过程中所涉及的设备、生产过程或物品。
只有在DMF持有者或授权代表以授权书的形式授权给FDA,FDA在审查IND、NDA、ANDA时才能参考其内容)holder:DMF持有者CFR(code of federal regulation):(美国)联邦法规PANEL:专家小组batch production:批量生产;分批生产batch production records:生产批号记录post or pre-market surveillance:销售前或销售后监督informed consent:知情同意(患者对治疗或受试者对医疗试验了解后表示同意接受治疗或试验)prescription drug:处方药OTC drug(over—the—counter drug):非处方药U.S. public health service:美国卫生福利部NIH(national institute of health):(美国)全国卫生研究所animal trail:动物试验accelerated approval:加速批准standard drug:标准药物investigator :研究人员;调研人员preparing and submitting:起草和申报submission:申报;递交benefit(s):受益risk(s):受害drug product:药物产品drug substance:原料药established name:确定的名称generic name:非专利名称proprietary name:专有名称;INN(international nonproprietary name):国际非专有名称narrative summary: 记叙体概要adverse effect:副作用adverse reaction:不良反应protocol:方案archival copy:存档用副本review copy:审查用副本official compendium:法定药典(主要指USP、NF).USP(the united state pharmacopeia):美国药典(现已和NF合并一起出版)NF(national formulary):(美国)国家药品集official=pharmacopeial = compendial:药典的;法定的;官方的agency:审理部门(指FDA)sponsor:主办者(指负责并着手临床研究者)identity:真伪;鉴别;特性strength:规格;规格含量(每一剂量单位所含有效成分的量)labeled amount:标示量regulatory specification:质量管理规格标准(NDA提供)regulatory methodology:质量管理方法(FDA用于考核原料药或药物产品是否符合批准了的质量管理规格标准的整套步骤)regulatory methods validation:管理用分析方法的验证(FDA对NDA提供的方法进行验证)Dietary supplement:食用补充品ICH(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use)人用药物注册技术要求国际协调会议ICH:Quality-质量Q1A(R2): Stability Testing of New Drug Substances and Products (SecondRevision)新原料药和制剂的稳定性试验(第二版)Q1B: Photostability Testing of New Drug Substances and Products新原料药和制剂的光稳定性试验Q1C: Stability Testing for New Dosage Forms新制剂的稳定性试验Q1D: Bracketing and Matrixing Designs for Stability Testing of DrugSubstances and Drug Products原料药和制剂稳定性试验的交叉和矩阵设计Q1E: Evaluation of Stability Data对稳定性数据的评估处理Q1F: Stability Data Package for Registration Applications in ClimaticZones III and IV在气候带III和IV,药物注册申请所提供的稳定性数据Q2A: Text on Validation of Analytical Procedures分析程序的验证Q2B: Validation of Analytical Procedures: Methodology分析程序的验证:方法学Q3A(R): Impurities in New Drug Substances (Revised Guideline)新原料药中的杂质(修订版)Q3B(R): Impurities in New Drug Products (Revised Guideline)新制剂中的杂质(修订版)Q3C: Impurities: Guideline for Residual Solvents杂质:残留溶剂指南Q3C(M): Impurities: Guideline for Residual Solvents (Maintenance)杂质:残留溶剂指南(修改内容)Q4: Pharmacopoeias药典Q4A: PharmacopoeialHarmonisation药典的协调Q4B: Regulatory Acceptance of Pharmacopoeial Interchangeability药典互替在法规上的可接受性Q5A: Viral Safety Evaluation of Biotechnology Products Derived from CellLines of Human or Animal Origin来源于人或者动物细胞系的生物技术产品的病毒安全性评估Q5B: Quality of Biotechnological Products: Analysis of the ExpressionConstruct in Cells Used for Production of r-DNA Derived Protein Products生物技术产品的质量:源于重组DNA的蛋白质产品的生产中所用的细胞中的表达构建分析Q5C: Quality of Biotechnological Products: Stability Testing ofBiotechnological/Biological Products生物技术产品的质量:生物技术/生物产品的稳定性试验Q5D: Derivation and Characterisation of Cell Substrates Used forProduction of Biotechnological/Biological Products用于生产生物技术/生物产品的细胞底物的起源和特征描述Q5E: Comparability of Biotechnological/Biological Products Subject toChanges in Their Manufacturing Process基于不同生产工艺的生物技术产品/生物产品的可比较性Q6: Specifications for New Drug Substances and Products新原料药和制剂的质量规格Q6A: Specifications: Test Procedures and Acceptance Criteria for New DrugSubstances and New Drug Products: Chemical Substances质量规格:新原料药和新制剂的检验程序和可接收标准:化学物质Q6B: Specifications: Test Procedures and Acceptance Criteria forBiotechnological/Biological Products质量规格:生物技术/生物产品的检验程序和可接收标准Q7: Good Manufacturing Practices for Pharmaceutical Ingredients活性药物成份的GMPQ7A: Good Manufacturing Practice Guide for Active PharmaceuticalIngredients活性药物成份的GMP指南Q8: Pharmaceutical Development药物研发Q9: Quality Risk Management质量风险管理ICH:Safety-安全S1A: Guideline on the Need for Carcinogenicity Studies of Pharmaceuticals药物致癌性研究需要的指南S1B: Testing for Carcinogenicity of Pharmaceuticals药物致癌性的检验S1C: Dose Selection for Carcinogenicity Studies of Pharmaceuticals药物致癌性研究之剂量选择S1C(R): Addendum: Addition of a Limit Dose and Related Notes附录:极限剂量和有关注释的的补充S2A: Guidance on Specific Aspects of Regulatory Genotoxicity Tests forPharmaceuticals受法规管辖的药物基因毒性检验的特定方面的指南S2B: Genotoxicity: A Standard Battery for Genotoxicity Testing forPharmaceuticals基因毒性:药物基因毒性检验的标准S3A: Note for Guidance on Toxicokinetics: The Assessment of SystemicExposure in Toxicity Studies毒物代谢动力学指南的注释:毒性研究中的全身性暴露量的评估S3B: Pharmacokinetics: Guidance for Repeated Dose Tissue DistributionStudies药物代谢动力学:重复剂量的组织分布研究指南S4: Single Dose Toxicity Tests单剂量毒性检验S4A: Duration of Chronic Toxicity Testing in Animals (Rodent andNon-Rodent Toxicity Testing)动物体内慢性毒性持续时间的检验(啮齿动物和非啮齿动物毒性检验)S5A: Detection of Toxicity to Reproduction for Medicinal Products药物对生殖发育的毒性的检验S5B(M): Maintenance of the ICH Guideline on Toxicity to Male Fertility:An Addendum to the Guideline on Detection of Toxicity to Reproduction forMedicinal Products对男性生殖能力的毒性的指南的变动:药物对生殖发育的毒性的检验指南增加了一个附录S6: Preclinical Safety Evaluation of Biotechnology-Derived Pharmaceuticals生物技术生产的药物的临床前安全评价S7A: Safety Pharmacology Studies for Human Pharmaceuticals人用药的安全药理学研究S7B: The Nonclinical Evaluation of the Potential for Delayed VentricularRepolarization(QT Interval Prolongation) By Human Pharmaceuticals药物延迟心室复极化(QT间期)潜在作用的非临床评价S8: Immunotoxicology Studies for Human Pharmaceuticals人用药免疫毒理学研究M3(M): Maintenance of the ICH Guideline on Non-Clinical Safety Studies for the Conduct of Human Clinical Trials for Pharmaceuticals药物的对人临床试验的非临床安全研究指南的变动E-Efficacy(有效)E1: The Extent of Population Exposure to Assess Clinical Safety for DrugsIntended for Long-Term Treatment of Non-Life-Threatening Conditions对用于无生命危险情况下长期治疗的药物进行临床安全评估的族群暴露量范围E2A: Clinical Safety Data Management: Definitions and Standards forExpedited Reporting临床安全数据管理:速报制度的定义和标准E2B(R): Revision of the E2B(M) ICH Guideline on Clinical Safety DataManagement Data Elements for Transmission of Individual Case SafetyReports个案安全报告送交的临床安全数据管理的数据要素指南(E2B(M))的修订版E2B (M): Maintenance of the Clinical Safety Data Management including:Data Elements for Transmission of Individual Case Safety Reports临床安全数据管理的变动包括:个案安全报告送交的数据要素E2B(M): Maintenance of the Clinical Safety Data Management includingQuestions and Answers临床安全数据管理的变动,包括问答E2C: Clinical Safety Data Management: Periodic Safety Update Reports forMarketed Drugs临床安全数据管理:已上市药品的周期性安全数据更新报告Addendum to E2C: Periodic Safety Update Reports for Marketed DrugsE2C的附录:已上市药品的周期性安全数据更新报告E2D: Post-Approval Safety Data Management: Definitions and Standards for Expedited Reporting批准后的安全数据管理:速报制度的定义和标准E2E: Pharmacovigilance Planning药物警戒计划E3: Structure and Content of Clinical Study Reports临床研究报告的结构和内容E4: Dose-Response Information to Support Drug Registration支持药品注册的剂量-效应资料E5: Ethnic Factors in the Acceptability of Foreign Clinical Data引入海外临床数据时要考虑的人种因素E6: Good Clinical Practice: Consolidated GuidelineGCP:良好的临床规范:统一的指南E7: Studies in Support of Special Populations: Geriatrics对特定族群的支持的研究:老人病学E8: General Considerations for Clinical Trials对临床试验的总的考虑E9: Statistical Principles for Clinical Trials临床试验的统计原则E10: Choice of Control Group and Related Issues in Clinical Trials临床试验中控制组和有关课题的选择E11: Clinical Investigation of Medicinal Products in the PediatricPopulation小儿科药物的临床调查E12A: Principles for Clinical Evaluation of New Antihypertensive Drugs新抗高血压药物的临床评价原则E14: The Clinical Evaluation of QT/QTc Interval Prolongation and Proarrhythmic Potential for Non-Antiarrhythmic Drugs非抗心率失常药物的QT/QTc间期和致心率失常潜在作用的临床评价Multidisciplinary Guidelines 多学科兼容的指南M1: Medical Terminology医学术语M2: Electronic Standards for Transmission of Regulatory Information (ESTRI)药政信息传递之电子标准M3: Timing of Pre-clinical Studies in Relation to Clinical Trials (SeeSafety Topics)有关临床试验的临床前研究的时间安排M4: The Common Technical Document (See CTD section for complete Status of the guidelines)通用技术文件(见有关CTD章节)M5: Data Elements and Standards for Drug Dictionaries药物词典的数据要素和标准临床试验常用的英文缩略语TTP:time-to-progression 疾病进展时间SAE:severity Adverse Event 严重不良事件AE:Adverse Event 不良事件SOP:Standard Operating Procedure 标准操作规程CRF:Case Report form 病例报告表DLT:剂量限制毒性MTD:最大耐受剂量KPS:Karnofsky Performance Status行为状态评分CR:complete response完全缓解PR:partial response部分缓解SD:病情稳定PD:progressive disease病情进展CTC:常用药物毒性标准IEC:independent ethics committee 独立伦理委员会IRB :institutional review board 伦理委员会CRA:临床研究助理CRO:Contract Research Organization 合同研究组织DFS:Disease Free Survival 无病生存期OS:(Overall Survival)总生存时间IC:Informed consent 知情同意ADR:Adverse Drug Reaction 不良反应GAP:Good Agricultural Practice 中药材种植管理规范GCP:Good Clinical Practice 药物临床试验质量管理规范GLP:Good Laboratory Practice 药品实验室管理规范GMP:Good Manufacturing Practice 药品生产质量管理规范GSP:Good Supply Practice 药品经营质量管理规范GUP:Good Use Practice 药品使用质量管理规范PI :Principal investigator 主要研究者CI:Co-inveatigator合作研究者SI :Sub-investigator 助理研究者COI :Coordinating investigtor协调研究者DGMP:医疗器械生产质量管理规范ICF:Informed consent form 知情同意书RCT :randomized controlled trial, 随机对照试验NRCCT:non-randomized concurrent controlled trial, 非随机同期对照试验EBM:evidence-based medicine 循证医学RCD:randomized cross-over disgn随机交叉对照试验HCT:historial control trial, 历史对照研究RECIST:Response Evaluation Criteria In Solid Tumors. 实体瘤疗效反应的评价标准QC:Quality Control质量控制UADR:Unexpected Adverse Drug Reaction,非预期药物不良反应。
医药研发术语大全

医药研发术语大全1、医药外包(CXO):按产业链环节主要分为:CRO, CMO/CDMO、CSO三个环节,分别服务于医药行业的研发、生产、销售三大环节,可简单理解为研发外包、生产外包、销售外包。
2、新药研发合同外包服务机构(Contract Research Organization,CRO)英文全称Contract Research Organization(CRO),是新药研发合同外包服务机构。
主要通过合同形式向制药企业提供新药临床研究服务的专业公司。
CRO可在短时间内组织起一个具有高度专业化的和具有丰富临床经验的临床研究队伍,并能降低整个制药企业的管理费用。
3、合同生产组织(Contract Manufacturing Organization,CMO):接受制药公司的委托,提供产品生产时所需要的各种服务。
4、合同研发生产组织(Contract Development and Manufacturing Organization,CDMO):Contract Development and Manufacturing Organization, 指的是在医疗领域中定制、研发与生产,是一种在医疗领域新出现的研发外包模式。
它与企业在各个环节深度对接,从临床前的研究到临床试验,最终上市商业化生产销售,为企业带来了更规模化的生产过程与服务,工艺研发方面也为企业带来了不少创新。
CRO主要为跨国制药公司和生物制药提供药物发现、临床前研究、临床试验等新药研发合同研究服务;而CDMO是医药合同定制研发生产企业,主要为跨国制药企业以及生物技术公司提供医药,特别是创新的工艺研发及制备、工艺优化、注册和验证批生产等,定制研发生产服务的机构。
CDMO以工艺为核心,原材料投入占比最大。
5、合同销售外包服务商(Contract Sales Organization,CSO):CSO:Contract Sales Organization,合同销售外包服务商,接受制药企业、药品销售权所有人的委托,提供药物销售、市场营销服务。
常用临床医学英文缩写中英文对照
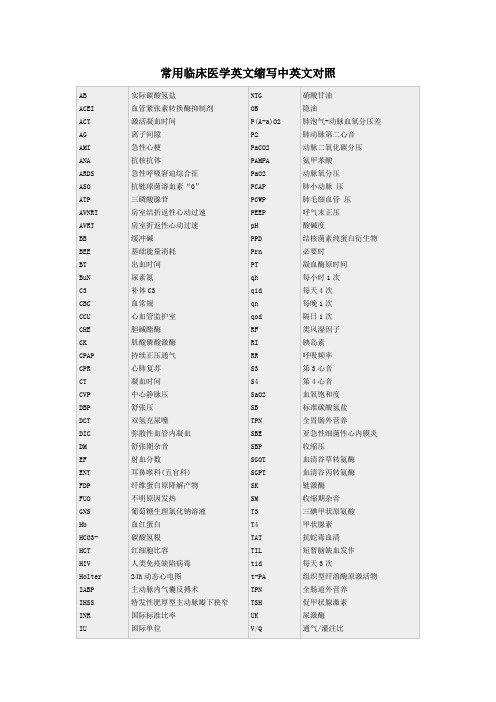
常用临床医学英文缩写中英文对照AB ACEI ACT AG AMI ANA ARDS ASO ATP AVNRT AVRT BB BEE BT BuNC3 CBC CCU CHE CK CPAP CPR CT CVP DBP DCT DIC DMEF ENT FDP FUO GNS Hb HCO3- HCT HIV Holter IABP IHSS INRIU 实际碳酸氢盐血管紧张素转换酶抑制剂激活凝血时间离子间隙急性心梗抗核抗体急性呼吸窘迫综合征抗链球菌溶血素“0”三磷酸腺苷房室结折返性心动过速房室折返性心动过速缓冲碱基础能量消耗出血时间尿素氮补体C3血常规心血管监护室胆碱酯酶肌酸磷酸激酶持续正压通气心肺复苏凝血时间中心静脉压舒张压双氢克尿噻弥散性血管内凝血舒张期杂音射血分数耳鼻喉科(五官科)纤维蛋白原降解产物不明原因发热葡萄糖生理氯化钠溶液血红蛋白碳酸氢根红细胞比容人类免疫缺陷病毒24h动态心电图主动脉内气囊反搏术特发性肥厚型主动脉瓣下狭窄国际标准比率国际单位NTGOBP(A-a)O2P2PaCO2PAMPAPaO2PCAPPCWPPEEPpHPPDPrnPTqhqidqnqodRFRIRRS3S4SaO2SBTPNSBESBPSGOTSGPTSKSMT3T4TATTILtidt-PATPNTSHUKV/Q硝酸甘油隐油肺泡气-动脉血氧分压差肺动脉第二心音动脉二氧化碳分压氨甲苯酸动脉氧分压肺小动脉压肺毛细血管压呼气末正压酸碱度结核菌素纯蛋白衍生物必要时凝血酶原时间每小时1次每天4次每晚1次隔日1次类风湿因子胰岛素呼吸频率第3心音第4心音血氧饱和度标准碳酸氢盐全胃肠外营养亚急性细菌性心内膜炎收缩压血清谷草转氨酶血清谷丙转氨酶链激酶收缩期杂音三碘甲状原氨酸甲状腺素抗蛇毒血清短暂脑缺血发作每天3次组织型纤溶酶原激活物全肠道外营养促甲状腺激素尿激酶通气/灌注比KPTT KUB LDH NS 部分凝血活酶时间腹部平片乳酸脱氢酶生理氯化钠溶液VMAWHO香草基杏仁酸世界卫生组织。
医药英文缩写注释

lent
慢慢地!
Cmax
峰浓度
Id(ic)
皮内注射
AUC
时间曲线下总面积
Ih(sc)
皮下注射
DNA
脱氧核糖核酸
Caps(Cap)
胶囊剂
RNA
核糖核酸
Ung(Oint、Oin)
软膏剂
PCR
聚合酶链式反应
Ocul
眼膏剂
AIDS
获得性免疫缺陷综合征
Gtt(Gutt、Ocust)
滴眼剂
SOD
超氧化物歧化酶
国际制药工程协会
ISO
国际标准化组织
sin
分
MDS
骨髓增生异常综合征
h
小时
MM
多发性骨髓瘤
d
天
HL
霍奇金淋巴瘤
a
年
NHL
非霍奇金淋巴瘤
kg
公斤
BMT
骨髓移植
mcg(μg)
微克
HSCT
造血干细胞移植
mL
毫升
PBSCT
外周血干细胞移植
mmHg
毫米汞柱
CBT
脐血干细胞移植
pH
酸碱度
auto-PBSCT
自体外周血干细胞移植
溶液剂
HAV
甲型肝炎病毒
aa[aa(ans)]
各
HBV
乙型肝炎病毒
ad
加至
HBAg
乙型肝炎抗原
Co(comp)
复方的
HBcAg
乙型肝炎核心抗原
Tab
片剂
HBeAg
乙型肝炎核心相关抗原
Inj
注射剂
HBIG
乙型肝炎免疫球蛋白
医药行业英文缩写

医药行业常用英文缩写释义1.OTC(Over The Counter):非处方药物我国卫生部医政司是这样定义的:它是消费者可不经过医生处方,直接从药房或药店购买的药品,而且是不在医疗专业人员指导下就能安全使用的药品,即不需要凭借执业医师或助理医师的处方即可自行选购、使用的药品。
非处方药英语称Nonprescription Drug,又称之为“可在柜台上买到的药物”(Over The Counter),简称OTC,现已成为国际通用的非处方药简称。
OTC中又分甲类OTC和乙类OTC。
甲类(红色)的可在医院、药店销售,宜遵医嘱服;乙类(绿色)的是可以在医院、药店、超市、宾馆等地方销售,安全性高,不良反应小。
相对于OTC,RX是指必须凭借执业医师或医生开取的处方方可购买的药品。
2.Rx(Receptor,X表示处方的内容):处方药处方药是必须凭执业医师或执业助理医师处方才可调配、购买和使用的药品,英文称Prescription Drug,Ethical Drug。
Rx是国际通用处方药的简称,据说Rx最早是写在一个医学处方前面,是个占星术的一个符号,用来避邪。
后来演变成一个大写的R并且结尾交叉,是拉丁文recipe的缩写,recipe 的意思是请拿、取的意思,是让药房的药剂师按照处方中开的药拿药的意思。
它的写法是一个大写的R,加一撇在它的结尾,打印出来就像Rx。
3.TCM(Traditional Chinese Medicine):中药4.INN(International Nonproprietary Name for Pharmaceutical Substances):国际非专有名称,国际通用名是世界卫生组织给每种药品的一个官方的非专利性名称。
在世界范围内使用不受任何限制,不能取得专利和行政保护。
自1953年WHO的国际非专有名方案实施以来已公布8000个INN,现每年大约要公布150多个INN,目前INN名称已被世界各国采用,任何该药品的生产者都可以使用INN,在药典,科技文献,教材,标签,广告等广泛使用,INN也是药品说明书中标明的有效成分的名称,在复方制剂中只能使用它作为复方组成的使用名称。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
医药行业常用英文缩写释义
1、OTC(Over The Counter):非处方药物
我国卫生部医政司是这样定义的:它是消费者可不经过医生处方,直接从药房或药店购买的药品,而且是不在医疗专业人员指导下就能安全使用的药品,即不需要凭借执业医师或助理医师的处方即可自行选购、使用的药品。
OTC中又分甲类OTC和乙类OTC。
甲类(红色)的可在医院、药店销售;乙类(绿色)的是可以在医院、药店、超市、宾馆等地方销售。
买非处方药(OTC)红绿要分清,包装盒上OTC标识为绿色,安全性高,不良反应小,红色宜遵医嘱服。
相对于OTC,RX是指必须凭借执业医师或医生开取的处方方可购买的药品。
2、GSP(Good Supply Practice):《药品经营质量管理规范》
GSP是英文Good Supplying Practice缩写,直译为良好的药品供应规范,在我国称为《药品经营质量管理规范》。
它是指在药品流通过程中,针对计划采购、购进验收、储存、销售及售后服务等环节而制定的保证药品符合质量标准的一项管理制度。
其核心是通过严格的管理制度来约束企业的行为,对药品经营全过程进行质量控制,保证向用户提供优质的药品。
GSP是控制医药商品流通环节所有可能发生质量事故的因素从而防止质量事故发生的一整套管理程序,医药商品在其生产、经营和销售的全过程中,由于内外因素作用,随时都有可能发生质量问题,必须在所有这些环节上采取严格措施,才能从根本上保证医药商品质量。
药品经营企业应在药品监督管理部门规定的时间内达到GSP要求,并通过认证取得认证证书。
3、GLP(Good Laboratory Practice):药物非临床研究质量管理规范
GLP是英文Good Laboratory Practice 的缩写,中文直译为优良实验室规范。
GLP是就实验室实验研究从计划、实验、监督、记录到实验报告等一系列管理
而制定的法规性文件,涉及到实验室工作的所有方面。
它主要是针对医药、农药、食品添加剂、化妆品、兽药等进行的安全性评价实验而制定的规范。
制定GLP的主要目的是严格控制化学品安全性评价试验的各个环节,即严格控制可能影响实验结果准确性的各种主客观因素,降低试验误差,确保实验结果的真实性。
4、GMP(Good Manufacturing Practice):药品生产质量管理规范
“GMP”是英文Good Manufacturing Practice 的缩写,中文的意思是“良好作业规范”,或是“优良制造标准”,是一种特别注重在生产过程中实施对产品质量与卫生安全的自主性管理制度。
它是一套适用于制药、食品等行业的强制性标准,要求企业从原料、人员、设施设备、生产过程、包装运输、质量控制等方面按国家有关法规达到卫生质量要求,形成一套可操作的作业规范帮助企业改善企业卫生环境,及时发现生产过程中存在的问题,加以改善。
GMP认证,是指由省食品药品监督管理局组织GMP评审专家对企业人员、培训、厂房设施、生产环境、卫生状况、物料管理、生产管理、质量管理、销售管理等企业涉及的所有环节进行检查,评定是否达到规范要求的过程。
5、GUP(Good Use Practice):药品使用质量管理规范
6、GAP(Good Agricultural Practice for Chinese Crude Drug)中药材生产质量管理规范
7、ICH(International Conference on Harmonization of Technical Requirements for
Registration of Pharmaceuticals for Human Use)人用药物注册技术要求国际协调会
为了严格管理药品,必须对药品的研制、开发、生产、销售、进品等进行审批,形成了药品的注册制度。
但是不同国家对药品注册要求各不相同,这不仅不利于病人在药品的安全性、有效性和质量方面得到科学的保证及国际技术和贸易交
流,同时也造成制药工业和科研、生产部门人力、物力的浪费,不利于人类医药事业的发展。
因此,由美国、日本和欧盟三方的政府药品注册部门和制药行业在1990年发起的ICH(人用药物注册技术要求国际协调会议)就是这样应运而生的。
8、NMR(Nuclear Magnetic Resonance):核磁共振。
是磁矩不为零的原子核,在外磁场作用下自旋能级发生蔡曼分裂,共振吸收某一定频率的射频辐射的物理过程。
核磁共振波谱学是光谱学的一个分支,其共振频率在射频波段,相应的跃迁是核自旋在核蔡曼能级上的跃迁。
国内叫NMR,国外叫MR,因为国外比较避讳Nuclear这个单词。
9、HPLC(High Performance Liquid Chromatography):高效液相色谱法
又称“高压液相色谱”、“高速液相色谱”、“高分离度液相色谱”、“近代柱色谱”等。
高效液相色谱是色谱法的一个重要分支,以液体为流动相,采用高压输液系统,将具有不同极性的单一溶剂或不同比例的混合溶剂、缓冲液等流动相泵入装有固定相的色谱柱,在柱内各成分被分离后,进入检测器进行检测,从而实现对试样的分析。
10、MS(mass spectrometry):质谱法
质谱法(Mass Spectrometry, MS),即用电场和磁场将运动的离子(带电荷的原子、分子或分子碎片)按它们的质荷比分离后进行检测的方法。
测出了离子的准确质量,就可以确定离子的化合物组成。
这是由于核素的准确质量是一多位小数,决不会有两个核素的质量是一样的,而且决不会有一种核素的质量恰好是另一核素质量的整数倍。
11、TCM(Traditional Chinese Medicine):中药。
