高考化学二轮复习 专题突破高考真题 18 电解质溶液
高考化学二轮专题复习 电解质溶液精品教考案(含13真题及名校质检题)

电解质溶液【考情分析】一、考纲要求1.了解电解质的概念。
了解强电解质和弱电解质的概念。
2.了解电解质在水溶液中的电离,以及电解质溶液的导电性。
3.了解弱电解质在水溶液中的电离平衡。
4.了解水的电离,离子积常数。
5.了解溶液pH的定义。
了解测定溶液pH的方法,能进行pH的简单计算。
6.了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用。
7.了解离子反应的概念、离子反应发生的条件。
了解常见离子的检验方法。
8.了解难溶电解质的溶解平衡及沉淀转化的本质。
二、命题趋向电解质溶液部分内容与旧大纲相比有一定的变化,删除了“了解非电解质的概念”,增加了“了解难溶电解质的沉淀溶解平衡及沉淀转化的本质”,降低了弱电解质电离平衡的要求层次,对pH、盐的水解的知识进行了具体的要求,将原化学计算中的“pH的简单计算”放在这部分的要求之中。
弱电解质的电离平衡、溶液的酸碱性和pH的计算、盐类的水解及其应用等知识是高考化学中的热点内容,常见的题型是选择题,也有填空题和简答题。
题目的考查点基于基础知识突出能力要求,并与其他部分知识(如化学平衡、物质结构、元素及其化合物、化学计算等)联系。
【知识归纳】(一)强弱电解质及其电离1.电解质、非电解质的概念电解质:在水溶液中或熔融状态时能够导电的化合物。
非电解质:在水溶液中和熔融状态都不能导电的化合物。
注意:①单质和混合物既不是电解质也不是非电解质;②CO2、NH3等溶于水得到的水溶液能导电,但它们不是电解质,因为导电的物质不是其本身;③难溶的盐(BaSO4等)虽然水溶液不能导电,但是在融化时能导电,也是电解质。
2.电解质的电离(1)强电解质如NaCl、HCl、NaOH等在水溶液中是完全电离的,在溶液中不存在电解质分子,溶液中的离子浓度可根据电解质浓度计算出来。
(2)弱电解质在水溶液中是少部分发生电离的。
如25℃时0.1mol/L的CH3COOH溶液中,CH3COOH的电离度只有1.32%,溶液中存在较大量的H2O和CH3COOH分子,少量的H+、CH3COO-和极少量的OH-离子。
2018年高考真题电解质溶液汇编
2018年高考真题电解质溶液汇编(2018.全国I卷27)(4)Na2S2O5可用作食品的抗氧化剂。
在测定某葡萄酒中Na2S2O5残留量时,取50.00mL葡萄酒样品,用0.01000mol·L-1的碘标准液滴定至终点,消耗10.00mL。
滴定反应的离子方程式为__________________________________________,g L-⋅(以SO2计)。
该样品中Na2S2O5的残留量为_______1(2018.全国II卷28)(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L–1KMnO4溶液滴定至终点。
滴定终点的现象是________________________________________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。
加稀H2SO4酸化,用c mol·L–1KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。
该晶体中铁的质量分数的表达式为________________。
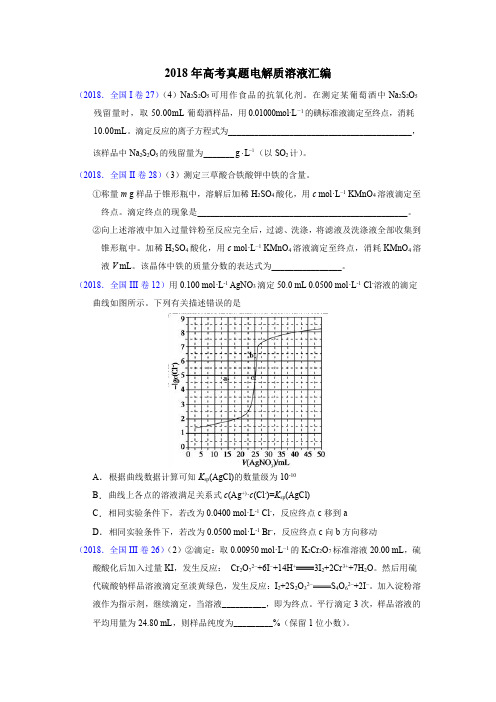
(2018.全国III卷12)用0.100mol·L-1AgNO3滴定50.0mL0.0500mol·L-1Cl-溶液的滴定曲线如图所示。
下列有关描述错误的是A.根据曲线数据计算可知K sp(AgCl)的数量级为10-10B.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=K sp(AgCl)C.相同实验条件下,若改为0.0400mol·L-1Cl-,反应终点c移到aD.相同实验条件下,若改为0.0500mol·L-1Br-,反应终点c向b方向移动(2018.全国III卷26)(2)②滴定:取0.00950mol·L−1的K2Cr2O7标准溶液20.00mL,硫酸酸化后加入过量KI,发生反应:Cr2O72−+6I−+14H+3I2+2Cr3++7H2O。
老高考旧教材适用2023版高考化学二轮复习专题八电解质溶液pptx课件

ΔH>0
为例]
溶度积(Ksp)的大小只与难溶电解质的性质和溶液的温度有关
条件变化
升高温度
加水稀释
加入少量AgNO3(s)
加入少量NaCl(s)
通入H2S(g)
平衡移动方向
向右移动
向右移动
向左移动
向左移动
向右移动
平衡后c(Ag+)
增大
不变
增大
减小
减小
平衡后c(Cl-)
增大
不变
减小
增大
增大
Ksp
增大
不变
分微粒浓度的对数lg c与pH的关系如
图所示。已知HX为一元弱酸,lg 2≈0.3。
下列说法错误的是( B )
A.曲线代表lg c(HX)与pH的关系
B.甲、乙之间溶液存在c(Na+)>c(HX)>c(X-)
C.0.2 mol·L-1NaX溶液的pH≈11.3
D.加水稀释甲点混合溶液,交点甲沿OH-线向左下移动
C.X点时溶液的pH=5
D.Ka2(H2A)=10-8
2(HA
)
(A
)
+
c水(H )与 lg
、lg
(H2 )
(HA-)
提示 当 lg
(HA -)
(A 2- )
(HA - )
(HA )
(H 2 )
=lg
(H 2 )
=1 时,即
-
=
(A 2- )
2=10,HA
和
A
水解会促进水的
不变
不变
不变
[命题角度]
角度1电离平衡和溶液的酸碱性
【典例】 已知25 ℃时二元酸H2A的Ka1 =1.3×10-7, Ka2 =7.1×10-15。下列
【附20套精选模拟试卷】高考化学二轮专题复习:电解质溶液-真题回顾(含答案解析)

考点搜索考纲要求:1、了解弱电解质在水溶液中的电离平衡。
2、了解水的电离,离子积常数。
3、了解溶液pH的定义。
了解测定溶液pH的方法,能进行pH的简单计算。
4、了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用。
5、了解难溶电解质的溶解平衡及沉淀转化的本质。
6、以上各部分知识的综合应用考纲解读:电解质溶液部分是历年高考的必考内容,题型主要是选择题和填空题,主要考查离子浓度比较、弱电解质的电离平衡、酸碱混合溶液酸碱性判断即pH值计算、盐的水解、沉淀溶解平衡及沉淀的转化等内容,其中沉淀溶解平衡是新课标中新增内容。
近几年,离子浓度比较、沉淀溶解平衡及转化成为考查的较多,解此类题,要注意其既与盐类的水解有关,又与弱电解质的电离平衡有关,题目不仅注重考查溶液中粒子浓度大小的顺序,还侧重溶液中三大(电荷、物料、质子)守恒关系的考查,因而题目具有一定的综合性、灵活性、技巧性。
要点回顾一、弱电解质的电离平衡1、电解质定义:在水溶液或熔融状态下能够导电的化合物。
分类:在水溶液里完全电离的电解质是强电解质,部分电离的电解质是弱电解质。
注意:①无论是电解质还是非电解质都必须是化合物;②电解质必须是本身能电离出离子;③电解质溶液的导电能力由自由移动的离子的浓度与离子所带的电荷数决定,与电解质的强弱无关。
④难溶盐(如:BaSO4、AgCl、CaCO3等)一般是强电解质,尽管难溶,但溶于水的那部分是完全电离的。
而许多难溶性碱(如Al(OH)3)却是弱电解质。
常见的强弱电解质:⑴强电解质:①强酸:HCl、H2SO4、HNO3、HClO4、HBr、HI、HMnO4;②强碱:NaOH、Ca(OH)2、Ba(OH)2、OH、RbOH…③大部分盐:BaSO4、AgNO3、CaCO3等。
⑵弱电解质:①弱酸:如H2S、H2CO3、CH3COOH、HF、HCN、HClO等。
HF酸是具有强极性共价键的弱电解质。
H3PO4、H2SO3从其酸性强弱看属于中强酸,但仍属于弱电解质。
2018高考化学二轮复习专题突破测练一物质的组成分类和变化化学用语

的一
分_
散-
系-
属-
丄
胶一
体一
,-
A_
项一
对一
亠
二
钻-
Bi-
菁-
_
分-
丄
能-
透-
过一
滤-
纸一
但
不
能-
透-
旦
半
透-
膜-
亠
皀
项一
错-
依
据
信
息
,
磁
性
是
物
理
性
质
,
C
项
对
由
高
中
理
、
化
、
生
知
识
可
知
磁
性
可
联
系
物
理
中
的
光
电
知
识
与
血
红
素
及
叶
绿
素
的
结
构
和
性
质
相
似
可
联
系
生
物
中
的
生
物
技
术
知
识
D
项
对
答
案
:
B
13
-
雾
霾
是
雾
玻璃都是
混,
合 口物
勿
C
•
HD|
HC
;H都是化合物
L
D
•十冰
K、可燃
冬冰都
►
是纯?
争物
W\~
解:
析:「A项,N02不是
!酸性
生氧化
高考化学二轮复习专题八电解质溶液

专题八电解质溶液A组基础巩固练1.(2022广东广州一模)溴甲基蓝(用HBb表示)指示剂是一元弱酸,HBb为黄色,Bb-为蓝色。
下列叙述正确的是( )A.0.01 mol·L-1 HBb溶液的pH=2B.HBb溶液的pH随温度升高而减小C.向NaOH溶液中滴加HBb指示剂,溶液显黄色D.0.01 mol·L-1 NaBb溶液中,c(H+)+c(Na+)=c(Bb-)+c(HBb)2.(2022河北张家口一模)联氨(N2H4)溶于水后是一种二元弱碱,在水中的电离方式与氨相似。
25 ℃时,K b1(N2H4)=8.5×10-7,K b2(N2H4)=8.9×10-16。
下列说法错误的是 ( )A.0.10 mol·L-1的N2H5Cl溶液呈酸性B.N2H4的第二步电离方程式为N2+H2O N2+OH-C.N2H4与稀硫酸中和生成的酸式盐的化学式为N2H5HSO4D.N2H4的稀溶液中存在c(OH-)=c(N2)+2c(N2)+c(H+)3.(2022广东梅州一模)甲胺(CH3NH2)为一元弱碱,可与盐酸反应生成盐酸盐(用CH3NH3Cl表示)。
将10 mL 0.1 mol·L-1 CH3NH2溶液与10 mL 0.1 mol·L-1盐酸混合。
下列叙述不正确是( )A.混合溶液呈酸性,加水稀释,n(H+)增加B.甲胺在水中的电离方程式为CH3NH2+H2O CH3N+OH-C.混合溶液中:c(CH3N)+c(Cl-)<0.1 mol·L-1D.往混合液中滴加少量NaOH溶液,可促进CH3N的水解,水解常数K h增大4.(2022内蒙古包头第二次模拟)25 ℃时,在0.10 mol·L-1的H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液的pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。
近年高考化学二轮复习 专题突破 电解质溶液检测题(2021年整理)

2017高考化学二轮复习专题突破电解质溶液检测题编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2017高考化学二轮复习专题突破电解质溶液检测题)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2017高考化学二轮复习专题突破电解质溶液检测题的全部内容。
专题九电解质溶液【夯实基础】1.对于常温下pH为1的硝酸溶液,下列叙述正确的是( )A.向该溶液中加入pH为13的氢氧化钡溶液恰好完全中和B.该溶液1 mL稀释至100 mL后,pH等于3C.该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为10-12D.该溶液中水电离出的c(H+)是pH为3的硝酸中水电离出的c(H+)的100倍2.短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是()A.W2-、X+ B.X+、Y3+ C.Y3+、Z2- D.X+、Z2-3。
能够使醋酸溶液的pH值和醋酸的电离度都减小的是( )A. 加入少许水稀释 B。
滴加少量H2SO4溶液C. 滴加少量NaCl溶液D. 加入少许醋酸钠晶体4。
常温下,下列有关电解质溶液的叙述正确的是 ( )A.等浓度等体积的强酸与强碱溶液混合后,溶液的pH=7B.将10mLpH=a的盐酸与100mLpH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13C。
pH=10的Ba(OH)2溶液和pH=13的NaOH溶液等体积混合后溶液的pH=10.7(lg 2=0.3)D。
pH=2的盐酸与pH=12的氨水等体积混合后所得溶液显中性5。
准确移取20。
00mL某待测HCl溶液于锥形瓶中,用0.1000mol·L-1NaOH溶液滴定。
高考化学二轮复习 电解质溶液(配2013高考真题分类详解)

高考化学二轮复习 电解质溶液(配2013高考真题分类详解)1.(2013·高考新课标全国卷Ⅰ)已知K sp (AgCl)=1.56×10-10,K sp (AgBr)=7.7×10-13,K sp (Ag 2CrO 4)=9.0×10-12。
某溶液中含有Cl -、Br -和CrO 2-4,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L -1的AgNO 3溶液时,三种阴离子产生沉淀的先后顺序为( )A .Cl -、Br -、CrO 2-4B .CrO 2-4、Br -、Cl -C .Br -、Cl -、CrO 2-4D .Br -、CrO 2-4、Cl -解析:选C 。
利用沉淀溶解平衡原理,当Q c >K sp 时,有沉淀析出。
溶液中Cl -、Br -、CrO 2-4的浓度均为0.010 mol·L -1,向该溶液中逐滴加入0.010 mol·L -1的AgNO 3溶液时,溶解度小的先满足Q c >K sp ,有沉淀析出。
比较K sp ,AgBr 、AgCl 同类型,溶解度:AgBr<AgCl 。
比较AgCl 、Ag 2CrO 4的溶解度:从数量级看,AgCl 中c (Ag +)=K sp AgCl= 1.56×10-10,Ag 2CrO 4中,Ag 2CrO 4(s)2Ag ++CrO 2-4,设c (CrO 2-4)=x ,则K sp (Ag 2CrO 4)=c 2(Ag +)·c (CrO 2-4)=(2x )2·x =4x 3,则x =3K sp Ag 2CrO 44=39.0×10-124。
故Ag 2CrO 4中c (Ag +)=2x =2 39.0×10-124> 1.56×10-10,故溶解度顺序为AgBr<AgCl<Ag 2CrO 4,推知三种阴离子产生沉淀的先后顺序为Br -、Cl -、CrO 2-4。
最新高考化学二轮复习专题突破:1-8《电解质溶液》ppt课件

第10页
名师伴你行 · 高考二轮复习 · 化学
基 础 记 忆
10.在滴定过程中,左手控制活塞或玻璃小球,右手摇动 锥形瓶,两眼注视滴定管内液面的变化。( )
试 做 真 题
11.NH4Cl溶液呈酸性的原因:NH4Cl溶于水时电离出的
热 点 盘 点
NH
+
4
与水电离出的OH 结合成弱电解质NH3· H2O,消耗了溶液
提 能 专 训
题 源 追 跟
(
)
[二轮备考讲义]
第一部分 第8讲
第 8页
名师伴你行 · 高考二轮复习 · 化学
基 础 记 忆
6.溶液酸碱性的实质是溶液中c(H )和c(OH )的相对大 小。在任意温度下的溶液中,当c(H+)>c(OH-)时,溶液呈酸 性;当c(H+)=c(OH-)时,溶液呈中性;当c(H+)<c(OH-)时,
[二轮备考讲义]
第一部分 第8讲
第 2页
名师伴你行 · 高考二轮复习 · 化学
基 础 记 忆
试 做 真 题
热 点 盘 点
第 8讲
电解质溶液
提 能 专 训
题 源 追 跟
[二轮备考讲义]
第一部分 第8讲
第 3页
名师伴你行 · 高考二轮复习 · 化学
基 础 记 忆
试 做 真 题
热 点 盘 点
基础记忆
思维对接
名师伴你行 · 高考二轮复习 · 化学
基 础 记 忆
试 做 真 题
热 点 盘 点
[二轮备考讲义]
提 能 专 训
题 源 追 跟
[二轮备考讲义]
第一部分 第8讲
第 1页
2021年高考化学二轮专题强化练习(九)--电解质溶液(含答案)

答案:A2.室温时,M(OH)2(s)M2+(aq)+2OH-(aq)K sp=a,c(M2+)=b mol·L-1时,溶液的pH等于()1b1a应:Na2CO3+H2SO4===Na2SO4+CO2↑+H2O,反应后溶质为Na2SO4,根据物料守恒反应结束后c(Na+)=2c(SO2-4);B项正确。
向溶液中加入0.05 mol CaO,则CaO+H2O=Ca(OH)2,则c(OH-)增大,且Ca2++CO2-3=CaCO3↓,使CO2-3+H2O HCO-3+OH-平衡向左移,c(HCO-3)减小,故c(OH-)c(HCO-3)增大;C项错误。
加水稀释有利于水解,CO2-3+H2O HCO-3+OH-水解平衡向右移动,水电离出的n(H+),n(OH-)均增大,但稀释后c(H+),c(OH -)均降低。
D项错误。
加入0.1 mol NaHSO4固体,NaHSO4===Na ++H++SO2-4,CO2-3+2H+===CO2↑+H2O,则反应后溶液为Na2SO4溶液,溶液呈中性,故溶液的pH减小,但引入了Na+,故c(Na+)增大。
答案:BB.0.1 mol·L-1的NaHCO3溶液中:c(OH-)+2c(CO2-3)=c(H +)+c(H2CO3)C.25℃时,向0.1 mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO2-4)>c(NH+4)>c(OH-)=c(H+)D.25℃时,将pH均为3的醋酸溶液和盐酸分别加水稀释到pH均为5,则由水电离出的H+的浓度均减小为原来的100倍答案:C8.25℃时,在10 mL浓度均为0.1 mol·L-1的NaOH和NH3·H2O混合溶液中滴加0.1 mol·L-1盐酸,下列有关溶液中粒子浓度关系正确的是()A.未加盐酸时:c(OH-)>c(Na+)=c(NH3·H2O)B.加入10 mL盐酸时:c(NH+4)+c(H+)=c(OH-)C.加入盐酸至溶液pH=7时:c(Cl-)=c(Na+)D.加入20 mL盐酸时:c(Cl-)=c(NH+4)+c(Na+)解析:A项,NH3·H2O是弱电解质,能微弱电离,溶液中c(Na +)>c(NH3·H2O)。
2022届高考化学二轮复习 化学反应原理 专练(2)电解质溶液问题的突破

(2)电解质溶液问题的突破1.吸收工厂烟气中的2SO ,能有效减少2SO 对空气的污染。
氨水、ZnO 水悬浊液吸收烟气中2SO 后经2O 催化氧化,可得到硫酸盐。
已知:室温下,3ZnSO 微溶于水,()32Zn HSO 易溶于水;溶液中23H SO 、3HSO -、23SO -的物质的量分数随pH 的分布如图1所示。
(1)氨水吸收2SO 。
向氨水中通入少量2SO ,主要反应的离子方程式为__________________________;当通入2SO 至溶液pH=6时,溶液中浓度最大的阴离子是______(填化学式)。
(2)ZnO 水悬浊液吸收2SO 。
向ZnO 水悬浊液中匀速缓慢通入2SO ,在开始吸收的40min 内,2SO 吸收率、溶液pH 均经历了从几乎不变到迅速降低的变化(见图2)。
溶液pH 几乎不变阶段,主要产物是______(填化学式);2SO 吸收率迅速降低阶段,主要反应的离子方程式为______。
(3)2O 催化氧化。
其他条件相同时,调节吸收2SO 得到溶液的pH 在4.5~6.5范围内,pH越低24SO -生成速率越大,其主要原因是_________________;随着氧化的进行,溶液的pH将_________(填“增大”“减小”或“不变”)。
2.碳酸及碳酸盐与自然界碳的循环有着密切的联系。
(1)已知常温常压下,空气中的2CO 溶于水,达到平衡时,溶液的pH=5.60,()5123H CO 1.510mol L c --=⨯⋅。
若忽略水的电离及23H CO 的第二级电离,则233H CO HCO H -++的平衡常数1=K ______。
(已知 5.60610 2.510--=⨯)(2)已知23H CO 的第二级电离常数211a 5.610K -=⨯,HClO 的电离常数83.0=10K -⨯,写出下列所发生反应的离子方程式:a.少量2Cl 通入过量的23Na CO 溶液中:_____________________________。
高考化学专题复习——电解质溶液

第八单元电解质溶液一、电离平衡1.电解质与非电解质(1)概念电解质:在熔融状态或溶液状态下能导电的化合物非电解质:在熔融状态和溶液状态下都不能导电的化合物[讨论]1.如何用实验区分电解质与非电解质?2.金属Cu常用作导线,NH3的水溶液能导电,能否Cu 、NH3说明是电解质?3.总结金属导电与电解质导电的区别。
(2)电解质溶液的导电其实质是电解质溶液的电解过程,其导电能力的大小取决于离子浓度的大小。
[讨论] 1.如何区别离子化合物和共价化合物?2.在0.1mol/LBa(OH)2溶液中逐滴滴入0.1mol/LH2SO4溶液,溶液的导电能力将如何变化?试画出草图。
3.强电解质溶液的导电能力是否一定比弱电解质溶液强?2.强电解质与弱电解质(1)概念[讨论]如何用简单实验来证明醋酸是弱酸?①②③④……(2)电离与电离方程式[例1]写出下列物质在水中发生电离的方程式NaCl、HCl、CH3COOH、NH3·H2O、H2CO3、H3PO4、Al(OH)33.弱电解质的电离—电离平衡(1)电离平衡在一定条件下,当电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就达到了平衡状态,称为电离平衡(2)影响电离平衡的因素①浓度同一弱电解质,通常是溶液越稀,电离程度越大②温度升高温度,电解质的电离程度增大③外加试剂的影响[例2]对于0.1mol/LCH3COOH溶液,采用何种措施,能使醋酸的电离程度减小而溶液的pH值增大的是A.加入一定体积的0.1mol/L的NaOH溶液B.加入等体积的水C.加入少量固体醋酸钠D.加热二、水的电离、溶液的pH值研究电解质溶液时往往涉及到溶液的酸碱性,而溶液的酸碱性与水的电离有着密切的联系。
1.水的电离、水的离子积(1)水是一个极弱的电解质。
存在极弱的电离:H2O H++OH- 或H2O+H2O H3O++OH-其特点是自身作用下发生的极微弱的电离,类似的还有:2NH3NH2-+NH4+(2)水的离子积在25℃时,纯水中的c(H+)=c(OH-)=10-7mol/L①K w= c(H+)·c(OH-)=10-14②水的离子积适用于所有稀的水溶液,而不论其是酸性、碱性或中性溶液③水的离子积随温度升高而增大[讨论]1.计算25℃时,纯水中平均多少个水分子中有1个水分子发生电离。
高考化学二轮专题复习【专题3】电解质溶液(31页,含答案)

学案9 电解质溶液最新考纲展示 1.了解电解质的概念;了解强电解质和弱电解质的概念。
2.了解电解质在水溶液中的电离,以及电解质溶液的导电性。
3.了解弱电解质在水溶液中的电离平衡。
4.了解水的电离、水的离子积常数。
5.了解溶液pH的定义;了解测定溶液pH的方法,能进行pH的简单计算。
6.了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用。
7.了解难溶电解质的沉淀溶解平衡,了解溶度积的含义及其表达式,能进行相关的计算。
基础回扣1.NH3·H2O在水溶液中的电离方程式为_____________________________________________,其电离常数表达式为_____________________________________________________________。
只改变下列一种条件:①升高温度②加水稀释③加少量NaOH(s) ④通少量HCl(g) ⑤加入NH4Cl(s) ⑥加入Na2CO3(s)其中能实现下列要求的是:(1)使电离平衡正向移动的有________。
(2)使c(NH+4)减小的有________。
(3)使c(H+)增大的有________。
(4)使平衡常数K b增大的有________。
答案NH3·H2O NH+4+OH-K b=c(NH+4)·c(OH-) c(NH3·H2O)(1)①②④(2)②③⑥(3)①②④⑤(4)①2.有下列几种物质:①NH3·H2O ②NH4Cl③(NH4)2SO4④NH4HSO4⑤NH4HCO3⑥Na2CO3⑦NaHCO3⑧NaOH按要求回答问题:(1)能促进水的电离且溶液呈酸性的是________。
(2)同浓度的①~④的溶液中c(NH+4)由大到小的顺序是____________________。
(3)常温下,同浓度⑤~⑧溶液,pH由小到大的顺序是________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【名师伴你行】2015届高考化学二轮复习专题突破高考真题 1-8电解质溶液1.(2014·上海高考)向饱和澄清石灰水中加入少量CaC2,充分反应后恢复到原来温度,所得溶液中( )A.c(Ca2+)、c(OH-)均增大B.c(Ca2+)、c(OH-)均保持不变C.c(Ca2+)、c(OH-)均减小D.c(OH-)、c(H+)减小答案:B 解析:本题考查物质的溶解度,饱和的澄清石灰水加入少量CaC2,虽然CaC2和水反应产生Ca(OH)2,但由于反应后恢复到原来温度,溶解度不变,溶液中溶质的浓度也不会改变,所以选B,但溶液中各物质的量都在减少。
2.(2014·福建理综)下列关于0.10 mol·L-1 NaHCO3溶液的说法正确的是( )A.溶质的电离方程式为NaHCO3===Na++H++CO2-3B.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大C.离子的浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO-3)+c(CO2-3)D.温度升高,c(HCO-3)增大答案:B 解析:A项中HCO-3不能拆开,正确的电离方程式为NaHCO3===Na++HCO-3,A项错误;B项,n(H+)×n(OH-)=[c(H+)×V]×[c(OH-)×V]=[c(H+)×c(OH-)]×(V×V)=K w·V2,由于水的离子积不变而溶液体积增大,故n(H+)×n(OH-)的值增大,B项正确;由电荷守恒可知:c(Na+)+c(H+)=c(OH-)+c(HCO-3)+2c(CO2-3),C项错误;温度升高,HCO-3水解程度增大,反应HCO-3+H2O H2CO3+OH-平衡右移,HCO-3浓度减小,D项错误。
3.(2014·四川理综)下列溶液中粒子的物质的量浓度关系正确的是( )A.0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO2-c(HCO-3)>c(OH-)3)>B.20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H +)>c(NH+c(OH-)4)+D.0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH)答案:B 解析:二者反应恰好生成Na2CO3,溶液中离子浓度大小关系为c(Na +)>c(CO2-c(OH-)>c(HCO-3)>c(H+),A项错误;二者反应后得到等物质的量浓度的NaCl、3)>CH3COONa和CH3COOH的混合溶液,且CH3COOH的电离程度大于CH3COO-的水解程度,B项正确;所得溶液呈碱性,则c(H+)<c(OH-)、c(Cl-)<c(NH+4),即c(Cl-)+c(H+)<c(NH+4)+c(OH-),C 项错误;二者恰好反应生成CH3COONa,根据电荷守恒和物料守恒可得c(OH-)=c(H+)+c(CH3COOH),D项错误。
4.(2014·江苏理综)25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( ) A.0.1 mol·L-1CH3COONa溶液与0.1 mol·L-1 HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)B.0.1 mol·L-1 NH4Cl溶液与0.1 mol·L-1氨水等体积混合(pH>7):c(NH3·H2O)>c(NH+4)>c(Cl-)>c(OH-)C.0.1 mol·L-1 Na2CO3溶液与0.1 mol·L-1NaHCO3溶液等体积混合:23c(Na+)=c(CO2-3)+c(HCO-3)+c(H2CO3)D.0.1 mol·L-1 Na2C2O4溶液与0.1 mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O2-4)+c(HC2O-4)+c(OH-)=c(Na+)+c(H+)答案:AC 解析:A项,两种溶液等体积混合,CH3COONa与HCl恰好完全反应生成0.05 mol·L-1 NaCl和0.05 mol·L-1 CH3COOH,由于CH3COOH是弱酸,部分电离,c(Na+)=c(Cl-)=0.05 mol·L-1>c(CH3COO-)>c(OH-),A项正确;B项,等浓度的NH4Cl溶液和氨水混合,溶液呈碱性,说明NH3·H2O的电离程度大于NH+4的水解程度,故c(NH+4)>c(NH3·H2O),B项错误;C项,根据物料守恒可知正确;D项,由电荷守恒可得:2c(C2O2-4)+c(HC2O-4)+c(OH-)+c(Cl -)=c(Na+)+c(H+),D项错误。
5.(2013·四川理综)室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:下列判断不正确的是( )A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=K W1×10-9mol·L-1C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol·L-1D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)答案:B 解析:依据电荷守恒c(K+)+c(H+)=c(OH-)+c(A-),pH=9可知c(OH-)>c(H +),所以c(K+)>c(A-),A项正确;实验①中根据电荷守恒c(OH-)+c(A-)=c(H+)+c(K+),则c (K +)-c (A -)=c (OH -)-c (H +),B 项错误;因反应后pH =7,则x 应大于0.2,依据物料守恒c (HA)+c (A -)=x 2mol·L -1,c (A -)+c (HA)>0.1 mol·L -1,C 项正确;由反应后pH =7得c (OH -)=c (H +),据电荷守恒得c (K +)=c (A -)>c (OH -)=c (H +),D 项正确。
6.(2014·浙江理综)氯在饮用水处理中常用作杀菌剂,且HClO 的杀菌能力比ClO -强。
25 ℃时氯气氯水体系中存在以下平衡关系:Cl 2(g)Cl 2(aq) K 1=10-1.2 Cl 2(aq)+H 2O HClO +H ++Cl - K 2 =10-3.4 HClO H ++ClO - K a =?其中Cl 2(aq)、HClO 和ClO -分别在三者中所占分数(α)随pH 变化的关系如图所示。
下列表述正确的是( )A .Cl 2(g)+H 2O 2H + +ClO - +Cl - K =10-10.9 B .在氯处理水体系中,c (HClO)+c (ClO -)=c (H +)-c (OH -)C .用氯处理饮用水时,pH =7.5时杀菌效果比pH =6.5时差D .氯处理饮用水时,在夏季的杀菌效果比在冬季好答案:C 解析:Cl 2(g)+H 2O2H ++ClO -+Cl - K =K 1×K 2×K a ,由图可得K a =10-7.5,故K 值为10-12.1,A 项错误;根据电荷守恒得,c (H +)=c (OH -)+c (ClO -)+c (Cl -),而c (HClO)由于部分电离而不等于c (Cl -),B 项错误;已知HClO 的杀菌能力比ClO -强,从图中可知,c (HClO)在pH =7.5时比在pH =6.5时低,则杀菌效果较差,C 项正确;夏季温度高,氯的溶解能力变差,杀菌效果也变差,D 项错误。
7.(2013·北京理综)实验:①0.1 mol·L -1 AgNO 3溶液和0.1 mol·L -1NaCl 溶液等体积混合得到浊液a ,过滤得到滤液b 和白色沉淀c ;②向滤液b 中滴加0.1 mol·L -1 KI 溶液,出现浑浊;③向沉淀c中滴加0.1 mol·L-1 KI溶液,沉淀变为黄色。
下列分析不正确的是( )A.浊液a中存在沉淀溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq)B.滤液b中不含有Ag+C.③中颜色变化说明AgCl转化为AgID.实验可以证明AgI比AgCl更难溶答案:B 解析:由题干信息可推知,AgNO3溶液和NaCl溶液恰好反应,AgNO3+NaCl===AgCl↓+NaNO3,沉淀c为AgCl(白色),滤液b为NaNO3溶液,AgCl虽然为难溶性物质,但在水中仍有少量溶解,故滤液b中仍有极少量的Ag+,当加入KI溶液时,Ag++I-===AgI↓,生成了溶解度更小的AgI沉淀。
故可判定B项错误,其他选项正确。
8.(2013·山东理综)某温度下,向一定体积0.1 mol·L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示,则( )A.M点所示溶液的导电能力强于Q点B.N点所示溶液中c(CH3COO-)>c(Na+)C.M点和N点所示溶液中水的电离程度相同D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积答案:C 解析:醋酸为弱酸,向其溶液中逐滴加入等浓度NaOH时,生成强电解质CH3COONa,溶液导电性逐渐增强,则Q点导电能力强于M点,故A错误;图中N点pH> pOH,即c(H+)<c(OH-),根据溶液中电荷守恒:c(H+)+c(Na+)=c(OH-)+c(CH3COO-),所以c(CH3COO -)<c(Na+),故B错误;由图知,M点pOH=b,则溶液中c(OH-)=10-b;N点pH=b,则溶液中c(H+)=10-b,即M与N点水的电离程度相同,C正确;D项,若消耗NaOH溶液体积与醋酸溶液体积相同时,二者恰好完全反应生成酸酸钠,醋酸钠溶液水解呈碱性,而Q点pH=pOH,即c(H+)=c(OH-),溶液呈中性,故D错误。
