第十二部分醛和酮教学课件
合集下载
第十二章-醛和酮-ppt

若用KMnO4氧化,则 C=C 断开!
酮类一般不易被氧化;但工业上:
O
浓HNO3 铜钒催化剂
环己酮
CH2CH2COOH CH2CH2COOH
己二酸(尼龙-66原料)
(乙) 还原反应
(A) C=O [H] CH-OH [H]=H2/Ni、NaBH4 、LiAlH4 、[(CH3)2CHO]3Al 、 不还原双键!
2HCHO 浓NaOH HCOONa + CH3OH
甲醛
甲酸钠
甲醇
2
CHO 浓NaOH
苯甲醛
COONa +
苯甲酸钠
CH2OH
苯甲醇
若反应物之一是甲醛,则一定是甲醛被氧化,另一分子被还原:
CHO + HCHO 浓NaOH
CH2OH + HCOONa
本章重点:
①羰基上亲核加成反应; ②羟醛缩合反应、碘仿反应及Cannizarro反应; ③醛与Tollen’s及Fehlling’s的反应; ④羰基还原为羟基的反应,羰基还原为亚甲基的
(CH3)
① HCHO>CH3CHO>ArCHO>CH3COCH3>CH3COR>RCOR >ArCOAr 即: 醛的活性大于酮;脂肪族大于芳香族。
② p-NO2-C6H4-CHO>ArCHO>p-CH3-C6H4-CHO ③ 例外:C6H5COCH3>(CH3)3CCOC(CH3)3 (后者的空间位阻大) 反应范围:所有的醛、脂肪族甲基酮、八个碳以下的环酮。
(2) α-氢原子的反应
(甲) 卤化反应 (乙) 缩合反应
(3) 氧化和还原
(甲) 氧化反应 (乙) 还原反应 (丙) Cannizzaro反应(岐化
反应)
(五) 醛和酮的化学性质
醛和酮PPT演示课件

(2)羰基化合物是极性化合物。
13
(二)醛、酮的物理性质
1、状:常温下,甲醛是气体,低、中级醛、酮是液体, 高级醛、酮是固体。
2、味:低级醛有强烈的刺激气味,低级酮有特殊气味, 中级醛、酮有果香味。
3、沸点:醛、酮的沸点比分子量相近的烷烃和醚高,而 比分子量相近的醇低。
4、溶解性:低级脂肪醛、酮易溶于水,其他醛、酮的 水溶性随分子量的增加而减弱,高级醛、酮和 芳香族醛、酮不溶于水。醛、酮能溶于乙醇、 乙醚等有机溶剂。
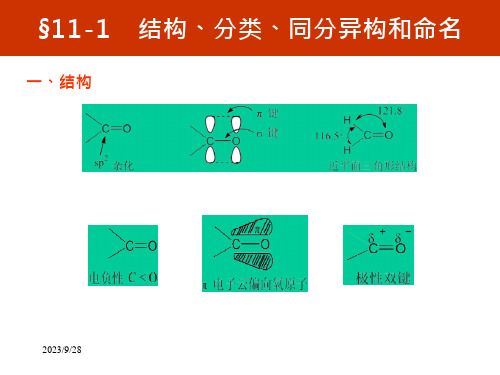
且垂直于σ键所在的平面。
12
问题:
碳氧双键和碳碳双键都是由一个σ键和一个π键 组成,它们在极性方面会有区别吗?
由于氧原子的电负性较碳原子大,羰基中π键的电 子云偏向于氧原子方面,使得羰基发生极化,羰基碳原 子就带有部分正电荷,而氧原子则带有部分负电荷。
羰基极化的情形:
δ+
δ—
CO
结论: (1)碳氧双键是一个极性不饱和键。
R—C—H + HCN O
H2O/HOH
α—羟基腈
α—羟基酸
18
(2)与亚硫酸氢钠的加成
醛、脂肪族甲基酮 、低级环酮 + 过量NaHSO3饱和 溶液作用,生成α—羟基磺酸钠。
R—C—H + HSO3Na O
R—CH—SO3Na
OH
α—羟基磺酸钠
α—羟基磺酸钠不溶于饱和NaHSO3溶液而呈白色结晶析出。
CH2 + N2
但该还原法是在碱性条件下进行的,所以当分 子中含有对碱敏感的基团时,不能使用这种还原法。
36
5、 歧化反应——Cannizzaro反应
不含α-H 的醛在浓碱作用下,一分子醛被氧化成羧酸, 一分子醛被还原成醇,该反应称为Cannizzaro反应。
13
(二)醛、酮的物理性质
1、状:常温下,甲醛是气体,低、中级醛、酮是液体, 高级醛、酮是固体。
2、味:低级醛有强烈的刺激气味,低级酮有特殊气味, 中级醛、酮有果香味。
3、沸点:醛、酮的沸点比分子量相近的烷烃和醚高,而 比分子量相近的醇低。
4、溶解性:低级脂肪醛、酮易溶于水,其他醛、酮的 水溶性随分子量的增加而减弱,高级醛、酮和 芳香族醛、酮不溶于水。醛、酮能溶于乙醇、 乙醚等有机溶剂。
且垂直于σ键所在的平面。
12
问题:
碳氧双键和碳碳双键都是由一个σ键和一个π键 组成,它们在极性方面会有区别吗?
由于氧原子的电负性较碳原子大,羰基中π键的电 子云偏向于氧原子方面,使得羰基发生极化,羰基碳原 子就带有部分正电荷,而氧原子则带有部分负电荷。
羰基极化的情形:
δ+
δ—
CO
结论: (1)碳氧双键是一个极性不饱和键。
R—C—H + HCN O
H2O/HOH
α—羟基腈
α—羟基酸
18
(2)与亚硫酸氢钠的加成
醛、脂肪族甲基酮 、低级环酮 + 过量NaHSO3饱和 溶液作用,生成α—羟基磺酸钠。
R—C—H + HSO3Na O
R—CH—SO3Na
OH
α—羟基磺酸钠
α—羟基磺酸钠不溶于饱和NaHSO3溶液而呈白色结晶析出。
CH2 + N2
但该还原法是在碱性条件下进行的,所以当分 子中含有对碱敏感的基团时,不能使用这种还原法。
36
5、 歧化反应——Cannizzaro反应
不含α-H 的醛在浓碱作用下,一分子醛被氧化成羧酸, 一分子醛被还原成醇,该反应称为Cannizzaro反应。
醛和酮精品PPT课件
2023/10/23
2.卤仿反应
① 鉴别具有- COCH3、- CHOHCH3结构的醛、酮和醇(CHI3是黄色 结晶);
② 合成一些难以得到的羧酸。
2023/10/23
3.羟醛缩合反应
要点:①净反应结果及特点
②反应机理
③交错羟醛缩合反应(N.B. 当一种分子有α-H,另一种分子没有 α-H时才有意义)
反应特点
Wittig 反应条件温和,无论是链状的或环状的脂 肪族或芳香族醛、酮均可进行反应。醛酮中原有的 C=C、-X、-NO2、-NR2、-CO2R等基团均可保留下变, 广泛用于烯烃的合成。
魏悌希(Wittig)发现的此反应对有机合成作出了巨大的贡献,特别 是在维生素类化合物的合成中具有重要的意义,为此他获得了1979年的诺贝 尔化学奖(1945年43岁发现,1953年系统的研究了魏悌希反应,82岁获奖)。
2023/10/23
4.其它缩合反应 ① Knoevenagel缩合反应 ( Z , Z ′ 为吸电子基团)
② Perkin反应
2023/10/23
§11-4 亲核加成反应历程
一、简单的亲核加成反应历程(加HCN、NaHSO3等)
亲核加成历程的证明——以丙酮加HCN为例:
2023/10/23
对于第二个反应,有下述实验事实: ① 无碱存在,反应3-4h,仅有一半原料反应; ② 加1滴KOH aq.,反应在2min内完成; ③ 加入无机酸,放置几周也不反应。
加成。
α , β - 不饱和醛酮、羧酸、酯、硝基化合物等与有活泼亚甲基化合 物的共轭加成反应称为麦克尔(Michael)反应,其通式是:
麦克尔(Michael)反应在有机合成上有其应用价值。
2023/10/23
2.卤仿反应
① 鉴别具有- COCH3、- CHOHCH3结构的醛、酮和醇(CHI3是黄色 结晶);
② 合成一些难以得到的羧酸。
2023/10/23
3.羟醛缩合反应
要点:①净反应结果及特点
②反应机理
③交错羟醛缩合反应(N.B. 当一种分子有α-H,另一种分子没有 α-H时才有意义)
反应特点
Wittig 反应条件温和,无论是链状的或环状的脂 肪族或芳香族醛、酮均可进行反应。醛酮中原有的 C=C、-X、-NO2、-NR2、-CO2R等基团均可保留下变, 广泛用于烯烃的合成。
魏悌希(Wittig)发现的此反应对有机合成作出了巨大的贡献,特别 是在维生素类化合物的合成中具有重要的意义,为此他获得了1979年的诺贝 尔化学奖(1945年43岁发现,1953年系统的研究了魏悌希反应,82岁获奖)。
2023/10/23
4.其它缩合反应 ① Knoevenagel缩合反应 ( Z , Z ′ 为吸电子基团)
② Perkin反应
2023/10/23
§11-4 亲核加成反应历程
一、简单的亲核加成反应历程(加HCN、NaHSO3等)
亲核加成历程的证明——以丙酮加HCN为例:
2023/10/23
对于第二个反应,有下述实验事实: ① 无碱存在,反应3-4h,仅有一半原料反应; ② 加1滴KOH aq.,反应在2min内完成; ③ 加入无机酸,放置几周也不反应。
加成。
α , β - 不饱和醛酮、羧酸、酯、硝基化合物等与有活泼亚甲基化合 物的共轭加成反应称为麦克尔(Michael)反应,其通式是:
麦克尔(Michael)反应在有机合成上有其应用价值。
2023/10/23
常见的醛和酮 醛和酮的化学性质课件

催化剂 RCHO+H2 ――→
RCH2OH
;
催化剂 +H2 ――→ ___________。
PPT学习交流
7
―→
发生氧化反应,
―→—CH2—OH 发生还原反应。
PPT学习交流
8
__________
氨及氨的衍生 物(以氨为例) NH3
δ+ δ- H—NH2
__________
PPT学习交流
4
试剂名称 化学式
δ+ δ- 电荷分布 A—B
醇类(以甲 醇为例) CH3—OH
δ+ δ- H—OCH3
与乙醛加 成的产物
(1)醛、酮的催化加氢反应也是它的还原反应,反应产物是醇
+H2催―化 ―→剂_C_H__3_—__C_H__2_O_H__
PPT学习交流
2
醛、酮的化学性质 探究 1 羰基的加成反应 醛基上的 C===O 键在一定条件下可与 H2、HX、HCN、 NH3、氨的衍生物、醇等发生加成反应。
PPT学习交流
3
几种与醛反应的试剂及加成产物如下表:
试剂名称
化学式
δ+ δ- 电荷分布 A—B
与乙醛加 成的产物
氢氰酸 H—CN
δ+ δ- H—CN
催化剂 +H2 ――→ _____________
PPT学习交流
5
(2)在有机合成中可利用加成反应增长碳链 +HCN催――化→剂______________
+HCN催――化→剂_______________
PPT学习交流
6
(2)还原反应:
醛、酮能在铂、镍等催化剂的作用下与 H2 加成,反应的化 学方程式分别为:
第3节
醛和酮__糖类
第 1 课时 常见的醛和酮 醛和酮的化学性质
醛和酮—醛和酮(药学有机化学课件)

+ COCH3
Br2
COCH2Br + HBr
卤仿反应
卤仿反应:如果醛、酮α-碳上有三个氢,三个氢被卤素原子
取代,使得碳碳键极性增大,发生碳碳键的断裂,生成三卤
甲烷和羧酸盐的反应。
O
O
CH3C-R(H)+ 3X2
NaOH
OH CX3-C-R(H)
O
CHX3 + R(H)-C-O
O
O
CH3 C CH3 I2 + NaOH CI3 C CH3 NaOH CH3COONa + CHI3
有机化学/ 醛和酮
醛的特征反应
醛基上氢原子由于受羰基 的影响变得比较活泼,因此醛 具有不同于酮的特殊的反应。 醛能被弱氧化剂——托伦试剂、 斐林试剂氧化为羧酸。
一、托伦反应
托伦(Tollens)试剂是AgNO3与氨水生成的一种无色的 银氨配合物溶液,其中Ag+ 起着氧化剂作用,当它与醛共热时, 醛被氧化为羧酸,而它则被还原为金属银,附着在试管内壁上, 形成光亮的银镜,因此该反应也称为银镜反应。
或浓H2SO4
H
或浓H2SO4 H
半缩醛
缩醛
➢ 半缩醛不稳定,很难分离。 ➢ 缩醛具有双醚的结构,对碱、氧化剂、还原剂稳定,可
以分离出来。
➢ 缩醛在稀酸中易水解转变为原来的醛,合成中可利用此 反应来保护醛基。
一、加成反应
与醇加成 分子内也能形成半缩醛、缩醛。
CH O
干 HCl
OH
H OH O
环状半缩醛(稳定) 在糖类化合物中多见
O
C5 H3C4 H2C3 C2 HC1 H3
CH3 2-甲基-3-戊酮
C H3
醛和酮PPT课件

醛的氧化: 醛容易被氧化为羧酸。
[O] RCHO
RCO2H
氧化剂:KMnO4, K2Cr2O7 , H2Cr2O7 , H2CrO4 RCO3H , Ag2O , H2O2, Br2-H2O ,
07:07:19
第13页/共58页
被Tollens 试剂氧化(银镜反应)
RCHO + Ag(NH3)2+OH
§9-1 醛、酮的分类和命名
一、分类
CH3CH2CH2CHO 脂肪醛
CHO
脂环醛
CHO
芳香醛
CH3CH=CHCHO 不饱和醛
CH2CHO CH2CHO
二元醛
O CH3CH2-C-CH3
脂肪酮
O O C-CH3
O CH3CH=CH-C-CH3
O
脂环酮 芳香酮
不饱和酮
OO CH3-C-CH2-C-CH3
CH2OH + HCOONa
07:07:19
O CHO
第17页/共58页
醛和酮的还原: 利用不同的条件,可将醛、酮还原成醇、
烃
: 1.2.1 用金属氢化物还原成醇
氢化锂铝或硼氢化钠还原醛得到伯醇,还原酮得到仲醇 (1)LiAlH4还原 LiAlH4是强还原剂,但①选择性差,除不还原C=C、C≡C外,其它不饱和 键都可被其还原;②不稳定,遇水剧烈反应,通常只能在无水醚或THF 中 使用 。
该反应在有机合成上有重要用途
O
RCH2MgX
无水乙醚
OMgX C
R
H2O
OH C
R
07:07:19
第26页/共58页
此反应是制备结构复杂的醇的重要方法
CH3
CH3
C OH
[O] RCHO
RCO2H
氧化剂:KMnO4, K2Cr2O7 , H2Cr2O7 , H2CrO4 RCO3H , Ag2O , H2O2, Br2-H2O ,
07:07:19
第13页/共58页
被Tollens 试剂氧化(银镜反应)
RCHO + Ag(NH3)2+OH
§9-1 醛、酮的分类和命名
一、分类
CH3CH2CH2CHO 脂肪醛
CHO
脂环醛
CHO
芳香醛
CH3CH=CHCHO 不饱和醛
CH2CHO CH2CHO
二元醛
O CH3CH2-C-CH3
脂肪酮
O O C-CH3
O CH3CH=CH-C-CH3
O
脂环酮 芳香酮
不饱和酮
OO CH3-C-CH2-C-CH3
CH2OH + HCOONa
07:07:19
O CHO
第17页/共58页
醛和酮的还原: 利用不同的条件,可将醛、酮还原成醇、
烃
: 1.2.1 用金属氢化物还原成醇
氢化锂铝或硼氢化钠还原醛得到伯醇,还原酮得到仲醇 (1)LiAlH4还原 LiAlH4是强还原剂,但①选择性差,除不还原C=C、C≡C外,其它不饱和 键都可被其还原;②不稳定,遇水剧烈反应,通常只能在无水醚或THF 中 使用 。
该反应在有机合成上有重要用途
O
RCH2MgX
无水乙醚
OMgX C
R
H2O
OH C
R
07:07:19
第26页/共58页
此反应是制备结构复杂的醇的重要方法
CH3
CH3
C OH
《醛和酮教学》课件

醛和酮具有致癌性,长期接触可 能导致癌症
醛和酮具有挥发性,容易扩散到 空气中,对环境和人体健康造成 危害
醛和酮的安全操作规程
操作前必须穿戴防护服、手套和 口罩等防护用品
操作过程中保持通风,避免吸入 有害气体
避免皮肤直接接触醛和酮,如有 接触应及时清洗
操作结束后,及时清理现场,确 保安全无隐患
醛和酮的防护措施
佩戴防护眼镜和口 罩,避免直接接触
保持通风,避免长 时间接触
使用防护手套和防 护服,避免皮肤接 触
定期进行安全培训 ,提高安全意识
醛和酮的应急处理方法
立即离开事故现场,到空气新鲜的地方,保持呼吸道通畅
皮肤接触后应立即脱去污染的衣物,用肥皂水或清水彻底冲洗
眼睛接触后应立即提起眼睑,用大量流动清水或生理盐水彻底冲洗
酮的还原反应: 在催化剂作用下, 酮被还原为醇
反应条件:催化 剂、加热、加压 等
反应产物:醇
应用:合成有机 化合物、药物合 成等
氧化反应
酮的氧化反应: 酮在空气中可 以被氧化为羧
酸
氧化剂:常用 的氧化剂包括 氧气、过氧化
氢等
反应条件:通 常在加热或光 照条件下进行
产物:酮的氧 化产物为羧酸, 如丙酮氧化为
亲核加成反应
反应类型:亲核加成反应
反应条件:碱性条件下
反应产物:加成产物
反应机理:亲核试剂进攻羰基碳,形成碳负离子,然后与亲核试剂结合生成加成 产物。
醛的亲电加成反应:醛与亲电试剂 (如HCN、H2O、HBr等)发生 加成反应,生成相应的加成产物。
亲电加成反应
加成反应条件:醛的亲电加成反应 通常在碱性条件下进行,以促进羰 基碳原子的亲核性。
醛的化学性质
醛和酮ppt学习教程.pptx

第7页/共102页
CH2
CH3 CH2
CO
(CH2)12
CHO CHO
3-甲基环十五酮(麝香酮)
1,2-萘二甲醛
3-methylcyclopentadcanone 1,2-naphthalene dicarbaldehyde
O CCH(CH3)2
2-甲基-1-环己基-1-丙酮 1-cyclohexyl-2-methyl-1-propanone
CH3 CH3
C
HCN
O
CH3
CH3 C OH
H2SO4
Δ
CN
CH3
CH3
CH3OH
CH2 C COOH
CH2 C COOCH3
H2O
α-甲基丙烯酸甲酯
第23页/共102页
②和Grignard试剂加成: ❖加成产物水解后生成醇。
C
δ-
O+R
δ+
MgX
Et2O
C
R H+,H2O R C OH
OMgX
第13页/共102页
⑤红外光谱: ❖C=O的伸缩振动在1750~1680cm-1处有一强吸收带,醛(1730cm-1)稍 高于酮(1715cm-1),当羰基与双键共轭时,吸收向低频方向位移。 ❖醛基的C—H键在2750 cm-1附近有一个非常特征的吸收峰。
第14页/共102页
❖乙醛的红外光谱:
1727 cm-1为C=O键的伸缩振动,2846 cm-1和2733 cm-1为醛基C—H键 的伸缩振动; 3001 cm-1为甲基C—H键的伸缩振动,1350 cm-1为甲基C—H键的弯曲 振动。
❖在实际应用中,常用乙二醇和醛或酮作用生成环状缩醛或缩酮以保护羰基。
醛和酮的课件

3.化学性质 (1)氧化反应
①银镜反应—和银氨溶液的反应
如RCHO 反应生成羧酸铵,还有一水二银三个氨
1 .银镜反应实验时必须注意以下几点: (1)试管必须洁净。试管先用热的烧碱溶 液洗涤,再用蒸馏水洗涤; (2)银氨溶液应现用现配,不可久置; (3)银氨溶液的配制,是向AgNO3溶液 中滴加稀氨水,直到生成的沉淀恰好完 全溶解为止。
醛基的检验方法:
(1)与新制的银氨溶液反应有光亮的银 镜生成 (2)与新制的Cu(OH)2共热煮沸有砖红 色沉淀生成
四、乙醛的用途
乙醛是有机合成工业中的 重要原料,主要用来生产乙酸、 丁醇、乙酸乙酯等。如:
2CH3CHO + O2
催化剂
2CH3COOH 乙酸
五、乙醛的工业制法:
(1)乙醇氧化法:
D
8.某天然有机化合物,其结构如图所示,
D
关于该化合物的说法正确的是( ) A.该化合物可以发生消去、银镜、显色等多种 反应 B.该化合物的分子式是C17H16O5 C.该化合物中全部的碳、氧原子可能在同一个 平面 D.一定条件下1mol该化合物最多可以和8molH2 发生加成反应
巩固练习:
1、写出丙醛与银氨溶液反应的 化学方程式
2、一定量的某饱和一元醛发生银镜
反应,析出银21.6g,等量的此醛完
全燃烧时生成CO2 8.96L(标况),
则此醛是
A、乙醛
B、丙醛
CD
C、丁醛
D、2-甲基丙醛
在日常生活中我们都会 有这样的疑问, 为什么有 的人喝酒“千杯万杯都不 醉”,而有的人喝一点酒后 就面红耳赤,情绪激动甚至 酩酊大醉?酒量的大小到底 与什么有关呢?
味的气体。 ②、甲醛中有2个活泼氢可被氧化。
第十二部分醛和酮教学-资料

C = N -Z+H 2O+H +
反应需在弱酸性的条件下进行。
*3 亚胺的应用
*3a 提纯醛酮 鉴别醛酮
C=O + H2N-Z
C=N-Z
重结晶
稀酸
C=O
O H2N-OH H2N-NH2 H2N-NH-C6H5 H2N-NH-C6H3(NO2)2 H2N-NHCNH2
羟胺
肼
苯肼
2,4-二硝基苯肼
氨基脲
(1)与氨及其衍生物的加成 (2)贝克曼重排
(1)与氨及其衍生物的加成
*1 反应式
亲核加成 HO H
CH3CH=O + NH3
CH3CH-NH
亲核加成 HO H
CH3CH=O + RNH2
CH3CH-NR
-H2O -H2O
CH3CH=O + R2NH 亲核加成
H OH CH2CH-NR2
-H2O
CH3CH=NH
与羟基或氨基的氢原子以氢键缔合,倾向于以重叠 式为优势构象形式存在。
第三节 醛酮的物理性质
由于羰基的偶极矩,增加了分子间的吸引 力,因此,醛酮的沸点比相应相对分子质量的 烷烃高,但比醇低。醛酮的氧原子可以与水形 成氢键,因此低级醛酮能与水混溶。脂肪族 醛酮相对密度小于1,芳香族醛酮相对密度大 于1。
炔烃
1 氧化 3 傅氏酰基化
芳烃
2 卤化-水解 4 加特曼-科赫反应
醇
1 氧化 2 频哪醇重排
醛 酮 氧化
取代
羧酸
羧酸衍生物
还原
乙醛和丙酮的工业制备
二 用羧酸、羧酸衍生物制备
1 由酰 卤制备
还原
H2/Pd-BaSO4硫-喹啉(罗森孟法)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四节 醛酮的光谱特征
羰基的红外光谱在1750-1680 cm-1之间有一个非常强 的伸缩振动吸收峰。-CHO中的C-H键在2720 cm-1区域有 一个非常特征的伸缩振动吸收峰。当羰基与双键共轭, 吸收向低波数位移。
其它参见第八章
第五节 醛酮的制备
一 制备概貌
1氧化 2直接醛基化
烯烃
1 水合 2 硼氢化-氧化
加成产物 0%
若用烷基 锂代替格 氏试剂, 可以发生 正常的加 成反应。
O (CH3)2CHCCH(CH3)2 + (CH3)2CHLi
[(CH3)2CH]3C-OLi H2O
[(CH3)2CH]3C-OH
*2 醛、酮的极限构象式
O M
S
L R
(1)交叉式
O
MLΒιβλιοθήκη SR(2) R-S重叠
O
L
S
MR
(4) R-M重叠
(1)醛、酮与格氏试剂的加成
*1 两个副反应。
不发生正
常反应的 酮主要发 生“烯醇 化”和 “还原”
两个副反 应。
O
== =
(CH3)3CCC(CH3)3 + C2H5MgBr O
加成产物 80%
(CH3)3CCC(CH3)3 + CH3CH2CH2MgBr
加成产物 30%
O
(CH3)3CCC(CH3)3 + (CH3)2CHMgBr
亲核加成 氢化还原
一 醛酮的结构与反应
O
CCH
H
-活泼H的反应 (1)烯醇化 (2) -卤代(卤仿反应) (3)醇醛缩合反应
醛的氧化
C=C–C=O
(1)碳碳双键的亲电加成 (2)碳氧双键的亲核加成 (3),-不饱和醛酮的共轭加成 (4)还原
二 羰基的亲核加成
1 总述 2 羰基与含碳亲核试剂的加成 3 羰基与含氮亲核试剂的加成 4 羰基与含氧亲核试剂的加成 5 羰基与含硫亲核试剂的加成
与金属化合物反应
O NaCCR RCC CR'
O 1R'MgX 2 H2O RC R'
O
C6H5CdCl or (C6H5)2Cd RCC6H5
R’2CuLi
O
RC R'
O
O
-H+
+ CR
AlCl3 低温
Cl-
CR Cl O
CR
2 由羧酸制备
ArCOOH
H2O
R’Li
O
R’Li
ArC-OLi
OL i Ar -C -OL i
+ O
CC ( H3)2 H2O
亲核加成
+OH2 -H+
O CC ( H3)2
OH O CH(HC3)2 C-O键断裂
_
+
O+
(CH3)2C=OH
质子转移
OH + (CH3)2C=O
第六节 醛酮的反应 一 醛酮的结构与反应 二 羰基的亲核加成 三 羰基化合物的还原 四 共轭不饱和醛酮的加成和还原 五 -活泼氢的反应 六 醛酮的氧化
1 总述 (1)反应机理
碱催化的 反应机理
C = O N u -
N u H + CO -
N u C
OH
酸催化的 反应机理
C=O + H+
Nu C
OH
[
+ C=OH
+ CO - H
Nu-
(2)醛、酮的反应活性
R C=O > R C=O > Ar C=O
H
R'
R'
2 羰基与含碳亲核试剂的加成
(1)与格氏试剂的加成 (2)与HCN的加成 (3)与炔化钠的加成
ArCH=NH
H2O
O ArCC10H7-n
ArCH=O
OH
PCl5
ArC=NH
三 醛酮制备实例
*1 CH3
CN SnCl2/HCl CH 3
无水醚
*2
COOH + 2CH3Li
H2O
CH=NH
CH3
CHO
H2O
O CCH3
O
Cl
O
O
*3
Lewis酸 R'ClC+RCHH =2C
R'CH-HC2CR' Na2CO3/H2O
OO (C H 3)2CH 2C C 2C H C H (2)H 2CO 2H 5C
四 异丙苯氧化重排-重要的工业制法
+ CH3CH=CH2 AlCl3
CH(HC3)2 O2 自动氧化
C(CH3)2 H+ O OH
C(CH3)2 -H2O O OH2
+
C(CH3)2 O+
重排
+ O CC ( H 3)2
炔烃
1 氧化 3 傅氏酰基化
芳烃
2 卤化-水解 4 加特曼-科赫反应
醇
1 氧化 2 频哪醇重排
醛 酮 氧化
取代
羧酸
羧酸衍生物
还原
乙醛和丙酮的工业制备
二 用羧酸、羧酸衍生物制备
1 由酰 卤制备
还原
H2/Pd-BaSO4硫-喹啉(罗森孟法)
LiAlH(OBu-t)3
RCHO
RCHO + HCl
O RC Cl
R
OH Ar -C -OH
-H2O
O Ar C- R
R
ArCOOH + R’MgX
ArCOOMgX + R’ H
3 由酰胺和腈制备
ArCN -H2O
O Ar CN H2
NMgBr
NH
-C10H7MgBr ArCC10H7-n H2O ArCC10H7-n H+
H2O
Cl
HCl
SnCl2
ArC=NH
R'CH=HCCR'
H+
*4
OH
-H2O
SOCl2
(n-C4H9)2CuLi
KMnO4
OO HOC(CH2)4COH
OO n-C 4H 9CC (2H )4C4C H 9-n
O
O
*5
O
C2H5OH
OC 2 H 5
SOCl2
OH
O
O
OO ClC C(H 2)2COC2H5
[(CH3)2CHCH2CH2]2Cd 无水乙醚
O S
L
M R
(5)交叉式
O L
M
S R
(3)交叉式
O
S
M
LR
(6) R-L重叠
R与L、M、S 之间的相互作 用大于羰基氧 与L、M、S 之间的相互作 用。所以,三 个交叉式中 (3)最稳定。 三个重叠式中 (6)最不稳 定。
*3 克莱姆规则一
如果醛和酮的不对称-碳原子上结合的三个基团以L (大)、M(中)、S(小)表示,那末这些非对称的醛和 酮与某些试剂(如格氏试剂)发生加成反应时,总是取R-L 重叠构象,反应时,试剂从羰基旁空间位阻较小的基团(S) 一边接近分子。这称为克莱姆规则一.
第十二章 醛和酮
exit
二 系统命名法(参见第一章)
O CH 3CC H2CH2CHO
4-氧代戊醛
OO CH 3CC HCCH 3
CH 2CH =CH 2
3-烯丙基-2,4-戊二酮
O
环己酮
O
CH O
2’-氧代环己基甲醛
第二节 醛酮的结构
1 C=O双键是由一个键和一个键组成的。 2 C=O是一个极性基团,具有偶极矩。 3 当羰基的位有羟基或氨基存在时,羰基氧原子可
与羟基或氨基的氢原子以氢键缔合,倾向于以重叠 式为优势构象形式存在。
第三节 醛酮的物理性质
由于羰基的偶极矩,增加了分子间的吸引 力,因此,醛酮的沸点比相应相对分子质量的 烷烃高,但比醇低。醛酮的氧原子可以与水形 成氢键,因此低级醛酮能与水混溶。脂肪族 醛酮相对密度小于1,芳香族醛酮相对密度大 于1。
