纤维结构不良及骨性纤维结构不良研究现状及对比研究
骨纤维结构不良患者围手术期的路径护理

骨纤维结构不良患者围手术期的路径护理目的:总结骨纤维结构不良患者围手术期的护理措施。
方法:根据病情均采取手术治疗,其中13例采取自体骨植骨,7例采取同种异体骨植骨,2例行股骨成角畸形矫形术。
通过22例骨纤维结构不良患者护理资料的回顾,总结在心理护理、术前护理、术后护理、常规护理等方面的体会。
结果:经过护理干预后,所有患者配合医护人员积极手术治疗,降低了患者的焦虑程度,治疗依从性提高,患者顺利通过手术治疗,无并发症发生。
结论:骨纤维不良患者发病多为青少年,应根据心理、生理特点给予积极护理,从而取得理想的治疗效果。
标签:骨纤维结构不良;路径护理;围手术期中图分类号R47 文献标识码 A 文章编号1674-6805(2012)20-0075-02骨纤维结构不良是一种以纤维、骨组织类肿瘤样增生为特点的非遗传性疾患,又称为骨纤维异常增生症。
可表现为单个骨组织或多骨病损,以畸形、疼痛和病理骨折为特点,约3%的多骨病损患者伴有内分泌紊乱,常见为性早熟和皮肤“牛奶咖啡斑”样病损(McCune-Albright综合征),极少数可出现肉瘤变,本病多发生在青少年,11~30岁为高发年龄段。
发生部位为一侧肢体的多数骨,以胫骨、股骨、颌骨较多见,肋骨、颅骨次之。
临床上表现为骨肿块(隆起)、畸形,并有85%的病例有骨折发生,约三分之一的患者有皮肤色素斑,以背、臀部多见,化验检查可见碱性磷酸酶升高。
部分病例可有由多发性骨折、性早熟和皮肤色素斑组成的Albright综合征。
该病发病期均为青少年,患者及家属担心预后,医护人员的密切配合,对骨纤维结构不良患者手术、护理及预后具有重要意义。
2008年3月-2011年12月笔者所在科室共收治22例骨纤维结构不良患者,现将护理方法与结果报道如下。
1资料与方法1.1一般资料本组患者共22例,其中男18例,女4例;年龄:8~12岁11例,13~18岁8例,19~26岁3例;单发20例,多发2例。
骨纤维结构不良恶变的病例对照研究

骨纤维结构不良恶变的病例对照研究刘巍峰;丁宜;杨勇昆;金韬;宫丽华;孙扬;郝林;牛晓辉【期刊名称】《中国肿瘤临床》【年(卷),期】2018(045)019【摘要】Objective: To elucidate the biological behavior of malignant transformation (MT) of fibrous dysplasia (FD) and investigate its risk factors for diagnostic identification. Methods: A retrospective analysis of 394 FD cases from March 2006 to March 2017 in Beijing Ji Shui Tan Hospital was performed. Seven cases had been histopathologically confirmed as malignant (study group). According to age, location, and other epidemiological data, we performed a 1:2 case-matched comparison between the patients with malignant FD and 14 patients with benign disease (control group). Clinical features, visual analog scale (VAS) score, tumor volume, imaging characteris-tics, alkaline phosphatase (AKP) levels, lactate dehydrogenase (LDH) levels, oncologic results, and function data were analyzed. Re-sults: The 7 MT cases included 3 males and 4 females. Mean follow-up time was 175 (3-396) months, and mean and median follow-up time were 25 (3-51) months after MT. Mean and median age were 45.6 and 47 (24-60) years, respectively. Among the 7 cases, 6 in-volved the femur and 1 involved the tibia. Two cases involved a single lesion whereas the remaining 5 involved multiple lesions. There were 5 recurrent cases and 2 initial cases. The mean MT period from initial surgerywere 207 (37-377) months. VAS scores in the study group were significantly higher than that in the control group (Z=-3.317, P=0.001); the VAS scores decreased significantly after opera-tion (Z=-2.384, P=0.017). Preoperative AKP levels were different between the study and control group; the levels were significantly higher in the former group than in the latter (Z=2.314, P=0.021). However, postoperative AKP levels were similar in both groups (Z=0.821, P=0.821). LDH levels were not significantly different between the two groups, either preoperatively (Z=1.269, P=0.205) or post-operatively (Z=0.075, P=0.940). As for the study group, AKP levels decreased significantly after surgery (Z=-2.366, P=0.018); LDH levels were also lower after surgery than before (Z=-2.028, P=0.043). CT enhancement values were higher in the study group than in the con-trol group (Z=-3.659, P<0.001). Univariate analysis indicated that preoperative VAS score, AKP level, cortical damage, presence of soft tissue mass, and CT enhancement value were clinical risk factors for determination of MT of FD. Histopathological analysis revealed 4 cases of osteosarcoma, 2 of low-grade spindle cell sarcoma, and 1 of undifferentiated pleomorphic sarcoma. Three patients had re-ceived adjuvant chemotherapy, 2 cases involved pulmonary metastasis, and 1 patient had died. The mean Musculoskeletal Tumor Soci-ety (MSTS) scores for the study and control groups were (95.0±3.9)% and (86.0±10.9)%, respectively (F=5.689, P=0.029). Conclusions:Malignant transformation of fibrous dysplasia is rare. The preoperative VAS score, AKP level, cortical damage, presence of soft tissue mass, and CT enhancement value may be helpful for clinical screening ofmalignant transformation. An adequate surgical margin is re-quired for treatment of this lesion.%目的:分析骨纤维结构不良(fibrous dysplasia,FD)恶变的生物学行为,探讨恶变诊断的危险因素.方法:回顾性分析北京积水潭医院2006年3月至2017年3月收拾的FD 394例,病理学证实恶变7例为研究组.根据恶变病例的年龄、部位等流行病学资料,按照1 :2配对分析同期FD 14例为对照组.对比临床特点、疼痛VAS评分、病灶大小、影像学特征、血液生化指标、随访肿瘤学结果及功能评分进行统计学分析.结果:FD恶变7例,其中男性3例,女性4例.平均随访时间为175(3~396)个月,恶变后平均随访时间为26(3~51)个月.平均和中位年龄分别为45.6岁和47(24~60)岁,其中股骨6例,胫骨1例.2例为单发病灶,5例为全身多发纤维结构不良,2例为初次手术,5例为复发后确诊,恶变距初次手术间隔平均时间为207(37~377)个月.研究组的疼痛(visual analogue scale/score,VAS)评分较对照组显著增高(Z=-3.317,P=0.001),且研究组术后VAS较术前明显改善(Z=-2.384, P=0.017).研究组较对照组术前碱性磷酸酶(alkline phosphatase,AKP)对比明显增高(Z=-2.314,P=0.021),术前乳酸脱氢酶(lac-tate dehydrogenase,LDH)(Z=-1.269,P=0.205)两组比较均无显著性差异.研究组术后AKP较术前明显下降(Z=-2.366,P=0.018),术后LDH较术前下降(Z=-2.028,P=0.043).CT扫描发现研究组增强后CT值明显高于对照组增强后CT值(Z=-3.659,P<0.001).单因素分析表明术前VAS评分、AKP值、皮质破坏、软组织包块和CT增强值5项因素在判断FD恶变具有临床意义.恶变病理分别为骨肉瘤4例,低级别梭形细胞肉瘤2例,未分化多形性肉瘤1例,3例患者接受辅助化疗,2例出现肺转移,1例死亡.术后功能MSTS评分,对照组平均95.0%±3.9%,功能优于研究组86.0%±10.9%(F=5.689,P=0.029).结论:FD恶变罕见,术前VAS评分、AKP 值、皮质破坏、是否存在软组织包块以及CT增强值有助于临床判断是否恶变;广泛外科边界切除为主要治疗方法.【总页数】7页(P1009-1015)【作者】刘巍峰;丁宜;杨勇昆;金韬;宫丽华;孙扬;郝林;牛晓辉【作者单位】北京积水潭医院骨肿瘤科,北京市100035;北京积水潭医院病理科,北京市100035;北京积水潭医院骨肿瘤科,北京市100035;北京积水潭医院骨肿瘤科,北京市100035;北京积水潭医院病理科,北京市100035;北京积水潭医院骨肿瘤科,北京市100035;北京积水潭医院骨肿瘤科,北京市100035;北京积水潭医院骨肿瘤科,北京市100035【正文语种】中文【相关文献】1.绝经后无症状子宫内膜息肉潜在恶变及恶变的高危因素分析 [J], 史崑;田蓉;李玉平;兰晓玉2.影响大肠息肉恶变危险因素的病例对照研究 [J], 李菲;朱云清;吕怡菲3.24例卵巢异位子宫内膜恶变的临床病理分析及恶变机制 [J], 黄雄辉4.颌面部骨纤维结构不良与恶变的临床分析(附18例报告) [J], 邹爱萍;陈必胜;姜晓钟;高宏;刘会敏5.胫骨纤维结构不良恶变一例 [J], 张泽坤;杨建柱;刘杰;于宝海;王溱因版权原因,仅展示原文概要,查看原文内容请购买。
骨纤维结构不良的研究及治疗进展

龙源期刊网
骨纤维结构不良的研究及治疗进展
作者:张晓琪
来源:《中国实用医药》2012年第12期
通讯作者:尚希福骨纤维结构不良又称之为骨纤维异常增殖症,是一组以骨纤维变性为特征的类肿瘤样疾病,1976年由Campanacci[1]第一次命名为“骨纤维结构不良”,约占肿瘤样疾病的7%[2]。
属于一种先天性疾病,病变可分为三种类型,依次为单骨型(monostic fibrous dysplasia MFD)、多骨型(polyostic fibrous dysplasia PFD)及多骨伴皮肤色素沉着、内分泌障碍的综合征(MAS),可发生于全身任何骨骼(以四肢长管状骨多见),人体的其他组织或器官也可受累。
FD多发于儿童和青少年患者,以正常骨髓组织、骨小梁结构被增生的纤维组织替代为特征的良性病变。
但有关FD的病因、发病机制及治疗仍处于争论之中而没有统一的观点和治疗方式。
22例骨的纤维结构不良临床病理分析

22例骨的纤维结构不良临床病理分析摘要】目的探讨纤维结构不良(FD)的临床病理特点、鉴别诊断及其本质。
方法观察22例骨的纤维结构不良的病理组织学特点、组织化学及免疫组化染色,并复习相关文献,总结纤维结构不良的临床病理特点、诊断和鉴别诊断及其本质。
结果本瘤可见于各年龄,青少年多见,各骨都可能发生,好发于股骨、头面骨和肋骨。
镜下基本病变由增生的纤维组织和新生的骨小梁构成。
梭形细胞常束状或漩涡状排列。
网状纤维染色病灶中均有数量不等的网状纤维。
免疫组化19例CK阴性,3例梭形细胞散在阳性,S-100阴性。
结论纤维结构不良是一种性质未定的肿瘤性病变,临床病程缓慢,主要与骨纤维结构不良鉴别。
【关键词】纤维结构不良本质病理学诊断鉴别诊断【中图分类号】R68 【文献标识码】A 【文章编号】2095-1752(2013)02-0042-01纤维结构不良(FD)又称纤维异常增殖症,其特点为受累骨内有纤维组织增生及不同程度的骨质化生。
我们收集22例骨的纤维结构不良病例进行光镜、组织化学及免疫组化观察,并复习和总结相关文献探讨其本质,旨在提高对本病的认识。
1 材料和方法收集济宁医学院附院病理科2003-2012年间手术及会诊经病理诊断为纤维结构不良的22例病例,重新阅片,并做网状纤维染色及免疫组化染色。
标本均经10%甲醛固定,部分病例脱钙,石蜡包埋,HE染色,镜检,免疫组化采用En Vision二步法,所用抗体CK、S-100及网状纤维染色试剂均购自Dako基因公司,染色过程按说明书进行,DAB显色。
2 结果2.1临床资料 22例病例中男性14例,女性8例,年龄5-72 岁,平均年龄24.5岁。
病变均为单发性,股骨8例,胫骨3例,额骨3例,肋骨2例,下颌骨1例,顶骨1例,桡骨1例,肱骨1例,指骨1例,锁骨1例。
就诊前病程半年-5年不等,临床表现多为无痛性包块,肿块最大径2-5cm不等;6例有局部疼痛,4例伴有病理性骨折。
纤维结构不良病理概述

纤维结构不良病理概述
纤维结构不良属于一种纤维骨组织进行的良性分化过程,通常见到的可能是单灶性的一些骨病损的过程,经常是在青少年骨骼快速生长的过程中发生的,在这个过程中可能会进行终身的扩大以及发展。
有些是临近骨的发生部位,而在头面骨以及股骨近端等方面都是经常发生的。
纤维结构不良病理概述对于这种骨组织受到损伤产生影响进行介绍,并且还表示其中可能会有性早熟的一些反应,其发病原因并不是非常明确,有的人认为是内分泌紊乱导致的,也有的人觉得是骨骼的发育异常。
在诊断的过程中,对于纤维结构不良是根据发病的年龄以及部位等特点,与X线相结合,做出的诊断。
在鉴别方面,纤维结构不良病理概述可能包括囊肿型以及硬化性,囊肿型指的是在发病早期或者说颅盖部位出现的骨密度比较低的地方,有的是外板隆起变薄的状态,而内板方面则不会受到影响。
而硬化性的纤维结构不良,则是表现为病变晚期的状态,其病变相对来说较为广泛,往往会导致骨质增厚的情况发生,这时候可能会导致象牙质的硬化变化,往往是在蝶骨的小翼部位出现的。
另外还有可能有一种混合型的纤维结构不良出现,也就是说结合上面两种情况的发生,这时候骨组织的状态也不同。
依照不同的临床表现,可以进行相应的诊断以及相关治疗措施。
教你诊断:骨性纤维结构不良

教你诊断:骨性纤维结构不良骨性纤维结构不良(OFD),临床和病理表现上与单发的骨纤维结构不良(FD)极为相似,所以常引起混淆。
1995 年 WTO 对骨肿瘤的分类的补充修订中,将发生于长骨的骨化性纤维作为一种新的肿瘤独立命名为OFD,即骨性纤维结构不良。
现结合宾夕法尼亚大学的 James X. Chen 医生在 auntminnie 上的病例来对该病进行介绍。
病史12 岁女孩,无创伤史,左胫骨疼痛肿胀三周。
影像学检查图 1 为胫骨正位片,可见左侧胫骨中段前侧骨干上一透亮病变区(红色箭头),周边骨质硬化图 2 为胫骨侧位片,可见左侧胫骨中段前侧骨干上一透亮病变区(红色箭头),周边骨质硬化图 3 为 T2 压脂,病变为边界清楚的均匀 T2 压脂高信号(红色箭头),临近骨髓水肿(黄色箭头)图 4 为横断位 T1,病变为边界清楚的均匀 T1 压脂等信号(红色箭头)图 5 为增强扫描,病变呈明显均匀强化(红色箭头)图 6 为 STIR 序列,病变呈明显均匀高信号(红色箭头)图 7 为矢状 T1,病变为边界清楚的均匀 T1 等低信号(红色箭头)图 8 为矢状 T1 压脂强化,病变为边界清楚的均匀强化(红色箭头)影像学发现平片:左侧胫腓骨前后位示胫骨中段前侧骨干上一透亮病变区,周边骨质硬化,皮质变薄。
无骨膜反应或病理性骨折。
病变内未见软组织成分。
MRI:平片上透亮区表现为边界清楚的均匀短T1、长T2 信号,增强扫描均匀强化。
病灶内未见巢样改变。
临近皮质扩张,但未见骨质破坏区。
临近骨髓见轻度水肿,但未见病变向骨髓扩展。
病灶内未见软组织成分。
诊断骨性纤维结构不良鉴别诊断骨性纤维结构不良、骨性纤维结构不良-类釉质细胞瘤型、釉质细胞瘤、纤维结构不良(皮层内型)病例要点骨性纤维结构不良病理学特点是在纤维基质内见网状骨小梁成分。
该病是一种特发性疾病,病因不明。
胫骨最常受累,其他受累部位包括腓骨、桡骨和尺骨。
良性肿瘤生理特点,但可有局部破坏性,致病理性骨折。
骨纤维异常增殖症的研究进展

骨 可 同 时存 在 . 具 特 征 的是 骨 小 梁 周 边 有 成 骨 细 胞 排 列 最
变, 表现为骨髓腔膨胀并 见斑点状骨化 和钙化影 ( ) 3 丝瓜
络 状 改 . 见 于 骨 十 平 行 的 粗 大 扭 曲的 骨 小 梁 呈 丝 瓜 络 状 可 ( ) 蚀状 改变 , 骨 性 改 变 边缘 锐利 如虫 蚀 状 4虫 溶 、 颌 骨 F B的 x 线可 表现 为 透 射性 改 变 .又 称 囊 样 型 : D 阻 射 性 改 变 , 括 “ 皮 样 ” 、 玻 璃 样 型 及 硬 化 型 : 射 包 橘 毛 透 及 阻射 混 合 型 改 变 等 : 表 现 与 X射 线 相 似 . 点 为 可 克 优 服平 片 『多 种 组 织 结 构 重 叠 的 缺 陷 . 较 好 地 显 示 病 变 的 } 1 能 细 节 、 界 和 累 及 范 围 ( 4 5 边 .) 。MR 不 能 准 确 显 示 骨 I 质 改 变 .对病 变 的 定 性 限 度 较 大 .但 可 观 察 病 灶 周 围 骨 髓
众 多 研 究 结 果 证 实 F B是 激 发性 G 蛋 白 q亚 基 突 变 D 所致 G蛋 白 ( u n encet ebnigpoe s 是调 节 腺 G ai ulo( —idn r i ) n i 1 tn 苷 酸 环 化 酶 (dnlt cc s . c 活 性 的膜 蛋 白 . ae y e vl eA ) a a G蛋 白分
0 0 3 6 5 2 —8 8 2 3 1
中华 口腔 医学研 究 杂志 ( 电子 版 ) 08年 1 20 O月第 2卷第 5 C i JS m t e( l tncV ro )O tbr 0 8V 1 , 05 期 hn t a0 R sEe r i e i , c e 0 , 02 N . o l co sn o 2 .
骨的纤维结构不良临床病理学特征、免疫学表型及其GNAS1基因突变的研究

上海交通大学硕士学位论文骨的纤维结构不良临床病理学特征、免疫学表型及其GNAS1基因突变的研究姓名:***申请学位级别:硕士专业:生物化学与分子生物学指导教师:***20080501骨的纤维结构不良临床病理学特征、免疫学表型及其GNAS1基因突变的研究摘要纤维结构不良(Fibrous dysplasia ,FD)也称纤维异常增殖症,是一种常见的,病因不明,进展缓慢的良性纤维性骨病。
以往病理学经典著作将FD列为非肿瘤性瘤样病变,认为是骨的发育不良,并假定由二个原因造成:第一,原始骨向成熟板层骨发育重建过程中的成熟障碍;第二,骨组织不能根据受力作用方向而重新整合。
但近年来研究表明无论多骨或单骨FD都存在GNSA1基因激活性突变[1],染色体克隆性异常、畸变[2], c-fos 原癌基因的过度表达等[3]。
为此2002版WHO软组织和骨肿瘤病理学和遗传学,已将其列为性质未定的肿瘤性病变。
目的:本实验研究FD临床病理学特征、免疫表型及其GNAS1基因突变,并探讨其病变的性质。
材料和方法:选取上海交通大学附属第六人民医院病理科2005-2007年二年间存档病例中FD石蜡组织35例,其中1例为FD恶变,1例为Mzabraud综合征(Mzabraud syndrome,MS)即FD合并肌内黏液瘤(intramuscular myxomas,IM)。
取存档福尔马林固定、石蜡包埋的病变组织,经石蜡切片,结合影像学改变,用常规HE染色观察组织学形态;采用免疫组织化学二步法检测P53, c-myc,P16和rasP21蛋白在35例FD及对照组5例(骨折后骨痂)中表达;采用基因组DNA抽提、PCR扩增35例(其中12例DNA扩增成功),用DNA测序方法,对DNA扩增成功的12例作GNAS1基因突变检测。
结果:(1)35例中,33例为典型FD,其中单骨性20例(61%),多骨性13例(39%),1例为MS,1例为FD骨肉瘤变。
骨纤维结构不良的原因

骨纤维结构不良的原因文章目录*一、骨纤维结构不良的简介*二、骨纤维结构不良的原因*三、骨纤维结构不良的危害*四、骨纤维结构不良的高发人群*五、骨纤维结构不良的预防方法骨纤维结构不良的简介纤维异样增殖症又称纤维结构不良。
其特征是纤维组织增生并通过化生而成骨,形成的骨为幼稚的交织骨。
另有一种病损是在纤维组织增生的同时,有板层骨小梁形成,骨小梁表面有骨母细胞覆盖。
骨纤维结构不良的原因病因不明,骨纤维异样增殖症病因不明,可能与骨先天性发育异常、骨形成障碍、内分泌异常有关。
有以下一些说法:1、先天性骨发育异常:认为是发生在胚胎的组织错构,骨小梁发育异常为纤维组织代替。
2、骨形成障碍:骨小梁停留在编织骨阶段,而不能形成正常的骨小梁。
3、内分泌异常。
1、大体标本特点:纤维异样增殖症大体标本骨膜没有改变,皮质变薄,有时可用手术刀切开,剖面为苍白致密组织,有一定的弹性沙砾感,沙砾感主要由于纤维组织内有软脆的骨样组织骨小梁成分,并随小梁数量及成熟程度而异。
这种组织不富含血管,然而,特别在骨松质(髂骨翼、肋骨、骨盆、干骺端),则可见许多血管截面。
有时可见囊腔,水肿或出血性组织内有血性液体;有时,尤其单骨型,整个溶骨区含有液性成分,易与骨囊肿相混淆。
有时,组织中有软骨岛结构,在儿童和干骺端更常见。
2、组织病理特点:纤维异样增殖症的组织病理在细小的骨小梁结构间有成束的组织即成纤维组织,而骨小梁周边无骨母细胞排列。
一般情况下,在纤细的胶原纤维网中,富含组织纤维母细胞,分裂相对少见,有时,排列成轮辐状,有时含多核巨细胞,主要在血管丰富或出血区域(尤其见于富含血管的骨松质,如肋骨)。
一些区域组织细胞纤维瘤替代了骨小梁,有的是被黏液样组织替代。
骨样组织和骨小梁一般比较稀疏,很少粗大,周边无骨母细胞排列,纤维异样增殖症的骨小梁一般呈纺织结构,不能形成板层骨。
纤维异样增殖症的组织中,血管少见。
有的囊性区域,可见富含毛细血管和血性渗出。
骨纤维不良治疗方案

骨纤维不良治疗方案概述骨纤维不良(Fibrous Dysplasia,FD)是一种常见的骨骼发育异常疾病。
其特征为骨结构异常,骨组织被纤维组织所替代,导致骨骼脆弱。
本文将介绍根据目前的医学研究和临床实践,总结出的骨纤维不良治疗方案。
诊断在制定骨纤维不良治疗方案之前,准确的诊断是非常重要的。
骨纤维不良的诊断通常包括以下几个步骤:1.临床评估:根据患者的症状、体征和病史进行综合评估,包括X光检查、骨密度检查、CT扫描等。
2.病理学检查:通过组织活检或手术标本分析来确定是否存在骨纤维不良。
3.适应症和排除症:根据临床评估和病理学检查结果,排除其他疾病,确定骨纤维不良的诊断。
治疗方案根据病情的不同,骨纤维不良的治疗方案可以分为以下几种:1. 保守治疗对于无症状的轻度骨纤维不良患者,可以采取保守治疗,主要包括观察和疼痛管理。
•观察:定期进行临床评估和影像检查,以监测病情的变化。
•疼痛管理:使用非处方止痛药,如非甾体类抗炎药(NSAIDs),以缓解疼痛症状。
对于较严重的疼痛,可以考虑使用强效止痛药,如阿片类药物。
2. 手术治疗对于症状明显或骨纤维不良影响日常生活的患者,手术治疗是常见的选择。
•内固定术:适用于局部骨折或畸形的患者,通过内固定器材(如钢板或螺钉)固定骨骼,恢复骨骼的结构和功能。
•骨移植术:适用于骨纤维不良较严重的患者,借助于捐赠者提供的骨骼,进行骨移植手术,以替代受损的骨组织。
•部分切除术:适用于局部病变较大的患者,通过部分切除受影响的骨骼,并进行修复或移植,以恢复正常的骨结构。
3. 药物治疗药物治疗在骨纤维不良的治疗中也起到了一定的作用,主要用于控制症状和改善骨密度。
•二磷酸盐类药物:如奥利司他(alendronate)和伊珂珠单抗(denosumab),可以抑制骨组织的吸收,减缓骨骼的破坏。
•雌激素类药物:雌激素类药物可以促进骨骼的形成和增加骨密度,但在使用时需谨慎考虑其潜在的副作用。
•生长激素类药物:对于儿童和青少年骨纤维不良患者,生长激素类药物可以促进骨骼的生长和重塑。
骨纤维结构不良
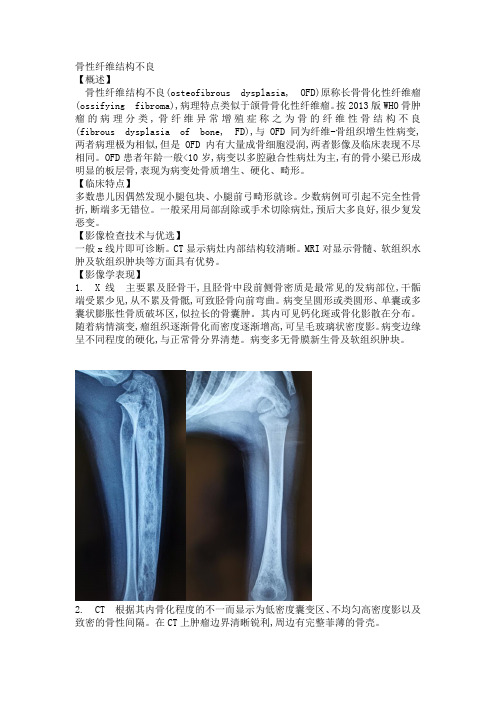
骨性纤维结构不良【概述】骨性纤维结构不良(osteofibrous dysplasia, OFD)原称长骨骨化性纤维瘤(ossifying fibroma),病理特点类似于颌骨骨化性纤维瘤。
按2013版WHO骨肿瘤的病理分类,骨纤维异常增殖症称之为骨的纤维性骨结构不良(fibrous dysplasia of bone, FD),与OFD同为纤维-骨组织增生性病变,两者病理极为相似,但是OFD内有大量成骨细胞浸润,两者影像及临床表现不尽相同。
OFD患者年龄一般<10岁,病变以多腔融合性病灶为主,有的骨小梁已形成明显的板层骨,表现为病变处骨质增生、硬化、畸形。
【临床特点】多数患儿因偶然发现小腿包块、小腿前弓畸形就诊。
少数病例可引起不完全性骨折,断端多无错位。
一般采用局部刮除或手术切除病灶,预后大多良好,很少复发恶变。
【影像检查技术与优选】一般x线片即可诊断。
CT显示病灶内部结构较清晰。
MRI对显示骨髓、软组织水肿及软组织肿块等方面具有优势。
【影像学表现】1. X线主要累及胫骨干,且胫骨中段前侧骨密质是最常见的发病部位,干骺端受累少见,从不累及骨骶,可致胫骨向前弯曲。
病变呈圆形或类圆形、单囊或多囊状膨胀性骨质破坏区,似拉长的骨囊肿。
其内可见钙化斑或骨化影散在分布。
随着病情演变,瘤组织逐渐骨化而密度逐渐增高,可呈毛玻璃状密度影。
病变边缘呈不同程度的硬化,与正常骨分界清楚。
病变多无骨膜新生骨及软组织肿块。
2. CT 根据其内骨化程度的不一而显示为低密度囊变区、不均匀高密度影以及致密的骨性间隔。
在CT上肿瘤边界清晰锐利,周边有完整菲薄的骨壳。
3. MRI病变内部的纤维及骨化部分于T1wI.T,WI均呈低信号,其他部分一般为T,WI低信号、T,WI高信号。
增强扫描肿瘤明显强化。
【诊断要点】胫骨前方皮质内多房状病灶,在平片或CT显示为低密度灶其间有厚度不等的高密度骨性间隔,MRI上为等/高信号灶其间有带状低信号间隔,是本病的特征。
多发性骨纤维结构不良症汇报ppt课件

家系调查
通过对患者家族成员的调查和遗传分析,可进一 步明确遗传方式和基因突变情况。
产前诊断
在明确家族遗传背景的基础上,可利用遗传学检 测技术对胎儿进行产前诊断,避免患儿的出生。
2023
PART 04
治疗方案及原则
REPORTING
骨代谢相关指标分析
骨形成标志物
如骨钙素、I型前胶原羧基端肽等 ,可反映成骨细胞活性和骨形成
状态。
骨吸收标志物
如抗酒石酸酸性磷酸酶、尿吡啶 啉/脱氧吡啶啉等,可反映破骨
细胞活性和骨吸收状态。
矿物质代谢指标
如25-羟基维生素D、甲状旁腺激 素等,可评估钙磷代谢及骨骼矿
化情况。
遗传学检测技术应用
基因突变筛查
多学科协作
PFD的治疗需要多学科协作,未来可能形成由骨科、遗传学、药学、康复医学等多学科 专家组成的综合治疗团队,为患者提供个性化的治疗方案。
社会支持与关注
随着社会对罕见病的关注度不断提高,PFD患者将获得更多社会支持和关注,包括政策 扶持、医疗保障、心理支持等。
2023
REPORTING
THANKS
2023
PART 02
影像学检查
REPORTING
X线平片表现
01
02
03
骨膨胀
病变部位骨皮质变薄,髓 腔增宽,呈磨玻璃样改变 ,界限清楚。
丝瓜瓤样改变
骨小梁粗大紊乱,排列不 整,呈丝瓜瓤样改变。
囊状改变
部分病例可见囊状透亮区 ,为骨囊肿形成所致。
CT扫描特点
清晰显示病变细节
CT扫描可清晰显示病变部 位的骨膨胀程度、骨皮质 变薄情况以及髓腔内磨玻 璃样改变等细节。
骨纤维结构不良治疗进展

• 二代测序(NGS):假阴性结果比例低,无假阳性表现,用于FD/MAS和 骨肉瘤的鉴别。
• 血液突变分析:无法排除单骨型FD,阳性结果有意义。
22
FR
FD/MAS的全面评估:
• ①骨骼系统的评估: • 疼痛的强度和范围、畸形的区域、骨折病史、骨科手术史、骨科药物史、旋转应
• 主诉:反复左髋部疼痛15年 • 症状:左髋部、踝部疼痛、久行后明显,休息后缓解 • 查体:双侧4字试验(-),双下肢肌力、感觉、反射未见异常。 • 辅助检查:我院X光示:左股骨上段、左胫骨及腓骨中段、左耻骨、左髋臼、左髂骨
翼、L5右侧横突多发骨质改变,考虑多发纤维结构不良。 • 既往史:左股骨肿瘤切除术。
13
FR
FD的自然病程:
• FD的大多数病变及其伴随的功能障碍发生在头十年内。到15岁时90%的病变会 出现,此后病程进展会逐渐停滞;
• 在颅面骨,90%的病变在3.4年内出现; • 在四肢骨,90%的病变在13.7年内出现; • 在中轴骨,90%的病变在15.5年内出现。 • 92%的患者在17岁时需要行走辅助。 • 患者的年龄,性别,既往放疗史以及FD的类型均不影响总生存期。
FR
5
FR
• 咖啡斑色素沉着: • 锯齿状 • 边界不规则 • 一般不过身体中线
6
FR
• A:卵巢囊肿 • B:睾丸增大 • C:甲状腺弥漫性结节 • D:垂体大腺瘤
7
FR
发病机制:
• 1.基因突变:与20号染色体上GNAS1基因的错义突变有关,突变激活后会导致 纤维组织的异常增殖。
• 2. 染色体变异:2 号染色体三体、核型异常。 • 3. 内分泌异常:病变组织的成骨细胞内甲状旁腺激素相关蛋白PTHrP 的表达水
骨纤维结构不良的病因及治疗研究进展

・综 述・骨纤维结构不良的病因及治疗研究进展刘 铖综述 姚长海审校中图分类号 R68 文献标识码 A 文章编号 1005-8478(2001)10-1002-03作者单位:解放军第304医院骨科,北京 100037作者简介:刘铖(19722),男,硕士研究生,医师。
主研方向:骨肿瘤。
电话(010) 骨纤维结构不良又称骨纤维异常增殖症,是先天性、非遗传性疾病。
病变分三型,依次为单骨型(monostotic fibrous dysplasia MFD )、多骨型(polyos 2totic fibrous dysplasia PFD )及多骨伴皮肤色素沉着、内分泌障碍的McCune -Albright 综合征(MAS )。
病理表现为正常骨组织及骨髓被大量增生的纤维组织所替代,在纤维组织内有结构不良的骨小梁,纤维组织可直接化生为骨。
临床上男女发病率1∶2~3,多在10岁左右发病,合并内分泌障碍者常在3~4岁发病。
我国的发病率为百万分之10~30,占骨肿瘤样病损的首位,国外为百万分之2~3〔1。
本病常位于单侧躯体,四肢病损常位于近侧端,长骨病损常位于干骺端,可局限或向骨干扩散。
临床上可导致疼痛、畸形、功能障碍及病理骨折。
对此病通常为对症治疗,但复发率较高,不过有些患者在成年后病变有自限性。
1 病因及发病机制目前研究认为Gs 蛋白的α亚单位突变可导致骨纤维结构不良,细胞膜上的G 蛋白即偶联蛋白是受体和效应器之间的中介者,而根据G 蛋白针对腺苷酸环化酶效应不同有激动性Gs 和抑制性G i 。
编码Gsα的基因GNAS1(GTP -binding protein ,α-stimulating activity polypeptide 1),位于20q 13.22。
GNAS1突变可导致不同的疾病,Gs 蛋白的α亚单位获得功能的突变可导致MAS ,PFD ,MFD 以及垂体腺瘤,失去功能的突变导致假性甲状旁腺功能减退症,遗传性糖皮质激素缺乏症,肾源性尿崩症3。
骨纤维结构不良的SPECTCT骨显像及临床特点

骨纤维结构不良症(OFD )是一种骨髓内纤维异常增生形成编织骨的骨性病变,临床上可分为单骨型和多骨型,多依赖X 线及CT 检查诊断,具有典型的磨玻璃样、硬化增生、囊状改变、丝瓜络样改变等征象[1-2]。
既往相关研究多局限于分析放射学检查[3-6];因一般影像学检查部位均较局限,而全身骨显像具有观察全身骨病变分布特征的优势,故另有部分研究从骨显像角度分析OFD 的骨代谢特点[2,7-8]。
本研究结合SPECT/CT 既能获得常规CT 扫描的解剖图像,又可同时拥有全身各骨骼的代谢情况的特点,分析骨纤维结构不良的SPECT/CT 骨显像结果,以期能助益OFD 的临床鉴别与诊断。
1资料与方法1.1一般资料收集2016年1月~2022年1月于福建医科大学附属第二医院行SPET/CT 全身骨显像,经病理或临床随诊证实为骨纤维结构不良的34例患者,对其影像特点及临床资料进行比较分析。
34例患者中,男16例,女18例,年龄58.6±18.6岁;青少年(17岁及以下)8例(23.5%),成年人26例(76.4%)。
按病灶数量将患者分为单病灶组(n =25,男13例、女12例,年龄38.5±16.8岁)和多病灶组(n =9,男3例、女6例,年龄23.8±13.7岁),两组性别差异无统计学意义(χ2=0.926,P =0.336);但多病灶组年龄小于单病灶组,差异有统计学意义(t =17.315,P =0.018)。
1.2仪器与方法SPECT/CT bone imaging and clinical features of osteofibrous dysplasiaXIE Long,ZHANG Guanjie,HUANG Liqun,YU Xiaopeng,SU Yingrui,ZHA JinshunDepartment of Nuclear Medicine,Second Affiliated Hospital,Fujian Medical University,Quanzhou 362000,China摘要:目的分析骨纤维结构不良的SPECT/CT 骨显像结果,探讨其核医学显像特征及鉴别要点。
骨的纤维结构不良克隆性分析

胞受损之后,需经过再生、修复,这一过程需要一定的时间。
另有研究称,AFP在肝硬化患者中与短期预后关系不大[8]。
早有研究发现肿瘤标志物CEA、AFP在诊断肿瘤的发生、转移、预后等方面具有很高的参考价值,如AFP含量显著升高提示可能患原发性肝癌,CEA含量显著增高提示可能肿瘤肝脏转移[9,10]。
然而,血清CEA、AFP水平对慢性乙型肝炎治疗的诊断和预后价值未见详细报导。
本研究样本含量较大,跟踪周期长,且在不同时间段定期监测各项指标,可较好的探讨治疗初始时期指标水平高低与不同时期BR的相关性,同时也可反映出这种相关性可能与治疗时间长短有关。
在治疗初期检测血清CEA和AFP的含量有助于治疗效果进行预测和判断。
参考文献[1] Ott JJ, Horn J, Krause G, et al. Time trends of chronic HBV infec-tion over prior decades - a global analysis[J]. J Hepatol, 2016, Aug 31. [Epub ahead of print.][2] 钱明, 袁君君, 汤艳平, 等. 肿瘤标志物AFP、CA125、CA199在原发性肝癌诊断中的应用[J]. 中外医学研究, 2011, 9(29): 58-59.[3] Liu F, Jiang DM, SIDQ, et al. Quantitative determination and analysis of serum alpha fetoprotein in patients with liver disease[J]. Lab Med Clin, 2008, 5(5): 315-316.[4] Zeuzem S, Gane E, Liaw YF, et al. Baseline characteristics and early on-treatment response predict the outcomes of 2 years of telbivudine treatment of chronic hepatitis B[J]. J Hepatol, 2009 Jul, 51(1): 11-20.[5] 雷平. HBV血清标志物与HBV-LP及HBV-DNA联合检测的临床意义初探[J]. 湖南师范大学学报(医学版), 2013, 3(1): 31-33.[6]何昭新, 段永强. 血清 AFP、CEA、IL-6和TNF水平对判断重型肝炎预后的价值[J]. 中西医结合肝病杂志, 2004, 14(3): 226-228.[7] Taketa K, Okada S, Win N, et al. Evaluation of tumor markers for the detection of hepatocellular carcinoma in Yangon General Hospital, Myanmar[J]. Acta Med Okayama, 2002 Dec, 56(6): 317-320.[8] 王婧涵, 李嘉, 赵新颜. 慢性乙型肝炎和乙肝肝硬化及原发性肝癌血清肿瘤标志物的检测意义[J]. 临床和实验医学杂志, 2013, 12(21): 1702-1705.[9] 叶芳, 计海芬, 罗锐, 等. 血清标记物联合检测对肝癌的临床诊断价值[J]. 临床输血与检验, 2016, 1(18): 32-34.[10] 王园园, 王保峰, 付书贞. 多项肿瘤标记物联合检测对肝癌诊断的临床意义[J]. 世界最新医学信息文摘, 2016, 16(20): 190.骨的纤维结构不良克隆性分析唐 娟,张惠箴,蒋智铭(上海交通大学附属第六人民医院病理科,上海 200233)【摘要】目的:检测FD病变的克隆性起源,探讨其病变的性质。
纤维结构不良的致病机制和治疗研究进展

纤维结构不良的致病机制和治疗研究进展
侯振兴;段星宇;廖文胜;刘明阳;高延征
【期刊名称】《医学综述》
【年(卷),期】2024(30)9
【摘要】纤维结构不良(FD)是一种由基因突变导致的罕见良性骨肿瘤,主要由鸟嘌呤核苷酸结合蛋白α刺激活性多肽基因突变导致骨骼矿化缺陷、局部破骨细胞增多,从而引起正常骨骼被纤维组织侵蚀。
FD可累及各部位骨骼,尚缺乏针对性的分类系统,且难以制订标准术式,目前一般采用髓内钉、椎体切除内固定等手术方式治疗。
FD的药物治疗常使用双膦酸盐以缓解骨痛,降低骨折风险。
核因子κB受体活化因子配体(RANKL)抑制剂地诺单抗通过抑制FD患者体内RANKL的过量表达阻止病变进展,而生长激素受体拮抗剂培维索孟可降低生长激素水平,故用于伴有内分泌疾病FD患者的治疗。
【总页数】6页(P1098-1103)
【作者】侯振兴;段星宇;廖文胜;刘明阳;高延征
【作者单位】河南大学人民医院脊柱外科;郑州市第一人民医院骨科
【正文语种】中文
【中图分类】R738.1
【相关文献】
1.骨纤维结构不良的病因及治疗研究进展
2.海洋致病菌致病机制及其感染的治疗研究进展
3.骨纤维结构不良诊断与治疗研究进展
4.骨纤维结构不良的发病机制及治疗进展
5.RANKL靶向抑制对骨纤维结构不良治疗的研究进展
因版权原因,仅展示原文概要,查看原文内容请购买。
