液态混合物和溶液
第四章,液体混合物与溶液

3. 化学势(chemical potential)
(1)
G G G dG dnB dT p dp n T p ,nB B T , n B B T , p , n
C
当组成不变时,
G dG SdT Vdp dnB n B B T , p ,nC
2.单选题: (1)1molA与 nmol B组成的溶液,体积为0.65 dm3 ,当xB = 0.8 时,A的偏摩尔体积VA=0.090dm3· -1,那么B的偏摩尔VB 为: mol (A) 0.140 dm3· -1 ; mol (B) 0.072 dm3· -1 ; mol (C) 0.028 dm3· -1 ; mol (D) 0.010 dm3· -1 。 mol
ΔG TΔS
1
ΔS2 ΔS1 ΔS 56.25J K
1
ΔG2 ΔG1 ΔG 298.15 56.25J 16.77kJ
(5)化学势与温度的关系
B SB,m T p,nB
4. 恒温下理想气体混合物化学势
(1)单组分纯理想气体
RT dGm Vmdp dp p
T Gm RT ln p
Gm RT ln p C
* (Pg) O (g) p RT dp O (g) RT ln( p / p O ) p O p
B
G T p ,nB T , p ,n
S
C
nB T , p ,n
S
B ,m
C
(3) 等温等压下, 系统内发生相变化或化学变化时, 有
2.4 拉乌尔定律、亨利定律
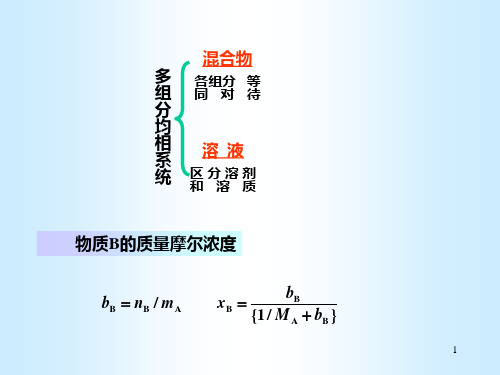
多 组
各组分 等 同对待
分
均
相 系
溶液
统
区分溶剂 和溶质
物质B的质量摩尔浓度
bB nB / mA
xB
{1 /
bB MA
bB }
1
§2-4 拉乌尔定律、亨利定律
1. 液态混合物和溶液的饱和蒸气 压
设由组分A, B, C……组成液态混 合物或溶液, T一定时, 达到气, 液两相 平衡.
此时, 气态混合物的总压力为p, 则 p 即为温度T下该液态混合物或溶液的 饱和蒸气压.
水(A)和乙酸乙酯(B)不完全混溶, 在37.55℃时两液相呈平衡.
一相中含质量分数为w(B) = 0.0675的酯, 另一相中含w(A) =
0.0379的水, 假定拉乌尔定律对每相中的溶剂都能适用, 已知
37.55℃时, 纯乙酸乙酯的蒸气压力是22.13kPa, 纯水的蒸气
压力是6.399kPa, 试计算:
ln p(s) 3133 27.650 11.99 p(s) 160.3k Pa Pa 200K / K
计算结果表明, 所给过程是恒温恒压不可逆相变化过程, 为
此可根据计算所得的液体及固体CO2在200 K的蒸气压数据, 设
计以下可逆过程进行计算:
8
s, 100kPa, 200K
s, 160.3kPa, 200K G2
(1)计算下述过程Gm :
CO2( s, 100kPa, 200K ) →CO2( l, 100kPa, 200K )
(2)判断在100 kPa下, CO2(l)能否稳定存在?
(1) 200 K时液体及固体CO2的饱和蒸气压:
ln p(l) 2013 22.405 12.34 p(l) 228.7kPa Pa 200K / K
物理化学(第三版)第3章 液态混合物和溶夜

B
dnB
B
dnB
...
B dnB
B
B
B
dG
B
dnB
≤0
B
< 自动进行 = 平衡
应用条件:( 恒温、恒压、 W’=0)
化学势在相平衡中的应用
设有物质的量为dn的纯物质A,在恒温恒压无非体积功的 条件下,由液相转移到气相。
A(l) T, p,W'0 A(g)
l
g
dnl dng
dn g
dG
溶液中组成可分为溶质和溶剂。
以物态可分为气态溶液、固态溶液和液态溶液。
3.1 偏摩尔量与化学势
一、偏摩尔量的定义 多组分系统的广度性质X不仅是温度、压力的
函数,还与系统的组成有关,即
X = f(T,p,nB,nC…)
dX
X T
p,nB ,nC L
dT
X p
T ,nB ,nC L
dp
解: (1)NaCl饱和溶液的质量分数:
w(
NaCl)
=
m(
m(NaCl) NaCl) + m(H
2O)
= 3.173 =0.2644 26.44% 12.003
(2)NaCl饱和溶液中
n(NaCl) = m(NaCl) 3.173= 0.0542mol M (NaCl) 58.5
n(H2O)
4.质量摩尔浓度--bB
bB
nB mA
单位:mol·kg-1
【例3-1】 在常温下取NaCl饱和溶液10.00cm3,测得 其质量为12.003g,将溶液蒸干,得NaCl固体3.173g 。求:(1)NaCl饱和溶液的质量分数,(2)饱和 溶液中NaCl和H2O的物质的量分数,(3)物质的量 浓度,(4)质量摩尔浓度。
物理化学(第五版) 演示文稿4-6 真实液态混合物和真实溶液

aA
def
exp
A A
RT
A
def
(
A
A
)
/
RTMA
bB
B
并且
lim bB 0
A
1
B
A
A
RTAM A
bB
(A)
B
A
A
RT
ln
aA
(B)
(A)与(B)比较 ln aA AMA bB
B
因 xA = 1 / (1+ MA bB)
故
ln
aA
A (1
xA
xA )
A
A
RT
ln
aA
A
= 1095Pa/94.7Pa=11.6
Cd,[%] = p´Cd,实 / p´Cd,计算 = 1095Pa/1894Pa=0.587
**本例中, Cd 对拉乌尔定律产生 哪种偏差? 对亨利定律产生 哪种偏差?
比较 理想稀溶液 真实溶液
pB= kx,B xB pB= kx,B aB,x= kx,B xBB,x
(2) 以[%Cd] = 1仍遵守亨利定律时 T、p下的Cd(1) 为 标准态。
解:(1) 当以 T、p 下的纯液体Cd为标准态时, Cd的组成必须为xCd。
所以,当[%Cd] = 20 时, xCd = 0. 316 a Cd,x = p Cd,实测 / pCd*
= 1095Pa/1840Pa=0.592
§4-6 真实液态混合物和真实溶液
一、真实液态混合物中组分 B 的化学势
1、活度与活度因子
一定温度下,各组分的化学势不符合
B
(l)
B, x
(l)
RT
物理化学2.3拉乌尔定律和亨利定律

pB T一定 (平衡)
xB
pB=kx,BxB
稀溶液的气、液平衡
kx,B 亨系数
pB=kx,BxB
kx,B 亨利系数 当溶质的组成标度用bB 表示时,亨利定律可表示成:
p B k b, B bB
注意:kx,B ,kb,B 的单位是不同的。
Pa
Pa/b
pB=kx,BxB
注意
亨利定律的适用条件及对象是稀溶液中的溶质,既 溶质分子B周围几乎全是溶剂A分子。
pA,p真B,p空C yA, yB, yC
T一定 (平衡)
xAA,,Bx,BC,x…C
多组分系统的气、液平衡
2. 拉乌尔定律
表述为:
平衡时,稀溶液中溶剂A在 气相中的蒸气分压等于同一 温度下,该纯溶剂的饱和蒸 气压p*A与该溶液中溶剂的摩 尔分数xA的乘积。
数学表达式为:
pA
p
* A
x
A
pA,pB1, yA, yB1, xA, xB1,
T一定 (平衡)
稀溶液的气、液平衡
注意
pA
p
* A
x
A
拉乌尔定律的适用条件及对象是:
稀溶液中的溶剂,既溶剂分子A 周围几乎全是 其它的A分子;
理想液态混合物中各组分。
3. 亨利定律
表述为:
一定温度下,稀溶液中挥发 性溶质B在平衡气相中的分压 力pB与该溶质B在平衡液相中 的摩尔分数xB成正比。
第二章 多组分系统热力学
《基础物理化学》 高等教育出版社,2011
§2.4 稀溶液的两个经验定律
—— 拉乌尔定律和亨利定律
1. 液态混合物和溶液的气、液平衡
设图中系统由组分A,B,C……组成液态混合物或溶液,
物理化学第四章 溶液

返回
2012-3-17
二、亨利定律
稀溶液上挥发性溶质的分压与溶质的摩尔分数成正 比。但比例常数不为pB*(1803年,Henry): pB=kx,B xB 换算浓度可有:pB=kc,B cB /c (c =1mol/L); pB=kb,B bB/b (b =1mol/kg); pB=k%,B[%B] 等。 k称为亨利系数,其值与T、p、溶剂、溶质以及溶液 组成的表示方法有关。 使用亨利定律要求溶质在气、液两相中的存在形态 相同。如水中NH3、HCl不能用,CO2只可近似应用。
∂∆ G ∆ mix S = − mix = − R ∑ nB ln xB ∂T p B
B
∂∆ mix G = 0 ∆ mixV = ∂p T
上一内容 下一内容 回主目录
∆ mix H = ∆ mix G + T ∆ mix S = 0
返回
2012-3-17
上一内容 下一内容 回主目录
返回
2012-3-17
三、偏摩尔量的的几个重要公式
1、集合公式 、 定T定p定组成条件下:
dZ = ∑ Z BdnB
nk
在保持偏摩尔量不变的情况下,对上式积分
Z = Z1 ∫ dn1 + Z 2 ∫ dn2 + ⋅ ⋅ ⋅ + Z k ∫ dnk
0 0 0 n1 n2
= n1 Z1 + n2 Z 2 + ⋅ ⋅ ⋅ + nk Z k
上一内容 下一内容 回主目录
返回
2012-3-17
三、拉乌尔定律与亨利定律的应用
1、用拉乌尔定律测定非挥发性溶质的摩尔质量M 、用拉乌尔定律测定非挥发性溶质的摩尔质量
4-3多组分系统热力学-理想液态混合物与理想稀溶液

Physical Chemistry
物理化学(上册)
绪论 第一章 气体 第二章 热力学第一定律 第三章 热力学第二定律 第四章 多组分系统热力学 第五章 化学平衡 第六章 相平衡
第四章 多组分系统热力学
§4-!本章基本要求 §4-1多组分系统热力学概念 §4-2拉乌尔定律与亨利定律 §4-3偏摩尔量 §4-4化学势 §4-5理想液态混合物 §4-6理想稀溶液 §4-7活度活度系数 §4-8化学势小节 §4-$小结与学习指导
d* S*dT V *dp
B
B
B
mixG p
T
B
nBVB
B
nBVB* mixV
2. mixV 0 或 V mix m 0
mix p
G
T
(RT
nB ln xB )
B
p
T
0
§4-5理想液态混合物
四、理想液态混合物混合性质
dG B S B dT VB dp
dG * S * dT V *dp
B
B
6.
mixU mix H P mixV 0
mixU 0 或 mixU m 0
§4-5理想液态混合物
四、理想液态混合物混合性质
小结: 1. mixV=0 , mixU=0 , mixH=0 2. Q=0, W=0 3. mixS=-RnBlnB>0 (绝热 S>0)
mixA=RTnBlnB<0 (恒温恒容W =0 A<0) mixG=RTnBlnB<0 (恒温恒压W =0 G<0)
§4-6理想稀溶液
一、理想稀溶液定义 无限稀溶液,溶质的浓度趋于零的溶液。 对溶剂(A表示)用符合拉乌尔定律
《物理化学》(南大第五版)知识点总结

W=ΔU= CV dT ;ΔH= Cp dT
不可逆绝热过程:Q=0 ; 利用 CV(T2-T1)=-pe(V2-V1)求出 T2, W=ΔU= CV dT ;ΔH= Cp dT 2、相变化 可逆相变化:ΔH=Q=nΔ_H; W=-p(V2-V1)=-pVg=-nRT ; ΔU=Q+W
B (T , p, sln ) b , B (T ) RT ln a b , B ; ab,B=γb,B bB;
标准态为:同温下 bB=1 且符合
亨利定律的溶质(假想状态) 。
B (T , p, sln ) %, (T ) RT ln a%, B ; a%,B=γ%,B[%B]; B
标准态为:同温下[B%]=1 且
符合亨利定律的溶质(一般为假想状态) 。 三、各种平衡规律 1、液态混合物的气液平衡
* pA=p * A ax,A ; pA=p A ax,A ; p=pA+pB
2、溶液的气液平衡
pA=p * A ax,A;pB=kx,Bax,B=kb,Bab,B=k%,Ba%,B;p=pA+pB
r Gm (T ) RT ln K
[ p( H 2 ) / p ][c( ZnCl 2 )] c2 (H C l )
三、 范特荷夫等温方程
r Gm (T ) r Gm (T ) RT ln J RT ln J / K
四、平衡常数与温度的关系
B f Gm ( B,298)
(4)ΔG 与温度的关系 ΔG=ΔH-TΔS ,设 ΔH、ΔS 不遂温度变化。 五、化学势 1、化学式的定义和物理意义
B (
G ) T , p ,nc ( c B ) ;在 T、p 及其他物质的量保持不变的情况下,增加 1molB 物质引 n B
中国石油大学华东物理化学课件溶液4-5

二、理想液态混合物中各组分的化学势 设 (A+B) 理 想 液 态 混 合 物 , 一 定 温 度 、 压 力
下达到气液平衡时:
对A组分 A (l) A (g)
ΘA (T )
RT
ln
pA pΘ
ΘA (T )
RT
ln
pA* xA pΘ
ΘA (T )
RT
ln
pA* pΘ
RT
ln
xA
A* (l) RT ln xA
RT ln xA(2) 2RT ln xB(2) 2RT ln xA(1) 2RT ln xB(1)
8.314
298(ln
1 3
2 ln
2 3
2 ln
1 2
2 ln
1 2
)J
2139.4J
∴ WR G 2139.4J
例4 20℃下,将压力为pΘ的1mol气态NH3溶解到大
量的物质的量之比为 nNH3 : nH2O 1: 21 的溶液中。
例3 在298.15K时,要从下列混合物中分出1mol纯A,试计算 Gibbs自由能的变化值及最少必须做功的值。 (1)大量的A 和B的等物质的量的混合物; (2)含A和B的物质的量各为2mol的混合物。 (p267 7题参考)
解:(1)
大量A和B混合物 T, p一定,G大量A和B混合物
nA : nB 1:1
GΘ m
NH3
Θ NH3
RT ln
pNH3 pΘ
8.314
293
.15
ln
3.6 101 .325
J
8134
J
问 题
0.5mol萘溶于1升苯中形成的溶液,与
0.25mol萘溶于0.5升苯中形成的溶液,二溶液
混合物分类

混合物分类
混合物是一种复杂的物质,由两种或者多种物质组成。
它们可以分为混合物和溶液两大类。
在化学上,混合物常常指固态物质,而溶液则指液态物质。
混合物中包含有多种元素,这些元素经过化学反应形成了一种新的物质,称为混合物。
根据不同的性质,混合物可以分为可溶物和不溶物两大类。
可溶物具有一定的溶解度,可以在水等液体中溶解成有机物质,例如食盐、糖等;而不溶物在任何液体中都不能溶解,例如铁、石英等。
混合物还可以按照均质性和不均质性分类。
均质混合物存在于混合物中,其中每一个组分的含量和特征都是完全相同的,例如金属合金;而不均质混合物则是由不同组分组成的,其中每一个组分的含量和特征都是不同的,例如乳糖和乳清混合物。
此外,混合物还可以按照其物理性质分为离子性混合物和分子性混合物。
离子性混合物是指由正离子和负离子组成的混合物,它们构成的物质可以在水中溶解;而分子性混合物则是指由分子构成的混合物,它们在溶剂中可以构成溶液。
最后,可以提出一种更宏观的分类,就是按照混合物中存在比例的不同,可分为完全混合物和不完全混合物。
完全混合物指的是混合物中所有组分的比例都是一定的,而不完全混合物则是混合物中某些组分的含量要远远大于其它组分,比如气体混合物中的一氧化碳和二氧化碳就是不完全混合物。
以上就是混合物的分类方法。
混合物的形成和性质都受其组成物
的影响,因此了解不同混合物的组成,有助于我们更好的了解其分类特点和性质特征,从而运用在实际应用中。
液体混合物与溶液

四、化学势与温度和压力的关系
Bf(T,p,xB ,xC , )
对一个给定的溶液 Bf(T,p)
1. B与T的关系:
TBp,nB,nC,TnG BT,p,nC, p,nB,nC,
n B G Tp,nB,nC, T,p,nC, ( nB S)T,p,nC,
第三章第三章液体混合物与溶液液体混合物与溶液第三章第三章液体混合物与溶液液体混合物与溶液第三章第三章液体混合物与溶液液体混合物与溶液第三章第三章液体混合物与溶液液体混合物与溶液溶液的特点及其组成表示方法溶液的特点及其组成表示方法一溶液的特点定义
第三章 液体混合物与溶液
第四第章三章多液组体混分合系物与统溶热液 力学
➢ 容量性质: VV(T,p,nB ,nC , )共k+2个变量
二元溶液
,xC , )共k+1个变量
二元溶液
(T,p,xB) (T,p,x)
偏摩尔量 (Partial molar quantities)
1. 问题的提出
结果 恒温、恒压下混合后,混合物的体积不等于混合前纯组
➢ 其他常用的偏摩尔量及它们之间的关系: UB, HB, SB, AB, GB,……
HBUBpB V ABUBTB S G B A B p B H V B T B U S B p B T V B S
三、集合公式 (Additive formula)
nBVBV
(1) 意义: (2) 二元溶液,
B Bd0
即
BB0
< 自发 = 平衡
结论:在等T,p,W’ = 0的条件下,化学反应向着 化学势降低的方向。化学平衡时化学势相等。
理想液态混合物 与理想溶液的区别

●如果两种纯液体组分能按任意的比例相互混溶,那么就会形成理想液态混合
物。
在一定的温度和压力下,液态混合物中任意一种物质在任意浓度下均遵守拉乌尔定律的液态混合物称理想液态混合物。
●溶液中的任一组分在全部浓度范围内都符合拉乌尔定律的溶液称为理想溶
液。
二者的区别:
①理想液态混合物是混合物,至少有两个相态存在.理想溶液是溶液只有一个相态存在.
②在一定的温度和压力下,理想液态混合物满足其中任意一种物质在任意浓度下均遵守拉乌尔定律
③理想溶液中,当各组分混合成溶液时,没有热效应和体积的变化。
④除了光学异构体的混合物、同位素化合物的混合物、立体异构体的混合物以及紧邻同系物的混合物等可以(或近似地)算作理想溶液外,一般溶液大都不具有理想溶液的性质。
⑤如果两种纯液体组分能按任意的比例相互混溶,那么就会形成理想的液态混合物。
通常,两种结构相似或极性相似的化合物可以按任意比例混合,并形成接近理想的液态混合物,如苯和甲苯、水和重水等。
《物理化学第4版》第四章4-1 多组分系统组成表示法ppt课件

1. 混合物及溶液的分类
多组分系统
非均相(多相) 均相(单相)
混合物 溶液
1
(i) 对混合物中的各组分不区分为溶 剂及溶质,对各组分均选用同样 的标准态;
(ii) 对溶液中的各组分区分为溶剂 及溶质,并选用不同的标准态加 以研究。
2
按聚集状态不同,
气态混合物如空气;
混合物液态混合物如苯和甲苯;
固态混合物如粘土和沙石。 液态溶液如Mn Fe液态合金;
溶液 固态溶液(固溶体黄铜 青铜等);
3
液态溶液— 简称溶液电非解电质解溶质液溶如 液食 (盐 分水 子溶 溶液液; 如高分子溶液)
非电解质溶液:蔗糖水溶液; 氧O2溶于水; 乙醇水溶液 H2O(l)—— C6H5NH3(l)溶液;
金属溶液: Fe(l)—— Mn(l)溶液; Cu(l)——Zn(l)溶液。
MA
bB
MA
17
def cB nB /V
SI单位:moldm-3
8
五、溶质B的质量摩尔浓度 溶质B的物质的量与溶剂的质量之比。
bB 或mB def nB / mA
用于液态或固态溶液的溶质,也可 以用下式定义:
bB 或mB def nB /(nAM A )
SI 单位:molkg-1 9
由于溶质B的质量摩尔浓度与温度无 关,在热力学处理中比较方便。在电 化学中也主要采用该浓度表示电解质 的浓度。
12
x1 = n1 / (n1 + n2 )= 0.321 mol / (0.321 mol+0.652 mol) = 0.329 b1= n1 /m2 = 0.321 mol / 30.0 10-3 kg = 10.7 molkg-1 w1 = m1 / ( m1+ m2 ) = 25.0 g / (25.0+30.0) g = 0.455
物理化学(第五版) 演示文稿4-5 理想液态混合物和溶液的相平衡

解: 以100g混合物为计算基准
mFe
xFe
M Fe
mFe M Fe
mMn M Mn
99.00 / 55.85 99.00 1.00 55.85 54.93
0.9898
x(Fe)=0.9898; x(Mn)=0.0102 p(Fe)=p*Fe x(Fe)=133.3Pa 0.99=132Pa p(Mn)=p*Mn x(Mn)=101325Pa0.0102=1033Pa p = p(Fe) + p(Mn)=1165Pa y(Fe)=p(Fe)/p=132Pa/1165Pa=0.113 y(Mn) =1-0.113 = 0.887
T
b
T
b
T
b
T
b
当溶液很稀时, -lnxA= -ln(1-xB) xB ,
而且当 Tb与Tb* 相差不大时, TbTb* Tb* 2
又令 Tb = Tb – Tb* , 则:
xB
vap H m ,A R(Tb* )2
Tb
对于稀溶液:
xB = nB / nA= nBMA / mA = bBMA
RT ln
pA* p
A
A (g) A
RT ln
pA p
* A
A
半透膜
pA* pA
* A
A
称为渗透压,阻止水分子渗透必须外加的最小压力。
若外加压力大于渗透压,水分子向纯水方渗透,
称为反渗透,可用于海水淡化、污水处理等。
Π cBRT —范特荷夫公式
(仅适用于稀溶液)
诺贝尔化学奖
首位得主
van't Hoff (1852-1911) , 荷兰
A(g, T, p)
理想液态混合物定义

理想液态混合物定义理想液态混合物是指在一定温度和压力下,两种或多种液体成分完全混合形成的均匀溶液。
这种混合物的形成是通过分子间的相互作用力来实现的,而不是通过化学反应。
理想液态混合物具有许多独特的性质和应用。
理想液态混合物的成分是均匀分布在整个溶液中的。
这意味着在任何给定的体积中,每一种成分的浓度是相同的。
这种均匀性使得理想液态混合物在实际应用中非常有用,例如在制备药物、化妆品和食品加工过程中。
理想液态混合物的物理性质可以通过混合物中各成分的性质加权平均得到。
例如,混合物的密度可以通过各成分的密度按照其在混合物中的百分比加权平均得到。
这使得我们可以根据已知成分的性质预测混合物的性质,从而方便地进行工程设计和实验操作。
理想液态混合物的沸点和凝固点等相变性质也可以通过各成分的性质加权平均得到。
这对于纯化和分离混合物中的成分非常有用。
根据混合物中各成分的沸点差异,我们可以通过蒸馏的方法将混合物分离成不同的组分。
理想液态混合物还具有溶解性和扩散性。
在理想液态混合物中,各成分之间会相互扩散,从而导致溶解和混合。
这使得我们可以通过调整温度、压力和浓度来控制混合物中各成分的含量,从而实现特定的应用需求。
理想液态混合物的粘度和表面张力等性质也受到各成分性质的影响。
通过调整成分比例,我们可以改变混合物的粘度和表面张力,从而适应不同的工艺要求。
在实际应用中,理想液态混合物有着广泛的应用。
例如,在制备药物时,理想液态混合物可以将多种活性成分溶解在一起,以提高药效和稳定性。
在化妆品生产中,理想液态混合物可以将不同的成分混合在一起,以获得所需的质地和功效。
在食品加工中,理想液态混合物可以将多种调味料和添加剂混合在一起,以提供特定的口感和营养价值。
理想液态混合物是一种具有均匀性和可预测性的溶液。
它有着独特的物理性质和应用,可以用于制备药物、化妆品和食品等领域。
通过混合不同的成分,我们可以调整理想液态混合物的性质,以满足特定的需求。
多组分系统热力学

第四章 多组分系统热力学 主要内容1.混合物和溶液(1)多组分系统的分类含一个以上组分的系统称为多组分系统。
多组分系统可以是均相(单相)的,也可以是非均相(多相)的。
将多组分均相系统区分为混合物和溶液,并以不同的方法加以研究:(Ⅰ)混合物:各组分均选用同样的标准态和方法处理;(Ⅱ)溶液:组分要区分为溶剂及溶质,对溶剂及溶质则选用不同的标准态和方法加以研究。
(2)混合物及溶液的分类混合物有气态混合物液态混合物和固态混合物;溶液亦有气态溶液液态溶液和固态溶液。
按溶液中溶质的导电性能来区分,溶液又分为电解质溶液和非电解质溶液(分子溶液)。
2.拉乌尔定律与亨利定律拉乌尔定律与亨利定律是稀溶液中两个重要的经验规律。
(1)拉乌尔定律平衡时,稀溶液中溶剂A 在气相中的蒸气分压A p 等于纯溶剂在同一温度下的饱和蒸气压与该溶液中溶剂的摩尔分数A x 的乘积。
这就是拉乌尔定律。
用数学式表达拉乌尔定律为 A *A Ax p p = (2)亨利定律一定温度下,微溶气体B 在溶剂A 中的溶解度B x 与该气体在气相中的分压B p 成正比。
也可表述为:一定温度下,稀溶液中挥发性溶质B 在平衡气相中的分压力B p 与该溶质B 在平衡液相中的摩尔分数B x 成正比。
这就是亨利定律。
用数学式表达亨利定律为: B B ,B x k p x =B ,x k 、B ,b k 为以不同组成标度表示的亨利系数,其单位分别为Pa ,Pa·kg·mol -1。
应用亨利定律时,要注意其不同表达式所对应的亨利系数及其单位。
还要注意亨利定律适用于稀溶液中的溶质分子同气相同种分子相平衡,即亨利定律适用于稀溶液中的溶质在液相及气相中具有相同分子形态的场合。
3.偏摩尔量(1)偏摩尔量的定义设X 代表V ,U ,H,S ,A ,G 这些广度性质,则对多组份系统(混合物或溶液)即 X =f (T ,p ,n A ,n B ,…)定义 ()B C C,,,B B def ≠⎪⎪⎭⎫ ⎝⎛∂∂n p T n X X式中,X B称为广度性质X (X=V ,U ,H ,S ,A ,G 等)的偏摩尔量,它们分别为只有系统的广延量才具有偏摩尔量,偏摩尔量是强度量。
第四章 液态混合物和溶液

返回
2013-6-28
§4.2 拉乌尔定律和亨利定律
一、液态混合物和溶液的气、液平衡
气态混合物的总压力为
p pA pB pC pB
B
yA, yB, yC pA,pB,pC A,B,C…… xA ,xB , xC
T一定 平衡
§4.4 理想液态混合物和理想稀溶液的化学势 例:
已知AgCl、PbCl2在800℃时可做为理想液态混合物, 求300g PbCl2和150g AgCl混合成混合物时的熵变 和吉布斯函数的变化。 已知:M(PbCl2) = 228 gmol-1 M(AgCl) = 143.5 gmol-1
上一内容
B B,[%] RT ln[%B]
在p下, [%B]=1 且仍遵守亨利定律时, 纯溶质B的化学势
上一内容
下一内容
回主目录
返回
2013-6-28
§4.5 真实液态混合物和真实溶液的化学势
一、真实液态混合物 1、定义 混合物中任意组分B均不遵守拉乌尔定律 2、活度与活度因子
aB
上一内容
下一内容
回主目录
返回
2013-6-28
§4.2 拉乌尔定律和亨利定律
例3:
0℃,p (O2)= 101325Pa 时,1000g水中至多可溶 解氧气48.8 cm3 求:(1)0℃,外压为101325Pa时,氧气溶于水的 亨利系数 (2) 0℃,每1000g置于101325Pa的空气中的水 最多可溶解多少克氧气 (氧气可看成理想气体)
def
f B xB
组分B的活度因子
任意组分B的活度
上一内容 下一内容 回主目录
返回
液态混合物和溶液-物理化学

如果组成溶液的物质有不同的状态,通常将液态 物质称为溶剂,气态或固态物质称为溶质。
如果都是液态,则把含量多的一种称为溶剂,含 量少的称为溶质。
以物态分
气态溶液(如空气)、 固态溶液(如金属固熔体) 液态溶液。
以溶质的导电性分 )
多组分均匀体系中,溶剂和溶质不加区分,各组 分均可选用相同的标准态,使用相同的经验定律, (一视同仁)这种体系称为混合物,也可分为气态 混合物(如空气)、液态混合物(如石油)和固态 混合物(如合金)。
单位:mol·kg-3
37 B的摩尔比:
rB
nB nA
.
6
§4.2 拉乌尔定律和享利定律
一:拉乌尔定律-溶剂的气液平衡规律
在一定的温度下 PA< PA*
A(g) PA*
A(L)
PA A+B
❖ 在一定温度下,稀溶液中溶剂的蒸汽压PA等于纯溶剂 的 蒸 汽 压 PA* 与 其 溶 液 中 纯 溶 剂 的 摩 尔 分 数 xA 的 乘 积 用数学式可表示为:
第四章 液态混合物和溶液
溶液(solution)(混合物)
广义地说,两种或两种以上物质彼此以分子或离子 状态均匀混合所形成的体系称为溶液(混合物) 。
溶液和混合物的区别:
溶液有溶剂和溶质之分而混合物没有;对溶液中 的溶剂和溶质采用不同的研究方法,而对混合物 则采用同一的研究方法。
.
1
溶剂(solvent)和溶质(solute)
PA*- PA=ΔPA= PA*xB
(4-2)
溶剂的蒸汽压下降与溶质的摩尔分数成比例。
2.若溶质不止一种,则
pA p*A xB B .
(4-3)
9
二、亨利定律-溶质的气液平衡规律
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.集合公式
若体系发生的过程为等温等压过程,dT=0,dP=0,则
将此式积分,得 ——偏摩尔量的集合公式
它的物理意义——在多组分体系中,广度性质Z等于体系中各组分的偏摩尔量与物质的量之乘积的加和。
例如:
二组分体系,有
与纯物质的摩尔量相似,V = nVm
集合公式是偏摩尔量最主要的性质。另一个性质是吉布斯-杜亥姆公式。
4、系统的组成改变,偏摩尔量也会改变。
xB→1,偏摩尔量→摩尔量。
5、对于均相多组分体系,也只有【T、P、nC】条件下,体系的广度性质X对nB的偏微商才是偏摩尔量。比如 ,而 就不是。
6、 既是化学势,也是偏摩尔吉布斯函数。
7、热力学关系式中的广延性质(U、H、G等),用该广度性质的偏摩尔量来代替也成立,例如
3.吉布斯-杜亥姆公式Gibbs - Duhem’s equation
将集合公式 微分
据
∴ ——吉布斯-杜亥姆公式
将等式左右两边除以物质的总量,得
——吉布斯-杜亥姆公式
此式表明了【T、P】下系统各偏摩尔量之间是联合联系,联合依赖的。
例如:
二组分体系有
n1dV1.m+ n2dV2.m= 0 ;
x1dV1.m+ x2dV2.m= 0 ——→dV1.m= -x2dV2.m/ x1
在【T、P、nC】条件下,
在系统中不断加入组分B,
同时测出相应的体积,
作nB——V图,
则曲线的斜率即为偏摩尔体积。
关于偏摩尔量,要注意几点:图4-1
1、只有广度性质才有对应的偏摩尔量。因为只有广度性质才与体系中物质的量有关。
2、偏摩尔量也是状态函数,是强度性质。
3、只有均相多组分体系才使用偏摩尔量的概念。单组分体系的偏摩尔量等于其摩尔量。
定义——系统中物质B的化学势为:
μB= GB=
物理意义——在恒T、恒P下,除B组分外其它物质的量不变时,加入dnB的物质后系统吉布斯函数发生相应的变化,dGB/dnB的比值称为B组分的化学势。或:在大量物系中加入1molB组分所引起的系统吉布斯函数的改变值。
注意:
(1)化学势是体系的状态函数,强度性质,单位J/mol。
第4章多组分系统热力学
重点:
偏摩尔量的定义,化学势的定义,纯理想气体、理想气体混合物、理想液态混合物和理想稀溶液中各组分化学势的表达式,拉乌尔定律和亨利定律的内容及应用,理想液态混合物的定义以及理想液态混合物的混合性质,理想稀溶液的定义及稀溶液的依数性及其应用条件。
难点:
理想稀溶液中溶质化学势的表达式中标态的规定。
(2)化学势与温度、压力有关。
(3)纯物质的化学势为:μB= GB= = =Gm
(4)化学势的绝对值不能确定,所以不同物质的化学势不能作比较。
(5)化学势总是指某种物质的化学势,没有整个物系的化学势这种概念,另外化学势,如H2O(l)+H2O(g)物系,只有一种物质,有两个相,化学势也有两个。
2.组成可变的多组分系统的热力学基本方程
说明——【T、P】下,系统中某一个或几个组分的量发生变化时,其它各组分的偏摩尔量也要随之变化,而且系统中各组分偏摩尔量随浓度的变化并不是彼此独立的,而是相互联系的。
§4.2化学势Chemical potential
在各偏摩尔量中,以偏摩尔吉布斯函数应用最广泛,有另一个名称——化学势
1.化学势的定义及表示式
设系统中含有k种物质,其物质的量分别为n1、n2、….、nk,则
G = f(T,p,n1,n2,….,nk)
全微分,有
dG = + + + +….
= + +
而等式在多组分物系中仍然适用,就有
= -S = V
代入dG的全微分式,有
dG = -SdT+Vdp+
或者是,
往无限大的体系中加入1摩尔B物质而引起体系广度性质Z的改变量;
例如:
表示水的偏摩尔体积partial molar volume of water,其物理意义是在【T、P】下,往无限大的体系(此体系不一定是由水组成)中加入1mol水,体系体积的变化量;或往有限的体系中加入微量的水(之所以限制微量,是为了保证体系nC不变)而引起该体系体积的变化。
那么,对于单相多组分系统,是否具有这种简单的加和性呢?
一般来说,不论是什么系统,物质的质量(克)和物质的量(摩尔)总是具有加和性的。但是,系统的其他广度性质则不一定具有简单的加和性。
以体积这一广延性质为例,
Vm*(水)= 18.09 cm3/mol,Vm*(乙醇)= 58.35 cm3/mol,
取1mol水和1mol乙醇混合,其体积V≠(18.09+58.35)cm3= 76.44 cm3,而是74.40 cm3。
重要公式
1.
2.
3.
前言
多组分系统——含两个或两个以上组分的系统称为多组分系统。可以是多相的,也可以是单相的。
根据研究方法的差别,多组分单相系统分为混合物和溶液:
混合物mixture——对多组分单相系统中的各组分用相同的方法研究,则称为混合物。
溶液solution——将多组分单相系统分为溶剂和溶质,并用不同的方法研究,则该系统称为溶液。
说明两组分混合前的体积和(V1+V2)与混合后的实际体积并不相等;两者的差值ΔV亦没有简单的规律。【Flash动画4-1】要找出规律,须引入“偏摩尔量”这个新概念。
在多组分(k个组分)的均相混合系统中,某一广度性质X(例如V、U、H、G),是T和P和各物质物质的量n的函数,即
X = f(T, P, n1,n2, … …nk),显然,X的全微分为
式中nC是除B物质以外的所有其他物质物质的量,B不同,nC也要相应变化。现令
称为B物质的某广度性质X的偏摩尔量partial molar quantities。
则上式可写成
从定义式可以看出,
偏摩尔量的物理意义——在等温等压下,其它组分物质的量不变的条件下,在系统中加入微量B物质dnB而引起Z的微小变化dZ与dnB之比。
气态混合物真实混合物
混合物液态混合物混合物
固态混合物理想混合物拉乌尔定律
遵循一定的规律
液态溶液理想稀溶液亨利定律
溶液溶液
固态溶液真实溶液
电解质溶液
溶液
非电解质溶液
§4.1偏摩尔量Partial molar quantities
1.偏摩尔量
对于纯物质,广度性质具有加和性:
V = nVm,U = nUm,S = nSm,等。
