化学反应工程原理—— 热量传递与反应器的热稳定性
华东理工大学反应工程阶段辅导(3)

当 1, 2 1 3 当 5 , 2
可忽略
Da 1 , Da 5 ,
1 1
1 1 Da
严重
⑶ 影响
2 的因素
T k 2
Cat .活性 k
rP 2
Cb
n=1, n>1, n<1,
C P ,b
C A ,b
①
C A ,es ②
④
C A ,is
③
③ 反应物在颗粒内表面上进
行化学反应(表面反应) ④ 反应产物从内孔深处向孔
C P ,es
C P ,is
口逆向扩散(内)
⑤ 反应产物从催化剂外表面
气膜
外表面
中心
扩散返回气流主体(外)
气固催化反应过程的传递现象 浓度与温度分布
主 气 体 膜 A 气 主 膜 体 A 气 气 相 膜 主 体 气 气 膜 相 主 体
Φ—西勒(Thiele)准数或西勒模数
rP kC De
n 1 b
双曲正切函数 e x e x tanh x x e e x
对一级不可逆反应,球形颗粒:
3 1 1 2 ( ) tanh
当 1, 2 1 3 当 5 , 2
C es 1 1 = Cb 1 Da
一般情况下
1 (
C es Cb
) (1 1 Da )
n
n
Da 1 , Da 5 ,
1 1
1 1 Da
1 Da
1 Da
的测定:
R ( rA ) lim R 1 Da ( rA ) lim ( N A ) lim kgaC b
化学反应工程原理-副本第九章 热量传递与反应器的热稳定性
第九章热量传递与反应器的热稳定性
1.如何区分反应过程中的反应与传热的交联作用所产生的热稳定性问题和参数灵敏性问题?
2.
2.作出催化剂颗粒放热曲线和移热曲线,说明哪些点是稳定点,哪些点是不稳定点?稳定的条件是什么?
3. 作出催化剂颗粒放热曲线和移热曲线,说明哪些点是催化剂颗粒临界着火点,催化剂颗粒临界着火的条件是什么?哪些点是催化剂颗粒临界熄火点?催化剂颗粒临界熄火的条件是什么?
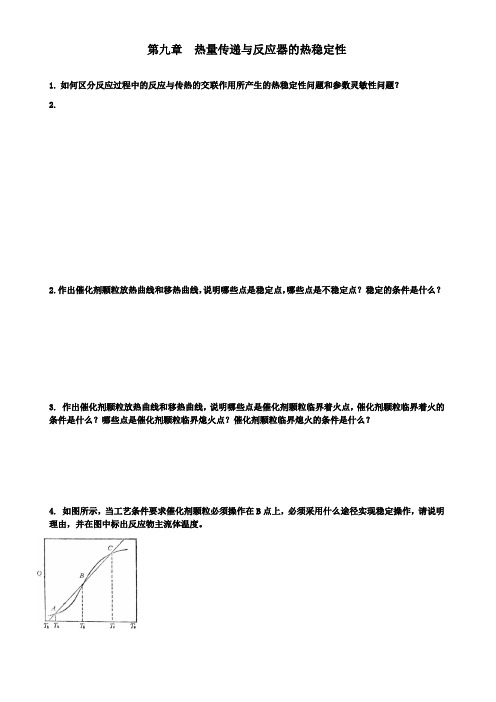
4. 如图所示,当工艺条件要求催化剂颗粒必须操作在B点上,必须采用什么途径实现稳定操作,请说明理由,并在图中标出反应物主流体温度。
化学反应工程原理-热量传递与反应器的热稳定性

04 热量传递与反应器热稳定 性关系
热量传递对反应器热稳定性影响
温度梯度
热量传递导致反应器内温度分布不均,形成温度 梯度,影响反应速率和选择性。
热应力
不均匀的温度分布导致反应器材料产生热应力, 可能引发破裂或变形。
热失控
过度的热量积累可能导致反应器热失控,引发安 全事故。
反应器热稳定性对热量传递要求
传热面积等。
选用高性能材料
选择具有优良传热性能和高温 稳定性的材料,如陶瓷、金属 合金等。
强化热量管理
采用先进的热量管理技术,如 热管技术、微通道反应器等, 提高热量传递效率。
引入控制系统
引入先进的温度控制系统,实 现反应温度的精确控制,确保
反应器热稳定性。
05 热量传递与反应器热稳定 性实验方法
热稳定性影响因素
01
反应器结构
反应器的形状、尺寸、材质和保温措施等结构因素都会影响其热稳定性。
例如,反应器壁面厚度和材质热导率会影响热量传递速率,从而影响热
稳定性。
02
操作条件
操作压力、温度、物料浓度和流速等操作条件对反应器的热稳定性也有
显著影响。例如,高温高压条件下,反应速率加快,热量生成增多,对
优化措施
为实现优化目标,采取了多种措施,包括 改进换热器设计、优化操作参数、实施节 能技术改造等。
THANKS FOR WATCHING
感谢您的观看
基于模拟的评价方法
通过建立反应器的数学模型,模拟不同操作条件下的温度响应过程,分析模拟结果中的温 度波动范围和稳定时间等参数,评价反应器的热稳定性。这种方法成本低、效率高,但模 型精度和适用性需要验证。
基于理论分析的评价方法
通过分析反应器内的热量传递和反应动力学过程,推导热稳定性的理论判据和评价方法。 这种方法具有普适性,但需要深入的理论分析和计算。
化学反应工程填空题、简答题目汇总

1.三传一反:质量传递、热量传递、动量传递,反应动力学2.化学反应工程是一门专门研究化学反应的工程问题的学科,既以化学反应作为研究对象,又以工程问题为其对象3.反应器的形式,不外乎管式、釜式、塔式、固定床、流化床,操作方式不外乎分批式、连续式、半连续式4.在化学反应工程中,数学模型主要包括:动力学模型、物料衡算式、热量衡算式、动量恒算式、参数计算式。
5.在建立数学模型时,根据基础资料建立物料、热量和动量恒算式的一般式为:积累量=输入量-输出量6.均相反应是指:在均一的液相或气相中进行的反应7.均相反应的速率取决于物料的浓度和温度8.多相反应过程是指同时存在两个或更多相态的反应系统所进行的反应过程9.非理想流动:凡是流动状况偏离平推流和全混流这两种理想情况的流动,统称为非理想流动10.理想混合反应器是指:理想混合反应器、平推流反应器11.视催化剂的运动情况可分为固定床、流化床等装置12.催化剂的中毒:均匀中毒、壳层中毒13.催化剂的制备方法:混合法、浸渍法、共凝胶法、喷涂法、溶蚀法、热熔法14.气固相催化反应,要测定真实的反应速率,首先要排除内扩散和外扩散的影响15.化学反应速率是指单位反应体系内反应速率和时间的变化率16.如果反应物分子在碰撞中一步直接转化为生成物分子,则该反应为基元反应17.几个基元反应才能转化为生成物分子的反应,则称为非基元反应18.反应级数在一定温度范围内保持不变,它的绝对值不会超过3,可以是分数、负数、019.反应级数(n)的大小反映了该物料浓度对反应速率影响的程度,n越高,该物料浓度对反应速率的影响越显著,n=0,在动力学方程中该物料的浓度项就不出现,说明该物料浓度的变化对反应速率没有影响,如果n为负值,说明该物料浓度的增加的反而抑制了反应,使反应速率下降。
20.非均相催化反应过程的三个控制步骤分别是外扩散过程、内扩散过程、化学动力学过程21.催化剂失活的类型和原因大致可分为物理中毒、化学中毒、结构变化22.孔径较大时,分子的扩散阻力是由于分子间的碰撞所致,这种扩散就是分子扩散或容积扩散,当微孔的孔径小于分子的自由程(约0.1ηm)时,分子与孔壁的碰撞机会超过了分子间的相互碰撞,从而前者成了扩散阻力的主要因素,这种扩散成为克努森扩散,当分子扩散和克努森扩散同时存在时,为综合扩散23.停留时间不同的流体颗粒之间的混合,通常称为返混24.平推流(PFR):反应物料以一致的方向向前移动,在整个截面上各处的流速完全相等特点:所有物料颗粒在反应器中的停留时间是相同的,不存在返混25.全混流(CSTR):刚进入反应器的新鲜物料与已存留在反应器中的物料能达到瞬间的完全混合,以致在整个反应器内各处物料的浓度和温度完全相同,且等于反应器出口处物料的浓度和温度。
化学反应工程综合复习资料(有答案)

《化学反应工程》综合复习资料(模拟题)一、填空题:1.所谓“三传一反"是化学反应工程学的基础,其中“三传”是指、和,“一反”是指。
2.各种操作因素对于复杂反应的影响虽然各不相同,但通常温度升高有利于活化能的反应的选择性,反应物浓度升高有利于反应级数的反应的选择性。
3.测定非理想流动的停留时间分布函数时,两种最常见的示踪物输入方法为和.4.在均相反应动力学中,利用实验数据求取化学反应速度方程式的两种最主要的方法为和.5.多级混合模型的唯一模型参数为,轴向扩散模型的唯一模型参数为。
6.工业催化剂性能优劣的三种最主要的性质是、和.7.平推流反应器的E函数表达式为,其无因次方差2θσ= ,而全混流反应器的无因次方差2θσ=。
8.某反应速率常数的单位为m3/(mol。
hr),该反应为级反应。
9.对于反应22A B R+→,各物质反应速率之间的关系为:(-r A):(-r B):r R=。
10.平推流反应器和全混流反应器中更适合于目的产物是中间产物的串联反应.11.某反应的计量方程为A R S→+,则其反应速率表达式。
12.物质A按一级不可逆反应在一间歇反应器中分解,在67℃时转化50%需要30min,而在80℃时达到同样的转化率仅需20秒,该反应的活化能为.13.反应级数(可能/不可能)大于3。
14.对于单一反应,在相同的处理量和最终转化率条件下,选择反应器时主要考虑;而对于复合反应,选择反应器时主要考虑的则是;15.完全混合反应器(全混流反应器)内物料的温度和浓度,并且(大于/小于/等于)反应器出口物料的温度和浓度.16.下图是某连串反应在各转化率下的产物浓度分布曲线,那么当转化率达70%时,中间产物R的化学反应工程定义总收率为,按炼厂或化工厂惯用的收率和选择性的定义,在该转化率条件下的收率是,选择性是.1.0A R S0.80.6C/C A00.40.200.20.40.60.8 1.0X A二、多项选择题:1.关于理想的间歇式反应器、平推流反应器和全混流反应器,下列描述正确的是A. 三者同为理想反应器,但理想的内涵是不同的;B。
化学反应工程第三章

m 1c A0 c A 1 ln m x A 1 ln m 1 mc A m 1 m1 x A
m m xA ln m 1 m1 x A
cB 0 k t
3.3 反应温度
3.2 理想连续流动反应器(1)
一 平推流反应器
1.1. 平推流反应器的特点 流体在管内作平推流流动具有如下特征: (1) 在与流动方向呈垂直的截面上没有流速分布; (2) 而在流体流动的方向不存流体质点间的混合,即无返混现象; (3) 离开平推流反应器的所有流体质点均具有相同的平均停留时间, 而这个停留时间就等于反应时间。
k1 cQ k 2
cp
3.1.2 间歇反应器内复合反应的计算(4)
二 连串反应 等温间歇反应器进行一级不可逆连串反应
K1 K2 A P Q
dcA k1c A dt dc p k1c A k 2 cP dt
t 0, c A c A0 , cP 0, cQ 0, 积分第一式: c A c A0 e k1t 或 t 1 c A0 1 1 ln ln k1 c A k1 1 x A
B
A
O
D
E
t
间歇反应器最优化反应时间
3.1.3 间歇反应器优化操作(3)
(2) 以生产费用为目标
AT
at a0t0 a f VR cR
dcR ac at a t a 0 0 f R dt dA dcR cR 当 T =0, dt dt t a0t0 a f / a dAT 2 dt VR cR
产物P的浓度先增大,在降低,存在极大值。可对cp对时间求导, 得最优化时间
topt ln k1 / k 2 k1 k 2
第一二章 化学反应工程基础

结构型式
适用的相态
应用举例
反应釜(包括 液相、气-液相、液-液 苯的硝化、氯乙烯聚合、高压聚乙烯、
多釜串联)
相、液-固相
顺丁橡胶聚合等
管式 鼓泡塔
气相、液相
石油裂解、甲基丁炔醇合成、高压聚乙 烯等
气-液相、气-液-固(催 硫酸的生产、苯的烷基化、二甲苯氧化、
化剂)相
乙烯基乙炔合成等
固定床
气-固(催化或非催化) 二氧化硫氧化、氨合成、乙炔法制氯乙
• 由于反应过程中反应物料的浓度随时间不断 变化,所以间歇反应是不稳定过程。这类反 应器通常是使用釜式反应器。
• 间歇反应器能用一釜进行多品种的生产, 操作灵活性与弹性大,投资小,适用于小 规模多品种的生产过程。
• 但间歇反应器操作需要较多的辅助时间(投、 出料,清洗、升温等),所以设备的利用率 低,产品质量不易均匀,特别在聚合物生 产时会使聚合产物的聚合度及其分布发生 变化,影响产品的性能。
第二章 化学反应工程基础
第一节 化学反应和反应器分类
第一节 化学反应和反应器分类
一、化学反应的分类 二、反应器的分类 三、连续反应器内流体流动的两种理想型态
一、 化学反应的分类
• 按化学反应的特性分类 • 按反应物料的相态分类 • 按反应过程进行的条件分类
(1)按化学反应的特性分类
反应机理
简单反应、复 杂反应
3. 一级可逆反应
三 复合反应动力学方程式
• 复合反应是有几个反应同时进行,要用几 个动力学方程式来描述。
• 常见的复合反应有平行反应、连串反应、 平行连串反应。
1. 平行反应
2. 连串反应
由上图可以看出,A的浓度呈指数下降,S的浓度随反应 时间呈连续上升形状,而R的浓度随时间上升到一个最大 值后再下降。将式2-32对t微分,就可以求出tmax
化学反应工程知识点复习

三传一反
动量传递 热量传递 质量传递 反应工程
2·1 概 述
• 均相反应--在均一液相或气相中进行的反应 • 均相反应动力学是解决均相反应器的选型、操
作与设计计算所需的重要理论基础 • 公式:P15
1、化学反应速率及其表示
对于均相反应aA+bB=rR+sS反应速率定义为:
rA
1 V
dpA dt
k1 pA
k2 pP
k1 pA
2.5k2 pA0
pA
积分,得
(k1 2.5k2 )t
ln
pAe pA0 pA pAe
以(-ln(pA-pAe))对t作图
y 0.1633t 2.5035
k1 2.5k2 0.1633
K
k1 k2
2.5( pA0 pAe
pAe )
2.5(1 0.2) 0.2
10
k1 0.131 k2 0.0131
rA 0.131pA 0.0327 pA0 pA
2.2.2 复合反应
复合反应是指同时存在两个以上独立进行反应的反应过 程。
从相同的反应物按各自的计量关系同时地发生的过程称为 平行反应。
如果这些反应是依次发生的,这样的复合反应称为串联反 应。
反应的反应级数或总反应级数:指浓度函数中各组分 浓度的幂数之和。
对可逆反应,有正反应的反应级数和逆反应的反应级数 。
分子数:
对于基元反应:aA+bB=rR+sS
(rA ) k AcA cB
• 分子数:基元反应中反应物分子或离子的个数。 对于基元反应来讲α,β必须是正整数,α+β是基
元反应的分子数,不能大于3(根据碰撞理论, α+β的取值不能大于3,必须是一个小于等于3 的正整数)。
化学反应工程原理—— 热量传递与反应器的热稳定性

kg (− ∆H ) h Cb
∆ TM =
催化剂颗粒的最大温升
26
9.2.4 在上操作点时的催化剂颗粒温度
上操作点的特点
∆(Ts − Tb )很大
催化剂颗粒温度TS很高,无法测定 流体温度Tb很低,可以测定 传质控制
27
在上操作点时过程处于传质控制
表观反应速率=极限传质速率
20
9.2.3 临界着火条件与临界熄火条件
“着火”现象: C和u一定,Tb↑, 当Tb超过Tig时, 下操作点→上操作点 Tig—催化剂颗粒的 临界着火温度
1 2 3 4
21
“熄火”现象和熄火温度: 熄火”现象和熄火温度:
催化剂处于上操作点时, 使Tb逐渐↓,当Tb稍低于 Tex时, 上操作点下降到下 操作点。 Tex—为催化剂颗粒的临界 熄火温度
E (−∆H )k0CA0VR exp(− ) RT = E 1 + k0τ exp(− ) RT
Q
T
放热速率随反应温度的变化呈S形曲线
33
反应过程的移热速率
器壁传热+反应物流体热焓变化带走的热量
Qr = UA(T − Tc ) + vρcp (T − T0 )
设T0=TC
Q r = (UA + v ρ c p )( T − Tc )
9
9.2 催化剂颗粒的热稳定性
10
9.2.1 催化剂颗粒的定态温度
反应放热速率
Qg = (−∆H r ) RVp
T低时,过程为反应控制
Qg = ( − ∆H r ) kCbnV p
T高时,过程为扩散控制
Qg = (−∆H r )kg aCbVp
第九章、热量传递与反应器的热稳定性课件

以Qg—T作图为一S形曲线,如下图示。 反应过程的移热速率:
假设T0=Tc,且ρ 、Cp不随温度变,则: 以Qr—T作图为一直线。
25
26
二、全混釜的热稳定性 A 、B 、C三点均为满足热平衡条件的定态点。
A点: 当有扰动使T略大于TA 时(dT>0),有Qg<Qr ,移热速
率大于放热速率,体系温度下降,自动恢复到a点。当有扰动使 T略小于TA 时,有Qg>Qr ,移热速率小于放热速率,体系温度 上升,自动恢复到A点。
催化剂与颗粒间的传热速率为:
15
催化剂在临界着火条件下的特征为: 在临界着火点处,反应温度较低,其极限反应速率远远小于
极限扩散速率,固可近似认为: CS=Cb ,则有: 将上式对Ts求导数:
16
将
代入:
对TS求导数得:
得:
又据:
两式相除得:
17
在临界着火点: TS=TSi , Tb=Tig 固有:
率小于放热速率,体系继续温度上降,直至到C点;
当有扰动使T略小于T B 时,有Qr>Qg ,移热速率大于放热 速率,体系温度继续下降,直至到A点。此点为不稳定点。
11
C点: 当有扰动使T略大于Tc 时(dT>0),有Qg<Qr ,移热速
率大于放热速率,体系温度下降,自动恢复到C点; 当有扰动使T略小于TC 时,有Qg>Qr ,移热速率小于放热
致反应温度和反应结果的剧烈变
化,灵敏性很高。 o
37
同样,在D点操作时,若传热系数U增大,其Qr线的斜率会 相应增大,操作点会由原D点移至E点,表现出极大的灵敏性。
若在E点操作, TC升高时, Qr线会右移,操作点会从E点升 至D’ 点;另外, U减小, Qr线的斜率会相应减小,也会造成操作 点的移动,使温度剧升,此现象称为“飞温”。
环境工程原理第四章 热量传递

3、辐射传热
以电磁波形式发出辐射能的过程。 特点:辐射传热不仅是能量的传递,还伴随着能量的
转化。不需要任何介质作媒介,可以在真空中
传播。
传热过程的基本问题 ⑴ 载热体用量的确定; ⑵ 设计新的换热器; ⑶核算现有换热器的传热性能; ⑷ 强化或削弱传热的方法。 热量恒算
解决这些问 题需要两个 基本关系式
纯液体的导热系数比溶液的导热系数大。
4、气体的导热系数
气体导热系数很小,不利于导热,但利于保温。
气体导热系数随温度升高而加大 。 在相当大的压强范围内,气体的导热系数随压强变 化极小。
注意:传热过程中,物质内不同位置的温度可能
不同,因而导热系数也不同,工程计算中常取导热系 数的算术平均值。
r1q1 r2q2 r3q3
【例题4.2.3】外径为426mm的蒸汽管道外包装厚度为 426mm 的 保 温 材 料 , 保 温 材 料 的 导 热 系 数 为 0.615 W/(m· K)。若蒸汽管道外表面温度为177℃,保温层的 外表面温度为38℃,试求每米管长的热损失和保温层 中的温度分布。
r
b
(T1 T2 ) T Q R R
导热热阻,K/W
Q T q A r
温差为传 热推动力
单位传热面积的导热热阻,m2· K/W
传导距离越大,传热壁面和导热好,相接触两表面温度相同,T1>T2>T3>T4 稳态热传导中,通过各层的热流量相等,故有:
成正比。
傅立叶定律的表达式
t dQ dA n
t dQ dA n
dQ ──传热速率,W或J/s; dA ── 导热面积,m2; t/ n ── 温度梯度,℃/m或K/m;热量传递的推动力 ── 导热系数,W/(m· ℃)或W/(m· K)。 负号表示热流方向与温度梯度方向相反(即热量向温度降低 方向传递)。
环境工程原理 第四章 热量传递

有利于提高管程流体的流速和对流传热系数,但能量损失增加,传热
温度差小,程数以2、4、6程多见。 管外流体每通过一次壳体成为一个壳程。在管外装有折流板(或挡 板)可以提高壳程流体的流速,以保持较高的传热系数,折流板形式 常用的有弓形和盘环形两种。折流板同时起中间支架作用。
换热器
*列管式换热器
优点:
固体壁面的形状、尺度、方位、粗糙度、是否处于管 道进口段以及是弯管还是直管等。 a c p
(3)流动特征
对流传热
一、影响对流传热的因素
(3)流动特征 流动起因(自然对流、强制对流) 流动状态(层流、湍流) 有无相变化(液体沸腾、蒸汽冷凝) 流体对流方式(并流、逆流、错流)
第四节 辐射传热
浮头补偿 补偿圈补偿 U形管补偿
换热器
选择的原则:
⑴ 不清洁易结垢的物料应选管;
⑵ 需要通过增大流速以提高给热系数的流体应选管; ⑶ 腐蚀性流体宜走管程,以免管束和壳体同时受腐蚀; ⑷ 压力高的流体宜选管程,以防止壳体受压; ⑸ 蒸汽走壳程,冷凝液易于排出;
⑹ 被冷却的流体一般走壳程,便于散热;
⑺ 粘度大流量小流体选壳程,壳程Re>100即可达到湍流。
折流挡板
按一定数目与管束垂直设置;防止短路、增加流速;可 强制流体按规定路径、多次错流经过管束,增加湍动程 度。
t1
t1 T1 T2
T1 T2 t2
t2
热流体 T1
t2
冷流体 t1
T2
换热器
*列管式换热器
冷、热流体两种流体在进行换热时,一种流体通过管内,其行程称
为管程;另一种流体在管外流动,其行程称为壳程。 换热器内通过管内的流体每通过一次管束称为一个管程;管程数多
化学反应工程备课-第三章

非理想流动模型
偏离活塞流的产生的原因: ——涡流、湍动或流体碰撞 反应器中的填料或催化剂引 起旋涡运动(a) ; ——垂直于流体流动方向截 面上的流速不均匀(b);
——填料或催化刑装填不均 匀引起的沟流或短路(c);
——存在死角。
偏离全混流的几种情况 ——搅拌不均匀造成死角(a); ——进、出门管线设置不好引起短路(b); ——搅拌造成再循环。
(2)浓度效应 ——主反应级数大于副反应级数,即需要cA高时,可以采用 活塞流反应器(或间歇反应器);或使用浓度高的原料,或采用 较低的单程转化率等
——主反应级数小于副反应级数,即需要cA 低时,可以采用全 混流反应器;或使用浓度低的原料(也可加人情性稀释剂,也 可用部分反应后的物料循环以降低进料中反应物的浓度);或 采用较高的转化率等。
设计和优化的基础。
反应器就流体的返混情况而言,抽象出两种极限的情况: (1)完全没有返混的活塞流反应器——实际生产中的多数管 式反应器及固定床催化反应器。 (2)返混达到极大值的全混流反应器——多数槽式反应器。
流动模型概述
(1)间歇反应器 反应物料间歇加入与取出,反应物料的温度、浓度等操作
参数随时间而变,不随空间位置而变,所有物料质点在器内 的反应时间相同。
——对复合反混中的平行反应,若主反应级数低于副反应级 数,对复合反应中的连串反应选择率下降。若主反应级数高 于副反应级数,返混使主产物选择率下降,返混使主产物选 择率提高。
——对复合反应中的连串反应,返混使反应物浓度降低,产 物浓度提高,因而使主产物的选择率下降。 (2)逗留时间分布 ——逗留时间分布密度
全混流反应器中由于返混,整个反应器的推动力等于出口处反 应推动力。
——如果在相同温度、相同进、出口浓度, CA0、CAf 、 CA*相
化学反应工程原理

1 绪论1.1.3 优化的技术指标(1)反应速率(2)反应选择率(3)能量消耗1.1.4 决策变量(1)结构变量(2)操作方式(3)工艺条件1.4.1化学反应工程理论在反应过程开发中的作用要解决的问题:(1)反应器的合理选型(2)反应器操作的优选条件(3)反应器的工程放大2化学反应动力学2.2.1均相反应的条件(1)反应系统可以成为均相(2)预混合过程的时间远小于反应时间活化能的工程意义是反应速率对反应温度敏感程度的一种度量反应级数的工程意义是表示反应速率对于反应浓度变化的敏感程度2.3.3化学吸附的速率与平衡化学吸附可以分为活化化学吸附和非活化化学吸附。
活化化学吸附随着温度的变化服从阿伦尼乌斯方程;非活化化学吸附的活化能接近于零,吸附速率极快。
常常可以观察到化学吸附最初是非活化的,吸附进行得非常快,而随后速率变慢,且与温度有关,属于活化化学吸附1.理想吸附型理想吸附模型,基于如下假设(1)催化剂表面各处的吸附能力的均匀的,各吸附位具有相同的能量(2)被吸附物仅形成单分子层吸附(3)吸附的分子间不发生相互作用,也不影响分子的吸附作用(4)所有吸附的机理是相同的2.真实吸附模型不满足理想吸附条件的吸附,都称为真实吸附。
以焦姆金和弗隆德里希为代表提出不均匀表面吸附理论,真实吸附模型认为固体表面是不均匀的,各吸附中心的能量不等,有强有弱。
吸附时吸附分子首先占据强的吸附中心,放出的吸附热大。
随后逐渐减弱,放出的吸附热也愈来愈小。
由于催化剂表面的不均匀性,因此吸附活化能E a随着覆盖率的增加而线性增加,解吸活化能E d则随覆盖率的增加而线性降低,即2.4流固相非催化反应动力学两种反应(1)整体反应模型(2)收缩未反应芯模型3理想间歇反应器与典型化学反应的基本特征常见的典型化学反应(1)简单反应(包括自催化反应)(2)可逆反应(3)伴有平行副反应的复杂反应(或平行反应)(4)伴有串联副反应的复杂反应(或串联反应)(5)自催化反应3.1.2反应器设计基本方程(1)物料衡算方程组分i 流入量=组分i 流出量+组分i反应消耗量+组分i积累量(2)热量衡算方程式带入的热焓=流出的热焓+ 反应热+ 热量的积累+ 传向环境的热量(3)动量衡算方程式动量守恒物料衡算和反应速率式是描述反应器性能的两个最基本的方程式3.2.1理想间歇反应器的特征从理想间歇反应器操作可以看到有以下特点(1)由于剧烈的搅拌,反应器内物料浓度达到分子尺度上的均匀,且反应器内浓度处处相等,因而排除了物质传递问题(2)由于反应器内具有足够的传热条件,反应器内各处温度始终相等,因而无需考虑反应器内的热量传递问题(3)反应器内物料同时加入并同时停止反应,所有物料具有相同的反应时间。
化学反应工程知识点

化学反应工程知识点化学反应工程知识点—郭锴主编1、化学反应工程学不仅研究化学反应速率与反应条件之间的关系,即化学反应动力学,而且着重研究传递过程对宏观化学反应速率的影响,研究不同类型反应器的特点及其与化学反应结果之间的关系。
2、任何化工生产,从原料到产品都可以概括为原料的预处理、化学反应过程和产物的后处理这三个部分,而化学反应过程是整个化工生产的核心。
3.化学反应工程的基本研究方法是数学模型法。
数学模型法是对复杂的、难以用数学全面描述的客观实体,人为地做某些假定,设想出一个简化模型,并通过对简化模型的数学求解,达到利用简单数学方程描述复杂物理过程的目的。
模型必须具有等效性,而且要与被描述的实体的那一方面的特性相似;模型必须进行合理简化,简化模型既要反映客观实体,又有便于数学求解和使用。
4.反应器按型式来分类可以分为管式反应器、槽式反应器(釜式反应器)和塔式反应器。
5反应器按传热条件分类,分为等温反应器、绝热反应器和非等温非绝热反应器。
第一章均相单一反应动力学和理想反应器1、目前普遍使用关键组分A 的转化率来描述一个化学反应进行的程度,其定义为:00A A A A A A n n n x -==组分的起始量组分量转化了的 2、化学反应速率定义(严格定义)为单位反应体系内反应程度随时间的变化率。
其数学表达式为dtd V r ξ1=。
3、对于反应D C B A 432+=+,反应物A 的消耗速率表达式为dt dn V r A A 1-=-;反应产物C 的生成速率表达式为:dtdn V r C C 1= 4.反应动力学方程:定量描述反应速率与影响反应速率之间的关系式称为反应动力学方程。
大量的实验表明,均相反应的速率是反应物系的组成、温度和压力的函数。
5.阿累尼乌斯关系式为RT E C C e k k -=0,其中活化能反应了反应速率对温度变化的敏感程度。
6、半衰期:是指转化率从0变为50%所需时间为该反应的半衰期。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
定态时热量平衡: (−∆H ) R = kgaCb = ha(Ts − Tb ) 传质控制时温差最大(催化剂颗粒的最大温 升):
∆TM = (Ts − Tb ) max = kg h ( − ∆ H )C b
28
催化剂颗粒温度
传热与传质是同一流动条件下的结果
由JD和JH与Re关系得:
第九章 热量传递与反 应器的热稳定性
1
热量传递过程对化学反应过程的影响 特点
不能忽略,有时比传质的影响严重
反应过程的热量传递按其尺度分为两类:
颗粒尺度的热量传递 设备尺度的热量传递 催化剂与流体 反应器与冷却介质
2
反应器中传热与换热过程中传热的区别 换热过程传热
单纯的传热,无化学反应
反应器传热
反应过程和传热过程相互交联作用
CSTR处在D点: 当TC↑,反应温度TD→TD‘,反 应结果影响不大; 当TC↓, 会出现“熄火”现象, 将导致反应温度和反应结果 的剧烈变化。
47
在E点操作时
TC微小↑,会出现“飞温”现象, 导致反应温度和反应结果的剧烈变 化 当TC↓,无剧烈变化
在反应器设计时,应避免太近于D或E的操作点, 以留有余地作为调节之用。
14
可见: 可见:
A、C定态操作点对外界的扰动作用具有自衡能 力,为稳定的定态;
B操作点虽然是定态点,但是它对外界扰动作 用没有自衡能力,为不稳定的定态。
15
定态稳定条件分析
dQ dQ g r > 定态C点: Qr线斜率>Qg线斜率,即: dT dT dQ dQ g r > 定态A点: Qr线斜率>Qg线斜率,即: dT dT
Tb TA TC
18
工艺条件要求在B 工艺条件要求在B点操作
方法:
Q r = ha ( T s − T b )V p
Qr斜率↑,即haVp↑;同时,Tb↑ 增加的程度:满足定态稳定条件 催化剂颗粒大小一定,a不变,有效h↑ h↑的措施:气流线速度↑
19
在一个工业反应的开发过程中: 工艺角度: 着眼于反应器的空速,以确保获得一定的 反应结果。 工程观点: 着眼于流体在反应器中线速度的大小,确 保所需的定态处于稳定状态。
如果反应器是稳定的,扰动消失后它能自动返回原来 的平衡状态,也无需对温度进行专门的调节。如果反 应器是不稳定的,则必需增设附加的调节装置使它回 到原来的平衡状态,否则它将自动地愈离愈远而无法 正常操作。 热稳定性是热平衡状态抗扰动的能力。 灵敏性是参数作微小调整时,反应器内温度或反应结 果将会有多大变。灵敏性增加,参数的调整精度要求 增加,反应器的操作困难增加。 参数灵敏性和热稳定性是两个不同的概念。
kg
1 Pr 2 3 = ( ) h ρcp Sc
∆ T ad ( − ∆ H )C b = ρcp
催化剂颗粒绝热温升为:
∴ ∆ T M = ∆ T ad
Pr 2 ( ) Sc
3
29
由上式可见: 在上操作点时,催化剂颗粒温度与流体温度 之间的差值大小仅与物系性质有关; 对于气固反应系统:
Pr Q ( ) ≈ 1 Sc
Amin = Qg U ∆ T max v ρ c p ( − ∆ H ) kC Af V vρcp − = − U U ∆ T max U
44
由上式可见: ∆ T = ( T − T ) c max max
RT = E
2
C A0 C Af
决定∆Tmax 的反应参数是活化能; E↑,反应速率对温度变化愈敏感, T ↓; ∆ 最大允许温差、最小传热面积—是热稳定性 对CSTR设计和操作中的一个限制。
36
B.可逆放热反应 B.可逆放热反应
受化学平衡的限制,放热速率线有一极大值; 与移热速率线有三个交点; A、C是热稳定的操作点, B是热不稳定的操作点。
A B C
37
C.吸热反应 C.吸热反应
定态为唯一的,不存在多态 。
38
9.3.3 操作参数对热稳定性的影响
改变CSTR反应器的操作参数,会对热稳定性产生 影响:
进料温度T0 冷却介质温度Tc 进料流量v 传热系数U 传热面积A
39
Qg =
( − ∆ H ) k 0 C A 0V R exp( − E 1 + k 0τ exp( − ) RT
E ) RT
Q r = UA ( T − T c ) + v ρ c p ( T − T 0 )
进料温度: T01↑→T02 b1→b2,热稳定的 T01↓→T03 b1→c3,热不稳定的 冷却介质温度: 同上 进料温度、冷却介质温度↓↓,产生熄火;T3是极限
化学反应器的传热出现两个新问题
热稳定性和参数灵敏性
3
9.1 热稳定性和参数灵敏性概念
定态—定常状态 反应器处在热平衡状态,反应器各处温度不 随时间变化。 扰动 各种偶然的原因引起的反应参数的波动 自然变动,非人为调节
4
扰动产生后会出现两种情况: 反应器恢复到原来的热平衡状态 反应器热稳定 反应器不能恢复到原来的热平衡状态 反应器热不稳定 平衡有两种: 稳定的平衡、不稳定的平衡
4 3 2 1
22
临界着火和熄火条件: 临界着火和熄火条件:
着火和熄火时:Qg与Qr线相切—斜率相同 临界着火条件
(Qg )ig = (Qr )ig
dQ g
dQ r ( ) ig = ( ) ig dTs dTs
临界熄火条件:
dQ r ) ex = ( ) ex (Qg )ex = (Qr )ex ( dTs dTs
dQ g
23
催化剂颗粒临界着火温度
着火点在下操作点附近,反应控制,有:
Qg = (−∆H r )kC V
Qr = ha (Ts − Tb )V p
对Ts求导:
n b p
E ( − ∆H )kC = ha 2 RTs
n b
dQ g dQ r ( ) ig = ( ) ig dT s dT s
E ha(Ts − Tb) = ha 2 RTs
放热反应 反应T↑ 吸热反应 反应T↑ 反应T↓
7
(-rA)↑
放热速率↑
(-rA)↑
吸热速率↑
ห้องสมุดไป่ตู้
参数灵敏性
参数作微小调整时,反 应器内温度或反应结果 将会有多大变。 灵敏性↑,参数的调整 精度要求↑,反应器的 操作困难↑。 参数灵敏性和热稳定性 是两个不同的概念。
8
如何区分反应过程中的反应与传热的交联作用所 产生的热稳定性问题和参数灵敏性问题?
定态B点: Qr线斜率<Qg线斜率,即:
dQ dQ g r 〈 dT dT
16
催化剂颗粒定态稳定条件
Qr = Q g
dQ r dQ g > dT dT
移热线的斜率大于放热线的斜率
17
三个定态温度性质
A—下操作点 颗粒自冷态开始反应 ∆(Ts-Tb)小 C—上操作点 颗粒起始温度高于TC ∆(Ts-Tb)大 B点 不稳定
∴ ∆TM = ∆Tad
30
9.3 连续搅拌釜式反应器的 热稳定性
9.3.1 全混釜的热平衡条件
31
A.一级不可逆放热反应 A.一级不可逆放热反应
对组分A作物料衡算:
vCA0 = vCAf + VRkCAf
CA0 CAf = 1 + kτ
32
反应过程的放热速率: 反应过程的放热速率:
Qg = ( − ∆H )kC Af VR
5
反应器的稳定对反应器操作有极为重要
如果反应器是稳定的,扰动消失后它能自动 返回原来的平衡状态,也无需对温度进行专 门的调节。 如果反应器是不稳定的,则必需增设附加的 调节装置使它回到原来的平衡状态,否则它 将自动地愈离愈远而无法正常操作。
热稳定性:热平衡状态抗扰动的能力
6
放热反应存在反应器的热稳定性问题
42
Tc下降的最大极限:
dQ g
dQ r = dT dT
Q Q r = (UA + vρ c p )(T − Tc )
Q g = ( − ∆ H ) kC Af VR
43
CSTR最大允许温差:
∆ Tmax = (T − Tc ) max RT 2 C A 0 = E C Af
同样可以求得反应器所需具有的最小传热面积
40
进料流量: 进料体积流量↑, Qr线的斜率↑ 当Qr线的斜率↑↑时, 反应过程会出现热 不稳定的操作点。 进料体积流量↓,稳 定性↑ U、A变化情况相同
41
9.3.4 最大允许温差
是热稳定性对CSTR设计与操作的一个限制
当Tc↑,热稳定 当Tc↓,Tc<Tc3, c3→a3,热不稳定 Tc下降受到热稳定性限制
48
9.3.6 全混釜的可控性
全混釜反应器内由于物料的剧烈混合,升温 或降温同时发生。所以原则上不致发生局部 温度过高或过低的现象。
CSTR多用于液相反应,反应物系的热容较大, 温度的升降比较迟缓,易于调节和控制。也 能在B点操作。
49
思考题
1. 如何区分反应过程中的反应与传热的交联作用所产生的 热稳定性问题和参数灵敏性问题? 2.作出催化剂颗粒放热曲线和移热曲线,说明哪些点是稳 定点,哪些点是不稳定点?稳定的条件是什么? 3. 作出催化剂颗粒放热曲线和移热曲线,说明哪些点是催 化剂颗粒临界着火点,哪些点是催化剂颗粒临界熄火点? 催化剂颗粒临界着火的条件是什么? 4.作出CSTR放热曲线和移热曲线,说明哪些点是稳定点, 哪些点是不稳定点?稳定的条件是什么?
9
9.2 催化剂颗粒的热稳定性
10
9.2.1 催化剂颗粒的定态温度
反应放热速率
Qg = (−∆H r ) RVp
