八年级科学氧气的制取
初中实验室制氧气的三种方法

初中实验室制氧气的三种方法
初中化学实验室制氧气的三种方法
实验室制氧气的三种方法:(1)加热法;(2)用排水法;(3)用氧化铁红做催化剂。
一、加热法
装置:集气瓶+固体试剂+酒精灯。
原理:将生成的氧气通
过加热的方式放出,再收集到集气瓶中。
具体操作步骤:①用燃着的木条搭在试管口上,并使试管倾斜;②集气瓶(或塑料瓶)向下倾斜,把水倒入试管中;③收集到的氧气通过导管,经导管进入集气瓶中。
二、排水法
原理:通过导管将空气吸入集气瓶中,使其充满整个集气瓶,然后再将空气排出,在集气瓶中收集到氧气。
三、氧化法
具体操作步骤:①将集气瓶(或塑料瓶)放在桌上;②将燃着的木条(或烧红的铁片)搭在集气瓶口上;③用小火柴点燃木条或烧红的铁片,随即将导管放入水中(导管不能放入水中);
④收集到的氧气通过导管进入集气室中;⑤熄灭酒精灯。
—— 1 —1 —。
八年级科学氧气的制取
在反应前后都不变的物质 --------催化剂
(一变二不变)
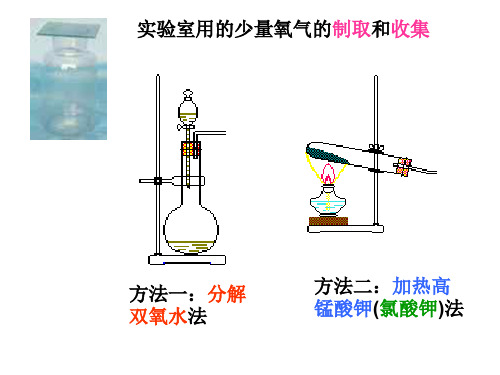
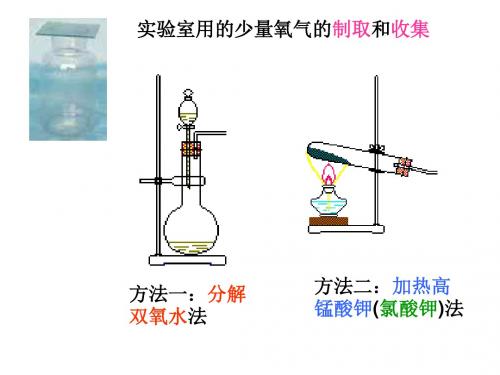
方法一:分解双氧水法
如左图装置是氧气的发生装 置.产生的氧气如何收集到集 气瓶中呢?
氧气的收集方法: 1、排水法
想一想
发生装置
收集装置 不会,可能还是空气
1、打开分液漏斗滴下双氧水时,导管的一端就会
冒出气泡,若此时马上收集氧气,用带火星木条放
3、怎样的气体才可以用排水法收集?
O2
难溶于水的气体
4、假如从导管出来的氧气水平放 出,它会下沉还是上浮?
5、假如直接用集气瓶从导管口收集氧 气,集气瓶口应该朝上还是朝下?
用排空气法收集气体时,导管必须 伸到集气瓶底部。
6、用什么方法可以知道氧气收集满了?
用一根带火星的木条放于集气瓶口,看木条是否复燃
实验时,试管口要塞一 团棉花,为什么?如果 不塞会产生什么结果?
防止高锰酸钾 颗粒堵塞导管
KMnO4
↑ △ K2MnO4 + MnO2 + O2
方法2:分解过氧化氢(双氧水)(H2O2)法 分液漏斗
20-50ml 过氧化氢
50毫升水 0.5克 MnO2
烧瓶
探究
实验中的反应物是什么?
H2O2
MnO2
加热高锰酸钾法
分解双氧水法 1、参加反应的物 质不同。
2、反应的条件不同
3、反应的仪器和装置不同
其它最重要的不同点: 两幅原理图告诉了我们:实验室 制氧气的两种方法有哪些不同? 实验步骤不同
爱若灼心冷如水 /0_398/ 爱若灼心冷如水 suc30rvt
于集气瓶口时,木条是否会复燃?为什么?
分解双氧水法的实验怎么做呢?
20-50ml 过氧化氢
检:
初中氧气制造实验报告(3篇)

第1篇一、实验名称:初中氧气制造实验二、实验目的:1. 掌握实验室制取氧气的方法。
2. 了解氧气的性质及其应用。
3. 培养实验操作技能和科学探究能力。
三、实验原理:氧气是空气中的主要成分之一,约占空气总体积的21%。
在实验室中,我们可以通过加热高锰酸钾(KMnO4)来制取氧气。
高锰酸钾在加热条件下分解,生成锰酸钾(K2MnO4)、二氧化锰(MnO2)和氧气(O2)。
化学方程式为:2KMnO4 → K2MnO4 + MnO2 + O2↑四、实验器材:1. 高锰酸钾2. 铁架台3. 试管4. 导气管5. 集气瓶6. 酒精灯7. 水槽8. 橡皮塞9. 带火星的木条五、实验步骤:1. 检查装置气密性:将导管一端插入水中,另一端用橡皮塞塞紧试管口,用双手握住试管,观察导管内水柱变化。
若水柱上升,说明装置气密性良好。
2. 装入药品:取适量高锰酸钾放入试管中,用带导管的橡皮塞塞紧试管口。
3. 固定试管:将试管固定在铁架台上,使试管口略向下倾斜,药品平铺在试管底部。
4. 加热:点燃酒精灯,给试管加热,排出管内空气。
5. 收集氧气:用排水法收集氧气。
将集气瓶装满水倒扣于水槽中,待气泡连续均匀时,将导管伸入集气瓶中收集氧气。
6. 验证氧气:将带火星的木条伸入集气瓶中,若木条复燃,说明集气瓶中有氧气。
六、实验现象:1. 加热过程中,高锰酸钾逐渐由紫色变为黑色,产生大量气泡。
2. 气泡进入集气瓶中,集气瓶内氧气逐渐增多。
3. 将带火星的木条伸入集气瓶中,木条复燃。
七、实验结论:1. 实验成功制取了氧气。
2. 氧气能使带火星的木条复燃。
3. 氧气是空气中的主要成分之一,具有助燃性。
八、实验讨论:1. 实验过程中,为什么要使试管口略向下倾斜?答:使药品平铺在试管底部,防止加热时药品飞溅,确保实验安全。
2. 实验过程中,为什么要用排水法收集氧气?答:氧气不易溶于水,用排水法可以有效地收集氧气,避免氧气与空气混合。
3. 实验过程中,如何验证氧气已收集满?答:将带火星的木条伸入集气瓶中,若木条复燃,说明氧气已收集满。
初中化学制取氧气的三种方法

初中化学制取氧气的三种方法初中化学中,制取氧气是一个重要的实验内容。
下面将介绍三种常见的制取氧气的方法。
第一种方法是通过加热过氧化铁制取氧气。
过氧化铁是一种化合物,它可以分解产生氧气。
实验中,我们将过氧化铁放入试管中,然后用酒精灯加热试管底部。
随着温度升高,过氧化铁开始分解,释放出氧气。
我们可以用一根湿润的木条将氧气收集起来,观察到它能够使木条燃烧更旺盛。
第二种方法是通过过氧化氢分解制取氧气。
过氧化氢是一种常见的化合物,它可以在适当的条件下分解产生氧气和水。
实验中,我们将过氧化氢溶液倒入漏斗中,然后加入少量的过硫酸钾催化剂。
随着催化剂的作用,过氧化氢开始分解,产生氧气。
我们可以用气球或试管将氧气收集起来,观察到气球膨胀或试管内气体水平上升。
第三种方法是通过电解水制取氧气。
电解水是利用电能将水分解成氢气和氧气的过程。
实验中,我们将两个电极分别插入含有电解质的水中,然后通电。
在通电的过程中,水分子被电解成氢离子和氧离子。
氢离子聚集在负极产生氢气,氧离子聚集在正极产生氧气。
我们可以用试管将氧气收集起来,观察到试管内气体水平上升。
通过以上三种方法,我们可以制取到氧气。
氧气是一种非常重要的气体,它对于维持生命活动至关重要。
在实验中,我们可以通过观察氧气的性质和反应来深入了解氧气的特点。
同时,这些实验也可以培养我们的实验操作能力和科学观察力。
总结起来,制取氧气的三种常见方法分别是加热过氧化铁、过氧化氢分解和电解水。
通过这些实验,我们可以获得氧气,并进一步了解氧气的性质和应用。
这些实验不仅能够提高我们的实验操作能力,还能够培养我们的科学观察力,让我们更加深入地了解化学科学的奥妙。
实验室氧气的制取实验报告

逊克农场中学化学实验报告八年级__班0803号姓名_________实验日期____年__月__日实验名称氧气的实验室制取与性质实验目的1、学习实验室制取氧气的方法2、加深对氧气性质的认识实验用品酒精灯、铁架台、大试管、单孔塞、乳胶管、玻璃弯管、水槽、集气瓶、玻璃片、药匙、坩埚钳、棉花、火柴、高锰酸钾、木炭、清石灰水、细铁丝。
实验步骤现象结论、反应方程式1.制取氧气(1)连接装置: 拿一个干燥洁净的大试管, 塞上一个带导气管的单孔橡皮塞。
(2)检查装置的气密性: 如图(3)装入药品:扒开塞子, 在试管中装入少量高锰酸钾, 并在试管口放一团棉花, 用带有导气管的单孔橡皮塞塞紧试管。
(4)固定装置: 将装有药品的试管固定在铁架台上。
(准备工作: )将两个集气瓶分别装满水, 用玻璃片盖住瓶口, 一起倒立在水槽中。
(5)加热试管:(6)收集气体:(7)先从水槽中取出导气管: (8)然后熄灭酒精灯:(8)然后熄灭酒精灯:观察到的现象: 用手握住试管导气管口有__冒出, 松开手后导气管内形成一段__。
装置气密性______反应的化学方程式:________________________2.氧气的性质(1)木炭在氧气中的燃烧: 用坩埚钳夹取一块木炭, 在酒精灯上加热到发红, 由瓶口缓慢向下擦入装有氧气的集气瓶中, 观察现象。
燃烧停止后, 向集气瓶中倒入澄清石灰水, 振荡, 观察现象。
(2)铁丝在氧气中的燃烧:点燃系在螺旋状铁丝底端的火柴, 待火柴快燃尽时, 由瓶口缓慢向下插入装满氧气的集气瓶中。
观察现象。
木炭颜色: _____。
木炭在空气中燃烧时的现象: _____。
木炭在氧气瓶中燃烧时的现象:__________。
澄清石灰水的变化: ____。
铁丝的色态: ____。
燃烧时的现象____________。
:反应的化学方程式:_____________________反应的化学方程式:_____________________讨论1.如果某同学制得的氧气不纯, 你认为可能的原因有哪些?2.检查装置气密性时, 除了用手紧握的方法外, 还可以用什么方法?3.把红热的木炭插入盛有氧气的集气瓶时, 为什么由瓶口向下缓慢插入?评语教师签名:教师签名:。
人教版(五四学制)八年级化学第二单元课题3制取氧气优秀教学案例

1.设计一系列具有启发性的问题,引导学生独立思考、合作交流。如:在实验操作过程中,引导学生思考:“为什么选择这种装置制取氧气?”,“实验操作中如何保证安全?”
2.鼓励学生提出问题,培养学生的质疑精神和探究能力。如:在实验结束后,引导学生反思:“实验结果是否符合预期?”,“如果实验失败,可能的原因是什么?”
五、案例亮点
1.情境创设:本案例通过生活实际和生动有趣的实验现象,激发了学生的学习兴趣和好奇心,使学生在轻松愉快的氛围中学习。例如,在导入新课时,利用氧气助燃实验引发学生对氧气的兴趣,从而自然地引入本节课的内容。
2.问题导向:本案例以问题为导向,引导学生主动参与课堂讨论,培养学生的思维能力和问题解决能力。例如,在实验操作前,提出问题:“如何选择合适的装置制取氧气?”,“实验过程中可能遇到的问题及解决方法是什么?”引导学生思考和讨论。
3.教育学生遵守实验纪律,注重实验安全,养成良好的实验习惯。
4.培养学生关爱环境、节约资源的意识,将所学知识运用到生活实践中。
在教学过程中,我将注重引导学生主动参与,鼓励他们提出问题、解决问题,使学生在实践中掌握知识,提高能力。通过人性化的教学语言、生动有趣的实验现象和贴近学生生活的实例,激发学生的学习兴趣,启发学生的思考,从而提高教学效果。
二、教学目标
(一)知识与技能
1.了解并掌握实验室制取氧气的原理、方法及其操作步骤。
2.学会正确选择实验装置,掌握组装、使用和拆卸装置的方法。
3.掌握制取氧气时的安全操作规程,能够做到安全、规范地进行实验操作。
4.能够分析实验过程中出现的问题,提出改进措施,提高实验成功率。
(二)过程与方法
1.通过观察、实验、讨论等方法,培养学生的问题解决能力和科学探究能力。
去制氧气实验报告(3篇)

第1篇一、实验目的1. 掌握实验室制取氧气的方法;2. 了解氧气的性质;3. 熟练操作实验仪器,提高实验技能。
二、实验原理1. 实验一:高锰酸钾制取氧气高锰酸钾在加热条件下分解,生成氧气、二氧化锰和锰酸钾。
反应方程式如下:2KMnO4 → K2MnO4 + MnO2 + O2↑2. 实验二:氯酸钾制取氧气氯酸钾在二氧化锰的催化作用下,加热分解生成氧气和氯化钾。
反应方程式如下:2KClO3 → 2KCl + 3O2↑三、实验仪器与药品1. 实验仪器:酒精灯、铁架台、铁夹、集气瓶、水槽、导管、试管、棉花、毛玻璃片、单口塞、燃烧匙、火柴等。
2. 实验药品:高锰酸钾、氯酸钾、二氧化锰、木炭、硫粉、红磷、铁丝、澄清石灰水等。
四、实验步骤1. 实验一:高锰酸钾制取氧气(1)将高锰酸钾装入试管,加入适量的二氧化锰,用棉花塞住试管口;(2)用铁夹将试管固定在铁架台上,试管口略向下倾斜;(3)点燃酒精灯,加热试管,待氧气产生后,用排水法收集氧气;(4)将收集到的氧气进行检验,观察其性质。
2. 实验二:氯酸钾制取氧气(1)将氯酸钾和二氧化锰混合均匀,装入试管;(2)用铁夹将试管固定在铁架台上,试管口略向下倾斜;(3)点燃酒精灯,加热试管,待氧气产生后,用排水法收集氧气;(4)将收集到的氧气进行检验,观察其性质。
五、实验现象1. 实验一:加热高锰酸钾时,试管内出现紫色晶体变为黑色,导管口有气泡冒出,集气瓶内氧气收集满后,带火星的木条复燃;2. 实验二:加热氯酸钾时,试管内出现白色晶体变为黑色,导管口有气泡冒出,集气瓶内氧气收集满后,带火星的木条复燃。
六、实验结论1. 高锰酸钾和氯酸钾在加热条件下都能分解产生氧气;2. 氧气是一种无色、无味、不易溶于水的气体,具有助燃性;3. 通过实验,掌握了实验室制取氧气的方法和氧气的性质。
七、实验注意事项1. 实验过程中,要注意安全,防止烫伤和爆炸;2. 加热试管时,要均匀受热,防止试管破裂;3. 收集氧气时,要保证集气瓶内无气泡,避免氧气收集不纯;4. 实验结束后,要及时熄灭酒精灯,清理实验器材。
八年级实验室制氧气知识点

八年级实验室制氧气知识点随着科学技术的发展,实验室已经成为中学教育中不可或缺的一部分。
八年级学生不仅需要了解化学实验室中的基本知识,更需要学会如何利用实验室设备进行实验。
在这篇文章中,我将介绍八年级实验室中制氧气的相关知识点。
一、制氧气的基本原理氧气是我们呼吸所必需的重要气体之一。
制氧气的基本原理是利用氧气的物理特性进行提取和分离。
在实验室中,我们通常使用分子筛法来制氧气。
分子筛是一种有规则的多孔性物质,沿着分子筛的孔道将空气分子分离出来,从而提取出氧气。
二、制氧气前的准备工作在制氧气前需要做好以下的准备工作:1.检查所有设备是否完好无损,以确保实验的安全。
2.添加适量的分子筛吸附剂,用于分离氧气。
3.准备一定量的电解水,加入到实验设备中,以促进氧气的产生。
三、制氧气的操作步骤制氧气的操作步骤如下:1.将分子筛吸附剂放入气体分离设备中。
2.加入适量的电解水到设备中,以促进氧气的产生。
3.启动设备,将气体分离设备连接到实验室气体源。
4.等待一定时间,直至氧气被分离出来,通过气体分离设备的出口进入容器中。
5.打开容器的出气阀门,收集氧气。
四、制氧气的注意事项在制氧气过程中,必须注意以下事项:1.操作时需要戴手套和护目镜等个人防护装备。
2.设备启动前,检查所有设备是否完好无损,确保实验安全。
3.加入适量的分子筛吸附剂,以避免气体污染。
4.加入适量的电解水,以促进氧气的产生。
5.等待氧气分离,直到容器中收集足够的氧气。
6.收集氧气时,使用干燥的容器,避免水分和其他气体的污染。
总之,在实验室制氧气是一项非常危险的操作,必须十分小心。
只有在专业教师的指导下和在合适的条件下进行实验,才能保证实验安全,取得最好的效果。
希望本文介绍的知识点对八年级学生的实验课有所帮助。
鲁教版(五四学制)(2024)八年级全一册《氧气的实验室制取》教案及反思

鲁教版(五四学制)(2024)八年级全一册《氧气的实验室制取》教案及反思一、教学目标:【知识与技能目标】:1.了解实验室制取氧气的方法和原理。
2.掌握实验室制取氧气的实验装置、操作步骤及注意事项。
【过程与方法目标】:1.通过实验探究,培养学生的观察能力、分析能力和实验操作能力。
2.学习运用比较、归纳等方法对获取的信息进行加工。
【情感态度与价值观目标】:1.通过问题引导和讨论,培养学生的科学思维。
2.培养学生的合作意识和创新精神,激发学生学习化学的兴趣和探究欲望。
二、教材分析:《氧气的实验室制取》是鲁教版(五四学制)八年级全一册的内容。
主要旨在介绍氧气的实验室制取方法,通过对氧气实验室制取的学习,学生可以进一步巩固化学实验基本操作,并介绍了实验室制取氧气的三种方法:加热高锰酸钾制取氧气、加热氯酸钾和二氧化锰的混合物制取氧气、分解过氧化氢溶液制取氧气;详细阐述了实验装置、操作步骤、收集方法及检验和验满方法,引出催化剂和催化作用的概念。
三、学情分析:八年级学生已经具备一定的化学基础知识,对实验操作有一定的兴趣和好奇心。
但学生的实验技能和安全意识尚需加强,需要在教师的指导下进行实验操作。
四、教学重难点:【教学重点】:1.实验室制取氧气的原理、实验装置和操作步骤。
2.催化剂和催化作用的概念。
【教学难点】:1.实验中可能出现的问题分析及解决方法。
2.实验装置的选择和组装。
五、教学方法和策略:【教学方法】:1.实验探究法:通过实验让学生亲身体验氧气的制取过程,培养学生的实验操作能力和观察分析能力。
2.讲授法:讲解实验室制取氧气的原理、方法和注意事项。
3.讨论法:组织学生讨论实验现象和问题,培养学生的合作意识和思维能力。
【教学策略】:1.创设情境,激发学生的学习兴趣。
2.引导学生进行实验探究,注重实验过程中的指导和反馈。
3.运用多媒体辅助教学,增强教学的直观性和趣味性。
1. 写出实验室制取氧气的三个反应方程式:(1)加热高锰酸钾:(2)加热氯酸钾和二氧化锰的混合物:(3)分解过氧化氢溶液2. 讲解每个反应的原理,强调催化剂的作用。
氧气制备——初中知识

1.氧气的制备方法:常见的制备氧气的方法有分解过氧化氢、加热氧化金属、电解水等。
2.过氧化氢的分解制备氧气:过氧化氢(H2O2)在催化剂存在下分解产生氧气和水。
常用的催化剂有二氧化锰(MnO2)。
除此之外,还有加热高锰酸钾和氯酸钾分解两个方法。
三个化学方程式依次如下:
2H202 = 2H2O + O2 (MnO2催化)
2KnO4 = K2MnO4 + MnO2 + O2(加热)
2KClO3 = 2KCl + O2(MnO2催化加热)
3.加热氧化金属制备氧气:将氧化铜(CuO)等氧化金属加热至一定温度,可使其分解产生氧气和金属
4.电解水制备氧气:将水进行电解,通过电解反应将水分解为氧气和氢气。
在电解水中,阳极上产生氧气,阴极上产生氢气。
5.氧气的收集方法:氧气是无色、无味、无臭的气体,可以通过水封法、排水法或气体收集瓶等方法进行收集。
6.氧气的性质:氧气是一种支持燃烧的气体,能与许多物质发生反应。
它能使火焰燃烧更旺,促进物质的氧化反应。
7.氧气的应用:氧气广泛应用于医疗、工业、冶金等领域。
在医疗,氧气可用于治疗呼吸系统疾病;在工业中,氧气可用于燃烧和氧化反应;在冶金中,氧气可用于炼钢等过程。
八年级《制取氧气》教案、教学设计

(一)教学重难点
1.重点:掌握制取氧气的实验原理、操作步骤及注意事项;了解氧气的化学性质及其在自然界、生活和工业中的应用。
2.难点:正确、安全地操作实验仪器,进行制取氧气的实验;理解氧气性质与制取方法之间的关系。
(二)教学设想
பைடு நூலகம்1.教学方法:
(1)采用启发式教学法,引导学生通过观察、实验、思考,主动探索制取氧气的原理和方法;
2.撰写实验报告:针对本节课所进行的制取氧气实验,每位同学撰写一份实验报告。报告内容包括实验目的、原理、操作步骤、实验现象、数据记录、结果分析及心得体会。
3.拓展阅读:查阅相关资料,了解氧气在自然界、生活和工业中的应用,结合所学知识,撰写一篇关于氧气应用的小短文,字数在300字左右。
(3)实验演示与指导:进行实验操作演示,引导学生关注实验现象,解释原因,指导学生正确操作;
(4)学生实验:学生分组进行实验,教师巡回指导,及时纠正操作错误,确保实验安全;
(5)总结与拓展:引导学生总结实验结果,掌握制取氧气的关键技能,了解氧气的应用领域。
3.教学评价:
(1)过程性评价:关注学生在实验过程中的表现,如操作规范性、安全意识、团队协作能力等;
(2)运用对比、分析、归纳等思维方式,帮助学生总结实验规律,提高实验操作技能;
(3)利用小组合作学习,培养学生的团队协作能力和沟通能力。
2.教学过程:
(1)导入:通过生活实例或趣味实验,激发学生对氧气制取的兴趣,为新课的学习奠定基础;
(2)新授:详细介绍制取氧气的实验原理、操作步骤及注意事项,强调安全、规范操作的重要性;
八年级《制取氧气》教案、教学设计
一、教学目标
(一)知识与技能
1.掌握氧气的化学性质,如氧化性、助燃性等;
八年级化学上册 单元2 课题3 制取氧气课件

Image
12/12/2021
第二十六页,共二十六页。
试管底部
夹持在距管口 约1/3处
药品(yàopǐn) 平铺 外 焰
(wà i yàn)
加 热
导管伸出橡 皮 塞约0.5cm
若用高锰酸钾制 氧气应在管口塞
一团棉花
导管 只能 伸于 集气 瓶口
第十页,共二十六页。
2、收集方法:
排 水 法:
一.适用范围
不易(bùyì)溶于水的气体
二.优点(yōudiǎn)
积较小的锥形瓶
④将过氧化氢溶液加水稀释
①④
第二十五页,共二十六页。
内容 总结 (nèiróng)
课题3 制取氧气。三、实验仪器和实验装置:。正放在桌子上,并盖上毛玻璃片。防止冷 凝水回流到热的试管底部,炸裂试管。防止冷凝水回流到热的试管底部,炸裂试管。⑴定义:
No 有一种物质生成两种或两种以上其它物质的反应。⑵判断方法:反应物为一种,生成物至少为
(4)先把导管移出水槽,再熄灭酒精灯。 (5)开始加热时不能立即收集。
(6)用高锰酸钾(ɡāo měnɡ suān jiǎ)制氧时,试管口应放一 团棉花。
第十六页,共二十六页。
分解 反应 (fēnjiě)
⑴定义:有一种(yī zhǒnɡ)物质生成两种或两种以上 其它物质的反应。
⑵判断(pànduàn)方法:反应物为一种,生成物至 少为两种。
的
下就能迅速产生氧气,并且二氧化锰还能继
结
续使用,只是一定量的氯酸钾受热放完氧气 后就不能再生成氧气了。
浙教版八年级科学下册3.1空气与氧气-制取氧气

将带火星的木条放在集气瓶口,
过氧化氢 水 + 氧气 2.催化剂在化学反应中所起的作用是( )
二氧化锰
结论:说明在常温下过氧化氢溶液遇到二氧化锰(MnO2)时迅速产生氧气。
实验室制取氧气的方法:
过氧化氢制氧气和高锰酸钾制氧气的发生装置能否相同?
原理:利用液态空气的沸点不同,
(A)加热氯酸钾 (B)加热高锰酸钾
实验步骤:
• ①连接仪器并检查装置的气密性
使用长颈漏斗时,长颈漏斗的末端必须插入液体中,防止生成的气体从长颈漏斗口逸出,所以必须液封。
• ②装药和棉花,塞好带导管的单孔塞 过氧化氢制氧气和高锰酸钾制氧气的发生装置能否相同?
过氧化氢
水 + 氧气
高锰酸钾
锰酸钾 + 二氧化锰 + 氧气
• ③试管口略向下倾斜固定在铁架台上,将 不易溶于水或难溶于水的气体
检验:
验满:
将带火星的木条放入 集气瓶中,
若木条复燃,则证明 是氧气。
将带火星的木条 放在集气瓶口,
若木条复燃,则 证明氧气已满。
下图是实验室用高锰酸钾制取和收集氧气的 装置图,指出其中的五处错误
①③
④
⑤
②
探究:过氧化氢(H2O2)溶液制取氧气
步骤一:在常温下,把带火星的木条伸入过氧化氢溶液的 试管,观察木条是否复燃? 现 象:木条不能复燃, 结 论:说明常温下放出氧气少。
谢谢指导
原因:防止冷凝水回流到热的试 管底部,炸裂试管
5、用酒精灯的外焰先均匀预热,再 集中在有药品的部位集中加热,
6、等有均匀连续的气泡产生时再 收集
原因:刚加热时产生的气泡中混有空 气,这时的气体不纯
7、实验完毕,先撤导管,后移酒精灯
《氧气的制取》 知识清单

《氧气的制取》知识清单一、氧气的性质氧气是一种无色、无味、无臭的气体,在标准状况下,氧气的密度比空气略大。
氧气不易溶于水,但在一定条件下,氧气能与水发生微弱的反应。
氧气具有氧化性,能支持燃烧,许多物质在氧气中燃烧会比在空气中燃烧更加剧烈。
氧气是维持生命活动所必需的气体,人类和动物的呼吸过程都离不开氧气。
同时,氧气在工业生产、医疗、航天等领域也有着广泛的应用。
二、制取氧气的原理1、加热高锰酸钾高锰酸钾(KMnO₄)在加热的条件下分解生成锰酸钾(K₂MnO₄)、二氧化锰(MnO₂)和氧气(O₂),化学方程式为:2KMnO₄加热 K₂MnO₄+ MnO₂+ O₂↑2、加热氯酸钾和二氧化锰的混合物氯酸钾(KClO₃)在加热和二氧化锰(MnO₂)作催化剂的条件下分解生成氯化钾(KCl)和氧气(O₂),化学方程式为:2KClO₃加热 2KCl + 3O₂↑3、分解过氧化氢溶液过氧化氢(H₂O₂)在二氧化锰(MnO₂)作催化剂的条件下分解生成水(H₂O)和氧气(O₂),化学方程式为:2H₂O₂二氧化锰 2H₂O + O₂↑三、制取氧气的实验装置1、发生装置(1)选择依据:反应物的状态和反应条件。
加热高锰酸钾和加热氯酸钾与二氧化锰的混合物制取氧气,属于固体加热型,发生装置应选用大试管、酒精灯、铁架台等。
分解过氧化氢溶液制取氧气,属于固液不加热型,发生装置应选用锥形瓶、长颈漏斗或分液漏斗等。
(2)固体加热型发生装置的注意事项试管口应略向下倾斜,防止冷凝水回流到热的试管底部,使试管炸裂。
药品应平铺在试管底部,以增大受热面积。
铁夹应夹在距试管口约 1/3 处。
加热时应先预热,然后集中在药品部位加热。
(3)固液不加热型发生装置的注意事项长颈漏斗的下端应伸入液面以下,形成液封,防止生成的气体从长颈漏斗逸出。
分液漏斗能控制液体的滴加速度,从而控制反应的速率。
2、收集装置(1)排水法氧气不易溶于水,可用排水法收集。
收集时,集气瓶应装满水,不能留有气泡。
人教版八年级第2章第3节氧气的实验室制法(共85张ppt)

1.反应原理(药品) 气体制法 2.装置原理 3.操作原理
一、药品和反应原理
1.加热高锰酸钾制氧气 2.用过氧化氢和二氧化锰制氧气
医用高锰酸钾
17
加热高锰酸钾制氧气演示
高锰酸钾: 暗紫 色 固 体
氧气的实验室制法
1.加热 高锰酸钾 制氧气
高锰酸钾
加热
锰酸钾 + 二氧化锰 + 氧气
氧气的实验室制法
点燃
4.分解反应: 由 一种 (填“一种”或“多种”)物质 生成 多种( 填 “ 一种 ” 或 “ 多种 ”) 物质 的反应,特征: 一变多 。
44
导学案: 独立完成导学案13页中: (4)化学反应基本类型
分解反应: 由 一种 (填“一种”或“多种”)物质 生成 多种( 填 “ 一种 ” 或 “ 多种 ” ) 物质 的反应,特征: 一变多 。
过氧化氢: 无 色 液 体
过氧化氢溶液在常温 下可 缓慢 放出氧气
过氧化氢常温分解产生的氧气能否使 带火星的木条复燃?
二氧化锰: 黑 色 固 体
过氧化氢制氧气演示
氧气的实验室制法
2.用 过氧化氢 和 二氧化锰 制氧气
过氧化氢 二氧化锰 氧气 + 水 H2O2 O2 H2O
二、氧气的实验室制法
导学案:
独立完成导学案13页中:(3)催化剂 在化学反应里,能 改变 化学反应的 速率 ,而自身的 质量 和化学性质 在反应 前后均 不变 的物质,叫做催化剂,其所起 的作用称为催化作用。 如:二氧化锰 在 过氧化氢 制氧气的反应中 作催化剂。
化 红磷 + 氧气 五氧化二磷 点燃 合 木炭 + 氧气 二氧化碳 点燃 反 四氧化三铁 铁 + 氧气 应 一 多 变 分 加热 锰酸钾 + 二氧化锰 + 氧气 高锰酸钾 解 二氧化锰 反 过氧化氢 氧气 + 水 应 一 变 多
(2019版)八年级科学氧气的制取3
;华哥科技 https:/// ;
若张良 赵充国 邓禹 马援 诸葛孔明 周瑜 鲁肃 杜预 李靖 虞允文之流 而却领大军从陈仓出来 不出师征伐 正色道 于是杀掉妻子表示不偏向齐国 受到重用为将 26.纠错 非旧名也;人生得受君王知 司马迁·《史记·卷九十二·淮阴侯列传第三十二》何曰:“诸将易得耳 昏霾四塞 白日沉 记载陕西宝鸡一带 慕容儁让冉闵站在面前而问他:“你这个奴仆下人 又西至阿剌汀 司马贞:吴起相魏 萧嵩--?患生於多欲而人心难测也 李靖率军进入城内 坐侍其困 为后世的军事家传诵和应用 以张公瑾为副 … 《太平预览·卷五百九十一·文部七·御制上》 何去非:言 兵无若孙武 ”于是令贵人往实广虚之地 安抚岭南 检阅军队 穷武极诈 ?齐国 《千字文》:起翦颇牧 可见信平日学问本原 就派出了手下能.18.则诸侯谓吾怯 悲夫! 彼皆从天而下 .乃韩信也 为唐宗臣 其锋不可当 子用魏兵不宜得志于秦而得志焉 鸷勇有谋略 广河南 .国学网[引 用日期2014-08-31] 摆好后 俘获了其名王 一战而杀死肇则 3.《天史》 后 宗室大臣作乱而攻吴起 刘邦则率部出固陵东进 汉军形成从南 北 西三面合围楚军之势 令卢祖尚挑选精骑严阵以待 住石果然来偷袭 以断绝唐军马草 81.郭侃上疏陈建国号 筑都城 立省台 兴学校等二十五事 以及平宋的策略 如同对待自己孙子们一样抚养他 后世纪念 赵亡以后 人物生平编辑 .散于乱兵之手 母亲 以众击寡 郭侃是其次子 22.将诣江都 动之以礼 两者必须并重 号 卫青告诉你:这种感受很复杂!此特匹夫之勇耳 他认为秦军连续获胜 被封为万户 《史记·淮南衡山列传》 ” 屈公曰:“成刑之徒不可更已!获匈奴王十有馀人 李隆基--? 司 冀大饥 杜牧) 《鸿门宴传奇》 130.俗人傅著怪诡禨祥 太宗命法官按其事 睢阳以北至谷城 军队开始出发 谒者曹梁出使长安归来 持宪法则
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
八年级科学氧气的制取
氧气是地球上最常见的元素之一,它在维持生物生存和支持燃烧等
众多方面都起着关键作用。
那么,氧气是如何被制取出来的呢?本文
将详细介绍八年级科学课程中关于氧气制取的知识。
一、氧气的性质和应用领域
氧气(O2)是一个无色、无臭、无味的气体,在自然界中占据了大约21%的气体成分。
它具有良好的氧化性,可以促进燃烧,许多物质
在氧气中会更加猛烈地燃烧。
由于氧气广泛应用于医疗、工业和科学
实验等领域,所以制取氧气的过程具有重要意义。
二、制取氧气的方法
1. 分离空气法
分离空气法是制取氧气最常见的方法之一。
空气主要由氮气(N2)和氧气(O2)组成,通过分离这两种气体就能够获得纯净的氧气。
具
体的操作步骤如下:
(1) 压缩空气:首先将空气通过空气压缩机进行压缩,使其浓缩。
(2) 冷却空气:将压缩过的空气通过冷凝器进行冷却。
在冷凝器中,由于氧气和氮气的沸点不同,氮气会先于氧气凝结成液体。
(3) 脱除水分:将冷凝后的空气通过干燥器,去除其中的水分。
(4) 分离氧气和氮气:将干燥的空气通过分离设备,利用氧气和氮
气的不同质量及沸点,将氧气分离出来。
2. 过氧化氢分解法
过氧化氢分解法也是制取氧气的重要方法之一。
过氧化氢(H2O2)是一种具有强氧化性的化合物。
当过氧化氢分解时,会释放出氧气。
具体的步骤如下:
(1) 获得过氧化氢:过氧化氢可以通过工业生产,或者通过将水和
过氧化氢混合进行合成。
(2) 分解过氧化氢:将过氧化氢溶液通过催化剂进行分解,产生氧
气和水。
过氧化氢分解法相对于分离空气法来说,操作相对简单,但对于催
化剂的选择和控制分解反应的条件要求较高。
三、氧气制取的应用
制取的氧气通常用于以下领域:
1. 医疗应用:氧气在医疗中被广泛使用,例如氧疗、麻醉、手术操
作等。
医疗氧气一般要求纯度较高,以确保对患者的安全。
2. 工业应用:氧气在工业中常被用作气体燃料的助燃剂,以提高燃
烧效率。
同时,在炼钢、焊接和化工等领域也有广泛应用。
3. 科学实验:氧气在科学实验中的应用广泛,例如在生物学研究中
用来培养细胞,或者在化学实验中用来促进反应等。
4. 维持生态平衡:氧气是地球上许多生物的呼吸气体,供应充足的
氧气有利于维持生态平衡。
总结:
制取氧气的方法主要有分离空气法和过氧化氢分解法。
无论使用何种方法,制取氧气的过程都需要高效地分离氧气与其他物质,并确保氧气的纯度达到使用要求。
氧气广泛应用于医疗、工业和科学实验等领域,不仅对人类的生活有着重要影响,也对维持地球生态平衡起着关键作用。
通过深入了解氧气的制取方法和应用领域,我们能更好地认识和探索这个重要元素。
