【化学】化学计算题中考压轴题分类汇编经典
中考化学与计算题有关的压轴题附答案解析

一、中考初中化学计算题1.现有10%的Na2CO3溶液,请按下面要求计算:(1)106 g上述溶液中所含溶质量为 g;(2)106 g 上述溶液与足量10%的盐酸反应,最多可生成CO2多少克?(3)向106 g 上述溶液中逐滴加入10%的盐酸并不断搅拌,此时发生的反应为:Na2CO3 + HCl =NaHCO3+ NaCl;当Na2CO3 全部转化为NaHCO3后,再加入盐酸才开始放出CO2 。
请在“题25图”中画出产生气体的曲线。
(4)另取10% Na2CO3溶液边搅拌边加入10%的盐酸,有关反应物与生成物的量如下表:物质Na2CO3HCl X NaCl CO H2O质量/g31.814.616.823.4 4.4m则m=;该反应的化学方程式为。
【答案】(1)10.6 g;(2)4.4g;(3);(4)1.8;3Na2CO3+ 4HCl=2NaHCO3+4NaCl+H2O + CO2↑【解析】【分析】【详解】(1)106g溶液中所含溶质的质量=106g×10%=10.6g,故填:10.6。
(2)设生成二氧化碳的质量为x,消耗的盐酸溶液中溶质的质量为a,则有2322Na CO +2HCl =2NaCl+H O+CO 106734410.6g 10610.6g=7310610.6g=44a xa xx =4.4g ,a =7.3g ;答:最多生成二氧化碳的质量为4.4g 。
(3)设全部转化为碳酸氢钠需要盐酸溶液中溶质的质量为y233Na CO +HCl =NaHCO +NaCl 10636.510.6g 10610.6g=36.5y yy =3.65g 盐酸溶液的质量为3.65g=36.5g 10%碳酸钠完全反应消耗盐酸的质量为:7.3g=73g 10%故碳酸氢钠完全反应生成二氧化碳消耗盐酸的质量为73g-36.5g=36.5g ,故曲线为:。
(4)根据表格提供的数据,生成4.4g 二氧化碳,需要碳酸钠的质量是10.6g ,生成氯化钠的质量是11.7g ,说明给出的碳酸钠有一部分转化生成了碳酸氢钠和氯化钠,X 为NaHCO 3,碳酸钠和HCl 是反应物,碳酸氢钠、氯化钠、二氧化碳和水是生成物,根据质量守恒定律可得31.8g+14.6g=16.8g+23.4g+4.4g+m ,m=1.8g ; 设反应方程式为aNa 2CO 3+bHCl ═cNaHCO 3+dNaCl+eH 2O+fCO 2↑31.6g 14.6g 16.8g 23.4g 1.8g 4.4ga:b:c:d:e:f=:::::=3:4:2:4:1:110635.58458.51844方程式为3Na 2CO 3+4HCl ═2NaHCO 3+4NaCl+H 2O+CO 2↑。
2020-2021中考化学计算题-经典压轴题.docx

一、中考初中化学计算题1.0g 样品中杂质CaCO3的质量为 4.0g-3.7g=0.3g(3)设反应的二氧化碳的质量为m,生成的碳酸氢钙的质量为nCaCO3 + H 2 O+CO 2 = Ca HCO32100441625.3g m n100 = 44 = 1625.3g m nm=2.332gn= 8.586g溶液中生成物的溶质的质量分数为8.586g100% 4.2% 4g+2.2g+2.332g+200g若所取样品中的 Ca(OH)2没有完全溶于水,对最后的计算结果没有影响。
原因是未溶解的氢氧化钙也能与二氧化碳生成碳酸钙。
2.为测定一瓶久置的烧碱中氢氧化钠的含量,某同学取25.0g 样品,溶于水得到100g 溶液,再加入100g 足量稀硫酸,充分反应至不再产生气体,测得溶液质量为197.8g 。
请计算:(1)反应产生 CO2的质量。
(2)样品中 NaOH的质量分数(结果保留至 0.1%)。
(3)最后所得溶液中的钠元素的质量(结果保留至0.1 )。
【答案】( 1) 2.2g ;( 2) 78.8%;( 3)13.6g【解析】(1)根据质量守恒定律,反应过程中所生成的气体的质量等于反应前后溶液质量的减少;(2)样品中 NaOH 的质量分数等于样品中 NaOH 的质量除以样品的总质量,所以我们可以根据上一步所求得二氧化碳的质量,根据质量守恒定律,求得样品中NaOH 的质量,而后再求样品中NaOH 的质量分数;(3)根据 NaOH 的质量、碳酸钠的质量分别乘以它们的质量分数可求得钠元素的质量;解:( 1)根据质量守恒定律,反应前后溶液质量的减少就等于反应过程中所生成的气体的质量,所以反应产生的 CO2 的质量为 100 g+100 g-197.8 g=2.2g。
(2)解:设所取样品中含有Na2 3CO 的质量为 x。
Na2CO3 +H2SO4═ Na2SO4+H2O+CO2↑10644x 2.2g10644x 2.2g解之得: x═ 5.3g烧碱样品中NaOH 的质量为: 25g-5.3 g=19.7 g19.7g样品中 NaOH 的质量分数为:× 100%=78.8%25g(3)所得溶液中钠元素的质量2346=19.7g × +5.3g× =13.6g 401063.某公司生产出的纯碱产品中经检测只含有氯化钠杂质。
中考化学(计算题提高练习题)压轴题训练含详细答案

一、中考初中化学计算题1.硫酸铜溶液对过氧化氢的分解有催化作用。
取一定质量8.5%的过氧化氢溶液倒入烧杯中,加入一定质量15%的硫酸铜溶液,过氧化氢完全分解。
有关实验数据如下表所示(不考虑气体在水中的溶解)。
请计算:(1)生成氧气的质量为___________g。
(2)反应后烧杯中溶液溶质的质量分数为____________。
(写出计算过程,结果精确到0.1%)【答案】0.8 2.2%【解析】【分析】【详解】(1)根据质量守恒定律,氧气的质量=(60g+3.3g)﹣62.5g=0.8g;(2)根据题意,过氧化氢完全分解后,溶液中的溶质是硫酸铜,因为硫酸铜是催化剂,反应前后质量不变,所以溶液中硫酸铜的质量=3.3g×15%=0.495g,只要求出反应后溶液的质量就可求出反应后溶液中溶质的质量分数。
设过氧化氢溶液中含H2O2的质量为x22222H O=2H O+O6832x0.8g↑68x=320.8g解得x=1.7g,则过氧化氢溶液的质量=1.7g÷8.5%=20g,反应后烧杯中溶液溶质的质量分数=0.495g100%20g+3.3g-0.8g⨯=2.2%。
答:(1)生成氧气的质量为0.8g。
(2)反应后烧杯中溶液溶质的质量分数为2.2%。
2.在一烧杯中盛有24.3g Na2SO4和NaCl组成的固体混合物,加入100g水使Na2SO4和NaCl全部溶解。
向其中逐渐滴加溶质质分数为20%的氯化钡溶液,生成沉淀的总质量与所滴入氯化钡溶液的质量关系曲线如图所示。
(1)请分析当BaCl2溶液滴加到B点时,溶液中的溶质是。
(2)请计算当滴加BaCl2溶液至图中A点时,所得溶液的溶质质量分数(计算结果保留一位小数)。
【答案】(1)BaCl2NaCl (2)10.6%【解析】试题分析:(1)当沉淀的质量不再增加时,说明反应已经进行完毕,所以当BaCl2溶液滴加到B点时说明氯化钡溶液滴加过量,当BaCl2溶液滴加到B点时,溶液中的溶质有刚生成的氯化钠和原来的氯化钠以及过量的氯化钡。
备战中考化学计算题-经典压轴题附答案解析

一、中考初中化学计算题1.为测定一瓶久置的烧碱中氢氧化钠的含量,某同学取25.0g样品,溶于水得到100g溶液,再加入100g足量稀硫酸,充分反应至不再产生气体,测得溶液质量为197.8g。
请计算:(1)反应产生CO2的质量。
(2)样品中NaOH的质量分数(结果保留至0.1%)。
(3)最后所得溶液中的钠元素的质量(结果保留至0.1)。
【答案】(1)2.2g;(2)78.8%;(3)13.6g【解析】(1)根据质量守恒定律,反应过程中所生成的气体的质量等于反应前后溶液质量的减少;(2)样品中NaOH的质量分数等于样品中NaOH的质量除以样品的总质量,所以我们可以根据上一步所求得二氧化碳的质量,根据质量守恒定律,求得样品中NaOH的质量,而后再求样品中NaOH的质量分数;(3)根据NaOH的质量、碳酸钠的质量分别乘以它们的质量分数可求得钠元素的质量;解:(1)根据质量守恒定律,反应前后溶液质量的减少就等于反应过程中所生成的气体的质量,所以反应产生的CO2的质量为100 g+100 g-197.8 g=2.2g。
(2)解:设所取样品中含有Na2CO3的质量为x。
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑106 44x 2.2g10644x 2.2g解之得:x═5.3g烧碱样品中NaOH的质量为:25g-5.3 g=19.7 g样品中NaOH的质量分数为:19.7g25g×100%=78.8%(3)所得溶液中钠元素的质量=19.7g×2340 +5.3g×46106=13.6g2.某补钙药剂说明书的部分信息如图所示,现将用20片该药剂制成的粉末与40盐酸混合(其他成分不与盐酸反应),恰好完全反应后称得剩余物的质量为55.6g,请回答下列问题(计算请写出过程):(1)青少年缺钙易出现的疾病是;(2)该品牌补钙药剂每片含CaCO3的质量为多少?(3)该盐酸中溶质的质量分数是多少?(精确到0.1%)【答案】(1)佝偻病(2)0.5g(3)18.3%【解析】试题分析:根据质量守恒定律化学反应前后物质的质量不变,故减少的质量即为生成的二氧化碳的质量。
中考化学计算题-经典压轴题及答案解析

一、中考初中化学计算题1.现有HCl与CaCl2的混合溶液,为了分析混合溶液中HCl和CaCl2的质量分数,设计了如下实验方案(假设反应都是充分完全):(实验数据)实验共记录了两组数据:第①组,气体吸收完全后,NaOH溶液质量增加4.4 g;第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为10 g。
根据实验设计及有关数据进行分析与计算:(1)实验中生成的气体用氢氧化钠溶液吸收时发生的反应方程式为__________。
(2)混合溶液中CaCl2的质量分数为_______?(写出计算过程,保留结果至0.1%,下同)(3)实验中混合溶液与Na2CO3溶液恰好完全反应,经过滤后所得滤液中溶质的质量分数为_______?(不考虑过滤中的损失。
)【答案】CO2+2NaOH═Na2CO3+H2O11.1%8.2%【解析】(1)根据二氧化碳与氢氧化钠的反应写出反应的化学方程式;(2)由题意可以知碳酸钠与氯化钙反应生成了碳酸钙沉淀和氯化钠,根据沉淀的质量可求出氯化钙、碳酸钠、氯化钠的质量,据此可计算出混合溶液中CaCl2的质量分数;(3)根据图中数据可以知道生成二氧化碳的质量为4.4g,结合碳酸钠和盐酸反应的化学方程式可以求出碳酸钠的质量、氯化钠的质量,再根据溶质质量分数的计算公式计算出混合溶液与Na2CO3溶液恰好完全反应,经过滤后所得滤液中溶质的质量分数。
(1)根据题意可知,混合液中的稀盐酸与碳酸钠反应生成的二氧化碳气体与氢氧化钠反应生成了碳酸钠和水,反应的化学方程式为CO2+2NaOH═Na2CO3+H2O;(2)设混合溶液中CaCl2的质量为x、生成的氯化钠的质量为y,与氯化钙反应的碳酸钠的质量为z。
CaCl2+Na2CO3═CaCO3↓+2NaCl111 106 100 117x z 10g y11110610011710x z g y===x=11.1gy=11.7gz=10.6g∴混合溶液中CaCl2的质量分数为11.1g100g×100%=11.1%;(3)氢氧化钠溶液增加的质量即为碳酸钠和盐酸反应生成二氧化碳的质量,即为4.4g,设与盐酸反应的碳酸钠的质量为m,生成的氯化钠的质量为n。
中考化学压轴题之计算题(中考题型整理,突破提升)附答案

一、中考初中化学计算题1.小新用20g含碳酸钠53%的天然碱制取氢氧化钠用于制作“叶脉书签”(杂质不参加反应)。
操作过程如下:请计算:(1)20g样品中碳酸钠的质量为__________g;(2)反应后所得滤液中氢氧化钠的质量分数为多少?__________(写出计算过程)(3)将200g滤液浓缩制成“叶脉书签”所需质量分数为10%的氢氧化钠溶液,需蒸发水__________g.【答案】10.6 4% 120【解析】【分析】【详解】(1)20g样品中碳酸钠的质量为20g×53%=10.6 g(2)解:设反应生成氢氧化钠的质量为x;Na CO+Ca(OH)=CaCO+2NaOH23231068010.6g x106/10.6g=80/x 解得x=8 g氢氧化钠的质量分数=8g/200g×100%=4%答:反应后所得滤液中氢氧化钠的质量分数为4% 。
(3)将200g滤液浓缩制成“叶脉书签”所需质量分数为10%的氢氧化钠溶液,需蒸发水的质量为X根据溶液稀释前后溶质的质量不变有:200g ×4%=(200g-X) ×10%X=120g2.工业生产的纯碱中常含有少量氯化钠杂质,现称取12 g纯碱样品于烧杯中,加入水使其完全溶解,逐渐加入氯化钙溶液至过量,测得加入氯化钙溶液的质量与生成沉淀的关系如下图所示。
(反应的化学方程式:CaCl2+Na2CO3=CaCO3↓+2NaCl)(1)计算样品中碳酸钠的质量分数________(要求写出计算过程,精确到0.1%)。
(2)若要计算氯化钙溶液中溶质的质量分数,可使用上图中_____点的一组数据(填标号)。
【答案】(1)88.3%;(2)a (或 b ) 【解析】由图可以看出生成的碳酸钙的质量为10g ,设碳酸钠的质量为x2233CaCl +Na CO ==CaCO 2NaCl ↓+106 100 x 10g10610010x g= x =10.6g样品中碳酸钠的质量分数为10.6100%88.3%12.0gg⨯≈,当求算氯化钙溶液中质量分数时,由于50g 氯化钙溶液对应的沉淀为4g ,125g 氯化钙溶液对应的沉淀为10g 都是氯化钙完全反应,所以可以根据a 点或者b 点数据计算。
2024年化学中考压轴题满分必刷:计算题

2024年化学中考压轴题满分必刷:计算题1.预防流感现在最有效的预防方法之一就是用消毒液对空气消毒。
深圳市科瑞德消毒用品公司生产的二氧化氯消毒液,是国际上公认的新一代强力、广谱、安全、高效的消毒剂,已被世界卫生组织(WHO)列为A1级安全消毒剂。
二氧化氯消毒液能够迅速、彻底杀灭各种细菌(大肠杆菌、白色念珠菌等)和病毒(肝炎病毒、流感病毒等)。
某校决定今天放学后对全校教室、寝室全面消毒。
小陈观察到瓶上的标签如下表所示。
二氧化氯1 000mL溶质的质量分数80%密度 1.2g/m3强腐蚀性,阴冷,密封储藏求:(1)这1 000毫升二氧化氯消毒液的质量是_____g,其中含溶质二氧化氯_____g。
(2)我校欲配制30kg质量分数为20%的稀二氧化氯消毒液用来消毒,需要多少kg这种二氧化氯消毒液和加入多少kg水?_____2.实验室可用高锰酸钾来制取氧气。
经实验探究,生成氧气的质量约是高锰酸钾质量的1/10.(1)现有高锰酸钾6.8g,大约能生成氧气的质量是______ ?(2)这些氧气若装在容积为125mL的集气瓶中,需要_____个集气瓶?(氧气在该条件下的密度为1.43g/L)3.为了配制50g 5%的氯化钠溶液,需进行如下操作:①计算;①用托盘天平称量g 氯化钠;①用(填“10mL”或“50mL”)量筒量取mL水;①将两者置于烧杯中,用玻璃棒搅拌。
(写出计算过程)4.“赠人玫瑰,手留余香”。
玫瑰花中含有的香茅醇(化学式为C10H20O)具有芳香的气味。
请计算。
(1)香茅醇的相对分子质量是。
(2)香茅醇中碳、氢、氧三种元素的质量比为(填最简整数比)。
(3) g香茅醇中含有6g碳元素。
5.某工厂生产了一批银戒指(银锌合金),检验部门通过化学实验来测定戒指中银的含量。
先用电子秤称得戒指样品的质量是40.0克,放入烧杯中,再将稀盐酸分5次加入烧杯与样品充分反应。
实验数据如下表所示根据上表中数据分析,完成下列问题:(1)戒指样品中银的质量是_____克。
中考化学常见计算压轴题总结(含参考答案)

中考化学计算压轴题总结(含参考答案)1.刘彬同学的姑父从三峡搬迁到我们家乡后,准备兴建一座碳酸钙精粉厂。
为检测当地石灰石中碳酸钙的纯度,他在实验室用6g石灰石样品(杂质不参加反应)与19g稀盐酸恰好完全反应,测得残留物为22.8g。
求:(1)依椐质量守恒定律,生成二氧化碳g;(2)样品中碳酸钙的质量分数;(3)所用稀盐酸溶液中溶质的质量分数。
2.用氯酸钾和二氧化锰的混合物16g,加热制取氧气,待完全反应,冷却后称量,得到11.2g固体物质,计算原混合物中二氧化锰的质量(计算结果保留二位小数)。
3.(5分)由硫元素和铜元素组成的一种化合物(硫化物)4.0g,高温条件下在空气中充分煅烧,只得到气体SO2和4.0g固体CuO 。
(1)要使煅烧后的固体CuO完全溶解,可加入适量稀硫酸。
计算至少需要溶质质量分数为10%的稀硫酸多少克?(要求写出计算所需的化学方程式)(2)运用所学知识和上述数据进行分析,这种硫化物的化学式为。
4.(1)曲酸(C6H6O4)是一种新型添加剂,它具有广泛的抗菌作用,作为防腐剂添加于食品中,具有非常好的效果.曲酸的相对分子质量是,曲酸中碳、氢、氧三种元素的质量比是(2)某工厂的废料中含铁和铜,需回收此废料中的铜.现取铁和铜的混合物样品l0g,向其中加入废弃的稀硫酸50g恰好完全反应,产生0.1gH2。
求:①废料中铜的质量分数。
②废弃稀硫酸中硫酸的质量分数。
5.侯德榜是我国著名的化学家。
由他发明的侯氏制碱法制得的纯碱中可能含有少量氯化钠。
现取仅含氯化钠杂质的纯碱样品33.2g,加入130g稀盐酸中,恰好完全反应,得氯化钠溶液150g。
求:(1)该纯碱样品中Na2CO3的质量;(2)反应后所得溶液中溶质的质量分数。
6.(10分)某矿井采出的食盐(俗称井盐)中含有CaCl2,为设计除杂方案需测定CaCl2的含量;取上述井盐22.8g,向其中加入100g质量分数为10.69%的Na2CO3溶液恰好完全反应。
【化学】化学方程式的计算中考压轴题分类汇编(word)
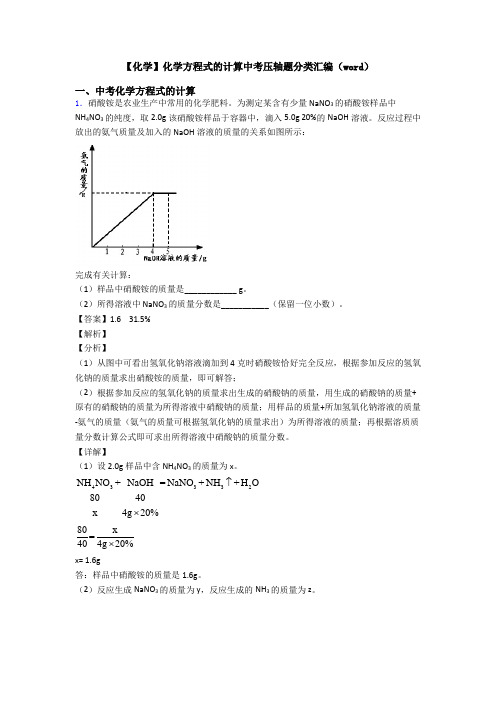
【化学】化学方程式的计算中考压轴题分类汇编(word )一、中考化学方程式的计算1.硝酸铵是农业生产中常用的化学肥料。
为测定某含有少量NaNO 3的硝酸铵样品中 NH 4NO 3的纯度,取2.0g 该硝酸铵样品于容器中,滴入5.0g 20%的NaOH 溶液。
反应过程中放出的氨气质量及加入的NaOH 溶液的质量的关系如图所示:完成有关计算:(1)样品中硝酸铵的质量是____________ g 。
(2)所得溶液中 NaNO 3的质量分数是___________(保留一位小数)。
【答案】1.6 31.5%【解析】【分析】(1)从图中可看出氢氧化钠溶液滴加到4克时硝酸铵恰好完全反应,根据参加反应的氢氧化钠的质量求出硝酸铵的质量,即可解答;(2)根据参加反应的氢氧化钠的质量求出生成的硝酸钠的质量,用生成的硝酸钠的质量+原有的硝酸钠的质量为所得溶液中硝酸钠的质量;用样品的质量+所加氢氧化钠溶液的质量-氨气的质量(氨气的质量可根据氢氧化钠的质量求出)为所得溶液的质量;再根据溶质质量分数计算公式即可求出所得溶液中硝酸钠的质量分数。
【详解】(1)设2.0g 样品中含NH 4NO 3的质量为x 。
43332NH NO NaOH NaNO NH H O4g 20%+=++8040x ↑⨯48g 0x =4020%⨯ x= 1.6g答:样品中硝酸铵的质量是1.6g 。
(2)反应生成 NaNO 3的质量为 y ,反应生成的NH 3的质量为z 。
43332NH NO NaOH N +=++408517y aNO NH H O40%zg 2↑⨯ 404g 20%=85y⨯ 404g 20%=17z⨯ y= 1.7gz= 0.34g 反应后所得溶液中NaNO 3的质量分数为= 1.7g+(2g-1.6g)100%=31.5%2g+5g-0.34g⨯ 答:所得溶液中 NaNO 3的质量分数是31.5%。
【点睛】做本道题时要将4克氢氧化钠溶液和5克氢氧化钠溶液区分清,不能乱用,参加反应的氢氧化钠溶液的质量是4克,所加的氢氧化钠溶液的质量是5克。
2024年化学中考压轴题满分必刷:计算题 (1)

2024年化学中考压轴题满分必刷:计算题1.维生素C,化学式为C6H8O6,在人体中具有维持免疫、促进非血红素铁吸收、抗氧化等功能,并起到美白、淡斑的功效。
(1)维生素C的相对分子质量为;(2)维生素C中氧元素的质量分数为(用百分数表示,保留一位小数);(3)二氧化碳的化学式是,计算克维生素C中所含碳元素的质量与66g二氧化碳中所含碳元素质量相等。
2.硝酸铵(NH4NO3)是一种农业中重要的氮肥。
(1)NH4NO3的相对分子质量为______。
(2)NH4NO3中氮元素与氧元素的质量比为______。
(3)160kg NH4NO3 中N元素的质量为多少?(要求写出计算过程)3.计算题:小M家乡有一跨河的铁索桥,小M欲检测铁索的锈蚀程度,判断铁索桥是否存在安全隐患,他将12.8g已生锈的铁索(注:生锈的铁索中只含氧化铁和铁)放入一定浓度的稀盐酸中充分反应,测得产生气体的质量与稀盐酸的质量关系如图所示。
请回答:(1)该生锈的铁索中铁的质量为g。
(2)求所用稀盐酸溶质的质量分数。
(写出计算过程)4.某兴趣小组用氯酸钾和二氧化锰的混合物制取氧气,实验过程中生成氧气的质量随时间变化如图。
(1)反应结束后产生氧气的质量是g。
(2)计算原固体混合物中氯酸钾的质量。
5.硫酸厂排放的废水中通常含有少量残余硫酸:为测定废水中硫酸的溶质质量分数,某校化学学习小组的同学们在韩老师的指导下做如下实验:取200g该废水,向其中逐滴加入溶质质量分数为8%的氢氧化钠溶液,所滴加的NaOH溶液的质量与溶液pH变化如图所示:(1)恰好反应时,消耗的NaOH溶液中溶质NaOH的质量为g,A点处所得溶液中溶质为。
(填化学式)(2)求废水中硫酸的溶质质量分数(写出计算过程)。
(3)请在图画出废水中硫酸钠的质量随NaOH溶液质量变化的图像。
6.某些厂家为延长食品保质期,常在食品中添加苯甲酸(C6H5COOH)作为防腐剂。
回答下列问题:(1)苯甲酸的相对分子质量是_____。
中考化学计算题-经典压轴题含详细答案

一、中考初中化学计算题1.实验室有一瓶未知浓度的BaCl2溶液,某同学取出150g该溶液于烧杯中,向其中逐滴加入溶质质量分数为26.5%的Na2CO3溶液。
反应过程中生成沉淀的质量与所用Na2CO3溶液质量的关系如图所示。
已知:BaCl2+Na2CO3=BaCO3↓+2NaCl。
请计算:(1)配制26.5%的Na2CO3溶液80g,需要Na2CO3固体___g。
(2)BaCl2溶液的溶质质量分数是____?(写出计算过程,结果保留到0.1%)【答案】(1) 21.2g;(2)13.9%【解析】试题分析:(1)根据溶质质量分数计算的表达式:配制26.5%的Na2CO3溶液80g,需要Na2CO3固体质量=80g×26.5%=21.2g(2)从图甲中获知,当BaCl2完全转化为沉淀时消耗Na2CO3溶液的质量为40g,再根据化学反应方程式:BaCl2+Na2CO3=BaCO3↓+2NaCl中Na2CO3与BaCl2的质量关系,可求出BaCl2的质量,进而可求解BaCl2溶液的溶质质量分数解:设BaCl2的质量为xBaCl2+Na2CO3=BaCO3↓+2NaCl208106x40g×26.5%208∶106=X∶(40g×26.5%)x=208×40g×26.5%/106=20.8g该BaCl2溶液的溶质质量分数=(20.8g/150g)×100%=13.9%答:该BaCl2溶液的溶质质量分数为13.9%考点:溶质质量分数计算,根据化学方程式计算2.向碳酸钠和氯化钠的混合物15.6 g中加入100 g稀盐酸,恰好完全反应后,得到111.2 g溶液。
试计算:(1)产生二氧化碳多少克?(2)所得溶液中溶质的质量分数是多少?【答案】解:(1)CO2的质量为:15.6g+100g-111.2g=4.4g (1分)(2)设反应生成氯化钠质量为X,原混合物中有碳酸钠质量为YNa2CO3+2HCl=2NaCl+H2O+CO2↑ (1分)106 117 44Y X 4.4gX=11.7g Y=10.6g (各1分,共2分)(15.6g-10.6g+11.7g)/111.2g×100%=15.0% (1分)答:(1) 产生二氧化碳4.4克(2)所得溶液中溶质的质量分数是15.0%【解析】试题分析:根据质量差可以计算生成二氧化碳的质量,根据二氧化碳的质量可以计算碳酸钠、生成氯化钠的质量,进一步可以计算所得溶液中溶质的质量分数。
2020-2021中考化学压轴题之计算题(中考题型整理,突破提升)含答案解析

一、中考初中化学计算题1.现有10%的Na2CO3溶液,请按下面要求计算:(1)106 g上述溶液中所含溶质量为 g;(2)106 g 上述溶液与足量10%的盐酸反应,最多可生成CO2多少克?(3)向106 g 上述溶液中逐滴加入10%的盐酸并不断搅拌,此时发生的反应为:Na2CO3 + HCl =NaHCO3+ NaCl;当Na2CO3 全部转化为NaHCO3后,再加入盐酸才开始放出CO2 。
请在“题25图”中画出产生气体的曲线。
(4)另取10% Na2CO3溶液边搅拌边加入10%的盐酸,有关反应物与生成物的量如下表:物质Na2CO3HCl X NaCl CO H2O质量/g31.814.616.823.4 4.4m则m=;该反应的化学方程式为。
【答案】(1)10.6 g;(2)4.4g;(3);(4)1.8;3Na2CO3+ 4HCl=2NaHCO3+4NaCl+H2O + CO2↑【解析】【分析】【详解】(1)106g溶液中所含溶质的质量=106g×10%=10.6g,故填:10.6。
(2)设生成二氧化碳的质量为x,消耗的盐酸溶液中溶质的质量为a,则有2322Na CO +2HCl =2NaCl+H O+CO 106734410.6g 10610.6g=7310610.6g=44a xa xx =4.4g ,a =7.3g ;答:最多生成二氧化碳的质量为4.4g 。
(3)设全部转化为碳酸氢钠需要盐酸溶液中溶质的质量为y233Na CO +HCl =NaHCO +NaCl 10636.510.6g 10610.6g=36.5y yy =3.65g 盐酸溶液的质量为3.65g=36.5g 10%碳酸钠完全反应消耗盐酸的质量为:7.3g=73g 10%故碳酸氢钠完全反应生成二氧化碳消耗盐酸的质量为73g-36.5g=36.5g ,故曲线为:。
(4)根据表格提供的数据,生成4.4g 二氧化碳,需要碳酸钠的质量是10.6g ,生成氯化钠的质量是11.7g ,说明给出的碳酸钠有一部分转化生成了碳酸氢钠和氯化钠,X 为NaHCO 3,碳酸钠和HCl 是反应物,碳酸氢钠、氯化钠、二氧化碳和水是生成物,根据质量守恒定律可得31.8g+14.6g=16.8g+23.4g+4.4g+m ,m=1.8g ; 设反应方程式为aNa 2CO 3+bHCl ═cNaHCO 3+dNaCl+eH 2O+fCO 2↑31.6g 14.6g 16.8g 23.4g 1.8g 4.4ga:b:c:d:e:f=:::::=3:4:2:4:1:110635.58458.51844方程式为3Na 2CO 3+4HCl ═2NaHCO 3+4NaCl+H 2O+CO 2↑。
2020-2021年化学计算题压轴试题分类汇编及答案(word)

2020-2021年化学计算题压轴试题分类汇编及答案(word )一、中考化学计算题1.氧化亚铜(Cu 2O )可用于生产船底防污漆,防止海生物对船舶设备的污损。
现将Cu 2O 和Cu 的固体混合物20g 放入烧杯中,加入质量分数为24.5%的稀硫酸50g ,恰好完全反应。
已知:Cu 2O+H 2SO 4═CuSO 4+Cu+H 2O .计算:(1)所加稀硫酸中溶质的质量为_____g 。
(2)原混合物中Cu 2O 与Cu 的质量比_____(写出计算过程,结果用最简整数比表示) (3)在图中画出向20g Cu 2O 和Cu 的固体混合物中逐滴加入24.5%的稀硫酸至过量,铜的质量变化曲线_____。
【答案】12.25 9: 1 。
【解析】 【分析】根据加入的硫酸中溶质的质量和对应的化学方程式求算氧化亚铜的质量,进而求算对应的比值以及画图。
【详解】(1)所加稀硫酸中溶质的质量为24.5%×50g =12.25g ;故填:12.25 (2)设原混合物中Cu 2O 的质量为x ,生成的铜的质量为y 。
224421449864x 12.Cu O+H SO CuSO +C 2u +H 5Og y═ 1449864==x 12.25g y解得:x =18 g ;y =8g ; 原混合物中Cu 2O 与Cu 的质量比为18 g :(20 g ﹣18 g )=9:1;故填:9:1(3)没加入硫酸时,铜的质量为2g ,加入到50g 稀硫酸时铜的质量为2g+8g =10g 。
如下图所示;故填:【点睛】根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
2.取一定量的木炭在氧气中燃烧,生成23.2 g气体(氧气已完全反应)。
将气体通入过量的澄清石灰水中,生成40 g沉淀。
计算:(1)生成气体的成分及质量___________。
(2)生成气体中碳元素的质量分数_________。
中考化学压轴题专题计算题的经典综合题含详细答案

一、中考初中化学计算题1.某纯碱样品中含有少量氯化钠。
为测定样品中碳酸钠的质量分数,现称取该样品11g ,加入到盛有50g 稀盐酸的烧杯中,恰好完全反应,最后称得烧杯中溶液的质量为56.6g 。
计算:(1)完全反应后生成CO 2的质量_______;(2)纯碱样品中碳酸钠的质量分数_________(结果精确到0.1%) 【答案】4.4g 96.4% 【解析】 【分析】 【详解】(1)根据质量守恒定律,完全反应后生成二氧化碳的质量=11g+50g-56.6g=4.4g (2)设参加反应的碳酸钠的质量为x2322Na CO 2HCl 2Na +=++106444.4C CO Ogl H x106x =444.4gx=10.6g纯碱样品中碳酸钠的质量分数=10.6g11g×100%≈96.4% 答:(1)完全反应后生成CO 2的质量为4.4g ;(2)纯碱样品中碳酸钠的质量分数约为96.4%.2.将Na 2CO 3和NaCl 固体混合物32.9g 放入烧杯中,此时总质量为202.9g ,加入326.9g 盐酸,恰好完全反应,待没有气泡逸出后再次称量,总质量为521.0g .计算所得溶液中溶质的质量分数______(CO 2的溶解忽略不计). 【答案】10 【解析】 【分析】首先根据质量守恒定律:化学反应前后,物质的质量不变,可先求出产生的气体二氧化碳的质量=202.9g+326.9g-521.0g=8.8g ,再根据化学反应方程式:Na 2CO 3+2HCl=2NaCl+H 2O+CO 2↑可知,反应后所得溶液中溶质是NaCl ,但NaCl 来自两部分,一是反应生成的,二是原固体混合物中含有的,生成的NaCl 可通过化学方程式来求解,原固体混合物中含有的NaCl 可通过混合物32.9g 减去Na 2CO 3的质量 【详解】解:根据质量守恒定律,反应生成的CO 2质量=202.9g+326.9g-521.0g=8.8g 设Na 2CO 3的质量为x ,生成的NaCl 的质量为y 。
2020-2021年化学计算题中考压轴题分类汇编

2020-2021年化学计算题中考压轴题分类汇编一、中考化学计算题1.20g含杂质(杂质不溶于水,也不溶于酸)的锌样品,与一定质量的稀硫酸恰好完全反应,所得溶液质量为80.5g,同时生成氢气0.4g。
试计算:(1)样品中锌的质量分数是_____;(2)完全反应后生成溶液中溶质的质量分数是_____;(3)所用稀硫酸的质量分数是_____(计算结果保留到0.01%)。
【答案】65% 40% 28.87%【解析】【分析】样品中的锌能与稀硫酸反应生成硫酸锌和氢气。
【详解】设样品中锌的质量为x;生成的硫酸锌的质量为y;硫酸中溶质的质量为z;2442Zn+H SO=ZnSO+H65981612x z y0.4g↑65981612===x z y0.4gx=13gy=32.2gz=19.6g(1)样品中锌的质量分数为13g×100%=65% 20g(2)完全反应后生成溶液中溶质的质量分数为32.2g×100%=40% 80.5g(3)所用稀硫酸的质量分数为19.6g×100%28.87% 80.5g+0.4g-13g≈答:样品中锌的质量分数为65%,完全反应后生成溶液中溶质的质量分数为40%,所用稀硫酸的质量分数为28.87%。
【点睛】利用化学方程式根据锌与生成的氢气的质量比求出锌的质量;反应后的溶液是硫酸锌溶液,利用化学方程式可计算出溶质硫酸锌的质量。
2.实验室有化学实验考试后留下混有少量食盐的小苏打样品。
现称取样品10克,加入某溶质质量分数的稀盐酸90克,至充分反应不再有气泡产生为止,称得剩余溶液质量为95.6克。
求:(1)生成气体的质量____。
(2)反应后所得溶液的溶质质量分数____。
(结果保留至0.1%)【答案】4.4g 7.8%【解析】【详解】(1)生成气体的质量为10g+90g-95.6g=4.4g。
(2)反应后所得溶液的溶质质量为x,样品中碳酸钠的质量为y,322NaHCO+HCl=NaCl+H O+CO8458.544y x 4.4g58.54484==x 4.4g y x=5.85g y=8.4g ↑,反应后所得溶液的溶质质量分数为5.85g10g8.4g100%7.8% 90g10g 4.4g+-⨯≈+-。
化学方程式的计算中考压轴题分类汇编(word)

化学方程式的计算中考压轴题分类汇编(word)一、中考化学方程式的计算1.请根据如图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),回答下列问题:计算稀盐酸中溶质质量。
【答案】7.3g【解析】【分析】【详解】根据质量守恒反应前后物质总质量不变可得二氧化碳的质量等于12g+100g+100g-207.6g=4.4g设稀盐酸中溶质质量为x3222CaCO2HCl=CaCl CO H O7344x 4.4g73x=,x=7.3g44 4.4g++↑+答:稀盐酸中溶质质量7.3g【点睛】根据质量守恒,求出二氧化碳质量,根据二氧化碳质量求稀盐酸中溶质质量2.某造纸厂排放的废水中含有Na2CO3和NaOH。
为测定废水中Na2CO3的质量分数,取50g废水样品于烧杯中,将40g稀盐酸分成4等份分4次缓慢加入到烧杯中,产生气体质量与稀盐酸溶液的质量关系如图曲线所示。
回答下列问题:(1)请仔细分析如图数据,完成下表实验记录:(2)上述生成气体________ g。
(3)计算该废水中Na2CO3的质量分数________。
(4)测定Na2CO3的质量分数,也可用下列方法:另取上述废水样品50g,向废水中逐滴加入CaCl2溶液,至反应完全时,经过滤、洗涤、干燥、_________,即可计算出Na2CO3的质量分数。
【答案】0 1.2 2.2 2.2 10.6% 称量固体质量【解析】【分析】【详解】解:(1)由图表信息可知:实验2,产生气体质量为0g;实验3产生气体质量为1.2g;实验4,盐酸过量,则产生气体质量为2.2g;(2)上述生成气体的总质量为2.2g;(3)设:参加反应碳酸钠的质量为x。
2322Na CO+2HCl=2NaCl+H O+CO10644x 2.2g↑106442.2x g= x=5.3g废水中Na2CO3的质量分数=5.3g100%10.6% 50g⨯=;(4)测定Na2CO3的质量分数,也可用下列方法:另取上述废水样品50g,向废水中逐滴加入CaCl2溶液与碳酸钠反应产生碳酸钙沉淀,至反应完全时,经过滤、洗涤、干燥、称量固体碳酸钙质量,根据该反应的化学方程式,即可计算出Na2CO3的质量分数。
2020-2021中考化学压轴题之计算题(中考题型整理,突破提升)

一、中考初中化学计算题1.工业生产的纯碱中常含有少量氯化钠杂质,现称取12 g 纯碱样品于烧杯中,加入水使其完全溶解,逐渐加入氯化钙溶液至过量,测得加入氯化钙溶液的质量与生成沉淀的关系如下图所示。
(反应的化学方程式:CaCl 2+Na 2CO 3=CaCO 3↓+2NaCl)(1)计算样品中碳酸钠的质量分数________(要求写出计算过程,精确到0.1%)。
(2)若要计算氯化钙溶液中溶质的质量分数,可使用上图中_____点的一组数据(填标号)。
【答案】(1)88.3%;(2)a (或 b ) 【解析】由图可以看出生成的碳酸钙的质量为10g ,设碳酸钠的质量为x2233CaCl +Na CO ==CaCO 2NaCl ↓+106 100 x 10g10610010x g = x =10.6g样品中碳酸钠的质量分数为10.6100%88.3%12.0gg⨯≈,当求算氯化钙溶液中质量分数时,由于50g 氯化钙溶液对应的沉淀为4g ,125g 氯化钙溶液对应的沉淀为10g 都是氯化钙完全反应,所以可以根据a 点或者b 点数据计算。
答:(1)计算样品中碳酸钠的质量分数约为88.3%;(2)若要计算氯化钙溶液中溶质的质量分数,可使用图中曲线上示出的点a 或者b 所对应的数据。
2.某碳酸钠样品中含有少量氯化钠。
现称量11 g 该样品放入烧杯中,然后加入一定量溶质的质量分数为14.6%的稀盐酸,至恰好完全反应,去除溶液中的水分,最终得到12.1g 氯化钠固体。
计算:(1)碳酸钠样品中碳酸钠的质量______________(2)反应后所得溶液中溶质的质量分数。
(结果精确到0.1%)_____________ 【答案】10.6g 21.4% 【解析】 【分析】设样品中氯化钠的质量为x,则生成的氯化钠质量为12.1g-x,样品中碳酸钠的质量为11g-x,生成的二氧化碳质量为y,反应中消耗的盐酸质量为z。
2322 Na CO+2HCl=2NaCl+H O+CO106731174411g-x z14.6%12.1g-x y ↑⨯1067311744=== 11g-x z14.6%12.1g-x y⨯解得x=0.4g;y=4.4g;z=50g则样品中碳酸钠的质量为10.6g反应后所得溶液中溶质质量分数为:12.1g100%11g+50g-4.4g⨯≈ 21.4%答:碳酸钠样品中碳酸钠的质量为10.6g,反应后所得溶液中溶质的质量分数为21.4%。
最新化学计算题压轴试题分类汇编及答案经典

最新化学计算题压轴试题分类汇编及答案经典一、中考化学计算题1.现有碳酸钠和氯化钠的固体混合物12.6g,其中含氧元素4.8g,将该混合物加入到一定质量的稀盐酸中,恰好完全反应,得到137g氯化钠溶液。
计算:(l)原固体混合物中碳酸钠的质量分数(结果保留至0.1%)______;(2)所用稀盐酸中溶质的质量分数(结果保留至0.1%)______。
【答案】84.1% 5.7%【解析】【分析】【详解】(l)原固体混合物中碳酸钠的质量分数4.8g÷=10.6g;混合物中碳酸钠的质量分数为10.6g÷12.6g×100%≈84.1%;(2)设盐酸中溶质的质量为x,生成二氧化碳质量为y2322Na CO+2HCl=2NaCl+H O+CO106734410.6g x y1067344==10.6g x yx=7.3gy=4.4g所用稀盐酸中溶质的质量分数7.3g÷(137g+4.4g-12.6g)×100%≈5.7%2.某混合溶液中含有硫酸和盐酸,取该混合溶液20g于烧杯中,不断滴加氢氧化钡溶液,反应过程中烧杯中产生沉淀的质量、溶液pH的变化如图所示(BaCl2溶液呈中性)。
求:(1)完全反应后生成沉淀的质量为_____g;(2)氢氧化钡溶液的质量分数为_____;(3)计算20g混合溶液中HCl的质量为多少?_____【答案】4.66 17.1% 2.92g【解析】【分析】根据图可知,生成4.66g 沉淀消耗的氢氧化钡溶液的质量为20g ,而总消耗的氢氧化钡的溶液的质量为60g ,则与盐酸反应的氢氧化钡溶液的质量为60g ﹣20g =40g ,据此结合对应的化学方程式求算。
【详解】由图可知生成沉淀的质量为4.66g ,与硫酸反应的氢氧化钡溶液的质量为20g设氢氧化钡溶液的质量分数为x22442Ba(OH)+H SO BaSO +2H O 17123320gx 4.66g ↓=171233=20g 4.66gx x =17.1%与盐酸反应的氢氧化钡溶液的质量为60g ﹣20g =40g设20g 混合溶液中HCl 的质量为y222()1717317.1%40g yBa OH +2HCl BaCl +2H O ⨯=17173=17.1%40g y⨯ y =2.92g 故填:(1)4.66;(2)17.1%;(3)2.92g【点睛】根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
2020-2021中考化学计算题-经典压轴题含详细答案

一、中考初中化学计算题1.0g 样品中杂质CaCO 3的质量为4.0g-3.7g=0.3g(3)设反应的二氧化碳的质量为m ,生成的碳酸氢钙的质量为n()32232CaCO +H O +CO =Ca HCO 10044162 5.3gm n10044162==5.3g m n m=2.332gn= 8.586g溶液中生成物的溶质的质量分数为8.586g100% 4.2%4g+2.2g+2.332g+200g⨯≈若所取样品中的Ca(OH)2没有完全溶于水,对最后的计算结果没有影响。
原因是未溶解的氢氧化钙也能与二氧化碳生成碳酸钙。
2.某纯碱样品中含有少量氯化钠。
为测定样品中碳酸钠的质量分数,现称取该样品11g ,加入到盛有50g 稀盐酸的烧杯中,恰好完全反应,最后称得烧杯中溶液的质量为56.6g 。
计算:(1)完全反应后生成CO 2的质量_______;(2)纯碱样品中碳酸钠的质量分数_________(结果精确到0.1%) 【答案】4.4g 96.4% 【解析】 【分析】 【详解】(1)根据质量守恒定律,完全反应后生成二氧化碳的质量=11g+50g-56.6g=4.4g (2)设参加反应的碳酸钠的质量为x2322Na CO 2HCl 2Na +=++106444.4C CO Ogl H x↑ 106x =444.4gx=10.6g纯碱样品中碳酸钠的质量分数=10.6g11g×100%≈96.4% 答:(1)完全反应后生成CO 2的质量为4.4g ;(2)纯碱样品中碳酸钠的质量分数约为96.4%.3.实验室有一瓶未知浓度的BaCl2溶液,某同学取出150g该溶液于烧杯中,向其中逐滴加入溶质质量分数为26.5%的Na2CO3溶液。
反应过程中生成沉淀的质量与所用Na2CO3溶液质量的关系如图所示。
已知:BaCl2+Na2CO3=BaCO3↓+2NaCl。
请计算:(1)配制26.5%的Na2CO3溶液80g,需要Na2CO3固体___g。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
6.现有硫酸钠和氢氧化钠的固体混合物(假设它们是混合均匀的),取部分样品进行分析
实验:
(1)取 2.62g 固体混合物加水完全溶解后,加入氯化钡溶液至不再产生沉淀为止,过滤干
燥后,称得沉淀的质量为 2.33g.求 2.62g 固体混合物中硫酸钠的质量是多少?
(2)另取等质量的固体混合物溶于 56.38g 水后,再加入 12g 一定质量分数的稀硫酸,恰
(1)P 点时溶液中的离子有_____。 (2)求原 BaCl2 溶液的溶质质量分数。________ 【答案】Mg2+和 Cl- 20.8% 【解析】 【详解】 加入 100g 硫酸镁出现明显的拐点,说明此时恰好完全反应。此时溶液为氯化镁,对应的离 子有 Mg2+和 Cl-。 根据质量守恒定律可得,生成硫酸钡的质量为 100g+100g-176.7g=23.3g 解:设原 BaCl2 溶液的溶质质量分数为 x
+HCl 36.5
=NaCl +H2O 58.5
x 50g 7.3 00 y
40 36.5 58.5
=
=
x 50g 7.3 00 y
x=4.0g
y=5.85g
反应后得到氯化钠的质量为:83.5g×10%=8.35g
混合物中氯化钠的质量为:8.35g-5.85g=2.5g
需要加水的质量为:83.5g-50g-4.0g-2.5g=27.0g
好完全反应,试计算反应后所得溶液中溶质的质量分数.
【答案】(1)1.42g;(2)5%
【解析】
解(1)设固体混合物中硫酸钠的质量是 x,
Na2SO4 + BaCl2= BaSO4↓+ 2NaCl
142
233
x
2.33g
142/x=233/2.33g x=1.42g;
(2)2.62g 固体混合物中氢氧化钠的质量为 2.62g-1.42g=1.2g
Mg + H2SO4 = MgSO4 + H2
24
2
2.4g
x
24 = 2 2.4g x
x=0.2g 答:若反应过程中产生的气体收集起来,可得到氢气的质量为 0.2g。 【点睛】 观察表格中前四次剩余固体变化情况,每次减少 0.5g,第五次开始,剩余固体质量不再变 化,则反应完全。
5.BaCl2 是一种重金属盐,其水溶液具有很强的毒性,若误服了 BaCl2 溶液可立即服用 MgSO4 溶液解毒。为测定某 BaCl2 溶液的溶质质量分数,现向 BaCl2 溶液不断加入 MgSO4 溶 液,并将反应过程中溶液总质量与加入 MgSO4 溶液的质量关系绘制成曲线如图所示,请回 答:
剩余固体质量 2.5g
m
1.5g
1.0g
0.6g
0.6g
(1)铜镁合金属于_____(填“混合物”或“纯净物“); (2)加入稀硫酸发生反应的化学方程式为_____; (3)分析数据可知表格中 m=_____; (4)合金样品中铜的质量分数是_____; (5)若反应过程中产生的气体收集起来,可得到氢气的质量为多少 g?_____ 【答案】混合物 Mg+H2SO4=MgSO4+H2↑ 2 20% 0.2g 【解析】 【分析】 根据镁的质量和对应的化学方程式求算生成的氢气的质量,合金是由金属和金属或金属和 非金属熔合而成的具有金属特性的物质,属于混合物。 【详解】 (1)合金属于混合物,所以铜镁合金属于 混合物。
(2)加入稀硫酸发生反应是镁和硫酸反应生成硫酸镁和氢气,对应的化学方程式为 Mg+H2SO4=MgSO4+H2↑; (3)前四次每次加入硫酸都是固体都是减少了 0.5g,所以分析数据可知表格中 m=2;
0.6g
(4)合金样品中铜的质量分数是
×100%=20%;
3g
(5)参加反应的镁的质量为 3g−0.6g=2.4g 设可得到氢气的质量为 x
Na2CO3 + 2HCl ═ 2NaCl+ H2O+ CO2
73
44
y
4.4g
73 = 44 y 4.4g
y=7.3g 第二次加入盐酸的质量为:150g×7.3%=10.95g; 第二次加入 150g7.3%的稀盐酸,溶液恰好变为无色,即盐酸与 B 烧杯溶液中的碱性物质恰 好反应完全,根据计算可知,碳酸钠消耗了 7.3g 盐酸,剩余的盐酸与氢氧化钠反应,即第 二次加入稀盐酸前 B 烧杯溶液中有氢氧化钠;
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2
106
98
142
44
z
x
y
4.4g
98 = x 44 4.4g
解得 x=9.8g
稀硫酸中溶质的质量分数为: 9.8g 100%=10% 98g
142 = y 44 4.4g
解得 y=14.2g
106 = z 44 4.4g
解得 z=10.6g
【答案】 Na2CO3 +2HCl═2NaCl+H2O+CO2
36.5 = 50g 7.3%
40
x
NaCl、Na2CO3、
NaOH 10% 40g 70.2t
【解析】
【详解】
(1)敞口放置的氢氧化钠溶液,会与空气中的二氧化碳反应生成碳酸钠,碳酸钠和盐酸反
应生成氯化钠、水和二氧化碳,方程式为: Na2CO3 +2HCl═2NaCl+H2O+CO2 ;
设氢氧化钠与硫酸反应生成硫酸钠的质量为 y
2NaOH + H2SO4 == Na2SO4 +2H2O
80
142
1.2g
y
80/1.2g=142/y y=2.13g
反应后所得溶液中溶质的质量分数=(2.13g+1.42g)÷ (2.62g+56.38g+12g)× 100%=5%
答:略
点睛:方程式的计算,关键根据化学反应方程式找出相关物质的质量关系,利用反应中物
(3)加入 98g 稀硫酸溶液时的溶液为碳酸钠和稀硫酸恰好完全反应时的溶液,溶液中溶质
的质量分数为:
14.2g
100%=7.1%
10.6g+95.8g+98g-4.4g
答:稀硫酸的溶质质量分数为 10%;A 点时烧杯中溶液的溶质质量分数为 7.1%。
2.取一定量的氯化钠与氢氧化钠的混合物,加一定量的水配成溶液,然后向其中滴加溶质
【化学】化学计算题中考压轴题分类汇编经典
一、中考化学计算题
1.取某碳酸钠样品放入烧杯中,加入 95.8g 水充分溶解,再向其中加入稀硫酸,反应放出 气体的总质量与所加入稀硫酸的质量关系曲线如下图所示,请根据题意解答问题:
(1)当加入 196g 稀硫酸时,放出气体的质量为___________g。 (2)计算加入的稀硫酸溶液溶质的质量分数为____________。 (3)试通过计算求出加入 98g 稀硫酸(即 A 点)时烧杯中溶液溶质的质量分数。(写出 计算过程)_____________ 【答案】4.4 10% 7.1% 【解析】 【分析】 【详解】 (1)从题中图像可知,当加入稀硫酸 98g 时,生成的气体质量达到最大值 4.4g,此时碳酸 钠和稀硫酸完全反应,因此继续加入稀硫酸至 196g,气体质量不会增加,因此反应中放出 气体的质量为 4.4g; (2)因为加入稀硫酸 98g 时,生成的气体质量达到最大值 4.4g,所以此时碳酸钠和稀硫酸 完全反应。 设加入的 98g 稀硫酸中溶质硫酸的质量为 x,恰好反应时生成的硫酸钠质量为 y,参加反应 的碳酸钠的质量为 z。
【答案】Na2CO3+CaCl2═CaCO3↓+2NaCl 碳酸钠溶液本身显碱性,pH>7 4.4% 【解析】
【分析】
AB 段发生的反应是盐酸和碳酸钠的反应,BC 段发生的反应是氯化钙和碳酸钠的反应,CD 段加入碳酸钠,但是没有发生化学反应。
【详解】
(1)BC 段反应的化学方程式为 Na2CO3+CaCl2═CaCO3↓+2NaCl; (2)CD 段加入碳酸钠,碳酸钠没有发生化学反应,碳酸钠溶于水显碱性,溶液 pH 大于
58.5
z
z=23.4g
所得不饱和溶液中溶质的质量分数为: 23.4g 100%=10% 245.6g-11.6g
(5)实验共用 7.3%的稀盐酸 200g,设需要质量分数为 36.5%的浓盐酸的质量为 m:
200g×7.3%=m×36.5% m=40g (6)由以上实验可知,50g 该氢氧化钠样品溶液与 200g7.3%的稀盐酸完全反应得到 23.4g 氯化钠,所以 150t 此氢氧化钠废液,变成氯化钠回收,可得到氯化钠的质量为:
MgSO4+BaCl2=BaSO4↓+MgCl2 208 233 100gx 23.3g
208 100x 233 23.3g
x=20.8% 答:(1)P 点时溶液中的离子有 Mg2+和 Cl-。 (2)原 BaCl2 溶液的溶质质量分数为 20.8%。 【点睛】 此题为图形计算题,解题关键是对图形的理解,图中转折点表示氯化钡和硫酸镁恰好完全 反应,此时消耗硫酸镁溶液的质量为 100g,而生成沉淀的质量等于反应前两种溶液质量总 和与反应后溶液的质量差,此点也是解答该题的一个重点。
质的质量比不变进行列比例计算,易错点是,由方程式求质量比算数错误,所以这一步要
仔细检查。
7.取氯化钙和盐酸的混合溶液 51.88g,逐滴滴加 10.6%的碳酸钠溶液。所加入碳酸钠溶液
的质量和混合溶液 pH 变化关系如图所示,回答下列问题: (可能用到的相对分子质量:CaCl2﹣111 HCl﹣36.5 Na2CO3﹣106 NaCl﹣58.5 CaCO3﹣100 CO2﹣44 H2O﹣18) (1)BC 段反应的化学方程式为_____。 (2)CD 段溶液 pH>7 的原因是_____。 (3)计算充分反应至 C 点时所得溶液中溶质的质量分数(写出计算过程,计算结果精确至 0.1%)_____。
