巨细胞病毒IgG抗体 ( 抗-CMV·IgG )标准操作程序SOP文件
人类巨细胞病毒IgG
湖南省职业病防治院作业指导书标题:人类巨细胞病毒病毒(IgG)(酶联免疫法)修改记录湖南省职业病防治院作业指导书文件编号:标题:人类巨细胞病毒IgG(酶联免疫法)版号:第 1 版页码1/21、目的用于检测人体血清或血浆人类巨细胞病毒(IgG).2、范围利用酶联免疫间接法原理(ELISA)定性检测人血清中的人类巨细胞病毒IgG 抗体,适用于人类巨细胞病毒病毒感染的辅助诊断。
3、职责检测人员按照本规程进行检测操作。
4、原理采用酶联免疫间接法原理定性检测人血清中的人类巨细胞病毒IgG抗体(HCMV-IgG),以纯化人类巨细胞病毒抗原包被酶联板。
待检血清中的人类巨细胞病毒与包被抗原反应,再与酶标记鼠抗人IgG抗体结合,形成抗原-抗体-酶标抗体复合物。
加底物TMB显色,在酶标仪上比色后根据吸光度(A值)判定有无人类巨细胞病毒IgG抗体的存在。
5、样本要求5.1仅限于检测人体血清或血浆。
5.2常规方法采集。
5.3血清:采血后,室温放置1-2小时,待血液凝固,再于3000转/分钟离心15分钟。
5.4血浆:采血后,样品与抗凝剂反复轻摇混匀,再3000转/分钟离心15分钟。
5.5如果样品没有在8小时内测定,应将其保存于2℃-8℃。
如果样品不能在7天内测定,应将血清或血浆与血细胞分离, -20℃保存,避免反复冻融。
6.分析系统6.1分析仪器:Thermo Mk3型酶标仪,检测波长450nm,参考波长630nm。
6.2 37℃恒温箱。
6.3 振荡器用于样品、试剂的混匀。
6.4 微量加样枪。
6.5 试剂准备:试剂盒于冰箱保存,使用前应取出置37℃。
取试剂盒内洗涤液用蒸馏水作25倍稀释,置洗瓶中备用。
6.6 质控试剂:-20℃保存,溶解后随试剂一起冷藏,每天随样品一起检测并保存质控结果,每月一次质控小结,失控要有记录及纠正的结果。
7、分析步骤7.1 样品编号:从5号开始编号。
7.2设阴、阳性对照各2孔,每孔加入阴性对照(或阳性对照)各100微升。
ELISA法检测巨细胞病毒CMV抗体测定(CMV-IgM)标准操作程序

1.检测原理采用酶联免疫捕获法原理进行检测。
利用抗人IgM单克隆抗体制备包被板,辣根过氧化物酶标记CMV 抗原制备酶结合物。
通过免疫反应形成固相二抗-抗体-抗原-酶复合物,该复合物催化底物显色,显色强度与CMV-IgM抗体含量成正比。
2. 样本类型及处理方法3.试剂注意事项:开启所有试剂(包括校准品、标准品、质控品)需注明日期及签名。
每个试剂容器都需贴上写有以下内容的标签:启用日期、截止日期。
开启时应检查试剂是否变色,是否肉眼可见的细菌生长迹象、浊度、沉淀反应等,这些表示试剂已经变质或超过保质期。
不同批号试剂盒中各组份不可以互换,组份所标示量为最低分装量。
4.仪器设备备注:“溯源方式”栏填写送较、自校、送检、自检、比对等。
5.质量控制5.1使用的质控品5.2质控周期5.2.1每一批次标本均需运行一次质控。
5.2.2每一批标本最大量为:92个标本。
5.3变异系数CV<20%5.4质控判断标准即时质控法5.5失控处理:对质控失控需查找原因并进行分析5.5.1先观察整块酶标板显色是否正常。
5.5.2查找操作过程是否按照SOP文件进行。
5.5.3质控品S/CO值>3SD或质控品S/CO值<3SD,结合模式报告结果。
6.操作步骤6.1选用试剂:郑州安图生物工程股份有限公司6.2平衡:从冷藏环境中取出的试剂盒内全部瓶装试剂及待测标本所需微孔反应条应放置室温平衡30分钟后方可使用,余者应及时放入有干燥剂的自封袋封存于冰箱中备用。
在平衡试剂的同时,待测标本需放置室温平衡30分钟后再行测试。
6.3配液:取1包固体洗液用500ml纯化水溶解后备用。
配制好的洗涤液如用不完可放置2-8℃冷藏储存,使用前应放置室温平衡20分钟后方可使用。
6.4加样:用移液器在反应孔中分别加入阴、阳性对照血清和CMV-IgM质控品各100ul,测定孔中加入样品稀释液100ul,再依次加入待测血清样品10ul,用封口膜封板。
巨细胞病毒IgM抗体测定操作规程

巨细胞病毒IgM抗体测定操作规程血清抗巨细胞病毒IgM抗体测定操作规程1、检测目的规范巨细胞病毒IgM抗体的检测实验,以保证检测结果的准确性和重复性。
2、检测方法)检测IgM抗体。
采用酶联免疫吸附法(ELISA3、检测原理采用捕获法原理检测人血清或血浆样品中人类巨细胞病毒IgM抗体(HCMV-IgM),微孔中预包被鼠抗人-IgM(u链),首先加入待检标本的血清或血浆样品后,样品中的IgM抗体都可被捕获,未结合的其他成份(包括特异的IgG抗体)将被洗涤除去;第二步,加入酶标记物,酶标记物是辣根过氧化物酶(HRP)标记的基因重组抗原HCMVrp52-65。
被捕获的IgM中的HCMV-IgM会与辣根过氧化物标记的HCMV重组抗原特异性的结合,洗去其他未结合物,最后用TMB底物显色。
通过酶标仪检测吸光度(A值)从而判定样品中HCMV-IgM抗体的存在与否。
4、实验条件(1)实验室应具有空调、离心机、加样水浴锅,酶标仪等设备。
(2)检验人员应经过操作前培训。
(3)用酶标仪测定。
5、操作程序(1)样本采集。
无抗凝静脉血2ml,当日不做的标本4?保存,必要时,-20?冻存。
(2)操作步骤。
参照试剂盒说明书进行操作。
一肌步骤如下:?取出已包被HCMV 抗原的微孔反应条板。
稀释待测血清(血清1ul加稀释液200u1),加至微孔中,每孔100ul。
将强阳性、弱阳性、阴性对照各100ul加至相应孔内。
?37?温育30分钟;弃去孔内液,每孔加200--300ul洗涤液,共洗5次。
每次弃去孔内液体后均需在滤纸上拍于(下同)。
?每孔加酶标记抗体100ul,37?,30分钟。
洗板同上。
?加酶底物,色原溶液(OPD,TMB),每孔100ul37?,15分钟。
?加终止液(2mo1,L HSO),24每孔50ul。
于酶标仪上读取吸光度(A)值。
(3)结果判定:?阴性对照平均A值必须小于0 .2;弱阳性对照平均A值在0 .20,0 .65;弱阳性对照与阴性对照平均A值之比必须大于或等于2。
欧蒙抗核抗体谱(IgG)检测标准操作规程完整

抗核抗体谱(IgG)检测标准操作规程1.目的规抗核抗体谱(IgG)检测,保证结果的准确性。
2.适用围检验科免疫组工作人员。
3.试剂规格名称与组成型号名称:ANA 谱 1靶抗原:nRNP/Sm,Sm,SS-A,Ro-52,SS-B,Scl-70,Jo-1,CENP B,dsDNA,核小体,组蛋白,核糖体 P 蛋白类型:IgG基质:抗原包被的检测膜条规格:16×01(16)4.预期用途:用于体外定性检测人血清或血浆中的抗 nRNP、Sm、SS-A(天然 SS-A 和 Ro-52)、SS-B、Scl-70、PM-Scl、Jo-1、CENP B、PCNA、dsDNA、核小体、组蛋白、核糖体P 蛋白和 AMA M2 共 14 种不同抗原 IgG 类抗体。
5.适应症:夏普综合征(MCTD),系统性红斑狼疮(SLE),干燥综合征,进行性系统性硬化症,多肌炎皮肌炎、重叠综合征、局限型进行性系统性硬化症(CREST 综合征),原发性胆汁性肝硬化。
6.临床意义:抗核抗体识别是各种细胞核组分(细胞核的生化成份)[1,2],包含核酸、细胞核蛋白及核糖蛋白。
可特征性地出现于许多疾病中,尤其是风湿性疾病[3,4,5]。
在炎症性风湿性疾病中,这些抗核抗体的阳性率在 20%到 100%之间,以风湿性关节炎的阳性率最低,在 20%至40%之间。
因此,ANA 鉴别诊断在对个别风湿疾病的确认十分必要,而且对自身免疫性疾病的进一步诊断也很有价值。
[3,6,7,8,9,10,11]风湿疾病—夏普综合征(混合结缔组织病=MCTD)[8]—系统性红斑狼疮(SLE)[8, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22]—干燥综合征(原发性干燥综合征)[5],—系统性硬化症(系统性硬皮病,SSc)[1, 23],—局限型系统性硬化症(CREST 综合征) [28]—多肌炎/皮肌炎[12,15]—类风湿性关节炎[5]7.主要组成成分:8.储存条件及有效期: 2-8°C 保存,不要冷冻。
抗核抗体谱(IgG)检测标准操作规程

抗核抗体谱(IgG)检测标准操作规程1.目的规范抗核抗体谱(IgG)检测,保证结果的准确性。
2.适用范围检验科免疫组工作人员。
3.试剂规格名称与组成型号名称:ANA 谱 1靶抗原:nRNP/Sm,Sm,SS-A,Ro-52,SS-B,Scl-70,Jo-1,CENP B,dsDNA,核小体,组蛋白,核糖体 P 蛋白类型:规格:164.、Scl-70、IgG5.6.及核糖蛋性率在风湿疾病—多肌炎/7.8.储存条件及有Array效期:2-8°C 保存,不要冷冻。
未开封前,除非特别说明,试剂盒自生产日起可稳定 18 个月。
稀释后的酶结合物和清洗缓冲液需在一个工作日内用完。
9.样本要求样本:人血清或EDTA、肝素或柠檬酸盐抗凝的血浆。
稳定性:待检患者样本于 2-8°C 可稳定 14 天,稀释后的样本应在同一个工作日内检测。
样本稀释:患者样本用样本缓冲液匀。
10.10.12-8°C-- 稀释如:- 酶结合物:10 倍浓缩。
使用时用干净的吸管从瓶中吸取所需酶结合物,并用样本缓冲液 1:10 稀释。
如需温育一条检测膜条,用 1.35 ml 样本缓冲液稀释 0.15 ml 酶结合物。
已稀释的酶结合物应在同一个工作日用完。
- 样本缓冲液:直接使用。
- 清洗缓冲液:10 倍浓缩。
使用时用干净的吸管从瓶中吸取需要量用蒸馏水 1:10 稀释。
如需温育一条膜条,用 9ml 蒸馏水稀释 1ml 浓缩缓冲液。
稀释后的缓冲液应在同一个工作日用完。
- 底物液:直接使用,对光敏感,使用后应立即盖紧瓶盖。
10.2操作流程预处理:取出所需的膜条,将其放入温育槽内。
膜条上有编号的一面朝上。
在温育槽中分别加入 1.5ml 样本缓冲液,于室温在摇摆摇床上温育 5 分钟后,吸去温育槽中的液体。
血清温育第一次:在温育槽中分别加入 1.5 ml 已稀释的血清样本,在摇摆摇床上室温(18°C-25°C)温育 30 分钟。
巨细胞病毒IGM抗体测体测定操作规程

巨细胞病毒IGM抗体测体测定操作规程用途:通过检测人血清样本中是否含有巨细胞病毒IGM抗体,用于辅助诊断患者近期感染了巨细胞病毒。
基本原理:本试剂盒采用鼠抗人IGM单克隆抗体包被微孔条,辣根过氧化物酶标记基因工程重组表达的巨细胞病毒特异性原原为示踪物,TMB显示系统,EIA捕获一步法检测人血中抗巨细胞IGM抗体。
试剂:巨细胞病毒IGM抗体检测试剂盒仪器:酶标检测仪样本要求:血清标本按常规方法由静脉采集,血浆标本可采用常规用量的肝素或枸橼酸钠抗凝,5天内测定的标本可以放置4℃保存。
标本放置在-20℃至少可以保存3个月。
标本避免溶血或反复冻溶,混浊或有沉淀的标本应离心或过滤澄清后再检测。
需保存的血清在采集、保存过程中应注意无菌操作。
试验方法:1、平衡:将试剂盒从冷藏环境中取出,置室温平衡30分钟后使用。
2、配液:将浓缩洗液用蒸馏水或去离子水20稀释备用。
3、设定:每次试验应预设空白对照1孔(暂不加任何液体),阴性对照3孔,阳对照2孔。
4、加样:按顺序在各反应孔中分别加入20υL待检标本和阴、阳性对照。
5、加酶:依次向每孔加入100υL酶结合物(空白对照不加),振荡混匀。
6、温育:在反应板上加盖封板膜,置37℃温箱或水浴锅中,反应60分钟。
7、洗板:将孔内液体甩干,在各反应孔加入稀释后的洗涤液300υL,静置15秒钟,甩弃洗涤洗涤液:如此洗涤5遍,最后一次扣干反应板。
8、显色:每孔依次加入底物A、B液务50υL(包括空白对照孔),加盖封板膜,振荡混匀,37℃避光显色15分钟。
9、终止:每孔加入终止液50υL(包括空白对照孔),振荡混匀终止反应。
10、测定:用空白对照孔调零,并尽快用酶标仪单波长450 nm测定各孔OD值。
也用双波长450nm/630-690nm测定各孔OD值。
结果解释1、临界值(CUT-OFF值)计算:临界值=0.10+阴性对照OD平均值(阴性对照OD平均值≤0. 05按0. 05计算)。
65-人巨细胞病毒核酸检测标准操作程序

人巨细胞病毒核酸定量核酸检测标准操作规程(荧光PCR法)1.目的规范人巨细胞病毒(HCMV)核酸DNA(荧光PCR法)检测操作流程,准确进行人巨细胞病毒(HCMV)DNA分析。
2.应用范围使用中山大学达安基因股份有限公司人巨细胞病毒(HCMV)核酸检测试剂盒(荧光PCR 法)和PE GeneAmp 5700、ABI Prism 7000、ABI Prism 7700等仪器进行人巨细胞病毒(HCMV)DNA 检测。
3.职责由PCR实验室制定程序文件,专业技术人员负责执行,实验室主管负责监督实施。
4.内容4.1 实验原理和临床应用本品选取人巨细胞病毒珠(即人疱疹病毒5型)-AD169基因组中编码即刻早期转录调节蛋白的IE1基因的一高度保守的非编码区为扩增靶区域,设计特异性引物及荧光探针,扩增片段长度为86bp,利用实时荧光定量PCR技术,定量检测尿液、乳汁、血清或淋巴细胞样本中人巨细胞病毒DNA。
本品用于器官移植、骨髓移植及HIV阳性/AIDS患者尿液、乳汁、血清或淋巴细胞中的人巨细胞病毒(HCMV)感染的检测,用于人巨细胞病毒感染的辅助诊断和疗效监控,不用于血源筛查。
本品检测结果仅供临床参考,不能单独作为确诊或排除病例的依据。
4.2标本采集4.2.1 使用标本类型:尿液、乳汁、血清和淋巴细胞4.2.2 标本采集;由合作单位按照以下要求进行采集。
4.2.2.1 尿或乳汁:取晨尿或成熟乳1ml于1.5ml的无菌离心管中,离心取沉淀即为标本。
标本可立即用于测试,也可保存于-20℃待测,保存期为6个月。
4.2.2.2 血清:用无菌注射器抽取受检者静脉血1ml,注入无菌1.5mlEppendoff管,4℃静置过夜。
吸取上层血清(注意勿带入红细胞)至另一无菌1.5mlEppendoff管中,即为血清标本。
标本可立即用于测试(48小时以内),也可以保存于-20℃待测,保存期为6个月。
4.2.2.3 淋巴细胞:取静脉血(EDTA抗凝)1ml,利用淋巴细胞分离液分离淋巴细胞即为标本。
巨细胞病毒IgG亲和力检测

巨细胞病毒IgG亲和力检测:评估妊娠期感染风险2011-01-23 09:06:18 作者:佚名来源:网络转载当孕期巨细胞病毒IgM和IgG抗体检测结果同时阳性,临床医生无法判断孕妇感染状态时,可以通过IgG抗体亲和力检测,以明确鉴别感染时期,评估胎儿CMV感染风险。
巨细胞病毒(CMV)是一种疱疹病毒,人体感染后,将终身携带CMV病毒。
巨细胞病毒在人群中的感染非常广泛,正常成人的免疫系统能产生保护性抗体,在中国约80%人群为巨细胞病毒血清学阳性。
CMV通常为隐性感染,少数有临床症状。
因此孕妇在孕期感染时,虽然对孕妇本身影响较小,但却会对胎儿产生严重危害。
巨细胞病毒可通过先天性宫内感染、性接触感染以及围产期获得性感染等途径引起胎儿流产、死亡或畸形。
对巨细胞病毒没有免疫力的孕妇,在孕期,尤其是孕早期的12周内,如果感染了巨细胞病毒感染,会严重影响胎儿的发育,因为这段时间是胎儿神经系统发育和器官形成的主要时期。
长久以来,让妇产科医生困惑的是,孕期巨细胞病毒IgM和IgG抗体检测结果同时为阳性时,我们应该怎么做?应该如何评估胎儿感染的风险?在上世纪90年代早期,有一些孕妇,仅仅因为检验结果显示IgM阳性,便终止了妊娠,给孕妇和其家庭造成了伤害。
因此,孕期CMV感染的准确诊断和感染分期是产科医生面临的巨大的挑战之一。
临床医生需要判断该感染是怀孕之前的既往感染的再次复发还是怀孕后出现的原发感染,如果是前者,则胎儿将有充分的母体免疫作为保护,则危害和风险较低。
反之,如果是怀孕时的原发感染,则母体很有可能将病毒传染给胎儿,危害胎儿的正常发育。
在巨细胞病毒感染的血清学模式中可以看到,在出现病毒血症后不久,抗CMV IgM和IgG抗体几乎同时出现,IgM抗体在感染后约4至6个月达到峰值,然后抗体滴度开始下降,并最终转变为阴性。
而IgG抗体水平则逐步升高达免疫水平。
如果多年后再次妊娠,尽管该孕妇对CMV病毒已有保护性,IgG抗体阳性,但也会出现IgM血清学阳性的检测结果。
TORCH-IgG 人类巨细胞 抗体酶免测定(SOP)1

TORCH-IgG 人类巨细胞抗体酶免测定标准操作程序编写者:宿金涛日期:2012年5月26日一. 实验原理: 采用间接法原理检测人血清样品中人类巨细胞病毒IgG抗体(HCMV-IgG),以纯化人类巨细胞病毒抗原包被酶联板。
待检血清中的人类巨细胞病毒抗体与包被抗原反应,再与酶标记鼠抗人IgG 抗体结合,形成抗原-抗体-酶标抗体复合物。
加底物TMB显色,在酶标认仪上比色后根据OD值判定有无人类巨细胞病毒IgG 抗体的存在。
二. 试剂:北京贝尔。
规格为1*48Test。
试剂文号:国食药监械(准)字2010第3400534号三. 仪器:ST-36W洗板机;reader HT2 酶标仪。
四.操作步骤:1、取出试剂盒室温平衡30分钟。
将20×洗涤液用蒸馏水做20倍稀释。
2、加样品:将待检血清做1:10稀释(取100ul标本稀释液加入反应板孔内,再加10ul待检血清)混匀,同时预留阴、阳性及空白对照共5孔。
3、加入阴性对照3孔,阳性对照1孔,各100ul对照血清。
空白对照1孔空置。
将反应板轻轻震荡使样品混匀。
4、温育:用封板膜封板后,置37℃温箱或水浴中反应30分钟。
5、洗板:温育后,将封板膜揭掉,吸干孔内液体,用洗涤液洗板5次,第次浸泡30-60秒钟。
6、加酶标工作液:每孔加入100ul酶标工作液,空白孔除外。
7、温育;用封板膜封板后,置37℃温箱或水浴中反应30分钟。
8、洗板:温育后,将封板腊揭掉,吸干孔内液体,用洗涤液洗板5次,第次浸泡30-60秒钟。
9、显色:每孔加入底物A、B液各50ul,轻轻震荡混匀,用封板膜封板后,置37℃温箱或水浴中反应10分钟。
10、终止:每孔加入终止液50ul,轻轻震荡混匀。
11、测定:设定酶标仪波长于450nm(双波长450 /630nm检测),测定各孔A450值。
注意:在终止反应30分钟内计数。
12、当使用单波长时,校准空白孔,设定酶标仪波长于450nm,测定各孔A450值,当使用双波和450/630nm检测时,可以不设空白孔,直接测定各孔A值。
欧蒙抗核抗体谱IgG检测标准操作规程精编WORD版

欧蒙抗核抗体谱I g G检测标准操作规程精编W O R D版IBM system office room 【A0816H-A0912AAAHH-GX8Q8-GNTHHJ8】抗核抗体谱(IgG)检测标准操作规程1.目的规范抗核抗体谱(IgG)检测,保证结果的准确性。
2.适用范围检验科免疫组工作人员。
3.试剂规格名称与组成型号名称:ANA 谱 1靶抗原:nRNP/Sm,Sm,SS-A,Ro-52,SS-B,Scl-70,Jo-1,CENP B,dsDNA,核小体,组蛋白,核糖体 P 蛋白类型:IgG基质:抗原包被的检测膜条规格:16×01(16)4.预期用途:用于体外定性检测人血清或血浆中的抗 nRNP、Sm、SS-A(天然 SS-A 和 Ro-52)、SS-B、Scl-70、PM-Scl、Jo-1、CENP B、PCNA、dsDNA、核小体、组蛋白、核糖体P 蛋白和 AMA M2 共 14 种不同抗原 IgG 类抗体。
5.适应症:夏普综合征(MCTD),系统性红斑狼疮(SLE),干燥综合征,进行性系统性硬化症,多肌炎皮肌炎、重叠综合征、局限型进行性系统性硬化症(CREST 综合征),原发性胆汁性肝硬化。
6.临床意义:抗核抗体识别是各种细胞核组分(细胞核的生化成份)[1,2],包含核酸、细胞核蛋白及核糖蛋白。
可特征性地出现于许多疾病中,尤其是风湿性疾病[3,4,5]。
在炎症性风湿性疾病中,这些抗核抗体的阳性率在 20%到 100%之间,以风湿性关节炎的阳性率最低,在 20%至40%之间。
因此,ANA 鉴别诊断在对个别风湿疾病的确认十分必要,而且对自身免疫性疾病的进一步诊断也很有价值。
[3,6,7,8,9,10,11]风湿疾病—夏普综合征(混合结缔组织病=MCTD)[8]—系统性红斑狼疮(SLE)[8, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22]—干燥综合征(原发性干燥综合征)[5],—系统性硬化症(系统性硬皮病,SSc)[1, 23],—局限型系统性硬化症(CREST 综合征) [28]—多肌炎/皮肌炎[12,15]—类风湿性关节炎[5]7.主要组成成分:8.储存条件及有效期: 2-8°C保存,不要冷冻。
巨细胞病毒感染诊疗指南与操作规范

巨细胞病毒感染诊疗指南与操作规范【概述】巨细胞病毒感染(cytomegalovirus infection,CMV)是由人巨细胞病毒引起的先天性或后天获得性感染,人群普遍易感。
主要通过母婴及水平传播。
本病基本病理特征为受染的细胞体积增大,胞核和胞浆内出现包涵体。
大多数感染者没有症状或亚临床表现。
但在先天感染、免疫缺陷、器官和骨髓移植患儿中可引起严重感染,甚至危及生命。
【病史要点】1.流行病学资料询问母亲在妊娠期间有无CMV原发感染或再发感染。
有无输血和输血液制品病史。
有无器官和骨髓移植病史。
有无免疫缺陷病史。
2.临床表现1)先天性感染①肝炎表现:有无黄疸,出现时间、程度、进展与否,有无白陶土粪便。
有无鼻衄、皮肤、注射部位出血倾向(警惕肝功能衰竭)。
是否伴食欲减退、腹泻、呕吐等症状。
②肺炎表现:有无咳嗽、呛奶、呼吸困难、气急、青紫、伴或不伴发热(先天感染多伴有严重肺炎)。
抗生素治疗后有无好转。
③神经系统症状:有无小头畸形、智力低下、视力障碍、脑瘫、抽搐及神经性耳聋(主要见于先天感染)。
2)获得性感染①婴儿感染:重点询问黄疸及其程度,有无肝功能异常。
有无咳嗽、气急、青紫(该年龄段可以并发肺炎)。
②儿童期感染:重点询问有无发热、皮疹、伴有黄疸或无黄疸,肝功能有无异常(多数感染CMV后没有症状)。
③免疫缺陷者感染(包括原发性免疫缺陷、艾滋病、器官及骨髓移植):重点询问有无肺炎、肝炎、脑炎、视网膜炎、胃溃疡、糖尿病等多器官受累相应临床表现。
【体检要点】1.体检皮肤巩膜有无黄疸,程度(轻、中、重),有无肝脾肿大,肿大程度、质地、边缘,有无腹部膨隆,腹壁静脉怒张,有无移动性浊音,是否伴有皮肤的出血点、浅表淋巴结肿大、浮肿。
2.体检智力发育及体格发育有无落后,有无小头畸形、视力减退、听力损害等。
3.注意有无气急、紫绀、呼吸困难、肺部啰音。
【辅助检查】1.病毒分离或巨细胞包涵体的检测病毒分离或巨细胞包涵体的检测的传统方法是从血、尿、唾液、脐血等受检标本中培养出病毒,若呈阳性即可确诊。
巨细胞病毒IgGIgM目录

赛润ELISA classic巨细胞病毒IgG/IgM目录1.用途2.诊断意义3.赛润ELISA classic - 检测原理4.试剂盒组成5.检测所需物质,试剂盒未提供6.储存和稳定性7.赛润ELISA classic的检验步骤7.1注意事项7.2检验前的准备工作和储存7.3试剂盒反应试剂的准备7.4检测程序概要7.5检测过程8.检测结果评估8.1 4PL单点定量法8.2检验有效性标准8.3计算赛润ELISA classic巨细胞病毒IgG / IgM(定量)8.4检测结果分析9. 性能特性9.1重复性9.2 敏感性和特异性10.警告10.1警告和安全措施10.2废料处理11.参考文献V10.03/07-1赛润ELISA classic巨细胞病毒IgG/IgM试剂盒酶联免疫法测定人体抗体(IgG/IgM)- 只限用于体外诊断-IgG 试剂盒 (定量) 编号: ESR109GlgM 试剂盒 (定性)编号: ESR109M检测评估标准: Dade Behring BEP ® III / BEP ® 2000, DSX, 手动操1.用途:赛润ELISA classic巨细胞病毒IgG/IgM试剂盒主要用于人血清、脑脊液或血浆中抗巨细胞病毒抗体的定性和/或定量测定,IgM-ELISA试剂用于确定急性感染,而IgG-ELISA试剂则用于近期感染和血清学状态的诊断。
2.诊断意义巨细胞病毒(CMV)是一种DNA病毒,它是人病原体-疱疹病毒属的一种。
巨细胞病毒的主要感染途径是与被感染病人或有过接触,包括接触被感染病人的唾液、生殖器分泌物、尿液和乳汁,同时也可通过胎盘传播或发生医源性传染(输血,移植手术)。
初期感染后就会相继发生终生的潜在性感染。
巨细胞病毒寄生淋巴细胞中,可以在特定的环境下被激活。
巨细胞病毒在发达和不发达国家的感染率在45-50%之间,个别国家和地区感染率超过90%。
血清转化有两个高峰期:在感染后第2-3年间以及年龄在15-30岁之间。
医院检验科检验项目临床意义SOP

血清1ml
20.00
阳性提示单纯疱疹病毒既往感染。
250403021
风疹病毒抗体IgM定性测定(RV-IgM)
血清1ml
20.00
阳性提示风疹病毒急性感染。
250403021
风疹病毒抗体IgG定性测定(RV-IgG)
血清1ml
20.00
阳性提示风疹病毒既往感染。
250310030
血清睾酮测定(TTE)
血清1ml
25.00
增高:睾丸细胞间质瘤、柯兴氏综合征、多囊卵巢综合征、先天性肾上腺皮质增生症、女性多毛症。
降低:隐睾病、先天性睾丸发育不全综合征、睾丸炎、垂体功能减退、性发育不全、甲减、皮质醇增多症、骨质疏松症、系统性红斑狼疮。
250310037
血清孕酮测定(PGN)
血清1ml
10.00
与AFP联合应用可提高原发性肝癌的诊断率。
250404005
总前列腺特异性抗原测定(T-PSA)
血清1ml
40.00
前列腺癌的特异性标记物,前列腺肥大、前列腺炎或前列腺按摩后也可轻度升高。
250404006
游离前列腺特异性抗原测定(F-PSA)
血清1ml
40.00
前列腺癌的辅助标记物,可用于前列腺癌的鉴别诊断。
3.0
阳性提示病毒复制减少,传染性弱。
250403009
乙型肝炎核心抗体测定(HBcAg)
血清1ml
3.0
HBV既往感染的指标。
250403010
乙型肝炎核心IgM抗原测定(Anti-HBc IgM)
血清1ml
3.0
HBV近期感染,在体内持续复制的指标,阳性提示病人血液有传染性。
巨细胞病毒IgG抗体 ( 抗-CMV·IgG )标准操作程序SOP文件

标本为无溶血血清。
[操作步骤]
1,样本稀释:先将样本稀释液按10倍稀释成工作液(根据需要稀释),用此工作液稀释样本,血清1:100稀释。
2,加样:取包被板,每孔加洗涤液一滴于孔中,拍干。加入已稀释血清样本100ul/孔。同时设阴阳对照各一孔,并设空白对照一孔,37 C30分钟,甩去,加洗涤液一滴,蒸馏水洗涤5次,拍干。
[结果判定]
1、目测法:在白色背景下观察各孔颜色,明显兰色为阳性,无色或极淡兰色为阴性。
2、酶标仪检测(选择波长450nm):每孔加终止液一滴,用空白孔校零,测定各孔OD值。
临界值(C.O.)=2.1×阴性对照OD值
(1)样本OD值S/C.O.≥1.0判为阳性;
(2)样本OD值S/C.O.<0.9判为阴性。
[原理]
本试剂盒采用间接法法检测人血清或血浆中的抗-CMV·IgG。具有简便、快速等优点。
[试剂厂家]
深圳市绿瀚生物技术有限公司
[试剂盒组成]
1、包被板条6、显色液
2、样本稀释液7,终止液
3,洗涤液8、阴阳对照血清
4、酶结合物
5、底物
[试剂的稳定性与贮存]
试剂自生产日起避光贮存于2-8℃,有效期内稳定。
[临床意义]
人群中CMV感染极为普遍,多呈亚临床不显性感染和潜伏感染。初次感染大多在2岁以下,病毒可潜伏于体内成为长期或终身带病毒。通过口腔,胎盘,生殖道,输血,器官移植等多途径传播。可引起先天性畸形,单核细胞增多症,肝炎等。
[注意事项]
1、不同批号的试剂不可混用。
2、试剂盒用前先平衡至室温。含血球的标本易出现假阳性,应避免使用。
3、未用完的板条应及时封存于易封袋中。
免疫球蛋白G(IgG)测定标准操作程序SOP文件

定标频率:A试剂批号更换
B由质控结果决定
ABCD医院
生化实验室
文件编号:
ABCD-SOP-04-44
免疫球蛋白G(IgG)测定
版序:ABCD
页码:第2页,共3页
4.3质控物
来源:Precinorm protein (罗氏蛋白正常值质控)
Precipath protein (罗氏蛋白病理值质控)
4.2校准物
来源:ROCHE配套校准物,符合WHO标准,CRM470,具体如下:
S1:0.9%的NaCl
S2-6:Preciset Serum protein
批特异的定标液的靶值乘以下列的转换因子,用来计算定标曲线。
S2:0.10
S3:0.25
S4:0.50
S5:1.00
S6:2.00
贮存条件:校准物在2-8℃保存可保存至有效期。
3标本
血清及肝素-Li、Na-肝素或EDTA抗凝血浆,处理方法见标本处理程序。
稳定性:20-25℃3个月
4-8℃3个月
-20℃6个月
4试剂
4.1试剂
来源:ROCHE配套试剂(详见试剂说明书)。
贮存条件及稳定性:未打开试剂盒:2-8℃储存至效期末
R1:打开后机上稳定90天
R2:打开后机上稳定90天
准备:直接使用。
IgG是再次免疫应答的主要抗体,具有吞噬调理作用、中和毒素作用、中和病毒作用及激活补体经典途径。IgG是唯一可以通过胎盘的免疫球蛋白,并且对胎儿及新生儿有保护作用。婴儿在6个月左右建立免疫系统,在18个月左右达到成人水平。
多克隆IgG水平的升高见于系统性红斑狼疮、慢性肝炎及传染性疾病中。单克隆IgG水平的升高见于骨髓瘤。
免疫细胞储存SOP
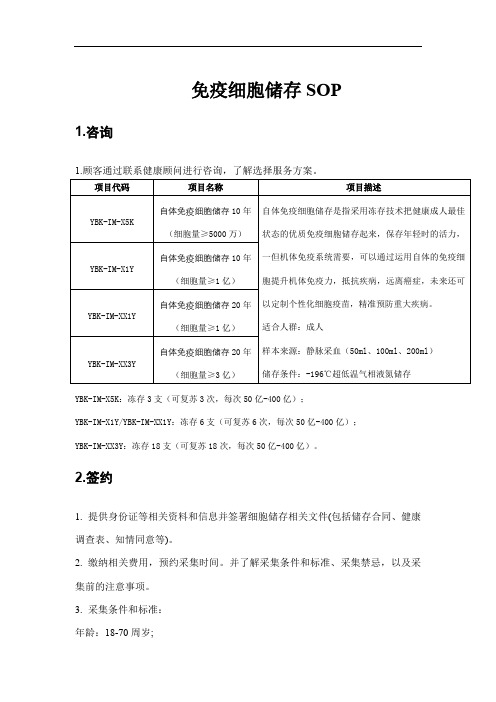
免疫细胞储存SOP1.咨询1.顾客通过联系健康顾问进行咨询,了解选择服务方案。
YBK-IM-X5K:冻存3支(可复苏3次,每次50亿-400亿);YBK-IM-X1Y/YBK-IM-XX1Y:冻存6支(可复苏6次,每次50亿-400亿);YBK-IM-XX3Y:冻存18支(可复苏18次,每次50亿-400亿)。
2.签约1.提供身份证等相关资料和信息并签署细胞储存相关文件(包括储存合同、健康调查表、知情同意等)。
2.缴纳相关费用,预约采集时间。
并了解采集条件和标准、采集禁忌,以及采集前的注意事项。
3.采集条件和标准:年龄:18-70周岁;体重:男≥50kg,女≥45kg;体温:正常;血压:90mmHg-140mmHg/60mmHg-90mmHg;脉压差不低于30mmHg;脉搏:节律规整,60-100次/分钟,高耐力的运动员不低于50次/分钟;血象正常:白细胞≥4*10^9个/L,淋巴细胞≥0.8*10^9个/ L;一周内没有感冒和急性胃肠炎,没有服药,24小时内没有饮酒;与上次采集时间相隔3个月以上;采血前做血常规、传染病学检测(乙肝、丙肝、梅毒、艾滋等)。
4.提供正规体检机构或二级以上医院相应体检报告,体检内容如下:5.采集禁忌1)凝血功能严重异常;2)近期有明显的活动性出血病史;3)重大脏器功能不全的供者;4)患有各种传染性疾病:如艾滋与梅毒患者;5)T细胞淋巴瘤患者;6)败血症及其他未有效控制的感染;7)女性在月经期和前后三天不宜采集;8)小手术后未满半个月,一般手术后未满三个月,较大手术后未满半年者不宜采集等。
6.采集前注意事项1)采集前一天晚餐不要进食过饱,少吃肉、鱼、蛋、牛奶、豆制品以及油腻食物,不要大量饮水,以免稀释血液,影响采集质量;2)采集前一晚要保持良好的睡眠,充足的休息;3)采集前不要空腹,可提前吃一些清淡饮食,如稀饭、馒头、面包等,可适当补充水分。
4)采集前一周内不宜服用任何药物。
临床基因扩增PCR实验室SOP标准操作程序文件(32项)

临床基因扩增实验室标准操作程序编写人:审核人:批准人:启用日期:年月日XXX医院前言为使基因扩增检验技术有效地应用于临床,更好地为疾病的预防、诊断和治疗服务,保证检验质量,严格按照《临床基因扩增检验实验室管理暂行办法》(卫医发[2002]10号文)附件《临床基因扩增检验实验室基本设置标准》要求,制定本实验室管理文件,本实验室任何实验均需遵循本管理文件中规定执行。
临床基因扩增检验技术指以临床诊断治疗为目的,以扩增检测DNA或RNA 为方法的检测技术,快速、可靠、准确、安全、收费合理方式下,以规范的操作对临床标本进行分析。
本室采用经国家药品监督管理局批准的试剂盒。
开展的检测项目:1、乙型肝炎病毒(HBV)核酸定量检测2、人巨细胞病毒(HCMV)核酸定量检测标准操作程序文件1.目的:为了分子实验室的规范管理,特制订本程序。
2.范围:分子实验室。
3.职责:3.1临床PCR检验实验室工作人员共同遵守、相互督促。
3.2因科研活动需要,进入实验区域(试剂准备区、样本准备区、PCR扩增区)的非本室人员需首先熟悉本程序的各项规定并严格遵守执行。
4.实验室设置:4.1实验室设计为:专用走廊、试剂准备区、样本制备区、PCR扩增区组成。
三个区域各有一个缓冲间。
(见设置图)4.2三个工作区各配备专用的设备、仪器、辅助设施、耗材、清洁用品、办公用品、专用工作服,并有明显的区分标识。
试剂准备区—白色、样品处理区—兰色、基因扩增区—红色。
4.3工作区的配置、功能、内务管理制度见各工作区文件。
4.4 实验室须严格遵守试剂区→样本区→扩增区的流向制度,严禁误入和逆进入各工作区。
4.5实验室流程:1)PCR室工作人员上班后,由过道走廊→试剂区→样本区→扩增区流向,打开排风、光源、温控装置。
2)标本接收区接收标本、验收登记后离心(不开盖),由内走廊入口将标本送入标本制备区缓冲间(标本制备区内门关闭)。
3)PCR工作人员按从试剂区→样本区→扩增区更衣开始流水操作。
免疫球蛋白(IgG)定量测定试剂盒标准操作程序

免疫球蛋白(IgG)测定标准操作程序1.摘要本试剂盒适用于体外临床检验,用于测定人血清中免疫球蛋白IgG的含量。
IgG的主要功能是与抗原结合,并进一步触发抗原的分解。
2.适用范围程序适用于日立7600自动生化分析仪检测血清、血浆中IgG的浓度。
3.职责使用日立7600自动生化分析仪进行测定IgG浓度的工作人员要严格按照本SOP程序进行,室负责人监督管理;本SOP的改动,可由任一使用本SOP的工作人员提出,并报经生化室负责人、科主任签字批准生效。
4.检测方法上海科华生物工程股份有限公司生产的免疫球蛋白(IgG)试剂盒采用的是免疫透射比浊法。
5.原理样本中的IgG与试剂中相应的抗体相遇,立即形成抗原抗体免疫复合物,在特定的缓冲环境中形成浊度,其浊度在合适的抗体浓度存在时与抗原含量成正比,与相同条件下操作的校准品比较,即可求出样品中IgG的含量。
6.仪器日立7600自动生化分析仪7.试剂7.1试剂来源:上海科华生物工程股份有限公司提供7.2试剂瓶内主要成分:磷酸缓冲液(PH7.2)、Tween20、PEG、NaN3、羊抗人IgG抗体。
7.3试剂稳定性:试剂避光保存于2-8℃,若无污染,可稳定至失效期,本试剂有效期为12个月。
试剂不可冰冻。
R1、R2:打开后冷藏于分析仪中可稳定28天。
7.4试剂准备:试剂为即用式。
8.标准品和质量控制8.1校准程序:使用上海科华生物工程股份有限公司试剂盒内提供的标准品对自动分析仪进行校准。
由a、b、c、d、e五只组成,浓度见瓶签。
校准品可溯源至国际参考物质ERM470。
8.2质控品使用某某公司提供的生化复合定值质控血清做为室内质控品。
每日在测定前做一次质控。
该质控品为干粉包装,在2-8℃冰箱可稳定到失效期,使用前用5ml去离子水复溶,待质控物充分溶解(大约30分钟)后使用。
8.3质控数据管理:按程序对检验后的质控结果进行转换,对质控数据进行分析处理,如出现失控值,应及时分析失控原因,并填写好相关失控记录。
抗体效价测定操作规程

抗体效价测定操作规程 Hessen was revised in January 2021抗体效价测定操作规程操作步骤:一.IgG类1.IgG类抗体效价滴定,须取适量血清200μL加等体积2—Me溶液混合,封口,置37℃水浴箱作用60分钟,先稀释血清:200L病人血清600L生理盐水备用,排列6支试管按顺序编号。
第二管开始到第六管加样枪各加生理盐水200L,在第一管和第二管中各加入稀释血清200L,第二管混匀后移出200L转至第三管,以同样操作第六管,从第六管吸出200L暂时保留在另一试管中(可做为第七管),以备必要时作进一步稀释。
这样从第一管到第六管的血清稀释度依次是1:8,1:16,1:32,1:64,1:128,1:256。
2.加红细胞悬液(自配红细胞悬液同反定型试剂)每管各加2%相应红细胞悬液200L,混匀。
(如待检血清抗体为抗A,则加入A型标准红细胞悬液;如待检血清抗体为抗B,则加入B型标准红细胞悬液;如待检血清中既有抗A又有抗B,则倍量稀释两份血清,一份加入A型标准红细胞悬液,另一份加入B型标准红细胞悬液;)3.先直接观察离心结果,之后在每管分别加入凝聚胺试剂盒中的R1液3d,混合30S均匀后,在各加R2液2滴,操作方法同凝聚胺交叉配血法,然后判读结果。
通常以肉眼观察到的第一个“±”的凝集管作为判断的终点,终点血清稀释度的倒数为效价(Titer),或称滴度。
二.IgM1.血清连续倍量稀释法先稀释血清:100L病人血清+700L生理盐水备用,排列6支试管按顺序编号。
第二管开始到第六管加样枪各加生理盐水200L,第一管和第二管中各加入稀释血清200L,第二管混匀后移出200L转至第三管,以同样操作第六管,从第六管吸出200L暂时保留在另一试管中(可做为第七管),以备必要时作进一步稀释。
这样从第一管到第六管的血清稀释度依次是1:8,1:16,1:32,1:64,1:128,1:256。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
本试剂盒采用间接法法检测人血清或血浆中的抗-CMV·IgG。具有简便、快速等优点。
[试剂厂家]
深圳市绿瀚生物技术有限公司
[试剂盒组成]
1、包被板条6、显色液
2、样本稀释液7,终止液
3,洗涤液8、阴阳对照血清
4、酶结合物
5、底物
[试剂的稳定性与贮存]
试剂自生产日起避光贮存于2-8℃,有效期内稳定。
[结果判定]
1、目测法:在白色背景下观察各孔颜色,明显兰色为阳性,无色或极淡兰色为阴性。
2、酶标仪检测(选择波长450nm):每孔加终止液一滴,用空白孔校零,测定各孔OD值。
临界值(C.O.)=2.1×阴性对照OD值
(1)样本OD值S/C.O.≥1.0判为阳性;
(2)样本OD值S/C.O.<0.9判为阴性。
[标本的收集与处理]
标本为无溶血血清。
[操作步骤]
1,样本稀释:先将样本稀释液按10倍稀释成工作液(根据需要稀释),用此工作液稀释样本,血清1:100稀释。
2,加样:取包被板,每孔加洗涤液一滴于孔中,拍干。加入已稀释血清样本100ul/孔。同时设阴阳对照各一孔,并设空白对照一孔,37 C30分钟,甩去,加洗涤液一滴,蒸馏水洗涤5次,拍干。
3、未用完的板条应及时封存于易封袋中。
4、滴加试剂前,应将滴瓶翻转数次混匀。滴加时瓶身应保持垂直。
5、试剂盒置于2-8℃贮存,有效期6个月
6、本试剂应视为有传染性物质,请按传染病实验室规程操作。
3,反应:加酶结合物二滴,37 C30分钟。甩去,每孔加洗涤液一滴,蒸馏水洗涤5次,拍干。
4,显色:每孔加底物和显色液各一滴,37 C5分钟。以阳性对照出现明显蓝色为准。
ABCD医院
免疫实验室
文件编号:
ABCD-SOP-01-35
巨细胞病毒IgG抗码:第2页,共2页
ABCD医院
免疫实验室
文件编号:
ABCD-SOP-01-35
巨细胞病毒IgG抗体(抗-CMV·IgG )
版序:ABCD
页码:第1页,共2页
[前言]
巨细胞病毒(CMV)亦称巨细胞涵体病毒。由于感染的细胞肿大并具有巨大的核内包涵体而命名。CMV在人群中感染广泛,是最常见的先天性感染病毒,其通过胎盘侵袭胎儿,引起宫内感染,临床表现为肝脾肿大、血小板减少、溶血性贫血,甚至引起畸形或死胎。由于CMV引起的先天畸形常在生后几个月-几年中表现症状,主要为智力低下。因此,检测CMV对优生优育学有重要意义。检测抗-CMV·IgG用于流行病调查。
(3)样本OD值S/C.O.介于0.9与1.0之间,判为可疑,需重复检测。
注:(1)当阳性对照/阴性对照OD值≥5时,试验结果有效;
(2)阴性对照OD值小于0.05时,按0.05计算;大于0.05时,按实际值计算。
[质量控制]
为确保测试结果准确可靠,每批测试均应放置阴阳性质控血清与被检样品同时测试,用以检查试剂性能。
[临床意义]
人群中CMV感染极为普遍,多呈亚临床不显性感染和潜伏感染。初次感染大多在2岁以下,病毒可潜伏于体内成为长期或终身带病毒。通过口腔,胎盘,生殖道,输血,器官移植等多途径传播。可引起先天性畸形,单核细胞增多症,肝炎等。
[注意事项]
1、不同批号的试剂不可混用。
2、试剂盒用前先平衡至室温。含血球的标本易出现假阳性,应避免使用。
