【人教版教材】电解池PPT1
合集下载
人教化学选修4第四章第三节电解池第一课时(共15张PPT)
B
H 2HS2OSA4O溶4液溶液
C
CCuCul CDF2l2溶溶液液
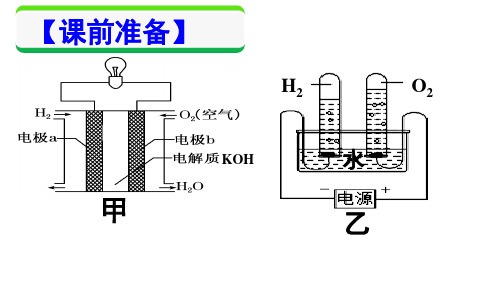
用石墨电极电解CuCl2、NaCl水溶液:
电解质溶液
电极反应及总反应式
电解类型
CuCl2
阴极:Cu2++2e-=Cu
( Cu2+、Cl- 、 H+、OH- )
阳 总极式::C2uCCl-l2-电2=解e-C= uC+l2C↑ l2↑
将实验2中的两个电极反接,即附有铜的电极接
到电源的正极作为阳极,继续电解CuCl2溶液。
有Cu析出
Cu
惰性电极 :本身不反应
电 极
石墨、Pt、Au
材 料 活性电极
做阴极,本身不反应。 做阳极,优先失电子
除Pt、Au外 被氧化而溶解
的金属电极
zzz3zz、zzzz放电顺序
①阳极:
活性电极> S2-> I-> Br-> Cl-> OH-
【探究实验】探究以石墨(碳棒)为电
极进行电解时,电解质溶液在导电的过
程中发生了哪些变化。
1、电解
2、电解
NaCl 溶液
(滴加
6V CuCl2
6V
溶液
有酚酞)
【其它实验用品】KI-淀粉试纸、蒸馏水、镊子。
粒子 移向
电极 反应
电子:负极 外电路 阴极, 阳极 外电路 正极 电流:正极 → 阳极, 阴极 → 负极 阴离子 → 阳极 阳离子 → 阴极
阴极:阳离子得电子——还原反应
阳极:阴离子失电子——氧化反应 总反应:阴、阳两极反应式相加
zz2zz、zzzzz电解原理
⑴电解:使电Байду номын сангаас通过电解质
溶液而在阴、阳两极引起 氧化还原反应的过程。
H 2HS2OSA4O溶4液溶液
C
CCuCul CDF2l2溶溶液液
用石墨电极电解CuCl2、NaCl水溶液:
电解质溶液
电极反应及总反应式
电解类型
CuCl2
阴极:Cu2++2e-=Cu
( Cu2+、Cl- 、 H+、OH- )
阳 总极式::C2uCCl-l2-电2=解e-C= uC+l2C↑ l2↑
将实验2中的两个电极反接,即附有铜的电极接
到电源的正极作为阳极,继续电解CuCl2溶液。
有Cu析出
Cu
惰性电极 :本身不反应
电 极
石墨、Pt、Au
材 料 活性电极
做阴极,本身不反应。 做阳极,优先失电子
除Pt、Au外 被氧化而溶解
的金属电极
zzz3zz、zzzz放电顺序
①阳极:
活性电极> S2-> I-> Br-> Cl-> OH-
【探究实验】探究以石墨(碳棒)为电
极进行电解时,电解质溶液在导电的过
程中发生了哪些变化。
1、电解
2、电解
NaCl 溶液
(滴加
6V CuCl2
6V
溶液
有酚酞)
【其它实验用品】KI-淀粉试纸、蒸馏水、镊子。
粒子 移向
电极 反应
电子:负极 外电路 阴极, 阳极 外电路 正极 电流:正极 → 阳极, 阴极 → 负极 阴离子 → 阳极 阳离子 → 阴极
阴极:阳离子得电子——还原反应
阳极:阴离子失电子——氧化反应 总反应:阴、阳两极反应式相加
zz2zz、zzzzz电解原理
⑴电解:使电Байду номын сангаас通过电解质
溶液而在阴、阳两极引起 氧化还原反应的过程。
人教版化学《电解池》课件1

阴极:碳棒上有一层红色物质析出
湖 南 省 长 郡 中学20 19-202 0学年高 二上学 期化学 选修四 《第四 章第三 节电解 池》( 共62张 PPT)
湖 南 省 长 郡 中学20 19-202 0学年高 二上学 期化学 选修四 《第四 章第三 节电解 池》( 共62张 PPT)
②实验事实
阴极
湖 南 省 长 郡 中学20 19-202 0学年高 二上学 期化学 选修四 《第四 章第三 节电解 池》( 共62张 PPT) 湖 南 省 长 郡 中学20 19-202 0学年高 二上学 期化学 选修四 《第四 章第三 节电解 池》( 共62张 PPT)
湖 南 省 长 郡 中学20 19-202 0学年高 二上学 期化学 选修四 《第四 章第三 节电解 池》( 共62张 PPT)
A
阴极
阳极
氯 气
阳极:有气泡,刺激性气味,并能使湿润的 KI—淀粉 试纸变蓝
阴极:碳棒上有一层红色物质析出
湖 南 省 长 郡 中学20 19-202 0学年高 二上学 期化学 选修四 《第四 章第三 节电解 池》( 共62张 PPT)
②实验事实
阴极
A
铜
阳极
氯 气
阳极:有气泡,刺激性气味,并能使湿润的 KI—淀粉 试纸变蓝
②实验事实
A
阳极
湖 南 省 长 郡 中学20 19-202 0学年高 二上学 期化学 选修四 《第四 章第三 节电解 池》( 共62张 PPT)
湖 南 省 长 郡 中学20 19-202 0学年高 二上学 期化学 选修四 《第四 章第三 节电解 池》( 共62张 PPT)
②实验事实
阴极
A
阳极
湖 南 省 长 郡 中学20 19-202 0学年高 二上学 期化学 选修四 《第四 章第三 节电解 池》( 共62张 PPT)
湖 南 省 长 郡 中学20 19-202 0学年高 二上学 期化学 选修四 《第四 章第三 节电解 池》( 共62张 PPT)
湖 南 省 长 郡 中学20 19-202 0学年高 二上学 期化学 选修四 《第四 章第三 节电解 池》( 共62张 PPT)
②实验事实
阴极
湖 南 省 长 郡 中学20 19-202 0学年高 二上学 期化学 选修四 《第四 章第三 节电解 池》( 共62张 PPT) 湖 南 省 长 郡 中学20 19-202 0学年高 二上学 期化学 选修四 《第四 章第三 节电解 池》( 共62张 PPT)
湖 南 省 长 郡 中学20 19-202 0学年高 二上学 期化学 选修四 《第四 章第三 节电解 池》( 共62张 PPT)
A
阴极
阳极
氯 气
阳极:有气泡,刺激性气味,并能使湿润的 KI—淀粉 试纸变蓝
阴极:碳棒上有一层红色物质析出
湖 南 省 长 郡 中学20 19-202 0学年高 二上学 期化学 选修四 《第四 章第三 节电解 池》( 共62张 PPT)
②实验事实
阴极
A
铜
阳极
氯 气
阳极:有气泡,刺激性气味,并能使湿润的 KI—淀粉 试纸变蓝
②实验事实
A
阳极
湖 南 省 长 郡 中学20 19-202 0学年高 二上学 期化学 选修四 《第四 章第三 节电解 池》( 共62张 PPT)
湖 南 省 长 郡 中学20 19-202 0学年高 二上学 期化学 选修四 《第四 章第三 节电解 池》( 共62张 PPT)
②实验事实
阴极
A
阳极
湖 南 省 长 郡 中学20 19-202 0学年高 二上学 期化学 选修四 《第四 章第三 节电解 池》( 共62张 PPT)
人教版化学选修四电解池PPT(22页)

C、若在阴极附近的溶液中滴入酚酞试液,溶液呈无色 D、电解一段时间后,将全部电解液转移到烧杯中,充
分搅拌后溶液呈中性
2.pH=a的某电解质溶液中,插入两支惰性电极通直 流电一段时间后,溶液的pH>a,则该电解质可能是
A
A、NaOH B、H2SO4 C、AgNO3 D、Na2SO4
3.下图中能验证氯化钠溶液(含酚酞)电解
活性电极>S 2->I ->Br ->Cl ->OH ->含氧酸根
人教版化学选修四电解池PPT(22页)
人教版化学选修四电解池PPT(22页)
1、电解含氧酸(如:H2SO4﹑HNO3﹑H3PO4等) 活泼金属含氧酸盐(如:Na2SO4﹑KNO3等) ﹑强 碱(如:NaOH﹑KOH﹑Ca(OH)2﹑Ba(OH)2等) 实 质上是电解水.阳极产生O2,阴极产生H2
连接电源的负极, 作为阴极
阴离子向负极迁移, 阳离子向正极迁移
阴离子向阳极迁移, 阳离子向阴极迁移
负极→正极
负极→阴极,
阳极→正极
两个电极、电解质溶液形成闭合回路。
电解池有外电源,原电池无需外电源。
下列装置中属于原电池的是 ( B ) 属于电解池的是 ( CD )
稀硫酸 A
稀硫酸 B
稀硫酸 C
硫酸 D
D.反应中有0.01mol的Ag被氧化
比较项目 能量转换 能否自发 两 氧化反应 个 失去电子 电 还原反应 极 获得电子 电池内离子 的迁移方向
电子流向
构成条件
原电池与电解池
原电池
电解池
化学能转化为电能
电能转化为化学能 作为负极
相对不活泼的金属 或石墨作为正极
连接电源的正极, 作为阳极
分搅拌后溶液呈中性
2.pH=a的某电解质溶液中,插入两支惰性电极通直 流电一段时间后,溶液的pH>a,则该电解质可能是
A
A、NaOH B、H2SO4 C、AgNO3 D、Na2SO4
3.下图中能验证氯化钠溶液(含酚酞)电解
活性电极>S 2->I ->Br ->Cl ->OH ->含氧酸根
人教版化学选修四电解池PPT(22页)
人教版化学选修四电解池PPT(22页)
1、电解含氧酸(如:H2SO4﹑HNO3﹑H3PO4等) 活泼金属含氧酸盐(如:Na2SO4﹑KNO3等) ﹑强 碱(如:NaOH﹑KOH﹑Ca(OH)2﹑Ba(OH)2等) 实 质上是电解水.阳极产生O2,阴极产生H2
连接电源的负极, 作为阴极
阴离子向负极迁移, 阳离子向正极迁移
阴离子向阳极迁移, 阳离子向阴极迁移
负极→正极
负极→阴极,
阳极→正极
两个电极、电解质溶液形成闭合回路。
电解池有外电源,原电池无需外电源。
下列装置中属于原电池的是 ( B ) 属于电解池的是 ( CD )
稀硫酸 A
稀硫酸 B
稀硫酸 C
硫酸 D
D.反应中有0.01mol的Ag被氧化
比较项目 能量转换 能否自发 两 氧化反应 个 失去电子 电 还原反应 极 获得电子 电池内离子 的迁移方向
电子流向
构成条件
原电池与电解池
原电池
电解池
化学能转化为电能
电能转化为化学能 作为负极
相对不活泼的金属 或石墨作为正极
连接电源的正极, 作为阳极
人教化学教材《电解池》PPT(完整版)

阴极:电解质阳 离子放电 阳极:H2O放O2 生酸
NaCl CuSO4
电解 对象
电解 质和 水
电解 质和 水
电解 质浓
度
生成 新电 解质
生成 新电 解质
电解质 pH 溶液复
原
增 通氯化 大氢
减 加氧化 小铜
【名校课堂】获奖PPT-人教化学教材 《电解 池》PPT (完整 版)推 荐(最 新版本 )推荐
【名校课堂】获奖PPT-人教化学教材 《电解 池》PPT (完整 版)推 荐(最 新版本 )推荐
【名校课堂】获奖PPT-人教化学教材 《电解 池》PPT (完整 版)推 荐(最 新版本 )推荐
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变 红的电极为__A___极(填“A”或“B”),并写出此电极的 反应式4:O_H-_-4e_-=_O2_↑+_2H_2O___。 (4)乙池中总反应的离子方程式: _4A_g+_+2_H2_O___4A_g↓_+O_2↑_+_4H_+ __。
【名校课堂】获奖PPT-人教化学教材 《电解 池》PPT (完整 版)推 荐(最 新版本 )推荐
【名校课堂】获奖PPT-人教化学教材 《电解 池》PPT (完整 版)推 荐(最 新版本 )推荐
3、纳米级Cu2O由于具有优良的催化性能而受到关注。 采用离子交换膜控制电解液中OH-的浓度制备纳米级 Cu2O的装置如图所示,发生的反应为: 2Cu+H2O 电解 Cu2O+H2↑。下列说法正确的是( D) A.钛电极发生氧化反应 B.阳极附近溶液的pH逐渐增大 C.离子交换膜应采用阳离子离子 交换膜 D.阳极反应式是: 2Cu+2OH--2e-= Cu2O+H2O
NaCl CuSO4
电解 对象
电解 质和 水
电解 质和 水
电解 质浓
度
生成 新电 解质
生成 新电 解质
电解质 pH 溶液复
原
增 通氯化 大氢
减 加氧化 小铜
【名校课堂】获奖PPT-人教化学教材 《电解 池》PPT (完整 版)推 荐(最 新版本 )推荐
【名校课堂】获奖PPT-人教化学教材 《电解 池》PPT (完整 版)推 荐(最 新版本 )推荐
【名校课堂】获奖PPT-人教化学教材 《电解 池》PPT (完整 版)推 荐(最 新版本 )推荐
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变 红的电极为__A___极(填“A”或“B”),并写出此电极的 反应式4:O_H-_-4e_-=_O2_↑+_2H_2O___。 (4)乙池中总反应的离子方程式: _4A_g+_+2_H2_O___4A_g↓_+O_2↑_+_4H_+ __。
【名校课堂】获奖PPT-人教化学教材 《电解 池》PPT (完整 版)推 荐(最 新版本 )推荐
【名校课堂】获奖PPT-人教化学教材 《电解 池》PPT (完整 版)推 荐(最 新版本 )推荐
3、纳米级Cu2O由于具有优良的催化性能而受到关注。 采用离子交换膜控制电解液中OH-的浓度制备纳米级 Cu2O的装置如图所示,发生的反应为: 2Cu+H2O 电解 Cu2O+H2↑。下列说法正确的是( D) A.钛电极发生氧化反应 B.阳极附近溶液的pH逐渐增大 C.离子交换膜应采用阳离子离子 交换膜 D.阳极反应式是: 2Cu+2OH--2e-= Cu2O+H2O
人教版新教材《电解池》优秀课件1

↓ 在阳极表面失去电子
Cl Cl
Cu
Cl CuClຫໍສະໝຸດ ↓ 电子沿阳极回到电源正极
人教版新教材《电解池》优秀课件1
人教版新教材《电解池》优秀课件1
电离与电解的比较
电离
电解
条件
电解质溶于水或受热融 化状态
电解质电离后再通直流电
电解质电离成为自由移 阴阳离子定向移动,在两
过程
动的离子 CuCl2=Cu2++2Cl-
2. 阳离子得电子顺序(阴极放电顺序):
Ag+ > Hg2+ > Fe3+ > Cu2+ > H+(酸) > Fe2+ > H+ (水) > Al3+ > Mg2+ > Na+ > Ca2+ > K+
人教版新教材《电解池》优秀课件1
人教版新教材《电解池》优秀课件1
用惰性电极电解下列物质的溶液, 填表并写出电极反应
总反应: 电解
2Al2O3(熔融)==4Al+3O2↑ 冰晶石
人教版新教材《电解池》优秀课件1
人教版新教材《电解池》优秀课件1
二、电解原理的应用——4.电冶金
法国皇帝拿破仑三世 是一个喜欢炫耀自己 的人。他常常大摆宴 席,宴请天下宾客。 每次宴会,餐桌上的 用具几乎全是用银制 成的,唯有他自己用 的那一个碗却是铝制 品。
人教版新教材《电解池》优秀课件1
人教版新教材《电解池》优秀课件1
电解时电极产物的判断
1. 阳极放电的顺序:
非惰性电极,如Fe、Cu>S2->I->Br>Cl->OH->非还原性含氧酸根离子> F-
Cl Cl
Cu
Cl CuClຫໍສະໝຸດ ↓ 电子沿阳极回到电源正极
人教版新教材《电解池》优秀课件1
人教版新教材《电解池》优秀课件1
电离与电解的比较
电离
电解
条件
电解质溶于水或受热融 化状态
电解质电离后再通直流电
电解质电离成为自由移 阴阳离子定向移动,在两
过程
动的离子 CuCl2=Cu2++2Cl-
2. 阳离子得电子顺序(阴极放电顺序):
Ag+ > Hg2+ > Fe3+ > Cu2+ > H+(酸) > Fe2+ > H+ (水) > Al3+ > Mg2+ > Na+ > Ca2+ > K+
人教版新教材《电解池》优秀课件1
人教版新教材《电解池》优秀课件1
用惰性电极电解下列物质的溶液, 填表并写出电极反应
总反应: 电解
2Al2O3(熔融)==4Al+3O2↑ 冰晶石
人教版新教材《电解池》优秀课件1
人教版新教材《电解池》优秀课件1
二、电解原理的应用——4.电冶金
法国皇帝拿破仑三世 是一个喜欢炫耀自己 的人。他常常大摆宴 席,宴请天下宾客。 每次宴会,餐桌上的 用具几乎全是用银制 成的,唯有他自己用 的那一个碗却是铝制 品。
人教版新教材《电解池》优秀课件1
人教版新教材《电解池》优秀课件1
电解时电极产物的判断
1. 阳极放电的顺序:
非惰性电极,如Fe、Cu>S2->I->Br>Cl->OH->非还原性含氧酸根离子> F-
课件《电解池》PPT_完美课件_人教版1

阳极:4OH- - 4e- = 2H2O + O2↑ 总反应:2H2O电==解2H2↑ + O2↑
电解水型:含氧酸、强碱、活泼金属的含氧酸盐 (KNO3、Na2SO4 _)。
电解后溶液中溶质的质量分数 增大 ,若要 恢复原来的浓度,只需加入一定量的 水 即可。
例2:①HCl
阴极:
2H+ + 2e- = H2↑
6.用惰性电极电解下列溶液一段时间再
加入一定量的另一纯净物(方括号
内),能使溶液恢复原来的成分和浓
度的是
(C )
A. CuSO4 [Cu(OH)2] B.B. NaOH [NaOH]
C.C. CuCl2 [CuCl2] D.D. NaCl [NaCl]
7、电解液中含有K+、Cl —、SO42—、 OH — (少量)、Cu2+、H+(少量), ⑴用两个石墨棒作电极电解,开始时 阳极上电极反应式是_2_C_l_--_2_e_-=__C_l _2__; 阴极上电极反应式是_C_u_2+_+__2e_-_=_C_u__ ⑵改用两个铜棒作电极电解时,则 阳极变化是_C_u__-_2e_-_=_C__u_2+___, 阴极上电极反应式是_C_u_2_++__2_e-_=_C_u__。
CuSO4 [Cu(OH)2]
阳极:水放O2产生酸
阳极:Ag - e- = Ag+ 电解后原溶液中溶质的质量分数减小,若要恢
用石墨作电极电解下列溶液,写出反应方程式。 7、电解液中含有K+、Cl —、SO42—、 OH — (少量)、Cu2+、H+(少量),NaOH [NaOH]
阴极上电极反应式是____________
串联电解池
电解水型:含氧酸、强碱、活泼金属的含氧酸盐 (KNO3、Na2SO4 _)。
电解后溶液中溶质的质量分数 增大 ,若要 恢复原来的浓度,只需加入一定量的 水 即可。
例2:①HCl
阴极:
2H+ + 2e- = H2↑
6.用惰性电极电解下列溶液一段时间再
加入一定量的另一纯净物(方括号
内),能使溶液恢复原来的成分和浓
度的是
(C )
A. CuSO4 [Cu(OH)2] B.B. NaOH [NaOH]
C.C. CuCl2 [CuCl2] D.D. NaCl [NaCl]
7、电解液中含有K+、Cl —、SO42—、 OH — (少量)、Cu2+、H+(少量), ⑴用两个石墨棒作电极电解,开始时 阳极上电极反应式是_2_C_l_--_2_e_-=__C_l _2__; 阴极上电极反应式是_C_u_2+_+__2e_-_=_C_u__ ⑵改用两个铜棒作电极电解时,则 阳极变化是_C_u__-_2e_-_=_C__u_2+___, 阴极上电极反应式是_C_u_2_++__2_e-_=_C_u__。
CuSO4 [Cu(OH)2]
阳极:水放O2产生酸
阳极:Ag - e- = Ag+ 电解后原溶液中溶质的质量分数减小,若要恢
用石墨作电极电解下列溶液,写出反应方程式。 7、电解液中含有K+、Cl —、SO42—、 OH — (少量)、Cu2+、H+(少量),NaOH [NaOH]
阴极上电极反应式是____________
串联电解池
《电解池》PPT全文课件-PPT【人教版】

《电解池》PPT全文课件-PPT【人教版 】优秀 课件( 实用教 材)
《电解池》PPT全文课件-PPT【人教版 】优秀 课件( 实用教 材)
应用2、电镀
⑴ 定义:利用电解原理在某些金属的表面镀上一薄层其它金属或是合金的方法。
⑵ 电镀材料的选择:
阴极 ——镀件(待镀金属)
阳极 —— 镀层金属
电镀液 ——含有镀层金属离子的溶液
《电解池》PPT全文课件-PPT【人教版 】优秀 课件( 实用教 材)
《电解池》PPT全文课件-PPT【人教版 】优秀 课件( 实用教 材)
氯碱工业:离子交换膜法制烧碱
阳离子交换膜:
只允许阳离子通过(Cl-、OH-离子和 气体不能通过),把电解槽隔成阴 极室和阳极室。
(2)阳离子交换膜的作用:
a、防止氢气和氯气混合而引起爆炸; b、避免氯气与氢氧化钠反应生成次氯酸钠影响氢氧化钠的产量。
通电
2NaCl (熔融) == 2Na + Cl2↑
AlCl3 ? MgO ?
为什么不电解钠、镁、铝的盐溶液? 盐溶液则相当于电解水中的H+得到氢气
《电解池》PPT全文课件-PPT【人教版 】优秀 课件( 实用教 材)
《电解池》PPT全文课件-PPT【人教版 】优秀 课件( 实用教 材)
【学以致用】1.下图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装 置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔 融盐,阴极最后只剩下纯钛。下列说法中正确的是
《电解池》PPT全文课件-PPT【人教版 】优秀 课件( 实用教 材)
思考:电解完后,CuSO4溶液的浓度有何变化?
稍变小
《电解池》PPT全文课件-PPT【人教版 】优秀 课件( 实用教 材)
《电解池》PPT全文课件-PPT【人教版 】优秀 课件( 实用教 材)
应用2、电镀
⑴ 定义:利用电解原理在某些金属的表面镀上一薄层其它金属或是合金的方法。
⑵ 电镀材料的选择:
阴极 ——镀件(待镀金属)
阳极 —— 镀层金属
电镀液 ——含有镀层金属离子的溶液
《电解池》PPT全文课件-PPT【人教版 】优秀 课件( 实用教 材)
《电解池》PPT全文课件-PPT【人教版 】优秀 课件( 实用教 材)
氯碱工业:离子交换膜法制烧碱
阳离子交换膜:
只允许阳离子通过(Cl-、OH-离子和 气体不能通过),把电解槽隔成阴 极室和阳极室。
(2)阳离子交换膜的作用:
a、防止氢气和氯气混合而引起爆炸; b、避免氯气与氢氧化钠反应生成次氯酸钠影响氢氧化钠的产量。
通电
2NaCl (熔融) == 2Na + Cl2↑
AlCl3 ? MgO ?
为什么不电解钠、镁、铝的盐溶液? 盐溶液则相当于电解水中的H+得到氢气
《电解池》PPT全文课件-PPT【人教版 】优秀 课件( 实用教 材)
《电解池》PPT全文课件-PPT【人教版 】优秀 课件( 实用教 材)
【学以致用】1.下图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装 置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔 融盐,阴极最后只剩下纯钛。下列说法中正确的是
《电解池》PPT全文课件-PPT【人教版 】优秀 课件( 实用教 材)
思考:电解完后,CuSO4溶液的浓度有何变化?
稍变小
《电解池》PPT全文课件-PPT【人教版 】优秀 课件( 实用教 材)
电解池ppt优秀课件人教版

D
当堂检测
3.如图所示是电解氯化铜溶液的装置,其中c、d为石墨电极,下列有关判断正确的是( ) A a为负极,b为正极 B a为阳极,b为阴极 C 电解过程中,d电极质量增加 D 电解过程中,氯离子的浓度不变
C
当堂检测
原电池与电解池比较
课堂小结
原电池
电解池
一个概念
将化学能转变为电能的装置
操作步骤:
阳极
阴极
现象
判断产物
反应方程式
氯气
铜
产生使湿润的碘化钾淀粉试纸变蓝的气体
有红色物质出现
实验现象及结论
CuCl2 == Cu + Cl2↑
通电
实验探究
C
CuCl2溶液
+
-
C
交流研讨二
1.通电前,CuCl2溶液中存在哪些离子?它们在溶液中如何运动?通电后,离子在溶液中的运动如何变化? 2.标出电路中电子流向?分析流入阴极的电子到哪里去了?流出阳极的电子从哪里来? 3.写出两极的电极反应式,判断反应类型。
(2)NaCl溶液:
阳极:
阴极:
2NaCl+2H2O H2↑+ Cl2↑
电解
2Cl- - 2e- = Cl2↑
2H+ + 2e- = H2↑
+ 2NaOH
(OH-)
2Cl-+2H2O H2↑+ Cl2↑+ 2OH-
电解
总反应式:
2.两极极板上都有气体产生,如何检验两种气体?
交流研讨四
阴极:收集纯净气体,点燃,并在上方罩一个干冷的烧杯,产生淡蓝色火焰,且烧杯壁上有水珠出现。
NaOH H2SO4 Na2SO4
当堂检测
3.如图所示是电解氯化铜溶液的装置,其中c、d为石墨电极,下列有关判断正确的是( ) A a为负极,b为正极 B a为阳极,b为阴极 C 电解过程中,d电极质量增加 D 电解过程中,氯离子的浓度不变
C
当堂检测
原电池与电解池比较
课堂小结
原电池
电解池
一个概念
将化学能转变为电能的装置
操作步骤:
阳极
阴极
现象
判断产物
反应方程式
氯气
铜
产生使湿润的碘化钾淀粉试纸变蓝的气体
有红色物质出现
实验现象及结论
CuCl2 == Cu + Cl2↑
通电
实验探究
C
CuCl2溶液
+
-
C
交流研讨二
1.通电前,CuCl2溶液中存在哪些离子?它们在溶液中如何运动?通电后,离子在溶液中的运动如何变化? 2.标出电路中电子流向?分析流入阴极的电子到哪里去了?流出阳极的电子从哪里来? 3.写出两极的电极反应式,判断反应类型。
(2)NaCl溶液:
阳极:
阴极:
2NaCl+2H2O H2↑+ Cl2↑
电解
2Cl- - 2e- = Cl2↑
2H+ + 2e- = H2↑
+ 2NaOH
(OH-)
2Cl-+2H2O H2↑+ Cl2↑+ 2OH-
电解
总反应式:
2.两极极板上都有气体产生,如何检验两种气体?
交流研讨四
阴极:收集纯净气体,点燃,并在上方罩一个干冷的烧杯,产生淡蓝色火焰,且烧杯壁上有水珠出现。
NaOH H2SO4 Na2SO4
课件《电解池》精品ppt课件_人教版1

此法主要用于防止土壤、海水及河水中的金属设备的腐蚀
Fe - 2e- = Fe2+
普遍
吸氧腐蚀比析氢腐蚀更普遍
性
铜铜器板上上的的铁铁铆铆钉钉为为什什么么特特别别容容易易生生锈?锈?
小结
1、在同一电解质溶液中: (1)、电解原理引起的腐蚀>原电池原理引起 的腐蚀>化学腐蚀>有防腐措施的腐蚀 (2)、浓度越大,腐蚀越快
淡盐水 电镀液——含有镀层金属离子的溶液
阴极:Cu2++2e- → Cu↓
Cl2
阳 极 特别活泼的金属钠、镁、铝等只能通过电解的方法制取
阴极:2Cu2++4e- → 2Cu↓
金属钛网 此法主要用于防止土壤、海水及河水中的金属设备的腐蚀
1、电解饱和食盐水(P19)
H+ Na+
NaOH溶液
阴极 碳钢网
阴离子向阳极迁移,阳离子向阴极迁移
CuSO4
阳极:2Cl- → 2e-+Cl2↑
阴极:2H++2e- → H2↑
阳极:2Cl- → 2e- +Cl2↑ 阴极:Cu2++2e- → Cu↓ 阳极:2Cl- → 2e- +Cl2↑ 阴极:2H++2e- → H2↑
阳极:4OH- → 4e-+O2↑+2H2O 阴极:2Cu2++4e- → 2Cu↓
充电电池又称二次电 池,它在放电时所进 行的氧化还原反应, 在充电时又逆向进行, 使生成物恢复原状, 如此充放电可循环进 行,至一定周期后终 止。
正极:PbO2、负极:Pb
两个电极均参与反应
铅蓄电池充电和放电的总化学方程式:
放电
PbO2 + Pb + 2H2SO4 充电 2PbSO4 + 2H2O
《电解池》PPT全文课件-PPT【人教版】

e- 阳极 C
解池的阴极,再从阳极流回电源正极
离子移动的方向:
CuCl2溶液
阳离子移向阴极,
内电路
阴离子移向阳极。
【思考4】电解质溶液导电的实质是什么?
《电解池》PPT全文课件-PPT【人教版 】优秀 课件( 实用教 材)
《电解池》PPT全文课件-PPT【人教版 】优秀 课件( 实用教 材)
6、电解质溶液导电的实质
——仅仅导电,不参与反应
活性电极(除铂、金外的金属): ——既可以导电、又可以参与电极反应
【思考2】形成电解池的条件是什么?
《电解池》PPT全文课件-PPT【人教版 】优秀 课件( 实用教 材)
《电解池》PPT全文课件-PPT【人教版 】优秀 课件( 实用教 材)
4、形成电解池的条件
⑴与直流电源相连的两个电极 ⑵电解质溶液或熔融电解质 ⑶形成闭合回路 (4)非自发进行的氧化还原反应
Cu2+、Cl-为自由移动的离子;
2.通电后,电路中电子的流动方向如何?
3.通电后,离子的运动情况有什么改变?
《电解池》PPT全文课件-PPT【人教版 】优秀 课件( 实用教 材)
《电解池》PPT全文课件-PPT【人教版 】优秀 课件( 实用教 材)
思考:
4.当离子定向移动到电极表面时,发生的是什么 类型的反应?
3、电极
⑴.两电极名称
阳极 阴极
(2).两电极确定
e- 阴极
C
e-
阳极 C
阴极:
CuCl2溶液
与电源负极相连—电子流入— 发生还原反应—阳离子移向
阳极:
与电源正极相连—电子流出—发生氧化反应—阴离子移向
《电解池》PPT全文课件-PPT【人教版 】优秀 课件( 实用教 材)
人教版《电解池》优质ppt课件1

2020山东
高考真题重现
采用惰性电极,以去离子水和氧气为原料通过电解法制备 双氧水的装置如下图所示。忽略温度变化的影响,下列说 法错误的是( D )
阳极 氧化反应
阴极 还原反应
√
H+
√
√ ×
阳极的反应为:2H2O-4e-=4H++O2↑ 阴极的反应为:2O2+4e-+4H+=2H2O2 总反应为:O2+2H2O=2H2O2
Fe-2e-= Fe2+
阴极:(H+(水) >Na+)
2H++ 2e-===H2↑(还原反应)。
防止氢气氯气混合见光爆炸;
通过与原电池装置的对比,强化电解池的工作原理;
C2Hu-+2e+-=2Ceu-2+==;=H32↑.(还通原反过应)。对电解三大应用及离子交换膜技术的介绍,让学生感受
例3:根据右图书写用惰性电极电解硫酸铜的电极反应和总反应方程式。
。
阳极:与电源
相连,
电子,发生
反应。
阳极 结合氧化还原反应原理和规律,正确书写电极反应和总反应方程式;
发生氧化反应 通过与原电池装置的对比,强化电解池的工作原理;
移 K、 Ca、Na、Mg、Al 、Zn、Fe、Sn、Pb、Cu、Hg、Ag
电解法
热还原法
2H++ 2e-===H2↑(还原反应)。
热分解法
溶液需为酸性
√
还原反应
阳极 氧化反应
高考热点——电解池中的膜技术
(1)离子交换膜的类型 离子交换膜是对离子具有选择透过性的高分子薄膜,
常见的离子交换膜为:阳离子交换膜、阴离子交换膜、 特殊离子交换膜如质子交换膜等。
(2)离子交换膜的类型的判断 首先根据阴、阳两极上的电极反应,确定出该电极附近的
人教版高中化学《电解池》ppt精品教学1

放电 次序
以碳棒作电极电解CuSO4溶液,阴极和阳
极分别有什么现象?
阴极:有红色固体物质析出 铜
阳极:有无色无味气体放出 氧气
人教版高中化学-选修四-4.3 电解池(共31张PPT)
实践探究
向氯化锌溶液中通入直流电
为什么不放 出H2?
e-
e-
e-
e-
Cl2
Zn
当c(Zn2+)»c(H+)时
Zn2+优先于H+先得 到电子
氯化铜溶液
C
氯化铜溶液
D
人教版高中化学-选修四-4.3 电解池(共31张PPT)
3.(双)在下图所示装置中,a、b都是惰性电极,通电
一段时间后,b极附近溶液呈红色。下列说法正确的是
A.X是正极,Y是负极
AC
B.X是负极,Y是正极
C.CuSO4溶液的PH逐渐减小 D.CuSO4溶液的PH不变
•X Y •
人教版高中化学-选修四-4.3 电解池(共31张PPT)
2.电解水型
阳极 电解含氧酸、强碱溶液、活泼
金属的含氧酸盐溶液时,如电
解H2SO4、NaOH、Na2SO4等
氧 气
阴极
氢 Na2SO4溶液 气
实例
电极反应
浓度 P 复原
H
阳极: 4OH- -4e- = 2H2O+O2↑
Na2SO4
阴极: 4H ++ 4e- = 2H2 ↑
4.放氧生酸型
阳极
电解不活泼金属的含氧酸盐时, 电解质和水都有一部分被电解,氧 如CuSO4溶液、AgNO3溶液等。气
阴极
铜
CuSO4溶液
实例
电极反应
人教版PPT《电解池》完美课件1

复习过关
1、下图是电解饱和NaCl溶液的实验装置,其中c、 d为石墨电极。则下列有关判断中正确的是( A )
A.a为正极、b为负极
B.c为阴极、d为阳极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
2、下图为直流电源电解稀Na2SO4水溶液的装置, 通电后在石墨电极a和b附近分别滴加一滴石蕊溶 液。下列实验现象中正确的是D ( )
1、分析电解熔融的氯化钠(工业上制钠)
电解法
e-
e-
阳极: 阴极:
2Cl--2e-=Cl2↑ 氧化反应 2Na+ + 2e- = 2Na 还原反应
电解反应: 2NaCl = 2Na +Cl2↑
2、将熔融的氯化钠改为氯化钠溶液
阳极: 2Cl-- 2e- = Cl 2 ↑
阴极: 2H ++ 2e- = H2 ↑
A.石墨电极上产生氢气 B.铜电极发生还原反应 C.铜电极接直流电源的负极 D.当有0.1 mol电子转移时,有0.1 mol Cu2O生成
4、用铜作电极电解盐酸溶液 阳极反应式______________________; 阴极反应式______________________; 总反应离子方程式 _____________________。
A.逸出气体的体积:a电极的小于b电极的 B.一电极逸出无味气体,另一电极逸出刺激性气味气体 C.a电极附近呈红色,b电极附近呈蓝色 D.a电极附近呈蓝色,b电极附近呈红色
3、Cu2O是一种半导体材料,基于绿色化学理念 设计的制取Cu2O的电解池示意图如下, 电解总反应为:2Cu+H2O =Cu2O+H2↑。下列 说法正确的是(A )
❖
8通过了解穆罕默德的主要活动,学习 他不畏 困难的 坚强意 志和为 阿拉伯 民族统 一与幸 福而奋 斗的远 大抱负 。
电解池演示课件PPT人教版PPT

⑵若阳极为纯锌,阴极为铜片,阳极反应式是
Zn -2e-=Zn2+
⑶如果两极均为铜片且不考虑H+在阴极上放电
当电路中有0.01mol电子通过时,阴极增重 0.32 g
,
Cu2+ +2e-=Cu
阴极上的电极反应式是
。
电解池演示课件PPT人教版PPT(优秀 课件)
1.下列说法或实验现象的描述不正确的是( 电解池演示课件PPT人教版PPT(优秀课件)
A.加入适量的6mol/L的盐酸 B.加入数滴氯化铜溶液
C.加入适量蒸馏水
D.加入适量的氯化钠溶液
3.用石墨作电极,电解1mol/L下列物质的溶液,溶液的PH值保
持不变的是( )。
A.HCl B.NaOH
C.Na2SO4
D.NaCl
4.下列关于铜电极的叙述,正确的是( )。
A.铜锌原电池中铜是正极
B.用电解法精炼粗铜时,铜作阳极
第三节 电解池
一、电解原理:
1.电解:使直流电通过电解质溶液而在阴、阳两 极引发氧化还原反应的过程。
(可为自发也可为非自发)
2.电解池:将电能转变为化学能的装置。 +
3.构成电解池的条件: C ①直流电源;
-
C
②两个电极(可相同也可不同); ③电解质溶液; ④形成闭合回路。
CuCl2溶液
4.电极名称及反应类型:
a电源b
–+
Pt
Cu a
b
CuSO4溶 液
电解池演示课件PPT人教版PPT(优秀 课件)
NaCl和酚酞溶 液
电解池演示课件PPT人教版PPT(优秀 课件)
例:在50mL 0.2mol/L的硫酸铜溶液中插入两个电
人教版《电解池》公开课课件PPT1

电解池 金属的腐蚀与防护
知识·要点梳理
知识清单
1. 电解 (1)定义:使电流通过电解质溶液(或熔融的电解质)而在阴、阳两极引起氧
化还原反应的过程。 (2)能量转化形式:在此过程中,将①___电___能转化为②___化__学___能。
中, 极上析出灰白色固体
2. 电解池的构成条件 (3)形成⑤____________。
5. 电解时两极的放电顺序
⑬_____________________⑭______________________⑮ ____________________
基础诊断
② 正极反应1式. 为判____断____正____误____(____正____确____的___。打“√”,错误的打“×”)。
例1 正
图1
图2
① X为___正___极,Y极反应式为________________________。
2
X
图3
① 负极反应式为______________________; ② 正极反应式为_______________________________。
能力1 金属的腐蚀
能力·重点突破
要点提醒
1.吸氧腐蚀是金属腐蚀的主要形式,而且析氢腐蚀最终也会被吸氧腐蚀所替代, 因为析氢腐蚀过程中溶液的酸性逐渐减弱。
2.在金属活动性顺序表中位于氢前面的金属和氢后面的金属都能发生吸氧腐蚀, 但只有在金属活动性顺序表中位于氢前面的金属才可能发生析氢腐蚀。
3.在同一电解质溶液中,金属腐蚀的快慢可用下列规律判断:电解原理引起的腐 蚀>原电池原理引起的腐蚀>化学腐蚀>有防腐措施的腐蚀。
中, 极上析出灰白色固体
(6)电解池的阳极发生氧化反应,阴极发生还原反应。( √ ) ____________⑪________________________
知识·要点梳理
知识清单
1. 电解 (1)定义:使电流通过电解质溶液(或熔融的电解质)而在阴、阳两极引起氧
化还原反应的过程。 (2)能量转化形式:在此过程中,将①___电___能转化为②___化__学___能。
中, 极上析出灰白色固体
2. 电解池的构成条件 (3)形成⑤____________。
5. 电解时两极的放电顺序
⑬_____________________⑭______________________⑮ ____________________
基础诊断
② 正极反应1式. 为判____断____正____误____(____正____确____的___。打“√”,错误的打“×”)。
例1 正
图1
图2
① X为___正___极,Y极反应式为________________________。
2
X
图3
① 负极反应式为______________________; ② 正极反应式为_______________________________。
能力1 金属的腐蚀
能力·重点突破
要点提醒
1.吸氧腐蚀是金属腐蚀的主要形式,而且析氢腐蚀最终也会被吸氧腐蚀所替代, 因为析氢腐蚀过程中溶液的酸性逐渐减弱。
2.在金属活动性顺序表中位于氢前面的金属和氢后面的金属都能发生吸氧腐蚀, 但只有在金属活动性顺序表中位于氢前面的金属才可能发生析氢腐蚀。
3.在同一电解质溶液中,金属腐蚀的快慢可用下列规律判断:电解原理引起的腐 蚀>原电池原理引起的腐蚀>化学腐蚀>有防腐措施的腐蚀。
中, 极上析出灰白色固体
(6)电解池的阳极发生氧化反应,阴极发生还原反应。( √ ) ____________⑪________________________
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Cl-移向阳极,失去电子 阳极:2Cl-- 2e-=Cl2↑(氧化反应)
CuCl2
Cu+Cl2↑
6
电解: 使电流通过电解质溶液而在
阴、阳两极上引起氧化还原反应 的过程叫做电解
电解池(电解槽): 把电能转变为化学能的装置。
7
在电解过程中是如何形成闭合回路的?
e- e-
电源负极
e-
e- ↓
e-
电解池阴极
A.a电极产生的气体小于b电极产生的气体 B.一电极逸出无味气体,另一电极逸出刺激性气味的气体 C.a 电极附近呈红色,b 电极附近呈蓝色 D.b 电极附近呈红色,a 电极附近呈蓝色
14
人 教化学 选修4第 四章第 3节 电解池( 共17张 PPT)
练习4 :如右图是电解氯化铜溶液的装置,其中c、d为石墨电 极,则下列有关判断正确的是 (C)
•
8.你可以观,可以赏,但你却没有风 的能耐 ,把好 端端的 东西破 坏了, 还居然 翻出新 意。还 有秋风 中的那 些树木 ,原本 蓊蓊郁 郁的, 可是经 不住风 的手轻 轻地摇 晃,三 摇两摇 的,就 只剩下 一副骨 骼了。
感谢观看,欢迎指导!
18
e- ↓
溶液中的阳离子在阴极得电子; 同时溶液中的阴离子在阳极失去电子
e- ↓
电解池阳极
e- ↓
电源正极
8
电解的本质: 电解质溶液的导电过程就是电解质
溶液的电解过程。
9
(1)阴极与电极材料无关。溶液中阳离子放电顺序:
Ag+> Hg2+>Fe3+> Cu2 +>H+ (酸) >Pb2+>Sn2+ >Fe2+>Zn2+>H+(水)>Al 3+>Mg2+>Na+>K +
人 教化学 选修4第 四章第 3节 电解池( 共17张 PPT)
16
人 教化学 选修4第 四章第 3节 电解池( 共17张 PPT) 人 教化学 选修4第 四章第 3节 电解池( 共17张 PPT)
17
•
1.文化危机深化到一定程度,必定引 起深刻 的文化 转型。 所谓文 化转型 ,是指 特定时 代、特 定民族 或群体 赖以生 存的主 导性文 化模式 为另一 种新的 主导性 文化模 式所取 代。
(2)阳极与电极材料有关。 阳极为活性电极(活性强的金属),则阳极本身失电子溶解。 阳极为惰性电极(石墨(C)、金(Au)、铂(Pt)),则溶液中阴 离子失电子。
活泼阳极>S2->I->Br->Cl->OH- >非还原 性含氧酸根>F-
10
练习1: 根据电解原理,画出电解盐酸的装置图。用碳棒作 两极材料,注明哪是阳极哪是阴极,写出两极反应式及总的 电解化学方程式。
2H2O + 2e - == H↑2 + 2OH-
电解
2H2O ==
2H2↑
+ O↑2
12
练习2: 1、标出图中电解池的阴、阳极。 2、写出电极反应式
13
练习3: 下图是直流电源电解稀Na2SO4水溶液的装置。通电后 在石墨电极 a 和 b附近分别滴加一滴石蕊试液。下列实验 现象中正确定是 ( )
+
-
A、a为负极,b为正极 B、a为阳极,b为阴极 C、电解过程中,d电极质量增加 D、电解过程中,氯离子浓度不变
阳极
阴极
人 教化学 选修4第 四章第 3节 电解池( 共17张 PPT)
CuCl2溶液
15
人 教化学 选修4第 四章第 3节 电解池( 共17张 PPT)
思考:石墨电极电解NaCl溶液,阴阳两极电极方 程式及总的化学方程式?
•
2.在这种意义上,文化转型同文化危 机一样 ,并不 是经常 发生的 社会历 史现象 ,无论 是个体 的文化 习惯的 改变、 价值信 念或信 仰的改 变,还 是特定 群体或 特定社 会某些 文化特 质或文 化理念 的一般 意义上 自觉的 或不自 觉的更 新,都 不能算 作文化 转型.
•
3.只有在大的历史尺度上所发生的主 导性文 化观念 、文化 理念、 价值体 系、文 化习惯 的总体 性的、 根本性 的转变 ,才是 我们所 说的文 化转型 。
•
4.按照这种尺度,人类迄今所经历的 最深刻 的文化 转型就 是现代 化进程 中的文 化转型 ,即传 统农业 文明条 件下自 在自发 的经验 型的文 化模式 被工业 文明条 件下的 自由自 觉的理 性文化 模式所 取代。 这即是 人们通 常所说 的文化 的现代 化或人 自身的 现代化 。
•
5.文化的变化呈现出多样化的特征。 例如, 我们生 活世界 中的具 体的文 化要素 、文化 特质、 文化形 式即使 在文化 模式的 常规期 或稳定 期也会 或快或 慢地变 化,一 些习惯 、惯例 、文艺 形式、 仪式等 等甚至 在总体 文化模 式没有 发生根 本性变 化时, 也会自 己经历 生灭的 变化。
第三节
电解池
1
• 1799年,意大利人发明了最原始的电池---伏打 电池。
• 1807年,英国化学家戴维将铂电极插入熔融的 氢氧化钾并接通直流电源时,奇迹终于产生了, 在阴极附近产生一种银白色的金属,随即形成 紫色的火焰。这就是发现钾元素的主要过程, 当时在社会上引起了轰动。他随后用电解法又 相继发现了钠、钙、锶、钡、镁、硼、硅等元 素,戴维成为发现化学元素最多的人。
2
思考: 以CuCl2溶液导电为例,电解质导电实验
需要哪些条件?
①有直流电源 ②与直流电源相连的两个电极
阳极:与电源正极相连的电极 阴极:与电源负极相连的电极 ③电解质溶液(或熔融的电解质) ④形成闭合回路
3
电解池的构成条件:
①有直流电源 ②与直流电源相连的两个电极
阳极:与电源正极相连的电极 阴极:与电源负极相连的电极 ③电解质溶液(或熔融的电解质) ④形成闭合回路
阳极
阴极
阳极: 2Cl- - 2e- = Cl2↑ 阴极: 2H+ + 2e- = H2↑
电解
2HCl===H2↑+ Cl2↑
盐酸
11
例题2:
1、标出图中电解池的阴、阳极
2、写出电极反应式
阳极: 4OH- - 4e - == O↑ + 2H O
2H2O - - == O2↑ + 4H+
阴极: 2H+ + 2e - == H2 ↑
•
6.因为风的缘故,乡村里许多平常得 不能再 平常的 事物, 便有了 某种诗 意。你 瞧,那 晚风中 的炊烟 ,怎么 看都像 是一幅 悬腕挥 就的狂 草,云 烟乱舞 ,该虚 的地方 虚,该 实的地 方实, 那是我 们在绢 和纸上 无法做 到的, 可谓真 正的“ 天书” 了。
•
7.一阵风吹过去,一阵风又吹过来, 满荡田 田的莲 叶便乱 了。然 而,乱 是乱了 ,但却 乱出了 味道。 究竟是 什么味 道呢?我 也说不 清。看 来这世 界上的 许多事 情,就 像这风 中的“ 乱荷” ,有一 种不触 动情欲 的美, 大美。
4
现象: 阳极:石墨棒上有气体产生,
气体使湿润的碘化钾淀粉试纸 变成蓝色,可判断新气体是Cl2
。阴极:石墨棒上有覆盖了
一层红色的铜。
结论:电解质溶液在导电过程中
有新物质产生,是化学变化 。
5
ee-
ee-
通电前: Cu2+和Cl-在溶液里自由运动;
通电后:
Cu2+移向阴极, 得到电子。
阴极: Cu2++2e-=Cu (还原反应)
