(安徽专版)2018中考化学总复习 第二部分 题型专题突破 专题4 流程图题
2018年中考化学工艺流程专题复习(共32张PPT)

类型一 海水资源的综合利用 类型二 能源工业(化石燃料的利用及合成氨工业等) 类型三 CaCO3和矿产资源的利用 类型四 回收利用类 类型五 环境保护类
类型一 海水资源的综合利用
例1 (2016· 连云港改编)连云港拥有丰富的海洋资源,开 发利用这些宝贵的资源有力地促进了连云港经济的发展。
(1)从海水中提取出的粗盐中除了NaCl外,还含有泥 沙等杂质。请完善下列实验室中除去泥沙等杂质的实验 步骤(如图1),并回答相关问题:其中操作1的名称 是 溶解;在过滤操作中要用到的玻璃仪器有烧杯、玻璃 棒、 漏斗 (填仪器名称);在加热蒸发过程中,当蒸 发皿中 时,停止加热。 出现较多固体 (2)上述除去泥沙后的澄清滤液中,还含有CaCl2、 MgCl2、Na2SO4等,以下是对澄清滤液进行提纯,制 备精盐的实验方案,各步操作流程如图2所示: a.第②步操作的目的是除去粗盐中的 Na2SO4 (填化 学式,下同),第⑥步操作的目的是除去滤液中过量 的 NaOH、Na2CO 。3 b.第⑤步“过滤”操作中得到沉淀的成分有:BaSO4、 Mg(OH)2、 。 BaCO3、CaCO3
(2)书写化学方程式
①依据信息书写未学过的化学方程式,首先要从流程图 中找出反应物和生成物, 从已知信息中找出的反应物和生成物不满足质量守恒定 律, 若在溶液中进行,可以在反应物或生成物中加上水,然 后进行配平,还应注意反应条件的有关信息; 若在空气中煅烧或通入空气则还需考虑空气中的成分是 否参与反应。 ②根据流程图书写其中某步中发生反应的化学方程式, 首先要找出进入该步操作中的物质,根据所学知识判断 其可能发生的反应,然后写出产物,并进行配平
例4 合成氨是人类科学技术上的一项重大突破, 对社会发展与进步做出了巨大贡献。 合成氨的工艺流程图如下:
中考化学压轴题专题复习——流程图的综合含答案解析

一、中考初中化学流程图1.高纯氧化铁可作为现代电子工业的材料,以下是硫铁矿烧渣(主要成分为Fe 2O 3、FeO 、SiO 2)为原料制备高纯氧化铁(Fe 2O 3)的生产流程示意图:[(NH 4)2CO 3溶液呈碱性,40℃以上时(NH 4)2CO 3分解]。
(1)实验室中,操作Ⅰ、操作Ⅱ用到的玻璃仪器玻璃棒、_______、烧杯等。
(2)写出通入CO 后所发生反应的化学方程式_______(任意写一个)。
(3)在该生产流程中当加入(NH 4)2CO 3后,应该控制的条件是 ______ 。
(4)滤液Ⅱ中可回收的物质在农业上可做 _____(5)写出在空气中煅烧FeCO 3的化学方程式_____。
【答案】漏斗 3CO+Fe 2O 3高温2Fe+3CO 2(或FeO+CO 高温Fe+CO 2) 温度控制在40℃以下(或控制溶液的酸碱度) 氮肥或肥料 322324FeCO +O 2Fe O +4CO 高温【解析】【分析】【详解】 (1)操作Ⅰ、操作Ⅱ都是将固体与液体分开,操作为过滤,过滤操作用到的玻璃仪器玻璃棒、漏斗、烧杯等。
(2)高温条件下,氧化铁和一氧化碳反应生成铁和二氧化碳,氧化亚铁和一氧化碳反应生成铁和二氧化碳,反应的化学方程式为:Fe 2O 3+3CO 高温2Fe+3CO 2,FeO+CO 高温Fe+CO 2。
(3)因为40℃以上时(NH 4)2CO 3分解,因此加入(NH 4)2CO 3后,温度控制在40℃以下;(NH 4)2CO 3溶液呈碱性,所以要控制酸碱性。
(4)滤液Ⅱ中可回收的产品中含有硫酸铵,在生活中可作为氮肥。
(5)在空气中煅烧FeCO3,是碳酸亚铁和氧气在高温下生成二氧化碳和氧化铁,对应的化学反应方程式4FeCO3+O2高温2Fe2O3+4CO2。
故答案为:(1)漏斗;(2)3CO+Fe2O3高温2Fe+3CO2(或FeO+CO高温Fe+CO2);(3)温度控制在40℃以下(或控制溶液的酸碱度);(4)氮肥或肥料;(5)4FeCO3+O2 高温2Fe2O3+4CO2。
【人教版】2018届中考化学专题复习题型突破四工艺流程题课件

13
类型4
环境保护
例5 工业烟气脱硫就是将烟气中含有的二氧化硫除去。一种采 用“双碱法”脱硫的工业流程示意图如图Z4-6所示:
图Z4-6
14
Na2SO3 (1)吸收塔中, 用 NaOH 溶液吸收 SO2, 生成____________ 和 H2O; 增大接触面积 。 NaOH 溶液喷成雾状能充分吸收 SO2 的原因是________________ (2)沉淀室中,发生反应的化学方程式为 Na2SO3+Ca(OH)2===CaSO3↓+2NaOH _____________________________________________________ ___________________。 化合 反应。 (3)氧化室中,化学反应的基本类型是______ NaOH (4)上述流程中,可以循环利用的物质是________________ , 有利于节约成本。
2
突破方法:关注流程“三线”(去线、进线和可逆线)和“核 心”。
总结如下:读正文,找信息,灵活运用;看框内,看框外,里 外结合;边分析,边思考,易处着手;先局部,后全盘,逐步 深入。
3
类型1 粗盐的提纯 例1 B工业上用海水获取粗盐以及实验室用粗盐制得精盐都包 含许多化学实验知识,分析以下过程后填写下列空白。
6
类型2
石灰石工业
例2 工业上用纯碱和石灰石为原料制备烧碱的简要工艺流 程如图Z4-3所示。请回答:
图Z4-3
7
(1)石灰石、生石灰、熟石灰均能与下列______( 填序号)发 B 生化学反应。 A.水 B.盐酸 C.二氧化碳 (2)步骤④发生反应的化学方程式是 Ca(OH)2+Na2CO3===CaCO3↓+2NaOH _____________________________ 。 (3)某研究性学习小组的同学想检验上述工艺中的烧碱溶液 里是否含有纯碱,甲同学选择了一种酸溶液,乙同学选择了一 种碱溶液,丙同学也选择了一种溶液,该溶液中溶质与甲、乙 同学所用溶液中溶质的物质类别不同,他们都能达到检验目的 ,你认为丙同学所选溶液中的溶质可能是__________________ __(填一种物质的化学式)。 CaCl2[或 Ca(NO3)2 或 BaCl2 或 Ba(NO3)2]
安徽2018年中考化学总复习 专题4 流程图题

程式为ZnCl2+(NH4)2C2O4
2NH4Cl+ZnC2O4↓,该反应发生在溶
液中是两种化合物相互交换成分生成另外两种化合物,属于复分解
反应。
1 2 3 4 5 6 7 8 9 10
3.(2017·重庆中考A卷)常温下,氯酸钾的溶解度较小,在工业上可通 过如下转化制得。
NaCl 溶液
NaClO3 溶液
(1)反应①的化学方程式
为
。
(2)反应②的基本反应类型是
。
答案:(1)Zn+2HCl (2)复分解反应
ZnCl2+H2↑
1 2 3 4 5 6 7 8 9 10
解析:(1)反应①是锌与稀盐酸反应,反应生成氯化锌和氢气,反应的
化学方程式为Zn+2HC lZnCl2+H2↑。(2)反应②是氯化锌溶液 与草酸铵溶液发生反应,生成氯化铵和草酸锌沉淀,反应的化学方
已知:①SiO2是一种难溶于水,也不与盐酸、硫酸反应的物质; ②铝盐与氨水反应,生成氢氧化铝沉淀和铵盐。 请回答下列问题:
1 2 3 4 5 6 7 8 9 10
(1)Al2O3与稀硫酸反应的化学方程式
为
。
(2)操作Ⅱ的名称是
。
(3)滤液Ⅱ中溶质的用途之一是
。
(4)电解熔融的Al2O3,除得到金属铝之外,还可得到的气体产物是 (填化学式)。
2018年中考化学真题分类汇编工艺流程2含解析

工艺流程1.(18安徽)废旧电路板中主要含有塑料、铜和锡(Sn)等,为实现对其中锡的绿色回收,某工艺流程如下。
已知:Sn+SnCl2=2SnCl4(1)SnCl4中锡元素的化合价是_____________________。
(2)铜的金属活动性比锡的________(填“强”或“弱”),固体A中一定含有的金属元素是_______。
(3)写出步骤②发生反应的化学方程式________________________________________。
(4)相比于直接焚烧废旧旧电路板回收金属,该工艺主要优点是__________________(回答一点即可)。
【答案】(1)+4(1分)(2)弱(1分)Cu(1分)(3)2SnCl2Sn+SnCl4分解反应(2分)(4)避免焚烧塑料产生污染,更加环保(1分)(其他合理答案均给分)【解析】(1)氯元素显-1价,根据正负化合价等于0,计算出SnCl4中锡元素的化合价是+4价;(2)根据金属活动性顺序表判断铜的金属活动性比锡的弱,Cu不与SnCl2反应,固体A中一定含有的金属铜;(3)根据流程图判断2SnCl2Sn+SnCl4分解反应;(4)避免焚烧塑料产生污染,更加环保或节能环保。
2.(18北京)炼铁的主要原料是赤铁矿(主要成分是Fe2O3)、焦炭、空气等,转化过程如下:(1)②中,反应为CO2+C高温2CO,其中化合价发生改变的元素是。
(2)③中,CO与Fe2O3反应的化学方程式为。
答案:(1)C或碳元素;(2)3CO+Fe2O32Fe+3CO2解析:(1)在CO2+C2CO中,反应物中C为单质碳,其中碳元素的化合价为0,反应后只有一种生成物,CO中的碳元素化合价为+2价,故化合价发生改变的元素是碳元素;(2)③中的反应为一氧化碳在高温的条件下还原氧化铁,其方程式为:3CO+Fe2O32Fe+3CO2。
3、(18北京)为保护绿水青山,可将工业残留的钡渣(主要成分为碳酸钡(BaCO3))进行无害化处理,制取化工原料;硫酸钡(BaSO4)。
安徽省2018年中考化学复习第二部分中考专题突破专题四工艺流程题课件

2018 年安徽省中考命题 2015— 2017 年安徽省中考命题分析 预测与趋势 题 分 考查 安徽省中考的工艺流 年份 考查内容 型 值 形式 程题往往以一个生 以制备 V 2O5 的流程为 产、生活中简单的工 工 艺流程图为情境,考查 背景考查化学方程式 艺 7 的书写、 过滤操作、 化 化学方程式的书写、 2017 流 填空 分 学反应基本类型、 质量 过滤等实验基本操 程 作、常见物质的用途 守恒定律的应用以及 题 等。 物质的用途等。
工艺流程题主要考查化学反应原理、常见化合物的性质、实验基本操作及名称、物质 的除杂和分离、利用溶解度分离物质以及流程中的物质转化和循环等内容,涉及的内容 有一定的难度,在复习时要注意:①心理方面不要有畏难情绪、看见长的文字就害怕、不 爱看流程题。②读题时要有耐心,注意把握整体,读懂流程图,能根据提问在流程中找到答 案。③加强提取信息、顺向和逆向思维相结合的能力,熟练掌握并能写出有关物质的化 学式和反应方程式,提高答题的正确率。④回答开放性试题时,叙述要条理清晰、科学合 理、符合化学用语。
典例2 ( 2017· 江苏苏州改编 )某工厂产生的烧渣( 主要含FeO、Fe2O3,还有一定量的 SiO2 )可用于制七水合硫酸亚铁晶体( FeSO4· 7H2O ),其工艺流程如下:
ቤተ መጻሕፍቲ ባይዱ
查阅资料:SiO2不溶于水,也不与稀硫酸反应。 ( 1 )“浸取”步骤中,FeO、Fe2O3和稀硫酸发生反应的化学方程式分别为FeO+H2SO4 FeSO4+H2O、 。 ( 2 )为提高“浸取”步骤的反应速率,可采取的具体措施有 ( 写一 条,不考虑“搅拌”和“使用催化剂” )。 ( 3 )“还原”步骤的目的是将Fe3+转化为Fe2+,试剂X可用SO2或Fe。若试剂X是Fe,转化原理 为Fe+Fe2( SO4 )3 3FeSO4。测得“还原”后溶液的pH明显增大,其原因是 。 ( 4 )由FeSO4溶液得到FeSO4· 7H2O的过程包含蒸发、 等操作,其中蒸发操作中 所需的玻璃仪器有酒精灯、 。
安徽中考化学总复习专题训练:专题四 流程图题

安徽中考化学总复习专题训练:专题四流程图题__________________________________________________________________。
3.(2019·福建)以某矿山酸性废水(主要含硫酸、硫酸铁、硫酸铜和硫酸锌等)为原料,通过下述流程可将废水中的铁、铜和锌分步沉淀,实现回收利用。
第3题图(1)步骤①中,加入Ca(OH)2有两个作用。
一是中和废水中的硫酸,该反应的化学方程式为________________________________________。
二是将硫酸铁转化为Fe(OH)3,该反应属于______________(填基本反应类型)。
(2)步骤③中,锌泥中最主要的含锌化合物的化学式为__________________。
(3)为分步回收铁、铜、锌等金属资源且直接得到铜单质,只需改变上述流程中的某步骤加入的试剂即可。
该步骤和应加入的试剂分别是______________________。
4.(2019·咸宁)某种手机电路板中含有Fe、Cu、Au、Ag、Ni(镍,银白色金属)△等金属,如下是某工厂回收部分金属的流程图。
已知:2Cu+O2+2H2SO4=====2CuSO4+2H2O。
第4题图(1)操作①的名称是________。
(2)写出滤液②中金属阳离子符号____________。
(3)写出滤液③和铁粉发生反应的一个化学方程式________________________ __________________________________________________________________。
(4)Cu、Ag、Ni在溶液中的活动性由强到弱的顺序依次是________________。
5.(2019·合肥瑶海一模)新型材料纳米级Fe粉具有广泛的用途,它比普通Fe 粉更易与氧气反应,其制备工艺流程如图所示:第5题图请回答下列问题:(1)上述流程中可加以回收利用的物质是__________________,在制备纳米级Fe粉的工艺流程中,其作用是____________。
(完整word)2018年安徽省中考化学试题(word版含答案),推荐文档

(化合反应基本分解反应2018安徽省中考化学试卷一、本大题包括10小题,每小题2分,共20分.每小题的4个选项中只有1个符合题意. 1 .陶瓷是中华民族在人类科技史上的伟大发明。
下列陶瓷制作工艺中发生化学变化的是( )2.为建设天蓝地绿水净的美丽中国,下列做法不合理的是( )A .寻找新能源减少使用化石燃料B .施用大量农药减少植物病虫害C .合成新型洗涤剂减少氮磷排放D .研发易降解材料减少白色污染3. 硼是作物生长必需的微量营养元素,硼元素的相关信息如图所示。
下列有关硼的说法正A .相对原子质量是 10.81gB .属于金属兀素C .原子的核电荷数为5D .原子核外有6个电子4. 实验室可通过加热高锰酸钾固体制取氧气,下列实验操作正确的是( )A .组装好装置后,检查装置气密性B .加入药品后,直接将酒精灯火焰对准药品加热C .水槽中有气泡冒出时,立即收集气体D .实验结束时,先移走酒精灯再从水槽移出导管 5.化学与人类健康密切相关。
下列说法正确的是()A .硬水经过滤后可软化B .食用碘盐可预防骨质疏松C .霉变大米经淘洗后可食用D .控制油脂摄入可减少肥胖的发生6. 归纳法是学习化学的重要方法之一,下列图示正确的是()确的是(C .D .)7.科学家研制出一种代号为 DEPA 的安全驱蚊剂,其化学式为C 12H 17N0,下列有该物质的 说法正确的是( )A •属于无机物B .碳、氢元素质量比为 12: 17C .由4种元素组成D •由31个原子构成&为实现二氧化碳的绿色利用,科学家用固碳酶作催化剂设计了如下转化过程。
下列说法 正确的是( )A .反应①的化学方程式为 C02+C=C0B •固碳酶在反应前后化学性质发生变化C . X 的化学式为 CH 2氧气 金属 里质[f]金属的化学性质D.)选实验目的实验设计选 实验 项项 目的 A探究温度对分子运 动快慢的影响B 探究 水对 铁钉实验设计C 探究空气是燃烧的 必要条件D 探究 C02 与 水发 生反 应10 •实验室测定蜡烛在盛有一定体积空气的密闭容器内燃烧至熄灭过程中, 量随时间变化曲线如图,通过分析该图可推理出的结论是(02和CO 的含D •该过程实现了无机物向有机物的转化9.对比实验是实验探究的重要方法,下列对比实验设计能实现相应实验目的是( )A .曲线①表示CO 含量的变化B .蜡烛发生了不完全燃烧C .蜡烛由碳、氢元素组成D •蜡烛熄灭时,容器内氧气耗尽 c .纯碱(3)纳米铁粉还能去除废水中的重金属离子(如铜离子),写出铁粉与含硫酸铜的废水反 应的化学方程式 ________ 。
合肥备战中考化学——流程图的综合压轴题专题复习
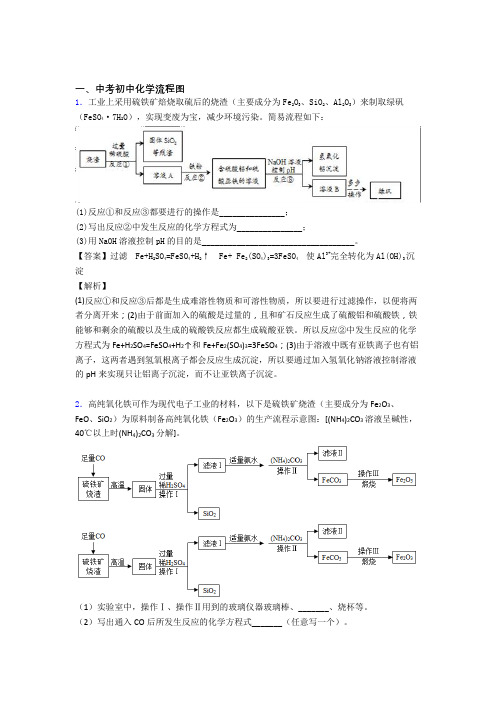
一、中考初中化学流程图1.工业上采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3)来制取绿矾(FeSO4·7H2O),实现变废为宝,减少环境污染。
简易流程如下:(1)反应①和反应③都要进行的操作是_______________;(2)写出反应②中发生反应的化学方程式为_______________;(3)用NaOH溶液控制pH的目的是___________________________________。
【答案】过滤Fe+H2SO4=FeSO4+H2↑ Fe+ Fe2(SO4)3=3FeSO4使Al3+完全转化为Al(OH)3沉淀【解析】(1)反应①和反应③后都是生成难溶性物质和可溶性物质,所以要进行过滤操作,以便将两者分离开来;(2)由于前面加入的硫酸是过量的,且和矿石反应生成了硫酸铝和硫酸铁,铁能够和剩余的硫酸以及生成的硫酸铁反应都生成硫酸亚铁。
所以反应②中发生反应的化学方程式为Fe+H2SO4=FeSO4+H2↑和Fe+Fe2(SO4)3=3FeSO4;(3)由于溶液中既有亚铁离子也有铝离子,这两者遇到氢氧根离子都会反应生成沉淀,所以要通过加入氢氧化钠溶液控制溶液的pH来实现只让铝离子沉淀,而不让亚铁离子沉淀。
2.高纯氧化铁可作为现代电子工业的材料,以下是硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)的生产流程示意图:[(NH4)2CO3溶液呈碱性,40℃以上时(NH4)2CO3分解]。
(1)实验室中,操作Ⅰ、操作Ⅱ用到的玻璃仪器玻璃棒、_______、烧杯等。
(2)写出通入CO后所发生反应的化学方程式_______(任意写一个)。
(3)在该生产流程中当加入(NH 4)2CO 3后,应该控制的条件是 ______ 。
(4)滤液Ⅱ中可回收的物质在农业上可做 _____(5)写出在空气中煅烧FeCO 3的化学方程式_____。
