第三章 中间体及重要的单元反应
有机化学中的反应中间体和活化能

有机化学中的反应中间体和活化能有机化学是研究碳及其化合物的科学,其中反应机理和反应中间体的研究对于理解有机化学反应的本质和发展有重要意义。
在有机化学反应中,中间体是指在化学反应中形成和消失的反应物和产物之间的中间物质。
活化能则是指化学反应发生所需的最小能量。
一、反应中间体反应中间体是在化学反应中暂时形成的物质,它具有较长的寿命,存在于反应物转化为产物的过程中。
反应中间体的形成和消失通常是化学反应的一个关键步骤,它们对于反应速率和产物选择性起着决定性的影响。
1.1 离子中间体离子中间体是指在有机化学反应中形成的带电离子物种。
常见的离子中间体包括碳正离子(碳正离子是在电子亲合力强的试剂作用下形成的,比如亲电取代反应)、碳负离子(碳负离子是在电子捐赠试剂作用下形成的,比如酸催化的亲核取代反应)和自由基离子(自由基离子是在自由基反应中形成的,比如自由基加成和自由基取代反应)。
1.2 中心化学键中间体中心化学键中间体是指在有机化学反应中两个化学键断裂和/或形成的过程中形成的共价中间体。
常见的中心化学键中间体包括碳-碳单键中间体(比如亲电加成反应,碳-碳双键断裂形成碳-碳单键中间体)、碳-碳双键中间体(比如亲电取代反应,碳-碳单键断裂形成碳-碳双键中间体)和碳-氢键中间体(比如氧化反应,氧化剂作用下碳-氢键断裂形成碳-氢键中间体)。
二、活化能活化能是指在化学反应中,反应物由其能量较低的状态转变为能量较高的过渡态所需要的最小能量。
它是影响化学反应速率的重要因素。
活化能较低的反应通常具有较快的反应速率,而活化能较高的反应则速率较慢。
在有机化学中,活化能的大小取决于反应的步骤和反应物之间的相互作用。
活化能的降低可以通过催化剂的添加或者调节反应条件来实现。
催化剂可以通过提供合适的反应路径、降低过渡态的能量或者提供其他交互作用来降低活化能,从而加速化学反应的进行。
三、应用和意义对于有机化学研究者和实践者来说,深入理解和掌握反应中间体和活化能的概念和特点具有重要的意义。
精细有机单元反应(含习题集及答案)

精细有机单元反应习题集精细有机单元反应教材编写组2007,6第一章绪论一、填空题1、所谓“精细化率”就是指。
2、精细化学品就是经加工得,具有或最终使用性得,品种、产量小、附加高得一大类化工产品。
3、我国原化学工业部上个世纪八十年代颁布得《关于精细化工产品得分类得暂行规定与有关事项得通知》中明确规定,中国精细化工产品包括个产品类别。
4、有机精细化学品得合成就是由若干个基本反应组成。
这些基本反应我们称之单元反应。
重要得单元反应有。
5、在新得合成路线设计与选择时,要优先考虑、污染环境不大且容易治理得工艺路线。
6、天然气得主要成分就是。
根据甲烷含量得不同,天然气可分为两种。
7、煤通过方法提供化工原料。
8、催化重整就是得到三种重要芳烃原料得方法。
二、判断题1、氧化锌类感光材料、铁酸盐类磁性材料、精细陶瓷产品、包括导电陶瓷、透光陶瓷等一般均属有机精细化学品。
2、在合成路线设计中,反应得排列方式也直接影响总收率。
一般来说,在反应步数相同得情况下,线性法得总收率高于收敛法,因此,尽可能采用线性法。
3、碳水化合物就是由碳、氢、氧三种元素组成,它们得分子组成一般可表示为Cx(H2O)y, 如葡萄糖C6H12O6=C6(H2O)6,蔗糖C12H22O11=C12(H2O)11,所以说碳水化合物就是由碳与水组成得化合物。
4、在进行合成路线设计与选择时,应尽量少用或不用易燃、易爆与有剧毒原料与试剂。
5、合成路线中反应步数与反应总收率就是评价合成路线得最直接、最主要得标准。
三、简答题1、为什么说合成路线中反应步数与反应总收率就是评价合成路线得最直接、最主要得标准。
2、简述精细化学品合成得原料来源。
3、在设计精细有机合成路线时,需要考虑哪些主要问题?4、写出以下基本化工原料主要来自哪种资源:(1)甲烷;(2)一氧化碳;(3)乙炔;(4)乙烯;(5)C18~C30直链烷烃;(6)C12~C18直链脂肪烃;(7)苯;(8)萘。
5、对精细化学品得定义进行释义。
《合成化学》第三章

第三章
卤化反应(5学时)
第一节 不饱和烃的卤加成反应(1学时)
-X 等),则不利于该反应的进行。因此,烯烃的反应活性
顺序是:R2C=CR2 > R2C=CHR > R2C=CH2 〉RCH=CH2 > CH2=CH2>
CH2=CHCl 。若烯键碳原子上连接有叔烷基或三芳甲基,则 卤加成反应中常会有重排、消除等副反应伴随发生。
第三章
卤化反应(5学时)
第一节 不饱和烃的卤加成反应(1学时)
多卤乙烯进行自由基加成时,加成方向也取决于取
代基稳定自由基的能力,其次序位:Cl > F > H
F2C
CFCl +
HBr
hν
CF2BrCHFCl 88%
+ : CH2FCF2Br 40
第三章
例如:
H2C CHCN + Cl2
卤化反应(5学时)
第一节 不饱和烃的卤加成反应(1学时)
CCl4 hv , 10oC
ClCH2CHClCN
Br Br2 / CCl4 hv , 0oC , 1小时
H
H Br
第三章
卤化反应(5学时)
第一节 不饱和烃的卤加成反应(1学时)
烯烃与卤素的自由基加成反应历程如下:
a.烯键邻近基团的影响
卤化反应(5学时)
第一节 不饱和烃的卤加成反应(1学时)
与烯键碳原子相连的取代基性质不仅影响着烯键极化方 向,而且直接影响着亲电加成反应的难易程度。烯键碳原子 上接有推电子基团(如HO-、RO-、 C6H5-、 CH3CONH-、R等),则有利于烯烃卤加成反应的进行;反之,若烯键碳原 子上接有拉电子基团(如-NO2、-CN、-CO2H、-CO2R、-SO3H
染料化学教学大纲

通过染料化学的学习,使学生比较全面掌握染料的基本知识(染料的分类、命名、牢度、商品化等),了解染料合成的基本反应和方法(偶氮染料的制备原理、各类染料合成的基本途径和常用反应),掌握染料结构与颜色的关系,以及外界因素对染料结构和颜色的影响,掌握染料结构与性能、牢度(上染速率、上染率、匀染性、色牢度等)的关系,初步具有按纤维性质和染整要求合理选择染料,并能从染料结构角度分析染整加工中的一些基本问题的能力,对新型染料、功能性染料有所了解。
4.用于蛋白质纤维染色用的活性染料有何要求?宜选用哪些类型?它们的结构特征如何?
5.试写出α—溴丙烯酰胺活性基的染料与蛋白质纤维的成键过程。
知识单元11:分散染料
参考学时:4学时
学习目标:
1.掌握分散染料的结构特点、基本合成方法;
2.理解分散染料结构与颜色、染色性能和染色牢度的关系。
教学内容:
1.分散染料简介
(三)素质目标
通过《染料化学》课程教学,培养学生严谨求实的科学态度和刻苦钻研的作风,注意培养学生善于分析、总结、归纳的科学学习方法,为以后走上染料生产与应用相关领域的科学研究、生产技术管理等岗位打下坚实的基础。
二、课程内容及学时分配
知识单元1:染料基本知识
参考学时:2学时
学习目标:
1.理解《染料化学》在专业知识结构中的重要地位;
4.偶合反应
知识要点:偶合反应机理;耦合剂;影响偶合反应的因素。
5.偶氮染料的性质
重点:
重氮化反应和偶合反应的机理、基本方法。
分析思考讨论题:
1.试述重氮化反应机理,并讨论影响重氮化反应的因素。
2.试述偶合反应的pH值对偶合反应速率的影响。
知识单元3:染料结构与颜色
卤化反应

Cl2 k1
Cl
HCl
Cl
Cl2
k2
Cl
Cl
HCl
k3
Cl
Cl2
Cl
HCl
Cl
Cl2
苯在硝化、磺化、氯化中k1/k2值的比较
反应类型 硝化
磺化
氯化
k1︰k2
105~107 103~104
~101
❖ 卤化反应中,随着反应生成物浓度的不断变化, 使各级反应的反应速率也相应发生较大的变化。
❖ 苯氯化的动力学方程式看用下式表示:
ICl)等。
❖ 用于置换卤化的卤化剂有HF,KF,NaF,SbF3, HCl,PCl3,HBr等。
第二节 芳环上的取代卤化反应
一 反应历程 芳环上取代卤化的反应通式为:
ArH + X2 = ArX + HX 反应类型:典型的亲电取代反应。 进攻芳环的活泼质点:卤正离子(X+),
1. 以金属卤化物为催化剂的反应历程
1 K-1
CA CA0
CA k CA0
CD CA0
=
K 1-K
CA CA0
1 K
CA CA0
k 1-K + K
K= k2/k1≠1
例:设苯氯化的转化率是50%,则
K=0.1/1=0.1 一氯苯的生成量
CC CA0
=
1 0.1 - 1
0.5
0.50.1 = 0.4811mol
二氯苯的生成量
CD CA0
亚铜进行氯化;目前采用分子筛分离得到纯 净的邻氯甲苯或者对氯甲苯。
(3)催化剂不同,邻、对位异构体比例不同。
催化剂
邻位/对位
二氯甲苯 含量(%)
重氮化反应机理优秀课件

SO3H
SO 4 H2 94%
H
2SO4 <6源自0℃SO 3H
180℃ 转位
165℃ SO 3H
SO 3H
H2SO4 165C H2SO4 SO3 165C
SO 3H
H 2S O 4 S O 3 20~55℃
SO 3H
H O 3S
SO 3H
SO 3H H 2SO 4 SO 3 H O 3S
SO 3H
重氮化反应机理优秀课 件
主要内容
引言 重要的单元反应 常用苯系、萘系及蒽醌中料 重氮化和偶合反应
第一节 引言
中间体——合成特定目标产物的专用原料(广义)。 例如医药中间体、塑料中间体、染料中间体、农药中 间体等等。中间体亦称中料,是生产过程中的半制品 (半成品)。
染料中间体——用以合成染料共轭结构的特定原料。 其主要特征是结构中含有许多个不饱和双键,且在合 成反应中双键较为稳定。如苯、萘、蒽醌等。通常将 这些还不具有染料特性的芳烃衍生物叫作“染料中间 体”,简称“中间体”或“中料”。
(2)在芳胺的氨基和酚羟基上引入烷基和芳基,可 改变染料的颜色和色光
(3)克服氨基、酚羟基遇酸、碱变色的缺点 试剂: 芳烃的烷基化卤烷和烯烃; 氨基的烷基化:醇、酚、环氧乙烷、卤烷、硫酸酯、烯烃; 酚类的烷基化:卤烷、醇、硫酸酯。 方法:在酸性卤化物或质子酸的催化作用下,卤烷和烯烃类
烷基化试剂分别通过亲电取代和亲电加成反应在芳环上引 入烷基。
一、磺化反应
在有机化合物中引入磺酸基的反应。 (一)目的 (1)引入磺酸基赋予染料水溶性; (2)赋予染料对纤维的亲和力,如染料分子中的
磺酸基能和蛋白质纤维上的-NH3+生成颜色键 结合; (3)亲核置换,转换成其他基团,如羟基、胺基, 在染料中间体合成中主要是-SO3Na经碱熔成 -ONa的反应。
有机合成单元反应

2.3.3 芳香族环上氢的亲核取代 反应
• .3.4.2 反应历程 • 1. 双分子历程 • .2. 单分子历程 • 3. 去氢苯历程
2.3.4.3 芳环上其他取代基对反 应的影响
• 在S N2反应中,当取代基x的邻位或对位有 吸电基时,反应较易进行;
• 当吸电性基在x的间位时,对反应的影响很 小。
2.2.3.2 两类定位基
• 属于第一类定位基的主要有: • 一Oˉ、一N(CH3)2、一NH2、一OH、一 OCH3、…… • O N(3) C(R) X • 第二类定位基的主要有: • 一N+(CH3)3、一CF3、 一NO 2…… • S N+(5) C(O=C< CN CX )
3
• 第一类定位基使苯环各碳原子的电子云密 度均有所增加,邻、对位增加得相对较多。 • 第二类定位基使苯环各碳原子的电子云密 度均有所减少,邻、对位减少得相对较多。
第二章 精细有机合成的理论基础
• 2.1 反应试剂的分类 • 有机化学反应通常是在反应试剂的作用 下,有机物分子发生共价键断裂,然后与 试剂生成键,提供碳的物质叫“基质”, 从基质上分裂下来的部分叫“离去基”。 促使有物共价键断裂的物质叫进攻试剂, 也称为反应试剂,有如下两种。
• 2、1、1、极性试剂 • 极性试剂是指那些能够供给或接受一对 电子以形成共价键的试剂。极性试剂又分 为亲电试剂和亲核试剂。 • 2.1.2 游离基试剂 • 含有未成对单电子的游离基或是在一定 条件下可产生游离基的化合物称游离基试 剂。
亲电试剂
• 1) 阳离子:N03、NO+、R+、R—C+=O、A rN+、 R+N+等。 • 2) 含有可极化和已经极化共价镀的分子:C12、Br2、 HF、HCl、 SO3、 RCOCl、 • 3)含有可接受共用电子对的分子(未饱和价电子层原于的 分子) • 4)羰基的双键。 • 亲电试剂是从基质上取定一对电子形成共价键的试剂。 这种试剂具有亲电性能,包括以下几类: • 5)氧化剂:Fe+3· 、O 3、H 2O2等。 • 6)酸类。 · • 7)卤代烷中的烷基:R—x。 • 由该类试剂进攻引起的离子反应叫亲电反应。
第三章反应历程

第三章反应历程
例
CH4 + CD4
1:
1
Cl2
hv
CH3Cl + CD3Cl
>> 1
C-H断裂所需的活化能比C-D断裂所需的 活化能小,因此C-H的反应速率比C-D键 反应速率要大。 说明决速步骤与C-H键的断裂有关,否则 kH/kD为1:1
第三章反应历程
3. 有机反应试剂的分类
有机反应是试剂和反应物相互作用而发生的
亲核试剂:具有较大的负电密度,反应中 有 给出电子(Nu:)包括所有的阴离子、具 机 有未共享电子的物质、氨及有机碱类、所 反 有烷基金属、金属还原剂、能供给电子的 应 烯烃或芳烃 试 亲电试剂:具有较高的正电密度,易接受 剂 电子(E+)包括所有的阳离子、可以接受
第三章反应历程
例外:乙炔基正离子是线型结构,空轨道 是Sp杂化轨道;苯基正离子是平面结构, 空轨道是Sp2杂化轨道。 利用X-ray和核磁共振的研究表明,三苯 甲基正离子为螺旋浆结构,三个苯环成 54°角。
+
C
第三章反应历程
碳正离子的产生
•中性底物的异裂产生 RX R+X X可以为卤素、羟基、甚至氢原子。
未共享电子的物质、所有碳正离子、酸类、 二氯卡宾、氧化剂
第三章反应历程
4. 研究反应历程的方法
4.1 产品的分离和鉴定
Ph
Br2
Ph
MeOH
Br Ph
Br Ph
+
Ph Br
Ph OMe
• 说明烯烃和卤素分子的两个部分不是同时加成
有机反应机理

+ +
N O-
N O-
N O+
N O
第二是因为亚硝基苯的亲核取代反应分两步,而生成中间体碳正离子是决定反 应速度的关键步骤。若进攻邻位,生成的碳正离子为:
N=O H Br
+
N O+ H Br
(II)
N=O H Br
+
N=O H Br
+
(I)
若进攻对位:
N=O
+
N=O
+
N O+
+
N=O
Br
H N=O
+
CH3 CH3 CH3
CH3 CH3 CH3 -H2 O CH3
CH3 CH3
CH3 CH3 CH3
rearrangement CH3
+
- H+
CH3
CH3 CH3
例 3、试为下列反应提出合理的反应机理:
81
1、
R
R
R H+ R OH Cl
O
2、
HCl
3、
H+ CH3
+
)
HBr Br R
R H OH
+ +
4、
CH3 C=CHCH2 CH2 C CH=CH2 CH3
R R H O H
+ + +OH
OH
R R R
+
R
R R
答: 1、
-H+
OH OH
+
2、
Cl
-
Cl
3、
H
+
+
精细有机合成单元反应_03磺化反应讲解

解析:发烟硫酸ω(SO3)换算为ω(H2SO4 )
SO3
H2O
H2SO4
80
18
98
X
Y
ω(H2SO4) = 100-x+y=100-x+(98/80)x=100+(18/80)x 例如:20%发烟硫酸换算为ω(H2SO4) ,酸中含为80g H2SO4
20g三氧化硫折算为H2SO4:(98/80)×20g,
R CH2CH2CH R CH2CH2CH
CH2 + SO3 CH SO3H
亲电加成
脱质子
环合
(老化) R CH2CH2CHCH2SO3 开环 R CH2CH2CH CH2
碳正离子中间体(1)
O SO2
氢转移
1,2-磺酸内酯
R CH2CH CHCH2 SO3H R CH CHCH2CH2 SO3H
脱质子
(1)
亲电加成
OSO3 R CH2 C OCH3
(2)
k2 氢转移
R CH
OSO3H C OCH3 (3)
k3
+SO3 亲电加成
O R CH C OCH3
SO3H (6)
-SO2 ,k5 老化
OSO3 R CH C OCH3
SO3H (5)
k4 氢转移
OSO3H R CH C OCH3
SO3 (4)
3.3.2 磺化和老化的主要反应条件(略)
返回
3.4 链烷烃用二氧化硫的磺氧化和磺氯化
3.4.1 链烷烃的磺氧化
高碳链烷烃(C14~C18)的磺氧化是以二氧化硫和空气为反应剂的 自由基链反应,其反应历程可表示如下:
引发:
光或引发剂
RH
R+H
Y03药物化学第三章—药物代谢反应

9
四、水解酶
水解酶主要参与羧酸酯和酰胺类药物的水解代谢,这 些非特定的水解酶大多存在于血浆、肝、肾和肠中, 因此大部分酯和酰胺类药物在这些部位发生水解。 酯水解酶包括酯酶、胆碱酯酶及许多丝氨酸内肽酯酶。 其他如芳磺酸酯酶、芳基磷酸二酯酶、β-葡萄糖苷酸 酶、环氧化物水解酶(epoxide hydrolase)等,它们和酯 水解酶的作用相似。 通常酰胺类化合物比酯类化合物稳定而难水解,水解 速度较慢,因此大部分酰胺类药物是以原型从尿中排 出。
20
长碳链的烷烃常在碳链末端甲基上氧化生成羟基, 羟基化合物可被脱氢酶进一步氧化生成羧基,称 为ω-氧化;氧化还会发生在碳链末端倒数第二位 碳原子上,称ω-1 氧化。
21
含有脂环和杂环的药物,容易在环上发生羟基化。 如口服降糖药醋磺已脲的主要代谢产物是反式4-羟 基醋磺环已脲。
O2 S O CH 3
10
第三节 第Ⅰ相的生物转化 (Phase Ⅰ Biotransformation)
1
2
3
4
氧化作用
Oxidation
还原作用
Reduction
脱卤素反应
Dehalogenation
水解作用
Hydrolysis
11
一、氧化反应(Oxidations)
药物代谢中的氧化反应包括失去电子、氧化反 应、脱氢反应等,是在CYP-450酶系、单加氧 酶、过氧化物酶等酶的催化下进行的反应。
3
一、细胞色素P-450酶系
细胞色素P-450酶系是主要的药物代谢酶系,在药物代 谢、其他化学物质的代谢、去毒性中起到非常重要的作 用。 CYP-450存在于肝脏及其他肝脏外组织的内质网中,是 一组血红素耦联单加氧酶,需辅酶NADPH和分子氧共 同参与,主要进行药物生物转化中的氧化反应(包括失 去电子、脱氢反应和氧化反应)。
化学反应机理和反应中间体

化学反应机理和反应中间体化学反应机理是指描述化学反应中各个步骤和反应物之间的分子转变及其速率的过程。
它提供了关于反应物如何转化为产物的详细描述,并且揭示了反应发生的路径和中间产物的形成。
对于任何化学反应,我们都可以通过观察反应速率来推断反应机理。
反应速率是指单位时间内反应物浓度的变化量。
从反应速率的变化趋势可以推断出反应机理中的步骤数以及每个步骤的速率限制步骤。
根据速率限制步骤的不同,反应机理可以分为单步反应和多步反应。
在单步反应中,反应物直接转化为产物,只有一个速率限制步骤。
多步反应则包含多个中间产物和多个速率限制步骤。
反应中间体是指在反应过程中生成但又不是最终产物的化合物。
它们是反应机理中的关键组成部分,对于理解反应机理和预测反应产物的形成具有重要意义。
通常情况下,反应中间体不稳定,往往只在反应特定阶段中出现。
它们通过化学键的断裂和形成来参与反应过程,最终转化为最终产物。
中间体的生成和消失是一个动态平衡过程。
通过研究反应中间体的结构和性质,可以深入理解反应机理中每个步骤的细节。
举例来说,酸催化醇的脱水反应是一个典型的多步反应。
在这个反应中,醇首先与酸发生质子化反应,生成醇的质子化中间体。
然后,这个质子化中间体通过失去水分子的方式发生脱水反应,生成烯烃产物。
这个反应过程涉及到中间体的形成和消失,其中质子化中间体在整个反应过程中发挥关键作用。
需要注意的是,反应机理和反应中间体的研究不仅对于学术研究有着重要意义,也在工业生产中具有重要应用价值。
了解反应机理和反应中间体可以帮助我们优化反应条件,提高产物收率和选择性,从而实现高效的化学合成过程。
总结起来,化学反应机理是描述化学反应的详细步骤和反应物之间的转化过程,而反应中间体是在反应过程中生成的但不是最终产物的化合物。
研究反应机理和反应中间体对于理解化学反应的本质、优化反应条件和提高产物收率具有重要意义。
有机化学实验-反应与制备

76%64% 第三章 反应与制备一、 氧化反应与应用1、氧化反应化学反应中,凡失去电子的反应称为氧化反应(Oxidation Reaction)。
有机化合物的氧化反应表现为分子中氢原子的减少或氧原子的增加。
在有机合成中,氧化反应是一类重要的单元反应,通过氧化反应,可以制取许多含氧化合物,例如醇、醛、酮、酸、酚、醌以及环氧化物等,应用十分广泛。
工业上常以廉价的空气或纯氧作氧化剂,但由于其氧化能力较弱,一般要在高温、高压的条件下才能发生氧化反应;实验室中常用的氧化剂有KMnO 4、Na 2Cr 2O 7、HNO 3等。
这些氧化剂氧化能力强,可以氧化多种基团,属于通用型氧化剂。
以KMnO 4作氧化剂,在不同的介质中,反应结果一样。
KMnO 4在中性或碱性介质中进行氧化时,锰原子的价态由+7下降为+4,生成二氧化锰,它不溶于水而被沉淀下来,在这个过程中,平均1mol 高锰酸根释放出1.5mol 原子氧:2KMnO 4 + H 2O 2MnO 2↓+ 2KOH + 3[O]在强酸性介质中,锰原子的价态则由+7降至+2,形成二价锰盐,平均1mol 高锰酸根释放出2.5mol 原子氧:2KMnO 4 + 3H 2SO 4 2MnSO 4↓+ 2K 2SO 4 + 3H 2O + 5[O]例如,在碱性条件下,如果将1mol 乙苯氧化为苯甲酸,则需要4molKMnO 4:相对来说,KMnO 4在中性介质中的氧化反应要温和一些,适合于由烯烃制备邻二醇:CH 3(CH 2)7CH=CH(CH 2)7COOH CH 3(CH 2)7CH ─CH(CH 2)7COOH在碱性介质中,KMnO 4可以将伯醇或醛氧化为相应的酸,也可以用来氧化芳烃上的侧链。
CH 3CHCH 2OH CH 3CHCOOHCH 2CH 3 COOH + 6[O] + CO 2 + 2H 2O KMnO 4,H 2O 0~10℃ OH OH KMnO 4,OH - CH 3 CH 3 COCH 3 CH 3 COOH COOH KMnO 4,OH -KMnO 4在酸性介质中的氧化反应常在25%以上的H 2SO 4溶液中进行。
有机化学第3章课后习题答案
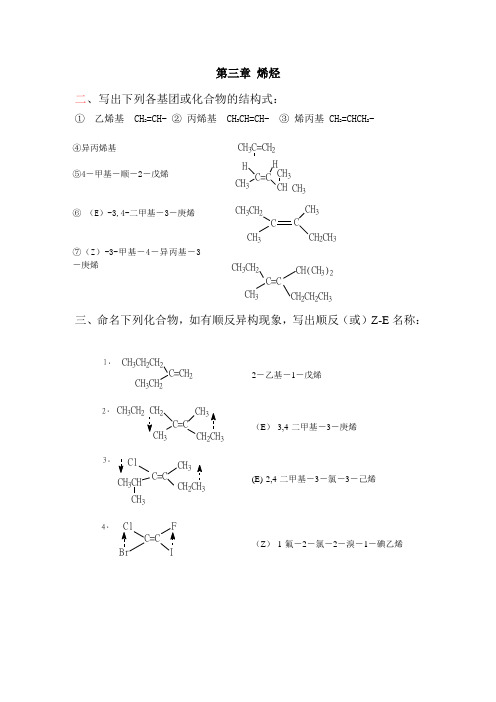
第三章烯烃二、写出下列各基团或化合物的结构式:①乙烯基 CH2=CH- ②丙烯基 CH3CH=CH- ③烯丙基 CH2=CHCH2-CH3C=CH2C=CCH3CHCH3CH3H HCH3CH2CH3CH3C CCH2CH3CH3CH2C=CCH3CH(CH3)2CH2CH2CH3三、命名下列化合物,如有顺反异构现象,写出顺反(或)Z-E名称:1.CH3CH2CH2C=CH2CH3CH22.CH3CH2 CH2CH3C=CCH2CH3CH33.ClC=CCH3CH2CH3CH3CHCH34.ClIBr5.6.C=C CH 3CH 2CH 3C 2H 5CH 3HHH 7.nPr i PrC=CEtMeCH38MeC=CBtEt Me五、2,4-庚二烯有否顺反异构现象,如有,写出它们的所有顺反异构体,并以顺反和Z,E 两种命名法命名之。
解:CH 3C=CHH2CH 33C=C HC=CCHCH 3HHCH 3C=C CH 2CH3CH3HCH 2CH 3HH六、3-甲基-2-戊烯分别在下列条件下发生反应,写出各反应式的主要产物:CH 3CH=CCH 2CH 3CH 3H 2/Pd -CCH 33CH 2CHCH 2CH 33CH CCH 2CH 3Br OHCH 33CHCCH 2CH 3CH 3Cl Cl3CH CCH 2CH 3CH 3OHOH 3CHO+CH 3CCH 2CH 3O3CH OHCHCH 2CH 3CH 33CHCH 3CHCH 2CH 3Br七、乙烯、丙烯、异丁烯在酸催化下与水加成生成的活性中间体分别为: 稳定性顺序 及反应速度顺序是CH 3CH 2+CH 3CH +CH 3CH 3CH 3CCH 3+CH 3CH 2+CH 3CH +CH 3CH 3CH 3CCH 3+<<八、试以反应历程解释下列反应结果:(CH 3)3CCH=CH 2+H 2O H +(CH 3)3CCHCH 3OH +(CH 3)2CCH(CH 3)2OH(CH 3)3CCH=CH 2+H +CH 3CCH 3CH 3CH +CH 3CH 3CCH 33CH +CH 3+H 2OCH 3CCH 3CH 3CH CH 3CH 3CCH 3CH 3CH CH 3OH 2+H+CH 3CCH 3CH 3CHCH3+CH 3COH 2CH 3CH 3CHCH 3CH 3COHCH 3CH 3CHCH 3H 2O+OH九、试给出经臭氧化,锌纷水解后生成下列产物的烯烃的结构:1.CH 3CH 2CHOHCHO CH 3CH 2CH=CH 22.CH 3CH 2CCH 3CH 3CHOOCH 3CH 2CH 3C=CHCH 33.CH 3CHO,CH 3CH 3C O,CH2CHO CHOCH 3CH=CH -CH 2CH 3-CH=CCH 3十、化合物:CH 2OCHClCH 2Ca(OH)OHCH 2ClCH ClCH 2HOClClCH 2CH=CH 2Cl 2+CH 3CH=CH 2nCN[CH ]-CH 2CH 2=CHCNC470NH 3+CH 3CH=CH 2Cl Cl CH 2CHCH 2Cl Cl ClCH 2CH=CH 2C500Cl 2+CH 3CH=CH 2CH 3CH 2CH 2OHB 2H 6+CH 3CH=CH 2CH 3CHCH 3OHH +H 2O +CH 3CH=CH 2CH 3CH 2CH 2BrROOR HBr +CH 3CH=CH 2BrCH 3CHCH 3HBr+CH 3CH=CH 2NaOH,H O十一、某烯烃催化加氢得2-甲基丁烷,加氯化氢可得2-甲基-2-氯丁烷,如果经臭氧化并在锌粉存在下水解只得丙酮和乙醛,写出给烯烃的结构式以及各步反应式:CH 3C CH 3=CHCH 3CH 3C CH 3=CHCH 3CH 3C CH 3=CHCH 3+H 2CH 3CH 3CHCH 2CH 3+HClCH 3CHCH 2CH 3CH 3Cl +O 3CH 3CH 3C O CHCH 3OOZn/CH 3COOH/H 2OCH 3C CH 3O+CH 3CHO十二、某化合物分子式为C 8H 16,它可以使溴水褪色,也可以溶于浓硫酸,经臭氧化,锌粉存在下水解只得一种产物丁酮,写出该烯烃可能的结构式。
化学制药工艺学——第3章

共九十二页
(一)简单 反应 (jiǎndān)
1 单分子反应(fǎnyìng)
➢在基元反应中,若只有一分子参与反应,则称为 单分子反应。
➢一级反应:反应速率与反应物浓度成正比。
-dC/dt= kC
➢包括热分解反应、异构化反应、分子内重排、酮 式与烯醇式互变等
13 共九十二页
(一)简单 反应 (jiǎndān)
二氯甲烷 3.4 41
乙酸乙酯 4.30 77
氯仿
4.4 61
丙酮
5.4 57
二甲基甲酰胺 6.4 153
甲醇
6.6 65
乙二醇
6.9 197
二甲亚砜 7.2 189
水
10.2 100
30
共九十二页
2 溶剂 的分类 (róngjì)
31
共九十二页
质子 性溶剂 (zhìzǐ)
➢质子(zhìzǐ)性溶剂含有易取代氢原子,可与含负离 子的反应物发生氢键结合,发生溶剂化作用; 也可与正离子进行配位结合;或与中性分子 中的氧原子或氮原子形成氢键,或由于偶极 矩的相互作用而产生溶剂化作用。
➢ 一般将介电常数(ε)在15以上的溶剂称为极性溶剂, 介电常数(ε)在15以下的溶剂称为非极性溶剂。
➢ 非质子非极性溶剂又称惰性溶剂(芳烃、脂肪烃)
33
共九十二页
非质子极性溶剂(róngjì)
➢ 醚类(乙醚、四氢呋喃、二氧六环等) ➢ 卤代烃类(氯甲烷、二氯甲烷、氯仿、四氯化碳
等) ➢ 酮类(丙酮、甲乙酮等) ➢ 含氮化合物(如硝基甲烷、硝基苯、吡啶、乙腈、
➢反应过程的外因(反应条件)
反应条件,也就是各种化学反应的一些共同点: 配料(pèi liào)比、反应物的浓度与纯度、加料次 序、反应时间、反应温度与压力、溶剂、催化 剂、pH值、设备条件、反应终点控制、产物分 离与精制、产物质量监控等。
沈阳药科大学高等有机化学课件(胡春版)——第三章 有机反应总论

三、反应机理的研究方法 3. 同位素标记
在机理研究中常常用同位素效应和同位数标记来 确定反应历程。
三、反应机理的研究方法 3. 同位素标记
(1)同位素效应
最常用的是用氘来代替氕,当反应底物中的 一个原子被它的同位素取代后,对它的化学反应 性没有影响,但反应速度有显著的影响。同位素 效应分一级同位素效应和二级同位素效应。 一级同位素效应:在决定速度步骤中与同位 素直接相连的键发生断裂的反应中所观察到的效 应, 其值通常在KH/KD 为2或更高。 二级同位素效应:在反应中与同位素直接相 连的键不发生变化,而是分子中其它化学键变化 所观察到的效应,其值通常在KH/KD = 0.7-1.5范 围内。
N
CN
-
-
O
+
O C-
O N
O C N H
N
hydrolysis ( NH
3
)
H OH O H
+
O H C O
-
N
O C
N O
O hydrolysis COOH + NO 2
-
an acyl nit rit e
Rosenblum Observations (1960)
Observation I: Inst ead of nit rite, molecular nit rogen was a by-product of t he von Richt er reaction. Apparent ly, in t he 1871 von Richt er paper, nitrit e had never been demonstrated to be a by-product. It had been deduced based on stoichiometry considerations. In t he revised Bunnet t mechanism, amm onia and nit rit e are stipulat ed by-products of the von Richter reaction. Ammonia and nit rit e can react t o form ammonium nitrit e which, upon heat ing, decom poses t o give molecular nitrogen and wat er. NH 3 t o an on-going von Richt er reaction, Upon addit ion of t he only molecular nit rogen obt ained contained no nitrogen-15! If t he revised Bunnet t mechanism were correct , the added NH 3 and the expelled NO 2 (from t he last st ep) should have produced N
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、亲核取代反应和取代基的转换
• 在染料中间体中,有许多基团不能直接引 入,需通过芳环上已有取代基的置换或转 换而得到。
X ZZ + X
• 有些芳香族化合物的亲核取代反应发生在 非芳环的原子上,如烃化、芳基化、氨化等 反应。
1.胺化反应 目的: • 在染料分子中引入-NH2,使染料颜色加深; • 提高染料与纤维的亲和力或直接性; • 通过氨基引入其他基团; • 生成杂环结构; • 通过芳胺的重氮化、偶合反应,制备偶氮染 料。
NO2 H2SO4 . SO3
NO2
SO3H
SO3H
35~60℃
160℃ SO3H
+ H2SO4
160℃
蒽醌:反应活泼性差,采用发烟硫酸进行磺化
H2SO4 SO3 O Hg2+ 165℃ O O SO3H H2SO4 SO3 HO3S O SO3H
O
O
H2SO4 SO3 140℃
O SO3H O H2SO4 SO3 HO3S O O SO3H
(1)磺酸基碱熔反应
SO3H NaOH 270℃
NaO3S NH2 NaOH 180℃ NaO3S SO3Na NaO3S SO3Na NaO3S SO3Na NaO NH2 H+ HO NH2
ONa
H+
OH
(2)置换反应
Ar Cl + NaOH Ar ONa H+ Ar OH
3.烷基化反应和芳基化反应
O Cl NH3 H-T, H-P O O O O NH2
O SO3H NH3 H-T, H-P NH2
O
O
OH
NH3 , NH4HSO3 NaOH , NH4HSO3
NH2
(可进行-OH与-NH2的 相互转换)
2.羟基化反应 目的:
• • • • • 在染料分子中引入-OH,使染料颜色加深; 提高染料与纤维的亲和力或直接性; 羟基具有媒染特性; 通过羟基引入其他基团; 含羟基的芳香化合物可作为偶合组分,通过偶合 反应,制备偶氮染料。
(1)硝基还原反应
-NO2 -NH2
还原剂: Fe + HCl H2 /Pt Na2S 较温和的还原剂
OH O2N NO2 Na2S OH O 2N
OH NH2
NO2
NO2
O Cl O NO2 Na2Sx OH Cl
O NH2 O
(2)氨解反应
对于采用硝化—还原法无法引入氨基的化合物,可 采用氨解法。主要是-Cl、―SO3H、―OH的氨 解反应。
HNO3 + H2SO4 NO2+ + H3+O + 2HSO4-
NHCOCH3
混酸
NHCOCH3
30℃ NO2
Cl
混酸
Cl
Cl + NO2
100~110℃ NO2
3.磺化反应 目的: • 引入磺酸基,赋予染料水溶性; • 染料通过磺酸基与蛋白质纤维中的氨基形 成盐键结合; • 通过磺酸基置换成其他基团,如-OH、- NH2、-Cl、-CN等。 磺化试剂:浓硫酸、发烟硫酸、三氧化硫和 氯磺酸。
Ar NH2 + RCO Y Ar NHCOR + HY
三、缩合反应和改变碳骨架的反应
1.非环化的缩合反应
N(CH3)2 + HCHO (CH3)2N CH2
N(CH3)2
N(CH3)2
N(CH3)2
+
CHO
CH
N(CH3)2
CH3
NaClO
CH
CH
+ H2O
2.柯氏反应
Ar ONa + CO2 Ar COONa
反应途径: 1.芳烃环上氢原子的取代反应:如 • 磺化反应 -SO3Na • 卤化反应 -X • 硝化和亚硝化反应 -NO2、-NO
2. 将芳环上已有的取代基转变为另一种取代 基的反应: • 氨基化反应 :
-NO2 -OH -SO3H -NH2 -NH2 -NH2
• N-酰基化反应: -NH2 -SO3H • 羟基化反应:
Ar
NH2 + Ar'
YArNH NhomakorabeaAr'
+ HY
其中Y为-Cl、-Br、-OH、-NH2等。 • 羟基的烷基化和芳基化试剂:醇、卤烷、 硫酸酯。
4.氨基酰化反应 目的: • 提高染料的染色牢度,改变染料的色光和 染色性能; • 降低氨基的活泼性,在染料合成过程中保 护氨基。 酰化试剂:脂肪酸、酸酐、酰氯、酯等。
目的: • 在染料分子中引入烷基和芳基,改善染料 的染色牢度和溶解性能; • 在-OH和-NH2上引入烷基和芳基,使染 料的颜色加深 • 提高染料的耐酸、碱稳定性。
烷基化和芳基化试剂: • 芳烃烷基化试剂:卤烷和烯烃。 • 氨基的烷基化和芳基化试剂:醇、酚、环 氧乙烷、卤烷、硫酸酯和烯烃。
Ar NH2 + R Y Ar NH R + HY
4.杂环系中间体
杂环系中间体的杂原子主要是N、S,少数为O。 常用杂环系中间体有: 吡啶酮类 吡唑啉酮类
CH2 O C N Ar C N
O N H OH
R
苯骈噻酚类
OH C CH S
苯骈噻唑类
N C S NH2
ONa
+ CO2
160~200℃ 5个大气压
ONa COONa
HCl
OH COOH
通过引入-COONa,提高染料的溶解度。
3.环化缩合 (1)苯绕蒽醌
CH2 OH
O Zn [H] O O O _ H2O
CH OH
CH2 OH
H2SO4 105~110℃
H H CH2
CH2
CH
CHO +
H2O
CH
CHO
H CH2
CH
CHO
O
(2)三聚氯氰的合成
3N C Cl △
加压
Cl
C N
N
C N
Cl
C Cl
(3)生成杂环
NH2 NaSCN NH C S NH2 [O] N C S NH2
§3 重要的染料中间体
1.苯系中间体 在苯环中引入羟基、氨基、硝基、磺酸基、 卤素、甲氧基等形成的中间体。 2.萘系中间体 萘酚、萘胺及其磺酸衍生物,各种氨基、羟 基萘磺酸化合物等。 3.蒽醌系中间体 蒽醌及其衍生物
苯系卤化反应:
CH3 Cl2 FeCl3 NO2
CH3 Cl
NO2
蒽醌系卤化反应:
O NH2 Br2 HCl+NaClO O O O NH2 Br
2.硝化反应 目的: • 硝基是染料重要的取代基和发色团,可加深 染料颜色。 • 通过硝基引入其他基团,如氨基。 在染料分子中硝基一般直接连接在芳环上。 硝化剂:硝酸+硫酸 (混酸)
-NH2
-NHCOR
-OH -OH
N N
• 重氮化反应:
-NH2
3.形成杂环及新碳环的反应: (1)采用成环缩合反应,即闭环或环化,主 要形成五元环或六元环 (2)分子重排反应
§2 重要的单元反应 一、亲电取代反应和取代基的引入 1. 卤化反应:主要引入Cl、Br,其中氯化反 应常用于苯系中间体,溴化反应常用于蒽 醌系中间体。 目的: • 改善染料染色性能,提高染色牢度。 • 通过卤素引入其他基团 • 通过卤素进行成环缩合反应
