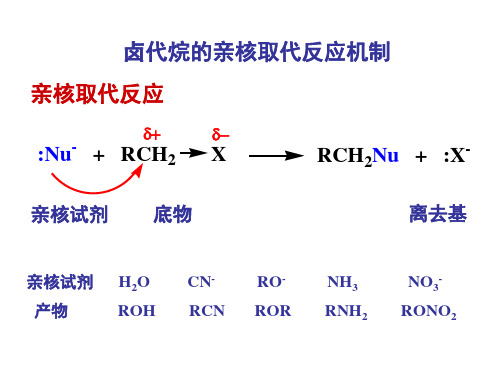
卤代烃的亲核取代反应机制
卤代烃亲核取代反应

7
毕节学院化学系
2. 双分子亲核取代反应 (SN2) 机理及其立体化学
一氯甲烷的水解:
CH3Cl + OH
-
60oC H2O
CH3OH + Cl-
反应速率 = k2[CH3Cl][OH-]
No. 1
[ CH3Cl ] 0.0010
[OH-] 1.0
Rate(mol L-1 s-1) 4.9×10-7
3
C
V = K ( 3 3 C - Br CH )
14
毕节学院化学系
3. 单分子亲核取代反应 (SN1) 机理及其立体化学
SN1反应历程 是一个多步反应
15
毕节学院化学系
3. 单分子亲核取代反应 (SN1) 机理及其立体化学
形成碳正离子时,中心碳原子由原来的sp3杂化的四面体构型转为sp2杂化 三角形的平面构型,三个基团在一个平面上,键角接近120℃,碳上还有 一个空p轨道,与亲核试剂成键。一旦成键,碳原子的结构又从三角形的 平面结构转变为四面体结构。
通过亲核取代反应:
1.可生成许多类型的有机物 2.由卤代烃提供烷基,形成C-C键,增长碳链 3.改变化合物构型,提高化合物生物活性
5
毕节学院化学系
伯卤代烷的水解速率
叔卤代烷的水解
与卤代烷的浓度成正比
只与卤代烷的浓度成正比
与碱的浓度也成正比
与碱的浓度基本没有关系
S N2
6
SN1
毕节学院化学系
2. 双分子亲核取代反应 (SN2) 机理及其立体化学
(c)
SN 2
H3C H
OH
H NHR
CH3
+
第七章 卤代烃 亲核取代反应

CH3CH2CH2CH3
n-C8H17Br + LiAlH4
O
C8H18
第四节 亲核取代反应和消除反应机理
一 亲核取代反应机理 (一)双分子亲核取代反应(SN2)机理
以 CH3Br NaOH-H2O CH3OH + Br- 为例: 反应速率方程: v=k[CH3Br][OH-]
反应机理:
HH HHOO ++ HH CC BBrr
(三)单分子亲核取代反应(SN1)
CH3 CH3 C Br + OH-
CH3
CH3 CH3 C OH + Br-
CH3
V = K (CH3)3 C - Br
第一步:
(H3C)3C Br
第二步:
(CH3)3C+ + OH-
δ+ δ -
(H3C)3C Br
δ+ δ(H3C)3C OH
(CH3)3C+ + Br- 慢
绝对乙醚——无水、无乙醇的乙醚。
RMgX + O2
RMgX+ CO2
ROMgX H2O ROH
RCOOMgX H2O RCOOH H
HHOOHH RR′-′-OOHH
OOHH RR--HH ++ MMgg
XX OORR RR--HH ++ MMgg XX
RRMMggXX ++
RR′C′COOOOHH RR--HH ++ MMgg OOCCOORR′′ XX
第七章 卤代烷 亲核取代反应
第一节 结构、分类和命名
一、结构
X
C
X=F,Cl,Br,I
刑其毅有机化学-卤代烃

C om pound
C H 3C H 2Br C H 3C H 2C H 2Br (C H 3)2C H C H 2Br (C H 3)3C C H 2Br
R elative R ate
100 28 3
0.00001
主要影响因素是位阻效应(steric effect)或称空间效应。 空阻越大,SN2 反应速率越小。
室温
ห้องสมุดไป่ตู้
C H 2=C H (C H 2)n X
加热
(n > 2 )
C H 2= C H -X X
(
)
加热无
2)离去基团——卤原子的影响 C-X键弱,X-容易离去;C-X键强,X-不易离去; X-离去倾向:I- > Br- > Cl- > F-
离去基团(X-)在亲核取代反应中的相对速率
离去基团 F- Cl- Br- I相对速率 10-2 1 50 150
离去基团:带着一对电子离去的分子或负离子。
C 5 H 1 1 C l+N a O HH 2 O C 5 H 1 1 O H +N a C l
C H 3 C H 2 C H 2 O N a + C H 3 C H 2 I
C H 3 C H 2 C H 2 O C H 2 C H 3 + N a I
XRX
H O
H
HO
O
H
H
:X :- H
O
H H
N u : -+ R - L
δ-
δ-
[N u RL ]
卤负离子溶剂化程度:F- > Cl- > Br- > I卤负离子亲核性顺序: I- > Br -> Cl- > F-
卤代烃亲核取代反应
硝酸银醇溶液 室温 卤化银沉淀 +
加热 +
加热 -
练习:将下列卤代烃按与硝酸银醇溶液的反应活 性排列成序: ①1-溴丙烯;②1-苯基-2-溴丁烷; ③3-溴-1-庚烯
(2) 亲核试剂的影响 对SN1反应速率影响不大。 对SN2反应,亲核性越强,反应速度越快。 亲核性:试剂对Cδ+的结合能力(给电子能力) 碱 性:指其对质子的结合能力。
H
CC
H CH3 Cl C2H5
CH3CHCH=CCH2CH3 Br CH3
4-甲基-2-溴-3-己烯
(2E,4R)-4-甲基-4-氯-2-己烯
二、结构和化学性质
• 卤素是卤代烃分子中的官能团。
• 卤代烃的化学性质是由于卤原子的存在所
引起的。
亲核试剂
δ++ δ+
• 亲核取代反应 R βCH αCH2
卤代烃:
饱和卤代烃 不饱和卤代烃 芳香卤代烃
RCH2X
RCH CHX
2、命名
普通命名法:
卤(代)某烃
Br
X
烃基 + 卤素
某 基 卤 CH2 CH CH2Br
俗名
CHCl3
比较复杂的卤代烃一般用系统命名法
CH3I
甲基碘
CH2 CH Br
乙烯基溴
Cl 烯丙基氯
Br
丙烯基溴
Cl
2-甲基-4-氯-1-丁烯
SN1: R X
δ+ δ -
RX
R+ + X-
反应物
过渡态
极性
溶剂的极性越大,对过渡态溶剂化作用越强,
02-卤代烃的亲核取代反应课件

卤烷的化学性质
结构
X
C
X=F,Cl,Br,I
键的极性 C F C Cl C Br C I
化学性质
亲核取代反应
Nu - + R-X
R-Nu + X -
Nu + R-X
R-Nu+ + X -
亲核试剂:带负电荷的试剂(OH-,RO-,CN-,HS-)或 具有未共用电子对的试剂(H2O,ROH,NH3)
2. 卤烃的氰解
• 卤代烷与氰化钠或氰化钾的醇溶液中反应,生成腈。
RX + NaCN
RCN + NaX
• 此反应是非常有用的一个反应,可以增加分子中碳 链的长度,每次可以增加一个碳原子,是增长碳链 的反应之一。
CH3CH2Cl + NaCN
CH3CH2CN + NaCl
3. 卤烃的氨解
• 此反应既可用氨反应,也可用氨的衍生物反应,来 制取伯、仲、叔胺。
1. 卤烃的水解
• 卤代烃与水作用,水解为醇,反应是可逆反应。如:
CH3CH2Br + H2O
CH3CH2OH + HBr
在一般情况下,此反应很慢。为增大反应速率, 提高醇的产率,常加入强碱(氢氧化钠),使生成 的HX与强碱反应,可加速反应并提高了醇的产率。
CH3CH2Br + NaOH
CH3CH2OH + NaBr
• 卤代烃与硝酸银的醇溶液发生亲核取代反应,生成 硝酸酯和卤化银沉淀。可用于卤烃的定性鉴别。
RX + AgNO3
RONO2 + AgX
卤代烃亲核取代反应历程

Substrate
Nucleophile
亲核试剂(Nucleophile): H O
RO
NC
O
H
H
N
H
H
H
两个典型反应为例:
1) H3C Br + OH-
H3C OH + Br-
动力学特征: υ = k [ H3CBr ] [ OH- ], 二级反应;
2) (CH3)3C
Br + OH-
(CH3)3C
HH
(4)瓦尔登转化
E
H
HO
Br
H H
反应历程
图1 SN2 反应势能图
二、亲核反应历程:SN1
(CH3)3C
Br + OH-
(CH3)3C OH + Br-
慢
(CH3)3C-Br
(CH3)3C
Br
(CH3)3C+ + OH 快
(CH3)3C+ + Br
(CH3)3C
OH
ΔE2
ΔE1
慢
H3)3C-Br
SN1
(1)两步反应 (2)单分子反应: υ= K [ R-X ] (3)生成碳正离子中间体 (4)构型翻转 + 构型保持
一切有利于过渡态形成的因素, 均有利于SN2
一切有利于中间体形成的因素, 均有利于SN1
(CH3)3C ++ OH-
δ+
[ (CH3)3C
δ-
OH ]
(CH3)3C + + Br- (CH3)3C OH
(2) 决定反应速率的一步为单分子反应: v = k [ (CH3)3CBr ]
有机化学基础知识点整理卤代烃的消除反应和亲核取代反应

有机化学基础知识点整理卤代烃的消除反应和亲核取代反应有机化学基础知识点整理:卤代烃的消除反应和亲核取代反应有机化学中,卤代烃是一类重要的化合物。
它们包含有一个或多个卤素原子,如氯、溴、或碘,与碳原子相连。
在有机合成和反应中,卤代烃经常被用作起始物质或中间体。
在本文中,我们将重点介绍卤代烃的消除反应和亲核取代反应两个重要的基础知识点。
一、卤代烃的消除反应卤代烃的消除反应是指在适当的条件下,卤素原子与相邻碳原子之间的化学键断裂,从而形成一个双键或三键,并且卤素原子被去除。
常见的消除反应有β-消除反应和氢化物消除反应。
1. β-消除反应β-消除反应是指当卤代烃的邻碳上有一个或多个氢原子时,卤素和一个氢原子同时被去除,形成一个双键。
常见的β-消除反应有氢氧化钠和氨水处理。
例如,当2-溴丙烷与氢氧化钠反应时,产物为丙烯和溴化钠:CH3CHBrCH3 + NaOH → CH2=CHCH3 + NaBr + H2O2. 氢化物消除反应氢化物消除反应是指当卤代烃中没有邻碳上的氢原子时,卤素与一个氢化物离子(如乙醇钠)同时被去除,形成烯烃。
例如,当1,2-二溴乙烷与乙醇钠反应时,产物为乙烯和溴化钠:CH2Br-CH2Br + 2 NaOEt → CH2=CH2 + 2 NaBr + EtOH二、卤代烃的亲核取代反应卤代烃的亲核取代反应是指一个亲核试剂与卤代烃发生反应,亲核试剂的亲电子进攻和取代卤素原子,形成一个新的化合物。
亲核取代反应是有机合成中最常见的反应之一。
1. SN1 亲核取代反应SN1 亲核取代反应是指在两步反应中,第一步生成一个稳定的卤代烷离子,然后在第二步中,亲核试剂攻击离子,取代卤素原子。
SN1亲核取代反应通常发生在三级卤代烷上,存在亲核试剂的浓度低的情况下。
例如,当溴代异丙基反应生成异丙基碳离子,然后氢氧化钠攻击碳离子,形成异丙醇:(CH3)3C-Br + NaOH → (CH3)3C-OH + NaBr2. SN2 亲核取代反应SN2 亲核取代反应是指在一步反应中,亲核试剂直接攻击卤素原子,并取代它。
卤代烃亲核取代和消除反应机理

卤代烃亲核取代和消除反应机理亲核取代反应历程卤代烃的亲核取代反应是⼀类重要反应,由于这类反应可⽤于各种官能团的转变,在有机合成中具有⼴泛的⽤途,因此,对其反应历程的研究也就⽐较重要。
在亲核取代反应中,研究最多的是卤代烃的⽔解,在反应的动⼒学、⽴体化学,以及卤代物的结构,溶剂等对反应速率的影响等都有不少的资料。
根据化学动⼒学的研究及许多实验表明,卤代烃的亲核取代反应是按两种历程进⾏的,即双分⼦亲核取代反应(S N 2反应)和单分⼦亲核取代反应(S N 1反应)。
⼀、双分⼦亲核取代反应(S N 2反应)实验证明:伯卤代烃的⽔解反应为S N 2历程。
RCH 2Br+OH -→RCH 2OH+Br -,v =k [RCH 2Br]·[OH -],v 为⽔解速率,k 为⽔解常数。
因为RCH 2Br 的⽔解速率与RCH 2Br 和OH -的浓度有关,所以叫做双分⼦亲核取代反应(S N 2反应)。
1.S N 2反应机理:亲核试剂(Nu -)从离去基团(L)的背⾯进攻中⼼碳原⼦。
当亲核试剂与中⼼碳原⼦之间逐渐成键时,离去基团与中⼼碳原⼦之间的键逐渐断裂,新键的形成和旧键的断裂是同步进⾏的协同过程,其反应过程如下所⽰。
反应物(sp 3) 过渡态(sp 2)产物(sp 3) 2.S N 2反应的能量变化,可⽤反应进程-势能曲线图表⽰如下:S N 2反应进程中的能量变化3.S N 2反应的⽴体化学:背⾯进攻和构型翻转。
(1)背⾯进攻反应:在S N 2反应中,亲核试剂Nu -可以从离去基团的同⼀边或离去基团的背⾯进攻中⼼碳原⼦(C δ+)。
若从离去基团的同⼀边进攻,则亲核试剂与带负电荷的离去基团(L δ-)之间,除空间障碍外,还因同种电荷相互排斥使反应活化能升⾼,不利于反应的进⾏。
若从离去基团的背⾯进攻,则反应活化能较低,容易形成相对较稳定的过渡态,反应易于进⾏。
(2)构型翻转:在S N 2反应中,中⼼碳原⼦由反应底物时的sp 3杂化转变为过渡态时的sp 2杂化,这时亲核试剂与离去基团分布在中⼼碳原⼦的两边,且与中⼼碳原⼦处在同⼀直线上,中⼼碳原CδδNu C + L -δδNu C + L δδNu C + L -Nu⼦与它上⾯的其他三个基团处于同⼀平⾯内。
卤代烃亲核取代

能量曲线: 溴甲烷水解反应
溴甲烷水解反应的能量曲线
伯卤烷易发生 SN2 反应: 空间阻碍小 CH3
叔卤烷: CH3-C-Br : 空间阻碍大(立体效应): 为主 CH3 烷基对α-C 的供电诱导效应(电子效应)
故不易发生 SN2 反应 ,(易 SN1)
SN2 特点: 速度取决于卤代烷与亲核试剂浓度,一步完成, 构型翻转. 反应决定于过渡状态是否容易生成.
SN1 反应特点: 速度只决定于卤代烃,两步完成,反应 只取决于第一步中活性中间体正碳离子的是否容易生成, 产物主要为外消旋体,且有正碳离子的重排可能.(两大标 志)
§7-58:亲核取代反应的影响因素
R-X 可表示成 R-L : L : Leaving Group
主要影响因素: R-L 结构,亲核试剂浓度,性质,溶剂 极性等.
因 SN1 或 SN2 都须把 C-X 键拉长断开,只决 定于 C-X 键的键能和极化度.
可极化性 : C-I > C-Br > C-Cl 键能(kcal/mol): 56 < 70 < 84
例 : (CH3)3C-X + H2O C2H5OH (CH3)3C-OH + HX
F Cl Br I 相对速度: 10-5 1 39 99
I > Br > Cl
二: 单分子亲核取代反应历程
② SN1 历程 : 叔丁基溴水解
(CH3)3C-Br + OH-
(CH3)3C-OH + Br-
速度 V = k [(CH3)C-Br] 一级反应: 只与卤代烃有关
附: V=k [A]a [B]b ,级数 n= a+b ,由实验确定. 对一般反应先确定动力学级数,后确定单,双分子反应, 一般为: 单分子反应---一级;双分子反应----二级.
2. 卤代烃的亲核取代反应机理。

CH3-Cl
甲基氯
(CH3)2CH-Br
异丙基氯
(CH3)3C-Cl
叔丁基氯
一 、卤代烃的分类和命名法
(二) 命名 2. 系统命名法: (1) 选择连有卤原子的碳原子在内的最长的碳链作 为主链,根据其碳数称“某烷”,卤原子作为取代基。 (2) 编号时,要使卤原子和取代基的位次较小。 (3) 命名时,取代基的排列顺序遵循“最低系列规 则”,较优先的基团后列出。
二 、卤代烃的制法
(三)芳环上的氯甲基化
在无水氯化锌的作用下,芳烃与干燥的甲醛 (通常用三聚甲醛代替)和干燥的氯化氢反应,结 果苯环上的氢原子被氯甲基取代。
C6H6+(CH2O)3+HCl
无水ZnCl2 60℃
C6H5CH2Cl+H2O
二 、卤代烃的制法
(四)以醇为原料制备 醇与氢卤酸(HX) ﹑三卤化磷(PX3)﹑亚硫酰氯 (SOCl2)反应生成卤代烃。
五、亲核取代和消除反应机理
常见亲核试剂:H2O 、NH3、 OH-、RO-、 CN-等。 大量实验表明,亲核取代反应(SN)有两种不 同的反应机理:双分子机理 SN2、单分子机 理 SN 1 。
五、亲核取代和消除的反应机理
(一)亲核取代反应机理 1.双分子亲核取代机理(SN2) 在乙醇 - 水溶液中 , 溴甲烷与 HO:-(NaOH 或 KOH) 的反应是SN2 机理。
CH3CH2CHCH3 Br
KOH/乙醇
CH3CH2CH=CH2 + CH3CH=CHCH3
1-丁烯(19%) 2-丁烯(81%)
练习
P151----习题7
四 、卤代烷的化学性质
(三)与金属镁反应-格利雅试剂的生成 卤代烷与金属(锂、钠、镁)反应,生成 金属原子与碳原子直接相连的化合物,称金属 有机化合物,最重要的是有机镁化合物。在干 醚中,卤代烷与金属镁反应,生成烷基卤化镁。
卤代烃亲核取代和消除反应机理

亲核取代反应历程卤代烃的亲核取代反应是一类重要反应,由于这类反应可用于各种官能团的转变,在有机合成中具有广泛的用途,因此,对其反应历程的研究也就比较重要。
在亲核取代反应中,研究最多的是卤代烃的水解,在反应的动力学、立体化学,以及卤代物的结构,溶剂等对反应速率的影响等都有不少的资料。
根据化学动力学的研究及许多实验表明,卤代烃的亲核取代反应是按两种历程进行的,即双分子亲核取代反应(S N 2反应)和单分子亲核取代反应(S N 1反应)。
一、双分子亲核取代反应(S N 2反应)实验证明:伯卤代烃的水解反应为S N 2历程。
RCH 2Br+OH -→RCH 2OH+Br -,v =k [RCH 2Br]·[OH -],v 为水解速率,k 为水解常数。
因为RCH 2Br 的水解速率与RCH 2Br 和OH -的浓度有关,所以叫做 双分子亲核取代反应(S N 2反应)。
1.S N 2反应机理:亲核试剂(Nu -)从离去基团(L)的背面进攻中心碳原子。
当亲核试剂与中心碳原子之间逐渐成键时,离去基团与中心碳原子之间的键逐渐断裂,新键的形成和旧键的断裂是同步进行的协同过程,其反应过程如下所示。
反应物(sp 3) 过渡态(sp 2)产物(sp 3) 2.S N 2反应的能量变化,可用反应进程-势能曲线图表示如下:S N 2反应进程中的能量变化3.S N 2反应的立体化学:背面进攻和构型翻转。
(1)背面进攻反应:在S N 2反应中,亲核试剂Nu -可以从离去基团的同一边或离去基团的背面进攻中心碳原子(C δ+)。
若从离去基团的同一边进攻,则亲核试剂与带负电荷的离去基团(L δ-)之间,除空间障碍外,还因同种电荷相互排斥使反应活化能升高,不利于反应的进行。
若从离去基团的背面进攻,则反应活化能较低,容易形成相对较稳定的过渡态,反应易于进行。
(2)构型翻转:在S N 2反应中,中心碳原子由反应底物时的sp 3杂化转变为过渡态时的sp 2杂化,这时亲核试剂与离去基团分布在中心碳原子的两边,且与中心碳原子处在同一直线上,中心碳原CδδNu C + L -δδNu C + L δδNu C + L -Nu子与它上面的其他三个基团处于同一平面内。
第六章 卤代烃 亲核取代反应.

R-C CR' 炔 上述反应都是由试剂的负离子部分或未共用 电子对去进攻C—X键中电子云密度较小的碳 原子而引起的。
P99
1°加NaOH是为了加快反应的进行,是反 应完全。 2°此反应是制备醇的一种方法,但制一 般醇无合成价值,可用于制取引入OH比 引入卤素困难的醇。
RCH2-X + NaOH
CH3CHCl Ph
OHH2O
CH3CHOH Ph
87% 外消旋 13% 构型转化
较大的外消旋化百分比说明主要发生了SN1反应。 离子对机制解释:
RX
R+X紧密离子对
R+
X-
R+ + X 自由碳正离子
溶剂分离子对
在紧密离子对中R+ 和X -之间尚有一定键连,因此仍保持原 构型,亲核试剂只能从背面进攻,导致构型翻转。 在溶剂分隔离子对中,离子被溶剂隔开,如果亲核试剂介入 溶剂的位置进攻中心碳,则产物保持原构型,由亲核试剂介入 溶剂的背面进攻,就发生构型翻转。当反应物全部离解成离子 后再进行反应,就只能得到外消旋产物。
SN1反应的另一个特点:反应伴有重排。
CH3 CH3-C-CH-CH3 H3C Br
H2O -H
+
H2O
CH3 CH3-C-CH-CH3
+ 重排
SN1 OH CH3- C- CH- CH3 H3C CH3
CH3 C- CH CH3 H3C CH3
+
H3 C
例 (S)-3-甲基-3-溴己烷在水-丙酮中反应, 结果旋光性消失的 实验事实。
3- 甲基 -5- 氯庚烷 3- 氯 -5- 甲基庚烷 × 4- 甲基 -2- 氯己烷
H3C
n-杂环卡宾参与的芳香醛与卤代烃的亲核取代反应及其机理研究

n-杂环卡宾参与的芳香醛与卤代烃的亲核取代反应及其机
理研究
N杂环卡宾(NHCs)是极性反转的有机催化反应中最常用的有机小分子催化剂之一。
NHCs参与的各类反应中,以Stetter反应通常在不对称催化和天然产物、药物中间体合成中起到关键作用而倍受关注,但亲电试剂局限于以不饱和羰基化合物为代表的Michael受体。
NHCs参与的亲核取代反应是NHCs在极性反转的应用中较新型的一类,目前有关的亲核取代反应的报道中底物往往缺乏多样性,或者反应仅限于分子内的亲核取代,或者反应实质上还是属于经典Stetter反应。
在我们研究的NHC参与的亲核取代反应中以卤代烃Michael受体作为亲电试剂,在NHC参与下与芳香醛进行反应,不但拓宽了类反应的底物范围和反应类型而且建立了方便合成各种含乙酮基结构单元的,包括α-芳基酮在内的各种酮类化合物的新方法,该类化合物是重要的医药、香精香料中间体或生物活性分子。
亲核取代反应机理(有机化学初解)

相对速度:
108 45
1.7
1.0
烃基结构对反应历程的影响
叔卤代烷由于容易失去卤素而形成稳定的
正碳离子,所以其亲核取代反应主要按SN1历
程进行;而伯卤代烷则由于-碳原子的空间位
阻较小,主要按SN2历程进行反应;仲卤代烷则
介于二者之间,即两种历程兼而有之,倾向于
哪种历程则取决于具体反应条件。
容易 叔卤代烷
有机化学
卤 代
烃
本章主要内容
卤代烃的分类 卤代烃的命名 卤代烃的物理性质 卤代烃的化学性质 亲核加成反应机理 消除反应机理
卤代烃的分类
按卤素所连接的烃基类型分为:
CH3CH2Cl (氯乙烷) 饱和卤代烃(卤代烷) CH2=CHCl(氯乙烯) 不饱和卤代烃
Clห้องสมุดไป่ตู้
(氯苯)
芳香族卤代烃
在质子溶剂中,一般常见的亲核试剂的亲核能力的次序是:
RS ≈ArS≈ C N >I > NH3(RNH2)> R O ≈ HO > Br > Cl > H2O
溶剂的影响
对于SN1反应: (CH3)3C-Br [(CH3)3C+ ··· Br-] (CH3)3C+ + Br
(过渡态1)
-
H H H H H
C
H
H
H
H
H
C C+ C
C + CH
H H
H
C + CH 2
H
H H
C
+ CH3
H
H
叔正碳离子>仲正碳离子>伯正碳离子>甲基正碳离子
卤代烃亲核取代反应机理演示

卤代烃亲核取代反应机理演示一、卤代烃亲核取代反应简介卤代烃亲核取代反应是一类重要的有机化学反应,其机理主要是由亲核试剂攻击卤代烃而产生的。
在该反应中,卤素原子可以被氢、羟基、氨基等亲核试剂所取代,从而形成新的化合物。
这种反应通常需要在有机溶剂中进行,并需要适当的温度和时间。
二、卤代烃亲核取代反应机理1. 亲核试剂的攻击在卤代烃亲核取代反应中,首先需要有一个具有强亲核性质的试剂来攻击卤素原子。
这个试剂通常是一个带有负电荷或富电子密度的分子,例如羟基离子、氨基离子等。
当这些试剂接近到卤素原子附近时,它们会攻击卤素原子上的δ+电荷,从而形成一个共价键。
2. 形成中间体在经过第一步后,形成了一个新的分子,其中一个原子与卤素原子共享了一个电对。
这个中间体通常不稳定,并且容易发生进一步反应。
在某些情况下,这个中间体可以通过脱离卤素原子上的卤素离子来稳定下来。
在其他情况下,这个中间体可以被其他试剂攻击,从而形成更加复杂的化合物。
3. 形成新化合物在经过第二步后,形成了一个新的化合物。
这个新化合物通常是一个取代了卤素原子的分子。
在某些情况下,这个新分子可能会继续发生反应,并形成其他类型的分子。
三、卤代烃亲核取代反应实例1. 羟基离子与卤代烃反应羟基离子是一种强亲核试剂,在有机化学中广泛应用。
当羟基离子接近到卤素原子附近时,它会攻击卤素原子上的δ+电荷,并形成一个共价键。
随后,羟基离子会从卤素原子上脱离出来,并形成一个新的醇分子。
2. 氨基离子与卤代烃反应氨基离子也是一种常见的亲核试剂,在有机化学中广泛应用。
当氨基离子接近到卤素原子附近时,它会攻击卤素原子上的δ+电荷,并形成一个共价键。
随后,氨基离子会从卤素原子上脱离出来,并形成一个新的胺分子。
四、总结卤代烃亲核取代反应是一种重要的有机化学反应,其机理主要是由亲核试剂攻击卤素原子而产生的。
在该反应中,卤素原子可以被氢、羟基、氨基等亲核试剂所取代,从而形成新的化合物。
卤代烃的亲核取代历程

• 介电常数大的极性溶剂有利于卤烷的离解,反应 有 利于按SN 1历程进行。
SN1反应的特点
• 由以上反应步骤可知SN1反应在以下特点: • ① 单分子反应; • ② 反应分步进行; • ③ 有正碳离子中间体产生; • ④ 影响反应速度的仅是反应物的浓度; • ⑤ 有重排产物产生; • ⑥ -手性碳发生外消旋化。 • 因有正碳离子产生,而正碳离子的特点是会重排成
• SN2反应是一步完成的双分子反应,反应受空间效 应的控制。当C上所连基团的体积较大或亲核试 剂的体积较大时,由于空间阻碍大,反应趋于困难。
这与SN1反应正好相反。有利于SN1反应的结构却不 利于SN2反应。
• SN2反应活性: 伯卤烷 > 仲卤烷 > 叔卤烷
• 叔卤烷发生SN2反应时的空间阻碍较大,反应困难, 而易于进行SN1反应。伯卤烷发生SN1反应时生成的 伯型正碳离子不稳定,易于进行SN2反应。
C3H7
+
C OH
H3C
C2H5
外消旋体
(R)-3-甲基-3-己醇 (S)-3-甲基-3-己醇
正碳离子的结构和相对稳定性
RX
120o
R RC
sp2
R
R+ + X-
RC
空轨道 R R
正碳离子的稳定性顺序: 3o > 2o > 1o > +CH3
CH3
CH3
H3C C+
H3C
CH +
H3C C+H2
C+H3
(CH3)3C---Br
E
(CH3)3C---OH
Ea1
Ea2
(CH3)3C+ +Br-+OH-
卤代烃亲核取代反应

4、被硝酸根(-ONO2)取代
_
5、被烃氧基(-OR)取代
RNu X
H2O NaCN/醇
NaOR'
卤代烃的合成意义
ROH + HX
NaOH
RX
ROH + HX
RCN + NaX H2O/H+ RCOOH
ROR' + NaX Williamson合成混醚
NH3
RNH2 + NH4X 氨ān、胺àn、铵ǎn
变快 变快 不变
1.SN1反应机理
(CH3)3C Br + OH
(CH3)3C OH + Br
υ= K[(CH3)3CBr]
慢
(1) (CH3)3C Br
δδ
(CH3)3C Br
(CH3)3C + Br
慢
sp3
Sp3~sp2
过渡态A
空助效应 sp2
快
(2) (CH3)3C + OH
两侧进攻
δδ
(CH3)3C OH
卤代烃:
饱和卤代烃 不饱和卤代烃 芳香卤代烃
RCH2X
RCH CHX
2、命名
普通命名法:
卤(代)某烃
Br
X
烃基 + 卤素
某 基 卤 CH2 CH CH2Br
俗名
CHCl3
比较复杂的卤代烃一般用系统命名法
CH3I
甲基碘
CH2 CH Br
乙烯基溴
Cl 烯丙基氯
Br
丙烯基溴
Cl
2-甲基-4-氯-1-丁烯
(R)-3-甲基-3-己醇 外
构型保持
消
旋
CH3
有机化学基础知识点整理卤代烃的消除与亲核取代反应

有机化学基础知识点整理卤代烃的消除与亲核取代反应有机化学基础知识点整理:卤代烃的消除与亲核取代反应在有机化学中,卤代烃是一类重要的有机化合物,它们是由一个或多个卤素(如氯、溴、碘等)取代有机骨架上的氢原子而形成的化合物。
卤代烃具有许多重要的反应和应用。
本文将重点讨论卤代烃的消除与亲核取代反应的基础知识点。
1. 卤代烃的消除反应卤代烃的消除反应是指在适当的条件下,通过引入一个或多个还原剂或碱性条件,使卤代烃中的卤素离子(如Cl-、Br-等)脱离有机分子,从而得到一个双键或多重键的反应过程。
常见的卤代烃消除反应有:(一)脱卤反应(Dehalogenation)脱卤反应是指通过还原剂作用或碱性条件下,将卤素原子从卤代烃中移除的反应过程。
最常见的脱卤反应是氯代烃的脱氯反应和溴代烃的脱溴反应,其中最典型的脱卤反应是氯代烃的脱氯反应。
脱氯反应的机理可以分为两种类型:亲核脱氯和还原脱氯。
亲核脱氯是指由亲核试剂(如HO-、CN-等)进攻卤素原子,形成亲核取代产物。
还原脱氯是指由还原剂(如金属钠、金属锂等)反应产生亲电负荷,攻击卤素原子,生成亲电取代产物。
脱溴反应与脱氯反应类似,但脱溴反应的反应条件较温和,通常需要溶剂和催化剂的存在。
(二)脱卤取代反应(Elimination substitution)脱卤取代反应是指卤化烃与碱性条件下(如强碱NaOH)反应,经过脱卤步骤后,再发生亲核取代反应的过程。
这种反应可以通过消除反应和亲核取代反应的竞争来进行选择性的控制。
一般情况下,通过调整反应条件可以实现消除反应或亲核取代反应的倾向性。
2. 卤代烃的亲核取代反应亲核取代反应是指通过一个亲核试剂(如氨、水、醇等)攻击卤代烃的卤素原子,从而取代卤素形成新的有机化合物的过程。
常见的亲核取代反应有:(一)氢氧化反应(Hydrolysis)氢氧化反应是指卤代烃与水或氢氧化物反应,主要形成醇类化合物或醚类化合物。
氢氧化反应可分为酸性水解和碱性水解两种。
卤代烷的亲核取代反应

C+ R
二、卤代烷的消除反应
碱性试剂
H
R C C X
δ-
δ+
KOH
加热
R
C
C
+ HX
卤代烷与NaOH, KOH醇溶液共热,可脱去一分 子HX而生成烯烃,这种类型的反应叫做消除反应。
β
H
CH3CH CH CH2 Br H
β
KOH 醇
CH3CH CHCH3 + KBr + H2O
第5章 卤代烃
(halohydrocarbon)
烃分子中氢原子被卤素取代生成的化合物。
通式:R-X 天然存在的少,多人工合成。 商品卤代烃超过15000种。 用途:溶剂、有机化工原料、制冷剂、杀虫剂等。 海洋生物(如海藻、海绵及软体动物)产生的某些 卤化物,具有抗菌和抗肿瘤活性,或用作为自身防卫 剂,也成为寻找研究新药的先导化合物。
H
H C H
+
Cl
–
= 1.9 D
第三节
化学反应
一、卤代烷的亲核取代反应
R C X + OH R C OH + X
R C X + CN
R C CN + X R C COOH
R C X + RO
R C OR + X
R C X + NH3
R C NH2 + X
12
反应特点:卤代烃-碳有正电荷,受负电荷的(如 OH-)或含电子对的试剂(如NH3)进攻,试剂与-碳 成共价键,卤素离去。
1、 消除反应的取向 [扎依切夫(Saytzeff)规则] 卤代烷脱卤化氢时,主要是从含氢少的β碳原 子上脱去氢原子。或者说生成烃基较多的烯烃。
卤代烃的亲核取代反应机制综述
CH3Br
+
υ
HO
CH3OH + Br
-
= k [ CH3 Br ] [ HO- ]
SN2 反应机制
δ+δ-
过渡态
H HO C H H Br
氯甲烷的水解反应动画
构型相反 • 瓦尔登转化
SN2反应的能量变化曲线
H HO C Br H H
OH C CH3 CH2CH2CH3 CH2CH3
H3C
+
CH3 C
CH2CH2CH3 CH2CH3
OH +
A
OHCH3 C OH
CH2 CH3 CH2 CH2 CH3
S
构型转化
制作:邓健 出版:人民卫生出版社 10
SN1反应的特点:
①属于单分子反应。 ②反应分两步进行,决定步骤是活泼中间体-正碳 离子的形成。 ③产物构型外消旋化。
(CH3)3C
Br
(CH3)3C+ + Br叔丁基正碳离子
过渡态A
第二步
(CH3)3C + OH
+ -
快
+
-
(CH3)3C OH 过渡态B
(CH3)3C OH
叔丁基溴水解反应动画
SN1反应的能量变化曲线
上页
下页
首页
SN1反应立体化学
R
C CH3CH2CH2 CH3CH2 Br
Br
反应动画
R
构型保持
-
SN2
E CH3Br + OH-
活化能
CH3OH + Br反应进程
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3Br
+
υ
HO
CH3OH + Br
-
= k [ CH3 Br ] [ HO- ]
SN2 反应机制
δ+δ-
过渡态
H HO C H H Br
氯甲烷的水解反应动画
构型相反 • 瓦尔登转化
SN2反应的能量变化曲线
H HO C Br H H
卤代烷的亲核取代反应机制
亲核取代反应
:Nu- + RCH2
亲核试剂 底物
X
RCH2Nu + :X离去基
亲核试剂
产物
H2O
ROH
CNRCN
ROROR
NH3
RNH2
NO3RONO2
亲核取代反应机制
例 RBr + H2O ROH + HBr
卤代烷的水解存在两种反应机制。 (A)双分子亲核取代反应(SN2)
OH C CH3 CH2CH2CH3 CH2CH3
H3C
+
CH3 C
CH2CH2CH3 CH2CH3
OH +
A
OHCH3 C OH
CH2 CH3 CH2 CH2 CH3
S
构型转化
制作:邓健 出版:人民卫生出版社 10
SN1反应的特点:
①属于单分子反应。 ②反应分两步进行,决定步骤是活泼中间体-正碳 离子的形成。 ③产物构型外消旋化。
(CH3)3C
Br
(CH3)3C+ + Br叔丁基正碳离子
过渡态A
第二步
(CH3)3C + OH
+ -
快
+
-
(CH3)3C OH 过渡态B
(CH3)3C OH
叔丁基溴水解反应动画
SN1反应的能量变化曲线
上页
下页
首页
SN1反应立体化学
R
C CH3CH2CH2 CH3CH2 Br
Br
反应动画
R
构型保持
-
SN2
E CH3Br + OH-
活化能
CH3OH + Br反应进程
上页
下页
首页
•SN2反应的立体化学 例:2-溴丁烷水解
CH3 H C Br
反应动画
3
+
NaOH
HO
C
H CH2CH3
CH3 CH2
R-2-溴丁烷
S-2-丁醇
• 瓦尔登转化是SN2反应的一个重要标志。
SN2反应历程的特点:
①属于双分子反应。
制作:邓健 出版:人民卫生出版社
12
②反应一步完成。
③反应过程伴随构型转化。
(B)单分子亲核取代反应(SN1)
一些卤代烷的水解反应速率仅取决于卤代烷的浓度
(CH3)3C Br + HO(CH3)3C OH
+
Br
υ = k [ (CH3)3C Br ]
上页
下页
首页
因此,上述反应可认为分两步进行: 第一步
(CH3)3C Br 慢
+ -
