高一化学电子式书写专题训练
陌生化学方程式书写专项练习

班级_________姓名___________一、请写出下列原子的电子式He______ ; Br ______ ; S ______二、请写出下列离子/基团的电子式H3O+ ______ ; N3-______ ; O2- ______ ;CH3- ______ ; -OH______ ; -COOH______ ;三、请写出下列各物质的电子式H2 _____ _ ; N2 ______ ; F2 ____ _ ;HCl_____ _ ; CS2_____ _ ; NaClO_____ _ ; CaC2_____ _ ; NH4H_____ _ ; 一氯甲烷_____ _ ;四、用电子式表示下列物质中化学键的形成过程(1)MgCl2_____ _ ;(2) CCl4 _____ _ ;要求:写出对应情况的离子方程式并注明条件1、用氨水吸收少量二氧化硫2、实验室制氯气3、工业制氯气4、氯气与水的反应5、钠与水反应6、在标准状况下将2.24 L CO2通入1mol/L 100mL NaOH溶液中7、二氧化碳通入饱和碳酸钠溶液中8、苯酚钠溶液中通入少量二氧化碳9、氯化铁溶液中通入硫化氢气体10、FeBr2溶液与等物质的量Cl2反应11、双氧水在酸性条件下氧化亚铁离子12、AgNO3溶液与锌片反应13、碳酸钙溶液与稀硝酸反应14、少量氢氧化钙溶液与碳酸氢钠溶液混合15、碳酸氢镁溶液中加入过量的澄清石灰水16、碳酸氢铵稀溶液中加入过量稀氢氧化钠溶液陌生化学方程式书写专项练习1.(东I)S2Cl2与水反应,有无色刺激性气味气体产生,并有黄色沉淀生成,该反应的化学方程式是。
2.(东I)欲降低废水中重金属元素铬的毒性,可将转化为Cr(OH)3沉淀除去。
工业用电解法来处理含废水。
阳极反应式是Fe-2e-=Fe2+,阴极反应式是2 H+ +2e-=H2↑。
Fe2+与酸性溶液中的反应的离子方程式是,得到的金属阳离子在阴极区可沉淀完全。
电子式练习题有答案

电子式练习题一、选择题1. 下列哪种电子属于主族元素?A. 2s²2p¹B. 3d⁵4s¹C. 3s²3p⁶D. 4f¹A. [He] 2s²2p⁴B. [Ne] 3s²3p⁴C. [Ar] 3d¹⁰4s²D. [Kr] 4d¹⁰5s²A. 碳(C)B. 氮(N)C. 氧(O)D. 氟(F)二、填空题1. 电子式为[Ne] 3s²3p⁴的元素是______。
2. 氢原子的电子式是______。
3. 钠原子失去一个电子后,其电子式变为______。
三、判断题1. 电子式中的方括号表示内层电子排布。
()2. 所有元素的电子式都是相同的。
()3. 电子式中的数字表示电子层数。
()四、简答题1. 请写出氦原子的电子式。
2. 请写出氯离子(Cl⁻)的电子式。
3. 请解释电子式中字母和数字的含义。
五、应用题1. 某元素的电子式为 [Ar] 3d⁶4s²,请推断该元素在周期表中的位置。
2. 已知某元素的电子式为[Xe] 6s²4f¹⁴5d¹⁰,请写出该元素的化学符号。
(1)[Ne] 3s²3p⁶(2)[Ar] 3d¹⁰4s²4p⁶(3)[Kr] 4d¹⁰5s²5p⁶六、匹配题A. [Ne] 3s²3p⁵B. [Ar] 3d¹⁰4s²4p⁶C. [He] 2s²2p⁶D. [Kr] 4d¹⁰5s²5p⁴1. 氯(Cl)________2. 钙(Ca)________3. 氖(Ne)________4. 硒(Se)________七、连线题元素:族:周期:A. 铝(Al)ⅠA族 3周期B. 硫(S)ⅥA族 3周期C. 钾(K)ⅠA族 4周期D. 铁(Fe)Ⅷ族 4周期八、计算题1. 某元素的原子序数为35,请写出其电子式。
书写电子式练习
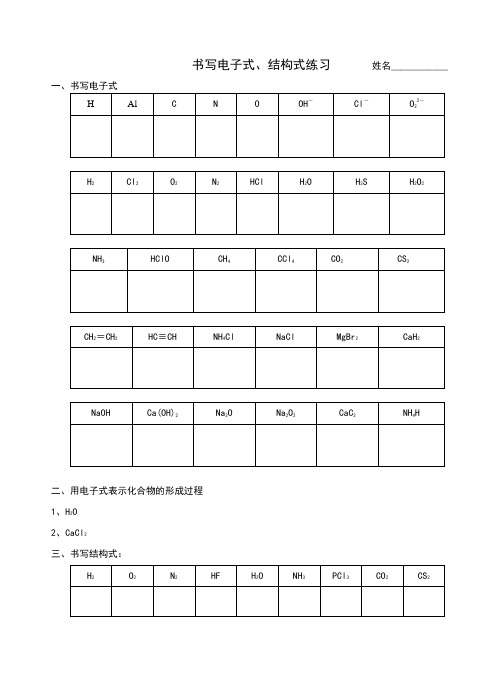
书写电子式、结构式练习姓名____________二、用电子式表示化合物的形成过程1、H2O2、CaCl2三、书写结构式:如何正确书写电子式对于电子式的书写和判断正误是高考试题中常涉及到的一个知识点,现将不同粒子的电子式的书写方法总结如下: 1.原子的电子式①书写方法:首先写出其元素符号,再在元素符号周围用“· ”或“×”标出它的 最外层电子②例子:钠原子 ;镁原子 ;氟原子 2.离子的电子式(1)简单阳离子的电子式①书写方法:用该阳离子的离子符号表示②例子:钠离子 Na + ;镁离子 Mg 2+ ;钡离子 Ba 2+(2)简单阴离子的电子式①书写方法:不但要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:硫离子 ;氟离子 (3)原子团的电子式①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:铵根离子 ;氢氧根离子 3.单质分子的电子式①书写方法:对于以共价键作用结合成的非金属单质分子,他们的电子式由对应原子的电子式组合而成,但同时要表示出共用电子对数;而对其他(金属单质、稀有气体单质等)则一律用原子的电子式表示②例子:氢气分子 ;氧气分子③技巧:可以根据非金属单质中各原子最外层都要达到8电子稳定结构(He 除外),来确定非金属单质中的共用电子对数4.化合物的电子式(1)离子化合物的电子式①书写方法:离子化合物的电子式由阴、阳离子的电子式组合而成, 但相同的离子不能合并②例子:NaCl 的电子式为 ;K 2S 的电子式为 ,(不能写成 ) (2)共价化合物的电子式①书写方法:共价化合物的电子式由对应原子的电子式组成,并要表示出 两原子之间的共用电子对情况②例子:HCl 的电子式为 ;CO 2的电子式: F N H H H H F S 2–Cl Na +Na Mg H H O O K + S 2– K + Cl H C O OK 2+S2– O –H③技巧:一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的 共用电子对数5.用电子式表示物质的形成过程 如:H 2的形成过程 +NaCl 的形成过程 +K 2S 的形成过程 2 +注意:①用“ → ”表示形成过程,不用“=”;②“ → ”左边是形成该物质的所有原子的电子式,相同的原子可以合并,“ → ”右边是该物质的电子式, 相同的原子不可以合并中学化学中常见的电子式大全原子 离子单质分子H H H H Na Cl Cl Na +K S S 2– K + K +形成过程。
高一化学下学期电子式化学键同位素练习题(附答案)

高一化学下学期电子式化学键同位素练习题一、单选题1.13C-NMR (核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构KurtWuthrich 等人为此获得2002年诺贝尔化学奖,下面叙述正确的是( )A.13C与15N有相同的中子数B.13C与C60互为同位素C.15N与14N互为同位素D.15N的核外电子数与中子数相同)元素 a b c d e f g原子的M层电子数 1 2 3 4 5 6 7D.e和f3.下列物质肯定不含离子键的是( )A.氧化物B.酸C.盐D.碱4.在元素周期表中金属与非金属的分界处,可以找到( )A.农药B.催化剂C.半导体材料D.合金5.下列结构示意图所代表的微粒中,最难发生化学反应的是( )A. B. C. D.6.下列化合物的电子式书写正确的是( )A. B.C. D.7.碳有三种同位素: 146C、136C和146C,它们之间不同的是( )A.电子数B.中子数C.质子数D.原子序数8.下列每组物质中含有的化学键类型相同的是( )A.NaCl、HCl、H2O、NaOHB.Cl2、Na2S、HCl、SO2C.HBr、CO2、H2O、CS2D.Na2O2、H2O2、H2O、O39.重水(D2O)是重要的核工业原料,下列说法错误的是( )A.H2O与D2O互称同素异形体B.1H与D互称同位素C.氘(D)原子核外有1个电子D.1H218O与D216O的相对分子质量相同10.下列说法正确的是( )A.形成离子键的阴阳离子间只存在静电吸引力B. HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱C.第三周期非金属元素含氧酸的酸性从左到右依次增强D.元素周期律是元素原子核外电子排布周期性变化的结果11.“嫦娥一号”需完成的四大科学目标之一是探测下列14种元素在月球的含量和分布:K 、Th 、U 、O 、Si 、Mg 、Al 、Ca 、Fe 、 Ti 、Na 、Mn 、Cr 、Gd ,其中属于短周期元素的有( )A.4种B.5种C.6种D.7种12.下列各组比较中不正确的是( )A.稳定性:32NH >H OB.碱性:2NaOH >Mg(OH)C.氧化性:22F >OD.酸性:424HClO >H SO13.下列分子的电子式书写正确的是( )A.氨气B.氮气C.四氯化碳D.二氧化碳14.可以用电子式表示的微粒是( ) A.He B.Ne C.+Na D.2-S15.下列离子符号可表示其电子式的是( )A.+4NH B.2+Ca C.-Cl D.-OH16.现有如下说法:①在水中氢、氧原子间均以化学键相结合②金属和非金属化合形成离子键③离子键是阳离子、阴离子的相互吸引④根据电离方程式:HCl=H ++Cl -,可判断HCl 分子里存在离子键⑤H 2和Cl 2的反应过程是H 2、Cl 2分子里共价键发生断裂生成H 、Cl,而后H 、Cl 形成离子键 上述各种说法正确的是( )A.①②⑤正确B.都不正确C.④正确,其他不正确D.仅①不正确17.关于1H 、2H 、3H 、H +、1H 2、2H 2、T 2 的说法,正确的是( )A.这是氢元素的六种核素B.1H 2、2H 2、T 2 互称为同素异形体C.1H 、2H 、3H 互称为同位素D.1H 、2H 、3H 的化学性质不同18.某同学对一些元素进行排列(表中数字为原子序数),根据元素周期表,下列排列你认为合理的是( ) A. B. C. D.19.下列物质中,含有离子键的是( )A.KClB.H 2C.CO 2D.CH 420.下列电子式书写正确的是( )A. B. C. D.21.在下列各组物质中,化学键类型完全相同的是( )A.2Cl 和2CaClB.22H O 和22Na OC.2CO 和ArD.NaCl 和2Na O22.下列电子式书写正确的是( )A.2Na S 的电子式为B.HCl 的电子式为C.2CaCl 的电子式为D.2Cl 的电子式为23.下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )A.4NH Cl 3NH +HCl ↑↑B.32243NH +CO +H O =NH HCOC.222NaOH+Cl =NaCl+NaClO+H OD.2222322Na O +2CO =2Na CO +O24.23592U 在核工业中有重要应用,U 元素有多种同位素。
高一化学电子式、离子共价化合物专练(附答案)

高一化学电子式、离子共价化合物专练一、单选题1.下列化合物的电子式书写正确的是( )A. B.C. D.2.下列每组物质中含有的化学键类型相同的是( )A.NaCl、HCl、H2O、NaOHB.Cl2、Na2S、HCl、SO2C.HBr、CO2、H2O、CS2D.Na2O2、H2O2、H2O、O33.下列说法正确的是( )A.形成离子键的阴阳离子间只存在静电吸引力B. HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱C.第三周期非金属元素含氧酸的酸性从左到右依次增强D.元素周期律是元素原子核外电子排布周期性变化的结果4.下列分子的电子式书写正确的是( )A.氨气B.氮气C.四氯化碳D.二氧化碳5.现有如下说法:①在水中氢、氧原子间均以化学键相结合②金属和非金属化合形成离子键③离子键是阳离子、阴离子的相互吸引④根据电离方程式:HCl=H++Cl-,可判断HCl分子里存在离子键⑤H2和Cl2的反应过程是H2、Cl2分子里共价键发生断裂生成H、Cl,而后H、Cl形成离子键上述各种说法正确的是( )A.①②⑤正确B.都不正确C.④正确,其他不正确D.仅①不正确6.下列电子式书写正确的是()Na S的电子式为A.2B.HCl的电子式为CaCl的电子式为C.2Cl的电子式为D.27.下列表示电子式的形成过程的式子正确的是( )A.B.C.D.8.下列化学用语正确的是( )A.H O的形成过程:2B.钙原子结构示意图:C.Na O的电子式:22D.铁离子:Fe2+9.下列各组化合物中.化学键类型完全相同的是( )A.C2H6、H2O2、C2H5OHB.HCl、NaCl、MgCl2C.H2O、CO2、Na2O2D.NaOH、NaClO、Na2O10.下列观点正确的是( )A.某单质固体能导电,该单质一定是金属B.某化合物的水溶液能导电,该化合物一定是电解质C.某化合物熔融态能导电,该化合物中一定有离子键D.某纯净物在常温常压下为气体,则组成该物质的微粒一定含共价键Y的最高正价代数和为零,下列说法正确的是( )XY Z WB.Z的最高价氧化物对应水化物的酸性比W的强C.X的简单气态氢化物的稳定性比W的弱D.X分别与Y、Z形成的化合物中化学键类型相同12.短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于ⅠA族,W与X属于同一主族。
高考化学专题练习-用电子式表示简单的离子化合物和共价化合物(含解析)

2019高考化学专题练习-用电子式表示简单的离子化合物和供价化合物(含解析)1.下列用电子式表示化合物的形成过程正确的是()A. B.C. D.2.下列叙述不正确的是()A.用电子式表示HCl的形成过程:B.H0中的原子核内的中子数与核外电子数之差是99C.在空气中加热金属锂:4Li+O22Li2OD.铝热法炼铁:2Al+Fe2O32Fe+Al2O33.下列化学用语使用正确的是()A.6个质子8个中子的碳原子:12CB.MgBr2的形成过程用电子式表示为:C.HClO的电子式:D.H2O的结构式:H﹣O﹣H4.下列用电子式表示物质的形成过程中正确的是()A.Na•+Cl:→[Na]+[•Cl:]﹣B.H2•+•O•→H:O:HC. D.5.下列表示HF、K2O形成过程的电子式正确的是()①HF:②K2OA.①②B.①C.②D.均不正确6.下列用电子式表示物质的形成过程中正确的是()A. B.C. D.7.下列表示电子式的形成过程正确的是()A. B.C. D.8.下列用电子式表示物质的形成过程正确的是()A. B.C. D.9.下列用电子式表示离子化合物的形成过程正确的是()A.B.C.D.10.下列表示电子式的形成过程正确的是()A.B.C.D.11.化学用语是化学学科中最美的语言,下列有关化学用语使用不正确的是()A.钙的元素符号:CaB.NaCl的形成:C.二氧化碳的结构式:O=C=OD.S2﹣的结构示意图:12.下列说法正确的是()A.用电子式表示氯化氢分子的形成过程:B.一定条件下从正反应开始的某可逆反应达到化学平衡时,正反应速率降到最小C.酸与碱发生中和反应时放出的热量叫中和热D.催化剂不但能改变反应速率,也能改变反应进行的限度13.下列表示离子化合物形成过程的电子式正确的是()A. B.C. D.14.下列物质中,属于共价化合物的是A.NaClB.Na2OC.CaCl2D.CO2二、填空题15.用电子式表示下列物质的形成过程:①MgCl2②Na2S③HF④N2⑤CO2⑥CaO.16.用电子式表示下列化合物的形成过程(1)H2S________;(2)MgF2________17.按要求完成下列各题:(1)用电子式表示Mg Cl2的形成过程________.H2O的电子式为________(2)质量相同的H2O和D2O所含质子数之比为________.(3)利用如图装置采用适当试剂可完成某探究实验,并得出相应实验结论.请根据相关信息回答:①为了证明元素的非金属性强弱是S>C>Si.你认为各物质应该是:甲为________;乙为________;丙为________.(已知乙中有气泡产生,丙中有白色沉淀)②如果甲为水,乙为Na2O2粉末,丙为H2S的饱和水溶液.实验中观察到丙中生成淡黄色沉淀.说明元素O、S非金属性强弱为________18.用电子式表示MgF2的形成过程________.19.用电子式表示下列化合物的形成过程:CaF2:________NH3:________.20.用电子式表示下列物质的形成过程:MgCl2________K2O:________H2O________HCl:________.三、综合题21.金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca,并含有3.5%(质量分数)CaO.(1)Ca原子结构示意图________(2)Ca与最活跃的非金属元素A形成化合物D,D的沸点比A与Si形成的化合物E的沸点________(填高或低),用电子式表示D的形成过程________(3)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n.则M位于元素周期表中的位置是:________(4)取1.6g钙线试样,与水充分反应,生成224ml H2(标准状况),再向溶液中通入适量的CO2,最多能得到CaCO3________g22.用电子式表示下列化合物的形成过程(1)H2S________;(2)MgF2________.答案解析部分一、单选题1.下列用电子式表示化合物的形成过程正确的是()A. B.C. D.【答案】C【考点】用电子式表示简单的离子化合物和共价化合物的形成【解析】【解答】解:A.二氧化碳是氧原子和碳原子之间通过共价键形成的共价化合物,形成过程为:,故A错误;B.硫化钠是硫离子和钠离子之间通过离子键形成的离子化合物,形成过程为:,故B错误;C.H2O为共价化合物,各原子达到稳定结构,用电子式表示形成过程为,故C正确;D.四氯化硅中所有原子最外层都满足8电子稳定结构;用电子式表示四氯化硅的形成过程为:,故D错误;故选:C.【分析】A.二氧化碳是氧原子和碳原子之间通过共价键形成的共价化合物,存在C=O;B.硫化钠为离子化合物,2个钠离子不能合写;C.水为共价化合物,氧原子与两根氢原子分别共用1对电子;D.四氯化硅中氯原子最外层有8个电子.2.下列叙述不正确的是()A.用电子式表示HCl的形成过程:B.H0中的原子核内的中子数与核外电子数之差是99C.在空气中加热金属锂:4Li+O22Li2OD.铝热法炼铁:2Al+Fe2O32Fe+Al2O3【答案】B【考点】用电子式表示简单的离子化合物和共价化合物的形成【解析】【解答】A.HCl为共价化合物,以共用电子对成键,用电子式表示HCl的形成过程为,故A正确;B.H0中的原子核内质量数为166,质子数为67,中子数为199﹣67﹣99,则中子数与核外电子数之差是99﹣67=32,故B错误;C.锂和氧气反应生成氧化锂,方程式为4Li+O22Li2O,故C正确;D.铝比铁活泼,可用铝热法冶炼铁,方程式为2Al+Fe2O32Fe+Al2O3,故D正确.故选B.【分析】A.HCl为共价化合物,以共用电子对成键;B.根据质量数=质子数+中子数,质子数=核外电子数判断;C.锂和氧气反应生成氧化锂;D.铝比铁活泼,可用铝热法冶炼铁.3.下列化学用语使用正确的是()A.6个质子8个中子的碳原子:12CB.MgBr2的形成过程用电子式表示为:C.HClO的电子式:D.H2O的结构式:H﹣O﹣H【答案】D【考点】用电子式表示简单的离子化合物和共价化合物的形成【解析】【解答】A.6个质子8个中子的碳原子,14C,故A错误;B.MgBr2的形成过程用电子式表示为:,故B错误;C.HClO为共价化合物,分子中存在1个氧氢键和1个Cl﹣O键,次氯酸的电子式为:,故C错误;D.1个水分子中含有2个氢氧共价键,结构式为H﹣O﹣H,故D正确;故选D.【分析】A.6个质子8个中子的碳原子质量数14;B.溴化镁为离子化合物;C.HClO为共价化合物,分子中存在1个氧氢键和1个Cl﹣O键;D.水中含有氢氧共价键.4.下列用电子式表示物质的形成过程中正确的是()A.Na•+Cl:→[Na]+[•Cl:]﹣B.H2•+•O•→H:O:HC. D.【答案】C【考点】用电子式表示简单的离子化合物和共价化合物的形成【解析】【解答】A.NaCl为离子化合物,用电子式表示形成过程为,故A错误;B.H2O为共价化合物,O原子达到8电子稳定结构,用电子式表示形成过程为,故B错误;C.硫化钠属于离子化合物,存在电子得失,用电子式表示形成过程为,故C正确;D.HF是共价化合物,不存在电子得失,用电子式表示形成过程为,故D错误.故选C.【分析】A.氯化钠属于离子化合物,存在电子得失,氯离子电子数不正确;B.水中O原子周围8个电子;C.硫化钠属于离子化合物,存在电子得失;D.HF是共价化合物,不存在电子得失.5.下列表示HF、K2O形成过程的电子式正确的是()①HF:②K2OA.①②B.①C.②D.均不正确【答案】A【考点】用电子式表示简单的离子化合物和共价化合物的形成【解析】【解答】解:①HF为共价化合物,分子中含有1个H﹣F键,用电子式表示其形成过程为,故①正确;②K2O为离子化合物,阴阳离子需要标出所带电荷,氧离子还需要标出最外层电子,用电子式表示其形成过程为,故②正确;故选A.【分析】①HF为共价化合物,分子中1个氢原子分别与1个F原子共用一对电子形成1个H﹣F键;②氧化钾为离子化合物,电子式中必须标出阴阳离子所带电荷.6.下列用电子式表示物质的形成过程中正确的是()A. B.C. D.【答案】C【考点】用电子式表示简单的离子化合物和共价化合物的形成【解析】【解答】A.NaCl为离子化合物,用电子式表示形成过程为,故A错误;B.HF为共价化合物,用电子式表示形成过程为,故B错误;C.硫化钠是硫离子和钠离子之间通过离子键形成的离子化合物,形成过程为:,故C正确;D.H2O为共价化合物,各原子达到稳定结构,用电子式表示形成过程为,故D错误.故选C.【分析】A.NaCl为离子化合物;B.HF为共价化合物,各原子最外层达到稳定结构;C.Na2S为离子化合物;D.H2O为共价化合物,不存在电子的得失7.下列表示电子式的形成过程正确的是()A. B.C. D.【答案】D【考点】用电子式表示简单的离子化合物和共价化合物的形成【解析】【解答】A.HCl为共价化合物,HCl电子式为,故A错误;B.MgF2为离子化合物,镁离子与两个F﹣形成离子键,其电子式为,故B错误;C.NaBr为离子化合物,其电子式为,故C错误;D.O原子和C原子通过共用电子对形成二氧化碳,所以其形成过程为,故D正确.故选D.【分析】A.氯化氢是共价化合物,原子之间形成共用电子对;B.MgF2电子式中2个氟离子在镁离子两边;C.溴化钠是离子化合物;D.O原子和C原子通过共用电子对形成二氧化碳.8.下列用电子式表示物质的形成过程正确的是()A. B.C. D.【答案】C【考点】用电子式表示简单的离子化合物和共价化合物的形成【解析】【解答】A.氧化钾中氧离子带两个单位正电荷,氧化钾的电子式为,故A错误;B.氟化镁中两个氟离子放在镁离子两边,氟化镁的形成过程为,故B错误;C.氯化钡是离子化合物,氯化钡是由一个钡离子和两个氯离子构成的,所以其形成过程为,故C正确;D.氯化钾是离子化合物,离子化合物中阴离子写出电荷及电性并用“[]”括起来,阳离子写出电荷和电性即可,氯化钾的电子式为,故D错误;故选C.【分析】A.氧化钾是离子化合物,氧化钾中氧离子带两个单位负电荷;B.氟化镁中两个氟离子放在镁离子两边;C.氯化钡是离子化合物,氯化钡是由一个钡离子和两个氯离子构成的;D.氯化钾是离子化合物,离子化合物中阴离子写出电荷及电性并用“[]”括起来,阳离子写出电荷和电性即可.9.下列用电子式表示离子化合物的形成过程正确的是()A.B.C.D.【答案】D【考点】用电子式表示简单的离子化合物和共价化合物的形成【解析】【解答】A.镁原子的电子式表示错误,用电子式表示氮化镁的形成过程为,故A错误;B.溴的电子式应该用溴原子的电子式表示,不能写溴单质的电子式,用电子式表示溴化钠的形成过程为,故B错误;C.氟离子和镁离子通过离子键形成离子化合物氟化镁,其形成过程为,故C错误;D.硫化钠是硫离子和钠离子之间通过离子键形成的离子化合物,形成过程为:,故D正确;故选D.【分析】A.镁原子的最外层的两个电子应该左右两边各一个,不能合并;B.用电子式表示溴化钠的写出过程时,溴应该为溴原子,不能为溴单质;C.镁原子的电子式错误,两个电子应该写在镁原子两边各一个;D.钠原子最外层1个电子,硫原子最外层6个电子,形成的硫化钠为离子化合物,钠离子直接用离子符号表示,硫离子需要标出所带电荷及最外层电子.10.下列表示电子式的形成过程正确的是()A.B.C.D.【答案】D【考点】用电子式表示简单的离子化合物和共价化合物的形成【解析】【解答】解:A.HCl为共价化合物,原子间以共用电子对成键,用电子式表示形成过程为,故A错误;B.MgF2属于离子化合物,Mg最外层两个电子被两个F原子得到,用电子式表示形成过程为,故B错误;C.NaBr属于离子化合物,Na原子最外层电子被Br原子得到,用电子式表示形成过程为:,故C错误;D.CaS为离子化合物,Ca失去电子被S得到,用电子式表示形成过程为:,故D正确.故选D.【分析】A.HCl为共价化合物,原子间以共用电子对成键;B.MgF2属于离子化合物,Mg最外层两个电子被两个F原子得到;C.NaBr为离子化合物,由离子构成;D.CaS为离子化合物,由离子构成.11.化学用语是化学学科中最美的语言,下列有关化学用语使用不正确的是()A.钙的元素符号:CaB.NaCl的形成:C.二氧化碳的结构式:O=C=OD.S2﹣的结构示意图:【答案】D【考点】用电子式表示简单的离子化合物和共价化合物的形成【解析】【解答】A.钙为20号元素,其元素符号为:Ca,故A正确;B.氯化钠为离子化合物,钠离子与氯离子通过离子键结合而成,NaCl的形成过程为,故B正确;C.用短线代替所有共价键即为结构式,二氧化碳分子中含有两个碳氧双键,其结构式为:O=C=O,故C正确;D.硫离子的核电荷数为16,核外电子总数为18,其离子结构示意图为:,故D 错误;故选D.【分析】A.钙为金属元素,元素符号为Ca;B.氯化钠为离子化合物,钠离子与氯离子通过离子键结合而成;C.二氧化碳分子中含有两个碳氧双键,为直线型结构;D.硫离子的核外电子总数为18,最外层达到8电子稳定结构.12.下列说法正确的是()A.用电子式表示氯化氢分子的形成过程:B.一定条件下从正反应开始的某可逆反应达到化学平衡时,正反应速率降到最小C.酸与碱发生中和反应时放出的热量叫中和热D.催化剂不但能改变反应速率,也能改变反应进行的限度【答案】B【考点】用电子式表示简单的离子化合物和共价化合物的形成【解析】【解答】A.氯化氢为共价化合物,氯化氢分子中不存在阴阳离子,用氯化氢的形成过程为:,故A错误;B.可逆反应正向进行时,正反应速率减小,逆反应速率增大,当反应达到平衡状态时,正逆反应速率相等,此时正反应速率最小,故B正确;C.中和热是在稀溶液中强酸与强碱生成1mol水放出的热量,故C错误;D.催化剂同等程度的改变正逆反应速率,所以加催化剂平衡不移动,即不能改变反应进行的限度,故D错误.故选B.【分析】A.氯化氢分子不存在阴阳离子,氯化氢的电子式不能标出所带电荷;B.可逆反应正向进行时,正反应速率减小,逆反应速率增大;C.根据中和热的概念分析;D.催化剂同等程度的改变正逆反应速率.13.下列表示离子化合物形成过程的电子式正确的是()A. B.C. D.【答案】D【考点】用电子式表示简单的离子化合物和共价化合物的形成【解析】【解答】A.该式子中左边不能写成过氧根离子形式,用电子式表示过氧化钠的形成过程为:,故A错误;B.NaF为离子化合物,用电子式表示的形成过程为:,故B错误;C.氟离子和镁离子通过离子键形成离子化合物氟化镁,其正确的形成过程为:,故C错误;D.氯化钙为离子化合物,用电子式表示其形成过程为:,故D正确;故选D.【分析】A.过氧根离子应该写成两个氧原子的形式;B.用电子式表示氟化钠的形成过程时,左边需要用原子及最外层电子表示,不能写成原子或分子;C.MgF2电子式中2个氟离子在镁离子两边;D.氯化钙属于离子化合物,阴阳离子需要标出所带电荷,阴离子还需要表示出最外层电子14.下列物质中,属于共价化合物的是A.NaClB.Na2OC.CaCl2D.CO2【答案】D【考点】用电子式表示简单的离子化合物和共价化合物的形成【解析】【分析】全部由共价键形成的化合物是共价化合物,所以D正确,其余都是离子化合物,答案选D。
北京市2018学年高一化学下册 1.3.2 专题:电子式的书

1-3-2 专题电子式的书写及判断课时测试(测试时间:30分钟满分100分)姓名:班级:得分:一、选择题(本题包括10小题,每小题6分,共60分)1.下列电子式中错误的是()A.Na+B.C.D.2.下列物质的电子式书写正确的是()A.B.C.D.3.下列物质的电子式书写正确的是()A.NaCl、B.H2S、C.氮气、D.NH4I、4.下列化学用语正确的是()A.H2S的电子式:B.钙原子结构示意图:C.Na2O2的电子式:D.铁离子:Fe2+5.正确掌握化学用语是学好化学的基础,下列有关表述正确的是()A.H、D、T互为同素异形体B.氨分子中的化学键为非极性共价键( )C.NH4Cl的电子式:D.S2-的结构示意图:6.氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列叙述不正确...的是()A.NH4H的电子式为B.NH4Cl的电子式为C.NH4H含有极性共价键和离子键D.NH4H固体投入少量热水中,有两种气体生成7.下列化学用语表示正确的是()A.氯化钙的化学式CaCl B.HCl分子的电子式C.氯化钠的电子式D.氯原子的结构示意图8.下列表达方式正确的是()A.CCl4的电子式:B.MgCl2的电子式:C.S2-的结构示意图:D.中子数为20的氯原子:20Cl9.固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子电子层结构。
则下列有关说法中错误的是()A.1 mol NH5中含有5NA个N-H键(NA表示阿伏加德罗常数的值)B.NH5中既有共价键又有离子键C.NH5的电子式为D.它与水反应的化学方程式为NH5+H2O=NH3·H2O+H2↑10.X元素的1个原子失去2个电子转移到Y元素的2个原子中去,形成离子化合物Z,下列说法中不正确的是()A.Z可以电离B.Z可以表示为XY2C.X形成+2价阳离子D.Z的电子式为二、非选择题(本题包括2小题,共40分)9.(20分)五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构。
课后强化作业:(电子式练习)

课后强化作业:(电子式练习)
一、原子的电子式:
1、原子的电子式书写要求:
2、写出下列原子的电子式:氢原子:锂原子:铍原子:硼原子:
碳原子:氮原子:氧原子:氟原子:钠原子:
镁原子:铝原子:硅原子:磷原子:硫原子:
氯原子:钾原子:钙原子:
二、简单离子的电子式
1、简单阳离子:
书写要求:
写出阳离子的电子式:锂离子:钠离子:镁离子:铝离子
2、简单阴离子:
书写要求:
写出阴离子的电子式:氮离子:氧离子:氟离子:硫离子:氯离子:
三、物质的电子式
1、气体单质分子:氢气:氯气:氧气:氮气:
2、共价化合物分子:氯化氢:水:氨气:甲烷:二氧化碳:
次氯酸:过氧化氢:四氯化碳:
(特别强化)复杂离子:氢氧根离子:氨根离子:过氧根离子:
3、离子化合物:氯化钠:硫化钠:氯化镁;氯化氨:
过氧化钠:氢氧化钠:碳化钙:
四、写出下列物质的形成过程:
氯气:
氯化氢:
氯化钠:
氯化镁:硫化钠:。
高考化学复习《电子式、结构式》练习.docx

高中化学学习材料唐玲出品《电子式、结构式》练习班级姓名1、下列化学用语正确的是A.氯化钠的电子式 B.乙炔的结构式H-C=C-HC.磷原子的结构示意图 D.乙酸的分子式C2H4O22、下列化学用语正确的是A.氯化氢的电子式: B. 镁的原子结构示意图:C.乙酸的结构简式:C2H4O2 D.碳酸钠的电离方程式:Na2CO3=Na++CO32-3、下列化学用语正确的是A.氟化氢的电子式: B.氯原子的结构示意图:C.氯化钠的电离方程式:NaCl=Na++Cl-D.乙醇的结构式:C2H6O4、填写表格:元素符号Na Mg Al O S F Cl原子电子式离子符号离子电子式5、写出下列离子化合物的电子式1:1型:NaCl ;MgO 。
2:1型:Na2O ;K2S 。
1:2型:MgCl2;CaBr2。
其它:Na2O2;NaOH ;NH4Cl 。
6、写出下列共价物质的电子式单质:Cl2;O2;N2。
化合物:HCl ;H2O ;NH3;CH4。
其它:CO2;H2O2;HClO ;CCl4。
7、写出下列物质的分子式、结构式和结构简式甲烷 、 、 ; 乙烯 、 、 ; 乙炔 、 、 ; 苯 、 、 ; 乙醇 、 、 ; 乙醛 、 、 ; 乙酸 、 、 ; 乙酸乙酯 、 、 。
8、下列化学用语正确的是 A .氯化钠的电子式: B .苯的结构简式:C 6H 6C .硅的原子结构示意图:D .硫酸的电离方程式:H 2SO 4=H 2++SO 42-9、下列化学用语正确的是 A .乙烯的最简式:C 2H 4 B .乙醇的结构简式:C 2H 6O C .四氯化碳的电子式: D .臭氧的分子式:O 310、下列化学用语正确的是A .乙烯的结构简式:CH 2CH 2B .乙酸的分子式:C 2H 4O 2C .明矾的化学式:KAlSO 4·12H 2OD .氯化钠的电子式:Na 11、下列说法正确的是A .一个D 2O 分子所含的中子数为8B .NH 3的结构式:C .HCl 的电子式:D .乙酸结构式:C 2H 4O 2· Cl ·· ·· · ··。
高一化学下学期化学键、电子式、元素周期律综合练习题(附答案)

2020年03月06日高一化学下学期化学键、电子式、元素周期律综合练习题学校:___________注意事项: 2、请将答案正确填写在答题卡上第1卷一、单选题↑+2H2O放热且产生气体,可用于冬天石油开采。
下列表示反应中422相关微粒的化学用语正确的是( )A.中子数为18的氯原子:1817Cl B.N2的结构式:N=NC.Na 的结构示意图:D.2H O的电子式:2.下列化学用语中,正确的是( )A.次氯酸的结构式:H-O-ClB.氮气的电子式:C.CO2分子的电子式:O=C=OD.用电子式表示氯化氢分子的形成过程:3.正确掌握好化学用语是学好化学的基础,下列有关表述正确的是()A.硫的原子结构示意图:B.NH4Br的电子式:C.过氧化钠的电子式:D.Be2+中的质子数和电子数之比为2:14.下列说法正确的是( )Na O的电子式为A.22B.氢氧根离子的电子式为:C.HClO的结构式为H—Cl—ONaHSO溶于水只破坏离子键D.45.化学键使得一百多种元素组成了世界的万事万物。
关于化学键的下列叙述中正确的是( )A.离子化合物可能含共价键,共价化合物中可能含离子键B.共价化合物可能含离子键,离子化合物中只含离子键C.构成单质分子的微粒一定含有化学键D.在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用6.下列化学用语书写正确的是( )A.氯离子的结构示意图:B.作为相对原子质量测定标准的碳核素:146CC.氯化镁的电子式::评卷人得分二、填空题① Ne ② HCl ③ P4 ④ H2O2 ⑤ Na2S ⑥ NaOH ⑦ Na2O2 ⑧ NH4Cl ⑨AlCl3请用上述物质的序号填空:(1)不存在化学键的是___________________。
(2)只存在极性共价键的是_______________。
(3)只存在非极性共价键的是_____________。
高一化学元素周期律电子式化学键综合练习(附答案)

2020年03月08日高一化学元素周期律电子式化学键综合练习学校:___________注意事项: 2、请将答案正确填写在答题卡上第1卷一、单选题( ) A.酸性:2434H SO >H PO B.非金属性:Cl>BrC.碱性:2NaOH >Mg(OH)D.热稳定性:233Na CO >NaHCO2.室温时,在容积为a mL 的试管中充满NO2气体,然后倒置在水中到管内水面不再上升时为止;再通入b mL O2,则管内液面又继续上升,测得试管内最后剩余气体为c mL,且该气体不能支持燃烧。
则a 、b 的关系是()A. a=4b+3cB. a=4b+cC. a:b=4:1D. a:b=4:33.原子序数依次增大的元素a 、b 、c 、d,它们的最外层电子数分别为1、6、7、1。
a -的电子层结构与氦相同,b 和c 的次外层有8个电子,c -和d +的电子层结构相同。
下列叙述错误的是( ) A.元素的非金属性次序为c>b>a B.a 和其他3种元素均能形成共价化合物 C.d 和其他3种元素均能形成离子化合物D.元素a 、b 、c 各自最高和最低化合价的代数和分别为0、4、64.短周期元素X 、Y 、Z 、W 在元素周期表中的相对位置如图所示,其中W 原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )A.原子半径:W>Z>Y>XB.最高价氧化物对应水化物的酸性:X>W>ZC.最简单气态氢化物的热稳定性:Y>X>W>ZD.元素X 、Z 、W 的最高化合价分别与其主族序数相等5.a 、b 、c 、d 为原子序数依次增大的短周期主族元素,a 原子核外电子总数与b 原子次外层的电子数相同;c 所在周期数与族数相同;d 与a 同族,下列叙述正确的是( ) A.原子半径:d>c>b>a B.4种元素中b 的金属性最强 C.c 的氧化物的水化物是强碱 D.d 单质的氧化性比a 单质的氧化性强6.下列有关化学用语表示正确的是( )A.质量数为31的磷原子:3115P B.氟原子的结构示意图:C.2CaCl 的电子式:D.明矾的化学式:243Al (SO )7.下列有关电子式的叙述正确的是( ) A.氢、氦、锂原子的电子式分别为、、B.氯原子的电子式为,Cl -的电子式为C.钠离子、镁离子、铝离子的电子式分别为Na +、Mg 2+、Al 3+D.Na 2O 的电子式为,H 2O 的电子式为8.下列说法正确的是( )①含有金属元素的化合物一定是离子化合物②第IA 族和第VIIA 族元素原子化合时,一定形成离子键 ③由非金属元素形成的化合物一定不是离子化合物 ④活泼金属与活泼非金属化合时.能形成离子键 ⑤含有离子键的化合物一定是离子化合物 ⑥离子化合物中可能同时含有离子键和共价键 A.① ② ⑤B.④ ⑤ ⑥C.① ③ ④D.② ③ ⑤9.下列叙述错误的是( )A.带相反电荷离子之间的相互吸引称为离子键B.金属元素与非金属元素化合时,不一定形成离子键C.某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键D.非金属元素原子间也可能形成离子键10.2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。
(2021年整理)书写电子式练习

书写电子式练习编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(书写电子式练习)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为书写电子式练习的全部内容。
书写电子式、结构式练习姓名____________一、书写电子式二、用电子式表示化合物的形成过程1、H2O2、CaCl2三、书写结构式:如何正确书写电子式对于电子式的书写和判断正误是高考试题中常涉及到的一个知识点,现将不同粒子的电子式的书写方法总结如下: 1.原子的电子式①书写方法:首先写出其元素符号,再在元素符号周围用“· ”或“×"标出它的 最外层电子②例子:钠原子 ;镁原子 ;氟原子 2.离子的电子式(1)简单阳离子的电子式①书写方法:用该阳离子的离子符号表示②例子:钠离子 Na +;镁离子 Mg 2+;钡离子 Ba 2+(2)简单阴离子的电子式①书写方法:不但要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:硫离子 ;氟离子 (3)原子团的电子式①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:铵根离子 ;氢氧根离子3.单质分子的电子式①书写方法:对于以共价键作用结合成的非金属单质分子,他们的电子式由对应原子的电子式组合而成,但同时要表示出共用电子对数;而对其他(金属单质、稀有气体单FN H H H H FS2–NaMgO –H质等)则一律用原子的电子式表示②例子:氢气分子 ;氧气分子③技巧:可以根据非金属单质中各原子最外层都要达到8电子稳定结构(He 除外),来确定非金属单质中的共用电子对数4.化合物的电子式(1)离子化合物的电子式①书写方法:离子化合物的电子式由阴、阳离子的电子式组合而成, 但相同的离子不能合并②例子:NaCl 的电子式为 ;K 2S 的电子式为 ,(不能写成 )(2)共价化合物的电子式①书写方法:共价化合物的电子式由对应原子的电子式组成,并要表示出 两原子之间的共用电子对情况②例子:HCl 的电子式为 ;CO 2的电子式:③技巧:一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的 共用电子对数5.用电子式表示物质的形成过程 如:H 2的形成过程 +NaCl 的形成过程 +K S 的形成过程 2 + ClNa + H HK + S2–K + ClH C O OK 2+ S2–H HHHNaClClNa + KSS2– K+K +注意:①用“→ "表示形成过程,不用“=”;②“→ "左边是形成该物质的所有原子的电子式,相同的原子可以合并,“→ "右边是该物质的电子式, 相同的原子不可以合并中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程。
