金属海水腐蚀
我国金属材料的海水腐蚀研究现状

我国金属材料的海水腐蚀研究现状一、本文概述我国金属材料在海洋环境中的腐蚀问题,一直是材料科学、海洋工程和防腐蚀技术等领域的研究热点。
金属材料作为海洋工程、船舶制造、石油开采、海洋资源利用等领域的主要结构材料,其耐蚀性能直接影响到设备的使用寿命和安全性。
因此,深入研究和了解我国金属材料的海水腐蚀现状,对于提升我国金属材料在海洋环境中的使用寿命,降低因腐蚀造成的经济损失,保障海洋工程的可持续发展具有重要意义。
本文旨在全面概述我国金属材料的海水腐蚀研究现状,包括腐蚀机理、影响因素、防护技术和研究进展等方面。
对金属材料在海水中的腐蚀机理进行阐述,包括电化学腐蚀、化学腐蚀和生物腐蚀等。
分析影响金属材料海水腐蚀的主要因素,如材料成分、微观结构、海水成分、温度、流速等。
接着,介绍我国目前在金属材料海水腐蚀防护技术方面的研究进展,包括涂层防护、电化学防护、合金化防护等。
展望金属材料海水腐蚀研究的未来发展趋势和挑战,为我国金属材料在海洋工程领域的应用提供理论支持和技术指导。
二、我国金属材料海水腐蚀研究的发展历程我国金属材料海水腐蚀研究的发展历程可以追溯到上世纪五十年代,那时我国开始着手进行海洋环境的腐蚀研究,以支持海洋工程的发展。
初期的研究主要集中在金属材料的耐蚀性测试和评估,通过对不同金属材料在海水环境中的腐蚀行为进行研究,初步建立了我国金属材料海水腐蚀的基础数据库。
进入八十年代,随着我国海洋工程的大规模建设,海水腐蚀问题日益凸显。
此时,我国的金属材料海水腐蚀研究逐渐深入,开始涉及到腐蚀机理的探索和腐蚀防护技术的研究。
研究者们不仅关注金属材料的耐蚀性能,更开始探索如何通过各种技术手段提高金属材料的耐蚀性,如涂层防护、电化学保护等。
进入二十一世纪,我国金属材料海水腐蚀研究迎来了飞速发展的时期。
随着科学技术的进步,研究者们开始运用先进的测试手段和技术,如电化学测试、表面分析、数值模拟等,对金属材料的海水腐蚀行为进行深入分析。
金属在海水环境中的腐蚀

4.2.1.2 溶解氧 • 海水中溶解氧,是海水腐蚀的重要因素。 • 正常情况下海水表面层被空气饱和; • 氧的浓度随水温一般在(5~10)×10-6cm3/L 范围内变化。 • 由表4-4可见,盐的浓度和温度愈高,氧 的溶解度愈小。
表4-4 氧在海水中的溶解度
4.2.1.3 海水的电化学特点
4.2 金属在海水中的腐蚀
• 海洋占地球表面积70%,海水是自然界中数量最大且 具有腐蚀性的天然电解质。我国海岸线长达18000km, 海域广阔。 • 沿海地区的工厂常用海水作为冷却介质,冷却器的 铸铁管在海水作用下,一般只能使用3~4年; • 海水泵的铸铁叶轮只能使用3个月左右; • 碳钢冷却箱内壁腐蚀速度可达1mm/a以上。 • 海洋开发受到重视,海上运输工具、海上采油平台, 开采和水下输送及储存设备等金属构件受到海水和 海洋大气腐蚀的威胁愈来愈严重; • 研究海洋环境中金属的腐蚀及其防护有重要意义。
6)海洋生物 • 海洋生物在船舶或海上构筑物表面附着形 成缝隙,易诱发缝隙腐蚀。 • 微生物的生理作用会产生氨、CO2和H2S 等腐蚀物质,如硫酸盐还原菌作用产生 S2- ,会加速金属腐蚀。
4.2.3 海水中常用金材料的耐蚀性
• 金属材料在海水中的耐蚀性差别很大; • 钛合金和Ni-Cr合金耐蚀性最好; • 铸铁和碳钢耐蚀性较差。 • 不锈钢的均匀腐蚀速度很小; • 在海水中易产生点蚀。 • 常用金属材料耐海水腐蚀性能表4-6。
1)多数金属,除特别活泼金属镁及其合金外,海水中的腐蚀 过程都是氧去极化过程, 腐蚀速度由氧扩散过程控制。 2)大多数金属(铁、钢、锌等),在海水中发生腐蚀时,阳 极过程的阻滞作用很小, 海水中Cl-离子浓度高,海水中用 增加阳极阻滞方法来减轻海水腐蚀的可能性不大, 添加 合金元素钼, 才能抑制Cl-对钝化膜的破坏作用,改进材 料在海水中的耐蚀性。 3)海水电导率很高, 电阻性阻滞很小, 对海水腐蚀,微观电池 的活性较大, 宏观电池活性也较大。在海水中, 异种金属 接触引起的电偶腐蚀有相当大的破坏作用。如舰船的青 铜螺旋桨可引起远达数十米处的钢船壳体的腐蚀。 4)海水中金属易发生局部腐蚀破坏。如点蚀,缝隙腐蚀, 湍流腐蚀和空泡4.2.1.1 盐类及导电率 • 海水为腐蚀性介质,特点是含多种盐类,盐分 中主要是NaCl,常把海水近似地看作质量分 数为3%或3.5%的NaCl溶液。 • 盐度是指1000g海水中溶解固体盐类物质的总 克数,一般海水的盐度在3.2%~3.75%之间, 通常取3.5%为海水的盐度平均值。 • 海水中氯离子的含量很高,占总盐量的 58.04%,使其具有较大腐蚀性。 • 海水平均电导率为4×10-2S/cm,远超过河水 和雨水的电导率。
钢在海水中的腐蚀产物

钢在海水中的腐蚀产物
钢在海水中的腐蚀产物
钢是一种常用的金属材料,广泛应用于建筑、船舶、桥梁等领域。
然而,当钢材暴露在海水中时,会发生腐蚀现象,产生一些有害的腐蚀产物。
本文将介绍钢在海水中的腐蚀产物及其对环境和人类的影响。
钢在海水中的腐蚀产物主要有铁离子、氢氧化铁、氢氧化铁锈、铁锈颗粒等。
其中,铁离子是最常见的腐蚀产物之一,它会使海水变得浑浊,影响海洋生态系统的平衡。
氢氧化铁和氢氧化铁锈是由铁离子在海水中与氧气反应而产生的,它们会附着在钢材表面,形成一层厚厚的铁锈,导致钢材的腐蚀加剧。
铁锈颗粒则是由氢氧化铁锈脱落而形成的,它们会污染海洋环境,对海洋生物造成危害。
钢在海水中的腐蚀产物对环境和人类都有一定的影响。
首先,它们会污染海洋环境,破坏海洋生态系统的平衡。
铁离子和铁锈颗粒会影响海水的透明度和光照强度,影响海洋生物的生长和繁殖。
其次,它们会加速钢材的腐蚀,缩短钢材的使用寿命,增加维护和更换的成本。
最后,它们会对人类健康造成危害。
铁离子和铁锈颗粒会附着在海洋生物的表面,被人类食用后可能对人体健康造成危害。
为了减少钢在海水中的腐蚀产物对环境和人类的影响,可以采取以下措施。
首先,可以采用防腐涂料或防腐处理等方法来保护钢材表面,减少钢材的腐蚀。
其次,可以加强海洋环境监测和管理,及时发现和处理海洋污染事件。
最后,可以加强公众环保意识教育,提高人们对海洋环境保护的重视程度。
总之,钢在海水中的腐蚀产物是一种有害的物质,对环境和人类都有一定的影响。
为了减少其对环境和人类的危害,需要采取有效的措施来保护海洋环境和人类健康。
海水腐蚀情况讲解

海水腐蚀情况讲解海水腐蚀情况海水腐蚀的原因浸入海水中的金属,表面会出现稳定的电极电势。
由于金属有晶界存在,物理性质不均一;实际的金属材料总含有些杂质,化学性质也不均一;加上海水中溶解氧的浓度和海水的温度等,可能分布不均匀,因此金属表面上各部位的电势不同,形成了局部的腐蚀电池或微电池。
其中电势较高的部位为阴极,较低的为阳极。
电势较高的金属,例如铁,腐蚀时阳极进行铁的氧化;电势较低的金属,例如镁,被海水腐蚀时,镁作为阳极而被溶解,阴极处释放出氢。
当电势不同的两种金属在海水中接触时,也形成腐蚀电池,发生接触腐蚀。
例如锌和铁在海水中接触时,因锌的电势较低,腐蚀加快;铁的电势较高,腐蚀变慢,甚至停止。
海洋环境对腐蚀的影响盐度海水含盐量较高,水中的含盐量直接影响水的电导率和含氧量,随着水中含盐量的增加,水的电导率增加但含氧量却降低。
海水中的盐度并不和NaCI的行为相一致,这是因为其中所含的钙离子和镁离子,能够在金属表面析出碳酸钙和氢氧化镁的沉淀,对金属有一定的保护作用。
河口区海水的盐度低,钙和镁的含量较小,金属的腐蚀性增加。
海水中的氯离子能破坏金属表面的氧化膜,并能与金属离子形成络合物,后者在水解时产生氢离子,使海水的酸度增大,使金属的局部腐蚀加强。
电导率海水中不仅含盐量高,而且其中的盐类几乎全部处于电离状态,这使得海水成为一种导电性良好的电解质。
这就决定了海水腐蚀过程中,不仅微观电池腐蚀的活性大,同时宏观电池的活性也大。
研究表明:随着电导率的增大,微观电池腐蚀和宏观电池腐蚀都将加速。
溶解氧海水溶解氧的含量越多,金属在海水中的电极电位越高,金属的腐蚀速度越快。
但对于铝和不锈钢一类金属,当其被氧化时,表面形成一薄层氧化膜,保护金属不再被腐蚀,即保持了钝态。
此外,在没有溶解氧的海水中,铜和铁几乎不受腐蚀。
(常压下氧在海水中的溶解度如下)(表一)/t7盐的质最1,0Z03*0X54.0010t309.008.36047.7210B.02h096.63金41S.IS206.575.835.525.355.17----30工575L274.954,654.SO1T34酸碱度一般来说,海水的HpH升高,有利于抑制海水对钢铁的腐蚀。
金属海水腐蚀

• 定义
海水腐蚀指金属在海洋环境中遭受腐蚀而 失效破坏的现象
海洋占地球表面积的71%,海水是自然界 中量最大,而且具有很强腐蚀性的天然电解 质
各种海上运输工具、海上采油平台、海 岸设施、军用设施,都可能遭受海水腐蚀
我国沿海工厂常使用海水做为冷却水, 海水泵的铸铁叶轮仅能使用3个月
•海水的组成和性质
➢ 流速
铁、铜等金属存在一个临界流速,超过它, 腐蚀明显加快
但对海水中能钝化的金属,一定的流速能促 进钛、镍合金和高铬不锈钢的钝化和耐蚀性
海水流速很高时,出现了冲刷腐蚀
➢ 生物因素
生物因素对腐蚀影响很复杂。但多数增加了 腐蚀
船舶和海洋设施的保护
(1)材料
低合金海水用钢与碳钢的比较
环境
海洋大气区 飞溅区 潮汐区 全浸区 海泥区
(5)海水中易出现点腐蚀&缝隙腐蚀,在高 速流水中,易产生冲击腐蚀和空蚀
•影响海水腐蚀的因素
➢ 盐度
当盐的浓度超过一定值,氧的溶解度降低,腐蚀速 率下降
➢ pH值
海水一般处于中性,对腐蚀影响不大。在深海中, pH值略有下降,不利于生成保护性碳酸盐
➢ 碳酸盐饱和度
在海水的pH值下,碳酸盐一般达到饱和,易于沉积; 当施加阴极保护时,更易于碳酸盐沉积析出。河口处的 稀释海水,碳酸盐并非饱和,不宜析出形成保护层,腐 蚀增加
➢ 氧含量
氧含量增加,促进腐蚀。波浪和绿色植物的 光合作用提高氧的含量;海洋动物的呼吸作用 及生物分解需要消耗氧,氧含量降低。污染海 水中氧含量可大大下降
➢ 温度
海水温度每升高10℃,腐蚀速率提高约一倍; 但随温度升高,氧含量降低。一般讲,铁、铜 和它们的合金在炎热的环境和季节里,海水的 腐蚀速率要更快些
金属在海水环境中的腐蚀

4.2.1.1 盐类及导电率
• 海水为腐蚀性介质,特点是含多种盐类,盐分 中主要是NaCl,常把海水近似地看作质量分 数为3%或3.5%的NaCl溶液。
• 盐度是指1000g海水中溶解固体盐类物质的总 克数,一般海水的盐度在3.2%~3.75%之间, 通常取3.5%为海水的盐度平均值。
• 微生物的生理作用会产生氨、CO2和H2S 等腐蚀物质,如硫酸盐还原菌作用产生 S2- ,会加速金属腐蚀。
4.2.3 海水中常用金材料的耐蚀性
• 金属材料在海水中的耐蚀性差别很大; • 钛合金和Ni-Cr合金耐蚀性最好; • 铸铁和碳钢耐蚀性较差。 • 不锈钢的均匀腐蚀速度很小; • 在海水中易产生点蚀。 • 常用金属材料耐海水腐蚀性能表4-6。
范围内变化。
• 由表4-4可见,盐的浓度和温度愈高,氧 的溶解度愈小。
表4-4 氧在海水中的溶解度
4.2.1.3 海水的电化学特点
1)多数金属,除特别活泼金属镁及其合金外,海水中的腐蚀 过程都是氧去极化过程, 腐蚀速度由氧扩散过程控制。
2)大多数金属(铁、钢、锌等),在海水中发生腐蚀时,阳 极过程的阻滞作用很小, 海水中Cl-离子浓度高,海水中用 增加阳极阻滞方法来减轻海水腐蚀的可能性不大, 添加 合金元素钼, 才能抑制Cl-对钝化膜的破坏作用,改进材 料在海水中的耐蚀性。
• 海平面至-800m深处,含O逐渐减少并达到最低值;
• 海洋动物要消耗氧气;-800m再降-1000m,溶氧 量又上升,接近海水表面的氧浓度,因为深海水 温度较低、压力较高的缘故。
4)温度 海水T每升高10℃,化学反应速度提高约 10%,海水中金属的腐蚀速度将随之增加。
• 但T升高, 氧在海水中的溶解度下降,每升高10℃, 氧的溶解度约降低20%,使金属的腐蚀速度略有 降低。
海水腐蚀知识点总结

海水腐蚀知识点总结一、海水腐蚀概述海水腐蚀是指海水中所含的各种物质对金属材料产生的侵蚀、腐蚀现象。
海水中除了含有一定量的氯化物之外,还有氯离子、硫酸盐离子、碳酸盐离子等化学物质。
这些化学物质都对金属材料起着不同程度的腐蚀作用,加速了金属材料的腐蚀速度。
海水腐蚀对海洋工程、船舶、海洋资源开发等领域的设备和设施造成了严重的腐蚀损害,因此具有重要的工程实际意义。
二、海水腐蚀的主要因素1.化学因素(1)氯离子腐蚀氯离子在海水中是一种重要的化学物质,它对金属材料的腐蚀作用非常显著。
氯离子对金属材料的腐蚀作用可以通过以下反应进行描述:Fe + 2Cl- → FeCl2 + 2e-随着氯离子浓度的增加,金属表面的腐蚀将会明显增加。
(2)硫酸盐离子腐蚀海水中还含有一定量的硫酸盐离子,它会加速金属材料的腐蚀速度。
例如,在含有硫酸盐离子的海水中,铁材料的腐蚀速度会明显加快。
(3)其它离子腐蚀海水中还含有一定量的碳酸盐离子、硫酸根离子、氢离子等。
这些离子也会对金属材料起着不同程度的腐蚀作用。
2.生物因素海水中有很多生物,它们对金属材料也会产生一定的腐蚀作用。
例如,海水中的藻类、微生物等会在金属表面形成生物膜,加速金属材料的腐蚀。
3.物理因素海水中的温度、氧气含量、PH值等也会对金属材料产生一定的影响。
温度的变化会影响金属的腐蚀速度,氧气含量会影响金属的腐蚀类型,PH值会影响金属的稳定性等。
三、海水腐蚀的类型1.普通腐蚀普通腐蚀也被称为一般腐蚀,是金属材料在海水中受到的最常见的一种腐蚀形式。
它表现为金属表面的均匀腐蚀,通常发生在整个金属表面,形成一定程度的腐蚀坑。
2.局部腐蚀局部腐蚀是指金属表面部分区域的腐蚀。
它包括点蚀、节理蚀、缝隙腐蚀等形式,通常会在局部区域形成较深的腐蚀坑。
3.应力腐蚀应力腐蚀是指金属在海水中受到应力作用而引起的腐蚀。
它主要发生于金属材料受到应力的情况下,通常在应力集中部位发生较为严重的腐蚀。
四、海水腐蚀的防护措施1.合理选材在海水环境下,选择适合的耐腐蚀金属材料非常重要。
(完整版)海水腐蚀情况讲解

海水腐蚀情况海水腐蚀的原因浸入海水中的金属,表面会出现稳定的电极电势。
由于金属有晶界存在,物理性质不均一;实际的金属材料总含有些杂质,化学性质也不均一;加上海水中溶解氧的浓度和海水的温度等,可能分布不均匀,因此金属表面上各部位的电势不同,形成了局部的腐蚀电池或微电池。
其中电势较高的部位为阴极,较低的为阳极。
电势较高的金属,例如铁,腐蚀时阳极进行铁的氧化;电势较低的金属,例如镁,被海水腐蚀时,镁作为阳极而被溶解,阴极处释放出氢。
当电势不同的两种金属在海水中接触时,也形成腐蚀电池,发生接触腐蚀。
例如锌和铁在海水中接触时,因锌的电势较低,腐蚀加快;铁的电势较高,腐蚀变慢,甚至停止。
海洋环境对腐蚀的影响盐度海水含盐量较高,水中的含盐量直接影响水的电导率和含氧量,随着水中含盐量的增加,水的电导率增加但含氧量却降低。
海水中的盐度并不和NaCl 的行为相一致,这是因为其中所含的钙离子和镁离子,能够在金属表面析出碳酸钙和氢氧化镁的沉淀,对金属有一定的保护作用。
河口区海水的盐度低,钙和镁的含量较小,金属的腐蚀性增加。
海水中的氯离子能破坏金属表面的氧化膜,并能与金属离子形成络合物,后者在水解时产生氢离子,使海水的酸度增大,使金属的局部腐蚀加强。
电导率海水中不仅含盐量高,而且其中的盐类几乎全部处于电离状态,这使得海水成为一种导电性良好的电解质。
这就决定了海水腐蚀过程中,不仅微观电池腐蚀的活性大,同时宏观电池的活性也大。
研究表明:随着电导率的增大,微观电池腐蚀和宏观电池腐蚀都将加速。
溶解氧海水溶解氧的含量越多,金属在海水中的电极电位越高,金属的腐蚀速度越快。
但对于铝和不锈钢一类金属,当其被氧化时,表面形成一薄层氧化膜,保护金属不再被腐蚀,即保持了钝态。
此外,在没有溶解氧的海水中,铜和铁几乎不受腐蚀。
(常压下氧在海水中的溶解度如下)(表一)酸碱度一般来说,海水的pH升高,有利于抑制海水对钢铁的腐蚀。
但是海水pH远没有含氧量对付腐蚀的影响大,尽管表层海水pH比深层海水高,但由于表层海水中的植物光合作用,含氧量远比深处海水高,所以表层海水的腐蚀性远比深层海水要强,这与实际的实验结论是一致的。
海水腐蚀原理

海水腐蚀原理
海水腐蚀是指海水对金属、混凝土和其他材料的腐蚀作用。
其主要原理包括以下几个方面:
1. 盐分和水分的作用:海水中含有丰富的盐分和水分,其中的氯离子特别具有强烈的腐蚀性。
当金属暴露在海水中时,水分与氯离子反应并形成酸性物质,从而加速金属的腐蚀。
2. 电位差造成的电化学腐蚀:海水本身含有多种阳离子和阴离子,这些离子在金属表面形成一个微小的电化学体系。
当不同金属或金属与水中其他物质相接触时,会形成电位差,从而引起电化学腐蚀。
例如,在船舶和海洋设施中使用的不同类型的金属接触时,会产生电位差,促使其中一种金属腐蚀。
3. 海水中的氧气:海水中溶解了大量氧气,而氧气是引起金属腐蚀的重要因素。
当金属暴露在海水中时,氧气可以与金属表面形成氧化物层,这将进一步使金属受到氧化腐蚀。
4. 海洋环境条件:海洋环境的恶劣程度也会对海水腐蚀产生影响。
例如,高温、潮湿的气候、海洋生物的存在以及水流的流速等,都会加速金属的腐蚀过程。
综上所述,海水腐蚀是由盐分和水分的作用、电位差引起的电化学腐蚀、氧气的存在以及海洋环境条件等多个因素共同作用所导致的。
这些因素相互影响,加速了金属在海水中的腐蚀速度。
为了减缓海水腐蚀的发生,我们需要在设计和选择材料时考虑到这些因素,并采取相应的防护措施。
海水腐蚀的原理

海水腐蚀的原理
海水腐蚀的原理是由于海水中存在的盐类和其他化学物质,以及海洋环境中的氧气和湿度等因素的作用下,金属材料会发生氧化、腐蚀的过程。
海水中的氯离子特别具有强烈的腐蚀性,能够与金属表面的阳离子发生反应,形成金属离子和氯化物。
当金属与海水接触时,海水中的氯化物会溶解并与金属表面的阳离子发生化学反应。
这种反应会导致金属表面形成氧化物、氢氧化物或氯化物的腐蚀产物,同时还会释放出电子。
这些腐蚀产物会进一步加速金属材料的腐蚀过程,形成更大的腐蚀面积。
此外,海洋环境中的湿度和氧气也会加速金属的腐蚀。
氧气与金属表面的阳离子相互作用,形成氧化物层,从而促进金属腐蚀的发生。
湿度会增加金属表面的氧气含量,使腐蚀过程更为迅速。
总之,海水腐蚀的原理是由于海水中的盐类和化学物质与金属表面的阳离子发生化学反应,形成腐蚀产物,并受湿度和氧气的影响,加速金属材料的腐蚀过程。
海水中钢的腐蚀产物及影响

海水中钢的腐蚀产物及影响海水中钢的腐蚀产物及影响1. 引言海洋中的水含有丰富的盐分和各种化学物质,这使得海水对金属材料具有极强的腐蚀性。
钢作为常用的结构材料之一,在海水环境中会遭受到严重的腐蚀。
本文将探讨海水中钢的腐蚀产物及其对结构材料的影响。
2. 海水中的腐蚀过程海水中的腐蚀主要是电化学腐蚀过程,可以通过氧化还原反应来描述。
当钢与海水接触时,形成了一个复杂的电化学系统,其中包括阳极、阴极和电解质。
钢表面的阳极氧化反应产生了一系列腐蚀产物。
3. 钢的腐蚀产物海水中钢的腐蚀产物主要包括:(1) 氧化铁(Fe2O3): 这是钢腐蚀后的主要产物,形成了钢表面的锈层。
锈层不仅会导致钢材的进一步腐蚀,还会降低钢材的力学性能和耐久性。
(2) 氢氧化铁 (Fe(OH)3): 这是一种沉淀物,常见于腐蚀严重的环境。
它会增加钢的质量,影响钢结构的稳定性。
(3) 氯化物: 海水中含有大量的氯离子,当钢腐蚀时,氯离子会与铁离子结合形成氯化铁。
氯化物的存在加速了钢的腐蚀速度。
4. 钢的腐蚀对材料的影响(1) 强度衰减: 钢在海水中长期暴露会导致腐蚀产物的积累,这会降低钢的强度和刚度。
一旦钢的强度衰减到一定程度,会威胁到结构的安全性。
(2) 耐久性降低: 海水中钢的腐蚀会缩短材料的使用寿命,尤其是在海洋工程和船舶领域。
腐蚀会导致钢材的疲劳和断裂,进而影响结构的正常运行。
(3) 维护和修复成本增加: 海水中钢的腐蚀需要耗费大量经济资源和时间用于维护和修复。
在设计和建造海洋工程等相关结构时,需要考虑腐蚀的影响并采取相应的防护措施。
5. 针对海水腐蚀的防护措施为了减少海洋环境对钢材的腐蚀,可以采取以下防护措施:(1) 使用耐腐蚀的钢材: 铬、镍等金属元素的添加可以提高钢材的耐蚀性。
不锈钢和镀锌钢等材料适用于海洋环境。
(2) 进行防腐涂层: 涂覆一层防腐漆或防腐涂料能够有效隔离海水与钢结构的接触,减少腐蚀的发生。
(3) 电化学保护: 通过施加电流或使用阴极保护系统,可以减缓腐蚀反应的进行,延长钢结构的使用寿命。
我国金属材料的海水腐蚀研究现状

引言:
由于金属材料在海洋环境中的腐蚀问题普遍存在,因此研究金属材料在长周 期海水环境下的腐蚀规律具有重要意义。本次演示重点金属材料在海水环境下的 耐腐蚀性能,通过实验室模拟和现场监测,深入探讨金属材料在海水环境中的腐 蚀机制和防护方法。
材料和方法:
本次演示选取了常见的金属材料如不锈钢、铝合金、铜合金等作为研究对象, 采用实验室模拟和现场监测两种方法进行研究。实验室模拟主要通过人造海水浸 泡实验和电化学腐蚀实验进行,现场监测则通过在海洋环境中安装金属材料样品 并定期取样进行分析。同时,采用了扫描电子显微镜(SEM)
一、我国海洋腐蚀研究概述
我国拥有长达数千公里的海岸线,是世界上重要的海洋大国之一。由于海洋 环境的特殊性质,金属材料在海水中的腐蚀问题尤为严重。据相关资料显示,每 年因腐蚀问题导致的海洋工程结构失效和设备损坏事件频繁发生,给我国的海洋 经济发展带来了巨大的经济损失。
针对这一问题,我国在海洋腐蚀研究方面做出了积极的努力。近年来,我国 在海洋腐蚀机理、耐腐蚀材料的设计与研发、腐蚀防护技术等方面取得了显著的 成果。同时,我国还积极参与国际合作与交流,与世界各国共同推动海洋腐蚀研 究的进步。
二、金属材料海水腐蚀研究现状
1、钢铁材料
钢铁材料是我国应用最为广泛的金属材料之一,其在海水环境中的腐蚀问题 备受。研究表明,钢铁在海水中的腐蚀速率受多种因素影响,如海水的温度、pH 值、溶解氧含量等。目前,针对钢铁材料的海水腐蚀防护技术主要有涂层保护、 电化学保护等。此外,通过改进钢铁材料的成分和加工工艺,也可以提高其耐腐 蚀性能。
3、加强监测与维护:建立健全金属材料的海水腐蚀监测和维护体系,定期 对海洋工程中的金属结构进行检测和维护,确保其安全可靠运行。
4、加强国际合作与交流:积极参与国际金属材料海水腐蚀研究领域的合作 与交流,共享研究成果和经验,提升我国在该领域的国际影响力。
金属的海水腐蚀实验

参考文献
• (1)刘茵琪,孟祥军,冯 岩,李其民,郑晓 军 TB一1 9合金腐蚀性能研究 • (2)田 光 ,魏爱军 ,霍富永等 磁场对金 属腐蚀的实验研究 • (3)翟文杰 ,孙瑜珉等 几种金属副在 NaCl溶液中的抗蚀耐磨性能评价 • (4)张万灵 ,刘建容 ,黄桂桥 E36钢的 海水腐蚀模拟试验研究
材料的加工
试样制备完毕后,先经过砂轮砂磨,把其表面厚厚的黑色氧 化皮磨掉。腐蚀速率测定的试样除了一个端面为工作面外, 其余部分用环氧树脂封装,非实验面部分试样表面依次用 400#、600#、800#、1200#和1600#水砂纸打磨,丙酮 擦净。实验面部分试样表面,用蒸馏水清洗再用水磨砂纸打 磨,打磨顺序为180#、400#、600#、800#、1000#、 1200#和1600#,直到试样的工作表面非常平整光滑,没有 可见的缺陷、划痕;经过酒精、丙酮除油除污,用蒸馏水冲 洗,后用无水乙醇脱水洗净后放置在干燥器内备用。 • 腐蚀速率测定的试样除了一个端面为工作面外,其余部分用 环氧树脂封装。用铜导线分布与非实验面,再用环氧树脂封 装。环氧树脂封装时应一层一层进行,且涂抹均匀。否则环 氧树脂易在干燥过程中发生干裂,造成裂缝腐蚀。
测定方法失重腐蚀速率计算验结束后迅速取出试片并将试片用无水乙醇冲洗后晾干然后用酸洗液10hcl1乌洛托品浸泡清洗完表面的腐蚀产物后用大量去离子水冲洗再依次经无水乙醇丙酮擦拭晾干后放入干燥器中24h后称重
金属的海水腐蚀实验
李思蒙
实验概要
• 316L不锈钢、钛合金、10%铜镍合金和30%铜镍合金
三组实验:
磁场对腐蚀速率的影响的测定
• 实验共分为3组,分别将腐蚀溶液装上试片放在强磁场(牛角 磁铁)、较小磁场(马蹄磁铁)以及无磁场干扰的环境中,通过 对实验前后试样厚度及质量的对比分析,研究磁场对金属腐 蚀速率的影响。实验过程中,过一段时间分别测定3组情况 下腐蚀介质的电导率,分析不同磁场下各溶液介质电导率的 大小与腐蚀速率之问的关系。实验采用全浸泡实验,在温度 一定状态下,通过静态挂片实验得出磁场对金属腐蚀速率的 影响规律。
海水、海洋大气腐蚀特点及防腐
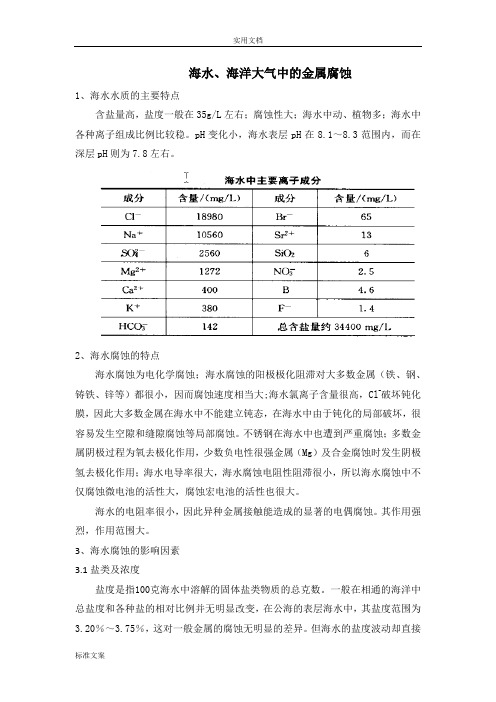
海水、海洋大气中的金属腐蚀1、海水水质的主要特点含盐量高,盐度一般在35g/L左右;腐蚀性大;海水中动、植物多;海水中各种离子组成比例比较稳。
pH变化小,海水表层pH在8.1~8.3范围内,而在深层pH则为7.8左右。
2、海水腐蚀的特点海水腐蚀为电化学腐蚀;海水腐蚀的阳极极化阻滞对大多数金属(铁、钢、铸铁、锌等)都很小,因而腐蚀速度相当大;海水氯离子含量很高,Cl-破坏钝化膜,因此大多数金属在海水中不能建立钝态,在海水中由于钝化的局部破坏,很容易发生空隙和缝隙腐蚀等局部腐蚀。
不锈钢在海水中也遭到严重腐蚀;多数金属阴极过程为氧去极化作用,少数负电性很强金属(Mg)及合金腐蚀时发生阴极氢去极化作用;海水电导率很大,海水腐蚀电阻性阻滞很小,所以海水腐蚀中不仅腐蚀微电池的活性大,腐蚀宏电池的活性也很大。
海水的电阻率很小,因此异种金属接触能造成的显著的电偶腐蚀。
其作用强烈,作用范围大。
3、海水腐蚀的影响因素3.1盐类及浓度盐度是指100克海水中溶解的固体盐类物质的总克数。
一般在相通的海洋中总盐度和各种盐的相对比例并无明显改变,在公海的表层海水中,其盐度范围为3.20%~3.75%,这对一般金属的腐蚀无明显的差异。
但海水的盐度波动却直接影响到海水的比电导率,比电导率又是影响金属腐蚀速度的一个重要因素,同时因海水中含有大量的氯离子,破坏金属的钝化,所以很多金属在海水中遭到严重腐蚀。
盐类以Cl-为主,一方面:盐浓度的增加使得海水导电性增加,使海水腐蚀性很强;另一方面:盐浓度增大使溶解氧浓度下降,超过一定值时金属腐蚀速度下降。
3.2 pH值海水pH在7.2-8.6之间,为弱碱性,对腐蚀影响不大。
3.3碳酸盐饱和度在海水pH条件下,碳酸盐达到饱和,易沉积在金属表面形成保护层。
若未饱和,则不会形成保护层,使腐蚀速度增加。
3.4含氧量海水腐蚀是以阴极氧去极化控制为主的腐蚀过程。
海水中的含氧量是影响海水腐蚀性的重要因素。
金属海水腐蚀

金属海水腐蚀是一种广泛存在的自然 现象,由于海水中含有丰富的溶解氧 和盐分,这些因素促进了金属的腐蚀 过程。
金属海水腐蚀的危害
01
02
03
设备损坏
金属海水腐蚀会导致各种 设备和设施的损坏,如船 舶、码头、石油平台和海 底管道等。
安全隐患
金属海水腐蚀可能引发各 种安全事故,如船舶沉没、 石油泄漏和管道破裂等。
02
金属海水腐蚀的影响因 素
金属材料的种类和特性
金属材料的种类和特性对海水腐蚀的敏感度有显著影响。例如,铁、铜、铝等金 属在海水中容易发生腐蚀,而某些合金或不锈钢则具有较好的耐腐蚀性能。
金属材料的微观结构和表面状态也对腐蚀速率有影响。例如,粗糙的表面或存在 缺陷的金属材料更容易受到腐蚀。
海水的成分和特性
控制温度
通过控制海水温度的方法,减缓金 属的腐蚀速率。
控制流速
通过控制海水的流速,减少对金属 表面的冲刷和磨损,降低腐蚀速率。
04
金属海水腐蚀的监测和 检测方法
物理检测方法
外观检查
通过观察金属表面的变化,如变色、锈迹、裂纹 等,初步判断腐蚀程度。
厚度测量
定期测量金属的厚度,以评估腐蚀造成的损失。
01
合金化
通过在金属中添加合金元素,改 变其成分和结构,提高耐腐蚀性。
02
控制金属的微观结 构
通过控制金属的晶粒大小、相组 成和微观结构,提高其耐腐蚀性 能。
03
选择适当的金属材 料
根据使用环境和腐蚀介质,选择 具有优异耐腐蚀性能的金属材料。
控制环境因素
控制盐度
通过降低海水中盐度的方法,减 缓金属的腐蚀速率。
经济损失
金属海水腐蚀会导致大量 的经济损失,包括设备维 修、更换和事故赔偿等。
海水腐蚀铁的原理

海水腐蚀铁的原理
海水腐蚀铁的原理其实很简单,主要是由海水中的盐分和氧气所引起的。
海水中含有大量的盐分,这些盐分能够与铁表面上的氢氧化物或氧化铁分子结合形成一种称为“盐基”的化合物。
此时,海水与铁表面的盐基会形成一种电化学反应,盐基中的氯离子和铁离子会相互交换,从而使铁表面发生腐蚀。
此外,氧气也是海水腐蚀铁的重要因素之一,它可以在铁表面上形成一层氧化物,阻止铁与海水中的化合物结合。
然而,在氧气供应充足的环境下,这层氧化物会很快被氧气消耗掉,从而使海水中的化合物能够直接与铁表面相互作用。
综合来看,由于海水中含有大量的盐分和氧气,水分子与盐基和铁表面形成电化学反应,因此使得铁表面容易受到海水的腐蚀。
此外,受环境因素的影响,海水腐蚀铁的速度也有所不同,例如水温、盐分、氧气浓度等。
防治海水腐蚀铁的方法有很多种。
常见的三种方法是:一、损伤表面保护法,可以通过添加保护胶层或油漆层来保护铁表面,从而减缓海水腐蚀铁的速度;二、使用不锈钢或耐腐蚀性较强的合金材料来替代铁制品,从而减少海水对铁的腐蚀;三、对铁件进行电镀处理,以增
强铁件的耐蚀性。
总之,了解海水腐蚀铁的原理和防治方法对于我们保护铁制品的安全和延长使用寿命的意义重大。
我们应该注意环境变化的影响,保护铁制品,保护自然环境。
海上腐蚀

海上腐蚀浸入海水中的金属,表面会出现稳定的电极电势。
由于金属有晶界存在,物理性质不均一;实际的金属材料总含有些杂质,化学性质也不均一;加上海水中溶解氧的浓度和海水的温度等,可能分布不均匀,因此金属表面上各部位的电势不同,形成了局部的腐蚀电池或微电池。
电势较高的金属,如铁,腐蚀时阳极进行铁的氧化(阳极被溶解):释放的电子从阳极流向阴极,使氧在阴极被还原 ;氢氧离子经海水介质移向阳极,与亚铁离子生成氢氧化亚铁 ;易与海水中的溶解氧反应生成氢氧化铁。
后者经部分脱水成为铁锈它的结构疏松,性能降低。
电势较低的金属,例如镁,被海水腐蚀时,镁作为阳极而被溶解,阴极处释放出氢。
当电势不同的两种金属在海水中接触时,也形成腐蚀电池,发生接触腐蚀。
例如锌和铁在海水中接触时,因锌的电势较低,腐蚀加快;铁的电势较高,腐蚀变慢,甚至停止。
(腐蚀竞争)工业用的大多数金属,金属状态不稳定,在海水中有转变成化合物或离子态物质的倾向。
但是金和铂等贵金属,金属状态稳定,在海水中不发生腐蚀。
海洋环境对金属腐蚀的影响金属在海水中的腐蚀,影响因素很多,包括化学、物理和生物等因素。
化学因素: ①溶解氧。
海水溶解氧的含量越多,金属的腐蚀速度越快。
但对于铝和不锈钢一类金属,当其被氧化时,表面形成一薄层氧化膜,保护金属不再被腐蚀,即保持了钝态。
此外,在没有溶解氧的海水中,铜和铁几乎不受腐蚀。
②盐度。
海水含盐量较高,其中所含的钙离子和镁离子,能够在金属表面析出碳酸钙和氢氧化镁的沉淀,对金属有一定的保护作用。
河口区海水的盐度低,钙和镁的含量较小,金属的腐蚀性增加。
海水中的氯离子能破坏金属表面的氧化膜,并能与金属离子形成络合物,后者在水解时产生氢离子,使海水的酸度增大,使金属的局部腐蚀加强。
③酸碱度。
用pH值表示。
pH值越小,酸性越强,反之亦然。
海水的pH值通常变化甚小,对金属的腐蚀几乎没有直接影响。
但在河口区或当海水被污染时,pH值可能有所改变,因而对腐蚀有一定的影响。
金属在海洋环境中的腐蚀

金属在海洋环境中的腐蚀随着人类经济、科技的不断发展,海洋经济成为全球经济发展的重要组成部分。
然而,海洋环境中的腐蚀问题一直是海洋工程、海洋装备等领域的重大难题。
海洋环境中的腐蚀不仅会导致海洋工程设施的损坏和失效,还会对海洋生态环境造成严重影响。
因此,研究海洋环境中的腐蚀机理和防腐措施,对于保障海洋经济的可持续发展具有重要意义。
一、海洋环境中的腐蚀机理1.1 海水中的离子海水中含有大量的离子,其中氯离子是最主要的腐蚀因素。
氯离子具有很强的腐蚀性,会与金属表面的氧化物或氢氧化物反应,生成金属离子和水。
这些金属离子会进一步与氯离子结合形成金属氯化物,从而使金属表面发生腐蚀。
1.2 海水中的微生物海水中存在大量的微生物,它们会在金属表面形成一层生物膜。
这些生物膜会吸附海水中的离子和有机物质,形成微生物膜腐蚀环境。
微生物膜中的细菌和藻类可以产生酸、碱、氧化剂等化学物质,从而加速金属的腐蚀。
1.3 海水中的氧气海水中的氧气是金属腐蚀的另一个主要因素。
氧气会与金属表面的氧化物反应,形成金属氧化物。
这些金属氧化物会进一步与氧气反应,形成金属氧化物颗粒,从而使金属表面发生腐蚀。
二、海洋环境中的金属腐蚀类型2.1 统一腐蚀统一腐蚀是最常见的金属腐蚀类型之一。
它是指金属表面整体腐蚀,导致金属表面减薄和损坏。
统一腐蚀通常发生在金属表面暴露于海水中的情况下,尤其是在高温高湿的海洋环境中。
2.2 局部腐蚀局部腐蚀是指金属表面的某一部分发生腐蚀,而其他部分没有发生腐蚀。
局部腐蚀通常是由于金属表面存在缺陷或异物所致,如划痕、裂纹、气泡等。
2.3 应力腐蚀应力腐蚀是指金属在受到应力的情况下发生腐蚀。
应力腐蚀通常发生在金属受到拉伸或弯曲应力的情况下。
在海洋环境中,应力腐蚀通常是由于海水中的氯离子和微生物膜的存在所致。
三、海洋环境中的金属腐蚀防护措施3.1 表面处理表面处理是防止金属腐蚀的重要措施之一。
表面处理可以使金属表面形成一层保护膜,从而防止海水中的离子侵蚀。
为什么海水会引起金属的腐蚀?

为什么海水会引起金属的腐蚀?一、海水成分中的氧气海水是由水和各种溶解的化学物质组成的,其中包括大量的氧气。
海水成分中的溶解氧能与金属表面发生反应,导致金属腐蚀。
当金属暴露在含氧海水中时,氧气会通过吸附、扩散、再反应等过程与金属表面发生化学反应,形成金属氧化物。
金属氧化物是一种不稳定的化合物,会继续与海水中的其他物质发生反应,进一步促进金属的腐蚀。
二、海水成分中的盐分海水中含有大量的盐分,主要是溶解的氯化物、硫酸盐和碳酸盐等物质。
盐分具有很强的腐蚀性,可以直接与金属表面发生反应,导致金属腐蚀。
与盐分接触的金属会发生离子交换,金属的离子会溶解于海水中,释放出电子。
这个过程被称为金属的电化学腐蚀。
金属腐蚀会导致金属表面的质量减少,甚至形成孔洞和裂缝,使金属的强度和性能降低。
三、海水的温度和湿度海水的温度和湿度也会影响金属的腐蚀。
在高温和高湿的环境下,金属腐蚀的速度会更快。
海水中的高温会加速金属和氧气的反应速率,同时增加了盐分对金属的腐蚀性。
潮湿的环境有利于氧气和盐分在金属表面的扩散和吸附,进一步加剧金属的腐蚀。
四、金属本身的性质不同类型的金属对海水的腐蚀程度也有所差异。
例如,铁、铝、镁等容易受到海水侵蚀,而不锈钢、铜等金属具有较好的抗腐蚀性能。
这是因为不锈钢中添加了一定比例的铬元素,形成了一层致密的氧化铬膜,能够防止海水的侵蚀。
不同的金属在不同的环境条件下表现出不同的耐蚀性能,这也是为什么一些金属在海水中容易腐蚀的原因之一。
通过以上几点可以看出,海水中的氧气、盐分和温度湿度等因素都会引起金属的腐蚀。
研究海水对金属腐蚀的过程和机理,有助于我们采取相应的措施,延缓和防止金属的腐蚀,保护海洋工程设施和海洋资源的科学开发利用。
海水腐蚀的化学方程式

海水腐蚀的化学方程式嘿,朋友们!今天咱们来聊聊海水腐蚀那点事儿,这就像是一场海洋对金属的“恶作剧”呢。
首先啊,铁在海水中那可就遭罪喽。
你看,铁(Fe)遇到海水里的氧气(O₂)和水(H₂O),就像一个手无寸铁的人遭遇了两个调皮捣蛋的小恶魔,发生了这样的反应:4Fe + 3O₂ + 6H₂O = 4Fe(OH)₃。
这氢氧化铁(Fe(OH)₃)啊,就像是铁穿上了一件破破烂烂的铁锈外衣,变得脆弱不堪。
再说说铜(Cu)吧,铜在海水中就像一个优雅的绅士突然被一群淘气的小精灵围攻。
海水中的溶解氧和一些盐类物质会让铜发生反应,2Cu + O₂+ H₂O + CO₂ = Cu₂(OH)₂CO₃。
这生成的碱式碳酸铜就像铜身上长满了绿色的小疙瘩,这就是我们说的铜绿,好好的铜就这么被“毁容”了。
铝(Al)在海水中也不能幸免啊。
铝就像是一个年轻力壮的小伙子,却被海水里的物质弄得狼狈不堪。
它和氧气反应:4Al + 3O₂ = 2Al₂O₃。
这氧化铝就像一层枷锁,套在铝的身上,而且随着时间推移,还会继续和海水中的其他物质反应,慢慢被腐蚀得千疮百孔。
镁(Mg)在海水中就像是一个孤独的行者被无情的风雨侵袭。
镁和水反应:Mg + 2H₂O = Mg(OH)₂ + H₂↑。
这氢气就像镁在痛苦中发出的叹息,而氢氧化镁就是它受伤后的痕迹。
锌(Zn)也躲不过。
它就像一个弱小的士兵在海水这个大战场上被攻击。
在海水中发生反应:Zn + O₂ + 2H₂O = Zn(OH)₂。
这个氢氧化锌就像锌身上的一道伤疤。
锡(Sn)在海水中也是战战兢兢的。
当它遇到海水中的酸性物质时,就像一个胆小的孩子遇到了凶猛的野兽。
例如和盐酸(HCl)反应:Sn +2HCl = SnCl₂ + H₂↑,氢气就像锡在求救时发出的信号。
铅(Pb)在海水中,就像一个老态龙钟的老人被海水里的物质慢慢折磨。
铅和氧气反应:2Pb + O₂ = 2PbO。
这氧化铅就像铅脸上的皱纹,慢慢增多。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
•海水腐蚀的分类
海洋环境的腐蚀分为几个区域 :海洋大气 区、飞溅区、潮汐区、全浸区和海泥区。 飞溅区的供氧充足,干湿交替,腐蚀速率 最大;海泥区氧分不足,腐蚀反应较慢,但可
能存在泥浆海水间的腐蚀电池或微生物腐蚀
距 试 样 上 端 距 离 ( 米 )
0.6 1.2 1.8 2.4 3.1 3.7 4.3 4.9 5.5 6.1
生物因素
生物因素对腐蚀影响很复杂。但多数增加了 腐蚀
船舶和海洋设施的保护
(1)材料
低合金海水用钢与碳钢的比较 环境 海洋大气区 飞溅区 腐蚀速度(mm/y) 低合金钢 0.04 0.05 0.1 0.15 碳钢 0.2 0.5 0.3 0.5
潮汐区
全浸区
0.1
0.15 0.2
温度
海水温度每升高10℃,腐蚀速率提高约一倍; 但随温度升高,氧含量降低。一般讲,铁、铜 和它们的合金在炎热的环境和季节里,海水的 腐蚀速率要更快些
流速
铁、铜等金属存在一个临界流速,超过它, 腐蚀明显加快 但对海水中能钝化的金属,一定的流速能促 进钛、镍合金和高铬不锈钢的钝化和耐蚀性 海水流速很高时,出现了冲刷腐蚀
(如钛、锆、铌、钽等)才能在海水中 保持钝态
(3)海水中含大量氯离子,容易造成金属钝
态局部破坏
(4)由于海水导电性好,腐蚀电池的欧姆电
阻很小,因此异金属接触能造成蚀&缝隙腐蚀,在高 速流水中,易产生冲击腐蚀和空蚀
•影响海水腐蚀的因素
盐度
当盐的浓度超过一定值,氧的溶解度降低,腐蚀速 率下降
金属在自然环境中的 腐蚀与防护
2. 海水腐蚀
• 定义
海水腐蚀指金属在海洋环境中遭受腐蚀而 失效破坏的现象 海洋占地球表面积的71%,海水是自然界 中量最大,而且具有很强腐蚀性的天然电解 质 各种海上运输工具、海上采油平台、海 岸设施、军用设施,都可能遭受海水腐蚀 我国沿海工厂常使用海水做为冷却水, 海水泵的铸铁叶轮仅能使用3个月
•海水的组成和性质
海水的总盐度约为3.2~3.7% ,近似看做3.5%的氯化
钠溶液。几乎含有地壳中所有的自然状态的元素。海水中 含氧量大,表层海水可以认为被氧饱和,随温度变化,氧 含量在5 ~ 10mg/L范围 pH:8.1 8.3,呈微碱性 温度: –2 ~ 35C 导电性强 :平均电导率为4×10 -2 S/m,远超过河水
0.1
0.2 0.25
海泥区
0.06
0.1
(2)设计和施工
在选材、设计和施工中要避免造成电偶腐蚀和缝 隙腐蚀。与高流速海水接触的设备(泵、推进器、海水 冷却器等)要避免湍流腐蚀和空泡腐蚀 。
(3)涂层保护
(4)电化学保护
电化学保护与涂层联合应用是最有效的防护方法。 现在海洋船舶、军舶普遍采用这种防护方法。 外加电流阴极保护便于调节,而牺牲阳极法则简 单可行。铝合金(如Al-Zn-Sn、Al-Zn-In等)牺牲阳极 较为经济
pH值
海水一般处于中性,对腐蚀影响不大。在深海中, pH值略有下降,不利于生成保护性碳酸盐
碳酸盐饱和度
在海水的pH值下,碳酸盐一般达到饱和,易于沉积; 当施加阴极保护时,更易于碳酸盐沉积析出。河口处的 稀释海水,碳酸盐并非饱和,不宜析出形成保护层,腐 蚀增加
氧含量
氧含量增加,促进腐蚀。波浪和绿色植物的 光合作用提高氧的含量;海洋动物的呼吸作用 及生物分解需要消耗氧,氧含量降低。污染海 水中氧含量可大大下降
6 5
飞溅区
潮汐区
全浸区 海泥区 Mainer钢 碳钢
4
3
2
1
耐海水钢Mariner与碳钢的试验结果(九年暴露,美国)
•海水腐蚀的机理及电化学特征
(1)除镁及其合金既有耗氧腐蚀又有析氢腐
蚀外,其它金属都属于耗氧腐蚀
(2)阳极极化阻滞对于大多数金属(如钢铁、
锌、铜等)很小;只有少数易钝化金属
( 2×10-4 S/m )和雨水( 1×10-5 S/m )
海水的主要成分
离子 浓度0/00 离子 浓度0/00
ClSO42HCO3BrFBO3-
18.98 2.65 0.14 0.09 0.002 0.3
Na+ Mg2+ Ca2+ K+ Sr2+
18.56 1.27 0.40 0.38 0.01
