材料热力学复习题
材料热力学习题集

问:1)当混合气体(97%H2O + 3%H2, 体积)在 1000 K 是否能将 Ni 氧化? 2)现有 Ni-Au 固溶体(XNi = 0.1)。已知在 1000 K 时, 与此合金平衡的氢气体体积
例题 6-8 右图所示是铜和铜铝合金(18 at.% Al)在 700℃温度下扩散退火 38.4 天的浓度分
布曲线。求当 Al 的浓度为 4 at%时,Al 在 Cu 中的扩散系数。
18
Cu - Al
Cu
16
A
14
C , at.% Al
12
k
Matano interface
10
8 mark interface
.
材料热力学上课题目
例 1-1 已知液体铅在 1 个大气压下的热容量 Cp(l)为 Cp(l)=32.43-3.10×10-3T J/(mol·k),固 体铅的热容量 Cp(s)为 Cp(s)=23.56+9.75×10-3T J/(mol·k),已知液体铅在熔点(600 K)凝固为固 体时放热 4811.60 J/mol,求液体铅过冷至 590K 凝固为固体时焓的变化。
6
4
2
A
1
0 -10 -8 -6 -4 -2 0 2 4 6 8 10
x
六大 板块
第一章 第二章 第三章 第四章 第五章 第六章
物理化学复习纲要
热力学定律(热力学第一定律、热力学第二定律) 自由能(ΔF、ΔG) 热力学状态函数、关系式及应用 相变热力学 溶液 扩散
.
材料热力学讲义

第一章一、选择题1. 下述说法中,哪一个是错误的?( )(A )系统放出的热量一定等于环境吸收的热量。
(B)系统温度的降低值一定等于环境温度的升高值。
(C )热力学平衡时系统温度与环境温度相等。
(D )若两物体分别与第三物体成热平衡,则此两物体的温度相同。
2.下列对可逆过程的描述何者不正确?( )(A )能使系统和环境完全复原的过程。
(B )在整个过程中系统内都无限接近于平衡态。
(C )过程进行无限缓慢,环境的温度、压力分别与系统的温度、压力相差甚微。
(D )一个带活塞储有一定量气体的气缸,设活塞无重量,控制内外压差无限小,缓慢膨胀到终态,再压缩使系统回到原始态。
3. 列宏观过程: (1)101325Pa 、273K 下冰融化为水;(2)气缸中活塞往复运动;(3)NaCl 溶解在水中;(4)水在101325Pa 、373K 下蒸发。
可看作可逆过程的是( )。
(A ) (1)(4) (B )(2)(3)(C )(1)(3)(D )(2)(4)4.一绝热容器中有一无摩擦、无质量的绝热活塞,两边各装入等量同温度同压力 的理想气体,左边有一电阻丝缓慢加热(如图),活塞慢慢向右移动。
今以左边气体为系统,其余为环境,则系统有( )(A )Q <0,W =0,ΔU <0(B )Q =0,W>0,ΔU >0(C )Q >0,W>0,ΔU >0(D )Q <0,W =0,ΔU >05上题若以两边气体为系统,其余为环境,则有( )(A )Q >0,W >0,ΔU <0(B )Q <0,W =0,ΔU >0(C )Q <0,W <0,ΔU =0(D )Q >0.W =0.ΔU >06.在一个密闭绝热的房间里放置一台电冰箱,将冰箱门打开,并接通电源使其工作,过一段时间之后,室内的平均气温将如何变化( )(A )升高(B )降低(C )不变(D )不能确定7.下述说法哪一种不正确?( )(A )一定量理想气体自由膨胀后,其ΔU =0。
热力学复习题及答案

热力学复习题及答案1. 热力学的定义是什么?答:热力学是研究能量转化和能量传递规律的一个物理学分支。
2. 什么是热力学系统?答:热力学系统是指被选定的一部分物质或空间,用于研究热力学性质和过程的对象或范围。
3. 请简要解释热力学过程中的熵变。
答:热力学过程中的熵变指系统熵的变化,代表了系统无序度的改变。
熵增加表示系统的无序度增加,熵减少表示系统的无序度减少。
4. 热力学第一定律是什么?答:热力学第一定律,也称能量守恒定律,表示能量不会被创造或破坏,只能从一种形式转化为另一种形式,能量的总量保持不变。
5. 温度和热量有什么区别?答:温度是物体分子运动的程度,用来衡量热力学系统的热平衡状态。
热量是能量的传递形式,表示因温度差而引起的能量传递。
6. 请解释等温过程和绝热过程。
答:等温过程是指系统与外界保持恒定温度的热力学过程。
绝热过程是指系统与外界无能量交换的热力学过程。
7. 热力学循环是什么?答:热力学循环是指能量转化过程中系统从一个状态经过一系列过程最终回到原来状态的过程。
8. 请解释热力学可能性原理。
答:热力学可能性原理,也称热力学第二定律,表示任何孤立系统都不可能完全转化热能为有效的功。
9. 热力学第三定律是什么?答:热力学第三定律,也称绝对温标定律,指出在绝对零度(0K)下,所有物质的熵可以达到最低值,即熵的极限为零。
10. 请解释吉布斯自由能。
答:吉布斯自由能,简称G,是热力学系统在等温等压条件下的可用能量。
它在化学平衡时取最小值,可用于预测化学反应的方向。
材料热力学习题答案

材料热力学习题答案
材料热力学学习题答案
热力学是物理学的一个重要分支,研究物质的热量和能量转化规律。
在学习热
力学的过程中,我们常常会遇到各种各样的学习题,通过解答这些学习题,我
们可以更好地理解热力学的知识,提高自己的学习能力。
1. 热力学第一定律是什么?请用数学公式表示。
答案:热力学第一定律是能量守恒定律,即能量不会自发地产生或消失,只能
从一种形式转化为另一种形式。
数学公式表示为ΔU = Q - W,其中ΔU表示系
统内能的变化,Q表示系统吸收的热量,W表示系统对外做功。
2. 什么是热容?如何计算物质的热容?
答案:热容是物质单位质量在单位温度变化下吸收或释放的热量。
物质的热容
可以通过公式C = Q/mΔT来计算,其中C表示热容,Q表示吸收或释放的热量,m表示物质的质量,ΔT表示温度变化。
3. 什么是热力学循环?请举例说明一个热力学循环的应用。
答案:热力学循环是指一定物质在一定压力下,经过一系列的热力学过程后,
最终回到初始状态的过程。
一个常见的热力学循环是卡诺循环,它被广泛应用
于蒸汽发电厂和制冷系统中。
通过解答这些学习题,我们可以更加深入地理解热力学的知识,掌握热力学的
基本原理和计算方法。
希望大家在学习热力学的过程中能够勤加练习,提高自
己的学习能力,为将来的科学研究和工程实践打下坚实的基础。
材料热力学习题解答

《材料热力学》复习思考题解答3. 在1560℃时,C 在液态铁中的活度系数和偏摩尔超额焓由下列式表示: 2l n 0.37711.7c C C X X γ=-++25.415.017.25E C C C H X X =++(K Cal) 其标准态为纯石墨,计算1560℃时液相与石墨平衡的相线的斜率。
解:以石墨为标准态时,C 在液态铁中的化学位为:l n (1)LC CC R T a μμ=+ 石墨 当液相与石墨平衡时,L C Cμμ=石墨。
即ln 0C α=。
又ln ln ln C C C X αγ=+ln ln 0(2)C C X γ∴+=由(2)式得:平衡时0.2067C X =两边取微分得:(ln )(ln )1[](1/)[]0(1/)C C C X T C C C C d T dX dX T X X γγ∂∂++=∂∂ (ln )[](1/)ln ln 1(1/)[()]1()CC X EC C C C C T C TC C CdX H X T d T R X X X X γγγ∂-∂∴==⋅∂∂-++∂∂2(5.415.017.25) 4.1810000.20678.311(723.4)278.6C C CC X X X X ++⨯⨯=-⋅++=- 2C dX T dT=-CdX 又d(1/T)5221278.68.310(1560273)C dX dT T -∴=-==⨯+C dX d(1/T) 1()K - 4. 在1000K 时,A-B 二元溶液中,当0.01B X =时,0.1B a =。
在盛有大量A 的量热计中加入少量的B 组元时,测得吸热7000Cal/mol ,假定2ln ln B A B X γγ=。
求1500K 时,当0.02B X =时,B 组元的活度。
解:在1000K 时,当0.01B X =时,0.1B a =0.1100.01B γ∴== 又022ln ln10ln 2.3490.99B B A X γγ=== 又ln [](1/)ii P H R T γ∂∆=∂15001500010001000l n (1/)BBH d d T Rγ∆∴=⎰⎰1500100011[ln ][ln ]()15001000B B B H R γγ∆∴=+-7000 4.18112.349()8.31150010001.175⨯=+-= 202l n (l n )0.981.175B A B X γγ∴==⨯ 1.128= l n 3.09B γ∴= 3.090.020.0B B B a X γ==⨯=7. 若A-B 二元合金系在液、固态两组元均能无限互溶,且均为理想溶液。
材料热力学考试习题

材料热力学考试习题6、10个小球分配在4个完全相同的容积中,试求4个小容积中各分得3、2、0、5个小球的微观状态数为多少?7、由5个粒子所组成的体系,其能级分别为0、、2及3,体系的总能量为3试分析5个粒子可能出现的分布方式;求出各种分布方式的微观状态数及总微观状态数。
8、有6个可别粒子,分布在4个不同的能级上(、2、3及4),总能量为10,各能级的简并度分别为2、2、2、1,计算各类分布的j及总。
9、振动频率为的双原子分子的简谐振动服从量子化的能级规律。
有N个分子组成玻耳兹曼分布的体系。
求在温度T时,最低能级上分子数的计算式。
10、气体N2的转动惯量I=1.39410-46kgm2,计算300K时的qJ。
11、已知NO分子的=2696K,试求300K时的q~如12、已知下列各双原子分子在基态时的平均核间距r0及振动波数下:分子H2O2COHIr0/10-10m0.7511.2111.1311.615~/(0.01m)-14395158021702310计算各分子的转动惯量、J及13、计算300K时,1molHI振动时对内能和熵的贡献。
14、在298K及101.3kPa条件下,1molN2的qt等于多少?15、在300K时,计算CO按转动能级的分布,并画出分子在转动能级间的分布曲线。
16、计算H2及CO在1000K时按振动能级的分布,并画出分子在振动能间的分布曲线;再求出分子占基态振动能级的几率。
17、已知HCl在基态时的平均核间距为1.26410-10m,振动波数~=2990m。
计算298K时的Sm-118、证明1mol理想气体在101.3kPa压力下qt=bLM3/2(T/K)5/2(b为常数)19、计算1molO2在25C及101.3kPa条件下的Gm、Sm及Hm。
设U0等于零。
20、已知300K时金刚石的定容摩尔热容CV,m=5.65Jmol-1K-1,求E及21.已知300K时硼的定容摩尔热容CV,m=10.46Jmol-1K-1,求(1)D;(2)温度分别为30K、50K、100K、700K、1000K时的CV,m值;(3)作CV,m值T图形。
材料热力学复习思考题(2013)
复习思考题:1. 简述化学热力学的理论体系以及它的局限性。
2. 简要说明热、功的定义。
并说明二者的区别和联系;热是体系与环境之间因温度有差别尔进行交换或传递的能量;功是除热以外其他能量的宏观传递形式;功与热都不是体系的性质,与过程有关。
在微观上,热是通过分子无序运动实现的,功则是通过分子定向运动完成的。
3. 什么是状态函数,状态函数有哪些特点?体系的状态不变,则体系的各种性质也不变。
当体系得状态发生变化,它的一系列性质也随之改变。
改变多少,只取决于体系得开始和终了状态而与变化途径无关。
无论经历多复杂的变化,只要体系复原,这些性质也复原,具有这样特性的物理量称为状态函数。
状态函数的特点:(1)单值性。
(2)“异途同归,值变相等。
”(3)“周而复始,数值还原”(4)状态函数的增量在数学上可用全微分表示(具有全微分的性质)。
4. 通过体系与环境的关系,说明敞开体系、封闭体系和孤立体系;体系指划分出来作为研究的对象的那部分称为体系(或称为物系和系统)。
环境则指体系以外与体系密切相关、影响所及的部分。
有体系和环境之间的关系可将体系分为三种类型:敞开体系:与环境既有质量交换又有能量交换的体系;封闭体系:与环境无质量交换但有能量交换的体系;孤立体系:与环境既无质量交换又无能量交换的体系。
5. 举例说明强度性质和广度性质;强度性质与体系的数量无关,不具有加和的性质,如温度、压力等;广度性质与体系的数量有关,在一定条件下具有加和性,如体积、内能等。
6. 写出基尔霍夫公式,说明其应用;7. 熵既然是状态函数,它的变化与过程性质无关。
为什么熵变又能作为过程性质的判据?首先,熵变能作为过程性质的判据,其前提是适用于绝热体系或孤立体系,此时δQ=0。
其次,有柯劳修斯不等式dS ≥δQ/T 的可逆性可知,熵值本身虽然与过程性质无关,因熵是状态函数,但熵变dS 值与实际发生过程中的热温熵有关;在可逆过程中熵变等于热温商,在不可逆过程中熵变大于热温商。
材料热力学与动力学复习资料 课后习题.

10. [ 形核驱动力 ] 碳钢淬火马氏体在进行低温回火时,并不析出该温度下的稳定碳化物Fe3C(θ, 而是首先析出一种碳含量更高的亚稳碳化物相 Fe2.3-2.5C(ε,试分析原因 - 从淬火马氏体低温回火析出和形核驱动力图示可以看出,成分为的过饱和固溶体(淬火马氏体中析出碳化物的相变驱动力实际上比相的相变驱动力要小些。
但是决定那种碳化物优先析出的并不是相变驱动力,而是形核驱动力。
11. [析出相的表面应力效应]在固态相变初期析出的第二相α一般与基体相β 呈共格状态,从表面张力导致的附加压力的角度分析其原因。
假定共格态的表面能(张力为 0.01 J/m2, 半共格态为 0.1 J/m2, 完全非共格态的表面张力为 1 J/m2, 试计算从α 基体相中析出直径为 10 nm 的β 相(球形在上述三种状态下的附加压应力。
P 2 / r - 在压力作用下,其自由能提高为 Gibbs-Thomson 公式: Gm Gm (0 P Vm d 2Gm dxB 2 dX B P Vm XB XB d B A X B X B dx B 2 Vm (1 X B XB r XB XB RT 2 I AB (1 X B X B 12. 假定 H 由纯铁素体和奥氏体组成的双相合金中进行扩散,相区宽度如右图所示。
a1 和 a2 分别表示 H 在单相区边界的活度,ai 表示 H 在/相界的活度;H 在两相中的活度系数为 H 和 H,H 在两相中的体积浓度为 CH 和CH,已知梯度的驱动下发生扩散。
H H 。
H 在活度 ai xi / i JH JH a1 a2 l H l H D D - 对于双相合金的扩散,哪一相对 H 的扩散阻力大,那么该相将对 H 的扩散起控制作用。
已经知道,在相同温度下,H 在相中的扩散系数远大于在相中的扩散系数 DH (100 倍以上,因此扩散作用主要取决于相。
DH。
材料热力学与动力学复习题答案word版本

材料热力学与动力学复习题答案一、常压时纯Al 的密度为ρ=2.7g/cm 3,熔点T m =660.28℃,熔化时体积增加5%。
用理查得规则和克-克方程估计一下,当压力增加1Gpa 时其熔点大约是多少? 解:由理查德规则RTm Hm R Tm Hm Sm ≈∆⇒≈∆=∆ …①由克-克方程VT H dT dP ∆∆=…② 温度变化对ΔH m 影响较小,可以忽略,①代入②得 V T H dT dP ∆∆=dT T1V Tm R dp V T Tm R ∆≈⇒∆≈…③ 对③积分 dT T1V T Tm R p d T Tm Tm pp p ⎰⎰∆+∆+∆= 整理 ⎪⎭⎫ ⎝⎛∆+∆=∆Tm T 1ln V Tm R p V T R V Tm R Tm T ∆∆=∆⨯∆≈ Al 的摩尔体积 V m =m/ρ=10cm 3=1×10-5m 3Al 体积增加 ΔV=5%V m =0.05×10-5m 3K 14.60314.810510R V p T 79=⨯⨯=∆∆=∆- Tm’=Tm+T ∆=660.28+273.15+60.14=993.57K二、热力学平衡包含哪些内容,如何判断热力学平衡。
内容:(1)热平衡,体系的各部分温度相等;(2)质平衡:体系与环境所含有的质量不变;(3)力平衡:体系各部分所受的力平衡,即在不考虑重力的前提下,体系内部各处所受的压力相等;(4)化学平衡:体系的组成不随时间而改变。
热力学平衡的判据:(1)熵判据:由熵的定义知dS Q T δ≥不可逆可逆对于孤立体系,有0Q =δ,因此有dS 可逆不可逆0≥,由于可逆过程由无限多个平衡态组成,因此对于孤立体系有dS 可逆不可逆0≥,对于封闭体系,可将体系和环境一并作为整个孤立体系来考虑熵的变化,即平衡自发环境体系总0S S S ≥∆+∆=∆ (2)自由能判据 若当体系不作非体积功时,在等温等容下,有()0d ,≤V T F 平衡状态自发过程上式表明,体系在等温等容不作非体积功时,任其自然,自发变化总是向自由能减小的方向进行,直至自由能减小到最低值,体系达到平衡为止。
热力学复习十套题

测试一一、选择(本大题16 分,每小题2 分)1. 已知当地大气压P b , 压力表读数为P e , 则绝对压力P 为()。
(a )P=P b -P e (b )P=P e -P b ( c )P=P b +P e2.准静态过程满足下列哪一个条件时为可逆过程()。
(a )做功无压差( b )传热无温差( c )移动无摩擦3. A 点是海平面某点,B 点是高原上一点,试问 A 、B 处哪点沸水温度高()(a)A 点( b )B 点(c )同样高4.工质进行了一个吸热、升温、压力下降的多变过程,则多变指数()(a) 0< <1 (b )0< <k ( c )>k5.以下()措施,不能提高蒸汽朗肯循环的热效率。
(a) 提高新汽温度(b )提高新汽压力( c )提高乏汽压力6.在环境温度为300K 的条件下,一可逆机工作于两个恒温热源(2000K ,400K )之间,吸热200kJ ,其中可用能为()(a) 160 kJ (b )170kJ ( c )180 kJ7.同一理想气体从同一初态分别经定温压缩、绝热压缩和多变压缩(1<n<k )到达同一终压,耗功最大的的是()过程(a)定温压缩(b )绝热压缩( c )多变压缩(1<n<k )8.适用于()(a)稳流开口系统(b)闭口系统(c)任意系统(d)非稳流开口系统二、判断正误(划―√‖或―×‖号)(本大题16 分,每小题 2 分)1.热力系统的边界可以是固定的,也可以是移动的;可以是实际存在的,也可以是假想的。
2.热力系统放热后,系统的熵一定减少。
( )3.理想气体任意两个状态参数确定后,气体的状态就一定确定了。
( )4.因为不可逆过程不可能T — s 图上表示,所以也不能计算过程的熵变量。
( )5.水蒸汽绝热膨胀过程中的技术功。
( )6.循环的热效率越高,所得到的循环净功也越大。
( )7.任何可逆循环的热效率都相等。
材料热力学11年试题

问答题1、简述热力学第一定律、热力学第二定律、热力学第三定律的内容及应用。
2、简述熵判据、亥姆赫兹函数判据和吉布斯函数判据的内容及使用条件3、请说明为什么纯金属(纯铁材料除外)加热的固态相变是由密排结构到疏排结构的变/link?url=TB3ynKTakLolx53PSt3lqIRlj9i0a7uxwlSvLchHRQzuXIqwFkc-ZsPauEoTMKUnLgq1B_IkWu-KihBIe8zx2YpCnkxGhYX9TYHlyKCPuSy室温下为铁磁性金属在超过居里温度将变为顺磁性,自发磁化消失物质由铁磁态变化到顺磁态的过程伴随着自由能的变化4、请说明为什么固相与气相或液相之间平衡时,相平衡温度T 与压力P 之间的关系是指数关系;而固相与液相之间平衡时,相平衡温度T 与压力P 之间的关系是直线关系5、对于一个二元体系A-B ,试简述相互作用能I AB 的意义,以及I AB 值对A-B 二元正规溶体体系吉布斯自由能-组分关系图形状以及A 、B 在溶体中微观存在状态的影响?T=0时i=0.自由能曲线倾斜的直线,0>i 自由能曲线向下的曲线i >0,自由能曲线向上的曲线T >0时i ≦0,向下凹曲线。
在绝大多数情况下,Gm-X 曲线都是单调向下弯曲的形状。
在i >0,T 不太高时,向上凸的曲线且两个拐点6、试简述多元体系中化学位和活度的意义,并说明为什么在一些固溶体中会发生上坡扩散的原因?7、试简述两相平衡条件的热力学条件、意义,对于两种或者两种以上物相存在的二元体系吉布斯自由能-组分关系图中如何确定相平衡条件啊和范围,以及上述方法的日力学原理;8、物相尺度影响其在溶体中的溶解度,晶体材料中出现晶界偏析的原因和热力学原理 P m GG G -=∆9简述固体热容的杜隆-普替定律,爱因斯坦,德拜模型中材料的热容随温度的变化规律,以及比较各自的优缺点杜隆-普替定律:温度较高Cv=3R 定值。
材料热力学复习题

复习题(材料热力学)1、体系与环境之间的关系?体系分为几种类型?其划分依据是什么?2、状态变数与状态函数?状态函数的特点是什么?3、分别阐述热力学第一定律、第二定律和第三定律?4、推导可逆过程体积功的表达式?5、设有64×10-3 kg氧气,在25℃下极缓慢地膨胀,使其体积由0.05 m3变为0.1 m3。
计算该过程气体所做的体积功。
6、设有10 mol氢气,在25 ℃下可逆压缩,使其压力增大3倍。
计算该过程气体所做的体积功。
7、推导焓的表达式?并解释其物理意义?8、在1大气压下,1 mol的水从25℃加热至150 ℃,计算该过程中的Q,W以及△U和△H。
9、推导基尔霍夫定律,并说明反应热与比热容变△Cp之间的关系。
10、熵的定义及其统计意义是什么?11、熵变计算:A.1 mol理想气体,在恒温T下体积增大10倍,求其熵变(1)设为可逆过程;(2) 设向真空膨胀。
B. 铅的熔点为600 K,凝固热为4811.6 J/mol,求铅在600 K凝固时熵值的变化(1 atm)C. 求液体铅过冷至590 K凝固时熵值的变化(1 atm)。
12、简述Richard和Trouton规则13、自由能和自由焓的表达式分别是什么?14、简述最小自由能原理?15、推导热力学基本关系式:VP S T U d d d -=PV S T H d d d +=VP T S F d d d --=P V T S G d d d +-=⎛⎛⎛⎛⎛⎛⎛⎛P V U T S U S V =-,⎪⎭⎫ ⎝∂∂=⎪⎭⎫ ⎝∂∂V P H T S H S P =,⎪⎭⎫ ⎝∂∂=⎪⎭⎫ ⎝∂∂P V F S T F T V -⎪⎭⎫ ⎝∂∂-=⎪⎭⎫ ⎝∂∂=,V P G S T G T P =,⎪⎭⎫ ⎝∂∂-=⎪⎭⎫ ⎝∂∂16、 什么是饱和蒸汽压?蒸汽压与体系自由能之间关系的表达式是什么? 17、 推导Gibbs-Helmholtz 方程,并简述相变自由能与温度关系的计算过程。
材料热力学习题及答案
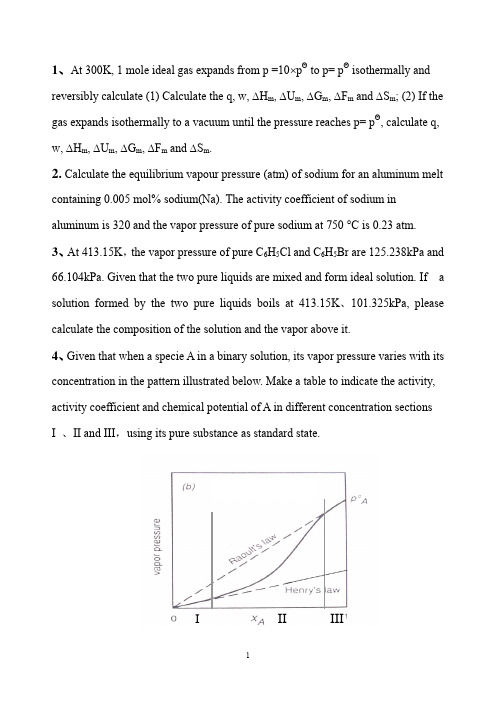
1、At 300K, 1 mole ideal gas expands from p =10⨯pΘ to p= pΘ isothermally and reversibly calculate (1) Calculate the q, w, ∆H m, ∆U m, ∆G m, ∆F m and ∆S m; (2) If the gas expands isothermally to a vacuum until the pressure reaches p= pΘ, calculate q, w, ∆H m, ∆U m, ∆G m, ∆F m and ∆S m.2. Calculate the equilibrium vapour pressure (atm) of sodium for an aluminum melt containing 0.005 mol% sodium(Na). The activity coefficient of sodium in aluminum is 320 and the vapor pressure of pure sodium at 750 °C is 0.23 atm.3、At 413.15K,the vapor pressure of pure C6H5Cl and C6H5Br are 125.238kPa and 66.104kPa. Given that the two pure liquids are mixed and form ideal solution. If a solution formed by the two pure liquids boils at 413.15K、101.325kPa, please calculate the composition of the solution and the vapor above it.4、Given that when a specie A in a binary solution, its vapor pressure varies with its concentration in the pattern illustrated below. Make a table to indicate the activity, activity coefficient and chemical potential of A in different concentration sectionsI 、II and III,using its pure substance as standard state.III III5、At 300K, the vapor pressure of liquid A and liquid B are 37.33kPa and 22.66kPa.When 2 moles of A and 2 moles of B are mixed to form a solution, the vapor pressure above the solution is 50.66kPa, and the molar fraction of A in the vapor is 0.60. Given that vapors can be taken as ideal gases. ①Calculate a A( R )and a B( R) in the solution, ②γA and γB , ③∆mix G , ④ If the solution is an ideal solution, what is the value of ∆mix G id ? ⑤ What is the value of ∆mix G ex of this solution?6、The variation, with composition, of G E for Fe-Mn alloys at 1863K is listedbelow:X Mn 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 G m E ,Joules 395703 925 1054 1100 1054925 703 395a 、Is the process to form Fe-Mn alloy at 1863K an exothermic one or an endothermic one ?b. Does the system exhibit regular solution behavior?c. Calculate E Feμ and EMn μ at X Mn = 0.6; d. Calculate m mix G ∆ atX Mn = 0.4; e. Calculate the partial pressures of Mn and Fe exerted by the alloy of X Mn = 0.27、Melts in the system Pb-Sn exhibit regular solution behavior. At 473︒C, a Pb =0.055 in a liquid solution of X Pb = 0.1. Calculate the value of PbSn ωfor the system and calculate the activity of Sn in the liquid solution of X Sn = 0.5 at 500︒C.8、With respect to the Ellingham diagram, answer the following questions:93.23ln 27.145390)(ln *+--=T Tatm pFe68.37ln 02.333440)(ln *+--=T Tatm p Mna) Explain the slope changes for the reaction 2Mg + O 2 = 2MgO; b) You want to heat up and a piece of silicon metal to 1600︒C, decide on a suitable crucible material;c) What is the value of ∆H Θ of formation of TiO 2 ? d) Find ∆G Θfor the reaction Fe + 0.5O 2 =FeO at 1200 ︒C;e) Find ∆G Θ for the reaction 3Mg + AlO 3 = 3MgO + 2A1 at 1500 ︒C; f) What is the equilibrium oxygen pressure when metallic titanium is in equilibrium with TiO 2 at 1000 ︒C?g) If you want to reduce pure TiO 2 to pure metallic titanium at 1000︒C using a CO/CO 2 gas mixture, what is the minimum CO/CO 2 ratio that can achieve such a reduction.9、Answer the following questions according to Ellingham diagram:① At what temperature(s) C can reduce SnO 2(s)、Cr 2O 3(s) and SiO 2(s) ? ② At what temperature, the decomposition pressure of CuO reaches 1.01325⨯105 Pa ?③ The temperature(s) at which Fe 3O 4 can be reduced to FeO by H 2 ? ④ ∆G Θ when Mg reduces Al 2O 3 at 1000︒C,⑤ At what temperature, for the reaction )(322)(3234S S O Cr O Cr =+,Pa 1019'2-(平)is p O ⑥ Calculate the ∆G when Fe reacts with O 2 at 10-5Pa and 10-10Pa respectivelyat1000︒C, and '(2平)O p as well. ⑦ Calculate the equilibrium constant of reaction 2)()(CO Mn CO MnO s s +=+ at1100︒C (CO CO p p K /2=)⑧ At what temperature, for reaction )(2)(2)(g s s O H Mn H MnO +=+, the(平))/(22O H H is 104/1 ? 10、The standard Gibbs free energy change for reaction I:Ni (s ) + 1/2 O2 == NiO (s )is -244560 + 98.53TlnT J/ mol , question: a) How much is the standard Gibbs free energy change for reaction II : 2Ni (s ) + O2 == 2 NiO (s )b) Calculate the equilibrium constants for reaction I and reaction II respectively at 1000︒ C.c) At 1000︒ C, when oxygen pressure is maintained at 10-4 atm, how much is theGibbs free energy change for reaction I ? Can reaction I proceed forward ? Is Ni stable under this condition ? Is NiO stable under this condition ? d) At 1000︒ C, how much should be the oxygen pressure if we want the Gibbs free energy change for reaction I to be 0, and how much should be the oxygen pressure if we want a Ni-NiO-O 2 system to be at equilibrium ?e) At 1000 C, what is the condition to prevent Ni from being oxidized ? and whatis the condition to reduce NiO ?11、Liquid FeO is reduced to metallic iron at 1600 °C with CO(gas) accordingto the following reaction:FeO(liquid) + CO(g) = Fe(liquid) + CO 2a) Calculate ∆G Θ at 1600 °C for this reactionb) Detennine the minimum CO/C02 ratio required to reduce pure liquid FeO topure metallic iron at 1600 °C.c) Determine the minimum CO/CO2 ratio required to reduce FeO dissolved in a liquid slag to metallic iron at 1600 °C. The metallic iron formed has a purity of 96 mole % iron. The activity of FeO in the liquid slag is 0.3.CO(g) at 1600 °C: ∆GΘ= -274.9 kJ/molCO2(g) at 1600 °C: ∆GΘ = -396.3 kJ/molFeO at 1600 °C: ∆GΘ = -144.6 kJ/molR= 8.314 J/ mol.K= 1.987 ca1/mol.K12、In an experiment, it was found that the Ar was not pure enough. So a setup was devised in an attempt to purify the Ar, as illustrated below. Ar which was at 2 atm was let to flow through a glass tube and the Cu powder pile in it. Given that the temperature in the glass tube is 600︒C and gas pressure is constant at 2 atm.. Calculate the purity of the outgoing Ar in percentage.Ellingham Diagram习题参考答案3.2 ΔG = -108.9 J/mol; ΔS = -21.42 J/(mol.K)3.6 (a ) 22.09/(.)S J mol K ∆=;(b) At 0︒C, ∆G =0; (c) ∆H = 5841.9 J;(d) ∆S =21.39J /(mol.K),∆G = 109.38 J/mol4.1 (a ) 2898.28J/mol; ( b ) No; ( c ) 345 J/mol; ( d ) 14939 atm; ( e ) 4921 J/mol 4.2 ( a ) 272.8K; ( b ) Pa P 610345⨯≈∆ ; ( c ) 249.46K 4.3 1202K4.4 P=5.73⨯10-6 atm 4.5 0.16P4.7 08.10430685ln +-=TP 4.8 ( a ) 1180K; ( b ) 695.3K; ( c ) 114.4kJ/mol; ( d ) 7123 J/mol; ( e ) 4.2J/mol 4.9 In the initial state: 4.06 mol %; in the final state: 5.3 mol% 4.10 ( a )348 kJ; ( b ) 2.3×10-3Pa ;( c ) “ solution not possible”; (d ) “solution not possible”5.1 atm p H 0005.0=5.2、atm p o 1221007.1-⨯= If the error in enthalpy is 500cal, the uncertainty in the pressure calculated is 28.6%, and if the error in enthalpy is -500cal, the uncertainty is -22.1%5.3、(a) T =462K; (b) T = 420K5.4 (a) atm P O 2621014.1-⨯=, (b) P O2 =2.28⨯10-10 atm., (c) The equilibrium oxygen pressureremains the same when the total pressure increases, which means a higher purity level of N 2 .5.5 (a) 略; (b) Pa atm P H 8.181013056.1800019.0)('2=⨯==; (c) 21.5L Ar is needed to bebubbled into the melt.5.6(a )l n K a1/T, 10-31/K=∆-=∆ooG kJ H 1000;50- 66.6kJ(b) Ja = 3 < Ka, the reaction will proceed from left to right, and the atmosphere willnot oxidize Ni.5.7 略5.8. (a) P SiO = 8.1⨯10-8 (atm) (b) ∆H o = 639500J; ∆So =334.9J/K (c ) PO2 =10-30 atm5.9 5.10.J H o72250=∆,the reaction is an endothermic one. )(106.08)(atm P g u -⨯=5.11. (a),166528J H o =∆ the reaction is an endothermic one.; (b) At 1168K, the equilibrium pressure of CO2 equals one atmosphere. 5.12 (a) 略 , (b) Mg CO P P =; (c) T = 2037 K 5.13 (a) 略; (b) 13109.2⨯=K ; (c) ppm 186.0 5.14 (a) 略; (b) kJ H 52.267=∆; (c) K T 1592= 5.15 (a) )(106.13atm -⨯≈; (b) )(1028.210)(2atm P g O H -⨯=5.16 (a) 97.9=K ; (b) atm x 14.4=; (c) if the temperature is increased, the fraction of water reacted will increase since the equilibria constant increases with increasing temperature.6.2 (a )1.287V;(b) When the water impure, the voltage will go higher; (c) 1.219V 6.4 (a) 145.3kJ;(b) The maximum work that could be derived is 702.36kJ;(c) In this case, the maximum work that could be derived is 696.56kJ. 6.5 (a) -6252J/mol; (b) 370.0)(=II Cd a ; (c) )(42.3mmHg P Cd =; 6.6 7.87⨯10-4 V 6.7 (a))(22g Cl Mg MgCl +=(b) Pa P Cl21'1086.82-⨯=; (c) 2.485V6.8 (a) Pa P O 11'2105.5-⨯=;(b) Anode:e NiNi 2+→Cathode:-→+2222/1O e O ; (c) 0.757V; (d) 0.261V6.10 (a) )(509.3V E o=;(b) 0.074kJ;(c) 4.1⨯106J;(d) Yes. In this case, the open circuit voltage is 3.648V;(e) In this case, to keep the temperature constant, 3.92⨯106J heat should beremoved from the battery per hour.6.11(a) TG CO Al C O Al o 26.3211008.12/322/36232-⨯=+=+Δ(b) The minimum voltage at which the electrolysis may be carried out at1250K is 1.172V .7.1 0.117 atm 7.5 ( a ) ,82.5 2.5 2.5B A B A B B T PV V V x x x x x ⎛⎫∂=+=--⎪∂⎝⎭ ,102.5 2.5 2.5A B A A B A T PV V V x x x x x ⎛⎫∂=+=-- ⎪∂⎝⎭( b) B A M x x V 5.2=7.7 2)1(736.0ln Sn Sn x --=γ7.8 The maximum solubility of MgF2 in liquid MgCl at 900 C is 19 mol% .7.9 ( a ) 1121K; ( b ) 1. 8 cal/K9.6Temperature(ºC ) Phase Composition Fraction1300 Liquid 0.59 0.64 α 0.06 0.36 β ---- 01000+Liquid 0.8 0.43 α 0.1 0.57 β ---- 01000-Liquid ---- 0α 0.1 0.65 β 0.95 0.359.8 Solution:(a) 90 mol%B is the composition of the first solid to form;10 mol % is the composition of the last liquid drop.(b) solid (60 mol%B is the composition) is about 77% ; liquid (15 mol%B is the composition) is 23%9.9 (a) 2900℃, α(12%) (b) 2300℃, liq(95%) (c) 8.2%α(composition is24% )+91.8%β(85%)习题参考答案1.ΔS m =19.1J/mol.K, ΔG m = -5740 J/mol, ΔF m = -5740 J/molIsothermally expands to a vacuum: w = 0, ΔH m =0 , ΔU m = 0,ΔS m =19.1J/mol.K, ΔG m = -5740 J/mol, ΔF m = -5740 J/mol2. 3.68 × 10-3 atm3、Pa x x Br H C Cl H C 406.0;594.05556==Pa p Pa p Br H C Cl H C 26838;744445556==4.5、JG J G J G a a ex mix id mix mix B A R B R A 5302)5(;6912)4(;1610)3(;788.1;62.1)2(;894.0;81.0)1()()(=∆-=∆-=∆====γγ 6. a endothermic one; b. Yes; c J J EMn E Fe 704;1584==μμd ;/9363mol J G m mix -=∆e Pa p Pa p Fe Mn 4;1198==7. J SnPb 4578-=ω; 418.0=Sn aPure Substance as Stand ard Statepq(b )I 、II 、IIIAAA AAA A AAAA x R T T p x k R T T p p R T T T 0'ln )(ln)(ln )()(γμμμμ+=+=+=*****III:I:II:AA AAAA a RT T p p RT T T ln )(ln )()('+=+=***μμμAA AA AA x RT T p p RT T T ln )(ln)()(*'*+=+=*μμμk A8. a) Mg boils and which makes o S ∆more negative, so the slope changes for larger; b) Firstly, we should avoid using metallic material for this purpose since the melting points of metals are mostly too low. Ceramic materials, usually composed of oxides and having high melting points can be chosen The material should not be reduced by pure silicon at 1600ºC. By examing Ellingham diagram, crucibles (坩埚) made of Al 2O 3 .c ) -890kJ /molO2;d ) -170kJ /molFeO; e) -30kJ; f) Pa 2110-; g)721063.0/⨯=pco p CO 9、⑨ 650ºC ,1220 ºC and 1520 ºC ; ⑩ 1480 ºC ;⑪ When the temperature is equal to or higher that 710 ºC ; ⑫ 2/100molO kJ G o -=∆ ⑬ 900 ºC; ⑭0,102/112,1010'25'2=∆=-=∆=--G Pa P molO kJ G Pa P O O , Pa p e O 10')(210-= ⑮ 510-=K ;⑯ 1220ºC10、a) -489120+197.06TlnT J/mol;b) 2.89×10-54 ; c) J G 749429=∆; Ni is stable under this condition, and NiO is not stable; d) Pa p e o 58')(21046.3⨯= e) from the calculation, we found that at 1000ºC,Pa p e o 58')(21046.3⨯=.So at 1000ºC, when theoxygen pressure is less than 3.46×1058Pa, Ni is stable and can not be oxidized, and NiO will be reduced to Ni under this condition.11. a) mol kJ G o /2.23=∆; b)43.42=⎪⎭⎫ ⎝⎛eCO COp p. This is the minimumCO/CO2 ratio required to reduce pure FeO to Fe at 1600ºC. c)2.142=⎪⎭⎫ ⎝⎛eCO CO p p . This is the minimum CO/CO2 ratio required to reduce FeO in a slag( 炉渣) to Fe in a metallic iron melt under the given conditions at 1600ºC.12.%100)1015.3%10⨯⨯-=(Ar。
热力学复习题(带答案)

第一章 绪论一、选择题1.对于同一物系, 内能是体系状态的单值函数概念的错误理解是(D)A. 体系处于一定的状态,具有一定的内能B. 对应于某一状态,内能只能有一数值,不能有两个以上的数值C. 状态发生变化,内能也一定跟着变化D. 对应于一个内能值,可以有多个状态2. 真实气体在什么条件下,其行为与理想气体相近? (D)A 高温高压B 低温低压C 低温高压D 高温低压3. 对封闭体系而言,当过程的始态和终态确定后,下列哪项的值不能确定: (A) A. Q B. Q + W, △U C. W (Q=0), △U D. Q (W=0), △U 二、名词解释1.独立变量与从属变量2. 化工热力学的三要素3.均相封闭系统4.热力学性质三、简答题1.自变量与独立变量、函数与从属变量有何区别?2.为什么当非均相封闭系统中各相达到平衡状态时,每个相都可以视为均相封闭系统?第2章 P-V-T关系和状态方程 一、选择题1. T 温度下的过冷纯液体的压力P(A)A.>B.<C.=D.≤2. T 温度下的过热纯蒸汽的压力P (B)A.>B.<C.=D.=0 3. 能表达流体在临界点的P-V 等温线的正确趋势的virial 方程,必须至少用到 (A ) A. 第三virial 系数 B. 第二virial 系数 C. 无穷项 D. 只需要理想气体方程 4.当时,纯气体的值为 (D )A. 0B. 很高的T 时为0C. 与第三virial 系数有关D. 在Boyle 温度时为零5. 指定温度下的纯物质,当压力低于该温度下的饱和蒸汽压时,则气体的状态为(C ) A. 饱和蒸汽 B. 超临界流体 C. 过热蒸汽 D. 湿蒸汽6. 纯物质的第二virial 系数B (A ) A . 仅是T 的函数 B. 是T 和P 的函数 C . 是T 和V 的函数D. 是任何两强度性质的函数7. 能表达流体在临界点的P-V 等温线的正确趋势的virial 方程,必须至少用到(A ) A. 第三virial 系数 B. 第二virial 系数C. 无穷项D. 只需要理想气体方程8. 对于纯物质,一定温度下的泡点压力与露点压力是(A )A . 相同的 B. 不同的 C.泡点压力高于露点压力D. 泡点压力低于露点压力9. 对于纯物质,一定温度下泡点与露点,在P -T 图上是(A )A. 重叠的B. 分开的C. 交叉的D. 平行的 10. 泡点的轨迹称为(A )A.饱和液相线B. 饱和汽相线()[]P T V P RT,-0→P ()T P s()T P s()T P s ()T P s ()T P s()T P s ()T P s ()T P sC. 超临界曲线D. 升华曲线 11. 露点的轨迹称为(B )A.饱和液相线B. 饱和汽相线C. 汽液平衡线D. 三相线12. 对于混合物,PR 方程常数a 的表达式∑∑==-=3131)1(i j ij jj ii j i k a a y y a 中的相互作用参数kij ,i =j 时,其值(A ) A.为0 B. 为1 C. >1 D. 从实验数据拟合得到,在没有实验数据时,近似作零处理13. 对于混合物,PR 方程常数a 的表达式∑∑==-=3131)1(i j ij jj ii j i k a a y y a 中的相互作用参数kij ,i≠j 时,其值(C ) A 为1 B. 为0 C. 从实验数据拟合得到,在没有实验数据时,近似作零处理D.从实验数据拟合得到,在没有实验数据时,近似作1处理14. 计算纯物质的R-K 方程中的参数a,b,是下列哪个因素的函数。
SYU材料热力学复习题

材料热力学复习题一、填空:1、系统的平衡态是在(系统不受外界作用)的条件下,系统的(宏观物理性质)不随时间变化的状态。
2、逆卡诺循环是由两个(等温)过程、两个(等熵)过程所组成的。
3、G-T关系曲线反映了在(定压)条件下,G函数与温度T之间的关系。
4、dG=dU+PdV- TdS 成立的条件是(等温)。
5、亨利定律和拉乌尔定律分别从(溶质)和(溶剂)的角度描述了溶液的蒸气压。
6、液相或固相与其气相形成(相平衡)时的压强称为饱和蒸汽压。
7、表面能是指(产生单位表面面积所做的可逆功)。
8、两个组元的体系最多可以存在( 4 )相平衡。
9、二元系(组元设为i, j)中α,β和γ三相形成平衡的条件是( 3 )。
10、G-T 关系曲线反映了定压条件下,G 函数与温度T 之间的关系,其斜率的负值表示了体系的(熵)。
二、判断:1、闭口体系的绝热膨胀过程是等熵过程。
(×)2、在等压条件下,闭口体系的熵不变。
(×)3、闭口体系的可逆绝热过程是否为等熵过程。
(√)4、闭口体系的的自由能只能减少不能增加。
( )5、孤立系统的熵的变化不可能通过外界的加热来实现(√)。
6、闭口体系发生相变的方向不一定向着体系自由能减少的方向进行( )7、对于铁在一定温度、一定压力下的固——液平衡,若单一增大压力或提高温度,还有可能保持平衡( )。
8、体系发生相变,则体系的自由能减少。
( )9、三组元的体系中可能存在两相平衡。
( )10混合相的mol 自由能是构成它的两个相互平衡的相的mol 自由能之和( )11、混合相mol自由能绝对不是构成它的两个相互平衡的相mol自由能之和( )12、体系发生相变,则体系的自由能减少。
( )13、母相中形成新相,新相的mol自由能一定要低于原来母相的mol自由能( )14、在等温等压条件下,闭口体系发生平衡相变,则体系的自由能减少。
( )15对于一个体系的平衡相而言亚稳相由于摩尔自由能更高而不能够先出现( )三、简答:1、一个绝热开口体系的熵能减少吗?能增加吗?试举例说明。
最新材料热力学习题解答第一章专业知识讲座

文档来源于网络,文档所提供的信息仅供参考之用,不能作为科学依据,请勿模 仿。文档如有不当之处,请联系本人或网站删除。
10、1.00mol(单原子分子)理想气体,由10.1kPa、300K按下列两种不同的途径 压缩到25.3kPa、300K,试计算并比较两途径的Q、W、ΔU及ΔH。 (1)等压冷却,然后经过等容加热; (2)等容加热,然后经过等压冷却。 解:Cp,m=2.5R,CV,m=1.5R
解:V1=100×8.314×273/101000/28=0.08026m3 (1)温度升高到409.5K
W0;Q U1002.5R(409.5-273)10133(J) 28
H 1003.5R409.5- 273 14186J
28
(2)温度升高到546K
W -10 1 00 .00 8 -08 01 2Q 0 6 6H (1 J)0 3 ;0. 5 (5 R -2 47 6 2 38 ) 372(J) 28
U Q W 28-3 87 12 00 6266(J)(3)ΔU NhomakorabeaΔH=0
W =-Q =-nRV 2 T =-l× n 8.3 × 2 17 × 4l3 n= 2 -5619(J) V 1
文档来源于网络,文档所提供的信息仅供参考之用,不能作为科学依据,请勿模 仿。文档如有不当之处,请联系本人或网站删除。
解:Q=400×103×0.5523×(850-25)×(1+30%)×10-3=236937(kJ) =236937/3600=65.82(kWh)
8、将1000g铜从25℃加热到1200℃,需供给多少热量?已知铜的熔点为1083℃,熔化 热为13560J/mol,Cp(l)=31.40 J·mol-1·K-1,Cp(s)=24.48J·mol-1·K-1。
最新《材料热力学与动力学》复习题

最新《材料热力学与动力学》复习题最新《材料热力学与动力学》复习题篇一:《材料热力学与动力学》复习题一、常压时纯Al的密度为= 2.7 g/cm3,熔点Tm = 660.28 C,熔化时体积增加5%。
用理查德规则和克劳修斯-克拉佩龙方程估计一下,当压力增加等1 GPa时其熔点大约是多少。
二、热力学平衡包含哪些内容,如何判断热力学平衡?三、试比较理想熔体模型与规则熔体模型的异同点。
四、固溶体的亚规则溶体模型中,自由能表示为Gmxi0GiRTxilnxiEGmii其中过剩自由能表示为EGmxAxBLAB(xAxB)实际测得某相中0LAB和1LAB,请分别给出组元A和B的化学位表达式五、向Fe中加入形成元素会使区缩小,但无论加入什么元素也不能使两相区缩小到0.6 at%以内,请说明原因。
六、今有Fe-18Cr-9Ni和Ni80-Cr20两种合金,设其中含碳量为0.1wt%,求T=1273C时碳在这两种合金中活度。
七、假如白口铁中含有3.96%C及2.2%Si,计算在900C时发生石墨化的驱动力,以铸铁分别处于+渗碳体两相状态与+石墨两相状态时碳的活度差来表示此驱动力。
由于Si不进入Fe3C中,所以有KSiCem/= 0。
在Fe-C二元合金中,已知900C时+渗碳体两相状态碳的活度为二aC= 1.04;当与石墨平衡时aC= 1。
八、通过相图如何计算溶体的热力学量如熔化热、组元活度。
九、请说明相图要满足那些基本原理和规则。
十、请说明表面张力产生的原因?十一、已知温度为608 K时,Bi的表面张力为371 mJ/m2,Sn 的表面张力为560 mJ/m2,Bi的摩尔原子面积为6.95104 m2/mol,Sn的摩尔原子面积为6.00104 m2/mol。
试Bi-Sn二元合金的表面张力。
十二、以二元合金为例,分析析出相表面张力对相变的影响。
十三、请解释钢中淬火马氏体低温回火时为什么先析出亚稳化合物而不是稳定的渗碳体(Fe3C)十四、通过原子的热运动,分析影响扩散系数的因素。
材料热力学与动力学复习资料+课后习题

材料热力学与动力学(复习资料)一、 概念•热力学基本概念和基本定律1. 热0:一切互为热平衡的物体,具有相同的温度。
2. 热1: - 焓:恒压体系→吸收的热量=焓的增加→焓变等于等压热效应 - 变化的可能性→过程的方向;限度→平衡3. 热2:任何不受外界影响体系总是单向地趋向平衡状态→熵+自发过程+可逆过程→隔绝体系的熵值在平衡时为最大→熵增原理(隔离体系)→Gibbs 自由能:dG<0,自发进行(同T ,p : )4. 热3:- (H.W.Nernst ,1906): - (M .Plank ,1912):假定在绝对零度时,任何纯物质凝聚态的熵值为零S*(0K)=0 - (Lewis ,Gibson ,1920):对于过冷溶体或内部运动未达平衡的纯物质,即使在0K 时,其熵值也不等于零,而是存在所谓的“残余熵” - Final :在OK 时任何纯物质的完美晶体的熵值等于零• 单组元材料热力学1. 纯金属固态相变的体积效应- 除非特殊理由,所有纯金属加热固态相变都是由密排结构(fcc )向疏排结构(bcc )的转变→加热过程发生的相变要引起体积的膨胀→BCC 结构相在高温将变得比其他典型金属结构(如FCC 和HCP 结构)更稳定(除了Fe )- 热力学解释1→G :温度相同时,疏排结构的熵大于密排结构;疏排结构的焓大于密排结构→低温:H ;高温:TS - 热力学解释2→ Maxwell 方程: - α-Fe →γ-Fe :磁性转变自由能- Richard 规则:熔化熵-Trouton 规则:蒸发熵 (估算熔沸点)2. 晶体中平衡状态下的热空位- 实际金属晶体中空位随着温度升高浓度增加,大多数常用金属(Cu 、Al 、Pb 、W 、Ag …)在接近熔点时,其空位平衡浓度约为10-4;把高温时金属中存在的平衡空位通过淬火固定下来,形成过饱和空位状态,对金属中的许多物理过程(例如扩散、时效、回复、位错攀移等)产生重要影响3. 晶体的热容- Dulong-Petit :线性谐振动子+能量均分定律→适应于较高温度及室温附近,低温时与实验不符U Q W∆=-dH PV U d Q =+=)(δRd Q S Tδ=()d dH TdS G H d TS =--=00lim()lim()0p T T T GS T→→∂∆-=∆=∂()()V T T P V V S ∂∂=∂∂//()()()T T T V P V V S T V H ∂∂+∂∂=∂∂///RK mol J T H S mm m ≈⋅≈∆=∆/3.8/K mol J T H S b v v ⋅≈∆=∆/9.87/3V V VQ dU C RdT dT δ⎛⎫⎛⎫=== ⎪ ⎪⎝⎭⎝⎭-Einstein(固体振动热容理论):晶体总共吸收了n 个声子,被分配到3N 个谐振子中;不适用于极低温度,无法说明在极低温度时定容热容的实验值与绝对温度的3次方成比例。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《材料热力学》复习题
一、在定压热容C p 的经验表达式中,若使用T 2项来代替T -2项,试导出这时的焓(H)、熵(S)和Gibbs 自由能(G)的表达式。
二、已知液体锌的
()
l p C 为
()K mol J C T C l p •︒-⨯+=-/()8505.419(1081.466.293) 固体密排六方锌的
()
l p C 为
())
/(1005.1113.223K mol TJ C s p •⨯+=-,锌的熔点
为692.6K ,熔化热mol J H /80.6589=∆,求固、液相之间随温度变化的自由
能差值()T G ∆。
三、某化合物A m B 的两种晶体结构分别是α、β,相变稳定为在0.1MPa 压力下为400K ,相变潜热为5.02J·mol -1,相变温度随压力的变化为0.005K·MPa -1,400K 时的密度为1.25g·cm-3,A m B 的相对分子量为120,试求该温度下β相的密度。
四、已知纯Sn 在压力为P MPa 时的熔点T sn 为:T sn =238.1+0.0033(P-0.1)℃ 纯Sn 的熔化潜热为58.8J·g -1,0.1MPa 压力下液体的密度为6.988g·cm-3,试求固体的密度。
五、试用G m-X图解法说明,为什么fcc结构的金属加入铁中后,大多会扩展Fe 的fcc结构相区?而Al(fcc结构)为什么却会封闭Fe的fcc相区?
六、根据相图,绘出T1、T2、T3温度下各相(L、α)摩尔自由能-成分曲线的位置关系。
七、根据相图,绘出T1、T2、T3、T4温度下各相(L、α、β)摩尔自由能-成分曲线的位置关系。
八、试用G m-X图中化学势的图解法,解释为什么有的固溶体中会发生上坡扩散?
九、试用G m-X图解法说明,为什么fcc结构的金属加入铁中后,大多会扩展Fe 的fcc结构相区?而Al(fcc结构)为什么却会封闭Fe的fcc相区?
第六题第七题
十、试根据Einstein热容理论,证明Dulong-Petit经验定律的正确性。
十一、根据固溶体自由能曲线分析固溶体的失稳分解。
十二、已知Cr-W二元合金系中固溶体α相的相互作用参数IαAB=33.50kJ·mol-1,试计算或列出α相的Spinodal分解曲线及溶解度间隙。
十三、试用摩尔自由能-成分图说明:1)为什么碳素钢在淬火后回火时,渗碳体的粒子越细,其周围的铁素体中的含碳量越高?2)为什么碳素钢的淬火马氏体在200℃以下低温回火时,首先析出的并不是渗碳体而是更富碳的ε碳化物?
十四、试根据Al-Mg二元相图中Mg17Al12在Mg基固溶体(β)中的溶解度数据(见下表),求Mg17Al12的生成自由能。
溶解度(Al)at.% 11 8.2 6.1 4.3 2.9 1.7 十五、经测定Fe-V固溶体(α)在1600K的活度如下表,试用正规溶体近似求Fe-V固溶体α中的相互作用能。
XαV0.1 0.2 0.3 0.4 0.5 0.6
ααV0.014 0.047 0.103 0.188 0.312 0.470 十六、试述Bragg-Williams近似和双亚点阵模型的构建、结论和应用。
十七、试用图解法标出,在某一温度T某一二元过饱和固溶体α在析出另一结构的化合物 时,如何确定相变驱动力和形核驱动力。
十八、谈谈自己对本课程的认识和建议(本问不计分)。
