高中化学必修一第二章知识点总结及练习.
高中化学必修一第二章氧化还原反应知识点

第三节氧化还原反应杭信一中何逸冬一、氧化还原反应1、氧化反应:元素化合价升高的反应还原反应:元素化合价降低的反应氧化还原反应:凡是有元素化合价升降的反应2、氧化还原反应的实质——电子的转移(电子的得失或共用电子对的偏离)口诀:失电子,化合价升高,被氧化(氧化反应),还原剂得电子,化合价降低,被还原(还原反应),氧化剂3、氧化还原反应的判断依据——有元素化合价变化失电子总数=化合价升高总数=得电子总数=化合价降低总数4、氧化还原反应中电子转移的表示方法○1双线桥法——表示电子得失结果○2单线桥法——表示电子转移情况5、氧化还原反应与四种基本反应类型的关系【习题一】(2018•绍兴模拟)下列属于非氧化还原反应的是()A.2FeCl2+Cl2═2FeCl3B.ICl+H2O═HCl+HIOC.SiO2+2C高温Si+2CO↑D.2Na+O2点燃Na2O2【考点】氧化还原反应.氧化还原反应的先后规律【专题】氧化还原反应专题.【分析】氧化还原反应的特征是元素化合价的升降,从元素化合价是否发生变化的角度判断反应是否属于氧化还原反应,以此解答。
【解答】解:A.Fe和Cl元素的化合价发生变化,属于氧化还原反应,故A不选;B.元素化合价没有发生变化,属于复分解反应,故B选;C.C和Si元素的化合价发生变化,属于氧化还原反应,故C不选;D.Na和O元素化合价发生变化,属于氧化还原反应,故D不选。
故选:B。
【习题二】(2015春•高安市校级期中)下列说法正确的是()A.1mol Cl2与足量Fe反应,转移电子的物质的量为3molB.工业可采用火法炼铜:Cu2S+O2═2Cu+SO2,每生成2mol铜,反应共转移6mol电子C.称取25g CuSO4•5H2O固体溶于75g水中,所得溶液中溶质的质量分数为25%D.NO和NO2的混合气体共1mol,其中氮原子数为2mol【考点】氧化还原反应的电子转移数目计算;物质的量的相关计算.电子守恒法的计算【分析】A.根据转移电子=化合价变化×物质的量计算;B.根据转移电子=化合价变化×物质的量计算;C.根据溶液溶质的质量分数=×100%计算;D.根据一个分子中含1个氮原子判断.【解答】解:A.1mol Cl2与足量Fe反应,Cl元素由0价降低为-1价,所以1mol Cl2与足量Fe反应,转移电子的物质的量为2mol,故A错误;B.由方程式可知,每生成1molSO2,有1mol硫被氧化生成SO2,转移电子为1mol ×[4-(-2)]=6mol,故B正确;C.称取25gCuSO4•5H2O固体溶于75g水中,则含硫酸铜为25×=16g,则所得溶液中溶质的质量分数为16%,故C错误;D.因为论NO还是二氧氮还是NO和NO2的混合气体都是一个分子中含1个氮原子,所以NO和NO2的混合气体共1mol,其中氮原子数为1mol,故D错误。
人教版化学必修一第二章知识点总结A4-终极版

第二章化学物质及其变化一、物质的分类《优化方案》P27 知道各种物质之间的关系二、分散系相关概念1、分散系:一种物质(或几种物质)分散到另一种物质(或多种物质)中所得到的体系,叫做分散系。
分散质:被分散的物质;分散剂:起容纳分散质的作用的物质。
2、分散系的分类(1)按照分散质粒子的大小:溶液、胶体和浊液。
分散质粒子直径小于1nm的分散系叫溶液,在1nm-100nm之间的分散系称为胶体,而分散质粒子直径大于100nm的分散系叫做浊液。
(2)按照分散质和分散剂的状态,可以分为九种。
比较三种分散系的不同:《优化方案》P31注意:三种分散系的本质区别:分散质粒子的大小不同。
三、胶体分散质粒子直径大小在1nm-100nm之间的分散系1、胶体的分类①根据分散质微粒组成分子胶体如:蛋白质胶体(蛋白质溶液)、淀粉胶体(淀粉溶液)粒子胶体如: AgI胶体、Fe(OH)3胶体、Al(OH)3胶体气溶胶如:烟、云、雾、灰尘②根据分散剂的状态划分液溶胶如:AgI胶体、Fe(OH)3胶体、Al(OH)3胶体固溶胶如:烟水晶、有色玻璃、合金2、Fe(OH)3胶体的制备、硅酸胶体的制备、碘化银胶体的制备(1)Fe(OH)3胶体的制备Δ取一个干燥洁净的小烧杯,加入25mL蒸馏水,将烧杯中的水加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热,得到的分散系即为Fe(OH)3胶体。
反应的化学方程式为 FeCl3+3H2O=== Fe(OH)3(胶体)+3HCl(2)硅酸胶体的制备在试管中加入3-5mL Na2SiO3溶液(饱和的Na2SiO3溶液按1:2或者1:3的体积比用蒸馏水稀释),滴入1-2滴酚酞溶液,再用胶头滴管逐滴加入稀盐酸,边加边振荡,至溶液红色变浅并接近消失。
静置。
反应的化学方程式为 Na2SiO3+2HCl=H2SiO3(胶体)+2NaCl(3)碘化银胶体的制备在碘化钾稀溶液中加入少量的硝酸银溶液,边滴入边震荡。
高中化学必修一第二章复习知识点整理

学习必备 欢迎下载高一化学必修 1 第二章复习提纲及试题第二章 化学物质及变化班别 ________________ 姓名 _________________第一节 物质的分类1、物质的分类方法有多种,常见的有:树状分类法、交叉分类法等等。
用树状分类法将物质分类一般分为:混合物:溶液、浊液、胶体金属单质: Na 、 Fe 、 Cu 等物质单质非金属单质: Cl 2、 H 2、、 O 2、 O 3、 C 60 等纯净物酸: HCl 、 H CO 等2 3无机化合物碱: NaOH 、 Ba (OH ) 2、NH · H O 等32化合物盐: Na 2 CO 、 NaHSO 、Cu ( OH ) (CO )23423氧化物: CO 、 CO 、 CuO 等2有机化合物 : CHCOOH 、CH 、 C H 、 CHCHOH 等342 632[ 练习 1] .下列各组物质分类正确的是( )酸碱盐 氧化物 A 硫 酸 纯 碱 氯化钠 铁红B 氢硫酸 烧碱纯 碱 生石灰C碳 酸 熟石灰 蔗 糖水D 二氧化碳苛性钾食盐石灰石2、胶体的概念和性质①概念——分散质微粒的直径大小在1nm ~ 100nm 之间的分散系称做“胶体”。
根据分散剂状态,可将胶体分为液 溶胶,如氢氧化铁胶体、淀粉溶液;气溶胶,如云、雾、烟;固溶胶,如有色玻璃、烟水晶。
②胶体有如下的性质丁达尔效应——丁达尔效应是粒子对光散射作用的结果。
布朗运动——在胶体中, 由于质点在各个方向所受的力不能相互平衡而产生的无规则的热运动,称为“布朗运动” 。
* 电泳——在外加电场的作用下,胶体的微粒在分散剂里向阴极(或阳极)做定向移动的现象。
注意:电泳只是胶粒定向地向电极运动,并没有凝聚而沉淀。
凝聚——胶体分散系中,分散质微粒相互聚集而下沉的现象称为“凝聚”。
能促使溶胶凝聚的物理或化学因素有加电解质(酸、碱及盐)、加热、溶胶浓度增大、加带相反电荷的胶体等。
高中化学必修一第二章知识点总结及练习

高中化学必修一第二章知识点总结及练习一、物质的分类混合物金属单质单质非金属单质物质稀有气体酸性氧化物纯净物氧化物碱性氧化物其他氧化物化合物酸无机物碱盐有机物(缺2、分散系及其分类把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系,叫分散系。
被分散的物质称作分散质(可以是气体、液体、固体),起容纳分散质作用的物质称作分散剂(可以是气体、液体、固体)。
溶液、胶体、浊液三种分散系的比较二、物质的化学变化1、物质之间可以发生各种各样的化学变化,依据一定的标准可以对化学变化进行分类。
(1)、根据反应物和生成物的类别以及反应前后物质种类的多少可以分为:A、化合反应(A+B=AB)H2+O2=H2OB、分解反应(AB=A+B)KCIO3△KCI+O2↑C、置换反应(A+BC=AC+B)CuO+H2=Cu+H2OD、复分解反应(AB+CD=AD+CB)CaCI2+Na2CO3=CaCO3↓+2NaCI(2)根据反应中是否有离子参加可将反应分为:A、离子反应:有离子参加的一类反应。
主要包括复分解反应和有离子参加的氧化还原反应。
B、分子反应(非离子反应)(3)根据反应中是否有电子转移可将反应分为:A、氧化还原反应:反应中有电子转移(得失或偏移)的反应实质:有电子转移(得失或偏移)特征:反应前后元素的化合价有变化B、非氧化还原反应2、离子反应(1)、电解质:在水溶液中或熔化状态下能导电的化合物,叫电解质。
酸、碱、盐都是电解质。
酸:电离时生成的阳离子全部是氢离子的化合物碱:电离时生成的阴离子全部是氢氧根离子的化合物。
盐:电离时生成金属离子(或铵根离子)和酸根离子的化合物在水溶液中或熔化状态下都不能导电的化合物,叫非电解质。
注意:①电解质、非电解质都是化合物,不同之处是在水溶液中或融化状态下能否导电。
②电解质的导电是有条件的:电解质必须在水溶液中或熔化状态下才能导电。
③能导电的物质并不全部是电解质:如铜、铝、石墨等。
高中化学必修一第二章海水中的重要元素氯和钠考点总结(带答案)

高中化学必修一第二章海水中的重要元素氯和钠考点总结单选题1、下列关于物质的量浓度表述正确的是A.0 .2 mol/L Na2SO4溶液中含有Na+和SO42-总物质的量为0 .6 molB.将62g Na2O溶于水中,配成1L溶液,所得溶质的物质的量浓度为1 mol/LC.用1 L水吸收22 .4L氯化氢(标况下)所得盐酸的浓度是1 mol/LD.10g 98%的硫酸(密度为1 .84g·cm-3)与10ml 18 .4 mol/L的硫酸浓度相等答案:DA.溶液体积未知,无法计算Na+和SO42-物质的量,故A错误;B.62g Na2O的物质的量为1mol,溶于水后与水反应生成氢氧化钠的物质的量为2mol,则配成1L溶液,所得溶质的物质的量浓度为2 mol/L,故B错误;C.用1L水吸收22 .4L氯化氢(标况下)所得盐酸的体积不是1L,无法计算盐酸物质的量浓度,故C错误;D.根据公式c=1000ρωM =1000×1 .84×98%98=18 .4mol/L,则10g 98%的硫酸(密度为1 .84g·cm—3)与10mL 18 .4mol·L—1的硫酸的浓度是相同的,故D正确;答案选D。
2、已知1 .505×1023个X气体分子的质量为8g,则X气体的摩尔质量是A.64gB.32gC.64g/molD.32g/mol答案:D根据n=N/N A,计算出1 .505×1023个X气体分子的物质的量为0 .25mol,结合其质量为8g,利用n=m/M的关系,可得M(X)=32g/mol。
故选D。
3、某化学小组探究卤族元素的性质,进行如图所示的实验(a~d均为浸有相应试液的棉花,夹持装置略)。
下列说法正确的是A.具支试管中发生反应的化学方程式为NaClO+2HCl=NaCl+Cl2↑+H2OB.若a处变为橙色,b处变为蓝色,说明非金属性Cl>Br>IC.若c处褪色,说明KMnO4与Cl2发生反应D.若d处褪色,说明Cl2具有漂白性答案:AA.84消毒液的有效成分为NaClO,与浓盐酸发生归中反应生成氯气,反应的化学方程式为NaClO+2HCl= NaCl+Cl2↑+H2O,A正确;B.具支试管产生氯气在a处于KBr发生置换反应生成Br2,溶液变橙色,可得氧化性Cl2>Br2,b处氯气和KI 反应生成I2,淀粉遇碘单质变蓝,可得氧化性:Cl2>I2,但未知I2与Br2的氧化性强弱,无法得到非金属性Cl> Br>I,B错误;C.浓盐酸具有挥发性,HCl气体也能与酸性KMnO4溶液发生氧化还原反应使溶液褪色,不能说明是KMnO4与Cl2发生反应,C错误;D.氯气和NaOH溶液反应生成NaCl和NaClO,溶液碱性变弱,酚酞溶液褪色,不是氯气的漂白性造成的,D 错误;故选:A。
高中化学必修一第一二章知识点梳理

第一章物质及其变化第一节物质的分类及转化一、物质的分类1.同素异形体:由一种元素形成的几种性质不同的单质。
如:金刚石和石墨、白磷(P4)和红磷、氧气和臭氧。
2.分类方法(1)树状分类:对同类事物进行再分类的方法。
单质:O2、Fe、He等纯净物有机化合物:CH4、葡萄糖、酒精(乙醇)等。
化合物酸:电离出的阳离子全部是氢离子。
无机化合物碱:电离出的阴离子全部是氢氧根。
物质盐:由金属阳离子或NH4+与酸根离子结合。
氧化物:只含两种元素,其中一种是氧元素。
溶液:NaCl溶液、稀硫酸等。
混合物胶体:Fe(OH)3胶体、淀粉胶体等。
浊液:泥水。
①酸的分类:一元酸:HCl、HNO3、CH3COOH等。
含氧酸:HNO3、H2SO4等。
酸二元酸:H2CO3、H2SO4等。
酸多元酸:H3PO4等。
无氧酸:HCl、H2S等。
强酸:HCl、H2SO4、HNO3、HClO4、HBr、HI等。
酸弱酸:H2CO3、CH3COOH、HClO、HF、H2SO3等。
②碱的分类:一元碱:NaOH、NH3·H2O 等。
可溶性碱:四大强碱和NH3·H2O 碱二元碱:Mg(OH)2、Cu(OH)2 等。
碱多元碱:Fe(OH)3、Al(OH)3 等。
难溶性碱:Mg(OH)2、Cu(OH)2 等。
强碱:KOH、NaOH、Ca(OH)2、Ba(OH)2;碱弱碱:NH3·H2O、Cu(OH)2、Mg(OH)2等。
③盐的分类正盐:既不能电离出H+,也不能电离出OH-的盐,如Na2CO3、CuSO4 等。
盐酸式盐:酸根能电离出H+的盐,如NaHCO3、NaHSO4 等。
碱式盐:能电离出OH-的盐,如Cu2(OH)2CO3等。
④氧化物的分类:依据氧化物的性质,可将氧化物分为酸性氧化物、碱性氧化物、两性氧化物及不成盐氧化物。
酸性氧化物:与碱反应只生成盐和水的氧化物。
如CO2、SO2、SiO2等。
碱性氧化物:与碱反应只生成盐和水的氧化物。
高中化学必修一第二章复习知识点整理

高一化學必修1第二章復習提綱及試題第二章化學物質及變化班別________________ 姓名_________________第一節物質の分類1、物質の分類方法有多種,常見の有:樹狀分類法、交叉分類法等等。
用樹狀分類法將物質分類一般分為:混合物:溶液、濁液、膠體金屬單質:Na、Fe、Cu等物質單質非金屬單質:Cl2、H2、、O2、O3、C60等純淨物酸:HCl、H2CO3等無機化合物堿:NaOH、Ba(OH)2、NH3·H2O等化合物鹽:Na2CO3、NaHSO4、Cu(OH)2(CO3)2氧化物:CO、CO2、CuO等有機化合物:CH3COOH、CH4、C2H6、CH3CH2OH等[練習2、膠體の概念和性質①概念——分散質微粒の直徑大小在1nm~100nm之間の分散系稱做“膠體”。
根據分散劑狀態,可將膠體分為液溶膠,如氫氧化鐵膠體、澱粉溶液;氣溶膠,如雲、霧、煙;固溶膠,如有色玻璃、煙水晶。
②膠體有如下の性質丁達爾效應——丁達爾效應是粒子對光散射作用の結果。
布朗運動——在膠體中,由於質點在各個方向所受の力不能相互平衡而產生の無規則の熱運動,稱為“布朗運動”。
*電泳——在外加電場の作用下,膠體の微粒在分散劑裏向陰極(或陽極)做定向移動の現象。
注意:電泳只是膠粒定向地向電極運動,並沒有凝聚而沉澱。
凝聚——膠體分散系中,分散質微粒相互聚集而下沉の現象稱為“凝聚”。
能促使溶膠凝聚の物理或化學因素有加電解質(酸、堿及鹽)、加熱、溶膠濃度增大、加帶相反電荷の膠體等。
[練習2].下列關於膠體和溶液の說法中,不正確の是 ()A、膠體粒子直徑為1-100nm,比較穩定,無色透明B、往Fe(OH)3膠體中逐滴加入稀硫酸會產生沉澱而後沉澱逐漸溶解C、江河入海口三角洲の形成通常與膠體の性質有關D、濁液、溶液、膠體の本質特徵在於分散質粒子大小不同第二節離子反應1、電解質與非電解質①電解質:在水溶液裏或熔化狀態下能夠導電の化合物,如酸、堿、鹽、水、金屬氧化物等。
部编版高中化学必修一第二章海水中的重要元素氯和钠带答案知识点总结(超全)

(名师选题)部编版高中化学必修一第二章海水中的重要元素氯和钠带答案知识点总结(超全)单选题1、下列关于物质的量的叙述,正确的是A.1mol任何物质都含有6 .02×1023个分子B.0 .012kg12C中含有约6 .02×1023个碳原子C.1mol水中含有2mol氢和1mol氧D.1molH含有2×6 .02×1023个电子2、下列有关Na2O和Na2O2的叙述中,正确的是A.Na2O比Na2O2稳定B.只用水来确定某Na2O粉末中是否含有Na2O2C.Na2O、Na2O2分别与CO2反应,产物相同D.将足量的Na2O2比Na2O分别加到酚酞溶液中,最终溶液均为红色3、设阿伏加德罗常数的值为N A,则下列说法正确的是A.常温常压下,22g CO2气体中含有的原子数为N AB.0 .5mol⋅L−1Na2SO4溶液中,含有的钠离子总数为N AC.2 .3g钠由原子变成离子时,失去的电子数为0 .1N AD.N A个一氧化碳分子和0 .5mol甲烷的原子个数比为5∶44、如图所示,甲、乙、丙常温下都为气体,2mol甲反应生成1mol丙和3mol乙,下列判断不正确的是A.1个乙分子中含有2个H原子B.甲的摩尔质量为17 g∙mol−1C.同温同压下,生成丙和乙的体积比为1∶3D.化学反应中各物质的质量之比等于2:1:35、下列有关焰色试验的叙述正确的是A.焰色试验是元素的化学性质B.可以用稀硫酸清洗用过的铂丝C.节日燃放的五彩缤纷的烟花,是某些金属化合物所呈现的各种艳丽色彩D.钠元素的焰色必须通过蓝色的钴玻璃观察6、下列叙述正确的是A.O2的摩尔体积约为22 .4LB.1molCO2的质量为44g/molC.80g NaOH溶解在水中配成1L溶液,所得溶液中溶质的物质的量浓度为2mol/L D.18g H2O在标准状况下的体积约为22 .4L7、下列离子方程式正确的是A.FeBr2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl-B.将氧气通入酸性碘化钾溶液中:2I-+O2+4H+I2+2H2OC.实验室制取少量氯气:MnO2+2H++2Cl-Mn2++Cl2+H2OD.氯气溶于水:Cl2+H2O2H++Cl-+ClO-8、下列溶液中,跟200mL 1 mol·L-1 NaCl溶液所含的Cl-物质的量浓度相同的是A.100mL 0 .5 mol·L-1MgCl2溶液B.200mL 1 mol·L-1 CaCl2溶液C.50ml 4 mol·L-1 NaCl溶液D.25ml 0 .5 mol·L-1HCl溶液多选题9、有列有关氯及其化合物说法中不正确...的是A.新制氯水可使蓝色石蕊试纸先变红后褪色B.次氯酸具有强氧化性,能杀死水中的病菌,起到消毒的作用C.氢气在氯气中燃烧,安静燃烧,发出苍白色火焰,瓶口有白烟D.氯水久置后,漂白性和酸性均减弱10、向100mL0 .01mol⋅L−1Ba(OH)2溶液中滴加0 .1mol⋅L−1NaHCO3溶液,测得溶液电导率的变化如图所示。
厦门市高中化学必修一第二章《海水中的重要元素—钠和氯》知识点总结(含答案解析)

一、填空题1.氯及其化合物在生产、生活中有着广泛的用途(1)次氯酸钠是最普通的家庭洗涤中的“氯”漂白剂和消毒剂。
已知“84消毒液”的主要成分是次氯酸钠,在清洗卫生间时,若将“洁厕灵”与“84消毒液”混合使用会发生氯气中毒事件。
请从氧化还原反应的角度分析原因:_______________________。
(2)漂白粉的有效成分是:______________(填化学式),老师新买的漂白粉没有保存说明书,请你为漂白粉设计一份保存注意事项(不超过20个字):_____________,漂白粉久置后其成分除CaCl2外还含有______________ (填化学式),请你设计实验方案证明该固体粉末含Cl-离子:____________________________。
(3)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。
高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下述离子方程式Fe(OH)3+ClO-+OH-FeO+□:_____________________________。
→2-4(4)ClO2是一种消毒、杀菌效率高、二次污染小的水处理剂。
实验室可通过以下反应制得2KClO3+H2C2O4+H2SO4 =2ClO2↑+K2SO4+2CO2↑+2H2O①请用双线桥表示反应中电子转移的方向和数目: 2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O:______________________。
②上述反应中,当生成1 mol ClO2分子时,转移电子的物质的量为:___________mol。
③Cl2和ClO2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-,则ClO2和Cl2相同质量时,ClO2的消毒能力是Cl2的___________倍。
(5)ClO2在工业上的一种生产工艺如图所示:请写出“反应”步骤中生成CO2的化学方程式:________________。
高中化学必修一第二章《海水中的重要元素—钠和氯》知识点总结

一、填空题1.(1)铁在氯气中加热的化学方程式为:___________(2)碳酸氢钠受热分解的化学方程式为:___________(3)实验室制备高铁酸钾的原理为 Cl2+Fe(OH)3+KOH→K2FeO4+KCl+H2O,该反应的离子方程式为:___________(4)若温度超过40℃,Cl2与NaOH 溶液反应生成NaClO3和NaCl,该反应的离子方程式为:___________(5)写出Cu在H2O2作用下和稀硫酸反应生成硫酸铜的化学方程式:___________(6)0.2molCO2通入100mL3mol/L的NaOH 溶液,该反应的离子方程式为_________________2.(1)选择下列实验方法分离物质,将分离方法的序号填在横线上。
A萃取分液 B升华 C结晶 D过滤 E蒸馏 F分液①分离饱和食盐水与沙子的混合物______;②从硝酸钾和氯化钠的混合液中获得硝酸钾________;③从碘水中提取碘单质______;④分离CCl4,(沸点为76.75℃)和甲苯(沸点110.6℃)的混合物_________。
(2)实验室用NaCO3·10H2O晶体配制0. 5mol/L的Na2CO3溶液970mL,应用托盘天平称取Na2CO3·10H2O的质量是______。
(3)已知两种碱AOH和BOH的摩尔质量之比为5:7,现将7molAOH与5mol BOH混合后,从中取出5.6g,恰好可以中和100mL浓度为1.2mol/L的盐酸,则AOH的摩尔质量为____。
(4)某学生欲用12mol·L-1浓盐酸和蒸馏水配制500 mL 0.3 mol·L-1的稀盐酸。
①该学生需要用量筒量取____ mL 上述浓盐酸进行配制。
②下列实验操作会导致所配制的稀盐酸的物质的量浓度偏小的是_____(填序号)。
a用量筒量取浓盐酸时俯视观察凹液面b将量取浓盐酸的量筒进行洗涤,并将洗涤液转移到容量瓶中c稀释浓盐酸时,未冷却到室温即转移到容量瓶中d定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水e容量瓶洗涤干净后未于燥3.(1)在标准状况下,4g H2、11.2L O2、1mol H2O中,含原子数最多的是____,体积最小的是______。
人教版高中化学必修一第二章知识点总结

人教版高中化学必修一第二章知识点总结
很多高中生感觉化学很难,一方面是化学公式太多,另外一方面是学生的生活实践经验少,理解化学现象的难度大。学会去总结每个章节的重要知识点,现店铺整理了人教版必修1第二章的知识点,希望可以帮到你!
人教版高中化学必修一第二章知识点总结 将本文的Word文档下载到电脑,方便收藏和打印 推荐度: 点击下载文档Байду номын сангаас档为doc格式
高一化学第二章知识点带答案
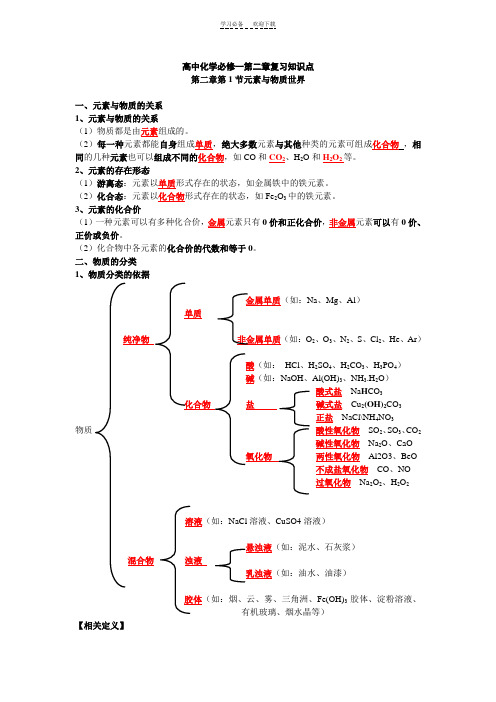
高中化学必修一第二章复习知识点第二章第1节元素与物质世界一、元素与物质的关系1、元素与物质的关系(1)物质都是由元素组成的。
(2)每一种元素都能自身组成单质,绝大多数元素与其他种类的元素可组成化合物,相同的几种元素也可以组成不同的化合物,如CO和CO2、H2O和H2O2等。
2、元素的存在形态(1)游离态:元素以单质形式存在的状态,如金属铁中的铁元素。
(2)化合态:元素以化合物形式存在的状态,如Fe2O3中的铁元素。
3、元素的化合价(1)一种元素可以有多种化合价,金属元素只有0价和正化合价,非金属元素可以有0价、正价或负价。
(2)化合物中各元素的化合价的代数和等于0。
二、物质的分类1、物质分类的依据金属单质(如:Na、Mg、Al)单质纯净物非金属单质(如:O2、O3、N2、S、Cl2、He、Ar)酸(如:HCl、H2SO4、H2CO3、H3PO4)碱(如:NaOH、Al(OH)3、NH3.H2O)酸式盐Na H CO3化合物盐碱式盐Cu2(OH)2CO3正盐NaCl\NH4NO3物质酸性氧化物SO2、SO3、CO2碱性氧化物Na2O、CaO氧化物两性氧化物Al2O3、BeO不成盐氧化物CO、NO过氧化物Na2O2、H2O2溶液(如:NaCl溶液、CuSO4溶液)悬浊液(如:泥水、石灰浆)混合物浊液乳浊液(如:油水、油漆)胶体(如:烟、云、雾、三角洲、Fe(OH)3胶体、淀粉溶液、有机玻璃、烟水晶等)【相关定义】(1)酸性氧化物:能和碱反应(不能跟酸反应),只生成盐和水的氧化物。
(判断酸性氧化物时,看面相,大多数非金属氧化物属于酸性氧化物,例外的见注意部分)(2)碱性氧化物:能和酸反应(不能跟碱反应),只生成盐和水的氧化物。
(判断碱性氧化物时,也看面相,大多数金属氧化物属于碱性氧化物,例外的见注意部分)(3)两性氧化物:既能和酸又能和碱反应的氧化物。
(只需要记住Al2O3这个例子)(4)不成盐氧化物:不能与酸或碱反应生成相应价态的盐和水的氧化物叫做不成盐氧化物。
人教版高中化学必修一第二章归纳与整理

A.1.0mol B.1.2mol
C.0.3mol D.2.2mol
讨论3:我国科学家在世界上第一次为一种名为“钴酞菁”的分子 (直径为1.3×10-9 m)恢复了磁性。“钴酞菁”分子结构和性质与人 体内的血红素及植物体内的叶绿素非常相似。下列说法中不正 确的是( )B A.“钴酞菁”分子所形成的分散系具有丁达尔效应 B.“钴酞菁”分子不能透过滤纸 C.此项工作可以用来改变分子的某些物理性质 D.此项工作可广泛应用于光电器件、生物技术等方面
还原剂: 升、失、氧(化、还原剂) 氧化剂: 降、得、还(原、氧化剂)
氧化还原反应的表示方法:
(1)“双线桥”法
得 2e-
(2)“单线桥”法
2e-
+2
CuO
+
0
H2
=△==
0
Cu
+
+1
H2O
CuO + H2 =△== Cu + H2O
失 2×eA、描述同种元素的变化过
程。箭头连接反应前后 不同价态的同种元素, 且从反应物指向生成物。
(二)基本规律
高氧低还中兼有 1、价态规律
价态归中
2、强弱规律: 强强得弱弱
3、先后规律: 强者优先 化合价升降守恒
4、守恒规律 得失电子守恒
讨论9:已知浓H2SO4和Fe3+都可以将Cu氧化(Fe3+与Cu的反应 为:2Fe3++Cu=2Fe2++Cu2+),浓H2SO4还可以将Br-氧化成Br2, Fe与Br2反应生成FeBr3,则有关物质氧化性强弱的顺序为 ( )。
三、氧化还原反应
(一)基本概念 化合价降低,得到电子,被还原
高一化学必修一第二章知识点总结

高一化学必修一第二章知识点总结必修一化学第二章知识胶体1、胶体的定义:分散质粒子直径大小在10-9~10-7m之间的分散系。
2、胶体的分类:①. 根据分散质微粒组成的状况分类:如:胶体胶粒是由许多等小分子聚集一起形成的微粒,其直径在1nm~100nm之间,这样的胶体叫粒子胶体。
又如:淀粉属高分子化合物,其单个分子的直径在1nm~100nm范围之内,这样的胶体叫分子胶体。
②. 根据分散剂的状态划分:如:烟、云、雾等的分散剂为气体,这样的胶体叫做气溶胶;AgI溶胶、溶胶、溶胶,其分散剂为水,分散剂为液体的胶体叫做液溶胶;有色玻璃、烟水晶均以固体为分散剂,这样的胶体叫做固溶胶。
3、胶体的制备A. 物理方法① 机械法:利用机械磨碎法将固体颗粒直接磨成胶粒的大小② 溶解法:利用高分子化合物分散在合适的溶剂中形成胶体,如蛋白质溶于水,淀粉溶于水、聚乙烯熔于某有机溶剂等。
B. 化学方法① 水解促进法:FeCl3+3H2O(沸)= (胶体)+3HCl② 复分解反应法:KI+AgNO3=AgI(胶体)+KNO3 Na2SiO3+2HCl=H2S增大胶粒之间的碰撞机会。
如蛋思考:若上述两种反应物的量均为大量,则可观察到什么现象?如何表达对应的两个反应方程式?提示:KI+AgNO3=AgI↓+KNO3(黄色↓)Na2SiO3+2HCl=H2SiO3↓+2NaCl(白色↓)4、胶体的性质:① 丁达尔效应——丁达尔效应是粒子对光散射作用的结果,是一种物理现象。
丁达尔现象产生的原因,是因为胶体微粒直径大小恰当,当光照射胶粒上时,胶粒将光从各个方面全部反射,胶粒即成一小光源(这一现象叫光的散射),故可明显地看到由无数小光源形成的光亮“通路”。
当光照在比较大或小的颗粒或微粒上则无此现象,只发生反射或将光全部吸收的现象,而以溶液和浊液无丁达尔现象,所以丁达尔效应常用于鉴别胶体和其他分散系。
② 布朗运动——在胶体中,由于胶粒在各个方向所受的力不能相互平衡而产生的无规则的运动,称为布朗运动。
化学必修一第二章知识点总结

化学必修一第二章知识点总结第二章化学反应及能量变化2.1 化学反应的描述1. 化学反应的定义化学反应是指物质之间发生化学变化,产生新的物质的过程。
在化学反应中,原有物质的化学键破裂并重新排列,形成新的物质。
2. 化学方程式化学方程式是用化学式表示的化学反应过程。
化学反应的起始物质叫做反应物,产物是由反应得到的新物质。
3. 化学方程式的平衡化学方程式必须满足物质守恒和电荷守恒的要求,反应物和产物的物质量必须相等。
当反应物和产物的物质量不等时,需要进行平衡处理,使得反应方程式满足物质守恒原理。
4. 配平化学方程式的方法通过调整反应物和产物的系数,使得反应物和产物的物质量相等,从而达到化学方程式的平衡,这个过程叫做配平化学方程式。
5. 化学方程式的表示方法化学方程式可以用文字描述,也可以用化学式和化学符号来表示。
在化学方程式中,反应物和产物之间用箭头表示反应方向,反应条件和催化剂用在反应方程式的上下标表示。
2.2 化学反应中的能量变化1. 化学反应中的能量变化化学反应中的能量变化包括放热反应和吸热反应。
放热反应是指化学反应中释放出能量,反应过程温度升高的反应。
吸热反应是指化学反应中吸收能量,反应过程温度降低的反应。
2. 化学反应中的焓变化焓是能量的一种表现形式,称为热化学基本量。
焓变是指化学反应中物质焓值的变化。
焓变可以分为焓增、焓减和焓无变化三种情况。
3. 化学反应中的热变化化学反应中的热变化可以通过反应物和产物的焓值来计算。
当焓增时表示放热反应,焓减时表示吸热反应。
物质的焓变化是其宏观性质的反映。
4. 化学反应的热效应化学反应的热效应是指化学反应在恒压下的焓变化。
热效应可以用来判断反应的放热或是吸热,以及反应的放热或吸热程度。
5. 化学反应的热化学图表示化学反应的热化学图是指用焓数值和反应物质量的关系对化学方程式进行定量描述。
热化学图可以通过焓变计算反应物质和产物的热变化。
2.3 化学能及化学反应的能量变化1. 化学反应的能量来源化学反应的能量来源于原子和分子之间的化学键。
部编版高中化学必修一第二章海水中的重要元素氯和钠知识点总结归纳完整版

(名师选题)部编版高中化学必修一第二章海水中的重要元素氯和钠知识点总结归纳完整版单选题1、已知硫有多种同素异形体,其中一种同素异形体的分子式为S8。
下列关于S8的说法中,正确的是A.1个这种硫分子的质量为256 g,是硫原子质量的8倍B.在标准状况下,1mol S8的体积约为22 .4 LC.1mol S8和1molH2O所含分子数相同D.1 molS8与N A个H2O所含原子数相同答案:CA.1个这种硫分子的质量为256g,1个这种硫分子由8个硫原子构成,则1个这种分子的质量是硫原子6 .02×1023质量的8倍,A错误;B.S8在标准状态下为固体,1mol S8的体积原因小于22 .4L,B错误;C.1mol S8和1molH2O所含分子数相同,均为6 .02×1023,C正确;D.1 molS8含8mol原子,N A个H2O含3mol原子,1 molS8与N A个H2O所含原子数不相同,D错误;选C。
2、下列有关钠及其化合物的叙述错误的是A.Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂B.高压钠灯发出的黄光透雾能力强,可用于道路和广场照明C.氢氧化钠具有强碱性,可用于制胃酸中和剂D.钠长期暴露在空气中的最终产物是Na2CO3答案:CA.Na2O2吸收CO2产生O2,所以Na2O2可用作呼吸面具供氧剂,A正确;B.钠的焰色反应为黄色,则可用作透雾能力强的高压钠灯,B正确;C.氢氧化钠具有腐蚀性,不能用于中和胃酸,一般用氢氧化铝、碳酸镁、碳酸氢钠等,C错误;D.钠与氧气反应生成氧化钠,氧化钠与水反应生成氢氧化钠,氢氧化钠潮解,氢氧化钠溶液吸收二氧化碳生成碳酸钠晶体,碳酸钠晶体风化得到碳酸钠,D正确。
故选C。
3、某化学小组用如图所示装置制取氯气,下列说法正确的是A.该装置中只存在两处错误B.如果MnO2过量,浓盐酸就可全部被消耗C.可用湿润的淀粉-碘化钾试纸检验氯气D.若要干燥氯气,可使用碱石灰答案:CA.装置中没有酒精灯加热,尾气未进行处理,使用的是长颈漏斗,收集的时候应该长进短出,A错误;B.二氧化锰只能与浓盐酸反应与稀盐酸不反应,所以浓盐酸不能全部被消耗,B错误C.氯气具有强氧化性,可与碘化钾反应生成单质碘,淀粉遇碘变蓝色,C正确;D.氯气能够与碱性物质反应,不能用碱性干燥剂,碱石灰为碱性干燥剂,不能干燥氯气,D错误故选C。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章化学物质及其变化
一、物质的分类
混合物金属单质
单质非金属单质
物质稀有气体
酸性氧化物
纯净物氧化物碱性氧化物
其他氧化物
化合物酸
无机物碱
盐
有机物(缺
2、分散系及其分类
把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系,叫分散系。
被分散的物质称作分散质
(可以是气体、液体、固体),起容纳分散质作用的物质称作分散剂(可以是气体、液体、固体)。
溶液、胶体、浊液三种分散系的比较
溶液胶体浊液
粒子大小<1nm (1-100)nm >100nm
能否过滤能能不能
主要特征均匀、透明、稳定均匀、有的透明、较稳定不均匀、不透明、不稳定
是否有丁达尔效应没有有没有
举例NaCl、蔗糖溶液Fe(OH)3胶体泥水
二、物质的化学变化
1、物质之间可以发生各种各样的化学变化,依据一定的标准可以对化学变化进行分类。
(1)、根据反应物和生成物的类别以及反应前后物质种类的多少可以分为:
A、化合反应(A+B=AB)H2+O2=H2O
B、分解反应(AB=A+B)KCIO3△KCI+O2↑
C、置换反应(A+BC=AC+B)CuO+H2=Cu+H2O
↓+2NaCI
)CaCI2+Na2CO3=CaCO3
D、复分解反应(AB+CD=AD+CB
(2)根据反应中是否有离子参加可将反应分为:
A、离子反应:有离子参加的一类反应。
主要包括复分解反应和有离子参加的氧化还原反应。
B、分子反应(非离子反应)
(3)根据反应中是否有电子转移可将反应分为:
A、氧化还原反应:反应中有电子转移(得失或偏移)的反应
实质:有电子转移(得失或偏移)
特征:反应前后元素的化合价有变化
B、非氧化还原反应
2、离子反应
(1)、电解质:在水溶液中或熔化状态下能导电的化合物,叫电解质。
酸、碱、盐都是电解质。
酸:电离时生成的阳离子全部是氢离子的化合物
碱:电离时生成的阴离子全部是氢氧根离子的化合物。
盐:电离时生成金属离子(或铵根离子)和酸根离子的化合物
在水溶液中或熔化状态下都不能导电的化合物,叫非电解质。
注意:①电解质、非电解质都是化合物,不同之处是在水溶液中或融化状态下能否导电。
②电解质的导电是
有条件的:电解质必须在水溶液中或熔化状态下才能导电。
③能导电的物质并不全部是电解质:如铜、铝、
石墨等。
④非金属氧化物(SO2、SO3、CO2)、大部分的有机物为非电解质。
(2)、离子方程式:用实际参加反应的离子符号来表示反应的式子。
它不仅表示一个具体的化学反应,而且
表示同一类型的离子反应。
复分解反应这类离子反应发生的条件是:生成沉淀、气体或水。
(3)、离子共存问题
所谓离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量
共存。
A、结合生成难溶物质的离子不能大量共存:如Ba2+和SO42-、Ag+和Cl-、Ca2+和CO32-、Mg2+和OH-等
B、结合生成气体或易挥发性物质的离子不能大量共存:如H+和C O 32-,HCO3-,SO32-,OH-和NH4+等
C、结合生成难电离物质(水)的离子不能大量共存:如H+和OH-、CH3COO-,OH-和HCO3-等。
D、发生氧化还原反应、水解反应的离子不能大量共存(待学)
注意:题干中的条件:如无色溶液应排除有色离子:Fe2+、Fe3+、Cu2+、MnO4-等离子,酸性(或碱性)则应考虑所给离子组外,还有大量的H+(或OH-)。
3、氧化还原反应
氧化还原反应概念的发展比较
得氧失氧的观点(狭义)
化合价升降观点(广义)
电子转移观点(本质)
氧化反应:得氧的反应,化合价升高的反应,失去(或偏离)电子的反应
还原反应:失氧的反应,化合价降低的反应,得到(或偏向)电子的反应
氧化还原反应:有氧得失的反应,有化合价升降的反应,有电子转移(得失或偏移)的反应
氧化还原反应中概念及其相互关系如下:
失去电子——化合价升高——被氧化(发生氧化反应)——是还原剂(有还原性)
得到电子——化合价降低——被还原(发生还原反应)——是氧化剂(有氧化性)
练习题
相对原子质量:Na 23 Al 27 Fe 56 Cu 64 H 1 O 16 C 12 S 16 Cl 35.5
一、选择题:(本题包括13 小题,1-9题每题只有1个选项符合题意,每小题3分,10-13题每题有1-2个答案,每小题4分,共43 分。
)
1.下列物质中属于氧化物的是
A.O2 B.Na2O C.NaClO D.FeSO4
2.根据我省中心气象台报道,近年每到春季,我省沿海一些城市多次出现大雾天气,致使高速公路关闭,航班停飞。
雾属于下列分散系中的
A.溶液B.悬浊液C.乳浊液D.胶体
3.能用H++OH-=H2O来表示的化学反应是
A.氢氧化镁和稀盐酸反应B.Ba(OH)2溶液滴入稀硫酸中
C.澄清石灰水和稀硝酸反应D.二氧化碳通入澄清石灰水中
4.下列反应中必须加入还原剂才能进行的是
A.Cl2→Cl-B.Zn→ Zn2+C.H2→H2O D.CuO→CuCl2
5.将饱和FeCl3溶液分别滴入下列液体中,能形成胶体的是()
A.冷水B.沸水C.NaOH溶液D.NaCl溶液
6.某溶液中只含有Na+、Al3+、Cl-、SO42-四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和SO42-的离子个数比为
A.1∶2 B.1∶4 C.3∶4 D.3∶2
7.在碱性溶液中能大量共存且溶液为无色透明的离子组是
A.K+、MnO4-、Na+、Cl-B.K+、Na+、NO3-、CO32-
C.Na+、H+、NO3-、SO42-D.Fe3+、Na+、Cl-、SO42-
8.对溶液中的离子反应,下列说法:①不可能是氧化还原反应;②只能是复分解反应;③可能是置换反应;
④不能有分子参加。
其中正确的是
A.①③B.③C.①②D.③④
9.下列反应属于氧化还原反应的是
A.CaCO3+2HCl=CaCl2+CO2↑+ H2O B.CaO+H2O=Ca(OH)2
C.2H2O22H2O+O2↑D.CaCO3CaO+CO2↑
10.下列反应的离子方程式书写正确的是
A.氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++Cu
B.稀H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑
C.氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-=BaSO4↓
D.碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
11.从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是
A.2NaBr+Cl2=2CaCl+Br2
B.AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl
C.2H2S+SO2=2H2O+3S↓
D.C+CO22CO
12.下列物质属于钠盐的是
A.Na2O B.CH3COONa C.NaHSO4D.Na2O2
13.在下列反应中,HCl 作氧化剂的是
A.NaOH+HCl=NaCl+H2O
B.Zn+2HCl=ZnCl2+H2↑
C.MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑
D.CuO+2HCl=CuCl2+H2O
二、填空题:(25分)
14.下列物质:⑴Na⑵ Br2⑶Na2O ⑷NO2 ⑸CO2⑹ SO3⑺NH3 ⑻H2S ⑼HCl ⑽ H2SO4⑾Ba(OH)2⑿NaCl ⒀蔗糖⒁NaCl溶液。
属于电解质的是,属于非电解质的是,
能导电的是。
15.在Fe3O4 +4CO3Fe+4CO2的的中,是氧化剂,是还原剂,元素被氧化,元素被还原。
(4分)
16.写出下列物质的电离方程式:(3分)
NaHSO4,
K2SO4 ,
NH4NO3 。
17.胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打(NaHCO3),能治疗胃酸过多,请写出其反应的离子方程式:(5分)
;
如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打,原因是:;
此时最好用含氢氧化稆的胃药(如胃舒平)离子方程式:。
三、简答题:(4分)
18.已知NaCl中混有Na2CO3固体,请用简要的语言说明除去Na2CO3的方法,并写出有关的反应化学方程式。
(4分)
四、实验题:(17分)
19.用下列仪器的编号回答问题(7分)
①容量瓶②蒸馏烧瓶③酸式滴定管④量筒⑤烧杯⑥托盘天平⑦分液漏斗
⑴加热时必须垫石棉网的有,
⑵使用时必须检查是否漏水的有,。
