初中化学常见化合物相对分子质量
初中化学常见化合物相对分子质量

4、“我迈出了一小步,但人类迈出了一大步。”这句话是阿姆斯特朗说的。二、问答:
25、意大利的科学家伽利略发明了望远镜,天文学家的“第三只眼”是天文望远镜,可以分为光学望远镜和射电望远镜两种。初中化学常见化合物相对分子质量
CH4
16
尿 素
CO(NH2)2
60
甲 醇
CH3OH
32
乙 醇
C2H5OH
46
乙 炔
C2H2
26
过氧化氢
H2O2
34
过氧化钠
Na2O2
78
氧化铜
CuO
80
氧化镁
MgO
40
氯化铵
NH4Cl
53.5
氢பைடு நூலகம்化镁
Mg(OH)2
58
相对分子质量
物质
化学式
相对分子质量
物质
化学式
相对分子质量
氨气
NH3
17
二氧化碳
CO2
44
二氧化硫
SO2
64
一氧化碳
CO
28
三氧化硫
SO3
80
氧化钙
CaO
56
四氧化三铁
Fe3O4
232
三氧化二铁
Fe2O3
160
氧化亚铁
FeO
72
氧化铝
Al2O3
102
五氧化二磷
P2O5
142
水
H2O
18
硝酸
HNO3
63
4、日常生活中我们应该如何减少垃圾的数量?水18、碳酸钙100,硫酸98盐酸36.5氢氧化钠40.
初中常用相对质量

初中常用相对质量相对质量是物质与质量为12的碳同位素的比值。
它是一个无单位的数值,可以用来表示分子或离子的质量相对于碳12的质量比。
以下是初中常用的相对质量的一些例子。
1. 氢:相对质量为1氢是宇宙中最丰富的元素之一,它的相对质量是1。
氢的原子核只有一个质子,没有中子,因此它的相对质量与其质子数相等。
氢在自然界中以单质的形式存在,也可以和其他元素形成化合物。
2. 氧:相对质量为16氧是一种非常重要的元素,它的相对质量是16。
氧是空气中的主要成分之一,也是水的组成部分。
氧是化学反应中的重要参与者,许多物质的燃烧都需要氧气。
3. 碳:相对质量为12碳是生命中不可或缺的元素,它的相对质量是12。
碳可以形成许多有机化合物,包括糖类、脂肪、蛋白质和核酸。
碳的同位素碳14被用于年代测定。
4. 氮:相对质量为14氮是空气中的主要成分之一,它的相对质量是14。
氮可以形成许多重要的化合物,包括氨、硝酸和氮气。
氮还是生命的重要组成部分之一,它在蛋白质和核酸中都有出现。
5. 铁:相对质量为56铁是最常见的金属之一,它的相对质量是56。
铁是自然界中的重要元素,也是人类工业的重要原料之一。
铁可以形成许多有用的合金,如钢。
6. 钙:相对质量为40钙是一种重要的元素,它的相对质量是40。
钙在生物体内扮演着重要的角色,它是骨骼和牙齿的重要组成部分之一。
钙还参与许多生物过程,如神经传递和肌肉收缩。
7. 氯:相对质量为35.5氯是一种有毒的气体,它的相对质量是35.5。
氯可以形成许多重要的化合物,如盐酸和氯气。
氯还被用于消毒和水处理。
相对质量是化学中一个重要的概念,它可以用来计算分子或离子的质量相对于碳12的质量比。
初中学生应该掌握常见元素的相对质量,以便更好地理解化学中的一些重要概念。
初中化学物质的密度与相对分子质量计算方法详解

初中化学物质的密度与相对分子质量计算方法详解密度是物质的一种重要性质,它反映了物质的质量与体积之间的关系。
对于初中学生来说,学习如何计算物质的密度与相对分子质量是非常基础且重要的。
本文将详细介绍初中化学中物质密度与相对分子质量的计算方法。
一、物质的密度计算方法物质的密度(ρ)定义为物质的质量(m)与体积(V)之比,可以用数学公式表示为:ρ = m / V其中,密度的单位通常用克/立方厘米(g/cm³)或克/毫升(g/mL)表示,质量的单位用克(g)表示,体积的单位通常用立方厘米(cm³)或毫升(mL)表示。
例如,如果一块物质的质量为100克,体积为50立方厘米,则可以通过密度公式计算出该物质的密度:ρ = 100g / 50cm³ = 2g/cm³因此,该物质的密度为2克/立方厘米。
二、物质的相对分子质量计算方法相对分子质量是化学中用于描述物质分子量的一个重要概念。
相对分子质量(M)可以用元素相对原子质量的加和来表示,即将每个元素的相对原子质量相加得到。
例如,如果要计算二氧化碳(CO₂)的相对分子质量,需要查找化学元素周期表中碳(C)和氧(O)的相对原子质量,并进行相加:CO₂的相对分子质量 = C的相对原子质量 + 2 × O的相对原子质量根据化学元素周期表,碳的相对原子质量为12,氧的相对原子质量为16,代入公式计算得到:CO₂的相对分子质量 = 12 + 2 × 16 = 44因此,二氧化碳的相对分子质量为44。
三、密度与相对分子质量的关系在实际的化学问题中,密度与相对分子质量之间有一定的关系。
当已知物质的密度和化学组成时,可以通过密度计算相对分子质量。
以乙醇(C₂H₅OH)为例,已知乙醇的密度为0.789克/毫升,要计算乙醇的相对分子质量,可以按照以下步骤进行:1. 计算乙醇的质量:已知密度和体积,可以通过密度公式计算出乙醇的质量。
初中常用相对分子质量及计算公式解析

氢 气 H 2 2 五氧化二磷 P 2O 5 142 氧 气 O 2 32 氢氧化钙(熟石灰) Ca(OH)2 74 氯 气 Cl 2 71 氢氧化铜 Cu(OH)2 98 氨 气 NH 3 17 氢氧化钠 NaOH 40 氮 气 N 2 28 过氧化氢(双氧水) H 2O 2 34 一氧化碳 CO 28 碱式碳酸铜(绿) Cu 2(OH)2CO 3 222 二氧化碳 CO 2 44 盐酸(氯化氢) HCl 36.5 一氧化硫 SO 48 氯化钙 CaCl 2 111 二氧化硫 SO 2 64 氯化钾 KCl 74.5 三氧化硫 SO 3 80 氯化铁(淡黄溶) FeCl 3 162.5 二氧化锰 MnO 2 87 氯酸钾 KClO 3 122.5 碳 酸 H 2CO 3 62 高锰酸钾(灰锰氧) KMnO 4 158 碳酸钙 CaCO 3 100 硫酸铜(白固 蓝溶) CuSO 4 160 碳酸氢铵 NH 4HCO 3 79 硫酸钠 Na 2SO 4 142 硝 酸 HNO 3 63 硝酸铵 NH 4NO 3 80 硫 酸 H 2SO 4 98 甲 烷 CH 4 16 亚硫酸 H 2SO 3 82 尿 素 CO(NH 2)2 60 磷 酸 H 3PO 4 98 甲 醇 CH 3OH 32 水H 2O 18 乙醇(酒精) C 2H 5OH 46 氧化铜(黑) CuO 80 乙 炔 C 2H 2 26 氧化镁(白) MgO 40 乙酸(醋酸) CH 3COOH 60 氧化钙(白) CaO 56 硫酸锌(白/无) ZnSO 4 161 四氧化三铁(黑) Fe 3O 4 232 硫酸亚铁(淡绿) FeSO 4 152 氧化铁(红)Fe 2O 3160氧化亚铁(黑)FeO72氢 H (1);氦 He (4);碳C (12);氮N (14);氧O (16); 氟F (19);氖Ne (20);钠Na (23);镁Mg(24);铝Al (27);硅Si (28);磷P (31); 硫S (32);氯Cl (35.5);氩Ar (40);钾K (39);钙Ca (40);锰Mn (55);铁Fe (56);铜Cu (63.5);锌Zn (65);银Ag (108);钡Ba (137);铂Pt(195);金Au (197);汞Hg (201);碘I (127).钾钙钠镁铝,锌铁锡铅(氢),铜汞银铂金.K 、Ca 、Na 、Mg 、Al,Zn 、Fe 、Sn 、Pb 、(H ),Cu 、Hg 、Ag 、Pt 、Au. 钾钙钠可以与水剧烈反应,镁与水反应不剧烈,铝可以与热水反应(要加热).初中化学反应常见基本的化学方程式: (1)单质与氧气的反应:(化合反应) 1.镁在空气中燃烧:2Mg+O 2====点燃2MgO 2.铁在氧气中燃烧:3Fe+2O 2====点燃Fe 3O 4 3.铜在空气中受热:2Cu+O 2====加热2CuO 4.铝在空气中燃烧:4Al+3O 2====点燃2Al 2O 3 5.氢气中空气中燃烧:2H 2+O 2====点燃2H 2O6.红磷在空气中燃烧(研究空气组成的实验):4P+5O 2====点燃2P 2O 5 7.硫粉在空气中燃烧:S+O 2====点燃SO 2 8.碳在氧气中充分燃烧:C+O 2====点燃CO 2 9.碳在氧气中不充分燃烧:2C+O 2====点燃2CO (2)化合物与氧气的反应:10.一氧化碳在氧气中燃烧:2CO+O 2====点燃2CO 2 11.甲烷在空气中燃烧:CH 4+2O 2====点燃CO 2+2H 2O 12.酒精在空气中燃烧:C 2H 5OH+3O 2====点燃2CO 2+3H 2O (3)氧气的来源:13.玻义耳研究空气的成分实验2HgO====加热2Hg+O 2↑14.加热高锰酸钾:2KMnO 4====加热K 2MnO 4+MnO 2+O 2↑(实验室制氧气原理1) 15.过氧化氢在二氧化锰作催化剂条件下分解反应:H 2O 2=====MnO22H 2O+O 2↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H 2O====通电2H 2↑+O 2↑ 17.生石灰溶于水:CaO+H 2O==Ca(OH)2 18.二氧化碳可溶于水:H 2O+CO 2==H 2CO 3 三、质量守恒定律:19.镁在空气中燃烧:2Mg+O 2====点燃2MgO20.铁和硫酸铜溶液反应:Fe+CuSO 4===F e SO 4+Cu 21.氢气还原氧化铜:H 2+CuO====加热Cu+H 2O 22.镁还原氧化铜:Mg+CuO====加热Cu+MgO 四、碳和碳的氧化物: (1)碳的化学性质23.碳在氧气中充分燃烧:C+O 2====点燃CO 2 24.木炭还原氧化铜:C+2CuO====高温2Cu+CO 2↑ 25.焦炭还原氧化铁:3C+2Fe 2O 3====高温4Fe+3CO 2↑ (2)煤炉中发生的三个反应:(几个化合反应) 26.煤炉的底层:C+O 2====点燃CO 2 27.煤炉的中层:CO 2+C====高温2CO28.煤炉的上部蓝色火焰的产生:2CO+O 2====点燃2CO 2 (3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳): CaCO 3+2HCl==CaCl 2+H 2O+CO 2↑30.碳酸不稳定而分解:H 2CO 3==H 2O+CO 2↑ 31.二氧化碳可溶于水:H 2O+CO 2==H 2CO 332.高温煅烧石灰石(工业制二氧化碳):CaCO 3====高温CaO+CO 2↑ 33.石灰水与二氧化碳反应(鉴别二氧化碳): Ca(OH)2+CO 2===CaCO 3↓+H 2O (4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+CuO====加热Cu+CO 2 35.一氧化碳的可燃性:2CO+O 2====点燃2CO 2 其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理): Na 2CO 3+2HCl==2NaCl+H 2O+CO 2↑ 五、燃料及其利用:37.甲烷在空气中燃烧:CH 4+2O 2====点燃CO 2+2H 2O 38.酒精在空气中燃烧:C 2H 5OH+3O 2====点燃2CO 2+3H 2O 39.氢气中空气中燃烧:2H 2+O 2====点燃2H 2O 六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg+O 2====点燃2MgO 41.铁在氧气中燃烧:3Fe+2O 2====点燃Fe 3O 4 42.铜在空气中受热:2Cu+O 2====加热2CuO 43.铝在空气中形成氧化膜:4Al+3O2=2Al 2O 3 (2)金属单质+酸--------盐+氢气(置换反应) 44.锌和稀硫酸Zn+H 2SO 4=ZnSO 4+H 2↑ 45.铁和稀硫酸Fe+H 2SO 4=FeSO 4+H 2↑ 46.镁和稀硫酸Mg+H2SO 4=MgSO 4+H 2↑ 47.铝和稀硫酸2Al+3H 2SO 4=Al 2(SO 4)3+3H 2↑48.锌和稀盐酸Zn+2HCl==ZnCl 2+H 2↑ 49.铁和稀盐酸Fe+2HCl==FeCl 2+H 2↑ 50.镁和稀盐酸Mg+2HCl==MgCl 2+H 2↑ 51.铝和稀盐酸2Al+6HCl==2AlCl 3+3H 2↑ (3)金属单质+盐(溶液)-------新金属+新盐 52.铁和硫酸铜溶液反应:Fe+CuSO 4==FeSO 4+Cu 53.锌和硫酸铜溶液反应:Zn+CuSO 4==ZnSO 4+Cu 54.铜和硝酸汞溶液反应:Cu+Hg(NO 3)2==Cu(NO 3)2+Hg (3)金属铁的治炼原理: 55.3CO+2Fe 2O 3====高温4Fe+3CO 2↑ 七、酸、碱、盐 1、酸的化学性质(1)酸+金属--------盐+氢气(见上) (2)酸+金属氧化物--------盐+水56.氧化铁和稀盐酸反应:Fe 2O 3+6HCl==2FeCl 3+3H 2O 57.氧化铁和稀硫酸反应:Fe 2O 3+3H 2SO 4==Fe 2(SO 4)3+3H 2O 58.氧化铜和稀盐酸反应:CuO+2HCl==CuCl 2+H 2O 59.氧化铜和稀硫酸反应:CuO+H 2SO 4==CuSO 4+H 2O (3)酸+碱--------盐+水(中和反应)60.盐酸和烧碱起反应:HCl+NaOH==NaCl+H 2O 61.盐酸和氢氧化钙反应:2HCl+Ca(OH)2==CaCl 2+2H 2O 62.氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)3==AlCl 3+3H 2O 63.硫酸和烧碱反应:H 2SO 4+2NaOH==Na 2SO 4+2H 2O(4)酸+盐--------另一种酸+另一种盐64.大理石与稀盐酸反应:CaCO3+2HCl==CaCl2+H2O+CO2↑65.碳酸钠与稀盐酸反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3+HCl==NaCl+H2O+CO2↑67.硫酸和氯化钡溶液反应:H2SO4+BaCl2==BaSO4↓+2HCl2、碱的化学性质(1)碱+非金属氧化物--------盐+水68.苛性钠暴露在空气中变质:2NaOH+CO2==Na2CO3+H2O 69.苛性钠吸收二氧化硫气体:2NaOH+SO2==Na2SO3+H2O 70.苛性钠吸收三氧化硫气体:2NaOH+SO3==Na2SO4+H2O 71.消石灰放在空气中变质:Ca(OH)2+CO2==CaCO3↓+H2O 72.消石灰吸收二氧化硫:Ca(OH)2+SO2==CaSO3↓+H2O (2)碱+酸--------盐+水(中和反应,方程式见上)(3)碱+盐--------另一种碱+另一种盐73.氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH 3、盐的化学性质(1)盐(溶液)+金属单质-------另一种金属+另一种盐74.铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu(2)盐+酸--------另一种酸+另一种盐75.碳酸钠与稀盐酸反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑碳酸氢钠与稀盐酸反应:NaHCO3+HCl==NaCl+H2O+CO2↑(3)盐+碱--------另一种碱+另一种盐76.氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH(4)盐+盐-----两种新盐77.氯化钠溶液和硝酸银溶液:NaCl+AgNO3==AgCl↓+NaNO378.硫酸钠和氯化钡:Na+S O4+BaCl2==BaSO4↓+2NaCl【力学部分】1、速度:V=S/t2、重力:G=mg3、密度:ρ=m/V4、压强:p=F/S5、液体压强:p=ρgh6、浮力:(1)、F浮=F’-F (压力差) (3)、F浮=G (漂浮、悬浮) (4)、阿基米德原理:F浮=G排=ρ液gV排7、杠杆平衡条件:F1 L1=F2 L2 8、理想斜面:F/G=h/L9、理想滑轮:F=G/n 10、实际滑轮:F=(G+G动)/ n (竖直方向) 11、功:W=FS=Gh (把物体举高) 12、功率:P=W/t=FV13、功的原理:W手=W机14、实际机械:W总=W有+W额外15、机械效率:η=W有/W总16、滑轮组效率:(1)、η=G/ nF(竖直方向)(2)、η=G/(G+G动) (竖直方向不计摩擦)(3)、η=f / nF (水平方向)【热学部分】1、吸热:Q吸=Cm(t-t0)=CmΔt2、放热:Q放=Cm(t0-t)=CmΔt3、热值:q=Q/m4、炉子和热机的效率:η=Q有效利用/Q燃料5、热平衡方程:Q放=Q吸6、热力学温度:T=t+273K【电学部分】1、电流强度:I=Q电量/t2、电阻:R=ρL/S3、欧姆定律:I=U/R4、焦耳定律:(1)、Q=I2Rt普适公式)(2)、Q=UIt=Pt=UQ电量=U2t/R (纯电阻公式)5、串联电路:(1)、I=I1=I2 (2)、U=U1+U2(3)、R=R1+R2 (1)、W=UIt=Pt=UQ (普适公式)(2)、W=I2Rt=U2t/R (纯电阻公式)9电功率:(1)、P=W/t=UI (普适公式) (2)、P=I2R=U2/R (纯电阻公式) 【常用物理量】1、光速:C=3×108m/s (真空中)2、声速:V=340m/s (15℃)3、人耳区分回声:≥0.1s4、重力加速度:g=9.8N/kg≈10N/kg5、标准大气压值:760毫米水银柱高=1.01×105Pa6、水的密度:ρ=1.0×103kg/m37、水的凝固点:0℃8、水的沸点:100℃9、水的比热容:C=4.2×103J/(kg•℃) 10、元电荷:e=1.6×10-19C 11、一节干电池电压:1.5V12、一节铅蓄电池电压:2V。
初中化学《有关相对分子质量的计算》 PPT课件 图文

第二课时 有关相对分子质量的计算
牛城一中
崔俊梅
让我们先来回忆一下上节课的内容!
标出化合价,再根据化合价写出元素
的氧化物的化学式:
+1
Na Na2O
+2
Mg MgO
+3
Al Al2O3
有关相对分子质量的计算
1、计算相对分子质量 2、计算物质组成元素的质量比 3、计算物质中某元素的质量分数
2、计算组成物质的各元素的 质量比
化合物中所含各元素的质量比, 就是组成化合物的各元素的相对原 子质量的总和之比。
例如:CO2中碳元素和氧元素的 质量比等于 12∶(16×2)=3∶8
练习:
计算下列物质中各元素的质量 比
1、SO2 中硫和氧元素质量比 2、CaCO3 中钙、碳、氧元素质 量比
3、计算物质中某元素的质量分 数
当堂检测:
1、计算水(H2O)的相对分子质量 2、计算Al2O3中铝元素和氧元素的质 量比 3、计算CaCO3中钙元素的质量分数
• 思考:
计1、算熟其石相灰对化分学子式质为量Ca(OH)2,
分2、子求质纯量碱(Na2CO3)的相对
小结:
• 1、相对分子质量的概念; • 2、有关化学式的计算。
• ①计算相对分子质量 • ②计算物质组成元素的质量比 • ③计算物质中的某元素质量分数 • 课后作业书本 P87 7、 8 、 9
化合物中某元素的质量分数=
某元素的相对原子质量×原子个数
化合物的相对分子质量
× 100 %
SO2中S的质量分数:
S的总质量
SO2中元素的总质量
×100 %
S×1
=
SO2
人教版初中九年级化学《有关相对分子质量的计算》精品教学课件

讲授新课
例2 分析蜡烛燃烧的过程:
蜡烛熔化 蜡烛燃烧
物理变化 化学变化
同时 发生
【总结】在化学变化中,生成新物质的同时,物质的 状态、形状、大小也改变,所以化学变化中一定同时 发生物理变化。但在物理变化中,不一定发生化学变化!
讲授新课
物理变化和化学变化
观察与思考
节日焰火
燃烧
讲授新课
钢铁生锈
牛奶变质
讲授新课
通过观察,我们知道烟花可以发光发热,木材可 以在空气中燃烧而发光发热,钢铁制品在潮湿的地 方会生锈,牛奶会变酸等等。
思考:从化学的角度看,物质的这些变化有什么本质 区别呢?
让我们先来做几个实验。
讲授新课
实验与探究
讲授新课
观察与思考
例3:(1)计算二氧化硫中硫元素的质量分数 (2)计算64t二氧化硫中硫元素的质量。
解:(1)SO2的相对分子质量=32+16×2=64
SO2中硫元素的质量分数=
S的相对原子质量×1 SO2的相对分子质量
×100%
32 = 64 ×100% =50%
(2)64t二氧化硫中硫元素的质量=64t×50%=32t
后序
亲爱的朋友,你好!非常荣幸和你相遇,很乐意为您服务。希望我的文档能 够帮助到你,促进我们共同进步。
孔子曰,三人行必有我师焉,术业有专攻,尺有所长,寸有所短,希望你能 提出你的宝贵意见,促进我们共同成长,共同进步。每一个文档都花费了我大量 心血,其目的是在于给您提供一份参考,哪怕只对您有一点点的帮助,也是我最 大的欣慰。如果您觉得有改进之处,请您留言,后期一定会优化。
初中常见相对原子质量及相对分子质量
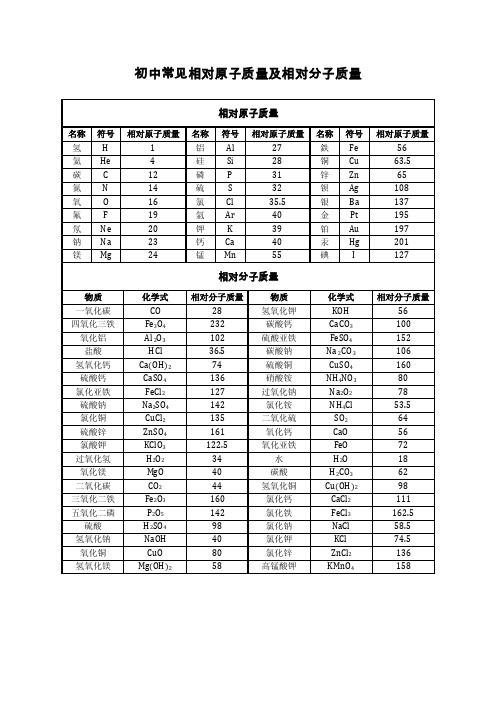
化学式
CO Fe3O4 A l 2O3 HCl Ca(OH)2 CaSO4 FeCl2 Na2SO4 CuCl2 ZnSO4 KClO3 H2O2 MgO CO2 Fe2O3 P2O5 H2SO4 NaOH CuO Mg(OH)2
相对分子质量
28 232 102 36.5 74 136 127 142 135 161 122.5 34 40 44 160 142 98 40 80 58
物质 氢氧化钾
碳酸钙 硫酸亚铁
碳酸钠 硫酸铜 硝酸铵 过氧化钠 氯化铵 二氧化硫 氧化钙 氧化亚铁
水 碳酸 氢氧化铜 氯化钙 氯化铁 氯化钠 氯化钾 氯化锌 高锰酸钾
化学式
KOH CaCO3 FeSO4 Na 2C O 3 CuSO4 NH4NO3 Na2O2 NH4Cl
SO2 CaO FeO H2O H2CO3 Cu(OH)2 CaCl2 FeCl3 NaCl KCl ZnCl2 KMnO4
初中常见相对原子质量及相对分子质量
相对原子质量
名称 氢 氦 碳 氮 氧 氟 氖 钠 镁
符号
H He C N O F Ne Na Mg
相对原子质量
1 4 12 14 16 19 20 23 24
名称 铝 硅 磷 硫 氯 氩 钾 钙 锰
符号
Al Si P S Cl Ar K Ca Mn
相对原子质量
27 28 31 32 35.5 40 39 40 55
名称 鉄 铜 锌 钡 银 金 铂 汞 碘
符号
Fe Cu Zn Ag Ba Pt Au Hg I
相对原子质量
56 63.5 65 108 137 195 197 201 127
最新人教版初中化学《有关相对分子质量的计算》课件

练习:SO2中氧元素的质量分数; Mg(OH)2 中氧元素的质量分数:
相对原子质量×原子个数 元素的质量分数= × 100% 相对分子质量
1.(吉林中考)下面是小刚计算硝酸铵 (NH4NO3)中氮元素质量分数的解题过程。 解:NH4NO3中氮元素质量分数=
相对分子质量=相对原子质量×原子个数之和
探究二:元素质量比 (一).自学展示:
◆计算二氧化碳(CO2)中碳元素和氧元素 的质量比: m (C):m(O)=12:(16×2)=3:8
练习:计算SO2 Na2O 元素的质量比: NH4NO3 Mg(OH)2 中各
元素质量比=相对原子质量×原子个数之比
探究三:元素的质量分数
知识回顾——展示
1.相对原子质量的概念与注意事项:
2.水(H2O)中氢、氧原子的个数比:
小明的烦恼
他梦到氢元素和氧元素在争辩谁在“H2O” 中的质量更大?争辩十分激烈,拉着让小明来 裁判,小明不知道怎么算,一着急醒了。
课题4 化学式与化合价
三、有关相对分子质量的计算
探究一:相对分子质量
(一).概念:
各原子的相对原子质量的总和 1.化学式中___________________________ ,就 是相对分子质量; 2.相对分子质量的符号和单位;
(二)动手实践:
◆计算CO2 的相对分子质量(C-12 O-16 ) Mr(CO2)=12+(16×2)=44 ◆练习:计算下列物质的相对分子质量 H2 HCl NH4NO3 Mg(OH)2
N-14
H-1
探究三:物质中元素的质量分数
尿素中氮元素的质量分数
初中常见相对原子质量及相对分子质量

80
氯化锌
ZnCl2
136
氢氧化镁
Mg(OH)2
58
高锰酸钾
KMnO4
158
THANKS !!!
致力为企业和个人提供合同协议,策划案计划书,学习课件等等
打造全网一站式需求
欢迎您的下载,资料仅供参考
铂
Au
197
钠
Na
23
钙
Ca
40
汞
Hg
201
镁
Mg
24
锰
Mn
55
碘
I
127
相对分子质量
物质
化学式
相对分子质量
物质
化学式
相对分子质量
一氧化碳
CO
28
氢氧化钾
KOH
56
四氧化三铁
Fe3O4
232
碳酸钙
CaCO3
100
氧化铝
Al2O3
102
硫酸亚铁
FeSO4
152
盐酸
HCl
36.5
碳酸钠
Na2CO3
106
72
过氧化氢
H2O2
34
水
H2O
18
氧化镁
MgO
40
碳 酸
H2CO3
62
二氧化碳
CO2
44
氢氧化铜
Cu(OH)2
98
三氧化二铁
Fe2O3
160
氯化钙
CaCl2
111
五氧化二磷
P2O5
142
氯化铁
FeCl3
162.5
硫酸
H2SO4
98
氯化钠
NaCl
初中常用相对分子质量及计算公式

氢气H22五氧化二磷P2O5142氧气O232氢氧化钙(熟石灰)Ca(OH)274氯气Cl271氢氧化铜Cu(OH)298氨气NH317氢氧化钠NaOH4氮气N228过氧化氢(双氧水)H2O234一氧化碳CO28碱式碳酸铜(绿)Cu2(OH)2CO3222二氧化碳CO244盐酸(氯化氢)HCl36.5一氧化硫SO48氯化钙CaCl2111二氧化硫SO264氯化钾KCl74.5三氧化硫SO380氯化铁(淡黄溶)FeCl3162.5二氧化锰Mn8氯酸钾KClO31O2722.5碳酸H2CO362高锰酸钾(灰锰氧)KMnO4158碳酸钙CaCO31硫酸铜(白固蓝溶)CuSO4160碳酸氢铵NH4HCO379硫酸钠Na2SO4142硝酸HNO363硝酸铵NH4NO38硫酸H2SO498甲烷CH416亚硫酸H2SO382尿素CO(NH2)26磷酸H3PO498甲醇CH3OH32水H2O18乙醇(酒精)C2H5OH46氧化铜(黑)CuO8乙炔C2H226氧化镁Mg4乙酸(醋酸)CH3C6(白)OOOH氧化钙(白)Ca O56硫酸锌(白/无) ZnSO4161四氧化三铁(黑)Fe 3O 4232 硫酸亚铁(淡绿)FeSO4152氧化铁(红)Fe 2O 3160氧化亚铁(黑) FeO72氢 H (1);氦 He (4);碳C (12);氮N (14);氧O (16); 氟F (19);氖Ne (20);钠Na (23);镁Mg(24);铝Al (27);硅Si (28);磷P (31);硫S (32);氯Cl (35.5);氩Ar (40);钾K (39);钙Ca (40);锰Mn (55);铁Fe (56);铜Cu (63.5);锌Zn (65);银Ag (108);钡Ba (137);铂Pt (195);金Au (197);汞Hg (201);碘I (127).钾钙钠镁铝,锌铁锡铅(氢),铜汞银铂金.K 、Ca 、Na 、Mg 、Al,Zn 、Fe 、Sn 、Pb 、(H ),Cu 、Hg 、Ag 、Pt 、Au.钾钙钠可以与水剧烈反应,镁与水反应不剧烈,铝可以与热水反应(要加热). 初中化学反应常见基本的化学方程式: (1)单质与氧气的反应:(化合反应)1.镁在空气中燃烧:2Mg+O 2====点燃2MgO 2.铁在氧气中燃烧:3Fe+2O 2====点燃Fe 3O 4 3.铜在空气中受热:2Cu+O 2====加热2CuO 4.铝在空气中燃烧:4Al+3O 2====点燃2Al 2O 3 5.氢气中空气中燃烧:2H 2+O 2====点燃2H 2O6.红磷在空气中燃烧(研究空气组成的实验):4P+5O 2====点燃2P 2O 5 7.硫粉在空气中燃烧:S+O 2====点燃SO 2 8.碳在氧气中充分燃烧:C+O 2====点燃CO 2 9.碳在氧气中不充分燃烧:2C+O 2====点燃2CO (2)化合物与氧气的反应:10.一氧化碳在氧气中燃烧:2CO+O 2====点燃2CO 2 11.甲烷在空气中燃烧:CH 4+2O 2====点燃CO 2+2H 2O12.酒精在空气中燃烧:C 2H 5OH+3O 2====点燃2CO 2+3H 2O (3)氧气的来源:13.玻义耳研究空气的成分实验2HgO ====加热2Hg+O 2↑14.加热高锰酸钾:2KMnO 4====加热K 2MnO 4+MnO 2+O 2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应:H 2O 2=====MnO22H 2O+O 2↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H 2O ====通电2H 2↑+O 2↑ 17.生石灰溶于水:CaO+H 2O==Ca(OH)2 18.二氧化碳可溶于水:H 2O+CO 2==H 2CO 3 三、质量守恒定律:19.镁在空气中燃烧:2Mg+O 2====点燃2MgO20.铁和硫酸铜溶液反应:Fe+CuSO 4===F e SO 4+Cu 21.氢气还原氧化铜:H 2+CuO ====加热Cu+H 2O 22.镁还原氧化铜:Mg+CuO ====加热Cu+MgO 四、碳和碳的氧化物: (1)碳的化学性质23.碳在氧气中充分燃烧:C+O 2====点燃CO 224.木炭还原氧化铜:C+2CuO ====高温2Cu+CO 2↑ 25.焦炭还原氧化铁:3C+2Fe 2O 3====高温4Fe+3CO 2↑ (2)煤炉中发生的三个反应:(几个化合反应) 26.煤炉的底层:C+O 2====点燃CO 2 27.煤炉的中层:CO 2+C ====高温2CO28.煤炉的上部蓝色火焰的产生:2CO+O 2====点燃2CO 2 (3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳): CaCO 3+2HCl==CaCl 2+H 2O+CO 2↑ 30.碳酸不稳定而分解:H 2CO 3==H 2O+CO 2↑ 31.二氧化碳可溶于水:H 2O+CO 2==H 2CO 332.高温煅烧石灰石(工业制二氧化碳):CaCO 3====高温CaO+CO 2↑ 33.石灰水与二氧化碳反应(鉴别二氧化碳): Ca(OH)2+CO 2===CaCO 3↓+H 2O (4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+CuO ====加热Cu+CO 2 35.一氧化碳的可燃性:2CO+O 2====点燃2CO 2 其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na 2CO 3+2HCl==2NaCl+H 2O+CO 2↑ 五、燃料及其利用:37.甲烷在空气中燃烧:CH 4+2O 2====点燃CO 2+2H 2O38.酒精在空气中燃烧:C 2H 5OH+3O 2====点燃2CO 2+3H 2O 39.氢气中空气中燃烧:2H 2+O 2====点燃2H 2O 六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg+O 2====点燃2MgO 41.铁在氧气中燃烧:3Fe+2O 2====点燃Fe 3O 442.铜在空气中受热:2Cu+O 2====加热2CuO 43.铝在空气中形成氧化膜:4Al+3O2=2Al 2O 3 (2)金属单质+酸--------盐+氢气(置换反应) 44.锌和稀硫酸Zn+H 2SO 4=ZnSO 4+H 2↑ 45.铁和稀硫酸Fe+H 2SO 4=FeSO 4+H 2↑ 46.镁和稀硫酸Mg+H2SO 4=MgSO 4+H 2↑ 47.铝和稀硫酸2Al+3H 2SO 4=Al 2(SO 4)3+3H 2↑ 48.锌和稀盐酸Zn+2HCl==ZnCl 2+H 2↑ 49.铁和稀盐酸Fe+2HCl==FeCl 2+H 2↑ 50.镁和稀盐酸Mg+2HCl==MgCl 2+H 2↑ 51.铝和稀盐酸2Al+6HCl==2AlCl 3+3H 2↑ (3)金属单质+盐(溶液)-------新金属+新盐52.铁和硫酸铜溶液反应:Fe+CuSO 4==FeSO 4+Cu 53.锌和硫酸铜溶液反应:Zn+CuSO 4==ZnSO 4+Cu54.铜和硝酸汞溶液反应:Cu+Hg(NO 3)2==Cu(NO 3)2+Hg (3)金属铁的治炼原理:55.3CO+2Fe 2O 3====高温4Fe+3CO 2↑ 七、酸、碱、盐 1、酸的化学性质(1)酸+金属--------盐+氢气(见上) (2)酸+金属氧化物--------盐+水56.氧化铁和稀盐酸反应:Fe 2O 3+6HCl==2FeCl 3+3H 2O 57.氧化铁和稀硫酸反应:Fe 2O 3+3H 2SO 4==Fe 2(SO 4)3+3H 2O 58.氧化铜和稀盐酸反应:CuO+2HCl==CuCl 2+H 2O 59.氧化铜和稀硫酸反应:CuO+H 2SO 4==CuSO 4+H 2O (3)酸+碱--------盐+水(中和反应)60.盐酸和烧碱起反应:HCl+NaOH==NaCl+H 2O61.盐酸和氢氧化钙反应:2HCl+Ca(OH)2==CaCl 2+2H 2O 62.氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)3==AlCl 3+3H 2O 63.硫酸和烧碱反应:H 2SO 4+2NaOH==Na 2SO 4+2H 2O (4)酸+盐--------另一种酸+另一种盐64.大理石与稀盐酸反应:CaCO 3+2HCl==CaCl 2+H 2O+CO 2↑ 65.碳酸钠与稀盐酸反应:Na 2CO 3+2HCl==2NaCl+H 2O+CO 2↑66.碳酸氢钠与稀盐酸反应:NaHCO3+HCl==NaCl+H2O+CO2↑67.硫酸和氯化钡溶液反应:H2SO4+BaCl2==BaSO4↓+2HCl2、碱的化学性质(1)碱+非金属氧化物--------盐+水68.苛性钠暴露在空气中变质:2NaOH+CO2==Na2CO3+H2O 69.苛性钠吸收二氧化硫气体:2NaOH+SO2==Na2SO3+H2O 70.苛性钠吸收三氧化硫气体:2NaOH+SO3==Na2SO4+H2O 71.消石灰放在空气中变质:Ca(OH)2+CO2==CaCO3↓+H2O72.消石灰吸收二氧化硫:Ca(OH)2+SO2==CaSO3↓+H2O(2)碱+酸--------盐+水(中和反应,方程式见上)(3)碱+盐--------另一种碱+另一种盐73.氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH3、盐的化学性质(1)盐(溶液)+金属单质-------另一种金属+另一种盐74.铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu(2)盐+酸--------另一种酸+另一种盐75.碳酸钠与稀盐酸反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑碳酸氢钠与稀盐酸反应:NaHCO3+HCl==NaCl+H2O+CO2↑(3)盐+碱--------另一种碱+另一种盐76.氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH(4)盐+盐-----两种新盐77.氯化钠溶液和硝酸银溶液:NaCl+AgNO3==AgCl↓+NaNO3 78.硫酸钠和氯化钡:Na+SO4+BaCl2==BaSO4↓+2NaCl【力学部分】1、速度:V=S/t2、重力:G=mg3、密度:ρ=m/V4、压强:p=F/S5、液体压强:p=ρgh6、浮力:(1)、F浮=F’-F (压力差) (3)、F浮=G (漂浮、悬浮)(4)、阿基米德原理:F浮=G排=ρ液gV排7、杠杆平衡条件:F1 L1=F2 L2 8、理想斜面:F/G=h/L9、理想滑轮:F=G/n 10、实际滑轮:F=(G +G动)/ n (竖直方向)11、功:W=FS=Gh (把物体举高) 12、功率:P=W/t =FV13、功的原理:W手=W机14、实际机械:W总=W有+W额外15、机械效率:η=W有/W总16、滑轮组效率:(1)、η=G/ nF(竖直方向)(2)、η=G/(G+G动) (竖直方向不计摩擦)(3)、η=f / nF (水平方向)【热学部分】1、吸热:Q吸=Cm(t-t0)=CmΔt2、放热:Q放=Cm(t0-t)=CmΔt3、热值:q=Q/m4、炉子和热机的效率:η=Q有效利用/Q燃料5、热平衡方程:Q放=Q吸6、热力学温度:T =t+273K【电学部分】1、电流强度:I=Q电量/t2、电阻:R=ρL/S3、欧姆定律:I=U/R4、焦耳定律:(1)、Q=I2Rt普适公式)(2)、Q=UIt=Pt=UQ电量=U2t/R (纯电阻公式)5、串联电路:(1)、I=I1=I2 (2)、U=U1+U2 (3)、R=R1+R2 (1)、W=UIt=Pt=UQ (普适公式)(2)、W=I2Rt=U2t/R (纯电阻公式)9电功率:(1)、P=W/t=UI (普适公式) (2)、P=I2R=U2/R (纯电阻公式)【常用物理量】1、光速:C=3×108m/s (真空中)2、声速:V=340m/s (15℃)3、人耳区分回声:≥0.1s4、重力加速度:g=9.8N/kg≈10N/kg5、标准大气压值:760毫米水银柱高=1.01×105Pa6、水的密度:ρ=1.0×103kg/m37、水的凝固点:0℃8、水的沸点:100℃9、水的比热容:C=4.2×103J/(kg•℃)10、元电荷:e=1.6×10-19C 11、一节干电池电压:1.5V 12、一节铅蓄电池电压:2V。
初中常见元素符号及相对分子质量
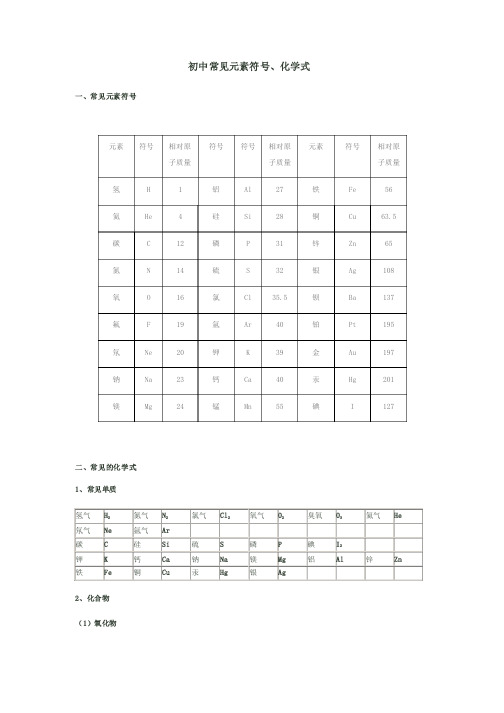
初中常见元素符号、化学式一、常见元素符号元素符号相对原子质量符号符号相对原子质量元素符号相对原子质量氢H 1 铝Al 27 铁Fe 56氦He 4 硅Si 28 铜Cu 63.5碳 C 12 磷P 31 锌Zn 65氮N 14 硫S 32 银Ag 108氧O 16 氯Cl 35.5 钡Ba 137氟 F 19 氩Ar 40 铂Pt 195氖Ne 20 钾K 39 金Au 197钠Na 23 钙Ca 40 汞Hg 201镁Mg 24 锰Mn 55 碘I 127二、常见的化学式1、常见单质氢气H2氮气N2氯气Cl2氧气O2臭氧O3氦气He 氖气Ne氩气Ar碳C硅Si硫S磷P碘I2钾K钙Ca钠Na镁Mg铝Al锌Zn 铁Fe铜Cu汞Hg银Ag2、化合物(1)氧化物水H2O三氧化硫SO3一氧化碳CO二氧化碳CO2五氧化二磷P2O5过氧化氢H2O2二氧化氮NO2二氧化硫SO2氧化钙CaO氧化亚铁FeO氧化铁Fe2O3四氧化三铁Fe3O4氧化镁MgO氧化锌ZnO二氧化锰MnO2氧化汞HgO氧化铝Al2O3氧化铜CuO (2)其他化合物硝酸HNO3硫酸H2SO4盐酸HCl碳酸H2CO3硫化氢H2S氢氧化钠NaOH氢氧化钾KOH氢氧化钙Ca(OH)2氢氧化镁Mg(OH)2氢氧化铝Al(OH)3氢氧化锌Zn(OH)2氢氧化铁Fe(OH)3氢氧化亚铁Fe(OH)2氢氧化铜Cu(OH)2氢氧化钡Ba(OH)2氨水NH3·H2O氯化钠NaCl氯化铜CuCl2氯化铝AlCl3氯化钾KCl氯化亚铁FeCl2氯化铁FeCl3氯化银AgCl氯化钙CaCl2氯化镁MgCl2氯化钡BaCl2氯化锌ZnCl2硫酸铜CuSO4高锰酸钾KMnO4锰酸钾K2MnO4氯酸钾KClO3碳酸钙CaCO3硝酸钾KNO3 硝酸钠NaNO3硝酸铁Fe(NO3)3硝酸亚铁Fe(NO3)2硝酸铝Al(NO3)3碳酸钠Na2CO3碳酸钙CaCO3碳酸铵(NH4)2CO3碳酸氢钠NaHCO3硫酸铁Fe2(SO4)3硫酸亚铁FeSO4硝酸银AgNO3硝酸钡Ba(NO3)2硝酸铵NH4NO3硫酸钡BaSO43、常见有机化合物甲烷CH4乙醇C2H5OH 葡萄糖C6H12O6氢氧根OH负一价正一价负一价 铵根NH4正一价负二价碳酸根CO3负二价负二价 硫酸根SO4负二价负一价硝酸根NO3负一价。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
16
尿 素
CO(NH2)2
60
甲 醇
CH3OH
32
乙 醇
C2H5OH
46
乙 炔
C2H2
26
过氧化氢
H2O2
34
过氧化钠
Na2O2
78
氧化铜
CuO
80
氧化镁
MgO
40
氯化铵
NH4Cl
氢氧化镁
Mg(OH)2
58
P2O5
142
水
H2O
18
硝 酸
HNO3
63
硫酸
H2SO4
98
亚硫酸
H2SO3
82
磷 酸
H3PO4
98
乙酸
CH3COOH
60
碳 酸
H2CO3
62
盐酸
HCl
氢氧化钠
NaOH
40
氢氧化铜
Cu(OH)2
98
氢氧化钙
Ca(OH)2
74
氢氧化钾
KOH
56
氯化钙
CaCl2
111
硫酸钙
CaSO4Leabharlann 136碳酸钙CaCO3
初中化学常见化合物相对分子质量
物质
化学式
相对分子质量
物质
化学式
相对分子质量
物质
化学式
相对分子质量
氨 气
NH3
17
二氧化碳
CO2
44
二氧化硫
SO2
64
一氧化碳
CO
28
三氧化硫
SO3
80
氧化钙
CaO
56
四氧化三铁
Fe3O4
232
三氧化二铁
Fe2O3
160
氧化亚铁
FeO
72
氧化铝
Al2O3
102
五氧化二磷
100
氯化铁
FeCl3
氯化亚铁
FeCl2
127
硫酸亚铁
FeSO4
152
氯化钠
NaCl
硫酸钠
Na2SO4
142
碳酸钠
Na2CO3
106
氯化钾
KCl
氯化铜
CuCl2
135
硫酸铜
CuSO4
160
氯化锌
ZnCl2
136
硫酸锌
ZnSO4
161
硝酸铵
NH4NO3
80
高锰酸钾
KMnO4
158
氯酸钾
KClO3
甲 烷
