一 手性---立体(三维)异构 - 分子识别与功能重点实验室 …
有机合成中的手性识别与手性放大策略研究

有机合成中的手性识别与手性放大策略研究手性识别和手性放大是有机合成领域中的重要概念。
在有机化学中,手性分子的相关研究具有巨大的重要性,因为手性决定了分子的性质和活性。
本文将探讨有机合成中的手性识别和手性放大策略,并介绍最近的研究进展。
一、手性识别的概念和意义手性识别是指在有机合成中优先选择一只手的立体异构体。
手性分子存在两种异构体,即左旋体与右旋体。
然而,在某些情况下,仅需一种手的异构体。
例如,药物合成需要选择具有特定效果的立体异构体。
手性识别的出现可以使有机合成更具选择性和效率。
二、手性识别的方法手性识别的方法多种多样,主要包括化学方法、物理方法和生物方法。
1. 化学方法化学方法是通过化学反应选择性地合成目标手性异构体。
其中,手性催化和手性配体是最常用的方法之一。
手性催化通常通过使用对映选择性配体来催化手性控制的反应。
手性配体通过形成稳定的配位络合物来实现对手性的控制。
2. 物理方法物理方法主要利用手性分离材料,如手性担体、手性排列的固体材料和手性胶体。
这些材料可以通过手性识别分离手性异构体,并用于手性放大。
3. 生物方法生物方法是利用生物分子,如酶和细胞,实现手性识别。
酶具有选择性催化的特性,常用于实现手性选择性合成。
在手性放大方面,一些微生物和细胞具有放大手性的功能。
三、手性放大的概念和意义手性放大是指从含有较低手性度的反应物中得到较高手性度的产物。
手性放大在有机合成中具有重要意义,可用于实现手性识别的扩大,合成高手性度的化合物。
手性放大的研究有助于提高手性合成的效率和产率。
四、手性放大的策略手性放大的策略包括不对称催化、动态动力学分辨和非对称反应。
1. 不对称催化不对称催化是指使用手性催化剂进行反应,实现手性放大。
手性催化剂通过控制手性识别的过程,在反应中扩大手性度。
2. 动态动力学分辨动态动力学分辨是指通过反应动力学中手性选择性的差异,从而扩大手性度。
这种策略常用于手性酸碱催化反应和手性催化剂反应。
光谱法鉴定手性化合物的绝对构型——从仪器表征到理论计算

光谱法鉴定手性化合物的绝对构型——从仪器表征到理论计算王娟;杨笑迪【摘要】手性化合物的结构确定,尤其是新型手性化合物的绝对构型测定一直是不对称研究的重要工作.除单晶测试外,光谱学方法近年来被广泛应用于手性分子结构鉴定,主要包括电子和振动圆二色谱、旋光光谱、旋光拉曼谱等.本文对上述测试方法的原理、应用范围和相关理论计算方法做了介绍.把谱学测试与理论计算相结合,将成为手性分子结构鉴定的重要发展方向.【期刊名称】《大学化学》【年(卷),期】2016(031)011【总页数】8页(P37-44)【关键词】绝对构型;理论与计算化学;电子圆二色谱;振动圆二色谱;旋光光谱【作者】王娟;杨笑迪【作者单位】复旦大学化学系,上海200433;复旦大学先进材料实验室,上海200438【正文语种】中文【中图分类】G64;O6自1848年Pasteur从外消旋的酒石酸铵钠中分离出左旋与右旋的酒石酸铵钠晶体,到1874年J.H.van′t Hoff与J.A.Le Bel提出碳原子的四面体模型,立体化学便成为有机化学及药物化学家的重要研究课题之一[1]。
从19世纪至今,人们对有机化学的认知发生了根本性转变,手性化合物已渗透到有机化学与药物化学的各个领域。
尤其在药物研发过程中,药物分子的功能性与其立体构型密切相关。
因此,准确有效地确定手性化合物的绝对构型至关重要。
手性化合物绝对构型的测定经历了漫长的探索与实践。
最早确定分子手性的方法是有机合成法,即从初始已知手性的化合物开始,通过手性控制的有机化学反应,将其转化为目标化合物的方法。
而有机反应路线过渡态计算,作为合成实验的有力补充,已经辅助有机化学工作者攻克了众多富有挑战性的复杂手性化合物[2]。
从仪器表征角度出发,目前确定手性分子绝对构型的方法主要有X射线单晶衍射法、核磁共振(NMR)法和光谱学方法等。
在各类测量方法中,X射线单晶衍射法作为一种可以精确测定分子三维空间结构的物理方法,是判断手性结构最有效的方法,其测试原理是基于分子中各原子对X射线的反常散射效应[3]。
手性与手性合成2

手性是三维物体的基本 孙万儒 中国科学院微生物研究所 属性。一个物体不能与 微生物资源国家重点实验室 其镜像重合的特性称为 手性。
手性化合物的特点
• • • • • • 化学组成相同 化学结构相同 基本的物理化学性质相同 立体结构不同 旋光(导电、导磁)性质不同 生物学性质不同
手性研究的意义
• 毒副作用不同
反应停(R)-对映体有效,(S)-对映体引起 胎儿畸形,有抗肿瘤作用。 乙胺丁醇抗结核药物,(SS)-对映体的抗 菌活性是(RR)-对映体的200倍, (RR)-对 映体有致失明作用。 河豚毒素,9(S)有巨毒,9( R)毒性很小。
FDA声明
• 发展单一对映体手性药物; • 鼓励外消旋药物转化为手性药物; • 新的外消旋药物申请,必需提供两个 对映体的详细生理活性和毒理数据。 发达国家在酝酿,外消旋药物不得作为 单一组分对待
在生物体的手性环境中,分子之间的严 格手性匹配是分子识别的基础
•酶催化的高度底物、区域、位点和立体专一性
•DNA复制 •蛋白质合成 •抗原与抗体的免疫识别 •受体与给体的专一作用 •药物的生物应答关系
•嗅觉对香料分子气味的感觉
生命起源与进化
手性药物
手性影响药物在体内的吸收,转运,组织分 配,作用位点,代谢和消除。与药理,临床 效果,毒副作用有关
国际上销售的药物
1850 种
天然药物和半合成药物
523 种(28.27%)
化学合成药物
1327 种(71.73%)
手性药物
517 种(98.85%)
非手性药物
6 种(1.15%)
手性药物
非手性药物
528 种(39.79%) 799 种(60.21%)
有机化学 第八章 立体化学

C2H5 Cl Cl
19
H
CH3 H Cl Cl H C2H5 Cl H
CH3 H Cl C2H5 Cl Cl
CH3 H H C 2H 5 H H
CH3 Cl Cl C2H5
CH3 Cl H Cl H C2 H5
CH3 H Cl Cl H C2H5
CH3 H Cl Cl H C2H5
CH3 Cl H Cl H C2 H5
20
注意: 注意
D,L是相对构型,与假定的 、 甘油醛相关联而确定的构型 甘油醛相关联而确定的构型。 D,L是相对构型,与假定的D、L甘油醛相关联而确定的构型。R,S 是相对构型 是绝对构型,能真实代表某一光活性化合物的构型( 、 ) 是绝对构型,能真实代表某一光活性化合物的构型(R、S) 。 两种标记法的依据: 两种标记法的依据:R/S法依据与*C相连的四个原子或基团 法依据与* 的大小顺序; 法依据与D 甘油醛的构型是否相同。 的大小顺序;D/L法依据与D-甘油醛的构型是否相同。 无论是D,L还是R,S标记方法, D,L还是R,S标记方法 无论是D,L还是R,S标记方法,都不能通过其标记的构型来判 断旋光方向。因为旋光方向使化合物的固有性质, 断旋光方向。因为旋光方向使化合物的固有性质,而对化合 物的构型标记只是人为的规定 人为的规定。 物的构型标记只是人为的规定。 目前从一个化合物的构型还无法准确地判断其旋光方向, 目前从一个化合物的构型还无法准确地判断其旋光方向,还 是依靠测定。 是依靠测定。
锲形式
COOH H OH CH3
Fischer投影式 投影式
项:
(1)不能离开纸面翻转;可以沿纸面旋转 )不能离开纸面翻转;可以沿纸面旋转180°,但不能旋转 ° ° 但不能旋转90° 或270°。 ° (2) 基团交换次数可以为偶数次,不能为奇数次;亦可以一基团 基团交换次数可以为偶数次 不能为奇数次; 偶数次, 不动,另三基团顺或逆时针轮换(相当于交换两次)。 不动,另三基团顺或逆时针轮换(相当于交换两次)。
手性异构的名词解释

手性异构的名词解释手性异构是化学中的一个重要概念,指的是分子或化合物的镜像异构体。
在自然界中,许多有机化合物都存在手性异构体,例如葡萄糖、氨基酸等。
本文将从不同角度对手性异构进行解释。
一、手性异构的定义手性异构可以简单地理解为具有对称结构,但无法通过旋转或平移使它与自身完全重合的分子。
这是因为手性异构体的分子中存在一个或多个手性中心,也称为手性碳原子。
手性中心是一个碳原子,其周围的四个取代基团分布对称,但不能通过旋转使它们完全重合。
手性异构体可分为两种类型,即映象异构体和非映象异构体。
映象异构体是指两个分子在空间结构上像鉴于映象的关系,如左手和右手。
这种类型的手性异构体可以通过镜面反射得到,但无法通过旋转或平移使其重合。
非映象异构体是指两个分子在空间结构上不具有镜像关系,如左右螺旋的螺旋状分子结构。
二、手性异构的产生手性异构体的产生主要是由于手性中心的存在。
手性中心定义了分子的空间结构,决定了手性异构体的形成。
在有机化合物中,手性中心通常是碳原子,但也有其他元素,如硫、氮等。
当手性中心的取代基团不同或位置不同时,就会形成不同的手性异构体。
手性异构体的产生可以是化学合成过程中的副产品,也可以是生物体内发生的产物。
在许多生物分子中,手性异构体是非常常见的,因为生命体系对手性物质具有高度选择性。
三、手性异构的性质和应用手性异构体具有许多不同的性质和应用。
由于其结构和性质的差异,手性异构体在生命体系中扮演着重要的角色。
例如,氨基酸的手性异构体决定了蛋白质的空间结构和活性。
只有特定的手性异构体才能参与生物体内的代谢和传递过程。
此外,手性异构体还在药物领域中得到广泛应用。
由于手性异构体的活性和生物可用性可能具有巨大差异,药物研究人员必须有效地合成和分离手性异构体。
有时候,某个手性异构体可能具有治疗效果,而另一个手性异构体则可能造成副作用。
因此,了解和控制手性异构体对新药研发非常重要。
四、手性异构的合成和分离方法手性异构体的合成和分离是手性化学中的重要课题。
有机化学基础知识点整理立体化学中的手性识别

有机化学基础知识点整理立体化学中的手性识别立体化学中的手性识别手性是有机化学中一个非常重要的概念,广泛应用于药物合成、材料科学等领域。
手性识别作为手性合成的前提和基础,是有机化学中的基础知识点之一。
本文将对手性的概念、手性分子的产生原因以及手性识别的方法进行整理和介绍。
一、手性的概念手性是指分子不具备轴对称性或面对称性,不能与其镜像重合的性质。
手性分子由手性中心或手性轴引起,具有两种不同的立体异构体,称为对映异构体或对映体。
对映体之间的相互转化需要打破化学键,因此具有非常高的化学和生物活性差异,尤其在药物研发中具有重要的作用。
二、手性分子的产生原因手性分子的产生主要有两种原因:空间异构和动力学异构。
1. 空间异构空间异构是由于手性分子的分子结构产生的,包括手性中心、手性轴和手性面。
手性中心是指一个分子中有一个碳原子与四种不同的基团连接,或者是一个原子具有两个或两个以上的非环顺式键。
手性中心对称关系下的两个异构体通过对称中心对立,互为镜像。
手性轴是指没有手性中心的分子,但其结构存在旋转轴。
手性轴的旋转将分子转化为其镜像分子。
手性面是指没有手性中心和手性轴的分子,但其结构存在镜面反射形成的平面。
2. 动力学异构动力学异构是指分子在一定条件下,通过化学反应或物理作用发生构象变化而产生的异构体。
这种异构体的转化一般不需要打破化学键,可以通过温度、溶剂等因素来控制。
三、手性识别的方法手性识别的方法主要包括实验方法和理论方法两种。
1. 实验方法实验方法是通过物理性质或化学性质的差异来进行手性的识别。
常用的实验方法包括:(1)旋光法:利用手性分子旋光光线的性质来确定其手性。
(2)质谱法:利用手性分子在质谱仪上的质谱图特征来判断其手性。
(3)核磁共振法:利用手性分子在核磁共振谱仪上的信号差异来区分其手性异构体。
2. 理论方法理论方法是通过计算机模拟和量子化学方法来预测和解释手性分子的性质和行为。
常用的理论方法包括:(1)密度泛函理论:利用电子结构计算方法和密度泛函理论来预测手性分子的光学旋光性质。
有机化学中的手性概念与立体异构体

有机化学中的手性概念与立体异构体有机化学是研究有机物结构、合成和性质的科学领域。
在有机化学中,手性(chirality)是一个重要的概念,涉及到分子的空间结构和立体异构体的存在。
本文将介绍手性的定义,手性的表现形式以及立体异构体的种类与分类。
一、手性的定义手性是指物体不与其镜像完全重合的性质。
也就是说,一个手性分子的镜像结构与原分子并不相同。
这种不对称性在有机化学中非常常见,并且对于分子的性质和功能有着重要的影响。
二、手性的表现形式手性可以通过不同的方式表现出来,其中最常见的是手性中心、手性轴和手性面。
1. 手性中心手性中心是指分子中一个碳原子上的四个取代基围绕着该碳原子排列成一个四面体的结构。
当这四个取代基中的任意两个取代基不能通过旋转互相重合时,就存在手性中心。
2. 手性轴手性轴是指分子中存在着旋转对称性,但在沿着该旋转轴方向的一侧存在着不同的官能团取代的情况。
这种情况下,分子仍然是手性的。
3. 手性面手性面是指分子中的一个平面,该平面上的取代基不能通过翻转互相重合。
例如,苯环上的取代基就可以形成手性面。
三、立体异构体的种类与分类立体异构体是指在空间结构上相互非重合、形状不同的同分异构体。
根据手性的不同表现形式,立体异构体可以分为两类:对映异构体和旋光异构体。
1. 对映异构体对映异构体是指存在手性中心的分子,其镜像结构与原结构不完全重合。
两个对映异构体是非重叠的、无法相互转化的,它们构成了一对对映异构体。
2. 旋光异构体旋光异构体是指分子对极性光的旋光性质呈现不同的现象。
旋光异构体包括旋光异构体和旋光体系。
旋光异构体在化学反应中的行为和性质常常有所不同。
根据旋光性质的不同,旋光异构体可以分为两类:左旋异构体和右旋异构体。
这两种异构体的旋光度(旋光光度的绝对值)和旋光方向都是不同的。
四、手性在生物体中的重要性手性在生物体中具有重要的作用和意义。
一方面,生物体内的许多分子都是手性的,比如葡萄糖、氨基酸等。
有机化学基础知识点整理立体化学的基本概念与应用

有机化学基础知识点整理立体化学的基本概念与应用在有机化学中,立体化学是一个重要的分支领域,它研究的是分子和化合物的三维结构及其对化学性质的影响。
立体化学的概念和应用在有机化学领域具有举足轻重的地位。
本文将对有机化学中的立体化学进行基本概念的整理,并探讨其在化学研究与应用中的重要性。
一、立体化学的基本概念1. 手性:手性是立体化学的一个重要概念,指的是分子或离子的不可重合的镜像异构体。
手性分子无法通过旋转或挪动使其镜像与原分子完全重合,就好像左手和右手无法完全重合一样。
2. 构象异构体:构象异构体指的是同分子式、同结构式但不同空间构型的异构体。
构象异构体的存在是由于分子的键旋转或自由转位所引起的。
典型的构象异构体如反式异构体和顺式异构体等。
3. 立体异构体:立体异构体指的是具有不同立体构型的分子或化合物。
常见的立体异构体有立体异构体、顺反异构体、环异构体等。
立体异构体的存在表明分子或化合物在空间上具有多种不同的构型。
4. 立体中心:立体中心是指一个分子中与不同基团相连的一个原子。
立体中心通常是由于其所连接的基团不对称而导致的。
一个分子可以有一个或多个立体中心。
5. 伪旋光体系:伪旋光体系是一种没有旋光性质的化合物与另一种旋光体系混合而形成的旋光体系。
这种混合体系的旋光性质来源于两个(或多个)异构体存在的旋光性质的合成。
二、立体化学的应用1. 手性药物:手性药物是指那些由手性分子构成的药物。
由于手性药物和其镜像异构体具有不同的生物活性,所以对于手性药物的合成和分离有着重要的意义。
立体化学在药物研发和制备中发挥着重要作用。
2. 光学活性物质:光学活性物质是指那些能够旋转平面偏振光的化合物。
通过立体异构体的性质,光学活性物质可以用于制备偏光镜、偏振片等光学器件,同时也广泛应用于化学分析和手性分离等领域。
3. 反应立体化学:立体化学对于有机反应的研究和理解具有重要意义。
通过研究反应的立体选择性、选择性和环境中对于反应物立体异构体的识别能力,可以更好地设计有机反应和催化剂的设计。
立体化学一异构体的分类

COOH
H
OH
H
COOH
H
OH
CH 2OH D-(+)-甘油醛
CH 2 OH
a
CH 3 D-(-)-乳酸
20
2. R / S标记法
OH
OH
H
CHO H OH
C2HO H
R
C2H5 H
C H3
R
CHO
H
OH
C2HO H
a
C H3 C2H5
S
H HO
CHO
C2HO H
21
D,L标记的是相对构型,R,S标记的是绝对构型
旋光方向,还是依靠测定。
a
22
五、含两个手性碳原子化合物的对映异构 1. 含两个不同手性碳原子化合物的对映异构
1
-
COOH
1
COOH
HO
HO 2 H
H2
Cl 3 H
H 3 Cl
4COOH
(2R,3R)
4COOH (2S,3S)
1
2
1
COOH HO 2 H
H 3 Cl 4COOH
(2R,3S)
3
-
1
COOH
COOH
(1)
(2)
(3) (+)-酒石酸
mp
(+)-酒石酸 170oc
(-)-酒石酸
170oc
()-酒石酸 (dl) 206oc
meso-酒石酸 140oc
[]D(水) +12.0 -12.0 0 0
溶解度(g/100ml) 139 139 20.6
a 125
COOH HO H (S)
H OH (S)
有机化学基础知识点整理立体化学中的手性识别方法

有机化学基础知识点整理立体化学中的手性识别方法有机化学基础知识点整理立体化学中的手性识别方法立体化学是有机化学中十分重要的一个分支,它主要研究分子空间结构以及涉及到的手性识别方法。
手性分子具有非对称的空间结构,它们的结构和性质与其镜像略有不同。
因此,准确识别和区分手性分子对于理论研究和实际应用都具有重要意义。
本文将对立体化学中的手性识别方法进行整理和说明。
一、旋光法旋光法是一种基于光学活性物质旋光现象的手性分子识别方法。
光学活性物质具有旋光性质,分为右旋光和左旋光两种,它们对应的旋光角度正好相反。
当手性分子通过旋光器时,会使得入射的偏振光发生旋转,根据旋光角度的正负以及旋光方向的确认,可以准确识别手性分子的构型。
旋光法以其简便、灵敏的特点,广泛应用于手性分析。
二、构象法构象法是一种基于手性分子在空间构型上的差异进行识别的方法。
手性分子不同的构象之间可能在空间取向、原子位置、键角等方面有细微的差别。
通过分析手性分子的构象,可以准确判断其手性性质。
例如,对于双酮类化合物,它们的手性性质与取代基的空间排布密切相关,通过构象法可以将其分为R型和S型两种构型。
三、差向异构体法差向异构体法属于物理性手性识别方法,它通过测定手性分子与其差向异构体形成的物理性质差异进行鉴定。
一般来说,差向异构体在光学、电学和磁学等性质上有明显差异。
例如,对于手性分子的环糊精包合物,在核磁共振波谱中会显示出明显的峰移,通过分析差向异构体所产生的这些差异可以准确鉴定手性分子。
四、动力学法动力学法是通过研究反应速率、化学平衡等动力学参数的差异来识别手性分子的方法。
手性分子在化学反应中可能出现反应速度的差异,或者在平衡时形成不同的化学异构体。
通过实验测定这些差异,可以推断手性分子的空间构型和手性性质。
动力学法在药物合成、酶反应等领域有着广泛的应用。
五、理论计算法理论计算法是一种通过计算手性分子的能量、振动频率等性质差异来进行鉴定的方法。
有机化学第三章立体化学基础(2024)

手性药物的合成。手性药物是指具有手性中心的药物分子。在合成手性药物时,需要利用 立体化学原理来控制产物的立体构型。例如,通过引入手性辅剂或利用不对称催化等方法 ,可以实现手性药物的高效合成。
22
06
2024/1/25
立体化学在药物设计中的重要性
23
药物活性与手性关系
手性对药物活性的影响
手性药物的两个对映异构体可能具有 不同的生物活性,其中一个可能具有 治疗效果,而另一个可能无效或有毒 。
手性中心判断方法
7
2024/1/25
03
观察碳原子连接的四个基团或 原子是否相同,若不相同则为 手性中心。
04
使用Cahn-Ingold-Prelog规则 (CIP规则)进行判断。
9
手性分子表示方法
2024/1/25
Fischer投影式
01
将碳链竖直表示,横前竖后,横向基团朝右,纵向基团朝上。
透视式
一个物体不能通过旋转和平移操作与其镜 像完全重合的性质。
对称性的定义
一个物体可以通过旋转和平移操作与其镜 像完全重合的性质。
手性与对称性的关系
手性是对称性的一个特例,即没有对称中 心或对称面的物体具有手性。
手性在化学中的应用
手性化合物在生命体系中具有重要的作用 ,如氨基酸、糖类等。
5
构型与构象
构型的定义
02
将碳链放平,基团朝向观察者方向。
Newman投影式
03
沿碳-碳键的键轴方向观察,将碳原子和与之相连的基团放在纸
平面上,其他基团则竖立在纸平面上。
10
2024/1/25
03
对称性与对称操作
11
对称元素及类型
手性与手性药物-文档资料

人们对手性的研究可以追溯到1874年第一位化 学诺贝尔奖获得者Jhvan(范霍夫)。当时他就提 出了具有革命性的理论,化学分子为三维结构,一 些化合物存在两种构像,且两者互为镜像。 1886年,科学家报道了氨基酸类对映体引起人 们味觉感受的差别。 1956年Pfeifer(普费费尔)根据对映体之间 药理活性的差异,总结出:一个药物的有效剂量越 低,光学异构体之间药理活性的差异就越大。即在 光学异构体中,活性高的异构体与活性低的异构体 之间活性比例越大,作用于某一受体或酶的专一性 越高,作为一个药物,它的有效剂量就越低。
在生命的产生和演变过程中,自然界往往对一种 手性有所偏爱,如我们吃的糖,无论是甘蔗汁制的, 还是甜菜汁制的,它们的分子都是右旋的.(糖的构 型为D-构型);人体内,一切氨基酸分子都是左旋 的,传递遗传信息的脱氧核糖核酸(DNA),95%以 上都是右旋。因此,分子手性在自然界生命活动中起 着极为重要的作用。人类的生命本身就依赖于手性识 别。如人们对L一氨基酸和D一糖类能够消化吸收, 而其对映体对人类来说没有营养价值,或副作用。
手性与手性药物
1953年,联邦德国Chemie制药公司研究了一种名为 “沙利度胺” 的新药,该药对孕妇的妊娠呕吐疗效极佳, Chemie公司在1957年将该药以商品名“反应停”正式推向市 场。 两年以后,欧洲的医生开始发现,本地区畸形婴儿的出 生率明显上升,此后又陆续发现12000多名因母亲服用反应停 而导致的海豹婴儿!这一事件成为医学史上的一大悲剧!
手性 “手性”,形象的说,就是手的性质。手具有什么性质 呢?每个人的手都有5个手指,左手右手又不能重叠,左手的 镜影是右手,反之亦然。
手性是自然界的普遍特征。构成自然界 物质的一些手性分子虽然从原子组成来看是 一模一样,但其空间结构完全不同,他们构 成了实物和镜像的关系,也可比喻成左右手 的关系,所以叫做手性分子 手性是三维物体的基本属性。构成生命 体的有机分子绝大多数都是手性分子。同时 生命体系,也具有极强的手性识别能力。
(3)立体异构专一性

第三章酶第一节酶的化学本质及其作用特点一、酶是生物催化剂二、酶的作用特点1.高效性;2.专一性;3.可调性三、酶的组成第二节酶的组成与辅酶一、酶的组成二、维生素与辅酶第三节酶的分类与命名一、习惯命名法1.根据底物命名;2.根据所催化的化学反应命名;3.根据酶作用的底物和催化的化学反应来命名;4.注明酶的来源及一些其他特点二、系统命名法1.注明酶的所有底物;2.注明所催化的化学反应的类型三、酶的系统分类1.氧化还原酶类;2.移换酶类;3.水解酶类;4.裂合酶类;5.异构酶类;6.合成酶类四、酶的编号第四节影响酶促反应速度的因素一、酶浓度的影响二、pH的影响三、温度的影响四、底物浓度对酶促反应速度的影响1.米氏方程;2.米氏方程的推导;3.米氏常数的意义和米氏常数的测定五、激活剂对酶促反应速度的影响六、抑制作用及其动力学1.不可逆性抑制;2.可逆性抑制第五节酶的结构及活性中心一、活性中心的概念二、活性中心的结构三、活性中心的形成及酶原激活第六节酶的催化机理一、底物与酶的靠近及定向作用二、变形与张力作用三、共价催化四、酸碱催化五、低介电区作用第七节别构酶与共价调节酶一、酶活性的调节与调节酶二、别构调节与别构酶1.别构效应;2.别构酶;3.别构酶动力学特点;4.别构调节机理;5.别构酶举例三、酶的共价调节第八节酶活力及其测定一、酶活力和比活力的概念1.酶的活力单位;2.比活力;3.转换数二、酶活力的测定第九节同功酶、诱导酶、组成酶与核酶一、同功酶二、诱导酶与组成酶三、核酶前言新陈代谢是生命活动的最重要特征,由生物体内进行的物质变化与能量变化构成,而这些变化都是在酶的催化下完成的。
经过近100年的研究,迄今为止,从酶的化学本质来讲已发现两类酶:一类是由活细胞产生的、对其特异性底物起高效催化作用的蛋白质,是在生物体内催化各种代谢反应最主要的催化剂;另一类酶是近年来发现的具有高效、特异催化作用的核酸,主要参与RNA 的剪接。
立体化学的名词解释是什么

立体化学的名词解释是什么立体化学是研究分子在空间中的结构和性质关系的一门学科,也是有机化学的一个重要分支。
它着眼于分子的三维构型,并探索了构型对分子性质和反应行为的重要影响。
立体化学的研究对于我们理解分子的行为和开发新的药物、催化剂和功能材料等方面都具有重要意义。
下面将从立体化学的基本概念、立体异构体和手性分子等方面展开论述。
1. 立体化学的基本概念立体化学研究的基本概念是分子的立体构型。
在立体化学中,我们研究的是分子在空间中的排列情况,即分子是如何在三维空间中存在的。
与平面几何关注二维形状不同,立体化学则探索了分子的三维结构。
分子的立体构型与它的性质和反应行为密切相关,因此研究分子的立体化学非常重要。
2. 立体异构体立体异构体指的是具有相同分子式但空间构型不同的化合物。
在立体异构体中,分子的原子组成相同,但它们的排列方式不同。
最常见的立体异构体类型是构造异构体和扭转异构体。
构造异构体通常发生在碳原子的键连接方式不同导致的情况下,如顺反异构体和环异构体。
顺反异构体是指两个官能团(一般为氢和卤素)相对位置不同的异构体。
而环异构体则是指相同分子中的原子在空间中围绕同一轴旋转而形成的异构体。
构造异构体通常会对分子的性质和反应行为产生重要影响。
扭转异构体则是指分子在空间中的取向不同而形成的异构体。
扭转异构体通常是由于分子中存在旋转自由度而产生的。
类似于构造异构体,扭转异构体也会对分子的性质和反应产生显著影响。
3. 手性分子手性分子是立体化学研究中的一个重要概念。
手性分子是指无法与其镜像重叠的分子,也就是左右非对称的分子。
一个手性分子可以存在两种镜像异构体,它们分别称为L-和D-型,也可以分别称为左旋和右旋异构体。
这两种手性异构体在立体中心(通常是一个碳原子)的配置不同而产生的。
手性分子常常具有不同的物理化学性质和生物活性,因此对于药物研发和医药领域非常重要。
总的来说,立体化学是研究分子在空间中的结构和性质关系的学科。
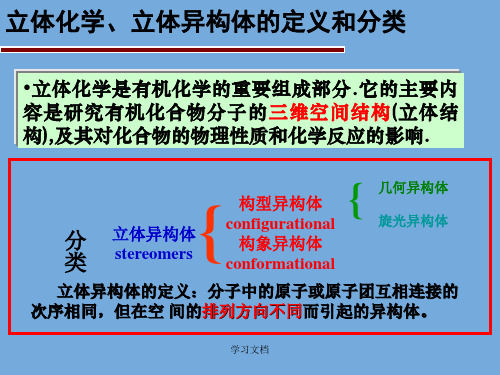
立体化学、立体异构体的定义和分类
注意事项
(4)Fischer投影式中的手性碳原子上所连原子或基团,可以 两-两交换偶数次,但不能交换奇数次。否则,构型变为其对映 体。
学习文档
对映体的命名 R\S命名原则
(1)按次序规则排出各取代基的顺序A>B>C>D a. 原子序数大小规则—序数大的原子优先 b. 同位素规则—原子量大优先 c. 外推规则—层层外推,先比较最大的 d. d. 相当规则—重键看作多个单键如:-HC=CH2 等
学习文档
镜象与手性的概念
手性:实物与其镜像不能重叠的特点。物体具有不对称性, 就具有手性。
学习文档
不对称碳原子
不对称碳原子:
(asymmetric carbon atom) 与四个互不相同的一价
C*
基团相连的碳原子叫
不对称碳原子﹡.
不对称碳原子是一种手性中心, 但手性中心不一定是不对称碳原子.
有不对称碳的分子不一定是手性分子.
有对学称习文中档 心的分子
对称中心 i
——设想分子中有一个点,从分子
中任何一个原子出发,向这个点作 一直线,再从这个点将直线延长出 去,则在与该点前一线段等距离处, 可以遇到一个同样的原子,这个点 就是对称中心.
有对学称习文中档 心的分子
交替对称轴(旋转反映轴Sn) Cn+
——设想分子中有一条直线,当分子以此直线为轴 旋转360º/n后,再用一个与此直线垂直的平面进行 反映(即作出镜象),如果得到的镜象与原来的分子完 全相同,这条直线就是交替对称轴.
线型分子有C∞对称轴
有2重对称轴的(2-丁烯)
学习文档
找出下列化合物的对称轴.
学习文档
对称面(镜面)
对称面:如果分子中存在一个平面,能将分子分割为 互为实物与镜象的两半,此平面就是对称面
手性与手性药物【文库论文】

手性与手性药物======================================================================【摘要】近年来,手性药物的临床意义引起人们的广泛关注,手性药物的开发已成为国际研究的热点。
本文对手性和药物手性的概念、研究的实际意义以及手性药物研究现状进行阐述,说明手性药物具有广阔的市场前景。
【关键词】手性;手性药物Abstract:Recently,clinical sigmificance of chiral drugattracts wide attention.Exploration of chiral drug was an heated discussion of internatiomal research.The paper expounded the conceptof chirality and drug ,chiral actual meaning of research,and progresses on the research of chiral drug,showed that market foreground of chiral drug was extensive.Key words:Chirality;Chiral drug.1 手性手性是自然界的普遍特征。
构成自然界物质的一些手性分子虽然从原子组成来看是一摸一样,但其空间结构完全不同,他们构成了实物和镜像的关系,也可比喻成左右手的关系,所以叫做手性分子[1]。
在生命的产生和演变过程中,自然界往往对一种手性有所偏爱,如自然界中,糖的构型为D-构型,氨基酸为L-构型,蛋白质和DNA的螺旋构象又都是右旋的,等等。
因此,分子手性在自然界生命活动中起着极为重要的作用。
人类的生命本身就依赖于手性识别。
如人们对L一氨基酸和D一糖类能够消化吸收,而其对映体对人类没有营养价值,或有副作用。
1手性化合物拆分与鉴定

手性物质提取分离手性药物的结晶拆分方法:手性化合物的拆分是给外消旋混合物制造一个不对称的环境,使两个对映异构体能够分离开来。
从方法学上来讲,可以分为结晶拆分法(物理拆分方法、化学拆分方法)、动力学拆分方法、生物拆分方法(相当部分是生物催化的动力学拆分)及色谱拆分方法。
--手性药物的拆分方法—1、结晶拆分法--直接结晶法---在光学活性溶剂中的结晶拆分--直接结晶法---外消旋体的不对称转化和结晶拆分--直接结晶法---逆向结晶法逆向结晶法则是在外消旋体的饱和溶液中加入可溶性某一种构型的异构体[如(R)—异构体],添加的(R)—异构体就会吸附到外消旋体溶液中的同种构型异构体结晶体的表面,从而抑制了这种异构体结晶的继续生长,而外消旋体溶液中相反构型的(S)—异构体结晶速度就会加快,从而形成结晶析出。
--直接结晶法---优先结晶法优先结晶方法(preferential crystallization)是在饱和或过饱和的外消旋体溶液中加入一个对映异构体的晶种,使该对映异构体稍稍过量因而造成不对称环境,结晶就会按非稍的过程进行,这样旋光性与该晶种相同的异构体就会从溶液中结晶出来。
--直接结晶法---自发结晶拆分法自发结晶拆分(spontaneous resolution)是指当外消旋体在结晶的过程中,自发的形成聚集体。
--通过形成非对映异构体的结晶法--非对映异构体的形成和拆分原理--通过形成非对映异构体的结晶法--用于碱拆分的拆分试剂(酸性拆分剂)2、动力学拆分化反应,分离方法直接。
的衍生化试剂具有良好的对热及水的稳定性。
局限性色谱柱价格昂贵,部分固定相还存在稳定性差,柱容量低,柱强度差等缺点,且根据不同手性药物的性质不同,选用的分析方法也不同。
系统平衡时间较长,添加剂消耗大,对于一些难分离的对映体效果差。
手性试剂需要有高的光学纯度,各对映体的衍生化速率及平衡常数应一致,要求衍生化反应迅速、彻底,否则影响定量结果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3
2.4 手性与环境
不对称合成是“绿色有机合成”的重要内容之一!! 如:在农药使用上,手性农药的使用可以达到减少剂量,提高药 效的作用;并且减少不良和无效对映体造成的环境污染。
除草剂异丙甲草胺(Metolachlor)以消旋体的形式问世 以来,每年以2万多吨的产量投放市场,1997年后以光活性 异构体替代消旋体,使用量减少了40%,这相当于每年少向 环境中排放8千多吨化学物质。
目前,美国FDA已禁售消旋药物,或 “……申请新的外消旋 药物,要求对两个对映体都必须提供详细的生理活性和毒理 数据,而不得作为相 同物质对待”。
日本、中国和欧盟都有类似的立法。
世界手性药物销售以每年15%以上的速度增长。形成巨大的手 性药物和手性化学品市场。2010年,手性药物的销售额达到 约2000亿美元。
就象左手和 右手一样,看起来相似,但不能重叠。
手性有机化合物的特点:
• 在非手性条件下,对映异构体的物理性质,如:熔点、溶解度, 以及色谱保留时间、IR和NMR谱等都是相同的。但是,平面偏 振光旋转的方向不同。
• 非对映异构体的物理性质,以及色谱保留时间、NMR谱等可能 是不同的。
• 从具有旋光性看,又可称为光活性化合物。 使偏振光左旋的对映体,表示为(-)-, 如:(-)-乳酸 使偏振光右旋的对映体,表示为(+)-, 如:(+)-乳酸
1.2 手性有机化合物-对映异构体
法国化学家巴斯德(L.Pasteur, 1822~1895)在 1848年,发现酒石酸两种不同的存在形式:左旋 酒石酸 和 右旋酒石酸。开创了 “手性有机分子 研究的新时代”。
有机分子的手性
有机分子中的碳原子如果连有四个不同的原子(或基 团),由于具有不同的空间排列形式,存在一对立体异构 体,称为镜像异构体(或称对映异构体)。
(-)-黄皮酰胺:我国自主研发新药,已进入临床三期
黄皮酰胺是由黄量先生小组从中国治疗风湿和肝炎的中药 黄皮中分离出来的,(-)-黄皮酰胺具有抗衰老,抗缺氧及 促智等作用,(+)-黄皮酰胺不仅无正作用,还有一定抑制 作用。
手性药物的药理作用
通过药物分子与体内的大分子之间严格的手性识别和匹配 而实现的。生物体的酶和细胞表面受体是手性的,两个对 映体在体内以不同的途径被吸收、活化或降解。
法国著名化学家Louis Pasteur
2.3 光活性异构体性质的差异
O
H2N OH
NH2OH
(S)-天冬酰胺,苦味
O
HO H2N
NH2 H
O
(R)-天冬酰胺,甜味
O
O
(R)-香芹酮,留兰香味
(S)-香芹酮,芜妥香味
2
更重要的是生物(药理)活性的差异
最著名的是1957-1962年在欧洲发生的“反应停”的大悲 剧,造成数万名婴儿严重畸形。进一步研究表明,其致 畸作用是由沙利度胺其中的一个异构体(S-异构体)引 起的,而即使大剂量使用R-异构体,也不会引起致畸作 用。生产厂家Chemie Gruenenthal公司因此被起诉。
MeO
O
(S)-异丙甲草胺,
Cl
[(S)-Metolachlor]
N
2.5 手性与材料
• 外消旋体(racemic):一对等量对映体的混合物。由于一对 对映体的旋光值相同,而符号相反, 所以没有旋光性, 如:()乳酸。
1
二. 手性研究的意义 2.1 自然界对手性化合物的选择
二十余种天然氨基酸都是L-构型
人们甚至发现,1969年坠落在澳大利亚默奇森林 的陨石中的氨基酸也主要是L 型的。
O
O HN
N OO
沙利度胺 (Thalidomide)
OCH2*OCCHH2NHCCHH3 3 CH3
Propranolol (普萘洛尔) (S)- 治心脏病(心得安) (R)- 避孕药
Me COOH
MeO
Naproxen(萘普生) (非甾体抗炎药) (S)-比(R)-高35倍
HO
ห้องสมุดไป่ตู้
NH2
HO
* COOH
第一章 绪论
一. 手性---立体(三维)异构
1.1 什么是手性 ?! 正如人的左、右手的关系一样,右手与左手成
镜 像 。 手 性 (chirality) 这 个 词 来 源 于 希 腊 字 “手” (cheir)。
手性是三维物体的基本属性。如果一个物体不 能与其镜像重合,该物体就称为手性物体。
自然界中的手性---各种贝壳呈“左”“右”螺旋
DOPA(多巴) (L)- 治帕金森病 (D)- 导致心脏病
O
*
NH
O
NH
O
巴比妥酸盐
(-)-抑制剂 (+)-惊厥剂
Nature, 2012, 3月,共有三篇文章:
脱氧酶基因的突变导致产生 2-羟基-戊二酸(2HG), 它是一种潜在的致癌代谢物。
Koivunen等发现,(R)-2HG而不是(S)-2HG能刺激 “ELN脯氨酰 4-氢化酶”的活性,导致“缺氧诱导 因子”水平下降。
多糖和核酸中的单糖主要是D-构型 蛋白质、核酸和多糖是生物体存在的基础,也都是手性的 复杂的天然产物
OH
H2N O
OO
OH
OH HO
O
OH
OH OH
OH
HO
OH
OH
OH OH
O
O
OH
HO OH
OH OH
OH
O
OH
HO
N
N
H
H OH
OH
OH HO
OH OH
OH HO
OO
OH OH
O OH
HO H O
以DOPA(多巴)为例:
真正有活性的是多巴胺,但多巴胺不能跨越“血脑屏障”。 只能服用多巴,在体内由多巴脱羧酶将其脱羧成多巴胺。 而酶 的作用是专一性的,只对 (L)-DOPA起作用。 这样若服用消旋的多巴, (D)-DOPA就可能在体内积累,产生危
险 (引发心脏病)。
手性药物是指:药物的分子结构中存在手性因素,而且由 具有药理活性的手性化合物组成的药物。 (其中只含有效对映体,或者以含有效的对映体为主。)
OH OH
OH
Palytoxin (10)
OH
OH
OH
HO
OH OH
1971年分离得到海葵毒素(71个手性中心)
紫杉醇(Taxol)
人们十分关注:这两个“对映”的天然产物是怎样生成的。
2.2 研究生命起源的重要课题是手性起源
宇宙是非对称的,如果把构成太阳系的全部物 体置于一面跟随着它们的镜子面前,镜子中的 影像不能和实体重合。……生命由非对称作用 所主宰。我能预见,所有生物物种在其结构上、 在其外部形态上,究其本源都是宇宙非对称性 的产物。
