叶绿体DNA的提取-微藻
微藻的筛选及分类方法5篇

微藻的筛选及分类方法5篇第1篇示例:微藻是一类微小的单细胞藻类生物,具有较高的生长速度和养分价值,被广泛应用于食品、化妆品、医药等领域。
在微藻的筛选及分类过程中,对不同品种的微藻进行鉴定是非常重要的环节。
本文将介绍微藻的筛选及分类方法,以帮助大家更好地了解和利用这一类微生物资源。
一、微藻的筛选方法:1. 采集样品:首先需要到自然水体或实验室培养基中采集微藻样品,可以使用显微镜观察并挑选较为典型的样本。
2. 光合作用测定:通过观察微藻在光照条件下的生长情况,可以初步筛选出具有良好光合作用能力的微藻。
3. 色素分析:利用色素分析技术,可以检测微藻的色素组成,据此判断微藻属于什么类别。
4. 生物学特性:观察微藻的生长速率、适应性、产额等生物学特性,可以进一步筛选出优质的微藻品种。
1. 形态学分类:根据微藻的细胞形态、大小、颜色等特征,可以将微藻进行初步分类,如绿藻、蓝藻、硅藻等。
2. 分子生物学分类:借助PCR、序列分析等技术,对微藻的基因序列进行比对和分类,可以更准确地确定其分类地位。
3. 生理学分类:根据微藻的生长环境、代谢途径、营养方式等生理学特征,可以将微藻进行系统分类。
4. 生态学分类:根据微藻在自然界中的生态角色和地位,对其进行生态学分类,包括水华微藻、底泥微藻等。
通过以上方法的筛选和分类,可以为微藻资源的开发利用提供科学依据,同时为微藻的生态学研究和环境保护提供重要参考。
希望本文能对相关领域的研究者和爱好者有所帮助,推动微藻资源的可持续利用和保护。
【注:此内容仅供参考,具体操作请遵循相关规定和标准。
】。
第2篇示例:微藻是一类微小的藻类生物,通常生长在水体中,是一种重要的原生生物。
在环境保护、生物能源开发以及食品营养等方面都有着重要的应用价值。
而微藻的筛选及分类方法则成为研究人员关注的重点之一。
一、微藻的筛选方法微藻的筛选是指通过对大量的藻类生物进行鉴定和分类,从中挑选出具有特定特性或潜在价值的微藻。
实验四植物DNA的提取[定稿]
![实验四植物DNA的提取[定稿]](https://img.taocdn.com/s3/m/5de4138468dc5022aaea998fcc22bcd126ff4203.png)
实验四植物DNA的提取[定稿]第一篇:实验四植物DNA的提取[定稿]实验四植物DNA的提取一、实验目的掌握CTAB法从植物叶片提取DNA的原理和方法。
采用CTAB法从植物叶片中提取基因组DNA,并进行纯度分析。
二、实验原理1、核酸提取的基本原理核酸是生物有机体中的重要成分,在生物体中核酸常与蛋白质结合在一起,以核蛋白的形式存在。
核酸分为脱氧核糖核酸(DNA)和核糖核酸(RNA)两大类,在真核细胞中,前者主要存在于细胞核中,后者主要存在于细胞质及核仁里。
在制备核酸时,通过研磨破坏细胞壁和细胞膜,使核蛋白被释放出来。
在浓氯化钠溶液(1~2 mol/L)中,DNA核蛋白的溶解度很大,RNA核蛋白的溶解度很小;而在稀氯化钠溶液(0.14 mol/L)中,DNA核蛋白的溶解度很小,RNA核蛋白的溶解度很大。
因此,可利用不同浓度的氯化钠溶液将DNA核蛋白和RNA核蛋白从样品中分别抽提出来。
分离得到核蛋白后,需进一步将蛋白等杂质除去,常采用的去除蛋白的方法有3种:①用含异戊醇的氯仿振荡核蛋白溶液,使其乳化,然后离心除去变性蛋白质,此时蛋白质凝胶停留在水相和氯仿相中间,而DNA溶于上层水相。
用两倍体积的无水乙醇溶液将DNA 钠盐沉淀出来。
如果用酸性乙醇或冰乙酸来沉淀,得到的是游离的DNA。
②用十二烷基硫酸钠(SDS)等去污剂使蛋白质变性,与核酸分离,从而从材料中直接提取出DNA。
③用苯酚处理,然后离心分层,DNA溶于上层水相,蛋白变性后则停留在酚层内。
吸出上面水层,加两倍体积的无水乙醇溶液,得到白色纤维状DNA沉淀。
反复使用上述方法多次处理DNA核蛋白溶液,就能将蛋白等杂质较彻底地除去,得到较纯的DNA制品。
为了彻底除去DNA制品中混杂的RNA,可用RNA酶处理。
生物材料中含有的脂肪物质和大部分的多糖,在用盐溶液分离核蛋白和用乙醇或异丙醇分级沉淀时即被除去。
在DNA提取、制备的过程中,核酸极不稳定,许多因素可破坏其完整结构:①化学因素,核酸的结构在pH值4.0~11.0间较稳定,pH值在此范围外就会使核酸变性降解,故制备过程应避免过酸过碱。
实验二微藻叶绿素的提取与定量

实验二微藻叶绿素的提取与定量一、目的要求掌握藻类光合色素的提取方法二、方法及原理选取典型微藻,培养至一定浓度,在显微镜计数微藻的细胞浓度,然后过滤一定体积的微藻至玻璃纤维滤膜上,置于甲醇中,待细胞内的可溶性色素完全溶解于甲醇中,然后在分光光度计下测定特定波长的吸光值,并依此计算该藻的光合色素含量。
三、器材与步骤藻种:三角褐指藻抽滤泵,抽滤瓶,过滤套装若干套,25mmGF/F滤膜1盒,100mL量筒5个,无水甲醇500mL,5mL移液枪及枪头若干套,10mL离心管20支,离心机,分光光度计,石英比色杯。
步骤1.上午9点,显微镜下计数细胞浓度2.根据血球计数板标示,计算出藻液的细胞浓度3.量取50-100mL藻液4.使用抽滤泵将藻液过滤至GF/F滤膜上5.将滤膜转移至10mL离心管中6.移取5mL甲醇至离心管中7.将离心管避光置于室温下,保证提取时间大于2小时8.下午1点,打开分光光度计并预热9.将离心管取出,并置于离心机中,4°下5000转/min离心10分钟10.移取2.5mL甲醇至比色皿中,在750,665与632nm波长处做空白11.小心将离心管取出,移液枪移取2.5mL甲醇提取上清液至比色杯中12.在分光光度计中测定13.导出数据,并按照如下公式计算甲醇提取物中的叶绿素浓度及单位细胞叶绿素含量四色素浓度与含量的计算溶剂中Chl a浓度(ug/mL)=13.27*(A665-A750)-2.68*(A632-A750)溶剂中Chl c浓度(ug/mL)=6.01*(A665-A750)+28.82*(A632-A750)A632,A665及A750分别代表在相应波长下的提取液吸光值。
五计算题根据细胞浓度,过滤的藻液体积,溶剂中色素浓度,分别计算出单位细胞中chla与chlc 的含量。
应用叶绿素荧光法测定微藻生物量的方法

应用叶绿素荧光法测定微藻生物量的方法
叶绿素是光合作用中必不可少的色素,同时也是微藻生物量的重要指标。
叶绿素荧光法是目前常用的测定微藻生物量的方法之一。
其通过
测量微藻生物体内叶绿素荧光的强度,推算出微藻的生物量。
本文将
分步骤说明如何应用叶绿素荧光法测定微藻生物量。
第一步,准备微藻样品。
首先需要将微藻培养物离心,将上清液倒掉,留下底物。
接着用去离子水洗涤1-2次,最后用去离子水重新悬浮微藻,调整至相同的悬浮液浓度。
第二步,取出少量微藻悬浮液放入试管中,并加入2-3滴叶绿素荧光素。
试管放到深色环境中静置15-30分钟。
第三步,测定叶绿素荧光强度。
将试管放到光度计中进行测定,记录
下荧光强度值,并保证测定时间相同。
第四步,利用标准曲线计算微藻生物量。
根据事先制定好的标准曲线,将荧光强度转换成对应的微藻生物量值,从而得出微藻样品的生物量。
需要注意的是,制备标准曲线时需要选取不同浓度的微藻样品,分别
进行叶绿素荧光测试,然后绘制曲线。
同时,每次测定时应该用同样
的参考物进行比较,以确保测定数据的准确性和可靠性。
另外,叶绿素荧光法还可以用于微藻生长的监测。
通过定期测量微藻
样品的叶绿素荧光强度,可以了解微藻的生长状态,并且可以通过调
整培养条件来提高微藻生长速度和生物量。
总之,叶绿素荧光法是一种简单、快速、准确的测定微藻生物量的方法,对于微藻研究具有重要的应用价值。
微藻总DNA提取(CTAB裂解法)

微藻总DNA提取(CTAB法)
1材料与方法
1.1微藻
微藻样品准备。
1.2试剂
(1)CTAB(十六烷基三甲基溴化胺)提取缓冲液:内含2%CTAB,100mmol/L Tris -Hcl(pH=8.0),2 mol/LNaCl,10mmol/LEDTA,2%β-巯基乙醇。
RNase (100mg/ml),异丙醇,75%乙醇。
(2)PCI抽提液:苯酚/氯仿/异戊醇(体积比)为25∶24∶1。
TE缓冲液:10mmol/ LTris-Hcl(pH=7.5),1mmol/ LEDTA(pH=8.0)。
1.3实验方法
1.3.1微藻DNA提取
(1)取200mg微藻样品置于1.5 ml的离心管中,加600 μlCTAB裂解液,混匀, 65℃水浴1h,期间每15 min颠倒混匀。
(2)取出后加600 μl PCI抽提液,混匀,13000 xg,离心10min。
(3)将上清液转至新的1.5 ml离心管中,加入6ulRNase,37℃,1h。
(4)再加600 μl PCI抽提液,混匀,13000 xg,离心10min,直至两相界面无沉淀。
(5)将上层水相转至新的离心管中,加入1倍体积的异丙醇(或2倍体积无水乙醇),室温下放置20 min,沉淀DNA。
13000 xg,离心10min。
(6)弃去上清液,用75%乙醇洗涤DNA沉淀2次。
(7)室温晾干,将DNA溶解于50 ulTE缓冲液中。
一种快速提取微藻完整叶绿体及其DN A的方法

一种快速提取微藻完整叶绿体及其DN A的方法潘远健;金刚;谢振华;代建国;王妍;栾崇林;于化泓【期刊名称】《江苏农业科学》【年(卷),期】2016(044)002【摘要】利用高盐结合SDS裂解法,对杜氏盐藻、湛江叉鞭金藻、球等鞭金藻叶绿体及其DNA进行分离和提取。
经超声波匀浆后差速离心,可获得比较完整的叶绿体,再经有机试剂萃取,可得到产率较高、纯度较好的叶绿体DNA,经PCR扩增得到清晰的条带。
本试验方法快速简便,DNA质量可以满足后续分子生物学操作需要。
【总页数】4页(P66-68,69)【作者】潘远健;金刚;谢振华;代建国;王妍;栾崇林;于化泓【作者单位】深圳职业技术学院/深圳市大规模细胞培养技术和细胞资源库公共技术服务平台,广东深圳518055; 南昌大学生命科学与食品工程学院,江西南昌330031;深圳职业技术学院/深圳市大规模细胞培养技术和细胞资源库公共技术服务平台,广东深圳518055;清华大学深圳研究生院,广东深圳518055;深圳职业技术学院/深圳市大规模细胞培养技术和细胞资源库公共技术服务平台,广东深圳518055;深圳职业技术学院/深圳市大规模细胞培养技术和细胞资源库公共技术服务平台,广东深圳518055;深圳职业技术学院/深圳市大规模细胞培养技术和细胞资源库公共技术服务平台,广东深圳518055;南昌大学生命科学与食品工程学院,江西南昌330031【正文语种】中文【中图分类】Q244;S917【相关文献】1.一种快速提取谷子叶绿体DNA的方法 [J], 袁进成;贾树利;刘颖慧2.简易、快速提取大葱叶绿体、线粒体DNA的方法 [J], 盖树鹏;孟祥栋3.一种植物基因组DNA快速提取方法的建立与评估 [J], 李琳; 罗淋淋; 罗光宇; 莫蓓莘; 刘琳4.一种适于PCR扩增的茶树基因组DNA快速提取方法 [J], 申超峰;周玲红;彭丁文;刘跃荣;周闰5.一种适用于绿僵菌克隆筛选的DNA批量快速提取方法 [J], 宋红生;邓博严;殷颖因版权原因,仅展示原文概要,查看原文内容请购买。
一种共生藻PCR模板DNA的快速制备法

对于共生藻 DNA的提取,既有采用先与宿主分 离再进行 DNA提取的方法[6],也有采用与宿主混合 采样的 提 取 方 法[7]。在 实 际 操 作 中,许 多 共 生 体 (如珊瑚)由于其产生大量粘多糖,共生藻往往难于 分离,李秀保等(2009)提出用冲洗法对活体珊瑚共 生藻进行分 离[8];张 露 (2017)比 较 了 冲 洗 法、液 氮 研磨法和酒精研磨法对共生藻的分离效果,发现酒 精研 磨 法 分 离 效 率 高、分 离 质 量 好[9];张 跃 环 等 (2018)提 出 了 用 毛 细 管 法 获 得 砗 磲 单 克 隆 共 生
摘要:采用 Chelex100树脂法制备了 26个物种(分别属于腔肠动物门、海绵动物门和软体动物门)
的共生藻以及一株纯培养共生藻的 DNA样品。通过 PCR扩增叶绿体 23SrRNA基因片段获得了
26个有效序列,测序比对结果显示获得的序列与扩增目的基因相符。该方法不仅样品消耗量小、
操作时间短、设备需求低廉,而且可以避免使用有害化学试剂。这是一种高效、环保的 DNA提取方
第 38卷 第 4期 2019年 11月
应用海洋学学报
JournalofApplied Oceanography
Vol38,No4 Nov,2019
一种共生藻 PCR模板 DNA的快速制备法
龙 寒,郖金彩
(广西民族大学海洋与生物技术学院、广西海洋微生物资源产业化工程技术研究中心、广西多糖材料与 改性重点实验室,广西 南宁 530008)
藻类dna提取方法

藻类dna提取方法嘿,咱今儿就来唠唠藻类 DNA 提取这档子事儿!你想想啊,藻类,那可是在水里头到处晃悠的小家伙们,别看它们不起眼,要从它们身上把 DNA 弄出来,还真得有点招儿呢!首先呢,得把藻类给收集起来呀。
就好比你去果园摘果子,得先找到那些成熟的果子不是?把藻类收集到一块儿,这就是提取 DNA 的第一步。
然后呢,就得把藻类给弄碎咯。
哎呀,这就像是要把一个大面包掰成小块儿,得让里面的好东西都能露出来呀。
可以用一些特殊的工具或者方法,把藻类细胞给破开。
接下来呀,就是关键的一步啦!要把 DNA 从那些碎碎的藻类里面分离出来。
这就好像在一堆沙子里找金子,得有耐心,还得有合适的办法。
可以用一些化学试剂啥的,让 DNA 乖乖地跑出来。
再之后呢,得把 DNA 给纯化一下。
这就好比把淘到的金子再洗一洗,把杂质去掉,让它变得更纯更亮。
这样得到的 DNA 才更干净,更好用呀。
你可能会问啦,这有啥难的呀?嘿,可别小瞧了这事儿。
就跟做饭似的,看着简单,做起来可不一定容易呢。
要是哪个步骤没弄好,可能就得不到好的 DNA 啦。
比如说吧,收集藻类的时候要是不仔细,混进去了别的东西,那后面提取出来的 DNA 可能就不纯净啦。
或者在弄碎藻类的时候太大力气了,把 DNA 也给弄坏了,那不就白忙活啦?还有啊,选择化学试剂的时候也得小心谨慎,要是用错了试剂,可能 DNA 就提不出来,或者提出来的质量不好。
咱再打个比方,这就像是盖房子,每一块砖都得放对地方,才能盖出坚固漂亮的房子呀。
提取藻类 DNA 也是这样,每个步骤都得认真对待,才能得到好的结果。
总之呢,藻类 DNA 提取可不是一件随随便便就能做好的事儿。
得有耐心,得细心,还得有一定的技术和经验。
但是只要咱认真去做,肯定能从那些小小的藻类里把宝贵的 DNA 给弄出来!怎么样,是不是挺有意思的呀?咱可别小看了这些小小的藻类,它们里面藏着的秘密可多着呢!。
高等植物叶绿体DNA的提取方法

高等植物叶绿体DNA的提取方法(Bookjans et al.提出,龚小松等改良。
)1、100g叶子被收集和储存在黑暗中24h,用自来水洗两次,再用蒸馏水洗两次;2、将叶子剪碎放在预冷的高速搅拌器里,再倒入400ml预冷的缓冲液 A(50mmol Tris,25mmol EDTA,1.25molNaCl,0.25mol 抗坏血酸(维生素C),ph3.6),叶子被先被低速搅拌两次,5s一次,然后再被高速搅拌3-4次,10s一次。
3、用四层粗棉布过滤匀浆,滤出液被分装到两个250ml离心管中800g 离心6min。
4、去上清,加入200ml 缓冲液 B(50mmol Tris,25mmol EDTA,1.25molNaCl,10mmo巯基乙醇,0.1%牛血清蛋白,ph8.0)悬浮,800g 离心 6min。
5、去上清,加入少量溶液 C(100mmol EDTA,150mmolNaCl,ph8.0)悬浮,转移到50ml的离心管中,再加入30ml提取液C,800g 离心 6min。
6、去上清,加入少量缓冲液D(50mmol Tris,25mmol EDTA,ph8.0)悬浮,充分悬浮后,再加入16ml的缓冲液D,4ml 10%的Sarcosy 溶液和200ul 5mg/ml 的蛋白酶K。
7、在37℃水浴中温浴3h以上。
8、当叶绿体被裂解以后,溶液用酚抽提两次,再用酚:氯仿:异戊醇抽提两次。
用1/2体积的7.5mol的醋酸铵和3倍体积的100%乙醇,-20℃过夜沉淀叶绿体DNA。
10000g离心15min收集叶绿体DNA,用70%乙醇洗两次,用500ul的TE buffer 熔解保存。
9、加入50ug/ml的RNase A,于37℃水浴中温浴30min,加入12ml蛋白酶K温浴1h。
10、再用酚和氯仿抽提两次以除去残留蛋白。
收集上清,用乙醇沉淀,-70℃30min 后,再次离心收集沉淀,用500ul的TEbuffer熔解备用。
实验七叶绿体色素的提取分离及理化性质的鉴定讲解

实验七叶绿体色素的提取及理化性质的鉴定一、目的1、学习应用提取分离叶绿体色素的实验方法。
2、验证叶绿素的理化性质。
3、了解叶绿体色素的荧光现象、皂化反应等理化性质。
二、原理1、叶绿体色素:植物叶绿体色素主要有三类:1)叶绿素2)类胡萝卜素3)藻胆素。
高等植物叶绿体中含有前两类,藻胆素仅存在于藻类植物中。
高等植物体内叶绿素(chlorophyll两种)主要有两种:叶绿素a、b(简写为chla、chlb,其结构式见图7-3),chla通常呈蓝绿色,而chlb呈黄绿色,chlb是chla局部氧化的衍生物。
chla是chlb的三倍,二十世纪30年代,知道了叶绿素的分子结构,50年代末期,人工合成了叶绿素a,其它色素也几乎在同时发现。
叶绿体中的类胡萝卜素主要包括胡萝卜素(carotene)和叶黄素(lutein)两种,前者呈橙黄色,后者呈黄色。
叶黄素是胡萝卜素的二倍。
一般植物叶绿素是类胡萝卜素的三到四倍;胡萝卜素:C40H56 (有α、β、γ三种同分异构体)叶黄素:C40H54(OH)2 (同分异构体很多)。
2、理化性质:这二大类四种色素都不溶于水,而溶于有机溶剂,如乙醇、丙酮等。
通常用80%的丙酮或丙酮:乙醇:水为4.5:4.5:1的混合液来提取叶绿素。
按化学性质来说,叶绿素是叶绿酸的酯,在碱的作用下,可使其酯键发生皂化作用,生成叶绿酸的盐,能溶于水,但由于它保留有Mg核的结构,仍保持原来的绿色。
而类胡萝卜素中,胡萝卜素是不饱和的碳氢化合物,β—胡萝卜素水解可生成2分子维生素A,叶黄素是由胡萝卜素衍生的二元醇,不能与碱发生皂化反应,根据这一点,可以将叶绿素和类胡萝卜素分开。
此外,叶绿素还可以在酸的作用下,其中的Mg被H所代替形成褐色的去Mg叶绿素:去Mg叶绿素能与其他金属盐中的铜、锌、铁盐等代H,又重新呈现绿色,比原来的绿色更稳定。
根据这一原理可用醋酸铜处理来保存绿色标本。
3、功能:1.叶绿体色素的功能叶绿素和类胡萝卜素都包埋在类囊体膜中,与蛋白质结合在一起,组成色素蛋白复合体,根据功能来区分,叶绿体色素可分为二类:(1)作用中心色素:叶绿素分子含有一个卟啉环的“头部”和一个叶绿醇的“尾部”,呈蝌蚪型,大卟啉环由四个小吡咯环以四个含有双键的甲烯基(-CH=)连接而成。
一种快速提取微藻完整叶绿体及其DNA的方法

一种快速提取微藻完整叶绿体及其DNA的方法作者:潘远健金刚谢振华代建国王妍栾崇林于化泓来源:《江苏农业科学》2016年第02期摘要:利用高盐结合SDS裂解法,对杜氏盐藻、湛江叉鞭金藻、球等鞭金藻叶绿体及其DNA进行分离和提取。
经超声波匀浆后差速离心,可获得比较完整的叶绿体,再经有机试剂萃取,可得到产率较高、纯度较好的叶绿体DNA,经PCR扩增得到清晰的条带。
本试验方法快速简便,DNA质量可以满足后续分子生物学操作需要。
关键词:微藻;叶绿体;叶绿体DNA;提取方法中图分类号: Q244;S917文献标志码: A文章编号:1002-1302(2016)02-0066-03收稿日期:2015-01-15基金项目:广东省深圳市科技项目(编号:JC201005280534A、JCY20130331151022276);广东省自然科学基金(编号:10151805501000007)。
作者简介:潘远健(1987—),男,广西梧州人,硕士研究生,从事基因调控研究。
E-mail:*********************。
通信作者:金刚,博士,教授,主要从事水生生物学研究。
E-mail:****************.cn。
叶绿体是绿色植物进行光合作用的细胞器。
20世纪初,学者根据植物叶片的花斑现象具有母性遗传的特性,推断在叶绿体上或许存在核外的遗传因子。
20世纪60 年代初,随着电镜技术与分子生物学技术的发展,叶绿体基因组的存在由Gupta等证实[1]。
目前,叶绿体DNA (cpDNA)被广泛应用于细胞质遗传、植物系统发育、植物雄性不育、亲缘关系、叶绿体转基因等研究中。
微藻作为水体生态系统重要的初级生产者及潜在的外源基因表达载体,研究其叶绿体和cpDNA功能、结构特征,对于叶绿体表达体系构建具有重要作用。
因此,快速、简便地获得质纯、量大cpDNA是许多工作的前提。
目前,获得微藻完整叶绿体和纯度高、浓度大的微藻cpDNA存在一定困难,主要原因是微藻种类繁多,每种微藻有其生物学特点,缺乏通用方法;叶绿体DNA含量较少,在提取过程中存在诸多干扰因素(核DNA、RNA、蛋白质等)。
叶绿体DNA的提取-微藻

叶绿体DNA的提取(参考杜氏盐藻)1、材料:扁藻2、培养基配方:3、仪器:超速离心机细胞破碎仪4、用于细胞破碎和叶绿体分离的缓冲液:溶液1:0.33 mol/L山梨糖醇Sorbitol,50m mol/L Hepes, 2m mol/LEDTA, 1m mol/L MnCl2, 2m mol/L DTT,体积分数0.5%BSA,Leupeptin 1mg/L溶液2(45%蔗糖加离心缓冲液):45g/L蔗糖,0.33mol/L Sorbitol,50m mol/L Hepes 溶液3(60%蔗糖加离心缓冲液):60g/L蔗糖,0.33mol/L Sorbitol,50m mol/L Hepes 溶液4(叶绿体洗涤缓冲液):0.33mol/L Sorbitol,25m mol/L Hepes以上缓冲液均用KOH调pH至7.5溶液5:50m mol/L Tris-HCl,100 m mol/L EDTA,pH8.05、完整叶绿体的分离(所有操作均在4℃进行)1)将培养10d左右达对数生长后期的250ml藻液,离心收集藻体,液氮充分研磨后,将上述藻体细胞用20ml冰预冷的溶液1充分缓慢的悬浮于50ml离心管,制成(粗体液)。
3)将粗体液于1000g离心30s,弃上清。
4)再次用10ml冰预冷的溶液1充分缓慢悬浮,悬浮液平均铺满于6个10 mL HITACHI CPIO0专用离心管上层,每个离心管最下层铺有冰预冷的3 mL溶液3,其上铺有冰预冷的3 mL溶液2形成梯度。
5)4℃,40 000 g离心3h,完整的叶绿体集中在梯度之间,将此层小心吸至10 mL 离心管(约2 mL)6)加入4倍体积的冰预冷的溶液4,3 000 g离心5min以除去多余的蔗糖,重复此步骤1次。
7)将沉淀悬浮于3 mL溶液4作为完整叶绿体制品,置于4 ℃备用。
6、cpDNA的提取及鉴定l)在得到的新鲜完整叶绿体制品中,加入终浓度分别为150μg/l和13mmol/l的DNase I和MgCl2,并于冰上静置2h以去除来自核DNA的潜在污染2)4℃,1 000 g离心1 min,收集叶绿体沉淀3)将叶绿体沉淀悬浮于500μl溶液5,加入终浓度为2%的SDS (初始浓度为20%的SDS加55μl) 和终浓度为100μg/ml的蛋白酶K(初始浓度为20mg/ml,加2.7μl),55℃水浴3h;4)、加入等体积的饱和酚(pH8.0),轻轻混合均匀,于4℃,12000rpm离心10-15min 5)小心移取上清于新的灭菌EP管,后加入等体积的酚:氯仿:异戊醇(25:24:1),混匀,于4℃,12000rpm离心10-15min;6)小心移取上清于另一离心管,加入等体积氯仿:异戊醇(24:1),上下颠倒混合均匀,于4℃,12000rpm离心10-15min;7)移取上清,加1/10体积的3M NaAC和二倍体积预冷的无水乙醇(-20℃),于-20℃冰箱中沉淀过夜或-80℃沉淀1h;8)4℃,10000rpm离心15min,弃上清;9)加入70%酒精,10000rpm离心10分钟,洗涤沉淀两次;10)将沉淀于室温放置,直至无酒精气味,加30-50μlTE缓冲液或RNase-free 水溶解沉淀。
叶绿体色素提取实验及作用
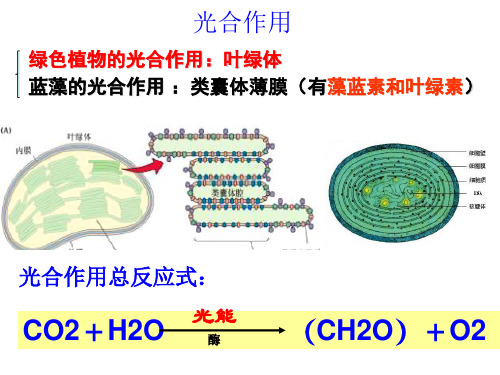
绿色植物的光合作用:叶绿体 蓝藻的光合作用 :类囊体薄膜(有藻蓝素和叶绿素)
光合作用总反应式:
CO2+H2O
光能
酶
(CH2O)+O2
实验:绿叶中色素的提取和分离
实验目的: 色素的提取(验证色素的存在) 实验材料:新鲜的菠菜、实验仪器、其他药品 实验方法: 研磨法
研磨法提取色素实验步骤:
材料剪碎 过滤
1880年
恩格尔曼实验 黑 暗
4、极细光束下好氧细菌分布发生变化,说明什么? 好氧细菌聚集地方有氧气产生 说明光合作用发生离不开光照 5、全光照下下好氧细菌分布情况,说明什么? 好氧细菌聚集在叶绿体周围 说明光合作用场所是叶绿体
提出问题: 光合作用产生的O2中的氧原子来自CO2 还是H2O?
实验设计:材料及器具:小球藻,放射性物质检测仪 C18O2 , H218O , CO2 , H2O
一、捕获光能的色素和结构
实验 绿叶中色素的提取和分离
实 验 原 理
提取: 绿叶中的叶绿素和类胡萝卜素都不溶于水, 而溶于无水乙醇等有机溶剂。
分离:绿叶中的各种色素在有机溶剂层析液中的 溶解度不同,溶解度高的随层析液在滤纸上扩 散得快;反之,则慢。
叶绿体——光合作用的场所
叶绿体为光合作用快速进行 提供了哪些必需和有利的条件?
较短时间内,蜡烛不灭, 较短时间后,蜡烛熄灭, 实验现象: 小鼠不死。 小鼠死亡。 实验结论: 植物体只有在光照下才能更新空气. 限于当时的科学水平,人们不知道植物如何更新空气, 不知道植物吸收和释放了什么气体。
Go back
到1785年,发现了空气的组成,人们才明确绿叶在光下放出的是O2,吸收的 是CO2。
变化 -0.1kg +74.4kg
杜氏盐藻高纯度叶绿体DNA的提取

杜氏盐藻高纯度叶绿体DNA的提取曲东京;李杰;潘卫东;贾彦龙;薛乐勋【期刊名称】《郑州大学学报(医学版)》【年(卷),期】2008(043)006【摘要】目的:分离大量完整的杜氏盐藻叶绿体,提取高纯度的叶绿体DNA(cpDNA).方法:取对数生长后期的杜氏盐藻细胞进行高压破碎,利用差速离心和蔗糖密度梯度离心得到完整的叶绿体.采用优化的SDS-蛋白酶K-酚/氯仿/异戊醇方案抽提cpDNA,并经10 g/L琼脂糖凝胶电泳鉴定.结果:蔗糖密度梯度离心结果表明分离到了大量的叶绿体,相差显微镜及电镜观察证实所得叶绿体的完整性.紫外分光光度仪检测3个批次cpDNA的浓度蛋白酶为(2.21±0.02) mg/L,A(260 nm)/A(280 nm)为(1.772±0.012).结论:获得了高纯度的杜氏盐藻cpDNA,为进行叶绿体的转化研究奠定了实验基础.【总页数】3页(P1127-1129)【作者】曲东京;李杰;潘卫东;贾彦龙;薛乐勋【作者单位】郑州大学生物工程系细胞生物学研究室,郑州,450052;郑州大学生物工程系细胞生物学研究室,郑州,450052;郑州大学基础医学院微生物学与免疫学教研室,郑州,450001;郑州大学生物工程系细胞生物学研究室,郑州,450052;郑州大学生物工程系细胞生物学研究室,郑州,450052【正文语种】中文【中图分类】Q781【相关文献】1.鱼汤提取物对杜氏盐藻植板率的影响 [J], 魏娟;赵良侠;唐欣昀;张海生;齐飞飞;吕芳芳2.杜氏盐藻多糖提取工艺的优化 [J], 戴军;王旻;尹鸿萍;汤坚3.超声波强化提取杜氏盐藻中β-胡萝卜素工艺的研究 [J], 周鸣谦;刘云鹤;陈宏柱4.超声波辅助提取杜氏盐藻油脂工艺研究 [J], 李秀霞;孙协军;韩鲁佳5.杜氏盐藻完整叶绿体的分离及其蛋白提取 [J], 贾岩龙;柴玉荣;曲东京;刘红涛;薛乐勋因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
叶绿体DNA的提取(参考杜氏盐藻)
1、材料:扁藻
2、培养基配方:
3、仪器:超速离心机细胞破碎仪
4、用于细胞破碎和叶绿体分离的缓冲液:
, 2m mol/L 溶液1: mol/L山梨糖醇Sorbitol,50m mol/L Hepes, 2m mol/LEDTA, 1m mol/L MnCl
2
DTT,体积分数%BSA,Leupeptin 1mg/L
溶液2(45%蔗糖加离心缓冲液):45g/L蔗糖,L Sorbitol,50m mol/L Hepes
溶液3(60%蔗糖加离心缓冲液):60g/L蔗糖,L Sorbitol,50m mol/L Hepes
溶液4(叶绿体洗涤缓冲液):L Sorbitol,25m mol/L Hepes
以上缓冲液均用KOH调pH至
溶液5: 50m mol/L Tris-HCl,100 m mol/L EDTA,
5、完整叶绿体的分离(所有操作均在4℃进行)
1)将培养10d左右达对数生长后期的250ml藻液,离心收集藻体,液氮充分研磨后,将上述藻体细胞用20ml冰预冷的溶液1充分缓慢的悬浮于50ml离心管,制成(粗体液)。
3)将粗体液于1000g离心30s,弃上清。
4)再次用10ml冰预冷的溶液1充分缓慢悬浮,悬浮液平均铺满于6个10 mL HITACHI CPIO0专用离心管上层,每个离心管最下层铺有冰预冷的3 mL溶液3,其上铺有冰预冷的3 mL溶液2形成梯度。
5)4℃,40 000 g离心3h,完整的叶绿体集中在梯度之间,将此层小心吸至10 mL离心管(约2 mL) 6)加入4倍体积的冰预冷的溶液4,3 000 g离心5min以除去多余的蔗糖,重复此步骤1次。
7)将沉淀悬浮于3 mL溶液4作为完整叶绿体制品,置于4 ℃备用。
6、cpDNA的提取及鉴定
l)在得到的新鲜完整叶绿体制品中,加入终浓度分别为150μg/l和13mmol/l的DNase I和MgCl2,并于冰上静置2h以去除来自核DNA的潜在污染
2)4℃,1 000 g离心1 min,收集叶绿体沉淀
3)将叶绿体沉淀悬浮于500μl溶液5,加入终浓度为2%的SDS (初始浓度为20%的SDS加55μl) 和终浓度为100μg/ml的蛋白酶K(初始浓度为20mg/ml,加μl),55℃水浴3h;
4)、加入等体积的饱和酚,轻轻混合均匀,于4℃,12000rpm离心10-15min
5)小心移取上清于新的灭菌EP管,后加入等体积的酚:氯仿:异戊醇(25:24:1),混匀,于4℃,
12000rpm离心10-15min;
6)小心移取上清于另一离心管,加入等体积氯仿:异戊醇(24:1),上下颠倒混合均匀,于4℃,12000rpm离心10-15min;
7)移取上清,加1/10体积的3M NaAC和二倍体积预冷的无水乙醇(-20℃),于-20℃冰箱中沉淀过夜或-80℃沉淀1h;
8)4℃,10000rpm离心15min,弃上清;
9)加入70%酒精,10000rpm离心10分钟,洗涤沉淀两次;
将沉淀于室温放置,直至无酒精气味,加30-50μlTE缓冲液或RNase-free水溶解沉淀
10)。
