物理化学 第五章 化学平衡.ppt
合集下载
2020高中化学竞赛—物理化学(基础版)-第五章 化学平衡(共72张PPT)

rGm ,3 rGm ,1 2rGm ,2
K
3
K1
/
K
2
2
上一内容 下一内容 回主目录
返回
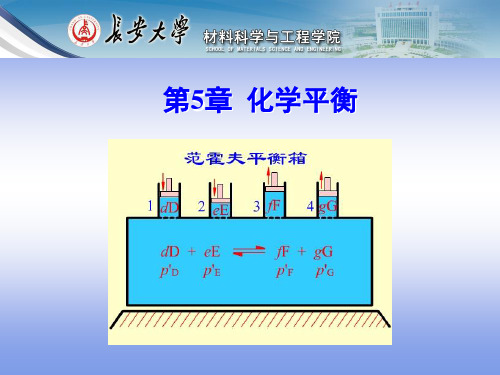
(1) N2 (g) 3H2 (g) 2NH3(g)
rGm ,1 RT ln K1
(2) 1/ 2N2 (g) 3 / 2H2 (g) NH3 (g) rGm ,2 RT ln K2
rGm ,1 2rGm ,2
vB( g )
B
上一内容 下一内容 回主目录
返回
证明
aA(g) bB(l) yY (g) zZ (s)
B
(cd
)
B
(cd
)
rGm aA bB yY zZ
a(
A
RT
ln(
pA
/
p ))
b
B
y(Y
RT
ln(
pY
/
p ))
zZ
a
A
bB
yY
zZ
RT
ln
( (
pY pA
/ /
p ) y p )a
B
B
B
rGm
v
B
B
vB RT ln( pB / p )
B
B
Jp:压力商
rGm rGm RT ln J p 理想气体反应等温方程
已知反应温度T时的
r
G
m
和各气体的分压pB,即
可求出该温度下的 rGm
上一内容 下一内容 回主目录
返回
Jp:压力商
aA bB yY zZ A,B,Y,Z均为气体
上一内容 下一内容 回主目录
返回
p(CO2): CO2的平衡压力,亦称碳酸钙的分解压力 分解压力越小,稳定性越高
第五章吉布斯自由能和化学平衡

• 平衡常数可由实验的方法测定。即:当反应达到平衡后, 分别测出各反应物质的分压(或浓度),再计算出平 衡常数的数值。
• 在同一温度下,平衡常数的数值,不随压力(浓度)的变化 而改变,是一个定值(常数)。
• 平衡常数与反应的标准摩尔吉布斯自由能相关,是 化学反应的热力学性质之一。
2、平衡常数与温度的关系
2 KClO3 = 2 KCl + O2
2、什么是化学平衡?
——所谓化学平衡,指的是这样一种状态,此时: •正向反应的速度与逆向反应的速度相等 •参与反应的物质的浓度保持一定 •动态的平衡,而非化学反应停止
化学反应的可逆性的定量表征:平衡常数
二、平衡常数
1、什么是“平衡常数”?
对于一个特定化学反应 aA + bB
ΔS体系 + ΔS环境 > 0
三、吉布斯自由能
?吉布斯自由能变与自发反应的方向
? 化学反应的标准摩尔吉布斯自由能变 ? 温度对化学反应的吉布斯自由能变 及
化学反应方向的影响
? 压力、浓度对反映吉布斯自由能变的影响
1 、吉布斯自由能变与自发反应的方向
既然熵作为自发反应方向判据的一个前提条件是体系必须 是一个孤立体系,而一般的化学反应都不是在孤立体系中进行 的,计算体系和环境的总的熵变也是非常困难的,故实际情况 中,以熵变作为判据并不方便。
什么情况下,混乱度过增加?
• 物质的三态
固态 < 液态 < 气态
• 溶解的过程 溶质的分子与溶剂的分子混合到一起
• 化学反应
反应前后,气态物质的总分子数增加
CaCO3 = CaO + CO2
• 温度
温度越高,混乱度越大,熵值越大
自发过程,往往是混乱度增加的过程
• 在同一温度下,平衡常数的数值,不随压力(浓度)的变化 而改变,是一个定值(常数)。
• 平衡常数与反应的标准摩尔吉布斯自由能相关,是 化学反应的热力学性质之一。
2、平衡常数与温度的关系
2 KClO3 = 2 KCl + O2
2、什么是化学平衡?
——所谓化学平衡,指的是这样一种状态,此时: •正向反应的速度与逆向反应的速度相等 •参与反应的物质的浓度保持一定 •动态的平衡,而非化学反应停止
化学反应的可逆性的定量表征:平衡常数
二、平衡常数
1、什么是“平衡常数”?
对于一个特定化学反应 aA + bB
ΔS体系 + ΔS环境 > 0
三、吉布斯自由能
?吉布斯自由能变与自发反应的方向
? 化学反应的标准摩尔吉布斯自由能变 ? 温度对化学反应的吉布斯自由能变 及
化学反应方向的影响
? 压力、浓度对反映吉布斯自由能变的影响
1 、吉布斯自由能变与自发反应的方向
既然熵作为自发反应方向判据的一个前提条件是体系必须 是一个孤立体系,而一般的化学反应都不是在孤立体系中进行 的,计算体系和环境的总的熵变也是非常困难的,故实际情况 中,以熵变作为判据并不方便。
什么情况下,混乱度过增加?
• 物质的三态
固态 < 液态 < 气态
• 溶解的过程 溶质的分子与溶剂的分子混合到一起
• 化学反应
反应前后,气态物质的总分子数增加
CaCO3 = CaO + CO2
• 温度
温度越高,混乱度越大,熵值越大
自发过程,往往是混乱度增加的过程
物理化学(上)课件 05章 相平衡

• 这种情况下组分数可用以下关系确定:
组分数(C) = 物种数(S ) 独立化学平衡数 (R) 同一相中独立的浓度关系数(R) 注意: ① 这种物质之间的浓度关系的限制条件:只有在同一
相中方能应用,不同相中不存在此种限制条件。
• 例如:CaCO3 的分解体系,虽然有 nCaO = nCO2
但因 CaO (s) 和 CO2 (g) 不是同一相,所以不能作 为特殊的浓度制约关系。
② 需要指出的是,有时由于考虑问题的角度不同,体 系物种数 (S) 的确定可能不同,但组分数不会改变。
• 例如水溶液体系:
i)纯水液相体系:
若不考虑水的电离,组分数 C = 1,等于物种数 S。
• 若考虑电离:H2O H+ + OH • 则 S = 3 ,但有一化学平衡: R =1;
• 液相中浓度关系式
• 注意:体系中的物种数(S )和组分数(C )这两个概念 的区别:
• 体系中有几种物质,则物种数 S 就是多少;而组分
1)如果体系中各物种之间没有发生化学反应,一般说 来此时组分数等于物种数:C = S
• 例如:乙醇 溶于水,组分数
C= S =2 2)如果体系中各物质之间发生了化学反应,建立了化
相与相之间在指定条件下有明显的界面,在界面上宏观 性质的改变是飞跃式的。
§5.1 引 言
相平衡是热力学在化学领域中的重要应用之一 研究多相系统的平衡在化学、化工的科研和生产 中有重要的意义,例如:溶解、蒸馏、重结晶、萃取、 提纯及金相分析等方面都要用到相平衡的知识。 一、多相平衡:
1)液体的蒸发(液相和气相平衡) 2)固体的升华或熔化(固相与气相或液相平衡) 3)气体或固体在液体中的溶解度(气-液、固-液相平衡) 4)溶液的蒸气压(溶液各组分-气相组分平衡) 5)溶质在不同相之间的分布(溶质在两溶液相中的平衡)
物理化学:05 化学平衡

B(T )
RT
ln
fB P
K
f
fG P
fD P
g
d
fH P
fE P
h
e
(2)液相反应
a) aA(l) bB(l) gG(l) hH(l)
如果参加反应的物质是构成理想溶液,物质的化学势
表示式:
B
B
RT
ln
B
代入
K
G g H h A a B b
如果参加反应的物质均溶于一溶剂中,而溶液为稀
2、用作判据
化学反应等温式主要用作判据。等温方程式可以判断
一个化学反应是否能自发进行。因为用 rGm 作判据,
在等温、等压、只作膨胀功(体积功)不作其它功的情况
下,如果一热力学过程的:
G 0 G 0 G 0
能自发进行 达平衡 反应不能自发进行
将此结论推广应用于任意一气相反应,则从 等温方程式可以看出:
平衡时:CaO(s) CO2 ( g ) CaCO3 (s) 0
对于凝聚相(液体或固体),其化学势随压力变化不
大,并且凝聚相均处于纯态不形成固溶体或溶液。则
CaO(s)
CaO( s )
CaCO3 (s)
CaCO3 (s)
CO2 ( g )
CO2 (T )
RT
ln
PCO2 P
P )
P2 SO3
P P 2
SO2
O2
(1/
(1/ P )2 P )2 (1/ P )
KP
1 P
2 ( 2 1)
KP
(P
B )B
B
PB P
B
B=产物的系数和-反应物的系数和 B
K
天津大学第五版物理化学课件

当系统达到平衡,
rGm rG RT ln J 0
$ m eq p $ eq rGm RT ln J p RT ln K $
K称为热力学平衡常数,它仅是温度的函数,在
数值上等于平衡时的压力商,是无量纲的量。因
为它与标准摩尔反应吉布斯函数有关,所以又称
为标准平衡常数。
1. 标准平衡常数
(1) C(s) O2 (g) CO2 (g)
(2) CO(g) 1 O2 (g) CO2 (g) 2
$ r Gm (1)
$ r Gm (2)
(1) - 2×(2) 得(3)
(3) C(s) CO2 (g) 2CO(g)
$ $ $ r Gm (3) r Gm (1) 2 r Gm (2)
例题
例题 298K时,正辛烷C8H18(g)的标准燃烧焓是 –5512.4 kJ· –1 ,CO2(g)和液态水的标准生成焓分别 mol 为–393.5和–285.8 kJ· –1 ;正辛烷,氢气和石墨的标 mol 准熵分别为463.71,130.59和5.69 J· –1· –1。 K mol ⑴ 试求算298K时正辛烷生成反应的K。 ⑵ 增加压力对提高正辛烷的产率是否有利?为什 么? ⑶ 升高温度对提高其产率是否有利?为什么? ⑷ 若在298K及标准压力下进行此反应,达到平衡 时正辛烷的物质的量分数能否达到0.1?若希望正辛烷 的物质的量分数达0.5,试求算298K时需要多大压力才 行?
例题
6. 其它的平衡常数
eq K p ( pB ) B B
一般有单位
对于理想气体
eq pB B $ eq B $ B K ( $ ) ( pB ) /( p ) p B B
rGm rG RT ln J 0
$ m eq p $ eq rGm RT ln J p RT ln K $
K称为热力学平衡常数,它仅是温度的函数,在
数值上等于平衡时的压力商,是无量纲的量。因
为它与标准摩尔反应吉布斯函数有关,所以又称
为标准平衡常数。
1. 标准平衡常数
(1) C(s) O2 (g) CO2 (g)
(2) CO(g) 1 O2 (g) CO2 (g) 2
$ r Gm (1)
$ r Gm (2)
(1) - 2×(2) 得(3)
(3) C(s) CO2 (g) 2CO(g)
$ $ $ r Gm (3) r Gm (1) 2 r Gm (2)
例题
例题 298K时,正辛烷C8H18(g)的标准燃烧焓是 –5512.4 kJ· –1 ,CO2(g)和液态水的标准生成焓分别 mol 为–393.5和–285.8 kJ· –1 ;正辛烷,氢气和石墨的标 mol 准熵分别为463.71,130.59和5.69 J· –1· –1。 K mol ⑴ 试求算298K时正辛烷生成反应的K。 ⑵ 增加压力对提高正辛烷的产率是否有利?为什 么? ⑶ 升高温度对提高其产率是否有利?为什么? ⑷ 若在298K及标准压力下进行此反应,达到平衡 时正辛烷的物质的量分数能否达到0.1?若希望正辛烷 的物质的量分数达0.5,试求算298K时需要多大压力才 行?
例题
6. 其它的平衡常数
eq K p ( pB ) B B
一般有单位
对于理想气体
eq pB B $ eq B $ B K ( $ ) ( pB ) /( p ) p B B
大学物理化学第四版课程课件:第5章相平衡

当 = 3 三相共存
f 0 无变量系统
单组分系统的自由度最多为2,双变量系统 的相图可用平面图表示。
相点 表示某个相状态(如相态、组成、温度等)的 点称为相点。
物系点 相图中表示系统总状态的点称为物系点。在T-x 图上,物系点可以沿着与温度坐标平行的垂线上、 下移动;在水盐相图上,随着含水量的变化,物系 点可沿着与组成坐标平行的直线左右移动。
f C n
5.4 单组分系统的相平衡
单组分系统的两相平衡——Clapeyron方程 外压与蒸气压的关系——
不活泼气体对液体蒸气压的影响 水的相图 *硫的相图 超临界状态
5.4 单组分系统的相平衡
单组分系统的相数与自由度
C=1
f + = 3
当 = 1 单相 当 = 2 两相平衡
f 2 双变量系统 f 1 单变量系统
5.2 多相系统平衡的一般条件
在一个封闭的多相系统中,相与相之间可以有 热的交换、功的传递和物质的交流。
对具有 个相系统的热力学平衡,实际上包
含了如下四个平衡:
(1) 热平衡 (2) 力学平衡 (3) 相平衡 (4) 化学平衡
(1) 热平衡条件
设系统有, 两个相构成,在系统的组成、
总体积和热力学能均不变的条件下,若有微量热
dG dGB dGB B dnB B dnB
因为 dnB dnB
dG B dnB B dnB (B B )dnB
平衡时 dG 0
B B
同理,可以推广到多相平衡系统
(4) 化学平衡条件
在达到化学平衡时,反应物的化学势等于生 成物的化学势,化学势的代数和可表示为
BB 0
B
对于含 个相的多相平衡系统,这几个平
物理化学5-化学平衡
B
B
B 0
反应自发地向右进行 反应自发地向左进行 反应达到平衡
8 /47
ห้องสมุดไป่ตู้
B B
B
B > 0 B = 0
B
判断化学反应的方向和限度
用 G
T , p
判断,这相当于 G ~ 图上曲线的斜率
因为是微小变化,反应进度处于0~1 mol之间。
G 0 T , p
( r Gm )T , p r G (T ) RT ln Qp
m
可以用 (1) (2) 只能用 但
( r Gm )T , p 判断反应的方向和限度
(rGm )T , p,Wf 0
判断反应的方向
rG rG
反映了反应的限度,可近似估计反应的 m
可能性 当
的绝对值很大时,基本上决定了 m
17 /47
B
§5.2 标准平衡常数
本节核心内容
1. 定义
2. 气相反应~
3. 气相反应~
4. 有凝聚相参与的气体反应~ 5. ~与化学反应式的关系
5.2.1 标准平衡常数的定义
气相反应
dD eE gG hH
( pG / p )g ( pH / p ) h r Gm r Gm (T ) RT ln ( pD / p )d ( pE / p )e
反应自发向右进行,趋向平衡 反应自发向左进行,趋向平衡
G 0 T , p
G 0 T , p
反应达到平衡
9 /47
判断化学反应的方向和限度
G 0 T , p
《化学平衡教学》课件

通过控制反应条件,如温度、压力和浓度,可以 02 调节化学平衡,提高产物的收率和质量。
在制药、石油化工、冶金等领域,化学平衡的计 03 算和分析对于工艺流程的优化和改进具有重要意
义。
环境保护中的应用
01 化学平衡在环境保护中发挥着重要作用,如大气 中温室气体的平衡、水体中污染物的平衡等。
02 通过研究污染物在环境中的化学反应和迁移转化 规律,可以预测和控制环境污染,制定有效的治 理措施。
THANKS
感谢观看
化学平衡的计算方法
平衡图解法
通过作图和观察图像,利用平衡 常数和温度的关系,求出平衡常
数和温度的关系。
代数法
通过建立化学平衡的代数方程组 ,求解未知数。
微分法
利用化学反应速率和浓度的关系 ,建立微分方程,求解未知数。
04
化学平衡的应用
工业生产中的应用
化学平衡在工业生产中有着广泛的应用,如化学 01 反应器的设计和优化、催化剂的选择和制备等。
的结构和功能研究等。
05
化学平衡的实验研究
实验目的与原理
实验目的
通过实验探究化学平衡的原理,加深对化学平衡概念的 理解。
实验原理
化学平衡是指在一定条件下,可逆反应的正逆反应速率 相等,反应物和生成物浓度不再发生变化的状态。实验 将通过具体反应来展示化学平衡的形成和特点。
实验步骤与操作
实验步骤 1. 准备实验器材和试剂,包括反应容器、温度计、搅拌器、可逆反应的试剂等。
《化学平衡教学》 ppt课件
目录
• 化学平衡的基本概念 • 化学平衡的原理 • 化学平衡的计算 • 化学平衡的应用 • 化学平衡的实验研究
01
化学平衡的基本概念
平衡的定义
在制药、石油化工、冶金等领域,化学平衡的计 03 算和分析对于工艺流程的优化和改进具有重要意
义。
环境保护中的应用
01 化学平衡在环境保护中发挥着重要作用,如大气 中温室气体的平衡、水体中污染物的平衡等。
02 通过研究污染物在环境中的化学反应和迁移转化 规律,可以预测和控制环境污染,制定有效的治 理措施。
THANKS
感谢观看
化学平衡的计算方法
平衡图解法
通过作图和观察图像,利用平衡 常数和温度的关系,求出平衡常
数和温度的关系。
代数法
通过建立化学平衡的代数方程组 ,求解未知数。
微分法
利用化学反应速率和浓度的关系 ,建立微分方程,求解未知数。
04
化学平衡的应用
工业生产中的应用
化学平衡在工业生产中有着广泛的应用,如化学 01 反应器的设计和优化、催化剂的选择和制备等。
的结构和功能研究等。
05
化学平衡的实验研究
实验目的与原理
实验目的
通过实验探究化学平衡的原理,加深对化学平衡概念的 理解。
实验原理
化学平衡是指在一定条件下,可逆反应的正逆反应速率 相等,反应物和生成物浓度不再发生变化的状态。实验 将通过具体反应来展示化学平衡的形成和特点。
实验步骤与操作
实验步骤 1. 准备实验器材和试剂,包括反应容器、温度计、搅拌器、可逆反应的试剂等。
《化学平衡教学》 ppt课件
目录
• 化学平衡的基本概念 • 化学平衡的原理 • 化学平衡的计算 • 化学平衡的应用 • 化学平衡的实验研究
01
化学平衡的基本概念
平衡的定义
《化学平衡状态》课件

总结词
详细描述
反应速率受温度、浓度、压力和催化剂等 因素影响。
温度越高,反应速率越快;浓度越高,反 应速率越快;压力越大,反应速率越快; 适当使用催化剂可以加快反应速率。
化学反应的方向
总结词
反应方向决定了化学平衡的移 动方向。
详细描述
根据勒夏特列原理,如果改变 影响平衡的条件,平衡就会向 着减弱这种改变的方向移动。
在制药工业中,化学平衡状态对于药物的合成和分离过程至关重要,通过调节平衡 条件可以获得高纯度的药物。
环境保护中的应用
化学平衡状态在环境保护中也有着重 要的应用,例如在大气污染控制中, 通过化学反应原理来降低大气中的污 染物浓度。
在土壤污染修复中,通过调节土壤中 的化学平衡来降低重金属等有害物质 的活性,从而减少对生态环境的危害 。
用率。
促进环境保护
通过研究化学平衡状态,可以减少 有害物质的排放,促进环境保护。
推动科学研究
化学平衡状态是化学反应动力学和 热力学研究的重要内容,有助于深 入了解化学反应的本质和规律。
02
化学平衡状态的建立
化学反应的速率
总结词
详细描述
反应速率是化学平衡状态建立的关键因素 。
化学反应速率决定了反应进行的快慢,对 于可逆反应,正逆反应速率相等是平衡状 态的特征之一。
《化学平衡状态》ppt课件
目录
• 化学平衡状态的定义 • 化学平衡状态的建立 • 化学平衡状态的移动 • 化学平衡状态的应用 • 化学平衡状态的实验验证
01
化学平衡状态的定义
什么是化学平衡状态
01
化学平衡状态是指在一定条件下 ,可逆反应进行到正、逆反应速 率相等且不再改变的状态。
02
物理化学第五章化学平衡

G ξ = A = r Gm T , P
G ξ = ∑ν B B = r Gm B T ,P
B
化学反应的亲和势,用A来表示,A只取决于系统的始、终态,是系统的强 度性质 二、化学平衡的热力学原因 在一定的条件下,自发的化学反应总是向着一定的方向进行,并进行到一 定的限度即达到平衡为止
r m p
J p (气) 只包括气体组分的分压商 平衡时
r Gm = 0
§5-2 等温方程及标准平衡常数
0 r Gm = RTLnJ p (平衡,g )
定义:
0 r Gm K ≡ exp RT 0
PB (g , 平衡) γ B ) 0 P PL 0 P = a PA 0 P
( ξ 增大),则系统的Gibbs函数降低,这就是说,此时反应的倾向是自左 而右进行,即向生成产物的方向进行。 G G 若 > ,表明反应在反应进度 ξ 时,若反应继续正向进行,( ξ 增 0
ξ T , P
大),则系统的Gibbs函数增大,此时反应不能向右进行,只能向左进行, 即向生成反应物的方向进行。 G 若 ξ = 0时,表明反应向右进行和向左进行的趋势相等,此时反应将达
§5-2 等温方程及标准平衡常数
0 Ky
0
PB = P y B
P K = ∏ B 0 BP
γB
K y = ∏ yB
B
P yB = ∏ P0 B
γB
γB
∑B ∑ P P γB = 0 ∏ yB = 0 P P B
γ
γB
Ky
Kn
PB = P
nB ∑ nB
P K = ∏ B 0 B P
§5-1 化学反应的方向和限度 一、化学反应的摩尔Gibbs函变 多组分封闭系统发生微小变化 ,系统的Gibbs函变表示为:
G ξ = ∑ν B B = r Gm B T ,P
B
化学反应的亲和势,用A来表示,A只取决于系统的始、终态,是系统的强 度性质 二、化学平衡的热力学原因 在一定的条件下,自发的化学反应总是向着一定的方向进行,并进行到一 定的限度即达到平衡为止
r m p
J p (气) 只包括气体组分的分压商 平衡时
r Gm = 0
§5-2 等温方程及标准平衡常数
0 r Gm = RTLnJ p (平衡,g )
定义:
0 r Gm K ≡ exp RT 0
PB (g , 平衡) γ B ) 0 P PL 0 P = a PA 0 P
( ξ 增大),则系统的Gibbs函数降低,这就是说,此时反应的倾向是自左 而右进行,即向生成产物的方向进行。 G G 若 > ,表明反应在反应进度 ξ 时,若反应继续正向进行,( ξ 增 0
ξ T , P
大),则系统的Gibbs函数增大,此时反应不能向右进行,只能向左进行, 即向生成反应物的方向进行。 G 若 ξ = 0时,表明反应向右进行和向左进行的趋势相等,此时反应将达
§5-2 等温方程及标准平衡常数
0 Ky
0
PB = P y B
P K = ∏ B 0 BP
γB
K y = ∏ yB
B
P yB = ∏ P0 B
γB
γB
∑B ∑ P P γB = 0 ∏ yB = 0 P P B
γ
γB
Ky
Kn
PB = P
nB ∑ nB
P K = ∏ B 0 B P
§5-1 化学反应的方向和限度 一、化学反应的摩尔Gibbs函变 多组分封闭系统发生微小变化 ,系统的Gibbs函变表示为:
物理化学04-第五章化学平衡

仅是T的函数
( pG / p ) ( pH / p ) 常数 K a b ( p A / p ) ( pB / p )
Kө标准平衡常数
无量纲
令
gG hH a A bB r Gm
g h
( pG / p ) ( pH / p ) 1 ln ( g h a b G H A B) a b ( p A / p ) ( pB / p ) RT
3. 化学反应的平衡常数和等温方程P347
理气化学反应: aA(g)+bB(g)=gG(g)+hH(g) 平衡时
(产物) (反应物)
i i i i
gG+hH=aA+bB 理气混合物中某一组分的化学势:
B B RT ln(PB / P )
g[ G RT ln( pG / p )] h[ H RT ln( pH / p )] a[ A RT ln( p A / p )] b[ B RT ln( pB / p )]
纯物质:GB=μ*B
G nA A nB (*:纯态) * * (1 ) A B
* * * B
A ( A )
* * B *
但是实际上A、B是混合在一起的,因此还要考虑混合 过程对系统吉布斯自由能的影响
mixG RT (nA ln xA nB ln xB )
平衡常数还有其他的表示形式,反应达平衡时,用反 应物和生成物的实际压力、摩尔分数或浓度代入计算, 得到的平衡常数称为经验平衡常数。 一. 气相反应(理想气体) aA+bB=gG+hH
物理化学05章_相平衡5-6

酚-苯酚
CuCl2 KCl
FeCl3 H2 O 的4种水合物
Mn(NO3 )2 H2O 的2种水合物
0.6
0.8
wCd
1 Cd
纯Bi的步冷曲线
T /K 546
a
A
f * 1 2. 冷至A点,固体Bi开始析出 * f 0 * f * 1
1. 加热到a点,Bi全部熔化 Φ 1 f * C 1 Φ 1 温度可以下降
Φ 2 f C 1 Φ 0 温度不能改变,为Bi熔点 Φ 1
453
单相
E点:水在苯胺中 的饱和溶解度 温度升高,互溶程 度增加
T/K
D点:苯胺在水中 的饱和溶解度
TB
B
等压
373
A'
An
A"
T1
两相
C 313 D 0.2 0.4 0.6 0 质量分数 H2 O
1.0 0.8 C6 H5 NH2
E
B点水与苯胺完全互溶
H2 O-C6 H5 NH2的溶解度图
TB 是最高会溶温度
帽形区内两相共存
DB线是苯胺在水 中的溶解度曲线
453
单相
T/K
EB线是水在苯胺中 的溶解度曲线
在
TB
B
等压
373
A'
T1 温度作水平线
两相
An
A"
T1
交点 A' A " 称为 共轭配对点
C 313 D 0.2 0.4 0.6 0 质量分数 H2 O
1.0 0.8 C6 H5 NH2
E
A n 是共轭层组成的平均值
具有会溶温度。
不互溶的双液系——蒸气蒸馏
CuCl2 KCl
FeCl3 H2 O 的4种水合物
Mn(NO3 )2 H2O 的2种水合物
0.6
0.8
wCd
1 Cd
纯Bi的步冷曲线
T /K 546
a
A
f * 1 2. 冷至A点,固体Bi开始析出 * f 0 * f * 1
1. 加热到a点,Bi全部熔化 Φ 1 f * C 1 Φ 1 温度可以下降
Φ 2 f C 1 Φ 0 温度不能改变,为Bi熔点 Φ 1
453
单相
E点:水在苯胺中 的饱和溶解度 温度升高,互溶程 度增加
T/K
D点:苯胺在水中 的饱和溶解度
TB
B
等压
373
A'
An
A"
T1
两相
C 313 D 0.2 0.4 0.6 0 质量分数 H2 O
1.0 0.8 C6 H5 NH2
E
B点水与苯胺完全互溶
H2 O-C6 H5 NH2的溶解度图
TB 是最高会溶温度
帽形区内两相共存
DB线是苯胺在水 中的溶解度曲线
453
单相
T/K
EB线是水在苯胺中 的溶解度曲线
在
TB
B
等压
373
A'
T1 温度作水平线
两相
An
A"
T1
交点 A' A " 称为 共轭配对点
C 313 D 0.2 0.4 0.6 0 质量分数 H2 O
1.0 0.8 C6 H5 NH2
E
A n 是共轭层组成的平均值
具有会溶温度。
不互溶的双液系——蒸气蒸馏
物理化学-第五章化学平衡

ΔG1=0
ΔG2=RTln(bθ/b)
C4H6O4(饱和溶液, b=0.715 mol/kg)
G
f
G
θ m
(aq)
f
G
θ m
(s)
G1
G2
ΔfG
θ m
(aq)
Δf
G
θ m
(s)
RTln(bθ /b)
5.4 各种因素对化学平衡的影响 问题:
1. 对于已经达到平衡的反应,可否改变其平衡位置?
2. 如何选择最适宜的反应条件? 工业合成氨 3H2(g) + N2(g) = 2NH3(g) 工业生产中的工艺条件一般是在520ºC, 30MPa,
B
pBeq
vB
pθ
平衡分压积
标准平衡常数, 简称平衡常数
rGmθ RT ln K θ 标准平衡常数Kθ热
力学定义式
K θ exp( rGmθ )
适用于任何类型的 化学反应
RT
任意化学反应
0 B BB
当化学反应处于平衡时:rGmeq
v
B
eq
B
0
B
化学势通式:
μB μBθ RTlnaB FB
(1) 根据反应的ΔrHmθ 和ΔrSmθ 计算
rGmθ
r
H
θ m
Tr Smθ
其中:
r
H
θ m
vB
f
H
θ m,
B
标准摩尔生成焓
B
Δr Smθ
vB Smθ , B
B
标准摩尔规定熵
由表中298.15K数据如何求T 下的ΔrGmθ?
T
r
H
θ m
物理化学-第五章-化学平衡
( g )
3. 增加反应物的量对平衡移动的影响
aA bB yY zZ 恒温恒容条件下增加反应物量对反应平衡的影响:
在已达到平衡的系统中,加入反应物A,瞬间A的分压增加,其他组分分压不变,结果Jp减小, 温度一定,Kϴ不变,反应右移。 恒温恒压条件下增加反应物量并不总是使平衡右移: 当起始反应物配比1:1时,平衡后加入反应物,会使平衡左移。
Kθ的实验测定和平衡组成的计算
Kθ的计算 1. Kθ可由热力学计算得到,由△rGθm=-RTlnKθ计算 2. Kθ 可由实验测定得到,由平衡时Kθ= ∏(PB/Pθ)vB( 理想气 体)可得
平衡组成的特点
1. 反应条件不变,平衡组成不变 2. 一定温度下,正向与逆向反应平衡组成算出的Kθ应一致 3. 温度不变,改变原料配比所得的Kθ应相同
注意:溶剂A和溶质B的标准态不同。
A
B
B
(r b
B
B B
/ b )B
习题
五氯化磷分解反应 在200℃时的Kθ =0.312,计算: (1)200℃、200kPa下PCl5的离解度; ( 2 )组成 1 ∶ 5 的 PCl5 与 Cl2 的混合物,在 200 ℃ 、 101.325kPa下PCl5的离解度。
上式中△rHθ m=∑vB△fHθ m,B=-∑vB△cHθ m,B,△rSθ m=∑vBSθ m,B (2)通过△fGθ m来计算△rGθ m
△rGθ m=∑vB△fGθ m
(3)由相关线性反应计算,如果一个反应可由其他反应线 性组合得到,那么该反应的△rGm也可由相应反应的△rGm线
性组合得到
如 (3)=(1)+ 2*(2),那么 △rGθ m,3=△rGθ m,1+2△rGθ m,2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
G
T
<0;A>0;ΔγGm<0
.P
;反应正向进行;
G
T .P
=0; A=0;ΔγGm=0 ; 化学平衡
G
T .P
>0;
A<0;ΔγGm>0;反应逆向进行;
2. 化学反应等温方程及平衡常数
对于理想气体反应
aAg+bBg
gGg+hHg
平衡转化率=某反应平衡时反应消耗原料的量/反应 开始投入原料的量×100%
产率=转化为指定产物的某反应物的量/该反应物的 原始量×100%
例1 已知反应
CO(g) H2O(g) H2 (g) CO2 (g)
在800℃时 K O 1
(1)若将等摩尔CO和H2O(g)在800℃反应。求平衡时CO的转化率和摩 尔分数。
ΔγGm=∑νBμB =gμG+hμH-aμA-bμB
gG hH aA bB
RT
ln
PG P
PA P
g
a
PH P
PB P
h
b
BB
RT
ln
PB P
B
令
Jp
PB P
4. 复相反应的平衡常数
对于复相反应 aA(g)+bB(l) hH(g)+gG(s)
∵l. s的化学势与P无关, μB(l或s)=μBθ
经推导, ∴ Kθ=∏(PB/Pθ)gνB 只与气体物质有关
1、Kθ与反应式写法有关。 反应式系数×2,平衡常数平方; 反应式系数÷2,平衡常数开方; 两反应式相加,平衡常数相乘; 两反应式相减,平衡常数相除;
B
rGm BB
范特霍夫等温式( Van’t Hoff isothermal equation)
ΔγGm= ΔγGmθ +RTlnJp
当化学平衡时,ΔγGm= ΔγGmθ +RTln(Jp)平 =0
令
K
Jp
平衡
PB P
标准平衡常数 KPθ =exp( ΔγGmθ - /RT)
Kn f (T , P, nB )
K
P
K P B P
KC
C RT P
B
KY
P P
B
Kn
P n P
B
当∑νB=0 KPθ=KP=KY=KC=Kn 注: a. K与反应式写法有关
b. Kθ与T有关, 也与标准态压力Pθ有关.
K
K P B P
KY
P P
B
KY =KθPθ- νB= KP P-νB
KY=f(T.P)
(4)பைடு நூலகம்n
PB
YB P
nB nB
P
令Kn nBB
KP
PBB
nB nB
B
P B
Kn
P nB
B
KPθ =f(T) 仅仅是温度的函数
ΔγGmθ = - RTln KPθ—— (*)
代入化学等温式中得 ΔγGm =-RTln KPθ +RTlnJp
=RTlnJp/ KPθ
范特霍夫等温式
ΔγGm<0,JP<KPθ ΔγGm=0, JP= KPθ ΔγGm>0,JP> KPθ
反应正向进行; 化学平衡; 反应逆向进行;
第五章 化学平衡 Chemical equilibrum
第一节 化学平衡的条件及平衡常数
1. 化学平衡的条件
在T、P一定的W′=0条件下,对于任意化学平衡,
可下式表示:
aA+bB gG+Hh
0 vBB
B
自发
dG
BdnB
B
vBBd
B
0 平衡
rGm vBB 0 B
PB
nB RT V
CBRT
CB C
C RT
令 ]
KC
CB C
B
代入KP式:
KP
CG gCH h CAaCBb
RT B KC
C RT B
KC f T
(3)KY
PB=YBP KP=Π(YBP)νB=ΠYBνB PνB =KYPνB ∴
自发 平衡
骣çç桫¶¶Gx
÷÷
T
,p
<
0
a
骣çç桫¶¶Gx
÷÷
T
,p
=
0
e
骣çç桫¶¶Gx
÷÷
T
,p
>
0
c
平衡
0
1
图3—1 G与反应进度的关系
热力学推导
ΔγGm=
G
=∑νBμB
T .P
定义
A=-
G
T .P
=-ΔγGm
A为化学反应亲和势
则
逆反应的平衡常数是正反应的平衡常数的倒数; 2、 Kθ与T有关,也与标准压力有关。
以老的pθ=101.325kPa为标准时的Kθ和以新 的pθ=100kPa为标准时的Kθ,两者不同。
5-2 化学平衡有关计算
一、平衡常数的测定及平衡混合物的组成计算 方法:物理法 化学法 条件:T一定时,各nB不随T变化;改变原料配比 ,Kθ不变。
(2)若CO和H2O(g)物质的量比为1:5,求CO的平衡转化率和摩尔分数 。
解:(1)设CO的转化率为α
CO(g) H2O(g) H2 (g) CO2 (g)
KO
Kn
2 (1 ) 2
1
开始 1
1 00
平衡 1-α 1-α α α
(2)
解得 α = 0.5
CO(g) H2O(g) H2 (g) CO2 (g)
解: N2O4(g) 反应前 n
2NO2(g) 0
平衡时 n(1-)
2n
为N2O4的解离度 M N2O4 =92.0gmol-1 n=n(1-2nn(1+
3、理气反应的其它平衡数表示
(1)分压常数 令
KP
PGg PHh PAa PBb
K
K P B p
当ΣνB=0 KPθ=KP 当ΣνB≠0 ΣνB>0 KPθ<KP;
ΣνB<0 KPθ>KP 注:a. KPθ无量纲. KP有量纲, 单位PaΣνB
b. KPθ和KP=f(T)
(2) Kc ∵理气
开始 1
5 00
KO
2
1
(1 )(5 )2
平衡 1-α 5-α α α
解得 α = 0.68
例题2:某可变的容器中放入1.564gN2O4气体, 此化合物在 298K时部分解离. 实验测得, 在标准压力下, 容器的体积为
0.485dm3, 求N2O4的解离度α以及解反应的Kθ和ΔrGmθ.
