倍林达说明书审批稿
倍林达说明书

:药品名称通用名称:替格瑞洛片Tablets) BRILINTA (Ticagrelor 英文名称:商品名称:倍林达: 成份本品活性成份为替格瑞洛适应症:段抬高心肌梗死)患者,包段抬高心肌梗死或ST本品用于急性冠脉综合征(不稳定性心绞痛、非ST)治疗的患者,降低血栓性心血管事件的发生率。
与氯吡格括接受药物治疗和经皮冠状动脉介入(PCI心肌梗死或卒中复合终点的发生率,两治疗组之间的差异来源于心雷相比,本品可以降低心血管死亡、血管死亡和心肌梗死,而在卒中方面无差异。
mg100 在ACS患者中,对本品与阿司匹林联合用药进行了研究。
结果发现,阿司匹林维持剂量大于。
会降低替格瑞洛减少复合终点事件的临床疗效,因此,阿司匹林的维持剂量不能超过每日100 mg:规格90mg用法用量:口服。
本品可在饭前或饭后服用。
mg1片(90 ),每日两次。
(本品起始剂量为单次负荷量180 mg90 mg×2片),此后每次除非有明确禁忌,本品应与阿司匹林联合用药。
在服用首剂负荷阿司匹林后,阿司匹林的维持剂量为每~100mg。
75日1次,每次患者,可以开始使用替格瑞洛。
已经接受过负荷剂量氯吡格雷的ACS(患者的下一应在预定的下次服药时间服用一片90 mg治疗中应尽量避免漏服。
如果患者漏服了一剂,个剂量)。
个月个月,除非有临床指征需要中止本品治疗(见【药理毒理】)。
超过12本品的治疗时间可长达12 的用药经验目前尚有限。
治疗,可能会使基础病引起的心血管死亡急性冠脉综合征患者过早中止任何抗血小板药物(包括本品)或心肌梗死的风险增加,因此,应避免过早中止治疗。
特殊人群儿童患者:岁以下儿童中的安全性和有效性尚未确定。
本品在18 老年患者:无需调整剂量。
肾功能损害患者:肾脏损害患者无需调整剂量(见【药代动力学】)。
尚无本品用于肾透析患者的相关信息。
.肝功能损害患者:重度肝损害患者对本品进行研究,因此,本品禁用于-轻度肝功能损害的患者无需调整剂量。
超说明书用药的处方审核基本要素与方法

超说明书用药的处方审核基本要素与方法吴凯珊1ꎬ伍俊妍1ꎬ郑志华2ꎬ邱凯锋1(1.中山大学孙逸仙纪念医院药学部ꎬ广州㊀510120ꎻ2.广东省药学会ꎬ广州㊀510080)摘㊀要㊀超说明书用药在临床工作中不可避免ꎮ超说明书用药的处方审核既保障了患者的用药安全ꎬ同时也有利于降低医疗机构及医务人员的执业风险ꎬ减少医疗纠纷ꎮ目前国内尚未建立一套系统的超说明书用药评价方法及公认的处方审核方法ꎬ笔者结合过往处方审核文献报道及本单位团队实践经验对超说明书用药处方审核的基本方法和要素进行介绍ꎬ为医院药师开展超说明书用药处方审核提供参考ꎬ从而规范医疗机构超说明书用药行为ꎬ提升合理用药水平ꎮ关键词㊀超说明书用药ꎻ处方审核ꎻ基本要素与方法中图分类号㊀R951ꎻR969.3㊀㊀㊀文献标识码㊀A㊀㊀㊀文章编号㊀1004-0781(2020)09-1215-07DOI㊀10.3870/j.issn.1004 ̄0781.2020.09.008㊀㊀㊀㊀㊀开放科学(资源服务)标识码(OSID)KeyElementsandMethodsonPrescriptionReviewofOff ̄labelUseWUKaishan1ꎬWUJunyan1ꎬZHENGZhihua2ꎬQIUKaifeng1(1.DepartmentofPharmacyꎬSunYat ̄senMemorialHospitalꎬSunYat ̄senUniversityꎬGuangzhou510120ꎬChinaꎻ2GuangdongPharmaceuticalAssociationꎬGuangzhou510080ꎬChina)ABSTRACT㊀Theoff ̄labeluseisinevitableinhospital.Thereviewofoff ̄labelprescriptionensuresthesafetyofpatientsꎬavoidstheriskofmedicalinstitutionsandmedicalstaffsꎬandreducesmedicaldisputes.Currentlyꎬthemethodofevaluatingoff ̄labeluseandreviewingthatprescriptionarelackinginChina.Thisaimofthisarticlewastointroducekeyelementandmethodsofthepreviouslyoff ̄labelreportsandourteam'spracticalexperience.Itwillprovideareferenceforpharmaciststoreviewtheoff ̄labeldrugprescriptionꎬsoastomanagemedicalinstitutions'off ̄labeldrugandimprovethelevelofreasonabledruguse.KEYWORDS㊀Off ̄labeluseꎻPrescriptionreviewꎻKeyelementsandmethod㊀㊀新药上市前的药品临床试验往往存在一定的局限性ꎬ例如缺乏儿童㊁孕妇㊁老人等特殊人群的试验数据ꎮ随着临床医学实践经验的积累ꎬ临床专科治疗指南与诊疗规范不断更新ꎬ说明书内容往往无法满足临床实际需要ꎮ由于说明书的修改审批程序严格ꎬ厂家需要耗费大量财力和时间ꎬ导致药品说明书更新滞后ꎮ临床实践中ꎬ医生为了挽救患者生命ꎬ降低患者疾病痛苦ꎬ提高患者生活质量ꎬ往往在无其他药物可替代使用或治疗效果不如意的情况下ꎬ根据临床经验ꎬ使用药品说明书之外的用法ꎮ因此ꎬ超说明书用药在临床实践工作中实际普遍存在ꎬ不可避免ꎮ目前ꎬ我国对超说明书用药尚无明确的立法规定ꎬ超说明书用药不受法律保护ꎬ一旦发生医疗纠纷ꎬ医疗机构或医疗工作者往往处于被动地位ꎮ因此ꎬ医疗机构必须规范医院内超说明书用药的管理ꎮ作为药学工作者ꎬ则需做好处方审核ꎬ及时干预和拦截不合理的收稿日期㊀2019-12-04㊀修回日期㊀2020-07-13作者简介㊀吴凯珊(1988-)ꎬ女ꎬ广东广州人ꎬ药师ꎬ学士ꎬ研究方向:超说明书用药分析ꎮORCID:0000 ̄0002 ̄1777 ̄2432ꎮ电话:020-81332893ꎬE ̄mail:wukaishan88@163.comꎮ通信作者㊀邱凯锋(1977-)ꎬ男ꎬ广东清远人ꎬ主任药师ꎬ硕士ꎬ专业方向:临床药学ꎮ电话:020-81332451ꎬE ̄mail:feng.qk@163.comꎮ无依据的超说明书用药ꎮ但目前国内并未建立一套系统的超说明书用药评价体系ꎬ缺少业内公认的超说明书用药处方审核规范ꎮ医务工作者在实际工作中容易把不合理用药与有科学依据的超说明书用药混为一谈ꎬ药师经常在超说明书用药是否合理㊁有无必要的问题上与临床医师意见不一致ꎬ有时甚至发生误解ꎬ从而对药师工作开展造成不利ꎮ笔者参考循证药学评价方法㊁借鉴业内处方审核经验以及集合本院在超说明书用药评价工作经验的基础上ꎬ整理㊁总结超说明书用药处方审核的基本方法ꎬ以期达到规范医疗机构超说明书用药行为ꎬ提升临床合理用药水平ꎬ为医院药师开展超说明书用药处方审核提供参考ꎮ1㊀超说明书用药概述㊀1.1㊀定义㊀超说明书用药的概念源于美国国立图书馆 off ̄labeluses 的定义[1]ꎬ又称之为药品未注册用法(unlabeledusesꎬout ̄oflabelusageoroutsideoflabeling)ꎬ是指药品使用的适应证㊁给药方法或剂量不在药品监督管理部门批准的说明书之内的用法ꎮ药品未注册用法的具体含义包括 药品未注册剂量㊁适应人群㊁适应证或给药途径等与药品说明书不同的用法[2]ꎮ1.2㊀使用条件㊀根据广东省药学会发布的«药品未注册用法专家共识»[2]ꎬ在临床工作中ꎬ超说明书用药应满足以下5个条件:①在影响患者生活质量或危及生命的情况下ꎬ无合理的可替代药品ꎻ②用药目的不是试验研究ꎻ③有合理的医学实践证据ꎻ④经医院药事管理与药物治疗学委员会及伦理委员会批准ꎻ⑤保护患者的知情权ꎮ2㊀超说明书用药处方审核㊀处方审核是医疗机构防范用药错误和药物不良事件的有效措施ꎬ是医院药师调剂处方工作流程中的一个重要环节[3]ꎮ2.1㊀超说明书用药与不合理用药㊀处方审核中ꎬ其结果一般可分为合理用药和不合理用药ꎮ超说明书用药处方审核的结果也可分为合理与不合理ꎮ合理的超说明书用药应符合安全㊁有效㊁经济的基本原则ꎬ同时应该有高质量的循证医学证据支持ꎬ如符合专科诊疗规范㊁有权威的指南共识支持或经严谨的临床试验验证ꎮ不合理的超说明书用药则缺乏充分的循证医学证据ꎬ不符合相关诊疗规范ꎮ当前ꎬ临床医疗实践中不合理用药时有发生ꎬ虽然不合理用药常常以超说明书用药为表现形式ꎬ但需认识到超说明书用药并不等同于不合理用药ꎮ需要仔细查阅相关依据ꎬ加以区别ꎮ2.2㊀超说明书用药处方审核基本要素㊀超说明书用药的处方审核ꎬ应基于以下几点要素:一是基于可靠的科学理论与权威的学术资料ꎮ可靠的科学理论ꎬ是指该超说明书用药有合理的药理作用机制支持ꎬ或有针对性地用于相关疾病的并发症ꎮ权威的学术资料ꎬ包括国家医疗行政部门(如国家卫生健康委员会)㊁国家级学术团体(如中华医学会)牵头制定学术专著(如«中华人民共和国药典 临床用药须知»)㊁临床诊疗规范(如临床路径)以及相关专科领域公认的具有权威性的学术组织所牵头制定的指南等(如美国国立综合癌症网络指南)ꎮ二是基于合理的医学实践证据ꎮ即超说明书用药所引用的文献研究ꎬ要考虑其证据级别与推荐强度ꎬ证据级别较低的不应作为超说明书用药依据ꎮ另一方面ꎬ在考虑其有效性等级的基础上ꎬ同时还应确保安全性ꎮ三是在超说明书用药处方审核时ꎬ还需充分权衡该超说明书用药的风险与获益ꎬ尤其重点关注孕妇㊁儿童等特殊人群的用药ꎮ2.3㊀超说明书用药处方审核基本流程与方法㊀超说明书用药的处方审核流程见图1ꎮ步骤1:原研国或欧洲㊁美国㊁日本厂家说明书查阅ꎮ针对处方审核中发现的超说明书用药ꎬ首先查阅该药品国外厂家的说明书有无记载ꎮ通常首选该药原研国说明书ꎬ或者欧洲㊁美国㊁日本等发达地区厂家说明书ꎮ如国外药品说明书已收录ꎬ说明该用法已经过临床研究证实ꎮ需要注意的是ꎬ查询国外说明书时ꎬ同一药品不同厂家的说明书内容也可能存在差异ꎬ如适应证不完全相同ꎮ如果查阅不全ꎬ则可能对结果造成误判ꎮ图1㊀超说明书用药的处方审核流程㊀Fig.1㊀Prescriptionreviewprocessforoff ̄labeluse㊀步骤2:Micromedex数据库查询ꎮMicromedex数据库是由美国ThomsonHealthcare(汤姆生卫生保健信息集团)制作的事实型医药知识数据库[4]ꎮ其内容是由医药学专家针对全世界2000余种医药学期刊文献进行分类㊁收集㊁筛选后ꎬ按照临床应用的需求ꎬ编写为基于实证的综述文献ꎬ直接提供给专业人士使用ꎮ其中内容包括药物的说明书外用法的综合评价ꎮ如数据库收录了该超说明书用药ꎬ则可查阅其有效性等级㊁证据等级㊁推荐强度及相关研究文献[4](表1)ꎮ步骤3:超说明书用药文献查询与筛选ꎮ如Micromedex数据库未收录该超说明书用药ꎬ这时就需自行查阅文献ꎬ并对这些文献进行证据等级评价ꎬ方法参照上述Thomson分级ꎮ与此同时ꎬ在评估该超说明书用药的有效性时ꎬ还需评估其用药安全性ꎮ一般来说ꎬ所引用的文献有效性㊁推荐等级在Ⅱb级㊁证据等级B级或以上ꎮ表1㊀Micromedex循证数据库中的Thomson分级㊀Tab.1㊀ThomsonclassificationintheMicromedexevidence ̄baseddatabase㊀有效性等级推荐等级证据等级Ⅰ治疗有效Ⅱ推荐A随机对照试验的荟萃分析ꎻ多个㊁设计良好㊁大规模的随机临床试验Ⅱa证据支持有效Ⅱa大多数情况下推荐B结论冲突的随机对照试验的荟萃分析ꎻ小规模或研究方法有显著缺陷的随机对㊀照试验ꎻ非随机研究Ⅱb有效性具有争议Ⅱb在某些情况下推荐使用C专家意见或共识ꎻ个案报道或系列案例Ⅲ治疗无效Ⅲ在某些情况下不推荐使用D没有证据㊀㊀步骤4:相关临床指南/专家共识查询ꎮ查阅相关药物或疾病的临床指南有无提及该超说明书用药ꎬ是一线治疗还是二三线治疗方案ꎬ或者是仅限于某种特殊情况下的使用ꎮ其中比较大型及权威的指南官网包括国际指南协作网㊁美国国家指南数据库㊁英国国家临床示范研究所㊁苏格兰校际指南网站等ꎮ也可以在医脉通或用药助手APP上下载相关的指南和专家共识ꎮ3㊀超说明书用药处方审核内容与案例㊀3.1㊀超用法用量用药㊀处方1:患者ꎬ男ꎬ30岁ꎮ诊断:急性肺损伤ꎮ氨溴索注射液495mgꎬ0.9%氯化钠注射液100mLꎬivdꎬbidꎮ审核见图2ꎮ3.2㊀超适应证用药㊀处方2:患者ꎬ女ꎬ28岁ꎮ诊断:多囊卵巢综合征(polycysticovarysyndromeꎬPCOS)ꎮ二甲双胍片0.5gꎬtidꎬpoꎻ炔雌醇环丙孕酮片1片ꎬqdꎬpoꎮ审核见图3ꎮ图2㊀超说明书用药的处方1审核㊀Fig.2㊀ReviewofprescriptionNo.1withoff ̄labeluse㊀图3㊀超说明书用药的处方2审核㊀Fig.3㊀ReviewofprescriptionNo.2withoff ̄labeluse㊀3.3㊀超用药途径用药㊀处方3:患者ꎬ男ꎬ25岁ꎮ诊断:难辨梭状芽胞杆菌相关性腹泻ꎮ万古霉素注射粉针125mgꎬq6hꎬ口服(需用饮用水30mL稀释)ꎮ审核见图4ꎮ3.4㊀超适应人群用药㊀处方4:患儿ꎬ男ꎬ7岁ꎬ体质量30kgꎮ诊断:高血压ꎮ缬沙坦胶囊40mgꎬqdꎬpoꎮ审核见图5ꎮ4㊀结束语㊀超说明书用药在临床普遍存在ꎬ只有通过超说明书的用药审核才能规范医疗机构超说明书用药行为ꎬ提升合理用药水平ꎮ图4㊀超说明书用药的处方3审核㊀Fig.4㊀ReviewofprescriptionNo.3withoff ̄labeluse㊀图5㊀超说明书用药的处方4审核㊀Fig.5㊀ReviewofprescriptionNo.4withoff ̄labeluse㊀参考文献[1]㊀NCBI.Mesh:off ̄labeluse[EB/OL].(2010-11-08)[2018-11-02].http//.ncbi.nlm.nih.gov/mesh/?term=off+label+drug+use.[2]㊀广东省药学会.药品未注册用法专家共识[J].今日药学ꎬ2010ꎬ20(4):1-3.[3]㊀赵德斌.关于医疗机构成立处方审核室的意义及可行性探讨[J].中国卫生产业ꎬ2018ꎬ8(34):90-92. [4]㊀医学导航.MICROMEDEX数据库简介及试用[EB/OL].[2020-07-13].http://www.meddir.cn/htm/1205378735767.htm.2007-2010.[5]㊀LEGRORSꎬARSLANIANSAꎬEHRMANNDAꎬetal.Diagnosisandtreatmentofpolycysticovarysyndrome:anendocrinesocietyclinicalpracticeguideline[J].JClinEndocrinolMetabꎬ2013ꎬ98(12):4565-4592. [6]㊀中华医学会妇产科学分会内分泌学组.临床指南多囊卵巢综合征的诊断和治疗专家共识[J].中华妇产科杂志ꎬ2008ꎬ43(7):553-555.[7]㊀FAUSERBCꎬTARLATZISBCꎬREBARRWꎬetal.Consensusonwomen'shealthaspectsofpolycysticovarysyndrome(PCOS):theAmsterdamESHRE/ASRM ̄Sponsored3rdPCOSConsensusWorkshopGroup[J].FertilSterilꎬ2012ꎬ97(1):28-38.[8]㊀TANXꎬLISꎬCHANGYꎬetal.EffectofmetformintreatmentduringpregnancyonwomenwithPCOS:asystematicreviewandmeta ̄analysis[J].ClinInvestMedꎬ2016ꎬ39(4):120-131.[9]㊀HUANGXꎬWANGPꎬTALRꎬetal.Asystematicreviewandmeta ̄analysisofmetforminamongpatientswithpolycysticovarysyndromeundergoingassistedreproductivetechnologyprocedures[J].IntJGynaecolObstetꎬ2015ꎬ131(2):111-116.[10]㊀PALOMBASꎬFALBOAꎬLASALAGB.Metforminandgonadotropinsforovulationinductioninpatientswithpolycysticovarysyndrome:asystematicreviewwithmeta ̄analysisofrandomizedcontrolledtrials[J].ReprodBiolEndocrinolꎬ2014ꎬ12(1):3.[11]㊀中国医师协会胸外科医师分会.胸外科围手术期肺部并发症防治专家共识[J].中华胸心血管外科杂志ꎬ2009ꎬ25(4):217-218.[12]㊀潘珍ꎬ黎嘉文.大剂量盐酸氨溴索对肺部有较好的保护作用[J].中国药房ꎬ2014ꎬ25(32):3041-3045. [13]㊀WUXDꎬLISWꎬZHANGJZꎬetal.Meta ̄analysisofhighdoseofambroxoltreatmentforacutelunginjury/acuterespiratorydistresssyndromebasedonrandomizedcontrolledtrials[J].JClinicPharmꎬ2014ꎬ54(11):1199-1206.[14]㊀MCDONALDLCꎬGERDINGDNꎬJOHNSONSꎬetal:Clinicalpracticeguidelinesforclostridiumdifficileinfectioninadultsandchildren:2017updatebytheInfectiousDiseasesSocietyofAmerica(IDSA)andSocietyforHealthcareEpidemiologyofAmerica(SHEA)[J].ClinInfectDisꎬ2018ꎬ66(7):e1-e48.[15]㊀COHENSHꎬGERDINGDNꎬJOHNSONSꎬetal.ClinicalpracticeguidelinesforC10stridiumdifficileinfectioninadults:2010updatebytheSocietyforHealthcareEpidemiologyofAmerica(SHEA)andtheInfectiousDiseaaesSocietyofAmerica(IDSA)[J].InfectionControlꎬ2010ꎬ31(5):431-455.[16]㊀万古霉素临床应用剂量专家组.万古霉素临床应用剂量中国专家共识(2012年11月)[J].中华传染病杂志ꎬ2012ꎬ30(11):641-646.[17]㊀ProductInformation.FIRVANQ(TM)powderfororalsolu ̄tionꎬvancomycinHClpowderfororalsolution[Z].CutisPharma(perFDA)ꎬWilmingtonꎬMAꎬ2018.[18]㊀ZARFAꎬBAKKANAGARISRꎬMOORTHIKMꎬetal.Acomparisonofvancomycinandmetronidazoleforthetreatmentofclostridiumdifficile ̄associateddiarrheaꎬstratifiedbydiseaseseverity[J].ClinInfectDisꎬ2007ꎬ45(3):302-307.[19]㊀ERWINKꎬKASTRUPꎬPHARMBSꎬetal.DrugFactsandComparisons[M].66thEdition.UnitedStatesofAmerica:WoltersKluwerHealthꎬ2011:837-838.[20]㊀WELLSTLꎬBLUMERJꎬMEYERSKEꎬetal.Effectivenessandsafetyofvalsartaninchildrenaged6to16yearswithhypertension[J].JClinHypertens(Greenwich)ꎬ2011ꎬ13(5):357-365.妊娠期用药处方审核实践∗陈杰1ꎬ弓晓皎1ꎬ陈攀1ꎬ陈孝1ꎬ许静2(1.中山大学附属第一医院药学部ꎬ广州㊀510080ꎻ2.南方医科大学皮肤病医院药剂科ꎬ广州㊀510091)摘㊀要㊀妊娠期用药处方审核需兼顾母体和胎儿ꎬ有其自身特殊性ꎬ处方审核首要的职责是保证孕妇及胎儿用药安全ꎮ因此针对妊娠患者的处方审核ꎬ应重点关注包括孕体发育不同阶段ꎬ是否符合妊娠期妇女用药原则ꎬ药物的禁忌证ꎬ选用药物的特性及安全性ꎬ剂量及用法ꎬ指南推荐用药的合理性及超说明书用药等ꎮ该文通过阐述妊娠期用药处方审核流程并对审核要点举例说明ꎬ旨为妊娠患者的处方审核提供思路和方法ꎬ进一步提高药师处方审核能力ꎮ关键词㊀妊娠ꎻ处方审核ꎻ超说明书中图分类号㊀R951ꎻR969.3㊀㊀㊀文献标识码㊀A㊀㊀㊀文章编号㊀1004-0781(2020)09-1221-05DOI㊀10.3870/j.issn.1004 ̄0781.2020.09.009㊀㊀㊀㊀㊀开放科学(资源服务)标识码(OSID)AuditPracticeofPregnancyMedicinePrescriptionCHENJie1ꎬGONGXiaojiao1ꎬCHENPan1ꎬCHENXiao1ꎬXUJing2(1.DepartmentofPharmacyꎬtheFirstAffiliatedHospitalofSunYat ̄senUniversityꎬGuangzhou510080ꎬChinaꎻ2.DepartmentofPharmacyꎬDermatologyHospitalofSouthernMedicalUniversityꎬGuangzhou510091ꎬChina)ABSTRACT㊀Auditofpregnancymedicationprescriptionneedtoconsidermaternalandfetalꎬwhichhasitsownparticularity.Auditofpregnancymedicationprescriptionaimstoensurethesafetyofpregnantwomenandfetalmedicine.Thereforeꎬtheprescriptionofpregnancypatientswasauditedbypharmacistꎬthesafetyofthedrugshouldbefocused.Theprincipleofwomenduringpregnancydrugswasperformedꎬthecontraindicationsofthedrugwasstrictlycarriedoutꎬguidelinesrecommendtherationalityofdruguseandoff ̄labelusemanagementwasexecuted.InthisarticleꎬtheaimedtotheprescriptionofpregnancypatientsauditideasandmethodsꎬTheprogramandkeypointsofpregnancydrugsprescriptionwasauditedꎬtheabilityofpharmacistprescriptionauditshouldbefurtherimproved.KEYWORDS㊀PregnancyꎻPrescriptionsauditꎻOff ̄labeluse。
药物临床试验登记填写指南(V2

药物临床试验登记填写指南(V2.0版)国家药品监督管理局药品审评中心2020年7月目录1一、简要说明 (4)2二、登记表填写指南 (6)3(一)题目和背景信息 (7)41.登记号(不可更新项、公示项) (7)52.相关登记号(可更新项、公示项) (7)63.药物名称*(不可更新项、选择公示项) (7)74.曾用名(可更新项、选择公示项) (7)85.药物类型*(不可更新项、公示项) (8)96.受理号/备案号*(不可更新项、选择公示项) (8)107.批件号(备案号)/批准日期(默示许可日期/备案日期)*(不可更11新项、不公示项) (8)128.适应症*(不可更新项、公示项) (8)139.试验专业题目*(不可更新项、公示项) (9)1410.试验通俗题目*(可更新项、公示项) (9)1511.试验方案编号*(不可更新项、公示项) (9)1612.试验方案编号重复原因(可更新项、不公示项) (9)1713.方案最新版本号*(可更新项、公示项) (9)1814.版本日期*(可更新项、公示项) (10)1915.是否联合用药*(不可更新项、公示项) (10)2016.联合用药受理号和联合用药批准证明*(不可更新项、不公示项)21 (10)22(二)申请人信息 (10)231.申请人名称(不可更新项、公示项) (10)242.联系人姓名*(可更新项、公示项) (10)253.联系人座机*(可更新项、公示项) (11)264.联系人手机号(可更新项、公示项) (11)275.联系人Email*(可更新项、公示项) (11)286.联系人邮政地址*(可更新项、公示项) (11)297.联系人邮编*(可更新项、公示项) (11)308.经费来源*(可更新项、不公示项) (11)31(三)临床试验信息 (12)321.试验目的*(不可更新项、公示项) (12)332.试验设计* (12)343.受试者信息 (15)354.试验分组 (15)365.终点指标 (17)376.数据安全监查委员会(DMC)*(可更新项、公示项) (18)387.为受试者购买试验伤害保险*(可更新项、公示项) (18)39(四)研究者信息 (19)401.主要研究者信息(可更新项、公示项) (19)412.各参加机构信息(可更新项、公示项) (20)42(五)伦理委员会信息*(不可更新项、公示项) (20)43(六)试验状态信息 (21)441.试验状态*(可更新项、公示项) (21)452.试验人数 (23)463.受试者招募及试验完成日期(不可更新项、公示项) (24)47(七)临床试验方案*(不可更新项、不公示项) (24)48(八)临床试验结果摘要(不可更新项、公示项) (25)49(九)其他附件(不可更新项、不公示项) (25)50(十)登记人及其联系方式 (25)515253一、简要说明54本指南是根据国家药品监督管理局《药品注册管理办法》(国家市场监督55管理总局令第27号)关于药物临床试验登记与信息公示的要求和药品审评中心56(以下简称“药审中心”)《药物临床试验登记与信息公示管理规范(试行)》57(以下简称“登记规范”)的要求以及对“药物临床试验登记与信息公示平台”(以58下简称“登记平台”)的总体目标要求,结合网络实现的具体设计而起草。
超药品说明书用药目录(详细)
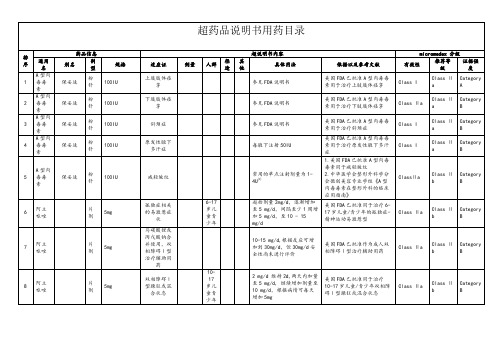
泊沙康唑
混悬液
400mg
毛霉菌
200mg,每日4次
1.美国FDA未批准泊沙康唑用于毛霉菌
2.中华医学会结核和呼吸学会《抗菌药物超说明书用法专家共识》
Class Ⅱa
Class Ⅱb
Category B
32
布洛芬
胶囊
300mg
骨关节炎
1200-3200mg/日,分3-4次服用
,一般使用不超过10天
美国FDA已批准用于治疗13-17岁儿童/青少年的精神分裂症
Class ⅡaClass Ⅱb来自Category B12
阿司匹林
拜阿司匹灵
肠溶片
100mg
预防子痫前期
对存在子痫前期复发风险和子痫前期高危因素者,在妊娠早中期(妊娠12~16周)开始服用小剂量阿司匹林(50-100mg),可维持到孕28周。
埃索美拉唑钠
耐信
注射液
40mg
急性上消化道出血
首剂量80mg iv,续以8mg/h iv 维持3~6天
1.美国FDA未批准用于急性上消化道出血
2.中华医学会内科学会《急性非静脉曲张性上消化道出血诊治指南(2009)》
Class I
Class Ⅱb
Category B
14
艾司西酞普兰
来士普
片剂
10mg
Class Ⅱa
Class Ⅱb
Category B
21
奥沙利铂
草酸铂
粉针
50mg
结肠癌,辅助性II期,与5-氟尿嘧啶/亚叶酸组合
85mg/m2
1.FDA说明书-超适应症用法
2.结直肠癌NCCN指南2016 version2
Class Ⅱa
超药品说明书用药目录(2020年版):心血管相关药物

超药品说明书用药目录(2020年版):心血管相关药物目录超药品说明书用药目录(2020年版):心血管相关药物 (1)1.阿司匹林(肠溶片) (2)2.贝米肝素钠(注射液) (2)3.厄贝沙坦 (2)4.伐地那非 (3)5.福辛普利 (3)6.卡托普利 (3)7.坎地沙坦酯 (3)8.螺内酯 (4)9.氯沙坦钾 (4)10.他达拉非 (4)11.西地那非 (4)12.硝苯地平(控释片/缓释片) (5)13.硝苯地平(片剂) (5)14.缬沙坦 (5)15.伊伐布雷定 (6)16.普萘洛尔 (6)超说明书用药需满足5项条件 (6)“超药品说明书用药”指的是超出药品说明书内容的用药方案,包括药品使用的适应证、适用人群、给药方法或剂量不在国内药品监督管理部门批准的说明书之内的用法。
临床上,这种情况并不少见。
规范的超说明书用药有着积极的临床价值,通过发挥药品前沿的治疗作用,给予患者治疗上的获益。
2020年7月,广东省药学会官网发布了最新版《超药品说明书用药目录(2020年版)》,共收录了230项药品超说明书用药信息,其中心血管相关药物整理如下。
1.阿司匹林(肠溶片)●适应证:预防子痫前期。
●具体用法:对存在子痫前期复发风险和子痫前期高危因素者,在妊娠早中期(妊娠12~16周)开始服用小剂量阿司匹林(50-100mg),可维持到孕28周。
●Micromedex分级:有效性Class I,推荐等级Class Ⅱa,证据强度Category A。
2.贝米肝素钠(注射液)●适应证:预防静脉血栓栓塞风险的发生。
●具体用法:2500-3500IU。
●Micromedex分级:未收录。
3.厄贝沙坦●适应证:糖尿病肾病。
●具体用法:每日150 mg,可增加至300mg qd。
●Micromedex分级:有效性Class I,推荐等级Class Ⅱa,证据强度Category A。
4.伐地那非●适应证:肺动脉高压。
●具体用法:5mg qd,2-4周后改为5mg bid。
ICH-GCP E6(R2)中文版

E6(R2)人用药品注册技术要求国际协调会ICH协调指导原则ICH指导委员会2016年11月9日当前版本:第四阶段中文编译:中国GCP联盟 & 临床研究大汇E6(R1)译者序公元1996年,ICH-GCP正式发布R1版,彼时之中国,了解GCP的人仅限于当时中国卫生部培养的数百名医学专家,规范的临床试验法规与体系还在起草中。
1998年3月卫生部而发布了中国第一部GCP(试行),同年5月实施;1998年国务院机构改革成立了国家药品监督管理局,1999年9月1日实施的《药品临床试验管理规范》(局令13号,已废止),在整整4年之后的2003年9月1日,我国的GCP,《药物临床试验质量管理规范》(局令第3号)颁布实施并持续至今。
受制于起步阶段的能力所限,我们的GCP法规只有70条款共计12998字,而对比ICH-GCP则有383条款共计27936单词。
R1版的ICH-GCP,2003年国家药监局中国药品生物制品检定所获权组织专家翻译,才有过中文版(未曾公开发布),陆续有过多个版本的企业/组织发布版本,而以国家药品审评中心(CDE)发布的官译稿件,时间却很明确,是在2016年8月5日才得以发布(如下图)。
可以说,无论是标准的水平高低还是时代的步伐快慢,我们都曾落后了太多太多。
人生如梦,岁月如歌,春去秋来,夏行冬至。
二十载岁月匆匆而过。
2016年11月30日,ICH正式颁布了GCP的增补件R2,标志着全球药物临床试验进入到了一个崭新的时代,无独有偶,仅仅过去了2天,2016年12月2日,中国国家食品药品监督管理总局发布了《药物临床试验质量管理规范》的第二次征求意见稿,大量新内容参考了ICH-GCP R1甚至R2,意见稿直接以超30000字的信息量向全中国全世界展现它的雄心:今天的和未来的中国药物临床试验,在经历了蹒跚学步与青春期的躁动之后,正大幅度的向着国际先进水平看齐。
天行健,君子当自强不息,“中关村玖泰药物临床试验技术创新联盟/中国药物临床试验机构联盟”携手“临床研究大汇”,有志于协助我国临床研究行业在这次革新中及时跟上时代潮流,我们在R2发布后的7日内,参考借鉴CDE的R1中文版,完成了中文版的翻译与校对工作,在此时正式向全球华语用户推送,由于时间紧,我们的工作可能有不足之处,在此虚心并诚恳的接受所有批评意见。
国内外生物制品、审评指导原则及法律法规清单-2017-025

26
药物相互作用研究--研究设计、数据分析、和对剂量及标签的影响
2012年2月
27
流感:研发治疗和/或预防药物
2011年4月
28
上市后研究和临床试验一联邦食品、药品和化妆品法案第505(0(3)
部分的实施
2011年3月
29
流感药物临床研究指导原则
2009年2月
30
动物模型-动物效应下考察药效的基本要素(第三批)
、生物制品、审评一般指导原则清单
序号
名称
颁布日期
生物制品指导原则
1
生物制品稳定性研究技术指导原则(试行)
2015-04-15
2
生物类似药研发与评价技术指导原则(试行)
2015-02-28
3
疫苗生产场地变更质量可比性研究技术指导原则
2014-01-08
4
预防用疫苗临床前研究技术指导原则
2010-04-22
2008-09-04
15
结合疫苗质量控制和临床研究技术指导原则
2008-09-04
16
化学药物和生物制品临床试验的生物统计学技术指导原则
2008-09-04
17
多肽疫苗生产及质控技术指导原则
2008-09-04
18
疫苗临床试验技术指导原则
2008-09-04
19
化学药品、生物制品说明书指导原则(第二稿)
2006年2月
42
临床试验中人种和种族数据收集的技术指导原则
2005年9月
43
人体首剂最大安全起始剂量的估算
2005年7月
44
药品审评质量管理规范
2005年4月
45
药品注册管理办法及六个附件:中药、天然药物注册分类及申报资料要求,化学药品注册分类及申报资料要求等

4
第二十条 按照《药品管理法实施条例》第三十五条的规定,对获得生产或者销 售含有新型化学成份药品许可的生产者或者销售者提交的自行取得且未披露的试验数 据和其他数据,国家食品药品监督管理局自批准该许可之日起 6 年内,对未经已获得 许可的申请人同意,使用其未披露数据的申请不予批准;但是申请人提交自行取得数 据的除外。
第十八条 申请人应当对其申请注册的药物或者使用的处方、工艺、用途等,提 供申请人或者他人在中国的专利及其权属状态的说明;他人在中国存在专利的,申请 人应当提交对他人的专利不构成侵权的声明。对申请人提交的说明或者声明,药品监 督管理部门应当在行政机关网站予以公示。
药品注册过程中发生专利权纠纷的,按照有关专利的法律法规解决。
第一章 总 则 .............................................................................................................2 第二章 基本要求 .........................................................................................................3 第三章 药物的临床试验 .............................................................................................6 第四章 新药申请的申报与审批 .................................................................................9 第五章 仿制药的申报与审批 ...................................................................................14 第六章 进口药品的申报与审批 ...............................................................................15 第七章 非处方药的申报 ...........................................................................................19 第八章 补充申请的申报与审批 ...............................................................................20 第九章 药品再注册 ...................................................................................................21 第十章 药品注册检验 ...............................................................................................23 第十一章 药品注册标准和说明书 ...........................................................................24 第十二章 时 限 .......................................................................................................25 第十三章 复 审 .......................................................................................................27 第十四章 法律责任 ...................................................................................................28 第十五章 附 则 .......................................................................................................30 附件1:中药、天然药物注册分类及申报资料要求 .................................................32 附件2:化学药品注册分类及申报资料要求 .............................................................42 附件3:生物制品注册分类及申报资料要求 .............................................................57 附件4:药品补充申请注册事项及申报资料要求 .....................................................76 附件5:药品再注册申报资料项目 .............................................................................85 附件6:新药监测期 期限表 .......................................................................................87
M4 模块一 行政文件和药品信息

附件M4 模块一行政文件和药品信息1.0说明函(详见附:说明函)主要对于本次申请关键信息的概括与说明。
1.1目录按照不同模块分别提交申报资料目录。
1.2申请表主要包括产品名称、剂型、规格及申请事项等产品基本信息。
1.3产品信息相关材料1.3.1说明书1.3.1.1 研究药物说明书及修订说明(适用于临床试验申请)1.3.1.2 上市药品说明书及修订说明(适用于上市及上市后变更申请)境外已上市药品尚需提供该药品生产国家或者地区药品管理机构核准的原文说明书,在生产国家或者地区上市使用的说明书实样,并附中文译本。
1.3.2包装标签1.3.2.1研究药物包装标签(适用于临床试验申请)1.3.2.2 上市药品包装标签(适用于上市及上市后变更申请)境外已上市药品尚需提供该药品生产国家或者地区上市使用的包装标签实样。
—1—1.3.3产品质量标准和生产工艺/制造及检定规程化学药品提交生产工艺信息表和质量标准,生物制品提交制造及检定规程和质量标准。
1.3.4临床试验相关资料1.3.4.1临床试验计划和方案1.3.4.2知情同意书样稿1.3.4.3研究者手册1.3.5药品通用名称核定申请材料(适用于上市注册申请)1.3.6检查相关信息(适用于上市申请和涉及检查检验的补充申请)包括药品研制情况信息表,药品生产情况信息表,现场主文件清单,药品注册临床试验研究信息表,临床试验信息表以及检验报告。
1.3.7疫苗生物安全及环境影响评价(详见附:疫苗生物安全及环境影响评价)1.3.8产品相关证明性文件1.3.8.1原料药、药用辅料及药包材证明文件(如适用)原料药、药用辅料及药包材合法来源证明文件,包括供货协议、发票等。
以及原料药、药用辅料及药包材的使用授权书(适用于制剂选用已登记原辅包情形)。
1.3.8.2专利信息及证明文件申请的药物或者使用的处方、工艺、用途等专利情况及其权属状态说明,以及对他人的专利不构成侵权的声明。
—2—1.3.8.3特殊药品研制立项批准文件(如适用)麻醉药品和精神药品需提供研制立项批复文件复印件。
2020年药审中心审评通过的境外生产原研药

67
乙磺酸尼达尼布软胶囊#
系统性硬化病相关间质性肺疾病;具有进行性表型的其他慢性纤维化性间质性肺疾病
68
红斑狼疮5岁及以上患者
69
阿达木单抗注射液#
4岁及以上儿童与青少年重度慢性斑块状银屑病;非感染性葡萄膜炎
70
恩曲他滨替诺福韦片#
HIV-1暴露前预防
法布雷病
5
阿替利珠单抗注射液
联合含铂化疗用于初治广泛期小细胞肺癌
6
艾地骨化醇软胶囊
绝经后女性骨质疏松症
7
艾度硫酸酯酶β注射液
黏多糖贮积症Ⅱ型
8
艾托格列净片
配合饮食和运动改善成人2型糖尿病患者的血糖控制。
9
达依泊汀α注射液
需血液透析的慢性肾病患者的贫血
10
地舒单抗注射液
骨折风险增高的绝经后妇女的骨质疏松症
71
乌司奴单抗注射液/
乌司奴单抗注射液(静脉输注)#
成人中重度活动性克罗恩病患者
72
左乙拉西坦注射用浓溶液#
4岁以上儿童及成人癫痫患者部分性发作
73
富马酸卢帕他定片*
过敏性鼻炎和荨麻疹
74
盐酸二甲双胍片*
2型糖尿病
注:1.“#”为新增适应症品种。
2.“*”是国内已有仿制品种上市的境外生产原研药,不纳入2020年统计范围内。
11
甘精胰岛素注射液
需胰岛素治疗的成人2型糖尿病
12
格隆溴铵福莫特罗吸入气雾剂
慢性阻塞性肺疾病
13
氯化镭[223Ra]注射液
伴骨转移且无已知内脏转移的去势抵抗性前列腺癌
14
马来酸奈拉替尼片
HER2阳性早期乳腺癌的强化辅助治疗。
一致性评价品种说明书撰写与审核

一致性评价品种说明书撰写与审核
• 仿制药说明书现状
– 旧,残,乱 – 长时间没有进行更新
• 资料准备情况
– 纸质资料无说明书内容 – 电子资料:有老版本/有重新拟定版本,差异大 – 审核工作量大
• 持证人和审评机构共同完成
– 资料准备:新拟版,参比制剂说明书 – 沟通交流
9
一致性评价品种说明书撰写与审核
14
一致性评价品种说明书撰写与审核
• 特殊人群信息
– 【孕妇及哺乳期妇女用药】 – 【儿童用药】 – 【老年用药】
15
一致性评价品种说明书撰写与审核 • 临床药理学及临床研究信息
– 【药物相互作用】 – 【临床试验】 – 【人体药代动力学】
16
一致性评价品种说明书撰写与审核
【药理毒理】——中国模板
XXX DDDD PPPP
XXXX说明书
请仔细阅读说明书并在医师指导下使用
警告:本品XXXXXXXXXXXXXXX!
【药品名称】
通用名称:
汉语拼音:
【成份】
【性状】
11
一致性评价品种说明书撰写与审核
• 适应症
– 参照参比制剂说明书(境内) – 几种特殊情况
• 仿制药适应症窄于参比制剂/原研 • 仿制药适应症宽于参比制剂/原研 • 境内独有品种 • 需要同时考虑数据保护问题
• 医学 • 临床概述作者 • 临床药理 • 药学(CMC) • 非临床 • 统计
监管机构
• 药学 • 药理毒理 • 临床药理
• 统计 • 临床 • 综合管理
说明书团队
产品特性概要
说明书团队
* 1.
开始讨论并决 定说明书策略
创建 CDS/USPI/S
倍林达(替格瑞洛片)说明书

倍林达(替格瑞洛片)说明书【倍林达药品名称】商品名:倍林达通用名:替格瑞洛片英文名:TicagrelorTablets汉语拼音:TiGeRuiLuoPian剂型:片剂【倍林达成份】替格瑞洛Ticagrelor【倍林达性状】倍林达活性成份为替格瑞洛,其化学名称为:(1S,2S,3R,5S)-3-[7-{[(1R,2S)-2-(3,4-二氟苯)环丙基]氨基}-5-(丙基硫氧嘧啶)-3H-[1,2,3]-三唑磷[4,5-d]嘧啶-3-基]-5-(2-羟乙基)环戊烷-1,2-二醇。
分子式:C23H28F2N6O4S,分子量:522.57。
性状:倍林达为黄色薄膜衣片,除去包衣后显白色或类白色。
【倍林达适应症】倍林达用于急性冠脉综合征(不稳定性心绞痛、非ST段抬高心肌梗死或ST段抬高心肌梗死)患者,包括接受药物治疗和经皮冠状动脉介入(PCI)治疗的患者,降低血栓性心血管事件的发生率。
与氯吡格雷相比,倍林达可以降低心血管死亡、心肌梗死或卒中复合终点的发生率,两治疗组之间的差异来源于心血管死亡和心肌梗死,而在卒中方面无差异。
在ACS患者中,对倍林达与阿司匹林联合用药进行了研究。
结果发现,阿司匹林维持剂量大于100mg会降低替格瑞洛减少复合终点事件的临床疗效,因此,阿司匹林的维持剂量不能超过每日100mg。
【倍林达用法用量】口服。
倍林达可在饭前或饭后服用。
倍林达起始剂量为单次负荷量180mg(90mg×2片),此后每次1片(90mg),每日2次。
除非有明确禁忌,倍林达应与阿司匹林联合用药。
在服用首剂负荷阿司匹林后,阿司匹林的维持剂量为每日1次,每次75-100mg。
已经接受过负荷剂量氯吡格雷的ACS患者,可以开始使用替格瑞洛。
治疗中应尽量避免漏服。
如果患者漏服了一剂,应在预定的下次服药时间服用1片90mg(患者的下一个剂量)。
倍林达的治疗时间可长达12个月,除非有临床指征需要中止倍林达治疗(见药理毒理)。
新药Ⅱ期和Ⅲ期临床试验药学申报资料的内容及格式要求

新药Ⅱ期和Ⅲ期临床试验药学申报资料的内容及格式要求2003年5月 美国FDA发布2009年6月 药审中心组织翻译辉瑞制药有限公司翻译北核协会审核药审中心最终核准目录Ⅰ. 前言 (1)Ⅱ. 背景 (2)A. 现行法规要求 (2)B.一般原则 (2)Ⅲ. Ⅱ期临床研究 (5)A. 原料药 (6)B. 制剂 (9)Ⅳ. Ⅲ期临床研究 (11)A. 原料药 (12)B. 制剂 (15)Ⅴ. 安慰剂 (19)Ⅵ. 标签 (19)Ⅶ. 环境评估 (19)新药Ⅱ期和Ⅲ期临床试验药学申报资料的内容及格式要求Ⅰ. 前言本指导原则为进行新药临床研究申请(INDs)的申办者,提供新药临床研究申请Ⅱ、Ⅲ期临床研究2申报的药学(CMC)资料方面的建议。
本指导原则适用于人用药(定义见联邦食品、药品和化妆品法案),不适用于植物药3、天然物质衍生获得的药物或使用生物技术产生的蛋白质类药物或其它生物制品。
本指导原则的目的是:(1)确保充足的数据提交给监管机构,从CMC角度评价拟进行的临床研究的安全性和质量;(2)通过阐明Ⅱ、Ⅲ期临床CMC资料的类型、范围和报告,加快新药上市;(3)推动协调药物研发。
提交给监管机构的CMC资料的数量和深度很大程度上取决于临床研究的阶段、拟定的人体试验及资料是否与安全性有关。
本指导原则确定申报资料的补充修订(即CMC安全性信息)和年度报告(即确证资料)中提交的CMC资料。
本指导原则旨在为数据的收集和报告提供更大的灵活性和避免多余的提交,简化对申办者的监管。
简化监管的四个方面如下:z按照惯例提交的某些修正资料会被认定为确证资料(见Ⅱ.B.2部分),其可在年度报告中提交。
zⅢ部分中推荐限定的Ⅱ期相关资料,可在Ⅱ期药物研发中生成,在Ⅱ期试验启动前无需提交。
zⅣ部分中推荐的Ⅲ期相关资料,可在Ⅲ期药物研发中生成,在Ⅲ期试验启动前无需提交。
z年度报告应包含受试者报告期提交的确证资料和CMC安全性资料综述,因此,在Ⅰ期或Ⅱ期结束时无需常规的CMC更新资料。
单臂试验支持上市的抗肿瘤药上市许可申请前临床方面沟通交流技术指导原则

202012目录一、背景 (3)二、资料准备 (4)三、沟通交流会议讨论的核心问题 (5)1.试验人群 (5)2.有效性 (6)3.安全性 (6)4.动态提交/补充资料 (7)5.确证性试验 (8)6.其他 (8)四、会后要求 (9)一、背景恶性肿瘤严重危及生命,尤其是缺乏标准治疗,或难治/复发的晚期恶性肿瘤患者,急需有效的治疗药物。
单臂试验(single arm trial, SA T)适用于难治疾病背景下,具备突出疗效的药物,目前主要适用于单药治疗;在进入关键试验前,与监管机构进行过沟通交流,并就试验中关键指标和要求达成共识的基础上,申请人可采用单臂试验结果支持上市。
根据《药品注册管理办法》(国家市场监督管理总局令第27号)第十六条,申请人在药品上市许可申请前,可以就重大问题与药品审评中心进行沟通交流。
为鼓励创新,帮助申请人提高与药审中心的沟通交流效率,既加快审评审批速度,又保证药品审评的科学性和严谨性,特制定本指导原则,以期为以单臂试验支持上市的抗肿瘤药申请上市前临床方面沟通交流提供技术指导。
本指导原则适用于抗肿瘤治疗性药物,不涵盖细胞治疗和基因治疗产品。
本指导原则仅代表药品监管部门当前的观点和认知。
随着科学研究的进展,本指导原则中的相关内容将不断完善与更新。
应用本指导原则时,还请同时参考药物临床试验质量管理规范(GCP)、国际人用药品注册技术协调会(ICH)和其他国内外已发布的相关指导原则。
二、资料准备申请人应在申请沟通交流前准备以下资料:1.关键单臂试验完整临床试验报告(CSR)或草案;如CSR尚未完成,应至少提交CSR概要,概要中至少包含试验设计(既往主要的方案修订历史)、治疗方案、入排标准、统计分析计划、受试者分布、有效性总结、安全性总结。
2.关键单臂试验中纳入有效性分析集的受试者诊断和既往治疗情况。
诊断(包括病理亚型)如需经中心病理确认,应该同时列出研究单位和中心病理确诊的诊断。
编号QR—030通用名称商品名称...

信息联系处理单药品质量档案表文件修订申请表文件销毁审批记录质量事故报告处理记录质量分析记录药品拒收报告单质量管理制度执行情况检查考核记录表编号:QR—010问题改进和措施跟踪记录编号:QR 011说明:本表一式三份,由实施部门实施后反馈到下达改进任务部门和分管领导各一份,自留一份。
内部质量管理体系审核报告(可另附纸叙述)不符合报告GSP自查评审表职工登记表编号:QR—020编号:QR—021 填表日期:健康档案登记表编号:QR—023强制检定计量器具检定记录卡编号:QR—026 制卡日期年月日制卡人:供货方一览表合格供货方档案首营企业审批表首营品种审批表编号:QR—030电话订货记录(代合同)编号:QR—033 年月日照,质量标准,生产批文。
所供药品包装、标签、说明书符合有关规定,药品应附产品合格证,包装符合运输要求,如遇有假药、劣药供方承担一切法律责任。
药品拆零登记表编号:QR—039购进退出通知单经办人:药品停售通知单编号:QR—043年第号通用名称规格剂型产品批号有效期生产日期生产企业经手人复核人其它停售原因签名:年月日药品解除停售通知单编号:QR—044年第号如下药品质量复查结果合格,撤消年第号“药品停售通知单”,请恢复正常出库及销售使用,特此告知。
通用名称规格剂型产品批号有效期生产日期生产企业经手人复核人其它签名:年月日不合格药品报损审批表编号:QR—046 报告时间:年月日说明:本表应附拟报损品种清单不合格药品销毁记录注:本表应附销毁品种清单。
记录人:药品质量复查报告单销后退回通知单经办人:药品养护档案表编号:QR—055 建档日期:中药饮片质量检查记录养护设备检修维护记录编号:QR—058药品储存温湿度记录表编号:QR—059 库区表号时间:年月药品陈列环境温湿度记录表编号:QR—060 库区表号时间:年月效期药品催销表报告人签字:年月日质量部门:业务部门经理注:1.此报告单由仓库保管员填写2.此报告单自填报日起保存2年3.此报告单一式四份,仓库、质量、业务、主管经理各一份。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
倍林达说明书YKK standardization office【 YKK5AB- YKK08- YKK2C- YKK18】药品名称:通用名称:替格瑞洛片英文名称:BRILINTA (Ticagrelor Tablets)商品名称:倍林达成份:本品活性成份为替格瑞洛适应症:本品用于急性冠脉综合征(不稳定性心绞痛、非ST段抬高心肌梗死或ST段抬高心肌梗死)患者,包括接受药物治疗和经皮冠状动脉介入(PCI)治疗的患者,降低血栓性心血管事件的发生率。
与氯吡格雷相比,本品可以降低心血管死亡、心肌梗死或卒中复合终点的发生率,两治疗组之间的差异来源于心血管死亡和心肌梗死,而在卒中方面无差异。
在ACS患者中,对本品与阿司匹林联合用药进行了研究。
结果发现,阿司匹林维持剂量大于100 mg会降低替格瑞洛减少复合终点事件的临床疗效,因此,阿司匹林的维持剂量不能超过每日100 mg。
规格:90mg用法用量:口服。
本品可在饭前或饭后服用。
本品起始剂量为单次负荷量180 mg(90 mg×2片),此后每次1片(90 mg),每日两次。
除非有明确禁忌,本品应与阿司匹林联合用药。
在服用首剂负荷阿司匹林后,阿司匹林的维持剂量为每日1次,每次75~100mg。
已经接受过负荷剂量氯吡格雷的ACS患者,可以开始使用替格瑞洛。
治疗中应尽量避免漏服。
如果患者漏服了一剂,应在预定的下次服药时间服用一片90 mg(患者的下一个剂量)。
本品的治疗时间可长达12个月,除非有临床指征需要中止本品治疗(见【药理毒理】)。
超过12个月的用药经验目前尚有限。
急性冠脉综合征患者过早中止任何抗血小板药物(包括本品)治疗,可能会使基础病引起的心血管死亡或心肌梗死的风险增加,因此,应避免过早中止治疗。
特殊人群儿童患者:本品在18岁以下儿童中的安全性和有效性尚未确定。
老年患者:无需调整剂量。
肾功能损害患者:肾脏损害患者无需调整剂量(见【药代动力学】)。
尚无本品用于肾透析患者的相关信息。
肝功能损害患者:轻度肝功能损害的患者无需调整剂量。
尚未在中-重度肝损害患者对本品进行研究,因此,本品禁用于中-重度肝损害患者。
不良反应:在一项大规模3期研究(PLATO 研究)中,对替格瑞洛在急性冠脉综合征(不稳定性心绞痛[UA],非ST段抬高的心肌梗死[NSTEMI]和ST段抬高的心肌梗死[STEMI])患者的安全性进行了评估,对接受替格瑞洛治疗的患者(本品起始剂量为180 mg,维持剂量为90 mg每日2次)与接受氯吡格雷治疗的患者(起始剂量为300~600 mg,维持剂量为75mg每日1次)进行了比较,两种治疗均联合使用阿司匹林(ASA)和其它标准疗法。
在10000例患者中对替格瑞洛片的安全性进行了评价,其中包括治疗期超过1年的3000多例患者。
在替格瑞洛治疗的患者中,最常报告的不良反应为呼吸困难、挫伤和鼻出血,这些事件的发生率高于氯吡格雷组患者。
不良事件总结列表在替格瑞洛的临床研究中出现以下不良反应(表1)。
不良反应按照发生频率和系统器官分类。
发生频率分组按照以下方式定义:十分常见(≥1/10)、常见(≥1/100, <1/10)、偶见(≥1/1000, <1/100)、罕见(≥1/10,000, <1/1000),十分罕见(<1/10,000),未知(无法从现有数据估计)。
表1. 按发生频率和系统器官分类(SOC)归类的不良事件表格中将多种相关的不良反应组合到一起,包括以下医学术语:1.高尿酸血症, 血尿酸升高2.脑出血,颅内出血, 出血性卒中3.呼吸困难,劳力性呼吸困难, 静息时呼吸困难, 夜间呼吸困难4.胃肠道出血、直肠出血、小肠出血、黑便、潜血5.胃肠溃疡出血、胃溃疡出血、十二指肠溃疡出血、消化性溃疡出血6.皮下血肿、皮肤出血、皮下出血、瘀点7.挫伤、血肿、瘀斑、挫伤增加倾向、创伤性血肿8.血尿、尿中带血、尿道出血9.血管穿刺部位出血、血管穿刺部位血肿、注射部位出血、穿刺部位出血、导管部位出血#PLATO研究中替格瑞洛组(n=9235)未报告关节积血ADR,发病频率是按点估计的95%置信区间上限计算的(基于3/X,其中X代表总样本量,如9235)。
计算得该发病频率为3/92 35,这属于‘罕见’类发病率。
对特定不良反应的说明出血在PLATO研究中使用了以下出血定义:主要致命/危及生命的出血:致命性或颅内出血、或伴有心包填塞的心包内出血、或由于出血所导致的低血容量休克或严重低血压需要升压药或手术、或临床显着或明显出血导致的血红蛋白下降(大于50 g/L)、或因出血而输血4个单位或以上(全血或浓集红细胞[P RBC])等。
其它主要出血:显着的功能丧失(如眼内出血伴永久性失明)、或临床显着或明显出血有关的血红蛋白下降(30~50 g/L)、或因出血而输血2~3个单位(全血或PRBC)等。
次要出血:需要医学干预止血或治疗出血(如需要到医院进行填塞治疗的鼻出血)。
轻微出血:其它所有无需干预或治疗的出血事件(例如擦伤、牙龈出血、注射部位渗血等)。
另外,将PLATO中报告的出血事件与TIMI(心肌梗死溶栓)量表进行了一一对应,以便与其它相似研究进行比较。
TIMI主要出血的定义是与血红蛋白下降> 5 g/dL或颅内出血有关的临床显着出血事件;TIMI次要事件的定义是与血红蛋白下降3 g/dL,但≤ 5 g/dL有关的显着出血事件。
在PLATO研究中出血事件的总体结果如图1和表2所示。
图1. 至第一次出现PLATO定义的‘总体主要’出血事件时间的Kaplan Meier评估PLATO研究中出血率的总体结果如表2。
表2. 各治疗组出血率的Kaplan-Meier估计替格瑞洛和氯吡格雷治疗后PLATO主要致命/危及生命的出血、PLATO总体主要出血、T IMI主要出血或TIMI次要出血(表2)的发生率无差异。
但替格瑞洛组PLATO主要+次要出血之和多于氯吡格雷组。
PLATO研究中发生致命出血的患者很少:替格瑞洛组有20例%),氯吡格雷组有23例%)。
年龄、性别、体重、种族、地理区域、伴随状况、合并用药治疗和病史(包括既往卒中或短暂性脑缺血发作)均不能预示总体或非操作性PLATO主要出血。
因此,无特别的人群组处于这些亚类出血的风险中。
CABG相关出血:在PLATO研究中,1584例(队列的12%)患者进行了冠状动脉旁路移植(CABG)手术,其中有42%发生了PLATO主要致命/危及生命的出血,且在两个治疗组间无差异。
每组中有6例患者发生了致命性CABG出血。
非-CABG相关出血和非操作相关出血:替格瑞洛与氯吡格雷组的非-CABG相关的PLATO-定义的主要致命/危及生命的出血发生率无差异,但PLATO定义的总体主要出血、TIMI主要出血和TIMI主要+次要出血在替格瑞洛组更为常见。
同样,去掉所有的操作相关出血,替格瑞洛组发生的出血多于氯吡格雷组(表2)。
替格瑞洛组由于非操作相关出血而导致停止治疗的发生率(%)高于氯吡格雷组(%;p<)。
颅内出血:替格瑞洛组发生的颅内非操作性出血的数量(26例患者发生27例次出血,%)多于氯吡格雷组(n=14例次出血,%),其中,替格瑞洛组的11例出血和氯吡格雷的1例出血是致命的。
两组的总体致命性出血无差异。
呼吸困难应用替格瑞洛治疗的患者中有呼吸困难(感觉呼吸急促)的报告。
在PLATO研究中,替格瑞洛组和氯吡格雷组分别有%和%的患者报告了呼吸困难的不良反应(包括呼吸困难、静息时呼吸困难、劳累性呼吸困难、阵发性夜间呼吸困难和夜间呼吸困难)。
研究者认为替格瑞洛组%的患者和氯吡格雷组%的患者发生的呼吸困难与接受的治疗有因果关系,其中少数为严重不良反应(替格瑞洛组%,氯吡格雷组%)。
呼吸困难症状多为轻度至中度,多数在治疗开始后早期单次发作。
与氯吡格雷相比,接受替格瑞洛治疗的哮喘/COPD患者发生非严重呼吸困难(替格瑞洛组%,氯吡格雷组%)和严重呼吸困难(替格瑞洛组%,氯吡格雷组%)的风险加大。
在绝对值方面,该组的风险高于总体PLATO人群的风险。
这些呼吸困难事件中约有30%在7天内消除。
PLATO中包括了基线即有充血性心力衰竭、慢性阻塞性肺病或哮喘的患者,这些患者和老年患者中报告呼吸困难者更多。
替格瑞洛组%的患者因呼吸困难停用研究药物,氯吡格雷组为%。
替格瑞洛组较高的呼吸困难发生率与新发或恶化的心肺疾病无关。
替格瑞洛对肺功能检查无影响。
实验室检查肌酐水平升高:在PLATO研究中,替格瑞洛组、氯吡格雷组分别有%、%的患者血清肌酐浓度显着增加>30%;分别有%、%的患者血清肌酐浓度显着增加>50%。
肌酐升高>50%的情况在> 75岁的患者(替格瑞洛%相比氯吡格雷%)、基线时即有重度肾损伤(替格瑞洛%相比氯吡格雷%)和接受ARB合并用药治疗的患者(替格瑞洛%相比氯吡格雷%)中更为显着。
在这些亚组人群,两组中导致停用研究药物的肾相关严重不良事件和不良事件相似。
替格瑞洛组报告的肾不良事件总数为%,氯吡格雷组为%,但研究者认为与治疗有因果关系的事件发生比率两组相似:替格瑞洛组有54%),氯吡格雷组有43%)。
尿酸水平升高:在PLATO研究中,替格瑞洛组、氯吡格雷组分别有22%、13%患者的血清尿酸浓度升高超出正常上限,替格瑞洛组平均血清尿酸浓度约升高15%,氯吡格雷组约为%,而在停止治疗后,替格瑞洛组下降至约7%,而氯吡格雷组没有下降。
替格瑞洛组报告的高尿酸血症不良事件的发生率为%,氯吡格雷组为%。
在这些不良事件中,研究者认为替格瑞洛组有%与治疗有因果关系,氯吡格雷组为%。
替格瑞洛组报告的痛风性关节炎不良事件为%,氯吡格雷组为%,研究者评估认为这些不良事件均与治疗无因果关系。
心动过缓:临床研究显示,替格瑞洛可增加Holter检出的缓慢性心律失常(包括室性间歇)。
PLATO排除了心动过缓事件风险增加的患者(例如患有病态窦房结综合征、2度或3度AV阻滞或心动过缓所致晕厥而无起搏器保护的患者)。
在PLATO研究中,替格瑞洛治疗的患者和氯吡格雷治疗的患者中分别有%、%报告有晕厥、先兆晕厥和意识丧失。
PLATO研究的Holter亚组(约3000位患者)中,在急性期,替格瑞洛组出现室性间歇的患者(%)多于氯吡格雷组(%);1个月后,替格瑞洛组室性间歇的发生率为%,氯吡格雷组为%。
男子乳腺发育:PLATO研究显示,替格瑞洛组男性患者有%报告有男子乳腺发育,而氯吡格雷组为%。
PLATO研究显示,两治疗组间其他性激素相关不良反应(包括性器官恶性肿瘤)并无差异。
上市后经验:在本品的上市后使用过程中出现了一些不良反应的报告。
由于这些反应都是自发报告,来自样本量不确定的人群,因此无法可靠估计这些不良反应的发生率。
