物理化学厦门大学
物理化学材料化学专业-厦门大学化学化工学院

物理化学(材料化学专业)(physical chemistry)目的和要求物理化学是化学科学的理论基础,是化学、化工、材料化学专业本科生的主干课程。
物理化学课程在化学化工教学计划的各自然科学理论课程中,居于承上启下的枢纽地位。
通过本课程的教学,应使学生在系统地掌握物理化学基本知识的同时,进一步提高自学能力和独立工作的能力,并学会用辩证唯物主义的观点和逻辑思维去认识化学变化的本质,学习前人提出问题和解决问题的思路和方法。
培养学生严谨的科学态度,理论联系实际的优良学风和勇于创新的科学素质。
本课程的教学内容包括:化学热力学及其在多组分系统中、相平衡和化学平衡中的应用,化学动力学、统计势力学初步、界面化学基础、电化学、胶体化学等。
具体要求如下:(1)化学势力学:主要让学生掌握热力学的三大基本定律及其在多组分系统、相平衡、化学平衡等方面的应用。
掌握界面热力学,可逆电池热力学及胶体化学中的热力学知识。
(2)化学动力学:掌握化学反应的速率和机理问题。
了解温度、压力和催化剂等外界条件对反应速率的影响,了解界面相的传递性质和反应性质。
初步掌握均相和多相催化原理。
(3)统计热力学:具备一些基本的统计热力学知识如玻尔茨曼统计、配分函数的意义。
掌握从分子配分函数及自由能函数表计算简单气相反应平衡常数及理想气体的热力学函数。
基本内容及学时分配课内学时 100 学分5′一、气体的PVT性质(讲授4学时)1.理想气体状态方程2.实际气体状态方程3.气体的液化和临界状态,超流态介绍。
4.对应态原理与压缩因子图及其应用二、热力学第一定律(讲授8学时,习题课2学时)1.热力学概论:热力学内容、方法、特点及发展简史。
2.基本概念:系统与环境、平衡态与热力学平衡、状态与状态函数、广度量与强度量。
3.热力学第一定律:文字表述及数学式、内容及焓、热与功、功与可逆过程、功的计算。
4.热容和热:恒容热容(C v)和恒压热容(C p)、C p与C v的关系、热容与温度关系、平均热容、恒容热和恒压热、PVT变化过程热的计算。
厦门大学物理化学习题及答案第章界面现象

厦门大学物理化学习题及答案第章界面现象1、表面性质与什么有关?服用同样质量同样成份的药丸和药粉,哪一种的药效快?为什么?答案:(药粉的比表面大,药效快。
)2、试计算在20℃时将1cm3水分散成半径为1某10-5cm的小水滴所需要的功。
答案:(2.16J)3、将一个系有细线圈的金属环,在肥皂液中浸一下然后取出,这时金属环被一层液膜所覆盖,而细线圈也保持着最初不规则的形状(见图),现若将线圈内的液膜刺破,问线圈将变成什么形状?为什么?答案:(变成一圆圈,因为表面张力的作用。
)4、有人从"表面扩展过程是一熵增过程"出发,得到"表面扩展是一自发过程"这一结论。
试指出此结论的错误所在。
答案:(体系熵增加并不等于总熵增加。
)5、设纯水的表面张力与温度的关系符合下面的关系式假定表面积改变不会引起总体积变化。
试求(1)在283K及压力下可逆地使水的表面积增加1cm2时,必须对体系做功多少?(2)计算该过程中体系的ΔU、ΔH、ΔS、ΔF、ΔG及所吸收的热。
(3)除去外力,使体系不可逆地自动收缩到原来的表面积;并设不做收缩功。
试计算该过程的ΔU、ΔH、ΔS、ΔF、ΔG及热。
答案:〔(1)W=-7.424某10-6J(2)ΔU=ΔH=7.564某10-6J、ΔF=ΔG=7.424某10-6J、ΔS=4.95某10-10J·K-1、Q=1.4某10-7J(3)ΔU=ΔH=-7.564某10-6J、ΔF=ΔG=-7.424某10-6J、ΔS=-4.95某10-10J·K-1、Q=ΔU〕4、如图所示两根毛细管中分别装有两种不同的液体,若在毛细管右端加热,问液体将如何移动。
答案:(上管向左,下管向右)5、在下列体系中将活塞两边连通时将出现什么情况?为什么?若连通大气又如何?答案:(小泡变小,大泡变大,若连通大气,则两气泡均变小,直至曲率半径变成无限大。
)6、在一管径不均匀的毛细管中有一些可润湿管壁的液体存在(见图)。
厦门大学物理化学近年真题考点归纳
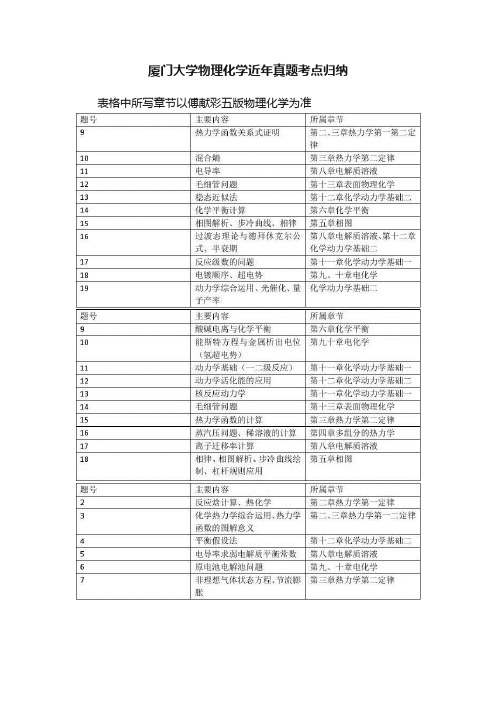
厦门大学物理化学近年真题考点归纳表格中所写章节以傅献彩五版物理化学为准
以上列了近几年厦门大学物理化学考试科目大题的主要考点。
厦门大学的物理化学不同于其他学校,他考察的题型比较单一。
一般12~16分的选择题,然后剩下的大概十道左右的大题。
首先,复习过程中一般使用傅献彩的物理化学课本,据悉厦大本校上课也是使用这本教材。
第一章气体的不用看,统计热力学一般就考一个选择,也可舍弃(明确说明只考概念),第十四章胶体近年来也只考选择,也可考虑舍弃。
厦大的物化热力学考察并非重点,但热力学函数的关系、麦克斯韦关系要会熟练推导,并要求熟悉各个函数的意义,今年来有向热化学、能源方面考察的趋势。
相图每年必考,且分值较大,考察的相图也较为常规,多进行几个典型相图的练习总结规律就行,步冷曲线也一般会要求绘制,杠杆规则的应用,并注意这部分可以和第四章结合考察。
化学平衡也几乎年年考,这部分相对简单。
电解质这一章本身就比较简单,一般是求电导率以及弱电解质平衡常数。
第九十章电化学每年必考大题,能斯特方程要熟练运用,注意超电势的问题以及电解过程中离子浓度的改变。
第十一十二章动
力学每年考察的比重比较大,常用的反应级数求解、稳态近似平衡假设的使用及其使用条件、过渡态理论中热力学函数与活化能的关系、重要的关系式的推导。
第十三章也年年考大题,开尔文公式、毛细现象,都很简单,但要注意浸润与不浸润时方程中R的正负(14年考的汞和玻璃,非常遗憾做错了)
最后,厦大物化最重要的参考书是孙世刚编写的物理化学的学习指导以及物理化学题库,历年真题很多出自上面。
要将上面的习题反复练习。
厦大物理化学、有机化学考研经验

厦大物理化学、有机化学考研经验分享给学弟学妹考研结束,担子卸了,忽然觉得时间一下子多了,在家无事,便胡乱写一下自己在这半年来的心得体会,希望后来的学弟学妹能够有所借鉴。
对于自己为何选择厦大作为考研的学校,其实没有特别的原因。
不想转专业考研,太难太累人,也不喜欢有机实验室浓重的试剂气味,于是我便选了物理化学。
而厦大的物化还是很有名气的,而且比对了历年来厦大物化的考研收录比,大概3:1的样子,对于名校来说,是比较简单的了。
于是我便着手开始收集资料。
我的大部分资料都是在百度文库收集来的,上面你能够找到很多好心人发的资料,很全,像真题、物化题库、厦大的物化ppt等都能找到。
我是从7月份开始复习的,当时看了下物化的真题,觉得好难好难,潜意识里就产生了对它的恐惧心理。
其实从现在来看这种心理是恨不正确的。
厦大的物化有它自己的特色,题目很活,看上去很偏,很难,即使是南大那本教材的题目都能做,看到厦大的一些题目也会摸不着头脑。
这是因为厦大有它自己的出题方式,南大教材的课后习题是很经典的题目,而厦大的出题则会偏向于应用,我感觉13年的真题尤其是这样。
所以,在大概地看一遍南大的教材,打下基础之后,就要马上去看厦大的教材了。
厦大的两本教材很厚,内容也很多,很复杂,我在开始复习时翻了翻,觉得吃不消,就没怎么看,还是以南大的教材为主。
事实证明,厦大的教材需要尽早看,因为你在做厦大的课后习题时(建议大家一定要买那本与厦大教材配套的课后习题集,而且至少要做两遍,因为历年真题里很多题目就是从这里出的),会发现很多知识点都是南大那本教材没有涉及的,需要你去重新翻书,这样非常浪费时间,也不利于形成一个整体的知识框架。
我的建议是,尽早开始看厦大教材,看一章,做一章课后习题,有做笔记习惯的同学可以在看的过程中做下笔记,因为内容多,公式多,做了笔记之后再第二次看时能够省力一些。
第一次做题目时,有好些不会做,这是很正常的,不要烦躁,好在它有答案,根据自己的习惯在那些不会做的题目上做好记号,第二次做的时候再来解决。
厦门大学 物理化学 (上) 各章 知识点 总结

第1章第零定律与物态方程一、基本要点公式及其适用条件1.系统的状态和状态函数及其性质系统的状态—就是系统物理性质和化学性质的综合表现,它采用系统的宏观性质来描述系统的状态,系统的宏观性质,也称为系统的"状态函数"。
系统的宏观性质(状态函数)—就是由大量(摩尔级)的分子、原子、离子等微观粒子组成的宏观集合体所表现出的集团行为,简称"热力学性质"或“热力学函数”如p、V、T、U、H、S、A、G 等。
Z=f(x,y)表示一定量、组成不变的均相系统,其任意宏观性质(Z)是另两个独立宏观性质(x,y)的函数。
状态函数Z具有五个数学特征:(1),状态函数改变量只决定于始终态,与变化过程途径无关。
(2),状态函数循环积分为零,这是判断Z是否状态函数的准则之一。
(3),系Z的全微分表达式(4),系Z的Euler 规则,即微分次序不影响微分结果。
(5),系Z、x、y满足循环式,亦称循环规则。
2.热力学第零定律即热平衡定律:当两个物态A和B分别与第三个物体C处于热平衡,则A和B之间也必定彼此处于热平衡。
T =t+273.15,T是理想气体绝对温标,以"K"为单位。
t是理想气体摄氏温标,以"℃"为单位。
绝对温标与摄氏温标在每一度大小是一样的,只是绝对温标的零度取在摄氏温标的-273.15℃处,可以看出,有了绝对温标的概念后,只需确定一个固定参考点(pV)0p=0,依国际计量大会决定,这个参考点选取在纯水三相点,并人为规定其温度正好等于273.16K。
3.理想气态方程及其衍生式为:;式中p、V、T、n单位分别为Pa、m3、K、mol;R=8.314J〃mol-1〃K-1,V m为气体摩尔体积,单位为m3〃mol-1,ρ 为密度单位kg〃m-3,M 为分子量。
此式适用于理想气或近似地适用于低压气。
4.理想混合气基本公式(1)平均摩尔质量;式中M B和y B分别为混合气中任一组份B 的摩尔质量与摩尔分数。
厦门大学物化大纲

厦门大学本科课程大纲
大纲制定者:陈良坦大纲审定者:
厦门大学本科课程大纲填写说明:
1.课程中英文名称必须准确、规范。
英文名称每个单词打头字母应用大写。
2.课程类型是指公共基本课程、校通识课程、院系通识课程、学科类通修课程或学科类方向性课程。
3.先修课程是与该课程具有严格的前后逻辑关系,非先修课程则无法学习该课程。
4.选用教材和主要参考书要求注明作者、书目、出版社、出版年限。
例如,“黄叔武、杨一平编:《计算机网络工程教程》,1999年7月。
”
5.开课专业必须明确,不能出现“等”字样,如“经济学、会计学等专业”。
6.课程性质、目的和任务不少于200字。
7.教学基本要求不少于400字。
8.考核方式是指笔试(开卷或闭卷)、口试或其它考查方式。
9.其它信息是指该课程获奖情况,例如“优秀课程”、“名牌课程”、“精品课程”或者“双语教学课程”等。
获奖情况必须注明获奖等级、级别。
厦门大学物理化学考研题库

厦门大学物理化学考研题库厦门大学作为中国著名的高等学府之一,其物理化学专业在国内外享有很高的声誉。
考研的学子们为了能够顺利通过考试,往往需要准备大量的复习资料和练习题。
以下是一些模拟的考研物理化学题库内容,供参考:一、选择题1. 根据吉布斯自由能的定义,下列哪个选项是错误的?A. G = H - TSB. 反应自发进行的条件是ΔG < 0C. 反应的吉布斯自由能变化等于反应物的吉布斯自由能减去生成物的吉布斯自由能D. 吉布斯自由能是状态函数2. 以下哪项不是热力学第一定律的表述?A. 系统内能的变化等于系统与外界交换的热量B. 系统内能的变化等于系统与外界交换的热量和做功的代数和C. 热力学第一定律是能量守恒定律的另一种表述D. 系统内能的变化只与过程有关,与路径无关二、填空题1. 在恒温恒压下,一个化学反应的焓变等于生成物的_________减去反应物的_________。
2. 理想气体状态方程为 PV = nRT,其中P代表压强,V代表体积,n 代表物质的量,R是_________。
三、简答题1. 解释什么是化学平衡常数,并说明它与温度的关系。
2. 描述范德华方程,并解释其与理想气体状态方程的区别。
四、计算题1. 已知某化学反应的焓变(ΔH)为-50 kJ/mol,反应物和生成物的熵变(ΔS)为0.2 kJ/(mol·K),求在298 K时该反应的吉布斯自由能变化(ΔG)。
2. 某理想气体在等压过程中从体积V1 = 2 m³膨胀到V2 = 4 m³,压强P = 1 atm,求该过程中气体所做的功。
五、论述题1. 论述化学动力学中的碰撞理论,并说明它与过渡态理论的区别。
2. 讨论溶液的渗透压,并解释为什么在不同浓度的溶液中,渗透压会有所不同。
请注意,这些题目仅供模拟参考,实际的考研题库内容可能会有所不同。
考生在准备过程中应以官方发布的考试大纲和教材为主,同时结合历年真题进行复习。
厦门大学 物理化学课件

Zeroth Law ofthermodynamicsan object A is inIf bj t i ithermal equilibriumwith B and if B is inthermal equilibriumwith C,then C is inthermal equilibriumth l ilib iwith A.ynamics-2nd LecThe eproperties for an uniform system at equilibrium macro properties for an uniform system at equilibrium In fact,the real equation can be established only for thedifferential equation,e.g.using differential equation e gd U=F d S-p d Vquation,i.e.V=V(T,p,n)en we extend the equation of state of perfect gas to real gas, we will meetThe appearance of deviations;(2) The liquefaction of real gas may occur undertain conditionst i ditiCondensationAt C ,all similarity to perfect behaviour is lost.This stage is represented by the horizontal line CDE .At the point just t th l ft f li id d g to the left of C ,a liquid appears,and there are two phases in the system in this stage.this stage.The pressure corresponding to the line CDE when both liquid and vapour are l ,q p present in equilibrium,is called the vapour pressure of the liquid at l + gl Experimental isotherms the temperature of the experiment.At E , the sample is entirely liquid. t ,t e sa p e s e t e y qu d.Critical constantsgle phase.The liquid Critical point gp qphase of a substance does notform above the criticalCritical point l T c ,the critical point of thegas.Critical constants arel + g l different from gas to gas.ThvolTh hi h t t t t li fe highest temperature to liquefy gas Critical pressure , 临界压力(p c ,临界力)The lowest pressure to liquefy gas at T cV c,m ,临界摩尔体积)The molar volume at p molar volume at T c , p cT are Critical constantsc , p c , V c are Critical constantsMRepr apart.Critical point=⎞⎛∂p 0⎟⎟⎠⎜⎜⎝∂TV m 02=⎟⎞⎜⎛∂p m 2⎟⎠⎜⎝∂TVReduced pressure =p/p Reduced pressure (对比压力)p r p/p c Reduced temperature 对比温度T = T/T ()r c Reduced volume (对比体积)V r = V/V c,m,m .V r压缩因子图At very low pressures:Z1At very low pressures: Z ≈1.At high pressures: Z> 1.At high pressures:Z>1Repulsive forces are now dominant.At intermediate pressures: Z<1g,For most gases, the attractive forces are dominant.A perfect gas has Z = 1A f t h Z1(E l t i fi 4)Evaluate p using figure operation methodZ T r压缩因子图Z=f(p r)p r’p r⎠⎝⎠⎝rrc4)Evaluate T by applying(E l t b l ifigure operation methodZ Z=f(1/T r)Z查T r’T re relationship between mechanics response functions::ακββ=1.∂α∂κ2.∂p∂T pTfirst law of thermodynamics (热力学第一定律)。
厦门大学物理化学课件

-1st lepartment of Chemistry, Xiamen University2008陈德俊h f i002@163:xuezhongfei_002@:yzjszzh@黄志忠j h@163¾教学大纲¾电子教案¾动态交流¾相关链接¾参考书目¾¾第9周中期测试•第9周至期末学习多组分体系热力学,相平衡等内容•考核:平时作业10%(每周四提交作业)中期测试40%期末测试50%Refer1.P.W. Atkins, 《Physical Chemistry》(7or 8Edition), W.H. FreemanP.W.Atkins,Physical Chemistry th or8th Edition),W.H.Freeman and Company, 1999 or 2006 (Since 1940-)2.孙世刚等,《物理化学》,厦门大学出版社,2007(普通高等教育“十一, 2002.Hill20025.韩德刚,高执棣,高盘良,《物理化学》,高等教育出版社,2001。
6.黄启圣,吴金添,魏光,《物理化学》,厦门大学出版社,1996。
7.傅献彩, 沈文霞, 姚天扬, 《物理化学》第四版,高等教育出版社,1996(1961年第一版)。
赵凯华, 罗蔚茵, 《热学》,高等教育出版社,1999。
热学高等教育出版社11.张三慧,《热学》(第二版),清华大学出版社,1999。
除重要定义外,对公式和推导过程要求从原理•除重要定义外对公式和推导过程要求从原理,而不是强记硬背上理解记忆,而不是强记硬背特别注•注意总结和领会每一部分的主要内容,特别注意使用的方法、依据的实验事实、定律或理论,•重视习题和实验•注意思维方法和逻辑推理•注意数理基础的适时复习,特别是数学知识的gual course:first thing is to study and understand the The first thing is to study and understand the contents of physical chemistry;terms and expressionsterms and expressionsI1the most general law and theory of chemical and the most general law and theory of chemical systems. Physical chemistry investigates the physical methods and introduces different and physical methods and introduces different experimental means to investigate chemical laws.2.The fuparts:gy in the change of matters (、V 、pp T 、phase and chemical changes), and the direction and limit of energetic effects (work, heat). Thermodynamics concerns the law of energy conservation and the law of matter equilibrium.(2) Quantum mechanics (量子力学)⎯that studies moving states of micro-systems.In elementary application, y y pp ,the Schrödinger equation is set up for the system and then solved either analytically or, in many-practical systems, y y ,y p y ,numerically, with due note of the boundary conditions .3)Statistical mechanics ⎯that studies 3) Statistical mechanics (统计力学)that studies the average behavior of large assemblies of particles.Statistical mechanics is the theory in which the properties of mechanics is the theory in which the properties of macroscopic system are predicted by the statistical behavior of their constituent particles.动力学)of their constituent particles.(动力学)⎯that studies the law ofinfluence of different factors such as the concentration,l l li h l i i hlyst, solvent, light, electricity, on the chemical reaction rate and mechanism (reaction details, l i )lementary reaction).Quantum chemistry(量子化学)量子化学Structural chemistry(结构化学)chemistry(催化化学) Catalytic chemistry( Electrochemistry(电化学)otochemistry(光化学)Ph h i(Chemical kinetics (化学动力学)y(热化学) Chemistry of high energy (高能化学) Computing chemistry (计算化学) Computing chemistry(pment trend ofphysical chemistry From static to transition•From static to transition•From qualitative to quantitative From equilibrium to non-equilibrium F ilib i t ilib i3. The(1) Mis thermodynamic method. Thermodynamics concerns It is thermodynamic method.Thermodynamics concerns macroscopic system that consists of large amount of particles.peculiarity of this method consists in that the method does The peculiarity of this method consists in that the method does not care the microscopic structure of particles inside matters, deals with only the macroscopic properties before andbut deals with only the macroscopic properties before and after the change of states.4. TInitiacalculationsDelivering methodology :General scientific methodology gy (materialism, epistemology, logic inference), and methodology of physical chemistry (thermodynamics, quantum mechanics, and i i l h i )istical mechanics).Importance of the methodology :It would be much beneficial toC lti ti th bilit Th bili f l i h i i l (授人以鱼,不如授人以渔)ultivating the ability :The ability of applying the principles of physical chemistry to solve practical problems.+methodology =Innovation ability5. The importance and the goal ofstudying physical chemistryhemical changes;h i l h2.Training the ability of thinking and solving;.Mastering experimental skills and methods through 3M i i l kill d h d h h experiments.main contents of the semester .Thermodynamics1Th d i. Thermochemistry2Thermochemistry. The application of thermodynamics in3The application of thermodynamics in multi-component systems. Statistical thermodynamics5St ti ti l th d iChathe state equationand the state equation1.1 Thermodynamic system and surroundings体系):The object of interest that is distinguished from its surroundings by a boundary (边界), i.e. the interface that separates . (A macro assembly that contains large number of particles) them(A macro assembly that contains large number of particles)Surroundings (环境):(=Heater(热源)+Engine(做功的机器))The that separates from the system by a physical (or an imaginary) universe that separates from the system by a physical(or an imaginary) boundary, and has close relation with the system.System Surroundings1Th l i b d di i1.The relation between system and surroundings consistsmainly in the exchange of matter and energy;particles (atoms, molecules, phonons, electrons, etc.) under specified confinement, whichmeans that the system satisfies the restriction of macroconditions, thus it can be described by macro parametersV,A,l,T, etc.);The large number means the (T,etc.The large number means thethermodynamic limit N=6.02×1023, cm3~m3;.The boundary of system may be multi-variable:it may 3The boundary of system may be multi variable it may be real, or imaginary, such as rigid wall, movable wall,diabatic wall, semi-transparent wall, etc.;di b ti ll i t t ll tS(a) An open system:can exchange matter andenergy with its surroundings.(b) A closed system:can exchange energy with itscan exchange energy with itssurroundings, but it cannotexchange matter.exchange matter(c) An isolated system:can exchange neither energy normatter with its surroundings.Open system Closed system Isolated system p y (开放体系)y (封闭体系)(隔离体系)S Mass transferringEnergy transferring SystemMass transferring between system and SurroundingsEnergy transferring (in the form of heatand work)Open yes Yes Closed No yes IsolatedNo NoCu电池电阻丝Open system Open systemO t O t电阻丝水+电池Closed systemClosed systemStationot change with time but it exists flow of matter and energy not change with time, but it exists flow of matter and energyStationary state ≠ Equilibrium stateque equilibrium state for enough long time.an particles q q g gaggregate that contains lots of particles,such as p,V ,T,U,H,S,F ,G,are named as macro characters of system (thermodynamic properties).properties ):They are not dependent of the(强度性质)y p amount of substance,and have no adding nature (e.g.p ,T ,etc.);Extensive properties :They depend on the amount ofp p (广度性质)y p substance,and have adding nature (e.g.,n ,V ,U,H ,etc.)有加和性无加和性1.3 Mstate and state functionstate and state functionMethods describing the states of a system:hod of statesh d fmechanics:Distributing probability, the statistical Statistical mechanics Distributing probability,the statistical description method of statesynamic description method or macro description method ofy p pstates)f Axiom of state (状态公理)For an uniform phase system at equilibrium, the number (F ) of independent macro properties equal the sum of the number ()f i bl b t th b ()f ibl k R ) of variable substances, the number (W ) of reversible work, and plus 1 (the energy exchanged in heat form)F R +W +1= R + W + 1e.g.1:system of uniformF =1+1+1=3, L =L T , , n),(,p ,)n 1,n 2,…n r L =L (T , p , n 1,n 2,…n r )e.g.2:system of uniformmulti substance (multi-substance l )H 2(g )T l ,p l ,n l T g ,p g ,n g H 2(l )|H 2(g )T s ,p s ,n sEquatbetweestate(热力学状态):The state that is Thermodynamic state Th t t th t i described by macro properties of system, it is also called macro stateState variable(状态变量):The independent macro properties that describe the states of system it is also called thermodynamic describe the states of system, it is also called thermodynamic variables (coordinates)that depends only on the current state of the system, and is property that depends only on the current state of the system,and is independent of the previous history of the system. That is, a state function is the function of a set of variables that define the currentΔU=0 ΔH=0ΔU=0 ΔH=01.4 TAnyT final T heater ConstantT===Constantinitial2. Constant temperature processes(恒温过程) :=Constant. Isobaric processes(等压过程):3Isobaric processesp i = p f = p ex = ConstantConstantC t t5. Iso processes:p(等容过程)V i = V f = V ex = ConstantQuasistatic processes(准静态过程) :7.Quasistatic processes)At any moment of the process the system is in equilibrium y gystem and its surroundings9. Expansion processes1.Gas is expanded to vacuumGas is expanded to vacuum(Free expansion process)G i i气体真空2. Gas is expanded againstChemical reaction processes例:合成氨反应::合成氨反应:N 2(g,1mol,723K,30MPa) + 3H 2(g,3mol,723K,30MPa)()在反应器(如合成塔)中等温等压进行反应生成分压2)在反应器(如合成塔)中等温等压进行反应,生成分压为p NH3的NH 3;将生的应离来剩余的续将生成的NH 3从反应器分离出来,剩余的N 2和H 2再继续反应,这样反复进行就能完全生成NH 3;1.5 Zertemperature)(The temperature)The Zeroth Law of thermodynamics is the justification of the concept of temperature, which is used to determine whether two systems would be in thermal equilibrium if they were in conduct through a diathermic (透热) wall, and to the direction of the resulting flow of energy: determine the direction of the resulting flow of energy: energy is transferred from high temperature to low.practice, the temperature of a system has much richIn practice the temperature of a system has much rich consequences than those are immediately obvious from this . For examples: it determines the efficiency of heat definition For examples:it determines the efficiency of heat engine, the distribution of molecules over their available energy level, the thermal conductivity of a system, etc. energy level the thermal conductivity of a system etcPreparation (预习)•3)吸热又作功的体系是封闭体系;()吸热又作功的体系是封闭体系(4)与环境又化学作用的体系是开放体系。
物理化学—厦门大学精品课程_部分2(共1700多页)

部分互溶的双液系
(4) 不具有会溶温度
乙醚与水组成的双液 系,在它们能以液相存在 的温度区间内,一直是彼 此部分互溶,不具有会溶 温度。
C点,曲线发生转折,有Bi(s)析出,降温速度变慢;
f * = C +1− = 2+1−2 = 1
至D点,Cd(s)也开 始析出,温度不变;
f * =2+1−3=0
Cd-Bi二元相图的绘制
2. 作含20%Cd,80%Bi的步冷曲线。 至D’点,熔液全部凝结为Bi(s)和Cd(s),温度又开
始下降;
f * =1
Cd-Bi二元相图的绘制
有三条多相平衡曲线 1. ACE线,Bi(s)+ l 共 存时,熔液组成线。 2. HFE线,Cd(s)+ l 共 存时,熔液组成线。
3. BEM线,Bi(s)+Cd(s)+l 三相平衡线,三个相的组 成分别由B,E,M三个点表示。
Cd-Bi二元相图的绘制
蒸馏(或精馏)原理
组成为 x4的液相在塔板冷凝后 滴下,温度上升为 T5 。又有部 分液体气化,气相组成为 y5 , 剩余的组成为x5 的液体再流到 下一层塔板,温度继续升高。 如此继续,在塔底几乎得到的 是纯A,这时温度为A的沸点。
精馏塔中的必须塔板数可以从理论计算得到。 每一个塔板上都经历了一个热交换过程:蒸气中的 高沸点物在塔板上凝聚,放出凝聚热后流到下一层 塔板,液体中的低沸点物得到热量后升入上一层塔 板。
液相和气相的数量借助于力学中的杠杆规则求算, 即以物系点为支点,支点两边连结线的长度为力矩,计 算液相和气相的物质的量或质量,这就是可用于任意两 相平衡区的杠杆规则。即
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Xiamen University
Relaxation time
上述结果说明, 上述结果说明,对峙趋向平衡 的过程为一级反应过程, 的过程为一级反应过程,其速率常 数为 k1 + k-1。
在平衡态产生一个微扰使反应偏 离平衡, 离平衡,从微扰态趋向平衡态的过程 称为弛豫过程, 称为弛豫过程,该过程的平均寿命 (xe﹣x=xe/e),即弛豫时间 , τ = 1/(k1 + k-1) 通常运用实验技术测量弛豫时 间的方法求k 间的方法求 1 + k-1,再通过平衡关 系把k 的值计算出来。 系把 1和k-1的值计算出来。
II. Kinetics of typical complex reactions III. Steady-State Approximation IV. Pre-equilibria
2011-10-14
2011
Physical Chemistry
Xiamen University
I. Elementary Reactions & Overall Reactions
2011-10-14
2011
Physical Chemistry
Xiamen University
8.7 Elementary & Complex Reactions
Focuses
I. Concepts
Elementary reactions 基元反应 Molecularity 分子数 Overall reactions 总包反应 Reaction order 反应级数 Reaction mechanism 反应机理
Physical Chemistry Xiamen University
A P → A+B P →
2A + B P →
2011-10-14
2011
Law of Mass Action
For an elementary reaction, the rate is proportional to the concentration of of the reactant molecules that meet together.
∆ = ∆0exp { [− kf ([Α]e + [Β]e) + kr([C]e + [D]e)] t} − [ [ ] ] ∆ = ∆0exp (−t/τR) −
Assume微扰 ∆0= [Α]e − [Α]0,∆ = [Α]e −[Α] 微扰 [Α] [Α]
∆ = ∆0exp{−(kf + kr) t} = ∆0exp (−t/τR) − −
τR = 1/(kf + kr)
再结合平衡常数分别求k 以实验方法监测∆~t,求出τR,再结合平衡常数分别求 f 及 kr ,
∫
[A] [A]0
d[A] [A]﹣[A]e
=-
0
∫
t
(k1+k-1)dt
[A]0−[A]e ln = (k1 + k-1) t [A]−[A]e
该式与一级反应表达式极为类似,只不过将 [A]0→[A]0−[A]e, [A] →[A]−[A]e, k →k1 + k-1
2011-10-14
2011
Physical Chemistry
k1 k-1
B
[B]0 [B]0 + x [B]0 + xe
[A]0 [A]0 – x [A]0 – xe
d[A ] − = k 1[ A ] − k - 1[B] dt
[A]0+[B]0=[A]+[B]=[A]e+[B]e k1/k -1 =[B]e/[A]e [B] = [A]e+ [A]ek1/k -1-[A]
An elementary reaction refers to a single-step reaction involving a small number of molecules or ions.
For examples: Cl 2 + M = 2Cl + M
Cl + H 2 = HCl + H H + Cl 2 = HCl + Cl 2Cl + M = Cl 2 + M
More common situation is that the forward and the back reactions may not be elementary reactions, and may be first-, second- or third-order reactions For examples
Elementary reaction
rate law
(1) Cl 2 + M = 2Cl + M (2) Cl + H 2 = HCl + H (3) H + Cl 2 = HCl + Cl (4) 2Cl + M = Cl 2 + M
2011-10-14
k1[Cl 2 ][M] k 2 [Cl][H 2 ] k3 [H][Cl2 ] k 4 [Cl]2 [M ]
Differential equation
d[A ] − = (k 1 + k - 1)([A] − [A ]e) dt
2011-10-14
2011
Physical Chemistry
Xiamen University
Reversible First-Order Reactions: Integrated equation
B C D
连续反应
Ation
k2 A k1 B → C →
2011-10-14
2011
Physical Chemistry
Xiamen University
II. Kinetics of typical complex reactions
Reversible (Opposing) reactions 对峙反应
2011-10-14
2011
Physical Chemistry
Xiamen University
Typical Combinations of Elementary Reactions
Reversible (Opposing) reactions 对峙反应
A
k1
B
平行反应
k1
k-1
Parallel reactions
2011 Physical Chemistry Xiamen University
对于很小的扰动值, 对于很小的扰动值 ∆2≈0
2011-10-14
Relaxation Time for 2nd-order Reversible Reactions
d∆ − = {k f ([A]e + [B]e ) + kr ([C]e + [D]e )}∆ dt 可见, 可见,∆向平衡的趋近可近似为一级 1 弛豫时间 τ R = k f ([A]e + [B]e ) + kr ([C]e + [D]e )
2011-10-14
2011
Physical Chemistry
Xiamen University
Relaxation Time for 1st-order Reversible Reactions
1-1级对峙反应 级对峙反应
A
kf kr
B
Integrated rate equation:
[A]0 − [A]e ln = (kf + kr )t [A] − [A]e [A]−[A]e = ([A]0−[A]e) exp[−(kf + kr) t] − −
A A+B A
kf kb kf kb kf kb
B C B+C
Xiamen University
2011-10-14
2011
Physical Chemistry
Reversible First-Order Reactions: Differential equation
A
t =0 t =t t =te
Xiamen University
2011
Physical Chemistry
Reaction Mechanism
For an overall reaction, the combination of a series of elementary-reaction steps is the reaction mechanism. 同一反应在不同的条件下,可有不同的反应机理。 同一反应在不同的条件下,可有不同的反应机理。 了解反应机理可以掌握反应的内在规律,从而更好的 了解反应机理可以掌握反应的内在规律, 掌握反应的内在规律 驾驭反应。 驾驭反应。一个反应机理需要经得起实验和理论的考 验,有时需要作长期的大量的动力学研究。 有时需要作长期的大量的动力学研究。
2011-10-14
2011
Physical Chemistry
Xiamen University
Relaxation Time for 2nd-order Reversible Reactions
2-2级对峙反应 级对峙反应
A+B
kf kr
C+D
Assume: [Α] = [Α]e − ∆; [Β] = [Β]e − ∆; [C] = [C]e + ∆; [D] = [D]e + ∆;
2011-10-14
2011
Physical Chemistry
