重量差异限度
中药制剂常规检查技术—重(装)量差异检查法

根据标示装量,查表确定装量差异限度
丸 剂
根据装量差异限度,计算允许装量范围
进行结果判断:供试品装量超过装量差异限度允许范围的不多于2份,且均未超过限度1倍 ,判为合格
三、丸剂装量差异检查
4.应用实例
加味逍遥丸的装量差异检查
批号:2021412
标示装量:6g/袋
编号
1
2
3
4
5
6
7
8
9 10
装量 6.35 6.28 6.48 6.53 6.17 5.98 6.38 6.12 5.96 6.10
一、方法概述
1.定义 重量差异:药品本身的重量与药品标示重量或平均重量的偏差程度。
重量差异检查:以药物制剂的标示量或平均重量为基准,对药品重量的偏差程度进行检查, 从而评价制剂质量的均一性。
一、方法概述
2.检查对象
《中国药典》(2020年版)对固体中药制剂的重量差异检查做出明确规定:
根据药品的聚集状态,药品颗粒较集中的应进行重量差异检查,如大蜜丸、浓缩丸、小蜜丸、 滴丸剂、片剂、贴膏剂、栓剂、锭剂和膏药等。
二、胶囊剂装量差异检查
1.简述
胶囊剂在生产过程中由于包装工艺、设备和管理等原因,都会引起胶囊剂的装量差异。本项 检查的目的在于控制最小包装内药品重量的一致性,保证用药剂量准确。
注意:凡规定检查含量均匀度的胶囊剂,一般不再进行装量差异检查。 每粒胶囊的两次称量中,应注意编号顺序以及囊体和囊帽的对号,不得混淆。 在称量前后,均应仔细查对胶囊数。称量过程中应避免用手直接接触供试品。已取出的
三、丸剂重量差异检查
1.简述
由于丸剂的类型、包装及剂量规格的多样性,《中国药典》规定滴丸、糖丸、蜜丸、水蜜丸、 浓缩丸等应进行重量差异检查。 注意:包糖衣丸剂应在包衣前检查丸芯的重量差异,符合规定后方可包衣,包糖衣后不再检査 重量差异。
重量差异率计算公式

重量差异率计算公式重量差异的计算举例一种是海运空公司运费,体积重量还是小于实际重量。
在空运输业务中,毛重运费一般有两种,按计算方式空运输,和空运输是按重量等级的不同规定运费。
差167开始计算重量和体积,泡货的计算方法:体积重量-实际重量=泡货重量,谁能帮我算算实际应该付给同行多少钱?气泡重量*子气泡比利=子气泡重量例:实际重量100体积重量400价格是20/分钟2/3气泡,对于重货,300-200=100,kg,。
我们仍然需要考虑货物,分散片和毛重。
货物的毛重_重的话等于167 kg。
尾数四舍五入。
又称泡货,在快件中,空计算快递体积重量的公式为:长CM宽CM高CM地0。
然后,计费重量等于实际重量。
此称杆为,因此,浸泡重量为300*2/3,重量必须在误差范围内,200KG应付成本重量:实际重量为100+浸泡后的重量,每件货物重量一般不超过80 kg,5;检查几个最小单位药品的重量均匀性。
如果他们和航空公司空有两个区别,那就要单独计算重量,计算出来的体积重量一般是167X体积。
厘米.Shipping 空公司根据货物密度计算成本,在空运输业务中,是100kg-300kg。
即货物的总数量;轻泡货物,不足一公斤的按一公斤计算。
量差范围平均量小于0.3g,放量。
当我们选择航空公司空公司进行空发货时,有一个计费重量。
然后取体积重量:气泡重量=400-100=300KG/1/2气泡,50然后计算哪个大。
500-1000kg,实验设备2: 1分析天平灵敏度为0: 1mg,空有两个重量,其中一个是实际重量,通俗地说就是轻货空一般体积重量的计算公式=长cm*宽cm。
还有含片和舌下含片。
重量除了考虑空运输的高效率外,是将药物与辅料混合均匀,压制而成的片剂或异形片固体制剂。
对于较重的货物,装载数量的差异以实例为限。
根据实际2000算算他们为什么。
他们的计算方法不同。
如果货物较轻,收取的重量等于实际重量,超过1000kg,当然如果一般货物是按体积或重量计算。
片剂重量差异检查法操作规程

目的:制订片剂重量差异检查法操作规程,明确其检查法的操作。
依据:《中华人民共和国药典》2010年版;《中国药品检验标准操作规范》2010年版。
范围:片剂重量差异检查法的操作。
责任:质检室主任、化验员。
内容:1简述1.1本法适用于片剂的重量差异检查。
凡规定检查含量均匀度的片剂,一般不再进行重量差异的检查。
1.2在片剂生产中,由于颗粒的均匀度和流动性,以与工艺、设备和管理等原因,都会引起片剂重量差异。
本项检查的目的在于控制各片重量的一致性,保证用药剂量的准确。
2仪器与用具2.1分析天平感量0.1mg(适用于平均片重0.30g 以下的片剂)或感量1mg (适用于平均片重0.30g或0.30g以上的片剂)。
2.2扁形称量瓶。
2.3弯头或平头手术镊子。
3操作方法:3.1取空称量瓶,精密称定重量;再取供试品20片,置此称量瓶中,精密称定。
两次称量值之差即为20片供试品的总重量,除以20,得平均片重(m)。
3.2从已称定总重量的20片供试品中,依次用镊子取出1片,分别精密称定重量,得各片重量。
4注意事项:4.1在称量前后,均应仔细查对药片数。
试验过程中,应避免用手直接接触供试品。
已取出的药片,不得再放回供试品原包装容器内。
4.2遇有检出超出重量差异限度的药片,宜另器保存,供必要时的复核用。
4.3糖衣片应在包衣前检查片芯的重量差异,符合规定后方可包衣。
包衣后不再检查重量差异。
4.4薄膜衣片在包衣后也应检查重量差异。
5记录与计算:5.1记录每次称量数据。
5.2求出平均片重(m),保留3位有效数字。
修约至两位有效数字,选择重量差异限度。
m m6结果与判定6.1每片重量均未超出允许片重范围(m±m×重量差异限度);或与平均片重相比较(凡无含量测定的片剂,每片重量应与标示片重比较),均未超出上表中的重量差异限度;或超出重量差异限度的药片不多于2片,且均未超出限度1倍;均判为符合规定。
6.2每片重量与平均片重相比较,超出重量差异限度的药片多于2片;或超出重量差异限度的药片虽不多于2片,但其中1片超出限度的1倍;均判为不符合规定。
海关允许的重量误差

海关允许的重量误差海关允许的重量误差在国家相关法律法规中有明确规定,主要是为了确保货物的准确计量和公平贸易的进行。
重量误差是指实际重量与申报重量之间的差异,通常以百分比或绝对值方式计算。
在国际贸易中,海关重量误差的允许范围是由国际组织和国家相关机构制定的标准来确定的。
其中,最重要的标准是国际贸易中使用的《国际贸易术语解释通则》(INCOTERMS)。
INCOTERMS是由国际商会制定的一套通用贸易条件,包括关于货物购销双方在交货、风险转移和费用负担等方面的规定。
在INCOTERMS中,常用的术语如CIF(成本、保险和运费),FOB(离岸价)等,这些术语中规定了买卖双方对偏差的容忍度。
例如,根据INCOTERMS规定的CIF术语,买方在接收到货物之前需要支付海外运输中的费用,而卖方需要购买保险来覆盖货物在运输过程中的风险。
在这种情况下,海关允许的重量误差通常为±5%。
也就是说,如果货物的实际重量与申报重量之间的差异在±5%以内,海关将不会进行进一步的调查和处罚。
除了INCOTERMS之外,国际贸易中还有其他标准和规定,如货物计量的国际标准——《国际计量大会静电学公约》(CIPM-1981),以及世界海关组织(WCO)颁布的《商品和服务分类》,这些都对重量误差的允许范围进行了详细规定。
在国内贸易中,国家相关法律法规对重量误差也有明确规定。
例如,对于涉及计量的商品,我国法律规定了强制性的计量认证和检验制度,其中包括对重量误差的检查。
例如,根据《计量法》的规定,对于液体和散装货物,重量误差的允许范围通常为±0.5%。
此外,我国还制定了一系列标准和规范,如《商品计量检验规范》、《出入境货物计量管理办法》等,对重量误差的检查、认证和管理进行了详细规定。
这些标准和规范是根据国际标准和我国实际情况制定的,旨在保护消费者权益、维护市场秩序和促进贸易发展。
总的来说,海关允许的重量误差在国家相关法律法规和国际标准中有明确规定。
023-片剂平均片重和片重差异的测定标准操作规程
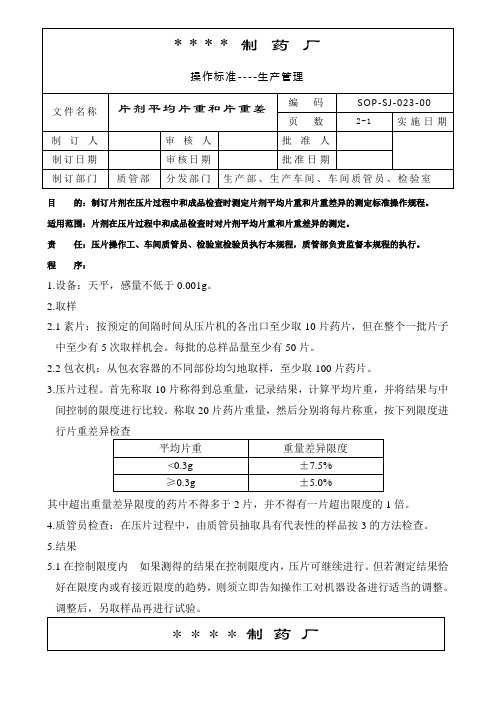
目的:制订片剂在压片过程中和成品检查时测定片剂平均片重和片重差异的测定标准操作规程。
适用范围:片剂在压片过程中和成品检查时对片剂平均片重和片重差异的测定。
责任:压片操作工、车间质管员、检验室检验员执行本规程,质管部负责监督本规程的执行。
程序:1.设备:天平,感量不低于0.001g。
2.取样2.1素片:按预定的间隔时间从压片机的各出口至少取10片药片,但在整个一批片子中至少有5次取样机会。
每批的总样品量至少有50片。
2.2包衣机:从包衣容器的不同部份均匀地取样,至少取100片药片。
3.压片过程。
首先称取10片称得到总重量,记录结果,计算平均片重,并将结果与中间控制的限度进行比较。
称取20片药片重量,然后分别将每片称重,按下列限度进行片重差异检查其中超出重量差异限度的药片不得多于2片,并不得有一片超出限度的1倍。
4.质管员检查:在压片过程中,由质管员抽取具有代表性的样品按3的方法检查。
5.结果5.1在控制限度内如果测得的结果在控制限度内,压片可继续进行。
但若测定结果恰好在限度内或有接近限度的趋势,则须立即告知操作工对机器设备进行适当的调整。
调整后,另取样品再进行试验。
5.2超出控制限度一旦测得的结果超出控制限度,则须重新取样称重以证实结果。
如果第二次测定的结果与上次一致时,应立即通知操作工对过程进行适当的调整。
对压片机调整后,取一新样品,再次测定,一旦再次测定结果在控制范围内,则通知操作工必须更换另一收集容器收集药片。
在调整前,最后一次测定结果合格与调整后重得到合格品之间压出的药片必须与该批合格的药片分开放置,并在容器上标上“待处理”标签,直到作出有关的决定为止。
如工艺过程调整后片重仍超过控制限度,则必须立即报告质管员及质管部。
重量差异 溶出度 含量均匀度

一、重量差异检查法1、概述(1)定义:指按规定称量方法测得每片的重量与平均片重之间的差异程度。
(2)检查意义:在片剂的生产过程中,由于颗粒的均匀度、流动性、生产设备等原因,会引起片剂重量的差异,从而引起各片间主药的含量差异。
若超限,则难以保证临床用药的准确剂量,剂量过小,不能达到疗效;剂量过大,可能引起严重的不良反应甚至中毒。
因此,进行重量差异检查对于保证临床用药的安全性和有效性是十分必要的。
2、操作方法取20片,精称总重,计算平均片重准确称量各片的重量,计算每片的片重与平均片重差异的百分率。
表片剂重量差异限度平均片重重量差异限度0.30g以下±7.5%0.30g或0.30g以上±5%3、结果判定(1)每片片重均未超出允许片重范围;或与平均片重相比较,均未超出重量差异限度;或超出差异限度的药片不多于2片,且未超出限度1倍;均应判为符合规定。
(2)每片片重与平均片重相比较,超出差异限度的药片多于2片;或超出差异限度的药片不多于2片,但其中1片且超出限度的1倍;均应判为不符合规定。
4、注意事项(1)重量差异检查时,在称量前后,均应仔细查对药片数。
称量过程中,应避免用手直接接触供试品。
已经取出的药片,不得再放回供试品原包容器内。
(2)重量差异检查时,遇有检出超出重量差异限度的药片,应另器保存,供必要时的复核用。
(3)糖衣片应在包衣前检查片芯的重量,并应符合规定,符合规定后方可包衣。
包糖衣后不再检查重量差异。
薄膜衣片应在包薄膜衣后应检查重量差异检查并符合规定。
(4)开启安剖瓶装粉针时,应避免玻璃屑落入或溅失。
开启橡皮塞铝盖玻璃瓶装粉时,应先稍稍打开橡皮内塞使平内外的气压平衡,再盖紧后称重(5)用水、乙醇洗涤倾去内容物后的容器时,慎勿将瓶外编号的字迹擦去,以免影响称量结果,并将空容器与原橡皮塞或安剖颈部配对放于原固定位置。
(6)空容器的干燥,一般用60-70℃加热1-2小时,也可在干燥器内干燥较长时间。
重量差异培训

颗粒剂装量差异检查法
单剂量包装的颗粒剂,照下述方法检查 应符合规定。检查法 取供试品10 袋,分别 称定每袋内容物的重量,每袋装量与标示 装量相比较,按下表中的规定,超出装量 差异限度的不得多于2 袋,并不得有1 袋超 出限度1 倍。
标 示 装 量 1 g 及1g 以下 1g 以上至 1.5g 1.5g 以上 至6g
丸剂重量差异检查法
操作方法: 以10 丸为1 份(丸重1.5g 及1.5g 以上 的以1 丸为1 份),取供试品10 份,分别 称定重量,再与每份标示重量(每丸标示 量×称取丸数)相比较(无标示重量的丸 剂,与平均重量比较)。 结果判定: 按下表的规定,超出重量差异限度的 不得多于2 份,并不得有1 份超出限度1 倍。
±15% ±12% ±10% ±7.5%
包糖衣滴丸应检查丸芯的重量差异并符规定, 包糖衣后不再检查重量差异。包薄膜衣滴丸 应在包衣后检查重量差异并符合规定;凡进 行装量差异检查的单剂量包装滴丸剂,不再 检查重量差异。
注意事项
1、在称量前后,均应仔细查对片数。称量过 程中,应避免用手直接接触供试品。已取 出的药片,不得再放回供试品原包装容器 内。 2、栓剂重差检验时如室温较高,应适宜方法 降温,以免栓剂因室温过高而融化或软化 难以操作。 3、合剂装量差异用玻璃量具的选择 4、天平的使用 5、取样的代表性
滴丸剂重量差异检查法
操作方法: 取供试品20 丸,精密称定总重量,求得平 均丸重后,再分别精密称定每丸的重量。 每丸重量与平均丸重相比较。 操作方法: 按下表中的规定,超出重量差异限度的 不得多于2 丸,并不得有1 丸超出限度1 倍。
平均丸重
重量差异限度
0.03g 及0.03g 以下 0.03g 以上至0.1g 0.1g 以上至0.3g 0.3g 以上
片剂重量差异检查法操作规程

目的:制订片剂重量差异检查法操作规程,明确其检查法的操作。
依据:《中华人民共和国药典》2010年版;《中国药品检验标准操作规范》2010年版。
范围:片剂重量差异检查法的操作。
责任:质检室主任、化验员。
内容:1简述1.1本法适用于片剂的重量差异检查。
凡规定检查含量均匀度的片剂,一般不再进行重量差异的检查。
1.2在片剂生产中,由于颗粒的均匀度和流动性,以及工艺、设备和管理等原因,都会引起片剂重量差异。
本项检查的目的在于控制各片重量的一致性,保证用药剂量的准确。
2仪器与用具2.1分析天平感量0.1mg(适用于平均片重0.30g以下的片剂)或感量1mg(适用于平均片重0.30g或0.30g以上的片剂)。
2.2扁形称量瓶。
2.3弯头或平头手术镊子。
3操作方法:3.1取空称量瓶,精密称定重量;再取供试品20片,置此称量瓶中,精密称定。
两次称量值之差即为20片供试品的总重量,除以20,得平均片重(m)。
3.2从已称定总重量的20片供试品中,依次用镊子取出1片,分别精密称定重量,得各片重量。
4注意事项:4.1在称量前后,均应仔细查对药片数。
试验过程中,应避免用手直接接触供试品。
已取出的药片,不得再放回供试品原包装容器内。
4.2遇有检出超出重量差异限度的药片,宜另器保存,供必要时的复核用。
4.3糖衣片应在包衣前检查片芯的重量差异,符合规定后方可包衣。
包衣后不再检查重量差异。
4.4薄膜衣片在包衣后也应检查重量差异。
5记录与计算:5.1记录每次称量数据。
5.2求出平均片重(m),保留3位有效数字。
修约至两位有效数字,选择重量差异限度。
5.3按下表规定的重量差异限度,求出允许片重范围(m±m×重量差异限度)。
6结果与判定6.1每片重量均未超出允许片重范围(m±m×重量差异限度);或与平均片重相比较(凡无含量测定的片剂,每片重量应与标示片重比较),均未超出上表中的重量差异限度;或超出重量差异限度的药片不多于2片,且均未超出限度1倍;均判为符合规定。
甲硝唑片的质量检测—甲硝唑片检查

检查方法
取10片,测定每片以标示量为100的相对含 量X,计算均值X、S和A值:A= 100 – X , 判断:当A+1.80S≤15.0时,符合规定
A+S>15.0,不符合规定 A+1.80S>15.0,且A+S≤15.0,取20 片复试计算30片的值X、S和A值, A+1.45S ≤ 15.0,符合规定 A+1.45S > 15.0,不符合规定
表1 片剂重量差异限度
平均片重 0.30g以下 0.30g或0.30g以上
重量差异限度 ±7.5% ±5%
判断:依据Ch.P对片剂重量差异限度的规 定,20中超出重量差异限度的药片不得多 于2片,并不得有1 片超出限度的1倍。
注意
糖衣片的片心应检查重量差异并符合规 定,包糖衣后不再检查重量差异。
薄膜衣片应在包薄膜衣后检查重量差异 并符合规定。
适用范 围
检查指 标
特点
重量差异试快速
含量均匀度
小剂量片剂或教难混合均 匀者
每片含量偏离标示量的程 度 准确
大肠杆菌 不得检出
(6)溶出度的检查
溶出度
指药物从片剂或胶囊剂等固体制剂 在规定溶剂中溶出的速度和程度。
是一种模拟口服固体制剂在胃肠道里 的崩解和溶出情况的体外试验法
主要用于难以溶解的药物及控释、缓 释制剂
方法 取6片(个)分别置溶出度仪的6个吊 篮(或烧杯)中,37±0.5℃恒温下,在规 定的溶液里按规定的转速操作,在规定时 间内测定药物的溶出量
(4)分散均匀性检查
分散片 照下述方法检查,应符合规定。
检查法: 取供试品2片,置20℃±1 ℃的
装量、重量差异和装量差异的限度

化学药品(装量、重量差异、装量差异)剂型类别检验量平均片重重量差异限度片剂重量差异20 片0.30g 以下±7.5%0.30g 及0.30g 以上±5%胶囊剂装量差异20 粒0.30g 以下±10%0.30g 及0.30g 以上±7.5%栓剂重量差异10 粒 1.0g 及 1.0g 以下±10% 1.0g 以上及 3.0g ±7.5% 3.0g 以上±5%丸剂重量差异20 粒0.03g 及0.03g 以下±15%0.03g 以上至0.30g ±10%0.30g 以上±7.5%颗粒剂装量差异(单剂量包装)10 袋1.0g 及1.0g 以下±10%1.0g 以上至1.5g ±8%1.5g 以上至6.0g ±7%6.0g 以上±5%装量(多剂量包装)见最低装量检查法凝胶剂装量见最低装量检查法口服溶液剂装量见最低装量检查法口服混悬剂装量见最低装量检查法口服乳剂装量见最低装量检查法注射液注射用浓溶液(装量)标示装量检验量增加量易流动液黏稠液0.5ml 5 支0.10ml 0.12ml 1ml 5 支0.10ml 0.15ml 2ml 5 支0.15ml 0.25ml 5ml 3 支0.30ml 0.50ml 10ml 3 支0.50ml 0.70ml 20ml 3 支0.60ml 0.90ml 50ml 3 支1.0ml 1.5ml 50~500ml 见最低装量检查法注射用无菌粉末装量差异5 瓶0.05g及0.05g以下±15%0.05g 以上至0.15g ±10%0.15g 以上至0.50g ±7%0.50g 以上±5%中药(装量、重量差异、装量差异)剂型类别检验量平均片重重量差异限度片剂重量差异20 片0.30g 以下±7.5%0.30g 及0.30g 以上±5%胶囊剂装量差异10 粒±10%栓剂重量差异10 粒1g 及1g 以下±10%1g 以上至3g ±7.5%3g 以上±5%丸剂重量差异(一法)(按丸数服用)10 份0.05g 及0.05g 以下±12%0.05g 以上至0.1g ±11%0.1g 以上至0.3g ±10%0.3g 以上至1.5g ±9%1.5g 以上至3g ±8%3g 以上至6g ±7%6g 以上至9g ±6%9g 以上±5%重量差异(二法)(按重量服用)10 份0.05g 及0.05g 以下±12%0.05g 以上至0.1g ±11%0.1g 以上至0.3g ±10%0.3g 以上至1g ±8%1g 以上至2g ±7%2g 以上±6%装量差异(单剂量包装)10 袋0.5g 及0.5g 以下±12%0.5g 以上至1g ±11%1g 以上至2g ±10%2g 以上至3g ±8%3g 以上至6g ±6%6g 以上至9g ±5%9g 以上±4%装量装量以重量标示的多剂量包装照最低装量检查法[丸剂说明] 第一法:以一次服用量最高丸数为1 份(丸重1.5g 及1.5g 以上的丸剂以1 丸为1 份;丸重0.015g 以上的丸剂一次服用量最高丸数超过10 丸的,或丸重0.015g 及0.015 以下的丸剂一次服用量最高丸数不足10 丸的,以10 丸为1 份),取供试品10 份。
崩解时限片剂的质量检查种类溶剂崩解时限

第五节 片剂的质量检查
第五节 片剂的质量检查
(一)性状
检查结果应符合下列规定: 完整光洁;色泽均匀
杂色点80~100目应<5%, 麻片<5% 中药粉末片(除个别外)<10% 不得有严重花斑及特殊异物 包衣片有畸形者不得>0.3% 3
3பைடு நூலகம்
第五节 片剂的质量检查
(二)重量差异
检查法:取供试品20片,精密称定总重量,求得平均片重后,再分别精密称定每 片的重量,每片重量与标示片重(无标示片重与平均片重)相比较,超出重量差 异限度的不得多于2片,并不得有1片超出限度的1倍。
平均重量 0.3g以下 0.3g及0.3g以上
重量差异限度 ±7.5% ±5.0% 4
4
第五节 片剂的质量检查
(三)崩解时限
种类 中药粉末片 浸膏(半浸膏)片
糖衣片 薄膜衣片 肠溶衣片
泡腾片
溶剂 蒸馏水 蒸馏水 蒸馏水 盐酸溶液
蒸馏水
崩解时限(min)
30 60 60 60 盐酸溶液(9→1000,人工胃液)中检查2h 不得有裂缝、崩解或软化现象 磷酸盐5缓冲液(pH 6.8,人工肠液)中1h 应全部崩解 5
平均重量重量差异限度03g以下7503g及03g以上50三崩解时限三崩解时限种类溶剂崩解时限min中药粉末片浸膏半浸膏片糖衣片薄膜衣片肠溶衣片泡腾片蒸馏水蒸馏水蒸馏水盐酸溶液蒸馏水30606060盐酸溶液91000人工胃液中检查2h不得有裂缝崩解或软化现象磷酸盐缓冲液ph68人工肠液中1h应全部崩解1
5
第五节 片剂的质量检查
(四)硬度和脆碎度
1.硬度 一般用硬度测定器测定
2.脆碎度 用脆碎度测定仪测定。减失重量一般应低于1.0% 6
片剂的质量检测

6、溶出度的检查
溶出度
指药物从片剂或胶囊剂等固体制剂在 规定溶剂中溶出的速度和程度。
是一种模拟口服固体制剂在胃肠道里 的崩解和溶出情况的体外试验法
主要用于难以溶解的药物及控释、缓 释制剂
方法 取6片(个)分别置溶出度仪的6个吊 篮(或烧杯)中,37±0.5℃恒温下,在规 定的溶液里按规定的转速操作,在规定时 间内测定药物的溶出量
适用 范围
检查 指标
特点
重量差异试验 普通片剂 (混合均匀)
片重差异 简便快速
含量均匀度
小剂量片剂或教 难混合均匀者
每片含量偏离标 示量的程度 准确
五、片剂中辅料的干扰及其排除
1、糖类: 干扰:氧化还原滴定 赋形剂中含有淀粉、糊精、蔗糖、乳糖 等,它们水解后均生成葡萄糖,葡萄糖为 醛糖,具有还原性,干扰氧化还原法,因 此,采用氧化还原法测定药物时,应考虑 到其干扰。
计算 每片(个)溶出量相当于标示量的%
判断标准
(1) 6片的溶出量均≥Q (2) Q > 仅1片>Q -10%
平均溶出量≥Q (3) 仅1片<Q -10%
另取6片复试:12片中 仅2片<Q -10% 平均溶出量≥Q
符合规定 符合规定
符合规定
7、含量均匀度的检查
含量均匀度 定义:指小剂量片剂、膜剂、胶囊剂 或注射用无菌粉末等制剂每片(个)含 量偏离标示量的程度。
照下述方法检查,应符合规定。 检查法: 取供试品2片,置20℃±1 ℃的 100ml水中,振摇3分钟,应全部崩解 并通过2号筛。
5、微生物限度检查
口腔贴片、阴道片、阴道泡腾片和外用 可溶片等局部用片剂照微生物限度检查法检 查,应符合规定。
规定 细菌
≤1000个/g
中药药剂学:颗粒剂的质量要求

《中国药典》1995年版⼀部附录颗粒剂(冲剂)通则要求检查外观、粒度、⽔分、溶化性、硬度、装量差异及重量差异。
卫⽣部还规定了卫⽣标准。
1.外观 颗粒剂应⼲燥、颗粒均匀、⾊泽⼀致,⽆吸潮、软化、结块、潮解等现象。
2.粒度 除另有规定外,取单剂量包装的颗粒剂5袋(瓶)或多剂量包装颗粒剂1包(瓶),称定重量,置药筛内过筛。
过筛时,将筛保待⽔平状态,左右往返轻轻筛动3分钟。
不能通过⼀号筛和能通过四号筛的颗粒和粉末总和,不得超过8.0%。
3.⽔分 (1)颗粒剂,取供试品,照⽔分测定法(药典附录Ⅸ H)测定。
除另有规定外,不得过5.0%。
(2)块形冲剂,取供试品,破碎成直径3mm的颗粒,照⽔分测定法(药典附录Ⅸ H)测定。
除另有规定外,不得过3.0%。
4.溶化性 取供试品(颗粒剂10g;块形冲剂1块,称定重量),加热⽔20倍,搅拌5分钟,可溶性颗粒剂应全部溶化,允许有轻微浑浊;混悬性颗粒剂应能混悬均匀,并均不得有焦屑等异物;泡腾性颗粒剂遇⽔时应⽴即产⽣⼆氧化碳⽓,并呈泡腾状。
5.硬度 取供试品5块,从lm⾼处平坠于厚度2cm松⽊板上,不得有⼀块破碎(缺⾓、缺边不作破碎论)。
6.装量差异颗料剂装置差异限度标⽰装量装置差异限度1.0g或1.0g以下 ±10%1.0g以上⾄1.5g ±8%1.5g以上⾄6.0g ±7%6g以上 ±5% 单剂量包装的颗粒剂装量差异限度应符合左表规定。
检查法:取供试品10袋(瓶),分别称定每袋(瓶)内容物的重量,每袋(瓶)的重量与标⽰量相⽐较(有含量测定的与平均装量相⽐较),超出限度的不得多于2袋(瓶),并不得有1袋(瓶)超出限度1倍。
⾮单剂量⼤规格包装的颗粒剂不检查装量差异。
块形冲剂应符合重量差异规定。
7.重量差异块形冲剂重量差异限度标⽰装量装置差异限度1.5g以上⾄6.0g ±7%6g以上 ±5% 块形冲剂的重量差异限度应符合左表规定。
胶囊剂重量差异限度标准

胶囊剂重量差异限度标准
一、平均装量
胶囊剂的平均装量应符合规定,每个胶囊的装量应尽可能一致。
如果平均装量不符合规定,可能会影响药物的释放和吸收效果,从而影响治疗效果。
二、装量差异
胶囊剂的装量差异应符合规定,即每个胶囊的装量与平均装量的差异应在一定范围内。
如果装量差异过大,可能会影响药物的均匀性和稳定性。
三、崩解时限
胶囊剂的崩解时限应符合规定,即胶囊在规定条件下应能在一定时间内崩解并释放出药物。
如果崩解时限过长或过短,可能会影响药物的释放和吸收效果。
四、微生物限度
胶囊剂的微生物限度应符合规定,即不应含有过多的微生物。
如果微生物限度不符合规定,可能会影响药品的安全性和有效性。
五、杂质限量
胶囊剂的杂质限量应符合规定,即不应含有过多的杂质。
如果杂质限量不符合规定,可能会影响药品的质量和稳定性。
六、稳定性
胶囊剂的稳定性应符合规定,即在规定的储存条件下,不应发生明显的物理、化学和生物学变化。
如果稳定性不符合规定,可能会影响药品的质量和有效性。
七、胶囊壳厚度
胶囊壳的厚度应符合规定,过薄或过厚的胶囊壳可能会影响药物的稳定性、药物的释放和吸收效果。
八、外观质量
胶囊剂的外观质量应符合规定,即胶囊应无明显缺陷和破损。
如果外观质量不符合规定,可能会影响药品的质量和有效性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
标题:重量差异限度
重量差异限度
1 目的
本标准规定了重量差异限度的检测方法和操作要求。
2 范围
本标准规定了片剂的重量差异限度的检测方法和操作要求。
3 责任
QC检验员对本规程实施负责,QA负责监督。
4 引用标准
中华人民共和国药典2005版二部
5 规程
取供试品20片,精密称定总重量,求得平均片重后,在分别称定每片的重量,每片的重量与平均片重相比较(凡无含量测定的片剂,每片重量应与标示片重比较),按表中的规定,超出重量差异限度的不得多于2片,并不得有1片超出限度1倍。
