(完整版)配位聚合物2016年9月
高分子化学 第6章 配位聚合
(4)配位聚合引发剂与单体
①引发剂和单体类型
Ziegler-Natta引发剂
-烯烃 有规立构聚合
二烯烃 有规立构聚合
环烯烃 -烯丙基镍型引发剂:专供丁二烯的顺、反1,4聚合 极性单体 烷基锂引发剂(均相) 有规立构聚合 二烯烃 茂金属引发剂(所有乙烯基单体)
②引发剂的相态和单体的极性
非均相引发剂,立构规整化能力强
δ +CH
Mt CH2 δ -
R
过渡金属阳离 子Mt +对烯烃 双键 碳原子的 亲电进攻
插入反应包括两个同时进行的化学过程。
单体的插入反应有两种可能的途径:
一级插入
δδ+
CH CH2 R
Mt
+
CH CH2 R
δδ+
CH CH2 CH CH2 R R
Mt
不带取代基的一端带负电荷,与过渡金属相连 接,称为一级插入。
全同1,2 、间同1,2、顺式1,4-聚丁二烯和反式 1,4-聚丁二烯。
n CH CH CH 2 CH 2 4 3 2 1
1,2加成 3,4加成
[ CH2 CH ]n CH CH2 (R)
丁二烯的1,2或3,4加成有全同和间同二种立构规整聚合物。
[ CH2 CH2 ]n C C H H
顺式1,4-聚丁二烯-1,3
最初的Ziegler-Natta引发剂由两组分构成。 主引发剂 是周期表中Ⅳ~Ⅷ过渡金属化合物。
1955年意大利的Natta改进了Ziegler引发剂。用TiCl3和烷 基金属化合物组成的配位引发剂使丙烯聚合,结果得到高相 对分子质量、高结晶度、耐热150℃的聚丙烯,并于1957年 实现了工业化。 Natta还用这些引发剂使乙烯聚合,所得到的PE无支链、 结晶度也很高, 这种PE、PP具有高的立构规整度。 Ziegler-Natta引发剂的出现使高分子科学和高分子工 业的发展有了重大突破,从而在高分子科学中开创了一 个新的研究领域----配位聚合。 Ziegler和Natta两位学者也于1963年同时获得诺贝尔 化学奖。
高分子化学--配位聚合省名师优质课赛课获奖课件市赛课一等奖课件

变化手性碳原子C*旳近邻环境 一种等量R和S旳外消旋单体,聚合后得到也是等量外消旋 聚合物旳混合物,无旋光活性 采用一种光学活性引起剂,可变化R和S旳百分比
* CH2 CH CH3
S R / S= 50 / 50
OH
tBu C*H CH2OH (R) ZnEt2
Ⅳ~Ⅵ副族:
Ti Zr V Mo W Cr旳
卤化物 氧卤化物 乙酰丙酮基 环戊二烯基
主要用于 -烯烃旳 聚合
TiCl3(、、 ) 旳活性较高 MoCl5、WCl6专用于环烯烃旳开环聚合
Ⅷ族:Co、Ni、Ru、Rh 旳卤化物或羧酸盐 主要用于二烯烃旳聚合
共引起剂
Ⅰ~Ⅲ主族旳金属有机化合物 主要有: RLi、R2Mg、R2Zn、AlR3
低温下只能引起乙烯聚 合
活性提升,可引起丙烯 聚合
TiCl4Ti
又如: Cl2
与
VCl3
AlR3
或
组合
AlR2Cl
反应后仍为非均相, 烯烃旳高活性定向引起剂
3. 使用Z-N引起剂注意旳问题
主引剂是卤化钛,性质非常活泼,在空气中吸湿后发烟、 自燃,并可发生水解、醇解反应
共引起剂烷基铝,性质也极活泼,易水解,接触空气中 氧和潮气迅速氧化、甚至燃烧、爆炸 鉴于此: 在保持和转移操作中必须在无氧干燥旳N2中进行 在生产过程中,原料和设备要求除尽杂质,尤其是氧和 水分 聚合完毕,工业上常用醇解法除去残留引起剂
丁醚
N(C4H9)3
叔胺
加入第三组分旳引起剂称为第二代引起剂 引起剂活性提升到 5×104 g PP / g Ti 第三代引起剂,除添加第三组分外,还使用了载体,如:
配位聚合

7.6 茂金属引发剂
高活性:几乎 100%金属原子可形成活性中心,而Z-N 引发剂只有1~3%形成活性中心。 单一活性中心:茂金属催化剂具有明确的分子结构, 聚合反应在该分子上的一个位臵 ——过渡金属原子发 生,有时称为单活性位臵催化剂。产物的分子量分布 很窄,1.05~1.8。共聚物组成均一。
TiCl4-AlR3或TiCl4-AlR2Cl
在-78oC反应可形成溶于 烃类溶剂的均相引发剂 温度升高,发生不可逆变 化,转化为非均相 TiCl3-AlR3或VCl3-AlR2Cl 反应后仍为非均相, -烯烃的高活性定向引发剂。 低温下只能引发乙 烯聚合 活性提高,可引发 丙烯聚合
7.3 Ziegler-Natta 引发剂
配位聚合
7.1 引言
1938 年,英国 ICI 公司在高温( 180~200 oC )、高压
(150~300 MPa)条件下,以氧为引发剂,合成出了
低密度聚乙烯(LDPE) 1953年,德国化学家 Ziegler发现了乙烯低压(0.2~1.5
MPa)聚合的引发剂,合成出了支链少、密度大、结
根据聚合物的物 理性质进行测定
A975 全同螺旋链段特征吸收,峰面积 聚丙烯全同指数 K A1460 甲基的特征吸收,峰面积
7.3 Ziegler-Natta 引发剂
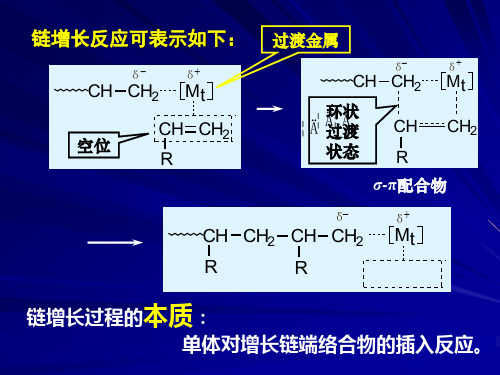
链增长反应 链增长过程的本质是 (以TiCl3-AlR3引发丙烯聚合为例): 单体对增长链端络合 物的插入反应 过渡金属
δδ+
δδ+
-烯烃聚合物的Tm大致随取代基增大而升高
HDPE
Tm (oC) 120
全同PP
175
聚3-甲基-1-丁烯
300
聚4-甲基-1-戊烯
高分子化学第6章配位聚合

四. 茂金属引发剂 由过度金属锆(Zr)或钛(Ti)与两个环戊二烯基或环戊
二烯基取代基及两个氯原子(或甲基)形成的有机金属络合 物和助催化剂甲基铝氧烷组成的 ,称作茂金属催化剂。是环 戊二烯基过渡金属化合物类的简称。
链增长反应可表示如下
δ-
CH CH2
δ+ 过渡金属
Mt
δ-
δ+
CH CH2 Mt
空位
CH CH2 R
¦Ä¦环Ħ状Ä过 CH CH2 渡状态 R
δ-
δ+
CH CH2 CH CH2 Mt
R
R
2. 配位聚合的特点
单体首先在过渡金属上配位形成络合物 证据:乙烯和Pt、Pd生成络合物后仍可分离
制得了4-甲基-1-戊烯-VCl3的络合物
第六章 配位聚合
6.1 引言(Introduction) 6.2 配位聚合
6.3 聚合物的立构规整性(stereoregularity) 6.4 α-烯烃的配位阴离子聚合
6.1 引言(Introduction)
1. 低密度聚乙烯
二十世纪30年代
ICI 公司
乙烯+苯甲醛
高温(180-200℃)
压力(180-200MPa)
2. 引发剂的作用 1) 提供引发聚合的活性种; 2) 提供独特的配位能力(反离子同单体和增长链的配位促使单
体分子按一定的构型进入增长链)起着连续定向模板作用。 控制方式: a. 引发中心控制:反离子与取代基之间的相斥作用-全同结构 b. 增长链端控制:相邻单体取代基间的相斥作用-间同结构
配位聚合

25
4)茂金属引发剂 即环戊二烯基(简称茂,Cp)过渡金属化合物
Cl Ti Cl Cl
化学组成(三部分)
Ⅳ 族过渡金属,如锆(Zr)、钛(Ti)、铪(Hf) + 茂型配体:至少一个茂基(Cp)、茚基(Ind)、芴基(Flu) 或其的衍生物(环上氢被烷基取代) + 非茂配体,如氯、甲基、苯基等。
26
24
80年代中:第四代(化学组分与第三代相同,但采用 球形载体),不但具有第三代引发剂高活性、高等规 度的特点,而且球形大颗粒流动性好,无需造粒(可 直接进行加工);采用多孔性球形引发剂还可通过分 段聚合方法制备聚烯烃合金。
第五代
Ziegler-Natta
Single-Site
单活性中心引发剂:茂后引发剂(尚在研发中) 茂金属催化剂(已工业应用)
δ+ δ
CH2 CH R
Mt
+
CH2 CH R
δ+ δ
CH2 CH CH2 CH R R
Mt
丙烯的间同聚合为二级 插入,得到间同聚丙烯。
7
几种聚合名称在含义上的区别: 配位聚合、络合聚合:在含义上是一样的,可互用。 均指采用具有配位能力的引发剂、链增长都是单体 先在活性种的空位上配位并活化,然后插入烷基金属键 中。可形成有规立构聚合物,也可以是无规聚合物。 一般认为,配位聚合比络合聚合意义更明确。 Ziegler-Natta聚合: 采用Ziegler-Natta引发剂的任何单体的聚合或共聚合。 所得的产物可以是立构规整的,也可以是无规的。
(E)反式
反-1,4-聚异戊二烯
CH3 CH3
|
CH2
|H
CH3 CH2 CH2 CH2
|
第六章配位聚合

第六章 配位聚合6.1引言乙烯 丙烯和其他a-烯烃为石油裂解懂得主要产物30年代 仅作为燃料后 引发剂高温高压 PE (高压) 1953 Zieglev (德) 70~5034常压、AlEt Ti -θ HDPE 1954 Natta (意) Ti 3θ35)(GH Al - PP接着 Goodrich-Fire 公司 Ti 3524)(H C Al -θ 高顺式1、4-聚异戊二烯(天然橡胶) 同时 Fire-stene 轮胎和橡胶公司 锂或烷基锂(Z-N 引发剂)以后 以金属有机化合物-过渡金属化合物的洛合体系作引发剂单体配位而后聚合,聚合产物呈定向聚合—洛合聚合,配位聚合,定向聚合 (区别)常用术语的区别① 配位聚合和洛合为同义词—采用具有配位(或洛合)能力的引发剂,链增长(有时包括引发)都是单体先在活性种的空位上配位(洛合)并活化,然后插入烷基—金属键(R —M )中。
(配位比洛合表达的意义更明确)② 定向聚合和有规立构聚合是词义词—按IUPAC 规定,均指以形成有规立构聚合物为主的聚合过程。
③ Ziegler —Natto 聚合—指采用Ziegler —Natto 引发剂的任何单体的聚合或共聚合。
所得聚合物可以是立构规整的,也可以是无规聚合物。
6.2 结合物的立构规整性配位聚合,除R P 、n X 外,首先要考虑立构规整性问题。
异构现象—在有机化学中将分子式相同而结构不同因而性质不同的化合物叫异构体,这种现象称~分两类① 结构异构—由于分子中原子或基团相互连接次序不同引起的:如:头—尾和头—头或尾—尾相连的聚合物结构异构体② 立体异构 —由于分子中原子或基团相互连接次序不同引起的,称构型聚合物中同样存在复杂的立体异构现象⎭⎬⎫⎩⎨⎧几何异构光学异构 即:聚合物分子组成和结构相同,只是构型不同。
一、 立体异构⒈光学异构。
(存在手性中心)⎩⎨⎧*(左)右S R C )( —取代基(原子)在手性中心的排布顺序不而产生的立体异构α—烯烃聚合 NCH 2 =CH-R → —CH 2-CH-CH 2-CH-全同立构(等规)各个手性中心*C 构型相同,如~RRRR ~或~SSSS ~(St-pp)无规(at-pp ):手性中心的构型呈无规排列。
配位聚合

3、立构规整性(重要概念) 立构规整聚合物:是指那些由一种或两种构 型的结构单元(即手性中心)以单一顺序重 复排列的聚合物。 立构规整度:又称为定向度或定向指数,指 立构规整性聚合物在整个聚合物中所占的重 量百分含量。
问题:在合成过程中,如何控制 聚合物的立构规整性?
配位聚合及其引发剂体系等
7.2 配位聚合和定向聚合
7.1 聚合物的立体异构
结构异构:元 素组成相同而 原子或基团键 接位置不同。
配位聚合所涉及的异构现象
1、几何异构(顺反异构)
(1)形成:取代基在双键或环形结构平面 两侧的空间排列方式不同而造成的。 (2)结构特点:主链上有“=”或“环” 顺式
CH CH2 CH CH2 CH2 CH CH CH2
不足 只解释了引发和增长,没有解释立 构的形成原因
(2)单金属机理 Ti上引发,Ti上增长
特点 解释了立体构型的形成原因 对共引发剂的考虑少 不足
单体在Ti-C键间插入与空位回跳交 替进行的可能性
乙丙橡胶的介绍
因为大量甲基的存在破坏了聚乙烯的高度结构对称性,
不结晶而成为橡胶。 分子链上不含双键,所以耐臭氧、耐化学品、耐老化、 耐候性最佳。 密度小,有优异的电性能和耐油性,广泛用于电线电 缆、汽车部件、耐热密封件、传送带和日用生活品。 也因为分子链上不含双键,所以只能采用过氧化物进 行自由基型链转移硫化,硫化速度慢,粘接性能差。 采用加入少量共轭双烯作为第三单体进行三元共聚来
碳-碳双键过渡金属引 自由基聚合、离子聚 发剂的活性中心的空位 合、配位聚合 上配位 有规或无规 络合聚合、插入聚合 有规 有规立构聚合
产物 别称 举例
Ziegler-Natta引发剂引 BuLi引发丁二烯聚合 发苯乙烯聚合
第七章配位聚合

第七章配位聚合一、名称解释配位聚合:指单体分子首先在活性种的空位处配位,形成某些形式(σ-π)的配位络合物。
随后单体分子插入过渡金属(Mt)-碳(C)中增长形成大分子的过程,所以也可称作插入聚合。
络合聚合:与配位聚合的含义相同,可以互用。
络合聚合着眼于引发剂有络合配位能力,一般认为配位聚合比络合聚合意义更明确。
定向聚合:也称有规立构聚合,指形成有规立构聚合物的聚合反应,配位络合引发剂是重要的条件。
异构体:分子式相同,但原子相互联结的方式或顺序不同,或原子在空间的排布方式不同的化合物叫做异构体。
构象异构:由单键内旋转造成的立体异构现象。
立体构型异构:原子在大分子中不同空间排列所产生的异构现象。
对映异构:又称手性异构,由手性中心产生的光学异构体R型和S型。
顺反异构:由双键引起的顺式和反式的几何异构,两种构型不能互变。
全同立构:将碳-碳主链拉直成锯齿形,使处在同一平面上,取代基处于平面的同侧,或相邻手性中心的构型相同。
间同立构:若取代基交替地处在平面的两侧,或相邻手性中心的构型相反并交替排列,则称为间同立构聚合物。
全同聚合指数:一致立构规整度的表示方法,指全同立构聚合物占总聚合物的分数。
立构规整度:立构规整聚合物占聚合物总量的百分数。
二、选择题1. 氯化钛是α-烯烃的阴离子配位聚合的主引发剂,其价态将影响其定向能力,试从下列3种排列选出正确的次序( A )A TiCl3(α,γ,δ) > α- TiCl3-AlEtCl2>TiCl4B TiCl2>TiCl4>TiCl3(α,γ,δ)C TiCl4>TiCl3(α,γ,δ) > TiCl22. 下列聚合物中哪些属于热塑性弹性体(d和e)(a) ISI (b)BS (c) BSB (d)SBS (e) SIS3. 下列哪一种引发剂可使乙烯、丙烯、丁二烯聚合成立构规整聚合物?(1)n-C4H9Li/正己烷(2)萘钠/四氢呋喃(3) TiCl4-Al(C2H5)3(4) α- TiCl3-Al(C2H5) 2Cl(5)π-C3H5NiCl (6) (π-C4H7)2Ni4. 下列哪一种引发剂可使丙烯聚合成立构规整聚合物?(D)(A)n-C4H9Li/正己烷(B)萘钠/四氢呋喃(C) TiCl4-Al(C2H5)3(D) α- TiCl3-Al(C2H5) 2Cl三、简答题1. 聚乙烯有几类?如何合成?结构与性能有什么不同?与生产方法有何关系?答:聚乙烯主要有三类:低密度聚乙烯(LDPE),高密度聚乙烯(HDPE),线形低密度聚乙烯(LLDPE)。
第七章配位聚合《配位聚合》

第七章配位聚合《配位聚合》
* CH2 CH CH3
S
R / S= 50 / 50
Ziegler催化剂马上受到意大利科学家Natta的重视, 并在此基础上1954年发展成为可使α-烯烃聚合得到立 构规整聚合物的通用催化剂(TiCl3/AlEt3)。主要是合 成等规聚丙烯,后来又扩展到环状烯烃。
第七章配位聚合《配位聚合》
这类催化剂的重要性之一在于实现了丙 烯的定向聚合,得到高分子量立构规整性 聚丙烯。这类聚合反应的链增长机理与前 述自由基、正、负离子均不同。在高分子 科学领域起着里程碑的作用,于1963年获 得诺贝尔化学奖。
14CH3OH 14CH3O- + H+
第七章配位聚合《配位聚合》
得到的聚合物无14C放射性,表明加上的是H+,而 链端是阴离子。
烯烃在金属-碳键上配位,然后发生重排和插入, 实现链增长,增长链与金属连接。这种金属-碳键 是极化的,链末端碳呈负电性,金属呈正电性, 因此,配位聚合属于配位阴离子聚合。
增长反应是经过四元环的插入过程
δ-
δ+
增长链端阴离
CH CH2 Mt 过 渡 金 属 阳 离
子对烯烃双键 β碳原子的亲 核进攻
δ+CH R
子 Mt+ 对 烯 烃 CH2δ- 双键α碳原子的
亲电进攻
插入反应包括两个同时进行的化学过程
第七章配位聚合《配位聚合》
单体的插入反应有两种可能的途径 一级插入
(2-甲基咪唑)配位聚合物的合成、结构及性质研究

中文摘要
咪唑及其衍生物常用于构筑金属有机框架配位化合物,两个2-甲基咪唑通过桥连作用可形成独特的拓扑结构和新颖的配位聚合物。
本论文用2-甲基咪唑柔性配体1,4-二(2-甲基咪唑-1-基)丁烷(bib)和过渡金属Co(II),Cd(II),Cu(II),Zn(II),Ni(II)以及1,3-金刚烷二甲酸(H2ada),5-氨基间苯二甲酸(H2aip),5-羟基间苯二甲酸(H2hip),1,4-萘二甲酸(H2ndc),邻苯二甲酸(H2bdc),对苯二乙酸(H2bda),戊二酸(H2glu)配体,合成了9个配合物:{[Co2(bib)(ada)2]·0.5H2O}n(1),{[Co(bib)(aip)]·H2O}n(2),{[Co(bib)(ndc)]·0.5H2O}n(3),[Cd2(bib)(bdc)2]n(4),[Cd2(bib)(bda)2]n(5),[Cu2(bib)(glu)2]n(6),{[Zn(bib)(ndc)]·0.25H2O}n(7),[Ni(bib)(hip)]n(8)和{[Ni2(bib)(adc)2]·0.5H2O}n(9)。
Abstract
Imidazole and its deriverties are used to buldingmetal-organic coordinationpolymers, 2-methylimidazole by a bridging role may form a unique topolygy and novel coordination polymers.
图1-1化合物[(bmib)3(H2O)12]n中通过bib桥连的六角棱柱水簇图
变形单元包括两个独立水分子和半个配体链如图1,O1W呈现的是一个四面体几何结构,然而O2W既作为双氢键供体,又作为单氢键受体。两个水分子间的氢键产生苯环状的水簇,保留O(1W)和O(2W)之间的氢键,进一步扩展为六棱柱十二水簇。水簇物中O与O间的平均距离是2.829Å,比冰中的氧氧间距(2.759 Å)要长,比流动水中间距(2.85Å)的要短。O…O…O键角平均值为85.01(5)–113.85(7)°。值得一提的是,六棱柱十二水簇和理论融合六边形的结构一致,理论上没有(H2O)12立方体结构稳定。它的存在归因于水与配体间的氢键的相互作用。配体采用反式-反式-反式结构,并作为氢键接受体。两个2-甲基咪唑链由于中心对称而互相平行。有趣的是,每个水簇作为第二构筑单元,进一步通过四配位水分子和来自两个不同配体链上的六个2-甲基咪唑上的氮原子以氢键相连。这样一个有趣的三维超分子框架结构就形成了(如图1-2、1-3)。
《材化高分子化学》第7章 配位聚合

(1)α-烯烃
H C* R
由于连接C*两端的分子链不等长,或端基不同, C*应当是手性碳原子,但这种手性碳原子并不 显示旋光性,原因是紧邻C*的原子差别极小, 故称为“ 假手性中心”。
根据手性C*的构型不同,聚合物分为三种结构:
RR R R HHHH
全同立构 Isotactic
RH RH HRHR
C O OCH2CH3
聚丙烯酸乙酯
[NH( CH2 )6NHOC ( CH2 )4CO ]n
尼龙-66
结构单元间的连接方式不同,又会产生序列异构。
例如首尾相接和首首相接的异构现象。其首尾相接、 首首相接和无规序列相接的聚合物,其化学组成相 同,连接方式不同,性能也是不一样的。
(2)聚合物的立体异构体
什么是同分异构? 化学组成相同,聚合物分子中原子或原子团相互连接
的次序不同而引起的异构叫做同分异构,又称结构 异构。
例如:通过相同单体和不同单体可以合成化学组 成相同、结构不同的聚合物。
如结构单元为-[ C2H4O-] n的聚合物可 以是聚乙烯醇、聚环氧乙烷等。
[ CH2 CH ] n OH
聚乙烯醇
7.1 引言
乙烯、丙烯在热力学上均具有聚合倾 向,但在很长一段时间内,用上述聚合方 法,却无法得到高分子量的聚合物。
为什么?
乙烯的自由基聚合必须在高温高压下进行,由 于较易向高分子的链转移,得到支化高分子,即 LDPE。
丙烯利用自由基聚合或离子聚合,由于其自阻聚 作用,都不能获得高分子量的聚合产物。
插入反应是配位阴离子机理 由于单体电子的作用,使原来的Ti-C键活化,极化 的Ti+-C -键断裂,完成单体的插入反应。
立构规整性成因 单体如果在空位(5)和空位(1)交替增长,所得聚合物 将是间同立构,实际上得到的是全同立构。
配位聚合

19
7.2 聚合物的立构规整性
立构规整性与性能的关系
有规立构与非立构规整性聚合物间的性质差别很大。 性能的差异主要起源于分子链的立构规整性对聚合物结晶 的影响。 有规聚合物的有序链结构容易结晶,无规聚合物的无 序链结构则不易形成结晶,而结晶导致聚合物具有高的物 理强度和良好的耐热性和抗溶剂性,因此有规立构聚合物 更具有实际应用意义。
高 分 子 化 学
23
7.3 引发剂
Zieglar-Natta引发剂
广义 Ziegler-Natta 引发剂指的是由 IV~VIII 族过渡金 属化合物与I~III族金属元素的金属烷基化合物所组成的一 类引发剂。其通式可写为:
MtIV-VIIIX + MtI-IIIR 主引发剂 助引发剂 常用过渡金属化合物 :Ti、V、Cr、Co、Ni 的卤化 物(MtXn),氧卤化合物(MtOXn),乙酰丙酮基化合 物[Mt(acac)n],环戊二烯基卤化物(Cp2MtX2)。
高 分 子 化 学
22
7.3 引发剂
引发剂的类型和作用
类型: Zieglar-Natta 型。用于α-烯烃、二烯烃、环烯 烃的定向聚合; 烷基锂。在均相溶液体系中引发二烯烃和极性 单体,形成立构规整聚合物 π-烯丙基镍(π-C3H5NiX)。专供引发丁二烯的 顺式-1,4和反式-1,4聚合 茂金属引发剂。 作用: 提供活性中心; 引发剂残余部分(金属反离子)紧邻引发剂中 心,使单体分子按照一定的构型进入增长链, 使单体定位,起连续定向的模板作用。
目前,聚乙烯和聚丙烯已经成为生产量最大、用途最广 的合成材料。
高 分 子 化 学
3
7.1 配位聚合概述
配位聚合:烯类单体的碳-碳双键首先在过渡金属
31讲 第5章5 配位聚合

表5-16
聚合反应类型和聚乙烯的主要物性 自由基型 氧气 180 ~ 200 180 ~ 200 0.91 ~ 0.93 50 ~ 70 105 ~110 1938年 低 密 度 聚 乙 烯 LDPE高压聚乙烯 0.94 ~ 0.96 80 ~ 90 125 ~ 135 1953年 高密度聚乙烯HDPE 低压聚乙烯 配位型 TiCl4-AlEt3 50 ~ 70
如果两种构型的手性碳原子无规排列,即由两种构型 结构单元组成的链节以无规的顺序重复排列,这种聚合物 称为“无规立构聚合物”。 全同立构聚合物和间同立构聚合物都称有规立构聚合 物。 5)立构规整度及其测定方法: 立构规整度又称为定向度或定向指数,乃立构规整性聚合 物在整个聚合物中所占的重量百分含量。 立构规整度的测定方法最早采用溶剂溶解法,如用沸腾 的正庚烷萃取聚丙烯样品。目前多采用红外、核磁等方法。
条件和性质 引发剂 温度(℃) 压力(Mpa) 密度(g/cm3) 结晶度(%) 熔点(℃) 问世时间 俗 称
5.5.2 聚合物的立体规整性 1)结构异构:
_ _ _ ~ CH2 _ CH ~ ; ~ CH O ~ ; ~ CH2 CH2 O ~ OH CH3
聚乙烯醇; 聚乙醛; 聚氧化乙烯(聚环氧乙烷)
表5-17 不同立构异构体聚α烯烃和共轭二烯烃的物理性质 聚 烯 烃 高密度聚乙烯 无规聚丙烯 全同聚丙烯 全同聚1-丁烯 全同聚3-甲基-1-丁烯 全同聚4-甲基-1-戊烯 顺式1,4-聚丁二烯 反式1,4-聚丁二烯 全同1,2-聚丁二烯 间同1,2-聚丁二烯 1.01 0.97 0.96 0.96 146 126 156 相对密度 0.95 ~ 0.96 0.85 0.92 0.91 熔点(℃) 120 ~ 130 75 175 136 304 250
配位聚合coordinationpolymerization

第六章配位聚合 (coordination polymerization)6.1 聚合物的异构现象6.1.1 分类结构异构(构造异构,同分异构)立体异构构象异构构型异构几何异构(顺反异构)光学异构(对映体异构)6.1.2结构异构一单体:n-BuLi,s-BuLi,t-BuLi二聚合物1结构单元不同:聚乙烯醇,聚环氧乙烷,聚乙醛2结构单元同,连接次序不同:SBR(无规),SBS(嵌段),HIPS(接枝)6.1.3几何异构:顺式-聚丁二烯,反式-聚丁二烯6.1.4光学异构一单体无手性碳,产物有1 CH2=CRR'(丙烯,α-烯烃)只有一种(假)手性碳全同(等规),间同(间规),无规(Flash动画演示)2 RCH=CHR' 有两种(假)手性碳叠同双等规,对映双等规,叠同双间规(对映双间规)(Flash动画演示)二单体有手性碳,产物有立构选择聚合6.1.5光学异构聚合物的性能6.1.6立构规整度1 定义:立构规整聚合物占总聚合物的分数等规度,间规度,杂规度2立构规整度与结晶度的区别3 测定6.2 配位聚合与定向聚合6.2.1 配位聚合一定义:单体分子的碳-碳双键先在过渡金属催化剂的活性中心的空位上配位,形成σ-Π络合物,随后单体分子相继插入过渡金属-碳键中进行增长的聚合反应过程。
二增长过程(Flash动画演示)三特点四常用引发剂6.2.2 定向聚合一定义:以形成立构规整聚合物为主的聚合反应二种类1自由基聚合2离子聚合3 配位聚合4 模板聚合6.2.3 配位聚合与定向聚合的区别与联系6.3 Ziegler-Natta催化剂发展历程1953年,Ziegler等从一次以Et3Al为催化剂从乙烯合成高级烯烃的失败实验出发,意外地发现以乙酰丙酮的锆盐和Et3Al催化时得到的是高分子量的乙烯聚合物,并在此基础上开发了的乙烯聚合催化剂TiCl4 - AlEt3。
1954年Natta等把Ziegler催化剂中的主要组分TiCl4还原成TiCl3后与烷基铝复合成功地进行了丙烯聚合。
配位聚合物[cu(niph)(bpy)]的合成,结构及性质
![配位聚合物[cu(niph)(bpy)]的合成,结构及性质](https://img.taocdn.com/s3/m/629f2a28bfd5b9f3f90f76c66137ee06eff94efc.png)
配位聚合物[cu(niph)(bpy)]的合成,结构及性质Cu(niph)(bpy)即Copper(II) 聚萘酚(Bipyridyl)复配聚合物,是一种常
见的无机聚合物,具有扩展的六面体框架结构,以Cu2+离子为中心,
可以容纳18个氧化物离子或其他分子。
Cu(niph)(bpy) 复配聚合物的结构是以Cu2+为中心,可以容纳18个氧化物离子或其他分子,配位四
价萘酚(bipyridyl,简称bpy)大部分和分子有关,可以再氧化配位。
Bpy以草灰石配位形式存在,它是通过两个碳-氮键相连,它们呈面形
式把Cu2+离子八价包裹起来。
Cu(niph)(bpy) 复配聚合物主要用于离子交换、吸附、催化等应用,因
其富含配位基可以极大提高其离子交换性能。
由于Cu(niph)(bpy)复配
聚合物具有非常强的生物、环境友好的特性,因此可以用于容积分离、电化学催化、能量储存等多种应用。
例如,用于分离体外和体内的氢
离子,可在纳米结构中注入氢离子,然后在条件适宜的环境中控制它
们的相互作用,从而有效地分离和储存氢离子。
此外,Cu(niph)(bpy)复配聚合物也可作为类似生物膜的模板材料参与材料合成,用于分离、吸附和合成敏感分子,在这一方面具有前景。
近
年来,随着晶体学和材料学的不断发展,Cu(niph)(bpy) 复配聚合物的
研究也越来越受到人们的重视,在各种应用中得到越来越多的应用。
配位聚合物[Ag2(C6H4NO2)2]n的合成、结构及光物理
![配位聚合物[Ag2(C6H4NO2)2]n的合成、结构及光物理](https://img.taocdn.com/s3/m/cbbea90ceff9aef8941e0696.png)
限空 间结构 , 中两个A 其 g 离子 均为2 配位 , 并且是 晶体学不等效 的。 其重复单元 由【g1 C H N 2 和[g2 C H A ( (6 4 O ) A ( (6 4 ) ] ) N 2 两部分组 成。 g2与A ( 之 间 以及A () g1 O) 】 A( ) g2 ) g 与A ( 之间存在 多种 弱键作用 , 2 ) 使配合 物形 成 了3 D网络结构 。 同时
2 实验 部分
21 [ 2C6 NO2 】的合成 . Ag( H4 ) 2
取08 05mmo) NO3 于 8mL 中 ,得 到 .5g(. 1Ag 溶 水 溶 液( ;取 01 1mmo) 烟 酸 溶 于 8 水 中 ,加 I ) . g( 2 1 异 mL 入00 05mmo) O . g(. 2 1Na H,得 到 溶 液 () H ;搅 拌 加 热
第2 9卷 第 3 期
20 0 8年 6月
大
连
大
学
学
报
Vl .9 N0 3 o 2 . 1 Jn 2 0 u.08
J 0URNAL 0F DAL AN I UNI VERS TY I
配位聚 合物 [ g ( 6 4 o )]的合成 、结构及 光物理 A 2C H N 22
隋丽丽1 韩 茜2 牛淑云2 , 晶2 迟 玉 贤2 , , , 金 ,
(. 阳医学 院 基础 医学 院, 1沈 辽宁 沈 阳 10 3 ; . 宁师范大学 化 学化工学院, 宁 大连 1 6 2) 10 4 : 过水热合成法得  ̄[g(6 4 O ) 通 J t 2 HN 2】 A c 2 配聚物 的晶体结构 。 配合物为单斜 晶系 , 21c P(/ ) 空间群 , 具有一维无
第七章配位聚合

Outline
Ziegler (1898-1973)小传
未满22岁获得博士学位 曾在Frankfort, Heideberg大学任教 1936年任Halle大学化学系主任,后任 校长 1943年任Mak Planck研究院院长 1946年兼任联邦德国化学会会长 主要el化学奖 治学严谨,实验技巧娴熟,一生发表 论文200余篇
Outline 7.2 聚合物的立构规整性
构型异构
光学异构:手性中心产生的光学异 构体R(右)型和S(左)型, 也可称作对映体异构或者手性 异构 几何异构:由分子中双键而产生的几 何异构,即Z(顺式)和E(反 式)构型。
构象异构
Outline 7.2 聚合物的立构规整性
光学异构体
光学异构体(也称对映异构体),由于聚合物分子不对称性造成 的,是由手征性碳原子产生 构型分为R(右)型和S(左)型两种 对于 -烯烃聚合物,分子链中与R基连接的碳原子具有下述结构:
H CH2 C* CH3 CH2 H C* CH3 CH2 H C* CH3
由于连接C*两端的分子链不等长,或端基不同,C*应当是手征性 碳原子 但这种手征性碳原子并不显示旋光性,原因是紧邻C*的原子差 别极小,故称为“假手性中心”
Outline 6.2 聚合物的立构规整性
根据手性C*的构型不同,聚合物分为三种结构:
Outline
这是因为自由基与烯丙基单体反应时,存在加成和转移两个 竞争反应:
加成 Mn + H2C=CH CH3 转移 Mn CH2 CH CH3
二级碳自由基
MnH + H2C=CH
CH2
H2C
CH
CH CH2
烯丙基自由基
烯丙基氢很活泼,且链转移后生成的烯丙基自由基由于有双键 的共振作用非常稳定,因此对链转移反应非常有利。这样,由 于链转移反应极易发生,ktr>>kp,烯丙基单体聚合只能得到低 聚物,并且由于链转移生成的烯丙基自由基很稳定。不能引发 单体聚合,只能与其它自由基终止,发生自阻聚作用
(完整版)配位化学习题

配位化合物(01)1.历史上记录的第一种人工合成的配位化合物是( D )A.硫酸六氨合钴(II)B.普鲁士蓝C.硫酸四氨合铜(II)D.氯化二氨合银(I)2.配位化学的奠基人是( D)A.阿仑尼乌斯B.路易斯C.鲍林D.维尔纳3.下列说法中错误的是( C)A 配合物的形成体通常是过渡金属元素B 配键是稳定的化学键C 配键的强度可以和氢键相比较D 四面体配合物中,不存在顺反几何异构现象4.下列说法中正确的是(D )A 配位原子的孤电子对越多,其配位能力就越强B 电负性大的元素充当配位原子,其配位能力也强C CH3-C-OH配体是双齿配体D 在[Cu(en)2]2+中,Cu2+的配位数是412.下列说法中错误的是(D )A.对于Ni2+来说,当配位数为6时,无论是强场或弱场配体本位,只能采用SP3d2杂化B.对Ni2+来说,当本位数为4时,随配体的不同可采取dsp2或SP3杂化C.无论中心离子杂化轨道是d2sp2或SP3d2,其构型均为八面体形D.配合物中,由于存在配键,所以配合物都是弱电解质13.下列配体的本位能力的强弱次序为(B )->NH3>NCS->H2O>X-->NH3>NCS->H2O>X-C.X->H2O>CH->NH3>NCS-D.X->CN->H2O>NH3>NCS-14.在配位分子3KNO2.Co(NO3)2中,配位数为(D )A 3B 4C 5D 627.1 共价键和配位共价键的区别是什么?在NH4+离子中分别有多少个共价键和配位共价键?如何对其进行区分?解配位共价键是指一对电子由两个原子共享,且此电子是由其中的一个原子提供的;共价键是指一对共用电子对,一旦形成这两种键就没有区别。
在NH4+离子中有四个共价键,其中有一个是配位共价键。
27.4 求下列配位化合物的中心原子的配位数分别是多少?(a) [Mo(CN)8]4-中的钼(b)Cu(en)22+中的铜(en为乙二胺)解(a) 8 (b) 427.7 指出下列各金属中心离子的特征配为数:(a) CuⅠ(b) CuⅡ(c)AlⅢ(d) CoⅢ(e) ZnⅡ(f) FeⅡ(g) FeⅢ(h) AgⅠ。
《高分子化学》教案第8章配位聚合

第八章立构规整聚合和配位聚合本章要点:1.聚合物的异构:聚合物有多种异构形式,除结构单元的原子与基团排列方式、结构单元的连接方式以及链结构与链构象以外,还有聚合物的立体异构。
聚合物的立体异构涉及结构单元的构型变化,分为“旋光”异构和顺反异构。
2.立构规整聚合物和立构规整聚合:聚合物链具有规整的立体构型排列的聚合物称为立构规整聚合物,结构单元具有一个手性中心的聚合物存在等规和间规两种立构规整聚合物,结构单元的主链含有双键或环结构的聚合物存在全顺式和全反式两种立构规整聚合物。
能形成立构规整聚合物的反应称为立构规整聚合。
3.配位聚合:是由配位引发剂引发的聚合反应。
单体与引发剂中的过渡金属配位形成 配位物,经四元环过渡态单体单元相继插入到过渡金属(Mt)与链末端的Mt–C键之间而进行链增长的聚合反应。
在配位聚合中,增长链活性中心一直与引发剂残片存在配位作用,对链增长反应的立体化学起到控制作用。
4.配位引发剂:Ziegler-Natta引发剂为最早研制出的配位聚合引发剂,基本组成为过渡金属的卤化物和Ⅰ-Ⅲ族金属有机化合物;茂金属引发剂是在Ziegler-Natta引发剂基础上发展起来的均相配位引发剂,过渡金属主要是锆,以环戊二烯结构作为配体;此外还有其它类型的配位引发剂。
从引发剂与活性中心存在配位作用的角度看,以紧密离子对形式进行链增长的离子型引发剂以及某些“活性”自由基聚合的引发剂也属于配位引发剂。
5.配位聚合机理:立构规整聚合物形成的原因是配位聚合机理的最为重要的内容,引发剂和聚合物立构规整性的关系、配位聚合的反应过程、聚合速率与分子量控制也是不可缺少的。
6.典型的配位聚合:非极性烯烃单体和共轭二烯烃单体的配位聚合及其常用的引发剂。
本章要点:1.立构规整度:聚合物的立构规整度有不同的表示形式,二单元组、三单元组或四单元组的立构规整度可以较好地反映聚合物的立构规整性,它们相互之间、与聚合物立构规整度之间存在一定数量关系,并可通过光谱法进行测定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
04 功能配位聚合物
应用领域——催化剂
在配位聚合物结构中引入催化活性中心, 并使之与参加反应的底物相接触从而达到催化 特定反应的目的。 MOFs因具有不饱和的金属位点,一定尺寸的空洞或可以提供反应中心的 功能基团,使它可以作为催化剂,可以用于多类反应,如氧化、开环、环氧化、碳碳键的 形成、加成、消去脱氢、加氢、异构化、碳碳键的断裂、重整、低聚和光催化等方面。
不仅直接影响到聚合物的合成, 而且还涉及到聚合物的空间结构问题。因此,可根 据有机配体种类的不同将现有的配位聚合物进行分为四大类。
含氮杂环类配体的 配位聚合物
含CN配体的配位聚合物
仅有几个含CN 的有
该类聚合物是通过吡 啶及其衍生物与过渡 金属盐反应获得的
12
机配体与过渡金属形 成了配位聚合物
含氧有机配体的聚合物
04 功能配位聚合物
应用领域——催化剂
水氧化和光催化剂
催化剂 MOF 1 MOF 2 MOF 3
TOF(h-1) 4.8 1.9 0.4
Ir、Re或Ru的复合物
光催化剂 TOF(h-1)
MOF-4
0.8
转化率(%)
MOF 5 MOF 6
Ar=H
59
86
Ar=Br
62
68
Ar=OCH3
96
97
04 功能配位聚合物
配体自组装而形成, 不同于Si-O类的无机聚合物。(指利用
金属离子与有机桥联配体通过配位键合作用而形成的一类具
有一维, 二维或三维无限网络结构的配位化合物。)
金属离子 配位
周期性网状骨架 的多孔材料 自组装
有机配体
01 配合聚合物简介
特点
由于同时存在构型各异的无机和有机构筑单元,从而能够制备出具有不同维度、空间构型和拓扑结构的 金属有机配位聚合物。这类化合物大多具有规则的孔状结构,这就使其在材料化学尤其是孔状材料领域有广 阔的应用前景,并越来越受到人们的广泛关注。 应用方面:
作为配位化学的一个重要分支, 配位聚合物研究还涉及到晶体工程、超分子 化学、材料化学及固态化学等诸多领域, 在世界各国科学家的推动下已取得了许 多重要进展 。随着相关研究的不断深入, 人们逐渐认识到可以通过选择具有各 种配位趋向以及光、电、磁等材料性能的金属离子, 利用配位作用来实现晶格中 对配体分子排列的有效控制, 从而能够在晶体工程的经验方法指导下, 有效地合 成出具有特定网络结构和理化性能的晶体材料 。
引入到MOFs材料中。
Two
Thre
e
02 配位聚合物发展史
2005年、Yaghi提出SBUs的概念
次级构造单元(SBU),如果能将金属中心键合在螯合点上而 不是在单齿配位点上,则不仅因为非常强的螯合效应而使网络结 构的稳定性大大提高,而且可能产生少的网络拓扑形式,这样在 骨架结构的设计与合成中就能够有更大的预测性和控制性。 SBU通过有机单元连接羧基的碳原子而形成网状的MOFs。
02 配位聚合物发展史
MOCPs在结构和应用上取得迅猛发展
种类 结构 各异、 功能 多样 的配 位聚 合物
03 配位聚合物分类
03 配位聚合物分类
方法一:Robson教授在1998 年对它们进行过总结。他根 据聚合物框架结构的不同将其分为三大类:
1
Ag N
一维链状聚合物
N Ag N
N Ag
03 配位聚合物分类 方法一:Robson教授在1998 年对它们进行过总结。他根
03 配位聚合物分类
所谓含氧有机配体, 是指配体中的氧参与配位, 起着桥连金属与配体的
作用。OX2 -(草酸根), 是最简单的含氧有机配体, 能同很多金属盐反应生成
3
含氧有机配体 具有二维、三维结构的聚合物[ M2(OX)3] 2 -和[MⅠMⅡ(OX)3]2 , 其结构如1 。
的聚合物
3-pyOH 也是一简单的含氧有机配体。1997 年曾报道了用Cu(OMe)2 、3-
04 功能配位聚合物
应用领域——气体储存
中山大学研究者利用非配位氮原子对吸附的活性作用,合成了一个基于三氮唑,具有暴露在孔表面的 非配位氮原子的沸石型多孔配位聚合物,其气体吸附性能比基于咪唑的同构材料提高一倍以上,对水的吸 附性能则提高超过100倍,且对水的吸/脱附基本发生在中等湿度,意味着既容易吸附大量水,也容易将其 完全脱附,尤其有利于低品质热源的回收或利用(如太阳能吸附制冷)。沸石等常规多孔材料虽可轻易吸 附大量水,却极难脱附。参考无机材料(如沸石)的固溶体结构,他们还控制咪唑和三氮唑的掺杂比例, 精细调节了材料对水吸附的突跃压力,可用于不同类型的低品质热源。
方法
特点
在MOFS 利用骨架自 MOF中的活性金属位或活性结构模块,可直接
中构建 身活性位
作为催化剂使用,但该法易导致骨架坍塌
特殊催
化位点 引入活性物 合成过程中引入具有催化活性的金属纳米粒子
的方法
质
,即将MOF作为一种高比表面积的载体使用
后合成法
先合成MOF材料,再向MOF中引入活性基团 或者活性物质
配位化学
2016年9月
目录
CONTENT
01 配位聚合物简介 03 配位聚合物分类 02 配位聚合物发展史 04 功能配位聚合物
01 配位聚合物简介
01 配位聚合物简介
配位 Байду номын сангаас合物
配位聚合物(coordination polymers)或金属-有机框架 (metal-organicframeworks 简称MOFs)是由过渡金属和有机
pyOH 和三氟乙酸在乙腈中反应, 获得聚合物[ Cu(3-pyOH)2(O2CCF3)2] 的论
文 , 其结构如2
结构1
结构2
03 配位聚合物分类
两种配位能力相近的多齿配体可与同一种金属配位形成聚合物。
通过两种配体与
4 一种金属组装而
成的配位聚合物
例如:
04 功能配位聚合物
04 功能配位聚合物
无机发光材料,组 性催化,或在MOFs骨
装起来就成为金属 架上引用具有催化活
有机骨架荧光材料。性的有机配体和负载
根据ISI Web of Science检索,目 前已经被报道的具
有荧光性能的 MOFs材料至少有 一千多种。
具有催化活性组分来 催化。通常的合成方 法有:直接合成法;合 成后修饰法;还有以 MOFs材料为基体,采 用浸渍、沉降或吸附 等方法将催化活性位
02 配位聚合物发展史
MOF-5简介
MOF-5 是指以 Zn2+和对苯二甲酸 (H2BDC)分别为中心金属离子和有机 配体,它们之间通过八面体形式连接 而成的具有微孔结构的三维立体骨架。 其次级结构单元为 Zn4O(-CO2)6,是 由以1个氧原子为中心、通过6个带苯 环的羧基桥联而成的,其结构示意图 如图所示。 这种物质有着很好的热稳定性,可被 加热至300℃仍保持稳定;具有相当 大的比表面积和规则的孔径结构: MOF-5 的比表面积是3362 m2/g, 孔容积是1.19 cm3/g,孔径是0.78 nm。
应用领域
催化剂
催化性能
分子探针
分子识别
气体储存
吸附性质
药物传输
吸附分离
向功 能发展 的配位 聚合物
04 功能配位聚合物
应用领域——气体储存
多孔配位聚合物具有规 则的孔道结构、可调控的孔 尺寸、能容纳不同客体分子 的柔孔性、独特的表面积和 活性位点及通过表面修饰而 获得的多种潜在功能等特点, 在客体小分子的吸附、分离 及存储(特别是氢气的存储)等 方面表现出可类比于传统无 机沸石类材料的性能。
应用领域——药物运输
背景: 5-氨基乙酰丙酸(ALA)是一种临床上广泛使用的光 动力学治疗(Photodynamic Therapy, PDT)前体药物, 能够选择性地在肿瘤部位富集,并转化成高效光敏剂 原卟啉(PpIX),通过亚铁螯合酶的催化形成亚铁血 红素,实现在可见光的照射下,产生高活性的单线态 氧来破坏包括蛋白质、核酸和脂质在内的多种生物分 子结构,从而杀死癌细胞。就目前来看,ALA输送体系 主要包括乳液和脂质体,乳液中的表面活性剂和脂质 体中的磷脂双分子层能够有效包覆ALA,但是都缺少靶 向输送能力,因此常用于体表的光动力学治疗。寻找 一种具有生物相容性好,能够实现pH响应的可控释放 以及具有肿瘤靶向性的ALA输送体系是目前PDT领域的 一个重大挑战。
据聚合物框架结构的不同将其分为三大类
2
二维网状聚合物
03 配位聚合物分类
方法一:Robson教授在1998 年对它们进行过总结。他根 据聚合物框架结构的不同将其分为三大类
3
三维网状聚合物
3D 金刚石型
3D 立方体型
03 配位聚合物分类
方法二:在配位聚合物的合成过程中, 有机配体起着关键作用, 配体种类的不同
气体 储存
药物 缓释
手性 拆分
选择性 催化
01 配位聚合物简介
空间构型
MOFs主要是通过金属离子和有机配体自组装的方式,由 金属或金属簇作为顶点,通过刚性的或半刚性的有机配体连接 而成。由配位基团包裹金属离子而形成的小的结构单元称为次 级结构单元(Secondary Building Unit,SBU)
近10 年来的大量研究结果表明, 配位聚合物(尤其是多孔配位聚合物)在客体 交换与分离、气体储存、手性拆分、药物缓释、电致发光、选择性催化、分子 识别及微孔器件等诸多方面均显示出潜在的应用前景 , 在获得新型多功能分子 基晶体材料的同时, 也极大地推动了相关领域的发展和交叉融合。
04 功能配位聚合物
聚合物[ (pph3)2Cu2(μ-Cl)2(4, 4'-bpy)2]
聚合物[ Ag(py z)] (BF4)
01 配位聚合物简介 空间构型实例
