氧化还原反应第一课时
[正式版]氧化还原反应第一课时ppt资料
![[正式版]氧化还原反应第一课时ppt资料](https://img.taocdn.com/s3/m/d2f72ae5763231126fdb1123.png)
化合价升降
氧化反应
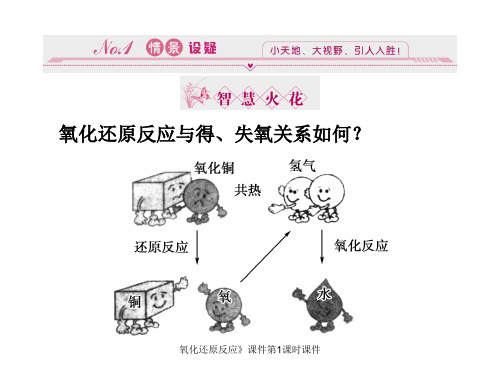
得氧的反应
还原反应
失氧的反应
氧化还原反应 有氧得失的反应
化合价升高的反应
化合价降低的反应
有元素化合价 发生升降的反应
[继续探讨] 标出下面的反应各元素化合价的变化,
指出氧化反应、还原反应。
化合价升高 氧化反应
0
+2
Fe + CuSO4
0
+2
Cu + FeSO4
化合价降低 还原反应
2H2O
1、WO3+ 3H2
W + 3H2O
得失氧角度
CuO + H2 == Cu + H2O
【思考】下列反应哪个是氧化反应,哪个是还原反应?
氧化反应 得氧的反应 【思考与交流】
标出以下方程式化合价的升降情况,并指出氧化剂和还原剂、氧化产物和还原产物: 元素化合价________,发生_________反应,
化合价升高,被氧化
0
+2
H2 + CuO
0
+1_H__2 _是还原剂,__C__u_O___是氧化剂; _H__2O__是氧化产物,____C_u___是还原产物.
元素的化合价_升__高__,发生__氧_化___反应的反应物
叫还原剂。
元素的化合价_降__低__,发生__还_原___反应的反应物叫
化合价升高的反应 化合价降低的反应
氧化还原反应 有氧得失的反应 有元素化合价发生升降的反应
2、
元素化合价___升__高___,发生__氧__化_____反应, 即被__氧_化____是___还__原____剂。
元素化合价__降__低____,发生__还__原_____反应, 即被__还__原___是___氧__化____剂。
氧化还原反应ppt课件

化合价升高,失电子,被氧化
三、四个基本反应类型与氧化还原反应的关系
1、化合反应:
A + B = AB
2、分解反应:
3、置换反应:
4、复分解反应:
AB = A + B
A + BC = B + AC
思考:有单质参加或生成的反应一定是置换反应吗?
AB + CD = AD + CB
C
B D
自我检测
5、下列哪个反应表示二氧化硫被还原( )A、SO2+2H2O+Cl2 = H2SO4+2HCl B、SO2+2H2S = 2H2O+3S↓C、SO2+2NaOH = Na2SO3+H2O D、SO2+Na2CO3 = Na2SO3+CO2↑
B
自我检测
氧化还原反应 第一课时
一、从不同角度认识氧化还原反应
1、从得氧失氧的角度认识氧化还原反应
得到氧原子,发生氧化反应
失去氧原子,发生还原反应
H2 + CuO = Cu + H2O
化合价升高
化合价降低
氧化反应
还原反应
0 +1
失去电子
发生氧化反应
元素化合价降低
得到电子
发生还原反应
口诀:
升、失、氧
降、得、还
二、关于氧化还原反应的几个重要概念
1、氧化剂:
2、还原剂:
反应物中元素化合价降低的物质
(被还原的物质)
(主要从升失氧、降得还入手分析)
氧化性:
(氧化剂具有氧化性)
物质得到电子的性质
√
氧化还原反应第一课时

化合价升降的原因: 化合价升降的原因:电子的偏移 综合上述两种情况,氧化还原反应的实质是什么? 综合上述两种情况,氧化还原反应的实质是什么?
实质:有电子转移(得失或偏移) 有电子转移(得失或偏移) 有电子转移
练一练
1、氧化还原反应的实质是 、 A、发生了得氧、失氧的变化 、发生了得氧、 B、元素化合价发生了改变 、 C、有无新物质的生成 、 D、 √ 、发生了电子的转移
→ →
化合价 升高 化合价 降低
→ 氧化反应 → 还原反应
↓
本质
↓
特征
规律: 规律:升、失、氧化
第三节 氧化还原反应 第一课时
【思考】下列反应属于什么反应? 思考】下列反应属于什么反应?
→从得氧失氧的角度分析氧化反应和还原反应 从得氧失氧的角度分析氧化反应和还原反应 氧化反应和还原
反应类型 定义 举例
点燃
氧化反应 得到氧的反应 S + O == SO 2 2 2CuO+ 2CuO+C == 还原反应 失去氧的反应 2Cu+ 2Cu+CO2↑
③CuO+H2
高温
0 +2
+4 0
2Cu+CO2↑ Cu+ CO+H2↑
高温
+2
0
△
0 +1O Cu+H
2
从化合价升降的角度分别分析 氧化反应、 氧化反应、还原反应和氧化还原反应 反应类型 氧化反应 还原反应 氧化还原 反应 化合价变化 所含元素化合价升高的反应 所含元素化合价升高的反应 升高 所含元素化合价降低的反应 所含元素化合价降低的反应 降低 有元素化合价升降的反应 有元素化合价升降的反应 升降
2、下列变化属于氧化反应的是 、
√
A、 H+ 、 B、 SO3 、 C、 Fe3+ 、 D、 Cl、
氧化还原反应课件第1课时课件
(2)分析下列反应的化学方程式,是氧化还原 反应的用单线桥法标出电子转移的方向和数 目。 ①BaCl2+Na2SO4===BaSO4↓+2NaCl ________________________________, ②Fe+2HCl===FeCl2+H2↑ ____________________________________。
失去
6×2e-↑
答案: C
氧化还原反应》课件第1课时课件
热点实验 探究氧化还原反应在生活中的应用
[探究举例] (1)人体血红蛋白中含有Fe2+,如
果误食亚硝酸盐,会使人中毒,因为亚硝酸盐 会使Fe2+转变成Fe3+,生成高铁血红蛋白而丧 失与O2结合的能力,服用维生素C可缓解亚硝 酸盐的中毒,这说明维生素C具有________。
氧化还原反应》课件第1课时课件
氧化还原反应中电子转移的表示 (1)分析下列反应的化学方程式,是 氧化还原反应的用双线桥法标出电子转移的方 向和数目,指出被氧化和被还原的元素。 ① 2Na+Cl2=点==燃==2NaCl ______________________________________, ②NaOH+HCl===NaCl+H2O ___________________________________。
氧化还原反应》课件第1课时课件
得氧和
化合价 电子转移观
失氧观点 升降观点
点
反 氧 化 应
得氧的反应
化合价升高 的反应
失去(或偏 离)电子的
反应
还 原 反 应
失氧的反应
化合价降低 的反应
得到(或偏 向)电子的
反应
氧化还原反应》课件第1课时课件
得失(或偏
高中氧化还原反应第一课时课件

B B
A.Zn+2HCl=ZnCl2+H2↑ B.2H2S+SO2=3S+2H2O C. H2+CuO=Cu +H2O D.2H2O = 2H2↑+O2↑
4、氧化还原反应发生在同种元素之间的是 ( )
A.Fe+2HCl=H2↑+FeCl2 B.2FeCl2+Cl2=2FeCl3 C.CaO+H2O=Ca(OH)2 D.2Fe(OH)3 =Fe2O3 +3H2O
什么叫氧化还原反应?
氧化还原反应元素化合价变化的本质是什么?
四大基本反应类型与氧化还原反应的关系如何?
你能想到哪些氧化还原反应的现象或应用呢?
怎么判断氧化还原反应?
05
第三节 氧化还原反应(第一课时)
一、预习 合作
CONTENTS
01
单击添加文本具体内容
02
单击添加文本具体内容
从物质得氧、失氧角度分析
从化合价变化角度分析
从电子转移角度分析
成果展示
思考
氧化反应和还原反应是否是独立发生?
物质得氧
物质失氧
氧化反应
还原反应
高温
C + 2CuO = Cu + CO2↑
结论:氧化反应和还原反应是同时发生的。
㈡从化合价变化角度分析
C + 2CuO = Cu + CO2 ↑
物质得氧
物质失氧
化合价升高
化合价降低
氧化反应
还原反应
高温
还有其他的什么变化吗?
0
+2
0
+4
氧化反应:物质所含元素的化合价升高的反应。 还原反应:物质所含元素的化合降价低的反应。
概念:凡是有元素化合价升降的化学反应
氧化还原反应ppt课件

拉瓦锡 1743~1794 (法)
弗兰克兰 1825~1899(英)
1852年,弗兰克兰在研究金属有化合物时提出化合价的概念,并逐步得到完善后,人们把化合价升高的反应叫做氧化反应,把化合价降低的反应叫做还原反应。
得失氧的视角
化合价的视角
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
元素水平——化合价升降的视角
氧化还原反应
环节三:宏观辨识,归纳氧化还原反应和四大基本反应类型的关系
反应前后物质的类别和数目
反应前后有无元素化合价的变化
氧化还原反应
环节三:宏观辨识,归纳氧化还原反应和四大基本反应类型的关系
氧化还原反应
非氧化还原反应
本节小结
得氧、失氧
元素(宏观视角)
元素化合价升降
电子(微观视角)
电子转移(电子得失或共用电子对的偏移)
物质水平——得失氧的视角
在一个反应中同时发生
氧化还原反应
狭义
一种物质得到氧发生氧化反应,同时另一种物质失去氧发生还原反应的反应叫氧化还原反应。
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
元素水平——化合价升降的视角
1774年,拉瓦锡创立氧化学说(既燃烧是物质与氧气的反应)推翻了流行千年的燃素说,以解释燃烧等实验现象,指出动物的呼吸实质上是缓慢氧化。
化合价升高,
化合价降低,
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
元素水平——化合价升降的视角
氧化还原反应
非氧化还原反应
无元素化合价变化
有元素化合价变化
氧化还原反应的特征
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学必修1
氧化还原反应
教学设计
一.教材分析
氧化还原反应安排在高中化学必修1第二章化学物质及其变化中的第三节,有其重要的意义。
因为在中学阶段的基本概念、基础理论知识中,氧化还原反应占有极其重要的地位,贯穿于中学化学教材的始终,是中学化学教学的重点和难点之一。
在中学化学中要学习许多重要元素及其化合物的知识,凡涉及元素价态变化的反应都是氧还原反应。
只有让学生掌握氧化还原反应的基本概念,才能使他们理解这些反应的实质。
学生对本节教材掌握的好坏直接影响着其以后对化学的学习。
本节教材安排在这里是承前启后,它既复习了初中的基本反应类型及氧化反应、还原反应的重要知识,并以此为铺垫展开对氧化还原反应的较深层次的学习,还将是今后联系元素化合物知识的重要纽带。
氧化和还原是一对典型矛盾,它们既是相反的,又是相依存的,通过认真引导使学生逐步理解对系统规律在自然现象中的体现,又会帮助学生用正确的观点和方法学习化学知识。
二.学情分析
在初中化学学生已经学习了氧化反应与还原反应,也具备了化合价的知识,初步认识了化合价的变化跟电子的转移有一定关系,这些都为本节课的实施提供了可能。
通过学习教育心理学,我们知道高中生思维具有更高的概括性,辩证思维也迅速发展, 处于具体思维向抽象思维发展的前期, 但学生的抽象理解能力还稍弱, 需要借助一些具体手段帮助学生理解氧化还原反应的本质。
三.教学目标
(一)、知识与技能:
1、能从化合价的变化,认识并建立氧化还原反应的概念;
2、通过对典型化学反应的分析,理解氧化还原反应的本质是电子转移。
(二)、过程与方法:
1、通过对氧化还原反应的学习,学会怎样从特殊到一般规律,再从一般规律到特殊的认识问题的科学方法;
2、通过对氧化剂和还原剂这一矛盾体的学习,具有能用对立统一的观点分析问题的意识;
3、通过“思考与交流”、“问题探究”等活动,增强学生分析、联想、类比、迁移以及概括的能力。
(三)情感态度价值观:通过氧化还原反应概念的演变,培养学生用发展的眼光、科学的态度、
勇于探索的品质学习化学;通过创设问题情景,营造宽松和谐的学习气氛,诱导学生积极思维,激发学生的学习兴趣和求知欲望。
通过氧化还原反应有关概念的学习,初步形成对立统一的辨证唯物主义的观点。
使学生形成勇于创新的习惯、培养创新能力。
四.教学重难点
(一)教学重点
用化合价升降和电子转移的观点来理解氧化还原反应。
(二)教学难点
用电子转移的观点分析氧化还原反应
五.教学方法
为了突破重点、难点,调动学生的思维,让他们积极参与到教学过程中,我采用“讨论探究式”的教学方法,通过设计富有驱动性、环环相扣的问题,让学生思考、讨论、归纳,并辅以多媒体教学手段展示微观过程,化抽象为形象,在解决问题的过程中逐步将学生的认识引向深入。
六.教学过程
教学过程教师活动学生活动设计意图复
习
导入【复习导入】
什么是氧化反应?什么是还原反应?
【思考与交流1】
氧化反应和还原反应是独立发生的,还
是同时进行的?
【教师讲解】
【学生回答】
物质得到氧的反应是氧化反应,物质
失去氧的反应是还原反应。
【学生讨论】
【学生回答】
反应:2CuO+C2Cu+CO2↑
(1)氧化铜失去氧变为单质铜,发
生了还原反应,
(2)碳得到氧变成了二氧化碳,发
巩固和
加深旧知
识,联系旧
知识和新知
识,激发学
习动机
E. Mg +2HCl == MgCl2 +H2 ↑
F. NaOH+HCl == NaCl + H2O
新课教学【问题2】
氧化还原反应中为什么会发生化合价
的升降?氧化还原反应的本质是什么
呢?
【投影展示】
【投影展示】
【学生自学,阅读教材】
【学生讨论】
【学生回答】
从原子结构来看,钠原子的最外电子
层上有1个电子,氯原子的最外电子
层上有7个电子。
当钠和氯气反应
时,钠原子失去1个电子,带1个单
位正电荷,成为钠离子;氯原子得到
1个电子,带1个单位负电荷,成为
氯离子,这样双方最外电子层都达到
了8电子的稳定结构。
钠元素的化合
价由0价升高到+1价,被氧化;氯
元素的化合价由0价降低到-1价,
被还原。
在这个反应中,发生了电子
的得失,金属钠发生了氧化反应,氯
气发生了还原反应。
【学生自学,阅读教材】
【学生讨论】
【学生回答】
氢气和氯气的反应属于非金属
与非金属的反应。
从他们的原子结构
来看,氢原子的的最外电子层上有1
动态图清晰
直观的了解
氧化还原反
应中电子转
移的过程
让学生通过
动画分析,
培养学生独
立思考,合
作交流的能
力。
层层深入
新课教学(7)H2SO4+BaCl2= BaSO4↓+2HCl
(8)AgNO3+NaCl=AgCl↓+NaNO3
【板书】
二、氧化还原反应与四种基本反应类型
之间的关系
【当堂练习】
1.下列各类反应中,全部是氧化还原
反应的()
A.分解反应
B.化合反应
C.置换反应
D.复分解反应
2.在Zn+H2SO4=ZnSO4+H2↑反应
中, _____ 元素化合价升高, ___
电子,被 _____ (填“氧化”或“还
【归纳总结】
(1)置换反应一定是氧化还原反应。
(2)复分解反应一定不是氧化还原反
应。
(3)化合反应和分解反应不一定是氧
化还原反应。
①有单质生成的分解反应一定是氧
化还原反应。
②有单质参加的化合反应一定是氧
化还原反应。
【学生讨论】
【学生板演】
【学生总结】
氧化还原反应的定义、特征和本质以
及氧化还原反应与四种基本反应类
型之间的关系
原”),发生 _____ (填“氧化”
或“还原”)反应; _____ 元素化
合价降低, ___电子,被 _____ (填
“氧化”或“还原”),发生 _____
【学生练习】(填“氧化”或“还原”)反应。
【课后作业】
七、板书设计
氧化还原反应
一、氧化还原反应
1.定义:有元素化合价升降的化学反应。
2.特征: 有元素化合价的升降。
3.本质:电子的转移(得失或偏移)。
二、氧化还原反应与四种反应类型之间的关系。
