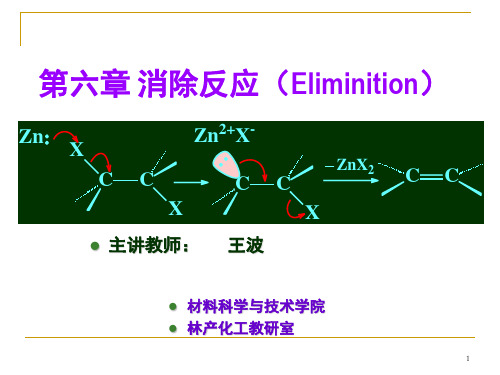
消除反应的历程
消除反应机理

CH2 CH2 H2O
H3O
实例 E2
CH3
H
H
C2H5OH
NaOH
H
CH3
CC
CH3
H3C
Br
实例 霍夫曼消除反应 E2
[RCHN+(CH3)3]OH-
CH3
100~200o C
RCH=CH2 + (CH3)3N + H2O
季铵碱在加热条件下(100~200C)发生热分解 生成烯烃旳反应称为霍夫曼消除反应。霍夫曼消除反 应遵照霍夫曼规则。
反应分子旳共轭碱
B- + H C C A -BH
CCA
+ A-
单分子共轭碱消除反应用E1cb表达。E表达消除反应, 1代表单分子过程,cb表达反应物分子旳共轭碱。E1cb反 应是反式共平面旳消除反应。
CH3CHCH2CH2CH3
F
CH3O CH3OH
CH2 CHCH2CH2CH3
70%
CH3CH CHCH2CH3
(CH3)3N CH3 OH
(CH3)3N CH3OH
反应:
CH3 CH3CHCH2
H N
CH3I CH2CH3
CH3 CH3CHCH2
CH3 N CH2CH3
I
彻底甲基化
CH3
Ag2O
CH3
CH3
湿
CH3CHCH2 N CH2CH3 OH
CH3
CH2
CH2
CH3
CH3
CH3CHCH2N
CH3
E1cb 反应机理
因为反应速率只与第一步有关,第一步是单分子过程,所以反应动力学上 是一级反应。
E1反应机理
• 消除反应旳决速环节是卤烷旳离解,生成碳正离子 • 卤烷消除反应活性顺序为:
有机化学反应中的消除反应机理

有机化学反应中的消除反应机理有机化学反应是有机化学领域中研究的重要内容之一,其中消除反应是一类常见的反应类型。
消除反应是指有机化合物中两个官能团之间的共价键断裂,产生一个双键或者三键的反应过程。
本文将从消除反应的定义、机理和应用等方面进行探讨,旨在全面了解有机化学反应中的消除反应机理。
一、消除反应的定义消除反应是有机化学中一种重要的反应类型,它是指有机化合物分子中两个官能团之间的共价键断裂,生成一个双键或者三键的反应过程。
在消除反应中,通常会伴随着一个或多个官能团的消失,而新产生的化学键则由两个官能团之间的原子提供。
消除反应可以通过热力学和动力学两个方面来考虑,其中热力学方面主要考虑反应的稳定性,而动力学方面则关注反应速率的因素。
二、消除反应的机理消除反应的机理多种多样,常见的消除反应包括酸催化消除、碱催化消除和热消除等。
下面以酸催化消除为例,介绍消除反应的机理。
1.酸催化消除机理酸催化消除反应是指在酸的催化下进行的消除反应。
在消除反应中,酸催化剂能够提供质子,将质子和待消除的官能团中的基团结合,形成离去基的共轭酸(也称为消除或β位酸)和新的质子酸性位点。
消除反应的速率通常与碳离开中间体的稳定性相关,通常会生成稳定性更高的烯烃或炔烃。
2.碱催化消除机理碱催化消除反应是指在碱的催化下进行的消除反应。
在消除反应中,碱的催化剂通常能够提供氢离子或者氢根离子,与待消除的官能团中的质子结合,形成新的共轭碱(也称为消除或β位碱)。
与酸催化消除不同,碱催化消除反应通常会生成稳定性更高的取代烯烃或炔烃。
三、消除反应的应用消除反应在有机化学合成中具有重要的应用价值,它可以用于构建新的C-C或C=C键,生成一系列有机化合物。
常见的应用包括:1.合成不对称双烯烃通过选择特定的消除反应条件和底物,可以构建不对称的双烯烃。
这种方法在天然药物合成和材料科学领域具有广泛的应用。
2.构建多环化合物消除反应可以用于构建多环化合物,通过选择不同的消除反应机理和底物,可以形成具有特定结构的多环化合物。
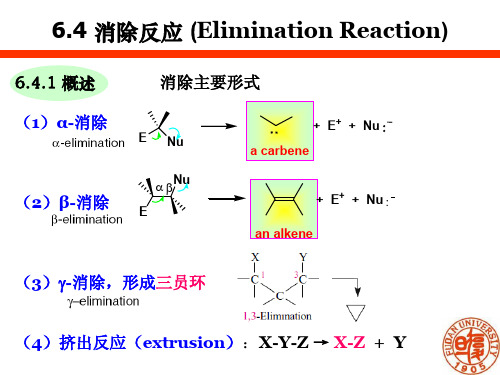
消除反应 (Elimination Reactions)

E1反应:
CH3CH CH(CH3)2 B CH3CH CH(CH3)2 -H CH3CH C(CH3)2
X
热力学控制产物
遵循Sayzaff规则
2、按E1cb历程进行的消除反应,主要产物为 Hofmann 烯烃 原因:离去基团难离去;主要考虑β-H的酸性及空间 因素。
CH3
CH2
△
N(CH3)3OH
C C 慢 C C +L
L
按E1cb机理进行反应底物结构特征:
① 当β-氢被吸电子基团活化时,如:COCH3、
NO2、Me3N+等; ② L是难离去基团。
O
O
OCCH3 H CH3O
NO2 H
OCCH3 H
NO2
NO2
H CF3
CF3
E1cb机理证明
同位素交换
CF2
CCl2
CF2 OH
CCl2
CF2
Dห้องสมุดไป่ตู้
后者两个苯基处于
CH3
邻位,构象不稳定, 其热消除的产物很
O
C O
少。
D
H
△
Ph
顺式五员环状模式 Ph
H
Ph
Ph
Ph
(主)
H
H
(痕量)
H
CH3 CH CHCH3 △ OCOCHC3 H3
H2C CH
(80%)
CHCH3 + CH3 CH
CH3
(20%)
C
CH3 CH3
热消除遵循Hofmann规则,优先得到取代程度较低
b
CH2 - H
(CH3)3C-OH
OH2
CH3
CH3C = CH2
第十二章 消除反应

Br H H meso Ph H H dl 对 Br Br Ph Br Ph H Ph Br trans H Ph Br Ph H Ph H Br Ph Ph Br H Ph ≡ Ph H cis Ph Br Ph
Br ≡ Ph
Br Ph
H H
不符合消去
Br H H 3C H OEt CH3 H H 3C H 3C
Br H H H OEt
对于环状化合物 相邻两个取代基只有处于a键位置才有利于消除
OTs
OTs
E2
H
OTs
具有反式氢
OTs H
E1 (慢)
处于反式的氢在e键上,与OTs不在一个平面上,反 应按E1机理进行。
例:消去反应,vCis = 500 vtrans, Why?
β
CH3 N CH2CH2CH3 CH3
β '
OH
H2C CH2 + CH3CH CH2
(98%) (2%)
从过渡态中的β-氢的活性考虑,失去β-氢,生成 伯碳负离子,失去β’-氢,生成仲碳负离子。 伯C-稳定性 > 仲C-稳定性,所以乙烯是主要产 物。
CH3 OH PhCH CH2 + CH3CH2N(CH3)2 CH CH PhCH2CH2 N 2 3 β ' β CH3
L首先 离去
4、影响反应机理的因素:
1) 底物
E1机理
利于C+的 生成
Ar
R
稳定C- 的作用
C L
H C
减弱β-氢 的酸性
R'
除此之外 均按E2 机理
Ar (Y)
EICB机理
有机化学中的消去反应

有机化学中的消去反应12031426-吕灵芝消去反应指分子内失去两个小基团,形成新结构的反应。
消去反应有三种:α-消去,β-消去和γ-消去1、定义与分类α-消去指分子内同一个原子上失去两个基团,形成卡宾或氮烯的反应。
β-消去指分子内两个相邻的原子上各失去一个基团,形成新的双键或叄键的反应。
这也是最为普遍认识的消去反应。
γ-消去指分子内两个不相邻的原子上各失去一个基团,最终形成环状化合物1的反应。
2、反应速率在离子型1,2-消除反应中,带着成键电子对一起从反应物分子的1位或a碳原子上断裂下来的基团称为离去基团(L),另一个失去基团往往是连在2位或β碳原子上的氢,称为β氢原子。
例如,1-溴丁烷与氢氧化钾在乙醇中共热,溴带着键合电子对断裂下来成为溴负离子,β氢原子以质子形式断裂下来与碱中和,同时在1和2位之间形成烯键:这类消除反应的速率与卤代烷结构有关,在相同的条件下以三级卤代烷最快,二级卤代烷次之,一级卤代烷最慢。
以碱为试剂的消除反应常伴有亲核取代2反应,也可能发生重排反应,这三种反应之间的竞争与卤代烷结构、试剂性能和反应条件等因素有关。
强碱和高温增加发生消除反应的机会。
编辑本段反应机理。
在离子型消除反应中,按有关价键发生变化的先后顺序不同,可分三种反应机理:?单分子消除反应(E1)。
反应物先电离,L断裂下来,同时生成一个正碳离子,然后失去β氢原子并生成π键。
反应分两步进行,决定速率的电离这一步只有反应物分子参加。
故E1的速率与反应物的浓度成正比,与碱的浓度无关。
?共轭碱单分子消除反应(E1CB)。
反应物先与碱作用,失去β氢原子,生成反应物的共轭碱负碳离子,然后从这个负碳离子失去L并生成π键。
在生成π键的步骤中只有共轭碱负碳离子参加。
E1CB也分两步进行,反应速率与反应物浓度成正比,也与碱的浓度有关。
一般,只有β碳原子上连有硝基、羰基或氰基等的反应物,才能按E1CB机理进行反应。
?双分子消除反应(E2)。
第六章 消除反应
(二)共轭碱单分子消除 (E1cb)(碳负离子)
2、有利于E1cb消除反应的因素:
① 当β-氢被强吸电子基团活化,具有酸性,如: COCH3,、NO2、Me3N+等;同时稳定负碳离子; ② L是难离去基团。 ③ 试剂的碱性强,浓度大
O OCCH3 CH3O H NO2 H
O OCCH3 H NO2
C 6H 5
H + NaBr + H2O H
C N + CH3COOH
5
CH3 Br H H
C6H5 CH N O C CH3 O
3、其他
C6H5 CH CH2 H CH2 F
OHCH2 CH CH CH2 + Br2
C2H5ONa
C6H5 CH
CH2
+ HF
CH2
1,3消除
CH2 CH Br
C C B
C A
C
C B
3
1,4-消除
1,3-消除
1、-消除,1,1-消除
1) 定义:从同一原子上除去两个原子或者基团产 生一个活性中间体碳烯或氮烯的过程 2) 机理:
C E Nu
H C Cl O Cl
△
ENu
Cl C Cl
C
+
Nu
E
3)举例:
Cl
+
HCl
CF3C ONa
CF2 + CO2 + NaF
CH CH2 Br
1,4消除
H
2
4 3 5
O
1
Cl O
+ HCl
1,5消除
大多数消除反应为1,2消除(-消除)。
第七章 消除反应

υ=k[RX][B:-]
双分子消除历程,二级反应
2. 反应活性(Reaction activity )
离去基团:RI > RBr > RCl
(与SN2反应相同)
进攻试剂的碱性越强,则反应活性越高。 如:HO﹣ > CH3COO﹣ (与SN2反应有所不同) 反应底物卤代烃的活性: 3º >1º >2º
1. 羧酸酯的热消除:
在无外加试剂存在下,通过加热,失去β-氢和羧 酸根,生成烯烃。
H O H O C H R R H H O + H O C R
R
H
H O
H C R
R
H
H
H O
反应特点:1) 高温,不需碱作催化剂 2) 环状过渡态机理 3) 通常是顺式消除。
环状化合物(Ⅰ)的热消除,只得化合 物(Ⅱ),为顺式消除。
(I) (II)
L
(2)
L: S(CH3)2 I / II 6.7
底物结构的影响
N(CH3)3 ~50
(CH3)3CCH2C(CH3)2 Br
EtO
(CH3)3CCH2C CH2 CH3
4.立体化学( Stereochemistry)
消除反应立体化学的确立:
(1)反应物中H和L 的空间关系:H和L可 在C-C键的两侧或同一侧,分别称为反式消 除和顺式消除。 (2)产物中取代基的空间关系:反应产物 是以顺式还是反式异构体为主
第七章 消除反应
Elimination Reaction
定义: 消除反应:是指从有机分子中消除去一个 小分子或两个原子或基团,生成双键、叁 键或环状结构化合物的反应。 分类: (1)α-消除(或1,1-消除)反应 H
8.5 消除反应的机理

8.5 消除反应的机理9两种消除机理(E1和E2)9影响消除反应机理及其活性的因素9消除反应的方向9E2反应的立体化学9取代反应和消除反应的竞争单分子消除机理The E1 Mechanism第一步生成碳正离子,其速度慢,是决定整个反应速度的一步。
因为这一步反应中只有一种分子发生共价键的断裂,所以此反应历程称为单分子消除反应,以E1表示个E1的反应速度仅取决于卤烷的浓度,而与其它试剂(例如氢氧根负离子)的浓度无关。
H CH3H CH3•失去β-质子(被碱所接收)而生成烯烃。
E1 反应势能变化图•注意:E1反应的第一步和S N1的相同双分子消除机理The E2 Mechanism反应主要按双分子历程进行,反应不分阶段,新键的生成和旧键的断裂同时发生(协同进行)。
反应速度与反应物浓度及进攻试剂的浓度成正比,说明反应是按双分子历程进行,因此叫做双分子消除反应,以E2表示。
实验现象•(1)卤代烃脱卤代氢为二级动力学反应。
rate = k[卤代烃][碱]•(2) 消除反应的速度取决于C—X 的键能C—X 键越弱; 反应速度越快顺序: RI > RBr> RCl> RF碱试剂的影响9只有E2反应与试剂的碱性强弱、浓度有关,高浓度的强碱试剂可提高E2反应的速度。
9E1反应不受试剂的碱性和浓度的直接影响。
在E2反应中,过渡态已有部分双键的性质;烯烃的稳定性反映在过渡态的能量上,生成烯烃的稳定性大,则其过渡态的能量也低,反应所需的活化能小,反应速度快,在产物中所占的比例也多。
消除反应的立体化学(重点)在E2反应中,C-L和C-H 键逐渐断裂,π键逐渐形成,如果两个被消除的基团(L,H)和与它们相连的二个碳原子处于共平面关系(即L-C-C-H在同一平面上),在形成过渡态时,二个变形的SP3杂化轨道可以尽多地交盖(形成部分π键)而降低能量,有利于消除反应的进行。
E2 反应的立体化学反式消除与顺式消除反式共平面顺式共平面取代反应和消除反应的竞争(以自修为主)Substitution And EliminationAs Competing Reactions。
卤代烃亲核取代和消除反应机理

卤代烃亲核取代和消除反应机理亲核取代反应历程卤代烃的亲核取代反应是⼀类重要反应,由于这类反应可⽤于各种官能团的转变,在有机合成中具有⼴泛的⽤途,因此,对其反应历程的研究也就⽐较重要。
在亲核取代反应中,研究最多的是卤代烃的⽔解,在反应的动⼒学、⽴体化学,以及卤代物的结构,溶剂等对反应速率的影响等都有不少的资料。
根据化学动⼒学的研究及许多实验表明,卤代烃的亲核取代反应是按两种历程进⾏的,即双分⼦亲核取代反应(S N 2反应)和单分⼦亲核取代反应(S N 1反应)。
⼀、双分⼦亲核取代反应(S N 2反应)实验证明:伯卤代烃的⽔解反应为S N 2历程。
RCH 2Br+OH -→RCH 2OH+Br -,v =k [RCH 2Br]·[OH -],v 为⽔解速率,k 为⽔解常数。
因为RCH 2Br 的⽔解速率与RCH 2Br 和OH -的浓度有关,所以叫做双分⼦亲核取代反应(S N 2反应)。
1.S N 2反应机理:亲核试剂(Nu -)从离去基团(L)的背⾯进攻中⼼碳原⼦。
当亲核试剂与中⼼碳原⼦之间逐渐成键时,离去基团与中⼼碳原⼦之间的键逐渐断裂,新键的形成和旧键的断裂是同步进⾏的协同过程,其反应过程如下所⽰。
反应物(sp 3) 过渡态(sp 2)产物(sp 3) 2.S N 2反应的能量变化,可⽤反应进程-势能曲线图表⽰如下:S N 2反应进程中的能量变化3.S N 2反应的⽴体化学:背⾯进攻和构型翻转。
(1)背⾯进攻反应:在S N 2反应中,亲核试剂Nu -可以从离去基团的同⼀边或离去基团的背⾯进攻中⼼碳原⼦(C δ+)。
若从离去基团的同⼀边进攻,则亲核试剂与带负电荷的离去基团(L δ-)之间,除空间障碍外,还因同种电荷相互排斥使反应活化能升⾼,不利于反应的进⾏。
若从离去基团的背⾯进攻,则反应活化能较低,容易形成相对较稳定的过渡态,反应易于进⾏。
(2)构型翻转:在S N 2反应中,中⼼碳原⼦由反应底物时的sp 3杂化转变为过渡态时的sp 2杂化,这时亲核试剂与离去基团分布在中⼼碳原⼦的两边,且与中⼼碳原⼦处在同⼀直线上,中⼼碳原CδδNu C + L -δδNu C + L δδNu C + L -Nu⼦与它上⾯的其他三个基团处于同⼀平⾯内。
第三节 β—消除反应

例如:
产物%
CH3CH2CH2CH2Br
C2 H5ONa C2 H5OH
55 C
SN2 90 2
E 98
CH3 2 CHCH2Br
〃
〃
40 5
59 5
CH2CH2Br
〃
(β-H 酸性大) 〃
44
94 6
(二) 试剂的碱性
试剂的碱性越强,越有利于E2历程,不利于SN2 反应。由于碱性越强,越易进攻β-H,(碱性是 亲质子的性能)不易进攻α-碳。
有些消除反应的反应速度只与反应物浓度 有关,而与试剂的碱性浓度无关,这些反应叫 E1反应。
E1与SN1 反应有相似的历程,都是通过生成 碳正离子 进行的。所不同的是E1反应的第二步 碱夺取碳正离子中的一个β-H而形成烯烃。故E1 和SN1也常一起发生(由于E1和SN1都经历碳正离 子中间体一步,而这一步骤为定速步骤,所以E1 和SN1同时发生)
CH3 CH3 C+ CHCH3
H+ CH3
CH3 CH3
C
+
CHCH3
2,3-二甲基-2-丁烯
H
所以E1历程常伴随着重排反应,重排反应 为E1历程的标志,当然也是SN1历程的标志。
碳正离子的重排规律是:1°>2 °>3 °
(三)碳负离子历程( E1CB )
在 E1历程中是离去基团首先离去;E2历程 中两个被消除原子或原子团同时离去。消除 反应的第三种历程是强碱B作用下,β-H 原子 以质子形式离去,然后离去基团带着一对电 子以负离子的形式离去。
I-
亲核最多
RCH2CH2I
OH-为三者中最强的碱,进攻β-氢几率多, 使消除为主,CH3COO-碱性较弱,E2消除产物 较少,亲核产物较多。而I-为最弱的碱,主要进 攻α-碳 ,以亲核产物为主。所以常用这个道理, 以卤代烃间接水解法制备醇。因为第一个反应, 卤代烃直接水解法,消除产物与亲核取代产物 并存。而第二个反应则主要以亲核产物为主, 成酯,然后酯水解得醇。
第10章 消去反应

化学
卤代烃对E1和E2消去反应的活性顺序: 3 ° > 2 ° > 1° 如果b-H酸性加大,有利于碱的进攻,有利于E2反应。
叔卤代烃以及仲、叔醇有利于E1反应。
(二) 进攻试剂的影响
E1与SN1历程中,决定反应速度的步骤是碳正离子的生 成,进攻试剂的影响不大 试剂的碱性对E2的影响较大,碱性越强,越容易夺取 b-H ,有利于E2反应。
化学
有利于 E1 反应的因素: 有叔烃基或a-C连有芳基的仲烃基
b-C上没有吸电子基团
离去基团容易离去 试剂的碱性不强 溶剂极性强
化学
有利于 E2 反应的因素:
含伯烃基或含仲烃基的作用物
β位上有活泼氢 离去基团离去倾向不大 试剂的碱性强 溶剂极性弱
化学
有利于 E1CB 反应的因素:
β位上的氢特别活泼 β位上有强吸电子基 离去基团离去倾向较小 试剂的亲核性特别强
相应氢的酸性次序: H-CH3 > H-CH2R > H-CHR2 > H-CR3
化学
3. E2历程 在E2反应的择向与其过渡态紧密相关。 在完全协同的E2反应中,过渡态已具有双键的性质, 烯烃的稳定性大,则过渡态的位能低,反应所需活 化能小,反应速度快。 遵从Saytzeff规则 若过渡态具有更多的E1CB特征时,产物符合 Hofmann规则 。 若过渡态具有更多的E1特征时,产物符合Saytzeff规 则
化学
(四) 温度的影响
(五) 离去基团的影响
较好的离去基团有利于离子化作用,对E1或E2反应 有利。较差的离去基团或带正电荷的离去基团使反 应按E1CB进行:强的吸电子基团使b-H酸性增加。
化学
离去基团与E1和SN1间的竞争无关。 在双分子反应中,好的离去基团有利于取代反应。 离去能力顺序:OTs >I>Br>Cl>+S(CH3)2 >+N(CH3)3 , 消去产物的产率按此顺序增高。 带正电荷的离去基团,由于具有强的-I效应, b-H酸 性增加,易被碱进攻,得到消去产物。
精细有机合成技术:消除反应

叔烷基>仲烷基>伯烷基
②单分子消除反应历程(E1)
➢单分子消除的反应分两步进行。首先是离去基团携带 一个电子离去,形成碳正离子,然后消除质子形成烯烃。
形成碳正离子的过程是速度控制步骤,该反应为一级反 应。反应速度可表示为:
精细有机合成技术
α-消除反应
• 在同一碳原子上消除两个原子或基团的反应称为α-消除, 也叫1,1-消除反应。产物是卡宾(一种高度活泼的缺电 性质点)。如氯仿在碱催化作用下,发生α-消除反应, 生成二氯卡宾(又称二氯碳烯)。
• 第二步形成卡宾的过程是速度控制步骤。二氯 卡宾很活泼,难以分离得到。但能水解生成酸。
CH3 CH3
CH2
②霍夫曼(Hofmann)法则
➢季铵碱分解时,主要生成在不饱和碳原子上连有烷基数 目最少的烯烃。例如:
➢研究表明,在E2历程中季铵碱消除按霍夫曼法则,卤代烷 消除按查依采夫法则;而在E1历程的反应中按查依采夫法则。
③若分子中已有一个双键(C=C,C=O)
➢消除反应后形成新的双键位置,不论何种消除历程,均 以形成共轭双键产品占优势。例如:
• β-消除的反应可分为双分子历程(E2)和单分子历程(E1)。
①双分子消除反应历程(E2)
➢双分子消除反应一般在强碱性试剂的作用下进行。当亲核性的碱性试剂 B接近β-H时,在B和H间形成微弱键的同时,原有C—H键、C—X键减弱 而形成过渡态,而后发生C—H键和C—X键同时断裂,构成烯键。
该反应为二级反应。反应速度可表示为:
感谢观看
v = k [RX]
• 碳正离子的稳定性高,有利于反应的进行。烷基中,叔 碳正离子的稳定性最高,仲位次之,伯位最差。
高等有机化学:6.4 消除反应 (Elimination Reaction)
+
HD
H Me
H Me
Me D
syn-elim. Me
Me Me +
D
TsO H
HH
H Me
29
30
31
3. E1cb
An acid-strengthening group on the β-carbon (a -R
type such as -COR, -SO2R, -NO2) and a rather difficult leaving group, e.g. -OR or -CN, will favor this route.
+ δ
Br δ-
(←) solv
H
+
B
H
+
Br- intimate
ion-pairs
k2
O Br- H S solvent separated
B
H
+
+ BH+
+ Br-
Solv
28
erythro-3-d-2-butyl tosylate
MeH H
anti-elim. Me Me Me H
TsO DMe
H
KOH ethanol heat
第三章消除反应

CHMe2 HH 100% 1 2 3 (IV) 4
氯化萜
Me
CHMe2
1 2 3 (V)
4
CHMe2
(3)通常反式消除占优势,但碱的状态(即以游离状态或是
以离子对存在)能影响顺式与反式作用。 (I)弱电离的溶剂促进不带电荷的离去原子团的顺式消除。
C H R O M X
R O H + M +X C +
第三章
1、消除反应的分类
消除反应
消除反应(Elimination Reaction) 是指从有机分子中排 除去一个小分子或两个原子或基团,生成双键、叁键或环状 结构化合物的反应。 (1)α-消除(或1,1-消除)反应
H R C X R
R C R
(2)β-消除(或1,2-消除)反应
HX R C HC H R H X + R C C R
又如氯代反丁烯二酸脱氯化氢的反应速度比顺式二酸快48倍, 反式消除作用比顺式消除作用占优势。
C l C C H O C 2 H C O H 2 碱 C O H 2 C C +H C l C l C ; C C O H 2 C O H 2 碱 C O H 2 C C C O H 2 +H C l
H C O H 2 反 式 比 顺 式 快 4 8 倍
2、 E1消除反应的立体化学
与E2历程相比, E1历程的反应立体选择性较差。
因为在E1反应中,首先生成具有平面构型的碳正离
子,此时反式消除和顺式消除的几率应该一样。但 是,与SN1反应的立体化学类似,假如,离去基团 尚未充分远离,即碳正离子尚未能形成平面构型之 前,而消除反应已经完成,则优先生成反式消除产
消除反应的反应机理

消除反应的反应机理以消除反应的反应机理为标题,我们将探讨一些常见的反应消除机制。
在化学反应中,反应的消除可以通过不同的途径实现,其中包括加热、溶解、催化剂等。
下面将详细介绍这些消除反应的机理。
一、加热消除反应机理加热是一种常见的消除反应机理。
当物质受到加热时,其分子间的作用力会变弱,导致分子结构的解离和重组。
这种解离和重组过程可以消除反应物之间的化学键,从而实现反应的消除。
例如,当我们加热氢氧化钠(NaOH)和盐酸(HCl)时,它们会发生中和反应,生成氯化钠(NaCl)和水(H2O)。
加热提供了反应所需的能量,使反应物分子中的化学键断裂,并形成新的化学键,最终消除了反应物。
二、溶解消除反应机理溶解也是一种常见的消除反应机理。
当物质溶解在溶剂中时,其分子会与溶剂分子发生相互作用,形成溶液。
在溶液中,反应物分子之间的距离变大,使得反应的概率降低,从而消除了反应。
以氯化钠(NaCl)的溶解为例,当将固体氯化钠溶解在水中时,氯化钠的晶体结构被破坏,其离子被水分子包围,形成溶液。
在溶液中,氯化钠的阳离子(Na+)和阴离子(Cl-)分散在水分子中,相互之间的距离增大,从而减少了反应的可能性,实现了反应的消除。
三、催化剂消除反应机理催化剂是一种能够加速反应速率的物质,其存在可以改变反应的机理,实现反应的消除。
催化剂通过提供新的反应途径,降低反应的活化能,从而加速反应的进行。
例如,当我们将过氧化氢(H2O2)与二氧化锰(MnO2)混合时,二氧化锰可以作为催化剂加速过氧化氢的分解反应。
在此反应中,二氧化锰提供了一个新的反应途径,使得过氧化氢分子更容易分解为水和氧气,从而消除了反应物。
加热、溶解和催化剂是常见的反应消除机理。
加热提供了反应所需的能量,溶解使反应物分子之间的距离增大,催化剂通过提供新的反应途径加速反应。
这些消除反应机理在化学反应中起着重要作用,对于我们理解和控制化学反应过程具有重要意义。
消除反应类型-E1-E2

消除反应的两种反应历程一、单分子消除反应E11.本质第一步:R-CH2-CH2X →R-CH2-C+H2+X-离去基主动脱离生成碳阳离子第二步:R-CH2-C+H2→ R-CH=CH2 + H+β氢变成氢离子同时产生碳碳双键2.特征:①E1历程反应速率只正比于反应物浓度,与催化剂路易斯碱浓度无关。
②由于反应中生成碳正离子,有时有可能发生重排生成更为稳定的3°碳正离子,形成相应的不饱和产物。
3.反应速率:由于两步反应中第一步反应比较慢,而第二步反应比较快,所以整体的反应速率几乎只与第一步反应的反应速率有关,而第一步反应的反应速率由碳正离子稳定性决定,碳正离子越稳定,反应速率越快,故其反应速率顺序为:苄基> 烯丙基> 叔碳> 仲碳> 伯碳(β碳上带有推电子基团(如烃基、氨基、羟基等)有利反应的进行)二、双分子消除反应1.综述:又名E2反应,E代表Elimination,而2代表反应速率受到二个化合物浓度的影响。
为消除反应的一项反应机构,由于反应为一步形成,与二种反应物浓度皆有关,在反应动力学上是属于二级反应,故又称为“双分子消除反应”。
2.本质:如同S N2反应,反应由一步完成,但不同的是由碱来拉走质子,而并不是当作亲核试剂,碱进攻β-氢,并与离去基同时离去,生成烯烃。
而由于反应为一步完成,与二种反应物浓度皆有关,在反应动力学上是属于二级反应。
3.特征:①因为E2反应不需侵入重围,攻击之中的碳原子,只需从旁拉走一个质子,因此立体阻碍在此并不如SN2反应般发生影响,因此在一、二、三级受质皆可发生反应。
②因为E2反应不会产生碳阳离子,故不会发生重排现象。
E2反应为一步反应,因此碱的强弱对其反应速率有很显著的影响,越强的碱能使反应进行越快,而对于离去基来说,E2反应需要好的离去基方能进行反应,但离去基的影响相较于E1反应并没有如此敏感,但是离去基越强,皆能增加E1及E2的反应速率。
第五章消除和加成反应

因此,E2 和SN2 反应常常同时进行。
5.1.1 β-消除反应
消除反应按E2 历程进行的最多。根据布尼特所提出的
E2 消除的可变过渡态理论,认为E2 为一系列双分子消除反 应历程的总称,而只是过渡状态中两个键断裂的程度有所不 同。也就是说键的破裂和生成并不一定是完全协同进行的。 在一定条件下, (1)C-H键破裂先于C-L键破裂和π键形成者,过渡态近 似于E1cB历程;
应,故称为E1cB。
(3) E2 历程
碱性试剂进攻β-H夺取氢质子,与离去基带着一对电子离去,
以及在两个碳原子间形成π键的过程是同时进行的。例:
H C2H5O CH2 CH2 Br C2H5OH
55 ℃
δ C2H5O
H CH2 CH2 δ Br
C2H5OH + CH2
CH2 + Br
E2 历程为一步反应。 速率=k[CH3CH2Br][C2H5O-] 在E2反应中,试剂还可以进攻α-碳原子,生成取代产物。
H+
R CH CH2R' OH
R CH CH2R' OH
RCH CHR' + H2O
5.1 消除反应
消除反应通常是指从一个分子上消除两个原子或基团, 生成不饱和化合物或环状化合物的反应。 (1)α-消除反应
C A - A,- B B C
(2)β-消除反应
C C E NU
ENu
C C
(3)其它消除反应
BH L-
C
C
(1) E1 历程
离去基团先带着一对电子离去,然后再失去一个质子,同 时生成π键。
第一步
H C H H
CH3 C Br CH3 C CH3
有机化学中的消除反应

有机化学中的消除反应有机化学中的消除反应是一种重要的反应类型,指的是有机物分子中的某种官能团或原子被去除,形成新的化学物质。
消除反应在有机合成、药物合成和生物化学等领域具有广泛的应用。
本文将介绍消除反应的机理、反应条件以及常见的消除反应类型。
一、消除反应的机理消除反应的机理可能有多种,其中最为常见的是亲核消除和酸催化消除。
1. 亲核消除机理亲核消除指的是一个亲核试剂攻击一个带有β氢的有机物分子,使其失去一个氢和一个卤素或其他官能团。
这个过程可以通过两个连续的步骤来描述:步骤一:亲核试剂攻击有机物分子中的碳原子,形成一个碳-亲核试剂中间体。
步骤二:中间体失去一个氢和一个卤素或其他官能团,产生消除产物和亲核试剂。
亲核消除通常需要存在β氢的有机物分子,而且该分子还要有足够的活化能,以便亲核试剂攻击。
2. 酸催化消除机理酸催化消除是以酸作为催化剂的消除反应。
酸可以使有机物中的其它官能团偏离其正常的反应路径,从而促使消除反应发生。
酸催化消除通常发生在酸性条件下,例如在浓硫酸或磷酸存在下进行。
二、常见的消除反应类型在有机化学中,存在多种消除反应类型,以下是其中几种常见的类型:1. β-消除β-消除是指当有机物分子中存在β位可活化的官能团时,它们往往会在适当的条件下发生消除反应。
常见的β-消除类型有:醇酸消除、亲核取代消除、脱氢消除等。
2. α-消除α-消除是指在有机物分子中,某个官能团与α位所连接的碳原子发生消除反应。
常见的α-消除类型有:鉍消除、卤素氢消除、萘环开启等。
3. 氧化消除氧化消除是指一种官能团在氧化剂的作用下发生消除,常见的氧化消除类型有:胺氧化消除、过氧化消除等。
4. 还原消除还原消除是指通过还原剂的作用,使含有特定官能团的有机物分子发生消除。
常见的还原消除类型有:酮醛消除、羧酸还原消除等。
三、消除反应的应用消除反应在有机合成中具有广泛的应用价值,常用于构建碳碳键和碳氧键等。
它可以用于合成具有复杂结构和功能的分子,例如天然产物合成、药物合成等。
13第十三章 消除反应

反应特点:1) 不需碱作催化剂 2) 环状过渡态机理 3) 通常是顺式消除。
高等有机化学
Advanced Organic Chemistry 35
2. 热消除反应举例 (1) 羧酸酯的热消除 -顺式消除,生成Hofmann烯烃
E’ D
CH3 CH
CEHCH3
△
OCOCHC3 H3
H2C CH
(80%)
HH
H2C C C CH2
H2C C C CH2 + Br2
Br
Br 1,4-消除
高等有机化学
Advanced Organic Chemistry 7
二.消除反应的历程
CC HL
根据离去基团和β-氢从分子中离去 的顺序,分为三种机理:
1. E1历程-单分子消除反应机理 2. E1cb历程-共轭碱单分子消除机理 3. E2历程-双分子消除反应机理
张力大 主要产物
高等有机化学
Advanced Organic Chemistry 22
四. 影响消除反应的因素 及消除反应与取代反应的竞争
1. 反应物结构的影响 2. 碱的影响 3. 离去基团的影响 4. 溶剂的影响 5. 温度的影响
高等有机化学
Advanced Organic Chemistry 23
V=k[反应物]
➢ 反应活性 R3CX > R2CHX > RCH2X 间接说明有正碳离子中间体生成
➢ 选择合适的反应底物, 在E1条件下完成消除反应 时,常常发现重排产物。
高等有机化学
Advanced Organic Chemistry 10
注意
1. 易于解离为碳正离子的化合物,通常按E1机理进行。 2. 有利于E1反应的因素:使碳正离子稳定的给电子基团;
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(CH3)3C -Cl
H2O C2H5OH
(CH3)3C-OH + CH3-C =CH2 CH3
CH3
E1反应的历程及反应活性: 反应的历程及反应活性:
CH3 CH ①、 3 _ C CH3 Br 慢
CH3 _ C+ + Br CH3
快 CH2 = C(CH3)2 + HB
CH3 ②、 BCH2 — C+ H CH3
对反应取向的解释 ——E2反应中两种过渡态稳定性的比较
δOC2H5
δC2H5O
H
H
H
H
CH3CH2— C — C — CH3 δBr H
CH3CH2CH2 — C — C —H δBr H
稳定性: (Ⅰ) 稳定性 Ⅰ
> (Ⅱ) Ⅱ
能够稳定产物烯烃的因素也能够稳定反应的过渡态, 能够稳定产物烯烃的因素也能够稳定反应的过渡态,因为反应的过渡态已 具有部分烯烃的性质。所以主要生成双键碳原子上烃基取代比较多的烯烃。 具有部分烯烃的性质。所以主要生成双键碳原子上烃基取代比较多的烯烃。 E1消除也同样遵循此规律。 消除也同样遵循此规律。 消除也同样遵循此规律
C
E Nu
△
C + Nu E
CF2+ CO2 + NaF
O CF3C ONa
1,3-消除: , -消除:
C C C Nu E
C C
E C + Nu
一、β— 消除反应 1、消除反应的两种历程(E1和 E2) 、消除反应的两种历程( 单分子消除) ⑴、 E1(单分子消除)反应 相似, 与SN1相似,分步进行,生成活性中间体 +: 相似 分步进行,生成活性中间体C
Β— H的位阻对消除取向的影响 的位阻对消除取向的影响
1丁烯%
CH3-CH-CH2-CH3 Br 19
2 丁 烯 %
81
CH3 Br
CH3 86 14 CH3
(试剂:C2H5ONa / C2H5OH) 试剂:
CH3-C-CH2-C-CH3
碱的体积对消除反应取向的影响
CH3 CH3-C-CH2-CH3 Cl CH3-C=CH-CH3 CH3 + CH2=C-CH2-CH3 CH3
消除反应的历程
(Mechanism for Elimination Reactions)
消除反应是指从一个较大的分子中消去一个较小的分子的反应.(消去的 消除反应是指从一个较大的分子中消去一个较小的分子的反应 消去的 分子可以是H 、 分子可以是 2O、ROH、RCOOH、NR3等。) 、 、 Or 从一个化合物分子中消除两个原子或原子团的反应。 从一个化合物分子中消除两个原子或原子团的反应。 分类: 分类
-
H2SO4
CH3 CH3 - C — CH - CH3 CH3 + OH2
-
- H2O
CH3 CH3 - C — CH - CH3 甲基迁移 CH3
CH3
CH3 —C — C — CH3 CH3 H
- H+
CH3 - C = C - CH3 H3C CH3
重排是单分子消除反应的标志
醇的脱水反应为E1历程 醇的脱水反应为 历程
消除增加
CH3X
RCH2X
R2CHX
R3CX
取代增加
所以,常用叔卤烷制备烯烃 伯卤烷制备醇 所以 常用叔卤烷制备烯烃,伯卤烷制备醇、醚等取代物 常用叔卤烷制备烯烃 伯卤烷制备醇、
2)试剂的碱性 试剂的碱性越强,浓度越大,越有利于E2反应。 试剂的碱性越强,浓度越大,越有利于E2反应。 E2反应 NH2-> RO- >OH- >CH3COO- >I• 当伯或仲卤烷用 当伯或仲卤烷用NaOH水解时 往往得到取代和消除两种产物 因为 水解时,往往得到取代和消除两种产物 因为:OH- 既 水解时 往往得到取代和消除两种产物(因为 是亲核试剂又是强碱); 是亲核试剂又是强碱 •而当卤烷与 而当卤烷与KOH的醇溶液作用时 由于试剂为碱性更强的烷氧负离子 的醇溶液作用时,由于试剂为碱性更强的烷氧负离子 而当卤烷与 的醇溶液作用时 由于试剂为碱性更强的烷氧负离子RO-,故 故 主要产物是烯烃 如果碱性加强或碱的浓度增加,消除产物的量也相应增加 烯烃; 消除产物的量也相应增加. 主要产物是烯烃 如果碱性加强或碱的浓度增加 消除产物的量也相应增加
DMSO CH3(CH2)5CH2BrCH3 + (CH3)3CONa (二甲亚砜) 二甲亚砜
CH3(CH2)5CH=CH2 99%
无论是发生E1反应还是发生 反应 的反应活性均为: 无论是发生 反应还是发生E2反应,RX的反应活性均为: 反应还是发生 反应, 的反应活性均为 RI > RBr > RCl 3oRX > 2oRX > 1oRX E1反应:3oC+最稳定容易形成; 反应: 最稳定容易形成; 反应 E2反应:3oR3CX能提供较多的可供消除的β-H。 反应: 能提供较多的可供消除的β 。 反应 能提供较多的可供消除的
H2O C2H5OH
(CH3)3C -Cl
(CH3)3C-OH + CH3-C =CH2 83% CH3 17%
OH2 (CH3)3C-OH
SN1
CH3 CH3C - Cl CH3
- Cl
-
CH3 a CH3C
CH2 - H b OH2
CH3 CH3C = CH2 E1
②、可能的条件下将发生重排
CH3 CH3 - C — CH - CH3 CH3 OH
%
C2H5O(CH3)3CO(C2H5)3CO-
%
30
72.5
88.5
70
27.5
11.5
烃基的结构与消除反应速率
反应物 CH3CH2Br CH3CH2CH2Br CH3CHCH3 Br (CH3)3CBr 产物 CH2 = CH2 CH3CH = CH2 CH3CH = CH2 (CH3)2C = CH2
X C SN2 B:
α
C H
β
SN1 E2
+ C
α
B:
C H
β
E1
反应究竟按照哪种方式进行,取决于底物的结构、试剂的碱性、 反应究竟按照哪种方式进行,取决于底物的结构、试剂的碱性、溶剂的性质 以及反应的温度等因素。 以及反应的温度等因素。
E2反应: 反应: 反应
C2H5O +
-
CH3__CH2 Br
可 被夺 取的 β-H的数目 的 参与σ-π超共 超 轭的 烷基 数目 速率
3 2 6 9
0 1 1 2
1 3.3 9.4 120
3、消除反应与亲核取代反应的竞争 P283-285 、 消除反应和亲核取代反应是由同一试剂进攻引起的,进攻α 消除反应和亲核取代反应是由同一试剂进攻引起的,进攻α-碳引起取 进攻β 氢引起消除。此二种反应是同时发生及互相竞争的。 代,进攻β-氢引起消除。此二种反应是同时发生及互相竞争的。
E2反应机理 反应机理
C2H5O + CH3 CH2 Br
__
C2H5O
H βCH
2
α CH2 Br
CHale Waihona Puke H5OH +CH2 = CH2
+ Br-
SN2反应机理 反应机理
H C2H5O- + CH3CH2Br C2H5O C
α
H Br C2H5OCH2CH3 + Br-
CH3
2、消除反应的取向 、
β β′ KOH CH3CH2-CH-CH3 CH3CH=CHCH3 + CH3CH2CH=CH2 C2H5OH 81 % 19 % Br
−C− C − − H OH
+H+ 质子化
−C− C − − H OH2
E1
-H2O
−C−− C − − H
-H+
C=C
醇的脱水总是在酸性条件下进行。在酸性条件下, 醇的脱水总是在酸性条件下进行。在酸性条件下,羟基发生质子化 由不良离去基变成良好离去基,在加热下失水生成碳正离子, 由不良离去基变成良好离去基,在加热下失水生成碳正离子,通过 E1历程进行消除。 历程进行消除。 历程进行消除
查依采夫规则: 查依采夫规则: 卤代烷在消除卤化氢时, 卤代烷在消除卤化氢时,总是优先得到双键碳原子上烃基取代比较多 的烯烃。 的烯烃。
稳定性原理:
活性中间体 反应 过 渡 态 的稳定性支配着反应的取向。
消除反应活性: (E1和E2一致 一致) 消除反应活性:叔>仲>伯(E1和E2一致) (1)对E1的解释:正碳离子稳定性,叔>仲>伯 ) 的解释:正碳离子稳定性, 的解释 的解释: (2)对E2的解释:过渡状态稳定性 ) 的解释 叔>仲>伯
注意有时反应中出现的例外: 注意有时反应中出现的例外: 1、烯丙型、苄基型卤代烃,消除时总是优先得到稳定的共轭烯烃: 烯丙型、苄基型卤代烃,消除时总是优先得到稳定的共轭烯烃:
CH3 CH2-CH-CH-CH3
β
CH3 C2H5ONa C2H5OH CH=CH-CH-CH3
Br
β
β
′
β′
CH2=CH-CH2-CH-CH2CH3 Br
C2H5O
H βCH
2
α CH2 Br
C2H5OH +
CH2 = CH2
+ Br-
SN2反应: 反应: 反应
H C2H5O- + CH3CH2Br C2H5O C
α
H Br C2H5OCH2CH3 + Br-
CH3
1)反应物的结构 ) 竞争中, 为主。 ⑴、1oRX在SN2、E2竞争中,以SN2 为主。 在 、 竞争中
