《分析化学》酸碱滴定曲线练习题
溶液的酸碱滴定练习题滴定曲线滴定终点与酸碱反应

溶液的酸碱滴定练习题滴定曲线滴定终点与酸碱反应溶液的酸碱滴定是一种常见的实验方法,用于确定溶液中酸碱物质的浓度。
在滴定过程中,通过向待测溶液中滴加已知浓度的酸碱溶液,观察化学指标的变化,从而确定待测溶液的浓度。
本文将通过几个酸碱滴定练习题,讨论滴定曲线、滴定终点以及酸碱反应等相关主题。
1. 题目一:强酸与强碱的滴定首先,我们考虑一种常见的酸碱滴定情景:强酸与强碱的滴定。
假设我们需要测定一溶液中NaOH的浓度,我们可以使用HCl作为滴定液。
在滴定过程中,逐渐向待测溶液中滴加HCl,观察滴定过程中pH值的变化。
首先,待测溶液中的pH值会随着HCl滴加量的增加逐渐下降。
当HCl滴加量较小的时候,待测溶液中的OH-离子会被中和,但pH值仍然较高。
当HCl和NaOH的物质摩尔比接近1:1时,待测溶液中的pH值会急剧下降,这个时候称为滴定终点。
滴定终点的出现是由于酸碱中和反应达到了摩尔比接近1:1的情况,滴定溶液的酸碱指示剂的颜色也会发生明显变化,用来指示滴定终点的指示剂可以是酚酞。
2. 题目二:弱酸与强碱的滴定接下来,让我们考虑不同酸碱性质的滴定情况。
例如,我们需要测定一溶液中乙酸(CH3COOH)的浓度,我们可以选择NaOH作为滴定液。
这里的滴定过程与题目一有所不同。
由于乙酸是一个弱酸,所以在滴定过程中pH值的变化就显得非常重要。
当NaOH滴加量较小的时候,乙酸在水溶液中仅部分中和产生CH3COO-离子,pH值会上升但仍然较低。
当NaOH滴加量逐渐增加时,CH3COOH的中和反应逐渐水解产生H2O和CH3COO-,pH值也会逐渐上升。
在滴定终点,CH3COOH的中和反应完全进行,pH值急剧上升,这个时候也是指示剂变色的点。
用于指示滴定终点的指示剂可以是溴酚蓝。
3. 题目三:多个酸碱滴定曲线的比较最后,让我们比较不同酸碱滴定曲线的特点。
我们以弱酸与强碱滴定曲线和弱碱与强酸滴定曲线为例。
在弱酸与强碱滴定曲线中,pH值的变化相对平缓,滴定终点的pH值较大,这是因为弱酸在水溶液中的电离程度较低,所以需要较大的NaOH滴加量才能使其完全中和。
山东大学分析化学练习题及答案02酸碱滴定法

第二章酸碱滴定法一、选择题1. 在水溶液中共轭酸碱对K a与K b的关系是------------------( )(A) K a·K b=1 (B) K a·K b=K w(C) K a/K b=K w(D) K b/K a=K w2. HPO42-的共轭碱是-----------------------------------( )(A) H2PO4-(B) H3PO4(C) PO43- (D) OH-3. 浓度相同的下列物质水溶液的pH最高的是-----------( )(A) NaCl (B) NaHCO3 (C) NH4Cl (D) Na2CO34. 相同浓度的CO32-、S2-、C2O42-三种碱性物质水溶液, 其碱性强弱(由大至小)的顺序是-----------------( )(已知H2CO3:p K a1 = 6.38,p K a2 = 10.25;H2S:p K a1 = 6.88 ,p K a2 = 14.15;H2C2O4:p K a1 = 1.22,p K a2 = 4.19 )(A) CO32->S2->C2O42-(B) S2->C2O42->CO32- (C)S2->CO32->C2O42-(D) C2O42->S2->CO32-5. 在H2C2O4溶液中,下列活度系数的排列顺序正确的是---------------( )(A) γ(HC2O4-) > γ(H+) > γ(C2O42-) (B) γ(H+) > γ(HC2O4-) >γ(C2O42-)(C) γ(C2O42-) > γ(HC2O4-) > γ(H+) (D) γ(HC2O4-) > γ(C2O42-) >γ(H+)6. 六次甲基四胺[(CH2)6N4]缓冲溶液的缓冲pH范围是---------( )⎨p K b[(CH2)6N4] = 8.85⎬(A) 4~6 (B) 6~8 (C)8~10 (D) 9~117. 在一定的温度下,活度系数与水合离子半径的关系是水合离子半径愈大,离子的活度系数-----------( )(A) 愈大(B) 愈小(C) 无影响(D) 先增大后减小8. H2A酸的pK a1= 2.0,pK a2= 5.0。
《分析化学》 酸碱滴定曲线练习题

酸碱滴定曲线练习题一、填空1.在酸碱滴定中,指示剂的选择是以为依据的。
2.强碱滴定弱酸,滴定曲线的突跃范围在碱性范围内,因此甲基橙、甲基红等都作为滴定的指示剂。
3.滴定范围的大小与滴定剂和被滴定物的浓度有关,浓度越,突跃范围越长,可供选择的指示剂越。
4.在酸碱滴定分析过程中,为了直观形象地描述滴定溶液中H+浓度的变化规律,通常以为纵坐标,以加入滴定剂的为横坐标,绘成曲线。
此曲线称为。
5.酸碱滴定曲线是以变化为特征的。
滴定时酸碱的浓度越大,滴定的突跃范围。
6.酸碱滴定法是用去滴定各种具有酸碱性的物质,当达到化学计量点时,通过滴定剂的体积和,按反应的关系,计算出被测物的含量。
7.在酸碱滴定中,选择指示剂是根据和来确定的。
8.二元弱酸被准确滴定的判断依据是,能够分步滴定的判据是。
二、判断题(正确的请在括号内打√,错误的打×)1.能用HCl标准溶液准确滴定0.1 mol·L-1NaCN。
已知HCN的K=4.9×10-10。
()2.强酸滴定强碱的滴定曲线,其突跃范围大小只与浓度有关。
()3.酸碱滴定中,化学计量点时溶液的pH值与指示剂的理论变色点的pH值相等。
()4.酸式滴定管一般用于盛放酸性溶液和氧化性溶液,但不能盛放碱性溶液。
()5.酸碱指示剂的选择原则是变色敏锐、用量少。
()6.各种类型的酸碱滴定,其化学计量点的位置均在突跃范围的中点。
()三、选择题(下列各题只有一个正确答案,请将正确答案填在括号内 )1.由于弱酸弱碱的相互滴定不会出现突跃,也就不能用指示剂确定终点,因此在酸碱滴定法中,配制标准溶液必须用()。
A.强碱或强酸B.弱碱或弱酸C.强碱弱酸盐D.强酸弱碱盐2.用NaOH测定食醋的总酸量,最合适的指示剂是()。
A.中性红B.甲基红C.酚酞D.甲基橙3.在酸碱滴定中,一般把滴定至等量点()的溶液pH值变化范围称为滴定突跃范围。
A. 前后±0.1%相对误差B. 前后±0.2%相对误差C. 0.0%D. 前后±1%相对误差4.用强碱滴定一元弱酸时,应符合cK a≥10-8的条件,这是因为()。
分析化学酸碱滴定法试卷

概论及酸碱滴定法作业一、填空题1. 写出下列物质的PBE :1)NH 4HCO 3水溶液的PBE 为( )。
2)NaNH 4HPO 4水溶液的PBE 为( )。
2. 一元弱酸HA 在溶液中以( )和( )两种型体存在,若一元弱酸的解离常数为Ka ,则两种型体的分布分数分别为:δHA =( ),δA -=( )。
当pH=pKa 时,δHA =δA -=0.5;当pH <pKa 时, δHA ( )δA -,溶液中以( )为主要的存在型体;当pH >pKa 时, δHA ( )δA -,溶液中以( )为主要的存在型体。
3. 用0.20 mol·L -1NaOH 溶液滴定0.10 mol·L -1酒石酸溶液时,在滴定曲线上出现个突跃范围。
(酒石酸的1pKa 3.04=,2pKa 4.37=)4. 根据酸碱质子理论,OH -的共轭碱是 。
5. H 2C 2O 4的pKa 1=1.2, pKa 2=4.2。
当pH=1.2时,草酸溶液中的主要存在形式是_____________当[HC 2O 4-]达最大值时的pH=______。
6. 酸碱滴定曲线是以 变化为特征的。
滴定时酸、碱的浓度愈 ,滴定突跃范围愈 。
酸碱的强度愈 ,则滴定的突跃范围愈 。
7. 某酸碱指示剂的pK =10.1,则该指示剂的pH 变色范围大约为 。
8. 有一碱液,可能是NaOH ,或Na 2CO 3,或NaHCO 3,或它们的混合物溶液。
今用标准盐酸滴定,若以酚酞为指示剂,耗去盐酸V 1 mL ;若取同样量的该碱液,也用盐酸滴定,但以甲基橙为指示剂,耗去盐酸V 2mL 。
试由V 1与V 2的关系判断该碱液的组成;(1)当V 1=V 2时,组成是 (2)当V 2=2 V 1时,组成是(3)当V 2>2 V 1时,组成是 (4)当V 1<V 2<2 V 1时,组成是(5)当V 1=0, V 2>0时,组成是9.已知NH 3的K b =1.8×10-5, 当NH 3-NH 4Cl 缓冲溶液的pH=9.0时, 该溶液中 [NH 3]/[NH 4Cl]为_ _。
分析化学作业及答案

分析化学作业第一章 概述一、选择题1.根据置信度为 95% 对某项分析结果计算后,写出的合理分析结果表达式应为(B )。
a. ( 25.48 ± 0.1) % b. ( 25.48 ± 0.13 ) %c. ( 25.48 ± 0.135 )%d. ( 25.48 ± 0.1348 ) %2.分析测定中的偶然误差,就统计规律来讲,(d )。
a. 数值固定不变b. 数值随机可变c. 无法确定d. 正负误差出现的几率相等3. 某小于1的数精确到万分之一位,此有效数字的位数是( d )。
a.1b.2c.4d.无法确定4. 消除或减小试剂中微量杂质引起的误差常用的方法是( A )。
A.空白实验B.对照实验C.平行实验D.校准仪器5.可用于减小测定过程中偶然误差的方法是( D )。
A .对照实验 B. 空白实验 C .校正仪器 D. 增加平行测定次数6.对某试样进行平行三次测定,得 CaO 平均含量为 30.60% ,而真实含量为 30.30% ,则 30.60%-30.30% = 0.30% 为( B )。
A. 相对误差B. 绝对误差C. 相对偏差D. 绝对偏差二、判断正误1.在分析测定中,测定的精密度越高,则分析结果的准确度越高(x )。
2.有效数字是指所用仪器可以显示的数字( x )。
3.分析结果的置信度要求越高 , 置信区间越小(x )。
4.对某项测定来说,它的系统误差大小是不可测量的(x )。
第二章 滴定分析概论一、选择题1.欲配制 1000ml 0.1mol/L HCl 溶液,应取浓盐酸(B )。
a. 0.84mlb. 8.4mlc. 1.2m ld. 12ml2. .用NaC 2O 4( A )标定KMnO 4( B )时,其反应系数之间的关系为(a )。
a. n A =5/2n B b. n A =2/5n Bc. n A =1/2 n Bd. n A =1/5n B3. .已知1mLKMnO 4相当于0.005682g Fe 2+,则下列表示正确的是( b )。
酸碱滴定化学反应 练习题

酸碱滴定化学反应练习题
1.试说明滴定反应的基本原理。
2.已知硝酸(HNO3)是一种强酸,氨水(NH3)是一种弱碱,请回答以下问题:
a) 当用0.1M硝酸滴定0.05M氨水时,应如何选择指示剂?请解释原因。
b) 如果反过来用0.05M氨水滴定0.1M硝酸,应如何选择指示剂?请解释原因。
3.某种化合物X为一种固体物质,在水中溶解形成酸性溶液,试判断该化合物X是酸还是碱。
请列出可能的化合物X,并说明原因。
4.请解释滴定过程中终点和终点指示剂之间的关系。
5.在滴定中,为什么滴加试剂的速度要逐渐变慢?
6.为了准确测定一种酸或碱的浓度,为什么要进行多次滴定?最少需要几次滴定?
7.试说明酸碱指示剂的选择应注意的原则。
8.滴定中的滴定误差会对结果产生哪些影响?如何减小滴定误差?
9.氢氧化钠(NaOH)是一种强碱,硫酸(H2SO4)是一种强酸。
请回答以下问题:
a) 当硫酸溶液滴定氢氧化钠溶液时,如何选择指示剂?请解释原因。
b) 当氢氧化钠溶液滴定硫酸溶液时,应如何选择指示剂?请解释原因。
10.已知ML为一种弱酸,已知其酸解离常数(Ka)较小,请回答以下问题:
a) 在滴定过程中,为了取得良好的滴定曲线,应该调整溶液的酸碱比例是偏酸、偏碱还是中性?请解释原因。
b) 若ML浓度较高,在滴定过程中应采用哪种指示剂?请解释原因。
以上是关于酸碱滴定化学反应的练题,希望对你有帮助。
分析化学 第五章 酸碱滴定法(习题)

第五章 酸碱滴定法一、选择题1、 浓度为c(HAc)(mol .L -1)的HAc 溶液中加入c(HCl)(mol .L -1) HCl 和c(NaOH)(mol .L -1)NaOH 后的质子平衡方程是 A. [H +]+ c(HCl)=[Ac -]+ c(NaOH)+[OH -] B. [H +]=[Ac -]+ c(NaOH)+[OH -] + c(HCl) C. [H +]+ c(HCl) + c(NaOH)=[Ac -]+[OH -] D. [H +]+ c(NaOH) =[Ac -]+ c(HCl)+[OH -] 答案:D2、 下列各组酸碱对中,属于共轭酸碱对的是A. H 2CO 3—CO 32-B. H 3O +—OH -C. HPO 42-—PO 43-D. NH 3+CH 2COOH —NH 2CH 2COO - 答案:C3、 用0.10 mol .L -1 NaOH 溶液分别滴定25mL 某一H 2SO 4和HCOOH 溶液,若消耗的NaOH 体积相同,则这两种溶液中H 2SO 4和HCOOH 浓度之间的关系是 A. c(HCOOH)=c(H 2SO 4) B. 4c(HCOOH)=c(H 2SO 4)C. c(HCOOH)=2c(H 2SO 4)D. 2c(HCOOH)=c(H 2SO 4) 答案:C解: 2NaOH~1H 2SO 4,1NaOH~1HCOOH ,消耗的NaOH 体积相同,HCOOH SO H c c 2142=。
4、 今有0.20 mol .L -1二元弱酸H 2B 溶液30mL ,加入0.20 mol .L -1 NaOH 溶液15mL时的pH= 4.70;当加入30mLNaOH 时,达到第一化学计量点的pH= 7.20。
则H 2B 的2a pK 是 A. 9.70 B. 9.30 C. 9.40 D. 9.00 答案:A解:中和到pH= 4.70时,溶液成为1:1:2=NaHB B H c c 的缓冲溶液,70.411lg 70.4lglg2121=-=-=⇒+=--BH HB a BH HB a c c pH pK c c pK pH达到第一化学计量点时,溶液成为0.10 mol .L -1 NaHB 溶液][)][(][121--+++=HB K K HB K K H a W a a当 c HB ≈-][,W a K c K 202>,120a K c >21][a a K K H =∴+,即 )(2121a a pK pK pH +=70.970.420.72212=-⨯=-=a a pK pH pK5、 用标准NaOH 溶液滴定同浓度的HAc ,若两者的浓度均增大10倍,以下叙述滴定曲线pH 突跃大小,正确的是 A. 化学计量点前后0.1%的pH 均增大B. 化学计量点前0.1%的pH 不变,后0.1%的pH 增大C. 化学计量点前0.1%的pH 减小,后0.1%的pH 增大D. 化学计量点前后0.1%的pH 均减小 答案:B解:化学计量点前0.1%形成的是NaAc —HAc 缓冲溶液HAcAc HAc a c c pK pH -+=lg)(,)前()前(21pH pH =∴化学计量点后0.1%形成的是NaAc —NaOH 溶液,)(lg 14过量NaOH c pH -= NaOH 的浓度增大,pH 也增大。
2021年高考化学考点62酸滴定碱的曲线必刷题

考点六十二酸滴定碱的曲线1.室温下,将0.10 mol·L-1 盐酸滴入20.00 mL 0.10 mol·L-1 氨水中,溶液中pH和 pOH随参加盐酸体积变化曲线如下图。
:pOH=-lg c(OH-),以下正确的选项是〔〕A. M点所示溶液中可能存在c(Cl-)> c(NH4+)B. N点所示溶液中可能存在c(NH4+)+c(NH3•H2O)=c(Cl-)C. Q点盐酸与氨水恰好中和D. M点到Q点所示溶液中水的电离程度先变大后减小【答案】B2.室温下,用一样物质的量浓度的 HC1 溶液,分别滴定物质的量浓度均为 0.1 mol/L 的三种碱溶液,滴定曲线如下图。
以下判断正确的选项是A.滴定前,三种碱溶液中水电离出的 c(H+)大小关系: DOH>BOH>AOHB. pH= 7 时,c(A+)=c(B+)=c(D+)C.滴定至 P 点时,溶液中:c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+)D.当中和百分数达 100%时,将三种溶液混合后:c(AOH)+c(BOH)+c(DOH)=c(H+)-c(OH-)【答案】D3.常温下,在20.0mL0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图。
0.10mol•L-1氨水的电离度为1.32%,以下表达错误的选项是〔〕C. M点处的溶液中c(H+)=c(OH-) D. N点处的溶液中pH>12【答案】D【解析】A.强酸弱碱相互滴定时,由于生成强酸弱碱盐使溶液显酸性,那么应选择甲基橙作指示剂,故A 表达正确;B.如果M点盐酸体积为20.0mL,那么二者恰好完全反响生成氯化铵,氯化铵中铵根离子水解导致该点溶液应该呈酸性,要使溶液呈中性,那么氨水应该稍微过量,所以盐酸体积小于20.0mL,故B表达正确;C.M处溶液呈中性,那么存在c〔H+〕=c〔OH-〕,故C表达正确;D.N点为氨水溶液,氨水浓度为0.10mol•L-1,该氨水电离度为1.32%,那么该溶液中c〔OH-〕=0.10mol/L×1.32%=1.32×10-3mol/L,c〔H+〕=10−14/1.32×10−3mol/L=7.6×10-12mol/L,所以该点溶液pH<12,故D表达错误。
酸碱滴定曲线分析练习题分析酸碱滴定曲线并确定等价点

酸碱滴定曲线分析练习题分析酸碱滴定曲线并确定等价点酸碱滴定曲线是化学实验中常用的一种实验方法,用于确定溶液中酸碱物质的浓度以及确定等价点。
本文将通过解答酸碱滴定曲线分析练习题的方式,来分析酸碱滴定曲线并确定等价点。
一、题目1已知0.1mol/L的硫酸溶液(酸性)滴入0.05mol/L的氢氧化钠溶液(碱性),请绘制滴定曲线,并确定等价点。
解析:1. 首先,我们需要根据已知的浓度和体积计算出反应物的物质量以及摩尔数。
假设我们滴定的硫酸溶液体积为V1,氢氧化钠溶液体积为V2。
硫酸的摩尔数(n1)= 浓度(C1)×体积(V1)= 0.1 × V1 (mol)氢氧化钠的摩尔数(n2) = 浓度(C2) ×体积(V2)= 0.05 × V2 (mol)2. 在滴定过程中,硫酸与氢氧化钠发生酸碱中和反应,反应方程如下:H2SO4 + 2NaOH → Na2SO4 + 2H2O根据反应方程,可以得知反应物的摩尔比为1:2。
因此,在反应结束后,硫酸与氢氧化钠的摩尔数满足以下关系:n1 = 2n23. 根据滴定过程和酸碱滴定曲线的特点,可以得出下面的结论:a. 当硫酸与氢氧化钠刚开始混合时,酸性溶液中的H+离子和碱性溶液中的OH-离子迅速中和,pH值逐渐升高。
b. 随着反应的进行,等价点附近,酸性溶液中的H+离子与碱性溶液中的OH-离子的摩尔比接近1:1,pH值逐渐增加到最大值。
c. 在等价点附近,溶液的酸性碱性程度相对较弱,pH值维持在较高的水平。
d. 等价点之后,碱性溶液中的OH-离子多于酸性溶液中的H+离子,pH值逐渐下降。
4. 根据以上分析和知识,我们可以得出酸碱滴定曲线的大致形状。
根据题目中的浓度和体积数据,可以绘制出对应的酸碱滴定曲线,并找到等价点。
5. 等价点的确定方法:a. 通过绘制的酸碱滴定曲线,我们可以根据pH值的变化情况找到变化最为剧烈的点,即为等价点。
分析化学习题第章滴定分析法

习题 1(酸碱滴定一)1.用0.1000 mol·L-1 NaOH溶液滴定0.1000 mol·L-1的甲酸溶液,化学计量点pH是多少?计算用酚酞做指示剂(pH=9.0)时的终点误差。
(参考答案)答:2.用mol·L-1的HCl溶液滴定20.00 mL mol·L-1的,化学计量点前后0.1%的pH是多少?若用酚酞做指示剂(PT为9.0)计算终点误差。
(参考答案)答:化学计量点前0.1%:3.用0.1000 mol·L-1 HCl溶液滴定20.00 mL0.1000 mol·L-1的NaOH,若NaOH溶液中同时含有0.1000 mol·L-1的NaAc。
计算化学计量点以及化学计量点前后0.1%时的pH。
若滴定到pH7.0,终点误差有多大?(参考答案)答:(1) 化学计量点时,体系中有0.0500 mol·L-1 NaAc。
4.用0.2000 mol·L-1HCl溶液滴定0.2000 mol·L-1一元弱碱B(p K b=6.0),计算化学计量点的pH和化学计量点前后0.1%的pH。
若所用溶液的浓度都是0.0200 mol·L-1,结果又如何?(参考答案)答:(1)化学计量点时(2)当浓度为0.0200 mol·L-1时5.计算0.1000 mol·L-1NaOH滴定0.1000 mol·L-1至pH=5.0和pH=10.0时的终点误差。
(参考答案)答:滴定至pH=5.0,相当于滴定至6.用克氏定氮法测定试样含氮量时,用过量的100 mL0.3 mol·L-1HCl吸收氮,然后用0.2 mol·L-1NaOH 标准溶液返滴。
若吸收液中氨的总浓度为0.2 mol·L-1,计算化学计量点pH和返滴到pH为4.0及7.0时的终点误差。
酸碱滴定练习题(1)

酸碱滴定练习题(1)酸碱滴定练习题一、单选题1、用基准无水碳酸钠标定L盐酸,宜选用()作指示剂。
A、溴钾酚绿—甲基红B、酚酞C、百里酚蓝D、二甲酚橙2、配制好的HCl需贮存于( )中。
A、棕色橡皮塞试剂瓶B、塑料瓶C、白色磨口塞试剂瓶D、白色橡皮塞试剂瓶3、用c(HCl)= mol?L-1 HCl溶液滴定c(NH3)= mol?L-1氨水溶液化学计量点时溶液的pH值为()A、等于;B、小于;C、等于;D、大于。
4、欲配制pH=缓冲溶液应选用的一对物质是()A、HAc(Ka=×10-5)~NaAc B 、HAc~NH4AcC、NH3?H2O (Kb=×10-5)~NH4ClD、KH2PO4-Na2HPO4( )5、欲配制pH=缓冲溶液应选用的一对物质是:A、HAc(Ka=×10-5)~NaAc B 、HAc~NH4AcC、NH3?H2O (Kb=×10-5)~NH4ClD、KH2PO4-Na2HPO46、在酸碱滴定中,选择强酸强碱作为滴定剂的理由是()A、强酸强碱可以直接配制标准溶液;B、使滴定突跃尽量大;C、加快滴定反应速率;D、使滴定曲线较完美.8、(1+5)H2SO4这种体积比浓度表示方法的含义是()A、水和浓H2SO4的体积比为1:6B、水和浓H2SO4的体积比为1:5C、浓H2SO4和水的体积比为1:5D、浓H2SO4和水的体积比为1:610、用LHCl滴定L NA2CO3至酚酞终点,这里NA2CO3的基本单元数是()A、 NA2CO3B、2 NA2CO3C、1/3 NA2CO3D、1/2 NA2CO311、下列弱酸或弱碱(设浓度为L)能用酸碱滴定法直接准确滴定的是()A、氨水(Kb=×10-5)B、苯酚(Kb=×10-10)C、NH4+D、H3BO3(Ka=×10-10)12、用L HCl滴定L NaOH时的pH突跃范围是,用L HCl滴定L NaOH的突跃范围是()A、 B、 C、 D、13、某酸碱指示剂的KHn=×105,则从理论上推算其变色范围是()A、4-5B、5-6C、4-6D、5-714、用NaAc?3H2O晶体,来配制PH为的HAC-NaAc缓冲溶液1升,其正确的配制是()(Ka=×10-5)A、将49克NaAc?3H2O 放入少量水中溶解,再加入50ml 2.0mol/LHAc溶液,用水稀释1升B、将98克NaAc?3H2O放少量水中溶解,再加入50ml lHAc溶液,用水稀释至1升C、将25克NaAc?3H2O放少量水中溶解,再加入100ml LHAc 溶液,用水稀释至1升D、将49克NaAc?3H2O放少量水中溶解,再加入100ml LHAc 溶液,用水稀释至1升17、用酸碱滴定法测定工业醋酸中的乙酸含量,应选择的指示剂是:()A、酚酞B、甲基橙C、甲基红D、甲基红-次甲基蓝18、已知邻苯二甲酸氢钾(用KHP表示)的摩尔质量为 g/mol,用它来标定L的NaOH 溶液,宜称取KHP质量为()A、左右;B、1g左右;C、左右;D、左右。
《分析化学》第4章》酸碱滴定复习题及答案

一、判断题1、(酸碱的概念)水是一种酸碱两性溶剂。
(√)2、(酸碱强弱的判断) 甲酸的pKa=3.74,乙酸的pKa=4.74,所以乙酸的酸强度比甲酸高。
(×)3、(酸碱强弱的判断) 硼酸的pKa=9.24,氢氟酸的pKa=3.20,所以硼酸的酸强度比氢氟酸高。
(×)4、(共轭酸碱的强弱关系) 某酸的酸强度越弱,则其共轭碱的碱强度越强。
(√)5、(指示剂的加入量) 滴定分析中多加指示剂可使滴定终点变色更明显,故应多加指示剂。
(×)6、(混合指示剂) 混合指示剂的变色范围常比单一指示剂变色范围窄,故用正确的混合指示剂可使终点误差变小。
(√)7、酸碱滴定突跃是指滴定体系在计量点附近误差允许范围内的pH值急骤变化。
(√)8、强酸滴定弱碱的计量点的pH值大于7。
(×)9、可依据滴定曲线获得滴定突跃范围,进而选择合适的指示剂。
(√)10、一般不可以利用盐酸标准溶液滴定醋酸钠而获得醋酸钠的浓度,因为醋酸根的碱性不够强。
(√)11、用NaOH滴定HCl,用酚酞作指示剂优于甲基橙。
(√)12、HCl滴定NaOH时,用酚酞作指示剂优于甲基橙。
(×)13、用NaOH滴定酸时,都可选酚酞作指示剂。
(×)14、NH3质子条件式为[H+]+[NH4+] = [OH-]。
(√)15、NaHCO3质子条件式为[H+]+[H2CO3] = [CO32-]+[OH-]。
(√)16、Na2CO3质子条件式为[HCO3-]+[H+]+[H2CO3] = [OH-]。
(×)17、NH4HCO3质子条件式为[H+]+[H2CO3] = [NH3]+[CO32-]+[OH-]。
(√)18、酸碱滴定中指示剂的变色范围最好完全处于滴定的pH突跃范围内。
(√)19、苯胺的pK b=9.34,其碱性太弱,不能用酸碱滴定法直接测定。
(√)20、醋酸钠NaOAc呈碱性,可用强酸直接滴定法测定其含量。
分析化学第五版题库试题选编(第五章酸碱滴定法)

某三元酸H3A的p K a1= 3.96、p K a2= 6.00、p K a3= 10.02,则0.10 mol/L Na3A溶液的pH是-----------------------------------------------------------------------------------------------------------( )(A) 8.01 (B) 10.02 (C) 11.51 (D) 12.51(C)2分(0302)HPO42-的共轭碱是---------------------------------------------------------------------------------( )(A) H2PO4-(B) H3PO4(C) PO43-(D) OH-2 分(0302)(C)1分(0307)0307浓度相同的下列物质水溶液的pH最高的是----------------------------------------------( )(A) NaCl (B) NaHCO3(C) NH4Cl (D) Na2CO31分(0307)0307(D)2 分(0309)水溶液呈中性是指--------------------------------------------------------------------------------( )(A) pH = 7 (B) [H+] = [OH-](C) pH+pOH = 14 (D) pOH = 72 分(0309)(B)2分(0314)0314某MA2型(M2+、A-)电解质溶液,其浓度c(MA2) = 0.10mol/L,则该溶液的离子强度为--------------------------------------------------------------------------------------------------------------( )(A) 0.10 mol/L (B) 0.30 mol/L(C) 0.40 mol/L (D) 0.60 mol/L2分(0314)0314(B)2分(0321)0321在磷酸盐溶液中,HPO42-浓度最大时的pH是-----------------------------------------------( ) (已知H3PO4的解离常数p K a1 = 2.12, p K a2= 7.20, p K a3 = 12.36)(A) 4.66 (B) 7.20 (C) 9.78 (D) 12.362分(0321)0321(C)2分(0339)丙二酸[CH2(COOH)2]的p K a1 = 3.04, p K a2 = 4.37,其共轭碱的K b1 = _______________, K b2 = ______________________。
高考化学一轮复习酸碱中和滴定曲线大全专题02酸度曲线练习(2021年整理)

专题02 酸度曲线1.化学上常用AG表示溶液中的。
25℃时,用0。
100 mol/L盐酸溶液滴定10mL0.1 mol/L MOH溶液,滴定曲线如下图所示。
下列说法正确的是A。
该流定过程可选择酚酞作为指示剂B。
溶液中由水电离的c(H+): C点〉D点C。
C点时加入盐酸溶液的体积等于10 mLD. 若B点加入的盐酸溶液体积为 5 mL,所得榕液中: c(M+) +c(H+)= c(MOH)+ c(OH—)【答案】B2.化学上常用AG表示溶液中的。
25℃时,用0。
100 mol/L 的NaOH溶液滴定20.00 mL0。
100mol/L的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是A. 随着NaOH溶液的加入,增大B. 25 ℃时,HNO2的电离常数Ka≈1。
0×C. b点溶液中存在D. a、b、c、d、e五点的溶液中,水的电离程度最大的点是d【答案】A【解析】A、HNO2中加入NaOH发生HNO2+NaOH=NaNO2+H2O,c(H+)减小,c (NO2-)增加,即随着氢氧化钠的量增加而减小,故A说法错误;B、根据a点进行计算,c(H+)/c(OH-)=10-8.5,根据c(H+)×c(OH-)=Kw,解得c(H+)=10-2。
75mol·L-1,根据Ka=≈1.0×,故B说法正确;C、b点溶液中存在的溶质为等物质的量为HNO2和NaNO2,根据电荷守恒,c(H+)+c(Na+)=c(NO2-)+c(OH-),根据物料守恒,2c(Na+)=c(NO2-)+c(HNO2),联立解得2c(H+)-2c(OH-)=c(NO2-)-c(HNO2),故C说法正确;D、HNO2、NaOH抑制水的电离,随着NaOH的量增多,对水的抑制减弱,当HNO2全部转化成NaNO2,即溶质为NaNO2,NO2-发生水解促进水的电离,即水的电离程度最大的是d点,故D说法正确.3.25℃时,NH4+的水解平衡常数为K b=5。
精品高考化学一轮复习酸碱中和滴定曲线大全专题03酸滴定盐或碱滴定盐曲线练习

专题03 酸滴定盐或碱滴定盐曲线1.在常温下,用0.1000 mol/L的盐酸滴定25 mL 0.100 mol/Lna2CO3溶液,所得滴定曲线如下图所示。
下列相关微粒浓度间的关系不正确的是A. a点: c(CO32-) >c(Cl-)> c(HCO3-)B. b点: c(Na+)+c(H+)= c(Cl-)+ c(HCO3-)+2c(CO32-)+c(OH-)C. c点: c(OH-)+ c(CO32-)= c(H+) +c(H2CO3)D. d点: c(Cl-)= c(Na+)【答案】A2.H2RO3是一种二元酸,常温下用1L1mol·L-1 Na2RO3溶液吸收RO2气体,溶液的pH随RO2气体的物质的量的变化如图所示。
下列说法正确的是A. a点溶液中2c(Na+)=3c(RO32-)B. 向b点溶液中加水可使溶液的pH由6.2升高到7.4C. 常温下,NaHRO3溶液中c(HRO3-)>c(RO32-)>c(H2RO3)D. 当吸收RO2的溶液呈中性时,c(Na+)=c(RO32-)+c(HRO3-)【答案】C【解析】a点溶液中含有H2RO31mol,H2RO3+H2O+RO2=2NaHRO3所以a点通入1/3 mol RO2后,溶液中生成钠离子2mol,RO32-为2/3 mol,此时a点溶液呈碱性,说明RO32-离子发生了水解,则2c(Na+)>3c(RO32-),A错误;b点导致溶液碱性的因素是HRO3-的电离,因此溶液加水后生成的氢离子浓度逐渐减小,pH会只能无限接近7,不会超过7,B错误;当通过5/6 molRO2时,溶液中生成5/3mol NaHRO3,剩余Na2RO3为1/6 mol,此时溶液的pH=6.2显酸性,说明HRO3-以电离为主,故常温下,NaHRO3溶液中,c(HRO3-)>c(RO32-)>c(H2RO3),C正确;当吸收RO2的溶液呈中性时,根据电荷守恒:c(H+)+c(Na+)=2c(RO32-)+c(HRO3-)+c(OH-),由于c(H+)=c(OH-),所以c(Na+)=2c(RO32-)+c(HRO3-),D错误;正确选项C。
高二化学关于酸碱中和滴定曲线的计算练习题

高二化学关于酸碱中和滴定曲线的计算练
习题
1. 某实验中,我们需要测定一种强酸的浓度,使用了一种已知
浓度的强碱进行滴定。
已知强酸溶液的摩尔浓度为0.05 mol/L,滴
定时,滴加了15 mL的强碱溶液后,指示剂的颜色发生了变化。
已
知强酸和强碱的质量反应比为1:1。
请计算该酸溶液的摩尔浓度。
2. 在另一次实验中,我们需要测定一种弱酸的浓度,同样使用
了一种已知浓度的强碱进行滴定。
已知弱酸溶液的摩尔浓度为0.1 mol/L,滴定时,滴加了30 mL的强碱溶液后,指示剂的颜色发生
了变化。
已知弱酸和强碱的质量反应比为1:2。
请计算该酸溶液的
摩尔浓度。
3. 又一次实验中,我们需要测定某个酸的浓度,使用了一种已
知浓度的强碱进行滴定。
已知该酸溶液的摩尔浓度为0.05 mol/L,
滴定时,滴加了20 mL的强碱溶液后,指示剂的颜色发生了变化。
已知该酸和强碱的质量反应比为2:1。
请计算该酸溶液的摩尔浓度。
4. 在最后一个实验中,我们需要测定一种弱酸的浓度,同样使用了一种已知浓度的强碱进行滴定。
已知弱酸溶液的摩尔浓度为0.2 mol/L,滴定时,滴加了40 mL的强碱溶液后,指示剂的颜色发生了变化。
已知弱酸和强碱的质量反应比为1:1。
请计算该酸溶液的摩尔浓度。
---
1. 强酸溶液的摩尔浓度为0.05 mol/L。
2. 弱酸溶液的摩尔浓度为0.05 mol/L。
3. 酸溶液的摩尔浓度为0.025 mol/L。
4. 酸溶液的摩尔浓度为0.1 mol/L。
《分析化学》酸碱滴定曲线及指示剂的选择练习题

《分析化学》酸碱滴定曲线及指示剂的选择练习题《分析化学》酸碱滴定曲线及指示剂的选择练习题一、填空1、滴定曲线2、滴定突跃3、指示剂的选择原则是_________________________________________________________________________________________________________________ __4、滴定范围的大小与滴定剂和被滴定物的浓度有关,浓度越,突跃范围越长,可供选择的指示剂越。
5、直接滴定弱酸的依据6、弱酸的浓度和Ka越大,突跃范围7.某溶液中加入酚酞和甲基橙各一滴,显黄色,说明此溶液的pH 值范围是。
8.硼酸是___元弱酸;因其酸性太弱,在定量分析中将其与____反应,可使硼酸的酸性大为增强,此时溶液可用强酸以酚酞为指示剂进行滴定。
9.多元酸能被准确滴定的条件是,分步滴定的条件是。
10.最理想的指示剂应是恰好在时变色的指示剂。
11.用强碱滴定一元弱酸时,使弱酸能被准确滴定的条件是。
12.在酸碱滴定中,指示剂的选择是以为依据的。
13.酸碱指示剂(HIn)的理论变色范围是pH= ,选择酸碱指示剂的原则是。
14.[OH—]= 0.10 mol/L的溶液中,pH= 。
15.六亚甲基四胺的pKb=8.85,用它配制缓冲溶液时的pH范围是。
16.酸碱指示剂的变色范围为,选择指示剂的原则为,指示剂的变色范围应落在滴定的之内。
二、选择1. 酸碱滴定突跃范围为7.0~9.0,最适宜的指示剂为()A.甲基红(4.4~6.4)B.酚酞(8.0~10.0)C.中性红(6.8~8.0)D.甲酚红(7.2~8.8)2.pH变色范围为8.0~9.8的指示剂是()A.甲基橙B.甲基红C.石蕊D.酚酞3.某酸碱指示剂的pK Hln=5,其理论变色范围是()pHA.2~8B.3~7C.4~6D.5~74.浓度为0.1 mol/L HAc(Ka=1.8×10-5)溶液的pH是()A、4.87B、3.87C、2.87D、1.875.pH =1.00的HCl溶液和pH =13.00的NaOH溶液等体积混合后pH是()A、14B、12C、7D、66.各类型的酸碱滴定,其化学计量点的位置均在()A.pH=7B.pH>7C.pH<7D.突越范围中点7.酸碱滴定中选择指示剂的原则是()A、指示剂变色范围与化学计量点完全符合B、指示剂应在pH 7.00时变色C、指示剂的变色范围应全部或部分落入滴定pH突跃范围之内D、指示剂变色范围应全部落在滴定pH突跃范围之内8.浓度为0.10 mol/L NH4Cl (Kb=1.8×10-5)溶液的pH是()A、5.13B、4.13C、3.13D、2.139、将甲基橙指示剂加到一无色水溶液中,溶液呈黄色,该溶液的酸碱性为()A、中性B、碱性C、酸性D、不能确定其酸碱性10、当弱酸满足()时,方可准确滴定。
酸碱滴定法课后习题和答案解析

第四章酸碱滴定法习题4-1下列各种弱酸的p K a已在括号内注明,求它们的共轭碱的pK b;?? (1)HCN;(2)HCOOH;(3)苯酚;(4)苯甲酸。
? 已知H3PO4的p K a=,p K a=,p K a=。
求其共轭碱PO43-的pK b1,HPO42-的pK b2.和H 2PO4-的p Kb3。
? 已知琥珀酸(CH2COOH)2(以H2A表示)的p K al=,p K b1=。
试计算在和时H2A、HA-和A2-的分布系数δ2、δ1和δ。
若该酸的总浓度为·L-1,求pH=时的三种形式的平衡浓度。
分别计算H 2CO 3(p K a1=,pK a2=在pH=,及时,H 2CO 3,HCO 3-和CO 32-的分布系数δ2` δ1和δ0。
已知HOAc 的p Ka = ,NH 3·H 2O 的pKb=。
计算下列各溶液的pH 值: (1) mol·L -1 HOAc ; (2) mol·L -1 NH 3·H 2O ;(3) mol·L -1 NH 4Cl ; (4) mol·L -1 NaOAc 。
计算浓度为mol·L-1的下列物质水溶液的pH(括号内为p Ka)。
(1)苯酚;(2)丙烯酸;(3)吡啶的硝酸盐(C5H5NHNO3)。
解:(1) 苯酚计算浓度为mol·L-1的下列物质水溶液的pH(p Ka:见上题)。
(1)苯酚钠;(2)丙烯酸钠;(3)吡啶。
计算下列溶液的pH :(1)·L -1NaH 2PO 4;(2) mol·L -1K 2HPO 4 。
计算下列水溶液的pH(括号内为p K a)。
? (1)·L-1乳酸和·L-1乳酸钠;? (2) mol·L-1邻硝基酚和·L-1邻硝基酚的钠盐(3)·L-1氯化三乙基胺和mol·L-1三乙基胺;? (4)·L-1氯化丁基胺和·L-1丁基胺。
2021年高考化学考点64酸滴定盐或碱滴定盐曲线必刷题
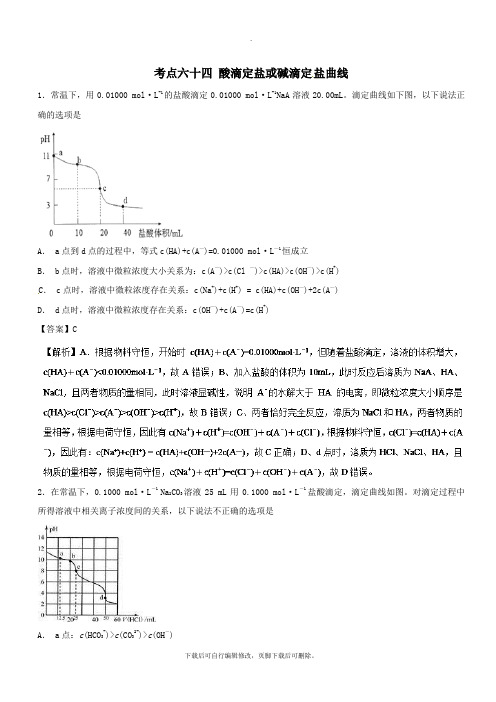
考点六十四酸滴定盐或碱滴定盐曲线1.常温下,用0.01000 mol·L-1的盐酸滴定0.01000 mol·L-1NaA溶液20.00mL。
滴定曲线如下图,以下说法正确的选项是A. a点到d点的过程中,等式c(HA)+c(A—)=0.01000 mol·L—1恒成立B. b点时,溶液中微粒浓度大小关系为:c(A—)>c(Cl —)>c(HA)>c(OH—)>c(H+)C. c点时,溶液中微粒浓度存在关系:c(Na+)+c(H+) = c(HA)+c(OH—)+2c(A—)D. d点时,溶液中微粒浓度存在关系:c(OH—)+c(A—)=c(H+)【答案】C2.在常温下,0.1000 mol·L-1 Na2CO3溶液25 mL用0.1000 mol·L-1盐酸滴定,滴定曲线如图。
对滴定过程中所得溶液中相关离子浓度间的关系,以下说法不正确的选项是A. a点:c(HCO3-)>c(CO32-)>c(OH-)B. b点:5c(Cl-)>4c(HCO3-)+4c(CO32-)C. c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)D. d点:c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)【答案】C3.如图1中的某条曲线是浓度为0.1mol·L-1NH4Al(SO4)2溶液的pH随温度变化的图像。
图2是室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线。
以下判断正确的选项是〔〕A.图2中b点,溶液中各离子浓度由大到小的排列顺序是:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)B.一样条件下,相等物质的量浓度NH4Al(SO4)2和NH4HSO4溶液中c(NH4+),前者更大C.图1中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是BD.图2中a、b、c、d四个点,水的电离程度最大的是b【答案】A【解析】A. 图2中b点,中和反响已经完成,少量NH4+转化为NH3·H2O,溶液中各离子浓度由大到小的排列顺序是:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故A正确;B. NH4HSO4溶液中H+抑制NH4+的水解,一样条件下,相等物质的量浓度NH4Al(SO4)2和NH4HSO4溶液中c(NH4+),后者更大,故B错误;C. NH4+、Al3+的水解程度随着温度升高而增大,溶液酸性增强,pH减小,所以图1中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是A,故C 错误;D. 图2中a点中和反响恰好完全进展形成Na2SO4和(NH4)2SO4的混合溶液,NH4+水解促进水的电离,之后越来越多的NH4+转化为NH3·H2O,一水合氨抑制水的电离,所以a、b、c、d四个点,水的电离程度最大的是a,故D错误。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酸碱滴定曲线练习题
一、填空
1.在酸碱滴定中,指示剂的选择是以为依据的。
2.强碱滴定弱酸,滴定曲线的突跃范围在碱性范围内,因此甲基橙、甲基红等都作为滴
定的指示剂。
3.滴定范围的大小与滴定剂和被滴定物的浓度有关,浓度越,突跃范围越长,可供选择
的指示剂越。
4.在酸碱滴定分析过程中,为了直观形象地描述滴定溶液中H +
浓度的变化规律,通常以
为纵坐标,以加入滴定剂的为横坐标,绘成曲线。
此曲线称为。
5.酸碱滴定曲线是以变化为特征的。
滴定时酸碱的浓度越大,滴定的突跃范围。
6.酸碱滴定法是用去滴定各种具有酸碱性的物质,当达到化学计量点时,通
过滴定剂的体积和,按反应的关系,计算出被测物的含量。
7.在酸碱滴定中,选择指示剂是根据和来确定的。
8.二元弱酸被准确滴定的判断依据是,能够分步滴定的判据是。
二、判断题(正确的请在括号内打√,错误的打×)
-1-10
1.能用HCl标准溶液准确滴定0.1mol·L
2.NaCN。
已知HCN的K=4.9×10。
()
3.强酸滴定强碱的滴定曲线,其突跃范围大小只与浓度有关。
()
4.酸碱滴定中,化学计量点时溶液的pH值与指示剂的理论变色点的pH值相等。
()
5.酸式滴定管一般用于盛放酸性溶液和氧化性溶液,但不能盛放碱性溶液。
()
6.酸碱指示剂的选择原则是变色敏锐、用量少。
()
7.各种类型的酸碱滴定,其化学计量点的位置均在突跃范围的中点。
()
三、选择题(下列各题只有一个正确答案,请将正确答案填在括号内)
1.由于弱酸弱碱的相互滴定不会出现突跃,也就不能用指示剂确定终点,因此在酸碱滴定法中,
配制标准溶液必须用()。
A.强碱或强酸
B.弱碱或弱酸
C.强碱弱酸盐
D.强酸弱碱盐
2.用NaOH测定食醋的总酸量,最合适的指示剂是()。
A.中性红
B.甲基红
C.酚酞
D.甲基橙
9.在酸碱滴定中,一般把滴定至等量点()的溶液pH 值变化范围称为滴定突跃范围。
A .前
后±0.1%差B
前后±0.2%差 C.0.0%D.前后±1%相对误差 10.用强碱滴定一元
弱酸时合cK a ≥10-8的条件,这是因为()。
-
8时滴定突跃B .c K -8时无
法确定化学系 A.cK a <10a <10
-
8时指示剂变化D .c K -8时反
C.cK a <10a <10 pH 滴定突跃范围增大,可以采取下列措施中的()。
A.改变滴定方式B.加热被滴溶液 C
.增加溶液酸
度D .增加
滴
度
12.下列酸碱滴定反应中,其等量点pH 值等于7.00的是()。
A.NaOH 滴定
HAcB.HCl 溶液滴定NH 3·H 2O
C.HCl 溶液滴定Na 2CO 3
D.NaOH 溶液滴定HCl 13.称取纯一元弱酸HA1.250g 溶于水中并稀释至50mL ,用0.100mol ·L -1 NaOH 滴定,消耗 NaOH50mL 到等量点,计算弱酸的式量为()。
A.200B.300C.150D.250。
