1第一章 物质聚集状态、分散体系与界面化学1详解
无机及分析化学课件第四版第一章

聚沉
1. 电解质的聚沉作用
聚沉值
✓ 离子价态越高,聚沉能力越强 ✓ 异号电荷一样的离子-----“离子〞半径
✓ 对于负溶胶 Cs+>Rb+>K+>Na+>Li+
✓ 对于正溶胶Cl->Br->NO3->I-
2. 溶胶的相互聚沉
明矾净水
1. 加热
大分子溶液及凝胶
➢ 大分子溶液macromolecular compound ➢ 盐析 salting out
胶体分散系
粗分散系
(粒子直径小于1nm) (粒子直径在1-100nm之间) (粒子直径大于100nm)
低分子溶液 (分散质是小分子)
高分子溶 液(分散质 是大分子)
胶体溶液 (分散质是 分子的小集
合体)
浊液(分散质是分子的大 集合体)
最稳定
很稳定
稳定
不稳定
电子显微镜不可见 超显微镜可观察其存在
一般显微镜可见
一、什么是“稀溶液的依数性 〞?
与溶液有关的性质分为两类:
溶液的颜色、比重、导电性等性质,与溶质 的本性有关;
溶液的蒸气压、沸点、凝固点等性质,与溶 质的本性无关。
只与溶质的数量〔摩尔分数〕有关,而 与溶质的本性无关的性质,称为“依数性〞。
依数性是指: 溶液的蒸气压下降 溶液的沸点上升、凝固点下降 溶液具有渗透压
O2: P1= 2×105 Pa V1= 3dm3
PO2=?
V2= 6dm3
同理PPO总:P2==NP2P1=OV231+×/VP12N=0252=××46×1/6015=×0533(×P/6a1=)051(×Pa1)05 (Pa)
高中化学 必修第一册 第1章 第1节 第2课时 分散系及其分类
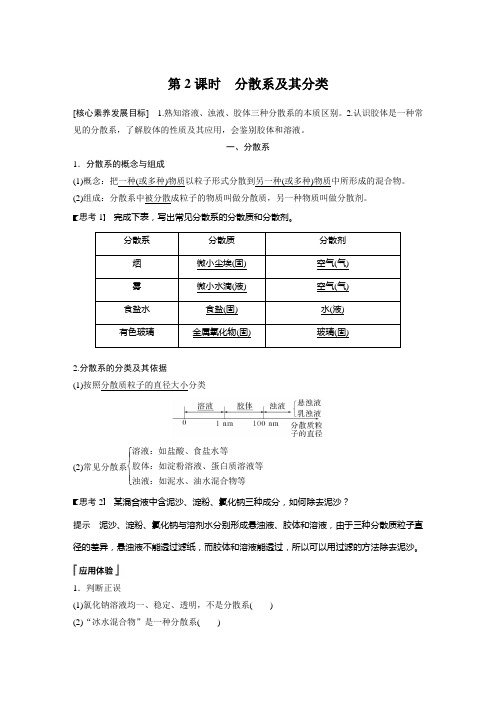
第2课时 分散系及其分类[核心素养发展目标] 1.熟知溶液、浊液、胶体三种分散系的本质区别。
2.认识胶体是一种常见的分散系,了解胶体的性质及其应用,会鉴别胶体和溶液。
一、分散系1.分散系的概念与组成(1)概念:把一种(或多种)物质以粒子形式分散到另一种(或多种)物质中所形成的混合物。
(2)组成:分散系中被分散成粒子的物质叫做分散质,另一种物质叫做分散剂。
思考1 完成下表,写出常见分散系的分散质和分散剂。
分散系分散质 分散剂 烟微小尘埃(固) 空气(气) 雾微小水滴(液) 空气(气) 食盐水食盐(固) 水(液) 有色玻璃金属氧化物(固) 玻璃(固)2.分散系的分类及其依据(1)按照分散质粒子的直径大小分类(2)常见分散系⎩⎪⎨⎪⎧ 溶液:如盐酸、食盐水等胶体:如淀粉溶液、蛋白质溶液等浊液:如泥水、油水混合物等思考2 某混合液中含泥沙、淀粉、氯化钠三种成分,如何除去泥沙?提示 泥沙、淀粉、氯化钠与溶剂水分别形成悬浊液、胶体和溶液,由于三种分散质粒子直径的差异,悬浊液不能透过滤纸,而胶体和溶液能透过,所以可以用过滤的方法除去泥沙。
1.判断正误(1)氯化钠溶液均一、稳定、透明,不是分散系( )(2)“冰水混合物”是一种分散系( )(3)分散系有的是纯净物,有的是混合物( )(4)分散系可以是固态、液态或气态( )(5)油水混合物属于乳浊液( )答案 (1)× (2)× (3)× (4)√ (5)√2.溶液、胶体和浊液三种分散系的本质区别是( )A .是否是大量分子或离子的集合体B .是否能通过滤纸C .分散质粒子直径的大小D .是否均一、透明、稳定答案 C解析 溶液、胶体和浊液三种分散系的本质区别在于分散质粒子直径的大小。
二、胶体1.胶体的树状分类思考1 (1)Fe(OH)3胶体中的分散质粒子与淀粉溶液中分散质粒子在组成上有什么区别? 提示 Fe(OH)3胶体中的分散质粒子是Fe(OH)3集合体,而淀粉胶体中一个淀粉分子就是一个分散质粒子。
1.1物质的聚集状态

(2)胶团结构通式
[(成核分子)m· n电位离子±· (n-x)反离子 ]x±· x反离子 其中: m、n、x可变,n>x;
+
+
例1、写出用AgNO3和KI溶液制备AgI溶胶的胶团结
构。 解:反应为: KI + AgNO3 = AgI + KNO3 ①当AgNO3过量后,溶液中的离为: Ag+、NO3-、H+和OH-, 则电位离子为:Ag+,反离子为NO3所以胶团结构为:
1.3.4 摩尔分数
物质B的摩尔分数是指物质B的物质的量与混 合物总的物质的量之比。用符号xB表示,即: xB = nB / n总 (2-5)
1.2.5 物质的质量分数 物质B的质量分数是指物质B的质量与混合物 质量之比。用符号wB表示,即: wB = mB / m总 (2-6)
1.4 稀溶液的通性(依数性)
溶液中溶质B的物质的量(nB)除以溶液的体积 (V),称为物质B的物质的量浓度(amount-of-substance concentration),简称浓度(concentration),用符号cB 或 [B]表示, cB = nB /V (2-1)
溶液中离子的初始浓度常用cB表示
溶液中离子的平衡浓度常用[B]表示。
390.06g 75.0L m(NaN3)= 223.6L
=131g
1.2.2 Dalton分压定律
1 分压定律 2 分压定律的应用 组分气体: 理想气体混合物中每一种气体叫做组分气体。 分压: 组分气体B在相同温度下占有与混合气体相同
体积时所产生的压力,叫做组分气体B的分压。
nB RT pB V
1.4.4 渗透压
第1章物质的聚集状态

廖文利 wenliliao2009@ 49919026
第1章
物质的聚集状态
Chapter 1 Collective State of Matter
1-1 分散系
1-2 气体
1-3 溶液浓度的表示方法
1-4 稀溶液的通性 1-5 胶体溶液
1-6 高分子溶液和乳浊液
Question 1
1mol H3PO4与3mol (1/3 H3PO4 )的 基本单元和基本单元数是否相同?质量 是否也相同?摩尔质量比是多少?
基本单元
前者 H3PO4
基本单元 数 1 mol
质 量 相 同
摩尔质量
后者
1/3 H3PO4
3 mol
前者是后者的 3倍
1-3 溶液的浓度
二、质量摩尔浓度 (molality )
在纯溶剂中加入难挥发的物质以后,达平衡时, p溶液总是小于同 T 下的p纯溶剂 ,即溶液的蒸气压 下降。蒸气压下降值△p=p纯-p液。
1-4 非电解质稀溶液的依数性
蒸汽压下降的原因:
纯溶剂
溶液
∴p液<p纯剂,c液越大,p液越小。 p纯-p液的差值也越大。
1-4 非电解质稀溶液的依数性
拉乌尔定律:在一定的温度下,难挥发的非电 解质稀溶液的蒸气压,等于纯溶剂的蒸气压乘 该溶剂在溶液中的摩尔分数。
nB △p≈ p A—— nA ∵nA=mA/MA nB nB ∴ △p≈ p A—— = p 0 — · A M A nA mA
0
nB △p= p A · A ——=K· ) M b(B mA
0
1-4 非电解质稀溶液的依数性
△p = K蒸 b(B) -----拉乌尔定律的另一种表述。 K蒸与溶剂、T有关的常数 ①同一温度,溶剂不同,其K蒸不同; ②同一溶剂,温度不同,其K蒸也不同。
高中化学人教版必修一第一章 第一节 分散系及其分类PPT完美课件(共38张)

带正电荷胶粒
金属氢氧化物 金属氧化物 AgI
带负电荷胶粒
金属硫化物(如Sb2S3) 非金属硫化物(如As2S3) 非金属氧化物(如SiO2泥沙)
硅酸盐(土壤和水泥) AgI
胶粒带同种电荷,相互间产生排斥作用,不易结合成更大的沉淀 微粒,这是胶体具有稳定性的主要因素。
总结 胶体稳性的原因是什么?
原因一: 同种胶粒带同种电荷,相互排拆 (主要原因)
泥水
土壤粒子
水
油水
油
水
浑浊,静置沉淀 浑浊,静置分层
溶液
酒精溶液
酒精分子
水
澄清 透明 均一 稳定
山东烟台
山东蓬莱
乌鲁木齐
海市蜃楼是一种光学现象。春夏、 夏秋之间,万里无云,海水水面的气 层与空中的气层密度便发生较大差异, 光线通过密度不同的气层便会发生折 射或全反射,就形成了海市蜃楼。
(2)分散剂是液体时
科学探究 如何区分这三种分散系?
思考: 有些液态胶体也是透明的,用肉眼是很难与溶液
相区别。那么用什么方法才能够区别溶液和胶体的呢?
视频:丁达尔现象
视频:胶体的过滤
光束照射时的现象
原因分析
Fe(OH)3胶体 形成一条光亮的通路
胶体的直径在1-100nm 之间,能使光波发生散 射
CuSO4溶液 无光现象产生
第一章 物质及其变化
第一节 物质的分类及转化
1.1.3 分散系及其分类
主讲老师:刘老师
学业要求
核心素养对接
1.知道分散系的概念,能说出分散 系的分类。 2.认识胶体是一种常见的分散系。 3.能举例说明胶体的典型特征。 4.能根据胶体的性质解释生活中与 之有关的现象。
1.通过学习胶体的概念,建立 起物质的聚集状态与物质性质 的关系。 2.通过学习胶体的性质和应用, 建立物质的聚集状态与物质用 途的关联,提高解决实际问题 的水平。
第一章 物质的聚集状态

R 单位:8.314Pam3 mol-1K-1; 8.314 Jmol-1K-1
3. 理想气体状态方程式的应用
计算p,V,T,n四个物理量之一
pV = nRT
气体摩尔质量的计算
m pV RT M
M mRT pV
气体密度的计算
M ρ RT p
RT ρ pM
难点:单位处理
例1-1 :一学生在实验室中,在73.3kPa和25℃下收集
(2) b(蔗糖) = 0.05/0.1 = 0.5 (mol/kg)
(3) n水 = 100/18.02 = 5.55 (mol)
X(蔗糖) = 0.05/(0.05+5.55) = 0.0089
3.几种浓度之间的转换关系 (1).物质的量浓度与质量分数
溶液密度ρ;B的质量分数wB
nB mB mB w B cB V M BV M Bm / M B
65.2 (2) 2.03 32.07
硫蒸气的化学式为S2
1.2.2 道尔顿分压定律
体积不变:5L 298K先通入2molH2 再通入2molN2 混合后H2的体积?混合后N2的体积?容器内压力有何变化? 分压力:在相同温度下,混合气体中某组分气体单独 占有混合气体的容积时所产生的压力。
1.道尔顿分压定律
2、分散系的分类 按聚集状态分
气-气(空气)
气-液(汽水)
气-固(浮石)
液-气(云、雾)
液-液(牛奶)
液-固(肉冻)
固-气(烟、)
固-液(溶液) 固-固(合金)
按粒子大小分
分 散 相 粒 分散系类型 分散相粒子的 子直径 组成 小于1nm 实 例
分子分散系 小分子或小离 生 理 盐 水 、 葡 子 萄糖溶液
教学课件:第一章-物质的聚集状态

气态物质如空气中的水蒸气、二氧化碳等,用于气象观测和气候变 化研究,对环境保护和气候预测具有重要意义。
THANKS FOR WATCHING
感谢您的观看
气体定律与状态方程
1 2 3
理想气体定律
理想气体遵循玻意耳定律、查理定律和盖吕萨克 定律,这些定律描述了气体在不同条件下的状态 变化。
状态方程
理想气体的状态方程为PV=nRT,其中P表示压 强,V表示体积,n表示摩尔数,R表示气体常数, T表示温度。
实际气体近似
对于压强较大或温度较低的气体,实际气体可以 近似为理想气体。
04 气态物质
气体分子运动论
01
分子运动论的基本假设
气体由大量做无规则运动的分子组成,分子之间相互作用力可以忽略。
02
分子平均动能
气体分子的平均动能与温度成正比,温度越高,分子运动越剧烈。
03
分子分布
气体分子在空间的分布是均匀的,但在单位时间内与器壁碰撞的分子数
与气体分子速率大小有关,呈现出“中间多、两头少”的分布规律。
流动性
液体具有一定的流动性,可以流动 和变形。
液体的相变与热力学性质
熔点和沸点
熔点和沸点是液体物质的重要热 力学性质。
热容量和导热性
液体的热容量和导热性与温度有 关,不同液体有不同的热容量和
导热性。
相变过程
液体在一定条件下可以发生相变, 如蒸发或凝固。
液体中的溶解与扩散
溶解度
不同物质在液体中的溶解度不同。
气体的相变与热力学性质
相变
01
气体在一定条件下可以发生相变,例如液化、凝华等。相变过
程中气体的热力学性质会发生显著变化。
《物质的聚集状态》PPT课件

(1) (2) (3)
pi V总 = ni R T ( 2 )
p总V总 = n R T ( 1 )
式(2)/ 式(1) 得
pi p总
ni =
n
= xi
故 pi = p总•xi
即组分气体的分压等于总压与该
组分气体的摩尔分数之积。P7例题1-2
p总 Vi = ni R T ( 3 )
p总V总 = n R T ( 1 ) 又 式(3)/ 式(1) 得
由一种(或多种)物质分散于另一种物质所 构成的系统,称为分散系。
分散相: 被分散的物质。 分散介质: 容纳分散相的物质。
按聚集状态或分散质粒大小可对分散系进行分类。
4
按聚集状态分类的分散系
分散相 气体 液体 固体 气体 液体 固体 气体 液体 固体
分散介质 气体 液体 固体
实例 空气、天然气、焦炉气 云、雾 烟、灰尘 碳酸饮料、泡沫 白酒、牛奶 盐水、泥浆、油漆 泡沫塑料、木炭 豆腐、硅胶、琼脂 合金、有色玻璃
pV = nRT
(1-1)
p为气体压力,单位:Pa; V为气体体积,单位:m3; T为气体温度,单位:K;
n为气体的物质的量,单位:mol;
R为摩尔气体常数,取值8.314 Jmol-1K-1 。
8
Question 例1-1 某碳氢化合物的蒸汽,在100℃及
101.325 kPa时,密度ρ=2.55 g·L-1,由化 学分析结果可知该化合物中碳原子数与 氢原子数之比为1:1。试确定该化合物的 分子式。
Vi = ni V总 n
= xi 又有
pi = p总•xi
故
Vi pi = p总• V总
即组分气体的分压,等于总压与
1第一章物质聚集状态、分散体系与界面化学1.

第一章 物质聚集状态、分散系与界面化学
§1-3 溶液的浓度
一、物质的量 二、物质的量浓度 三、质量摩尔浓度 四、摩尔分数 五、质量分数 六、质量浓度
19
第一章 物质聚集状态、分散系与界面化学
溶液:一种或几种物质(溶质)以分子或离子状 态均匀分散在另一种物质(溶剂)里所形成的 分散系。又称真溶液或分子溶液。溶液不限 于液体,也有气溶体或固溶体。本课程非特 别注明皆为水溶液。
2
第一章 物质聚集状态、分散系与界面化学
§1-1 物质聚集状态
一、 气体 二、 液体 三、 固体
3
第一章 物质聚集状态、分散系与界面化学
一、气体
1.理想气体状态方程 • 气体的基本特征:扩散性和可压缩性 •忽略气体分子本身占有的空间和分子间 作用力,该气体就是理想气体 •实际气体在低压高温条件下,才能被近 似地看成理想气体
在使用物质的量时,基本单元应予指明, 它可以是分子、原子、离子、电子及其他粒子 ,也可以是这些粒子的特定组合。基本单元要 求用加圆括号的化学式(或其组合)表示,不宜 用中文名称。
21
第一章 物质聚集状态、分散系与界面化学
1mol物质的质量称为该物质的 “ 摩尔质量”,符号为M,单位为kg·mol-1 ,常用单位为g·mol-1。任何分子、原子 或离子的摩尔质量,当单位为g·mol-1时 ,数值上等于其相对原子质量、相对分 子质量或离子式量。
9
第一章 物质聚集状态、分散系与界面化学
二、 液体
液体的特征 液体的性质 (1)蒸气压 (2)沸点 (3)凝固点
10
第一章 物质聚集状态、分散系与界面化学
三、固体
晶体与非晶体 (1)概念 (2)晶体与非晶体的不同点
(完整版)大学无机化学知识点

第一章物质的聚集状态§1~1基本概念一、物质的聚集状态1.定义:指物质在一定条件下存在的物理状态。
2.分类:气态(g)、液态(l)、固态(s)、等离子态。
等离子态:气体在高温或电磁场的作用下,其组成的原子就会电离成带电的离子和自由电子,因其所带电荷符号相反,而电荷数相等,故称为等离子态,(也称物质第四态)特点:①气态:无一定形状、无一定体积,具有无限膨胀性、无限渗混性和压缩性。
②液态:无一定形状,但有一定体积,具有流动性、扩散性,可压缩性不大。
③固态:有一定形状和体积,基本无扩散性,可压缩性很小。
二、体系与环境1.定义:①体系:我们所研究的对象(物质和空间)叫体系。
②环境:体系以外的其他物质和空间叫环境。
2.分类:从体系与环境的关系来看,体系可分为①敞开体系:体系与环境之间,既有物质交换,又有能量交换时称敞开体系。
②封闭体系:体系与环境之间,没有物质交换,只有能量交换时称封闭体系。
③孤立体系:体系与环境之间,既无物质交换,又无能量交换时称孤立体系。
三、相体系中物理性质和化学性质相同,并且完全均匀的部分叫相。
1.单相:由一个相组成的体系叫单相。
多相:由两个或两个以上相组成的体系叫多相。
单相不一定是一种物质,多相不一定是多种物质。
在一定条件下,相之间可相互转变。
单相反应:在单相体系中发生的化学反应叫单相反应。
多相反应:在多相体系中发生的化学反应叫多相反应。
2.多相体系的特征:相与相之间有界面,越过界面性质就会突变。
需明确的是:①气体:只有一相,不管有多少种气体都能混成均匀一体。
②液体:有一相,也有两相,甚至三相。
只要互不相溶,就会独立成相。
③固相:纯物质和合金类的金属固熔体作为一相,其他类的相数等于物质种数。
§1~2 气体定律一、理想气体状态方程PV=nRT国际单位制:R=1.0133*105Pa*22.4*10-3 m 3/1mol*273.15K=8.314(Pa.m3.K-1.mol-1)1. (理想)气体状态方程式的使用条件温度不太低、压力不太大。
物质的聚集状态

? 至今已知的液晶物质,多为脂肪族化合物, 芳香族化合物和甾族化合物。
? 液晶从分子排列的有序性分为: ? 向列型(丝状液晶)
? 近晶型(层状液晶) ? 胆甾型(螺旋状液晶)
? 近晶型液晶具有二维空间的层状规则性排列, 各层间则有一维的顺向排列。一般而言,此 类分子的粘度大,印加电场的应答速度慢,
n3 v3 + … → 混合
p Vi=ni RT p 总 V总= n总RT → vi / v总 =ni / n总=xi vi / v总 —称为物质的体积分数,在数值上等于摩尔分数。
v总= v1+v2+v3…+vi vi = xi v总 →分容定律
实际气体——范德华方程
? 在高压、低温下,因分子间距离的缩短和分 子平均动能降低,分子间的作用力和分子自 身的体积不能忽略。在理想气体状态方程进 行修正得到范德华方程。
? 理想气体定律比较简单,易获得。对于实 际气体的问题,可对理想气体定律作适当 修正,就可比较精确的解决。这是一种常 用的科学研究方法。
理想气体状态方程
? p V =n R T ——理想气体状态方程 其中:p—压力,单位:Pa(帕).
1atm=1.01325 ×105 Pa=101.3 kPa T—热力学温度,单位:K(开尔文). T=t(℃)+273.15 V —容器体积(分子自由活动的空间).单位:m3 n —物质的摩尔数,单位:mol R —摩尔气体常数,其值:8.314J .mol -1.k-1
? 二氧化碳在温度高于临界温度Tc=31.26℃、 压力高于临界压力Pc=7.2MPa的状态下,性 质会发生变化,兼有气液两相的双重特点, 既具有与气体相当的高扩散系数和低粘度, 又具有与液体相近的密度和物质良好的溶解 能力。
胶体与表面化学讲义第一章 基本概念

《胶体与界面化学》讲义第一章基本概念第一节胶体与表面一、胶体与胶体分散体系•目前科学地将颗粒大小在10-6~10-9m这样的物质(不管其聚集状态是气态、液态还是固态)称为胶体。
•胶体与其分散在其中的介质组成分散体系,介质可以是气、液和固体并与胶体颗粒间存在相界面,因此它还是高分散的多相的分散体系。
•胶体分散体系一般是两个组分以上的多组分体系,不过也存在极为罕见的单组分胶体分散体系,这类分散体系是液体,但由于分子的热运动而出现的涨落现象,一些分子会在液态内部聚集成较大的聚集体,这种分散体系称为类胶体(iso-colloid)分散体系。
聚合物或大分子量物质•聚合物或大分子量物质过去也称之为胶体分散体系的物质。
•如蛋白质,纤维素以及各种天然的和人工合成的聚合物,其尺寸也在胶体范围、并具有胶体的某些性质,比如慢扩散性,不透过半透膜,电泳行为等。
•因此过去也把它们作为胶体与表面化学的讲解内容。
但由于其迅速的发展,形成一个庞大的大分子家族,而成为一个独立学科去研究,不过它的某些理论和研究方法确系胶体的理论和研究方法。
二、表面和界面•表面(surface):是指凝聚相与真空,空气或其蒸气间的交界•界面(interface):是指凝聚相与其他相间的交界面。
•水的表面张力是水的表面(与空气或蒸汽的交界面)上的表面张力,约为72.8×10-3N/m;水和苯间界面张力为35×10-3N/m;水与汞间界面张力为375×10-3N/m。
•由此可见,界面张力值决定于相邻相的物质。
相边界上“面”的含义•这里所说的“面”是指相边界上的化学概念上的而非数学概念上的面。
数学面只有面积而无厚度,而化学面是有一定厚度的,起码有几个分子大小的厚度。
数学面所示在面上相的性质(如密度、浓度等)发生突变是不可思议的,而化学面中相的性质逐渐变化才是可理解的。
但在描述它时,由于其厚度值与两相本体尺寸比较可忽略不计近似为零。
2019_2020版新教材高中化学第1章第1节第2课时分散系及其分类课件新人教版必修第一册65

知识点二 胶体的制备和性质 三角洲是如何形成的?为什么会形成三角洲?带着这个问题完成下列问题:
1.Fe(OH)3胶体的制备实验 在小烧杯中,加入40 mL__蒸__馏__水___,加热至___沸__腾____,向沸水中逐滴加入5~6滴
__F_e_C__l3_饱__和____溶液,继续煮沸至液体呈__红__褐____色,停止加热。即可得到Fe(OH)3 胶体。化学方程式:__F_e_C_l_3_(饱__和__)_+__3_H__2O__=_=△_=_=_=_F_e_(_O_H__)_3(_胶__体__)_+__3_H_C__l _。
5.胶体的介稳性 (1)胶体的稳定性介于_溶__液___和__浊__液__之间,在一定条件下能稳定存在。 (2)主要原因是胶体粒子通过吸附而带有同种电荷,相互排斥;次要原因是胶体粒子 作布朗运动。 提醒:胶体与溶液的本质区别是分散质粒子直径的大小,而不是丁达尔效应。
微判断 (1)NaCl溶液、水、泥浆、淀粉溶液都属于胶体。( ) (2)FeCl3溶液呈电中性,Fe(OH)3胶体带电,通电时可以定向移动。( ) (3)可以利用丁达尔效应区分胶体和溶液。( ) (4)直径介于1~100 nm之间的粒子称为胶体。( ) (5)胶体都是均匀透明的液体。( ) (6)胶体一般比较稳定,不易产生沉淀。( ) (7)分散质粒子直径大小在几纳米到几十纳米之间的分散系是胶体。( ) (8)根据是否产生丁达尔效应,将分散系分为溶液、胶体与浊液。( ) 答案 (1)× (2)× (3)√ (4)× (5)× (6)√ (7)√ (8)×
第2课时 分散系及其分类
学业要求
核心素养对接
1.知道分散系的概念,能说出分散系的分 类。 2.认识胶体是一种常见的分散系。 3.能举例说明胶体的典型特征。 4.能根据胶体的性质解释生活中与之有关 的现象。
第一章 物质的聚集状态

式中nB表示溶液中溶质B的物质的量,其SI单位为mol;V为 溶液的体积,其SI单位为m3,在分析化学中,体积的常用单 位为L或mL;浓度cB常用单位为mol/L。
分散质
分散剂
实 例
气 液 固 气 液 固 气 液 固
气 气 气 液 液 液 固 固 固
空气 云、雾 烟灰尘 泡沫 牛奶、酒精的水溶液 糖水、油漆 泡沫塑料 珍珠(包藏着水的碳酸钙) 有色玻璃、合金
液态分散系(分散介质是液态)
分散相粒 子直径 /nm <1 分散系类型 分散相 主要性质 实例
低分子或离子分 散系 胶 体 分 散 系 粗 分 散 系 高分子溶液
611
T/K
从图中可以看出,
1) 随着温度的升高,水,水溶液,冰的饱和蒸气压都升高。
其中冰的曲线斜率大,随温度变化显著。 2) 同一温度,水溶液的饱和蒸气压低于水的饱和蒸气压。
p/Pa 1.013 10
611
5
A B
l1
l2 A′
l3
B′ T2 273 373 T1 T/K
3) 373 K时,水的饱和蒸气压等于外界大气压强,如图中 A 点,故 373 K 是水的沸点。大气压强 1.013 10 5 Pa 。
若 p 固 > p 液, p 固 < p 液, 饱和蒸气压图
则平物质的饱和蒸气压 p,对温度 T 做图,即得到物质饱和蒸气
压图。下面是水,水溶液,冰体系的饱和蒸气压图。
p/Pa 1.013 10 5 A
大学化学第二版(科学出版社)第一章第一节

ξ=△nR/vR= [nR(ξ) - nR(0)]/vR
反应进度的微变定义为:
dξ= dnR/vR
说 明: (1) vR 符号: 反应物为负(-);生成物为正(+)。
(2) 化学反应进度(ξ)的单位:mol。 (3)反应进度表示的意义:若ξ=1, 表明发生了1mol反应。
例如: 合成氨反应的有关数据见下表。试比较下列 两个反应式中反应进度是否相同? 反应式 (1) N2 + 3H2 = 2NH3 vR -1 -3 2 开始时物质的量/mol 10 20 0 t 时刻物质的量/mol 9 17 2
b.体积功W(膨胀功,expansile work)
在恒定外压下 W = - p外 • △V
C.热和功不是体系的状态函数,它们是途径函数。
六、反应进度(ξ)
1.定义: 反应进度是用来定量地描述和表征化学反应进行程度的物 理量。符号:ξ ,单位:mol 2.化学反应的一般形式:
对于某一反应:
可写为:
2.焓和焓变
焓(enthalpy)
焓变
根据 △U = U2-U1 = QP - P (V2-V1) 则有 QP=(U2-U1 )+P (V2-V1 )=(U2+Pபைடு நூலகம்2)-(U1 +PV1) 令: H = U + P V 则 : QP = H2-H1 = △H 即:△H = QP
结论:恒压过程的热效应在数值上等于该系统在变化过程中的焓变。
热化学与能量转化—热和功
五、热和功
1、热 ( heat , Q) 体系和环境间因存在温度差而传递的能量。
2、功 ( work, W )
除热以外其它各种形式传递的能量,统称为功。 W =W(体积功) + W′(非体积功) 说明:a 热力学规定:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一章 物质聚集状态、分散系与界面化学
§1-2 分散系
一、分散系的概念 二、分散系的分类 三、分散度与比表面积
12
第一章 物质聚集状态、分散系与界面化学
一、分散系的概念
分散系:一种或几种物质分散在另一种物 质里所形成的系统称为分散系统 ,简 称分散系。如泥浆、云雾、牛奶等分散 系。
分散质:被分散的物质叫做分散质(或分 散相);
分散剂:而容纳分散质的物质称为分散剂 (或分散介质)。
13
第一章 物质聚集状态、分散系与界面化学
二、分散系的分类
若按分散质粒子直径大小进行 分类,则可以将分散系分为九类, 见教材P3 表1-1。
按分散质和分散剂的聚集状态 可把分散系分为三类,见教材P4 表1-2。
14
第一章 物质聚集状态、分散系与界面化学
9
第一章 物质聚集状态、分散系与界面化学
二、 液体
液体的特征 液体的性质 (1)蒸气压 (2)沸点 (3)凝固点
10
第一章 物质聚集状态、分散系与界面化学
三、固体
晶体与非晶体 (1)概念 (2)晶体与非晶体的不同点
a 可压性和扩散性均不同 b 晶体有规则的几何外形,非晶体没有 c 晶体有固定的熔点,非晶体没有 d 晶体有各向异性,非晶体则是各向同 性的
17
第一章 物质聚集状态、分散系与界面化学
三、分散度与比表面积
分散系中分散质粒径不同,分散度就不 同,性质也不同。分散度用比表面积衡量:
S0 = S / V 比表面积S0增加,系统分散度增加。 比表面积增大,系统分散度增加;分散质 粒度减少,系统分散度增大。 例如1cm1cm1cm方块切成 0.1cm0.1cm0.1cm方块,比表面积从61cm2 增为610cm2 。
18
第一章 物质聚集状态、分散系与界面化学
§1-3 溶液的浓度
一、物质的量 二、物质的量浓度 三、质量摩尔浓度 四、摩尔分数 五、质量分数 六、质量浓度
19
第一章 物质聚集状态、分散系与界面化学
溶液:一种或几种物质(溶质)以分子或离子状 态均匀分散在另一种物质(溶剂)里所形成的 分散系。又称真溶液或分子溶液。溶液不限 于液体,也有气溶体或固溶体。本课程非特 别注明皆为水溶液。
4
第一章 物质聚集状态、分散系与界面化学
理想气体状态方程为
pV=nRT (1-1)
式中R 为摩尔气体常数, R=8.314 Pa·m3·K-1·mol-1。 由于1 J =1 Pa·m3, 所以 R=8.314 J·K-1·mol-1。
5
第一章 物质聚集状态、分散系与界面化学
2.道尔顿分压定律
对两种或两种以上互不发生化学反 应的理想气体的混合物,其状态方程是
在使用物质的量时,基本单元应予指明, 它可以是分子、原子、离子、电子及其他粒子 ,也可以是这些粒子的特定组合。基本单元要 求用加圆括号的化学式(或其组合)表示,不宜 用中文名称。
21
第一章 物质聚集状态、分散系与界面化学
1mol物质的质量称为该物质的 “ 摩尔质量”,符号为M,单位为kg·mol-1 ,常用单位为g·mol-1。任何分子、原子 或离子的摩尔质量,当单位为g·mol-1时 ,数值上等于其相对原子质量、相对分 子质量或离子式量。
2
第一章 物质聚集状态、分散系与界面化学
§1-1 物质聚集状态
一、 气体 二、 液体 三、 固体
3
第一章 物质聚集状态、分散系与界面化学
一、气体
1.理想气体状态方程 • 气体的基本特征:扩散性和可压缩性 •忽略气体分子本身占有的空间和分子间 作用力,该气体就是理想气体 •实际气体在低压高温条件下,才能被近 似地看成理想气体
1 分子与离子分散系中,分散质粒 子直径<1nm,它们是一般的分子或 离子,与分散剂的亲和力极强,均 匀、无界面,是高度分散、高度稳 定的单相系统。这种分散系即通常 所说的溶液,如蔗糖溶液、食盐溶 液。
15
第一章 物质聚集状态、分散系与界面化学
2 胶体分散系中,分散质粒子直径为 1~100 nm,它包括溶胶和高分子化合 物溶液两种类型。
第一章 物质聚集状态、分散系与界面化学
第一章 物质聚集状态、 分散系与界面化学
1
第一章 物质聚集状态、分散系与界面化学
第一章 物质聚集状态、 分散系与界面化学
§ 1-1 物质聚集状态 § 1-2 分散系 § 1-3 溶液的浓度 § 1-4 稀溶液的依数性 § 1-5 胶体溶液 § 1-6 粗分散系与界面化学简介
7
第一章 物质聚集状态、分散系与界面化学
3.阿玛格分体积定律
混合气体中任意理想气体B在具 有与混合气体相同的温度和压力时所 占有的体积称为气体B的分体积VB。 类似分压定律的推导,混合气体中气 体B的分体积VB为 VB=xBV
8
第一章 物质聚集状态、分散系与界面化学
4.相对湿度
相对湿度H: H = pw / p*w 通常H以百分数表示。式中pw代表大 气中实测的水蒸气压,p*w 代表该温 度条件下的饱和水蒸气压。
溶液的特征:均匀单相,高稳定性,含两种 或以上物质。
溶液的浓度:是指一定量溶液或溶剂中所含 溶质的量。浓度的表示方法多种多样,下面 介绍几种常用的浓度表示方法。
20
第一章 物质聚集状态、分散系与界面化学
一、 物质的量
物质的量是国际单位制(SI)规定的七个基 本单位之一的基本量的名称,用来表示系统中 所含基本单元的量,用符号“n”表示,其单位 为摩尔(简称摩),符号mol。1mol任何物质, 均含有N胶、硫 化砷溶胶、碘化银溶胶、金溶胶等。
另一类是高分子化合物溶液,如淀 粉溶液、纤维素溶液、蛋白质溶液等。
16
第一章 物质聚集状态、分散系与界面化学
3 粗分散系中,分散质粒子直径 >100nm,用普通显微镜甚至肉眼也能 分辨出,是一个多相系统。按分散质 的聚集状态不同,粗分散系又可分为 两类:一类是液体分散质分散在液体 分散剂中,称为乳浊液,如牛奶。另 一类是固体分散质分散在液体分散剂 中,称为悬浊液,如泥浆。故粗分散 系是极不稳定的多相系统。
pV=(n1+n2+…+ni)RT =n总RT pV=n1RT+n2RT+…+niRT =n总RT P=p1+p2+ …+pi
6
第一章 物质聚集状态、分散系与界面化学
混合气体中任意理想气体B在同 一温度下占有混合气体体积时所呈现
的压力称为气体B的分压力pB
气体B分压力pB: pB=xBp
xB-组分气体B的摩尔分数
