《溶液配制记录》
标准溶液配制记录

标准溶液配制记录 Company number:【WTUT-WT88Y-W8BBGB-BWYTT-19998】
标准溶液配制记录第页共页
内蒙古工大华远工程技术有限公司标准溶液配制记录
内蒙古工大华远工程技术有限公司标准物质领用记录
标准物质领用记录第页共页
内蒙古工大华远工程技术有限公司标准物质登记表
GDHY-ZP/CX-24-6 标准物质登记表第页共页
编号:GDHY-ZP-YS-001 气相色谱法原始记录第页共页
分析者:审核者:
光度法原始记录
编号:GDHY-ZP-YS-003 第页共页
分析者:审核者:
第页共页
分析者:审核者:
第页共页
分析者:审核者:
编号:GDHY-ZP-YS-002 光谱法原始记录第页共页
分析者:审核者:。
标准溶液配制记录

标准溶液配制记录一、前言。
标准溶液是化学分析中常用的一种溶液,它的浓度和成分都是经过严格计算和实验确定的。
正确、精确地配制标准溶液对化学分析结果的准确性和可靠性至关重要。
本文档旨在记录标准溶液的配制过程,以供参考和借鉴。
二、配制目的。
本次配制的标准溶液是XXX试剂,其主要用途是作为XXX分析的定量标准品。
通过配制标准溶液,可以确保在化学分析中得到准确的定量结果。
三、实验步骤。
1. 确定溶液浓度。
首先,根据实验需要和已知的化学反应式,计算出所需的标准溶液的浓度。
在确定浓度的过程中,需要考虑到实验的精确度和所需的最终结果。
2. 准备试剂和仪器。
在配制标准溶液之前,需要准备好所需的试剂和仪器。
试剂的纯度和仪器的准确度对标准溶液的配制至关重要。
3. 溶解试剂。
按照计算得出的配方,将所需的试剂溶解在适量的溶剂中。
在溶解过程中,需要充分搅拌并保持恒温,以确保试剂充分溶解。
4. 调整溶液体积。
根据需要,将溶解好的试剂溶液调整至所需的体积。
在调整体积时,需要使用准确的容量瓶或移液器,并注意避免气泡的产生。
5. 校正浓度。
配制好标准溶液后,需要进行浓度的校正。
校正的方法可以是比色法、滴定法或仪器分析法,根据实际情况选择合适的方法进行校正。
6. 记录实验数据。
在配制标准溶液的整个过程中,需要准确记录每一步的操作和实验数据。
这些数据将作为实验结果的依据,并在实验后的数据分析中起到重要的作用。
四、实验结果。
经过以上步骤,我们成功配制出了XXX浓度为XXX的标准溶液。
经过校正后,其浓度符合实验要求,可以用于后续的化学分析实验。
五、结论。
本次标准溶液配制实验成功完成,得到了符合要求的标准溶液。
在实验过程中,我们严格按照操作规程进行操作,严格控制试剂的纯度和仪器的准确度,最终取得了满意的实验结果。
六、致谢。
在实验过程中,得到了实验室老师和同事们的帮助和支持,在此表示衷心的感谢。
七、参考文献。
[1] XXX. 化学分析实验指导. 化学出版社, 20XX.[2] XXX. 分析化学. 化学工业出版社, 20XX.以上就是本次标准溶液配制的记录,希望对您有所帮助。
标准溶液‘配制’及‘标定’原始记录

标准溶液‘配制’及‘标定’原始记录标准溶液编号:有效期:温度修正系数f(mL/L) (GB/T 601-2002 附录A)溶液体积 V(mL)CB(mol/L)平均值(mol/L)计算式:V=(V1-V0)×(1+f/1000)CB=1000m/(M×V)说明:每次滴定必须从“0”开始备注:配制人:标定:复标:审核:标准物质配制(标定)记录编号: CHEC/QBG-075名称:、配制方法:使用天平型号编号室温℃、湿度 %RH配制:取定溶 mL标定:取份:⑴⑵⑶⑷用溶液滴定,滴定消耗量(mL)V1= 、V2= 、V3= 、V4= 、V0= 。
标准溶液浓度计算公式:C=计算结果():C1= C2= C3= C4= C =相对偏差(%):S1= S2= S3= S4=备注:。
配制人:复核人:配制日期:年月日有效期年月日标准溶液配制记录编号: CHEC/QBG-147标准溶液名称:规格:配制方法:仪器名称:溯源标准:温度:℃ 、湿度: %RH 标准溶液拟配浓度:配制或稀释过程:配制日期:年月日有效期:年月日配制人:复核人:0.1mol/L盐酸标准滴定溶液的标定编号:JL/LJ-001-01一、标定方法:GB/T5009.1-2003二、使用仪器:AEL-200电子天平(仪器编号:JYB001)马弗炉(仪器编号:JYC009)三、操作1、量取9ml盐酸,加适量水并稀释至1000ml。
混匀,待标定。
2、标定:精密称取约0.15g在270~300℃干燥至恒量的基准无水碳酸钠,加50ml水使之溶解,加10滴溴甲酚绿-甲基红混合指示液,用本溶液滴定至溶液由绿色转变为紫红色,煮沸2min,冷却至室温,继续滴定至溶液由绿色变为暗紫色。
四、记录和结果1、计算公式:c(HCl)=m/[(V1-V2)×0.0530]0.0530……与1.00ml盐酸标准滴定溶液[c(HCl)=1mol/L]相当的基准无水碳酸钠的质量,g2、数据配制人:复核人:配制日期:复核日期:稀释记录表标准溶液(滴定液)管理工作的基本要求关键词(必填项目):标准溶液、滴定液目的(必填项目):对标准溶液的使用等制定统一的要求,便于统一的管理。
硝酸汞标准滴定溶液配制标定记录

5.00
5.00
5.00
耗用标准溶液量(ml)
4.25
4.20
4.20
4.25
平均浓度
溶剂空白试验值(ml)
1.45
1.40
1.40
1.45
0.0714
对氯离子滴定度
0.0714
0.0714
0.0714
0.0714
复
标
基准试剂名称
0.04mg/ml氯离子标准溶液
复标人
分取溶液量(ml)
5.00
5.00
5.00
5.00
耗用标准溶液量(ml)
4.20
4.20
4.20
4.25
平均浓度
溶剂空白试验值(ml)
1.40
1.40
1.40
1.45
0.0714
对氯离子滴定度
0.0714
0.0714
0.0714
0.0714
硝酸汞标准滴定溶液对氯离子的滴定度:
TClˉ=0.0714mg/ml
1.2吸取50.00ml标准溶液放入250ml容量瓶中,定容摇匀。
2、硝酸汞标准滴定溶液配制
称取0.34g硝酸汞溶于10ml 0.5mol/L硝酸中,移入1000ml容量瓶中,定容摇匀
标准溶液对氯离子的滴定度
试验次数
项目
1
2
3
4
标
定
基准试剂名称
0.04mg/ml氯离子标准溶液
标定人
分取溶液量(ml)
标准滴定溶液配制标定记录
溶液名称
配制浓度(mol/L)
配制体积(ml)
溶质用量(g)
溶质
级别
硝酸汞标准滴定溶液
标准溶液的配置标定记录

氢氧化钠标准滴定溶液的配置滴定记录 ① 配制:将氢氧化钠配成饱和溶液,注入塑料桶中密闭放置至溶液清亮,使用时用塑料管虹吸上层清液。
氢氧化钠标准溶液:量取 毫升氢氧化钠饱和溶液,注入 毫升不含二氧化碳的水中,摇匀。
② 标定:称取 克于105℃--110℃电烘箱中干燥至恒重的工作基准试剂邻苯二甲酸氢钾,称准至0.0002克。
溶于 毫升不含二氧化碳的水中,加2滴1﹪酚酞指示液,用 氢氧化钠溶液滴定至溶液呈粉红色,并保持30s 。
同时做空白试验。
③ 计算:氢氧化钠标准滴定溶液的浓度[c(NaOH)],数值以摩尔每升(mol/L)表示,按下列公式计算:c(NaOH)=121000()m V V M⨯-式中:m-----邻苯二甲酸氢钾的质量的准确数值,单位为克(g); V 1----氢氧化钠溶液的体积的数值,单位为毫升(mL); V 2---空白试验氢氧化钠溶液的体积的数值,单位为毫升(mL);M----邻苯二甲酸氢钾的摩尔质量的数值,单位为克每摩尔(g/mol)[M(KHC 8H 404)= 204.22 ]容量分析原始记录检验: 审核: 检验日期:盐酸标准滴定溶液的配置滴定记录① 配制:盐酸标准溶液,量取 毫升盐酸,注入 毫升水中。
② 标定:称取 克于270℃--300℃高温炉中灼烧至恒重的工作基准试剂无水碳酸钠,称准至0.0002克。
,溶于50mL 水中,加10滴溴甲酚绿一甲基红指示液,用配制好的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸2min ,冷却后继续滴定至溶液再呈暗红色,同时做空白试验。
③ 计算:盐酸标准滴定溶液的浓度[c(HCl)]数值以摩尔每升(mol/L)表示,按下列公式计算:c(HCl)=121000()m V V M⨯-式中:m----无水碳酸钠的质量的准确数值,单位为克(g) V 1---盐酸溶液的体积的数值,单位为毫升(mL)V 2---空白试验盐酸溶液的体积的数值,单位为毫升(mL) M---无水碳酸钠的摩尔质量的数值,单位为克每摩尔(g/mol)[M (12Na 2CO 3)=52.994]容量分析原始记录检验: 审核: 检验日期:硫酸标准滴定溶液的配置滴定记录①配制:硫酸标准溶液,量取毫升硫酸,注入毫升水中。
碘标准溶液配制记录

量取待标定溶液量(ml)
消耗标准溶液量(ml)
空白试验
ml
计算结果
mol/L
平均值:C0=标定人:
标定人:
比较记录Байду номын сангаас
量取待标定溶液量(ml)
消耗标准溶液量(ml)
计算结果
mol/L
平均值C1=比较人:
(C1-C0)=
标准溶液浓度C=
备注:标准溶液配制温度为:20℃
标准溶液配制记录
日期
配制人
欲配标准溶液名称
碘标准溶液
欲配标准溶液浓度
0.1mol/L
待标定标准溶液配制过程:称取13g碘及35g碘化钾,溶于100ml水中,稀释至1000ml,摇匀,贮存于棕色瓶中。
标定过程:称取35.00ml~40.00ml配制好的碘标液,置于碘量瓶中,加150ml水,用配制好的硫代硫酸钠溶液滴定,临近终点时加2ml淀粉指示剂(10g/l)继续滴定至溶液蓝色消失,同时作空白试验。
标准溶液配制记录

标准溶液配制记录一、实验目的。
本实验旨在记录标准溶液的配制过程,以及相关实验数据,为后续实验提供准确可靠的参考依据。
二、实验原理。
标准溶液是已知浓度的溶液,通常用于分析化学中的定量分析。
在配制标准溶液时,需要根据溶质的化学性质和实验要求,选择适当的溶剂和溶质的质量,按照一定的比例配制而成。
三、实验步骤。
1. 准备实验所需的试剂和仪器设备,包括天平、容量瓶、移液管等。
2. 根据实验要求,选择合适的溶剂和溶质,并按照所需的浓度比例进行称量。
3. 将称量好的溶质溶解于适量的溶剂中,摇匀使其充分溶解。
4. 用容量瓶将溶液定容至刻度线,摇匀混合。
5. 将配制好的标准溶液转移至干净的密封瓶中,标注好溶液的名称、浓度、配制日期等信息。
四、实验数据记录。
| 溶质 | 质量/g | 溶剂 | 体积/mL | 浓度/mol/L | 配制日期 |。
|------|--------|------|---------|------------|----------|。
| NaCl | 5.85 | 水 | 1000 | 0.1 |2022/03/15|。
| KCl | 7.20 | 水 | 1000 | 0.2 |2022/03/16|。
五、实验结果分析。
通过本次实验的记录数据,我们成功配制出了两种浓度不同的标准溶液,分别为0.1mol/L的NaCl溶液和0.2mol/L的KCl溶液。
在实验过程中,我们严格按照配制步骤进行操作,确保了实验结果的准确性和可靠性。
六、实验总结。
本次实验记录了标准溶液的配制过程和相关数据,为后续实验提供了重要的参考依据。
在实验中,我们需要严格按照配制步骤进行操作,确保实验结果的准确性和可靠性。
同时,对于配制好的标准溶液,我们也需要做好标注和保存工作,以便后续实验的使用。
七、实验注意事项。
1. 在配制标准溶液时,需要准确称量溶质和溶剂,严格按照比例进行配制。
2. 配制好的标准溶液需要标注清楚名称、浓度、配制日期等信息,并保存在干净的密封瓶中。
A2、IVA标准溶液配制记录表
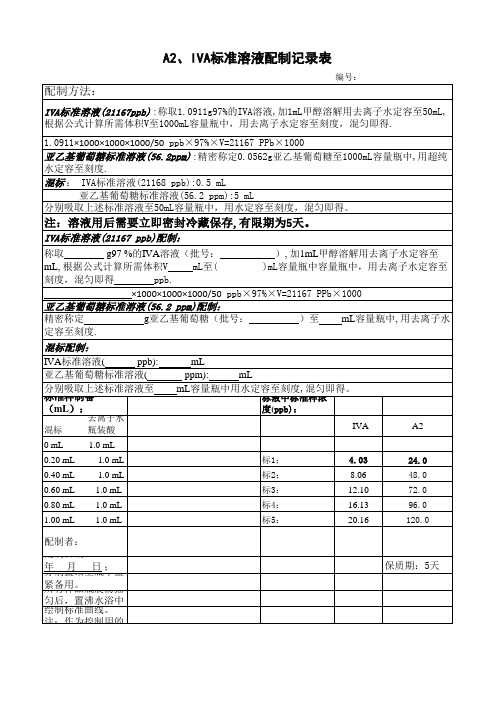
1.00 mL 1.0 mL
mLBiblioteka ppm):mLmL容量瓶中用水定容至刻度,混匀即得。 标液中标准样浓
度(ppb):
IVA
标1: 标2: 标3: 标4: 标5:
4.03 8.06 12.10 16.13 20.16
A2
24.0 48.0 72.0 96.0 120.0
配制者: 配制日期:
年分别置月顶空日瓶中;盖 紧所备有用样。品瓶震荡摇 匀后,置沸水浴中 绘制标准曲线。 注:作为控制用的
A2、IVA标准溶液配制记录表
配制方法:
编号:
IVA标准溶液(21167ppb) :称取1.0911g97%的IVA溶液,加1mL甲醇溶解用去离子水定容至50mL, 根据公式计算所需体积V至1000mL容量瓶中,用去离子水定容至刻度,混匀即得.
1.0911×1000×1000×1000/50 ppb×97%×V=21167 PPb×1000 亚乙基葡萄糖标准溶液(56.2ppm) :精密称定0.0562g亚乙基葡萄糖至1000mL容量瓶中,用超纯 水定容至刻度. 混标 : IVA标准溶液(21168 ppb):0.5 mL
保质期:5天
), 加1mL甲醇溶解用去离子水定容至 )mL容量瓶中容量瓶中,用去离子水定容至
×1000×1000×1000/50 ppb×97%×V=21167 PPb×1000
亚乙基葡萄糖标准溶液(56.2 ppm)配制:
精密称定
g亚乙基葡萄糖(批号:
)至 mL容量瓶中, 用去离子水
定容至刻度.
混标配制:
IVA标准溶液(
ppb):
亚乙基葡萄糖标准溶液(
分别吸取上述标准溶液至 标准样制备
(mL): 去离子水
溶液配制记录范文

溶液配制记录范文实验目的:本实验旨在通过溶液配制的方式,熟悉溶液的配制过程,并掌握配制过程中的操作技巧。
实验原理:溶液配制是将溶质溶解于溶剂中的过程。
通常情况下,配制溶液的方法有称量法和稀释法两种。
称量法是根据溶质的质量比例精确配制溶液,而稀释法是在已有溶液的基础上,用溶剂将其稀释至所需浓度。
实验仪器与试剂:1.磁力搅拌器2.称量瓶3.手持式电子天平4.三角底容量瓶5.各种试剂(如NaCl、NaOH、HCl等)实验步骤:1.准备工作a.清洗并消毒所需试剂容器。
b.检查瓶盖、瓶塞是否紧密,容器是否存在破损。
c.称量所需试剂前先校准电子天平。
d.检查溶剂是否过期,若过期则需更换新溶剂。
2.根据实验要求,决定所需溶质和溶剂,计算所需质量和体积。
3.称重试剂a.清洁并校准电子天平。
b.纳入干净的称量瓶中。
4.配制溶液a.根据所需质量或体积,向三角底容量瓶中加入适量的溶质。
b.用溶剂将溶质溶解至一定体积。
c.摇匀溶液直至充分溶解。
5.检验溶液浓度a.取适量溶液放入试管中。
b.使用合适的检测方法,如比色法、滴定法等,检测溶液的浓度。
c.如浓度不符合要求,根据需要进行稀释或浓缩。
6.记录所配制的溶液信息a.按照实验要求,记录有关溶液的相关信息,如浓度、溶质、溶剂、配制日期等。
实验注意事项:1.在称量试剂之前,保持天平干燥、清洁。
2.配制液体时,使用洁净、干燥的工具。
3.配制过程中,及时记录操作及所得结果。
4.每次操作后,清洗工具和容器,避免交叉污染。
实验结果与分析:本次实验中,成功配制了若干溶液,并通过浓度检测方法验证了其浓度。
每一步操作都严格按照实验步骤进行,并注意了各项注意事项。
实验结果表明所配制的溶液符合预期要求,操作过程中未出现明显误差。
通过本次实验,我对溶液配制有了更深入的理解,提高了实验操作的熟练度。
实验总结:通过本次溶液配制实验,我进一步理解了溶液配制的原理和方法,掌握了实验中的一些操作技巧。
在实验过程中,我加深了对操作的认识,提高了操作的精确性和独立性。
氯化锌标准溶液配制记录
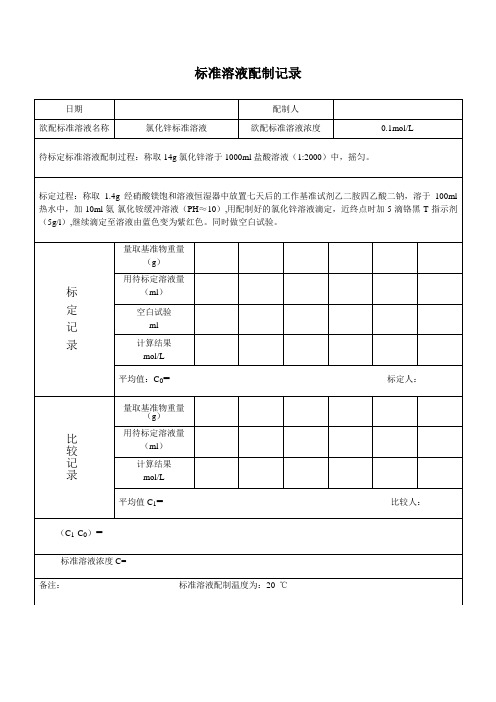
配制人
欲配标准溶液名称
氯化锌标准溶液
欲配标准溶液浓度
0.1mol/L
待标定标准溶液配制过程:称取14g氯化锌溶于1000ml盐酸溶液(1:2000)中,摇匀。
标定过程:称取1.4g经硝酸镁饱和溶液恒湿器中放置七天后的工作基准试剂乙二胺四乙酸二钠,溶于100ml热水中,加10ml氨-氯化铵缓冲溶液(PH≈10),用配制好的氯化锌溶液滴定,近终点时加5滴铬黑T指示剂(5g/l),继续滴定至溶液由蓝色变为紫红色。同时做空白试验。
标定记录
量取基准物重量(g)
用待标定溶液量(ml)
空白试验
ml
计算结果
mol/L
平均值:C0=标定人:
标定人:
比较记录
量取基准物重量
(g)
用待标定溶液量(ml)
计算结果
mol/L
平均值C1=比较人:
(C1-C0)=
标准溶液浓度Biblioteka =备注:标准溶液配制温度为:20℃
标准溶液配制记录
氢氧化钠标准溶液配制记录

氢氧化钠标准溶液的配制和标定记录
No
溶液名称:配制数量:(ml)
配制日期:有效日期:
配制
配制方法:称取________mL氢氧化钠溶液于100mL水的烧杯中,转移至1000mL的容量瓶中,稀释至刻度。
标定:
标定方法:
称取干燥至恒重的基准邻苯二甲酸氢钾,50mL水溶解,加入酚酞指示液,用配好的氢氧化钠滴定至粉红色,并保持30s。同时做空白:
配制人:审核人:
