元素电负性表
元素周期表电负性

元素周期表是一种结构完整的元素表,按照原子序数从小到大排列,它显示了元素的
基本特征,比如元素的原子量、电负性等。
元素周期表中电负性是指一种特定原子的电荷
密度,它描述了原子或分子中电子的分部方式,一般来说,电负性越高,则原子或分子中电子越分散。
电负性在元素周期表中是分布不均匀的,元素周期表中的电负性可以分为三个主要特点:第一个特点是每一列的电负性逐渐增加,每一行的电负性则呈现出“步进趋势”,意味
着每一行的电负性增加或减少的幅度不同;第二个特点是稀有气体一般具有较高的电负性;第三个特点是卤素元素在元素周期表中的电负性较高。
由于元素的电负性不同,这些元素的化学性质也会有所不同。
电负性高的元素通常容
易形成单质,因此具有较强的氧化性,电负性低的元素则容易形成化合物,具有较强的还
原性。
因此,元素周期表中的电负性各不相同,其性质可借此推断出它们的化学特性。
元素的电负性及其变化规律PPT 鲁科版
4、教学必须从学习者已有的经验开始。——杜威 5、构成我们学习最大障碍的是已知的东西,而不是未知的东西。——贝尔纳 6、学习要注意到细处,不是粗枝大叶的,这样可以逐步学习摸索,找到客观规律。——徐特立 7、学习文学而懒于记诵是不成的,特别是诗。一个高中文科的学生,与其囫囵吞枣或走马观花地读十部诗集,不如仔仔细细地背诵三百首诗。——朱自清 8、一般青年的任务,尤其是共产主义青年团及其他一切组织的任务,可以用一句话来表示,就是要学习。——列宁 9、学习和研究好比爬梯子,要一步一步地往上爬,企图一脚跨上四五步,平地登天,那就必须会摔跤了。——华罗庚 10、儿童的心灵是敏感的,它是为着接受一切好的东西而敞开的。如果教师诱导儿童学习好榜样,鼓励仿效一切好的行为,那末,儿童身上的所有缺点就会没有痛苦和创伤地不觉得难受地逐渐消失。——苏霍姆林斯基 11、学会学习的人,是非常幸福的人。——米南德 12、你们要学习思考,然后再来写作。——布瓦罗14、许多年轻人在学习音乐时学会了爱。——莱杰 15、学习是劳动,是充满思想的劳动。——乌申斯基 16、我们一定要给自己提出这样的任务:第一,学习,第二是学习,第三还是学习。——列宁 17、学习的敌人是自己的满足,要认真学习一点东西,必须从不自满开始。对自己,“学而不厌”,对人家,“诲人不倦”,我们应取这种态度。——毛泽东 18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫· 托尔斯泰 20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰· 贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基 13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚52、若不给自己设限,则人生中就没有限制你发挥的藩篱。 53、希望是厄运的忠实的姐妹。 54、辛勤的蜜蜂永没有时间悲哀。 55、领导的速度决定团队的效率。 56、成功与不成功之间有时距离很短只要后者再向前几步。 57、任何的限制,都是从自己的内心开始的。 58、伟人所达到并保持着的高处,并不是一飞就到的,而是他们在同伴誉就很难挽回。 59、不要说你不会做!你是个人你就会做! 60、生活本没有导演,但我们每个人都像演员一样,为了合乎剧情而认真地表演着。 61、所谓英雄,其实是指那些无论在什么环境下都能够生存下去的人。 62、一切的一切,都是自己咎由自取。原来爱的太深,心有坠落的感觉。 63、命运不是一个机遇的问题,而是一个选择问题;它不是我们要等待的东西,而是我们要实现的东西。 64、每一个发奋努力的背后,必有加倍的赏赐。 65、再冷的石头,坐上三年也会暖。 66、淡了,散了,累了,原来的那个你呢? 67、我们的目的是什么?是胜利!不惜一切代价争取胜利! 68、一遇挫折就灰心丧气的人,永远是个失败者。而一向努力奋斗,坚韧不拔的人会走向成功。 69、在真实的生命里,每桩伟业都由信心开始,并由信心跨出第一步。 70、平凡的脚步也可以走完伟大的行程。 71、胜利,是属于最坚韧的人。 72、因害怕失败而不敢放手一搏,永远不会成功。 73、只要路是对的,就不怕路远。 74、驾驭命运的舵是奋斗。不抱有一丝幻想,不放弃一点机会,不停止一日努力。3、上帝助自助者。 24、凡事要三思,但比三思更重要的是三思而行。 25、如果你希望成功,以恒心为良友,以经验为参谋,以小心为兄弟,以希望为哨兵。 26、没有退路的时候,正是潜力发挥最大的时候。 27、没有糟糕的事情,只有糟糕的心情。 28、不为外撼,不以物移,而后可以任天下之大事。 29、打开你的手机,收到我的祝福,忘掉所有烦恼,你会幸福每秒,对着镜子笑笑,从此开心到老,想想明天美好,相信自己最好。 30、不屈不挠的奋斗是取得胜利的唯一道路。 31、生活中若没有朋友,就像生活中没有阳光一样。 32、任何业绩的质变,都来自于量变的积累。 33、空想会想出很多绝妙的主意,但却办不成任何事情。 34、不大可能的事也许今天实现,根本不可能的事也许明天会实现。 35、再长的路,一步步也能走完,再短的路,不迈开双脚也无法到达。 36、失败者任其失败,成功者创造成功。 37、世上没有绝望的处境,只有对处境绝望的人。 38、天助自助者,你要你就能。 39、我自信,故我成功;我行,我一定能行。 40、每个人都有潜在的能量,只是很容易:被习惯所掩盖,被时间所迷离,被惰性所消磨。 41、从现在开始,不要未语泪先流。 75、自己选择的路,跪着也要走完。
元素周期表中的电负性与元素性质

元素周期表中的电负性与元素性质元素周期表是一种有序排列的化学元素集合,它对我们理解和研究元素的性质和行为提供了基础框架。
其中,元素的电负性是一个重要的指标,它在描述元素化学性质和化学反应中的作用有着关键的作用。
本文将从元素周期表中的电负性的概念、电负性与元素性质的关系以及电负性的应用等方面展开论述。
一、电负性的概念电负性是描述原子核周围的电子对于与之结合形成分子或产生化学键时的亲和力的一种度量。
它是一个无量纲的物理量,由化学家林德罗-保罗-因数表达。
电负性值一般在0至4之间,数值越大,原子吸引外层电子的能力越强,电负性值最高的元素是氟,为4.0。
二、电负性与元素性质的关系1. 化学键的形式电负性差异较大的元素之间形成离子键,如金属和非金属元素的结合,金属元素失去电子,非金属元素获得电子。
电负性差异较小的元素之间形成共价键,如氢气、氧气和水分子中原子之间的结合,共享电子。
2. 元素反应活性电负性高的元素往往具有较强的还原性,易失去电子形成阳离子。
电负性低的元素往往具有较强的氧化性,容易获得电子形成阴离子。
因此,在反应中,电负性高的元素更容易氧化,而电负性低的元素更容易还原。
3. 化学反应速率电负性差异大的元素之间的反应速率通常较快,因为电负性高的元素能够更强烈地吸引电子,促使反应发生。
反之,电负性差异小的元素之间的反应速率较慢,因为共享电子更稳定。
三、电负性的应用1. 预测化学键的类型根据元素的电负性差异可以预测化学键的类型。
当两个元素的电负性差异大于1.7时,它们往往形成离子键;当两个元素的电负性差异小于1.7但大于0.5时,它们往往形成极性共价键;当两个元素的电负性差异小于0.5时,它们往往形成非极性共价键。
2. 预测化学反应活性通过比较元素的电负性值,可以预测在化学反应中哪些元素更容易发生氧化还原反应。
电负性高的元素更容易被还原,而电负性低的元素更容易被氧化。
3. 解释元素的物理性质元素的电负性与其物理性质也有一定的关系。
元素周期律元素的电负性

规律一
一般认为: 电负性 大 于 1.8的元素 为非金属元素; 电负性 小 于 1.8的元素 为金属元素; 电负性 等 于 1.8 的元素为 类金属元素。
规律二
一般认为: 如果两个成键元素间的电负性差值 大于1.7,他们之间通常形成 离 子 键 如果两个成键元素间的电负性差值 小于1.7,他们之间通常形成 共 价 键
鲍林研究电负性 的手搞
元素电负性
2、电负性的递变规律:
电负性最大
。
电负性逐渐 增 大 电 负 性 有
减 小
的 电负性最小 趋 势
原因?
解释
• 1、同周期从左至右元素的电负性逐渐增大 • 原因:同周期从左至右,电子层数相同,核电荷数 增大,原子半径递减,有效核电荷递增,对外层电 子的吸引能力逐渐增强,因而电负性值增加 • 2、同一主族中,从上到下,元素的电负性逐渐减小 • 原因:同主族元素从上到下,虽然核电荷数也增多, 但电子层数增多引起原子半径增大比较明显,原子 和对外层电子的吸引能力逐渐减弱,元素的电负性 值递减
规律三 电负性小的元素在化合物中吸 引电子的能力 弱 ,元素的化合 价为 正 值;
电负性大的元素在化合物中吸 引电子的能力 强 ,元素的化合 价为 负 值。
课堂练习: 1、一般认为:如果两个成键元素的电负性相差大 于1.7,它们通常形成离子键;如果两个成键元素 的电负性相差小于1.7,它们通常形成共价键。查 阅下列元素的电负性数值,判断:①NaF ②AlCl3 ③NO ④MgO ⑤BeCl2 ⑥CO2 共价化合物( ②③⑤⑥ ) 离子化合物( ①④ )
8. A、B、C、D四种元素,已知A元素是自然界 中含量最多的元素;B元素为金属元素,已知 它的原子核外K、L层上电子数之和等于M、N层 电子数之和;C元素是第3周期第一电离能最小 的元素,D元素在第3周期中电负性最大。 (1)试推断A、B、C、D四种元素的名称和符号。 氧(O)钙( Ca)钠( Na)氯(Cl)
元素周期表中的电负性与原子半径

Part One
单击添加章节标题
Part Two
元素周期表中的电 负性
电负性的定义
电负性是衡量 元素原子吸引 电子能力的物
理量
电负性越大, 元素原子吸引 电子能力越强
电负性与原子 半径成反比, 原子半径越小,
电负性越大
电负性是元素 化学性质的重 要指标,影响 元素的氧化还 原反应和化学
键类型
电负性的周期性变化
电子构型对电负 性和原子半径的 影响:电子构型 决定了原子的电 负性和原子半径, 电子构型越稳定, 电负性越强,原 子半径越小。
电子密度的影响
电子密度与电负性:电子密度 越大,电负性越强
电子密度与原子半径:电子密 度越大,原子半径越小
电子密度与化学性质:电子密 度影响元素的化学性质,如氧 化还原反应、酸碱性等
电子密度与物理性质:电子密 度影响元素的物理性质,如熔 点、沸点、导电性等
电子亲和力的影响
电子亲和力是衡量元素电负性的重要参数 电子亲和力与原子半径的关系:电子亲和力越大,原子半径越小 电子亲和力与元素周期表的关系:电子亲和力随着元素周期表的变化而变化 电子亲和力与化学反应的关系:电子亲和力影响化学反应的速率和方向
Part Four
电负性与原子半径 的影响因素
核电荷数的影响
核电荷数增加,电负性降低 核电荷数增加,原子半径减小 核电荷数增加,原子核对电子的吸引力增强 核电荷数增加,原子核对电子的束缚能力增强
电子构型的影响
电子构型:原子 中电子的排布和 能级
电负性:原子吸 引电子的能力
原子半径:原子 的大小和电子云 的分布
电负性的应用
预测化学反应:电负性可以预测化学反应的性质和产物
解释化学键:电负性可以解释化学键的性质和强度
元素的电负性-高二化学课件(人教版2019选择性必修2)

3.电负性(阅读课本P24-25)
(5) 电负性的应用: ②判断化合物中元素化合价的正负
电负性大的元素在化合物中吸引电 子能力较强,元素的化合价为负值。
电负性小的元素在化合物中吸引电子能力弱, 元素的化合价为正值;
3.电负性(阅读课本P24-25)
(5) 电负性的应用:
②判断化合物中元素化合价的正负
+4 -1 0
SiH4 + 2O2
+4 -2 +1 -2
SiO2 + 2H2O
氧化产物
高中化学
判断共价化合物中元素的化合价的正负
高中化学
甲硅烷是一种较强还原剂
+4 -1 0
SiH4 + 2O2
+4 -2 +1 -2
SiO2 + 2H2O
氧化产物
-4 +1 0
CH4 + 2O2
点燃
+4 -2
CO2
说明:1.元素电负性的值是个相对的量,没有单位。 2.元素电负性的概念最先是由鲍林在研究化学键时提出来的。以氟的电负性为4.0 作为相对标准,然后根据化学键的键能推算其他元素的相对电负性的数值,后人 做了更精确的计算,数值有所修改。
鲍林L.Pauling 1901-1994
莱纳斯·卡尔·鲍林(Linus Carl Pauling, 1901.2.28~1994.8.19),美国著名化学家, 量子化学和结构生物学的先驱者之一。 1954年因在化学键方面的工作取得诺贝尔 化学奖,1962年因反对核弹在地面测试的 行动获得诺贝尔和平奖,成为获得不同诺 贝尔奖项的两人之一。
H2 H H 电负性差 0
非极性共价键
3.电负性(阅读课本P24-25)
元素周期表中元素的电负性变化规律

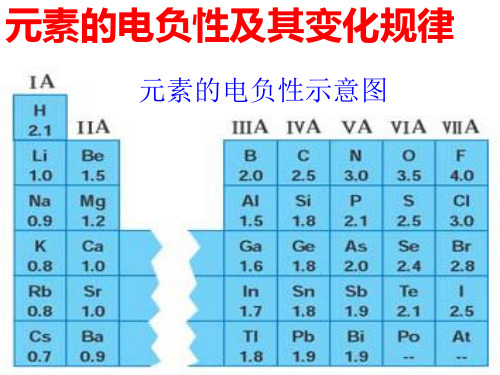
元素周期表中元素的电负性变化规律
1.随着原子序号的递增,元素的电负性呈现周期性变化。
2.同一周期,从左到右元素电负性递增,同一主族,自上而下元素电负性递减。
对副族而言,同族元素的电负性也大体呈现这种变化趋势。
因此,电负性大得元素集中在元素周期表的右上角,电负性小的元素集中在畅哗扳狙殖缴帮斜爆铆左下角。
3.非金属元素的电负性越大,非金属元素越活泼,金属元素的电负性越小,金属元素越活泼。
氟的电负性最大(
4.0),是最活泼的非金属元素;钫是电负性最小的元素(0.7),是最活泼的金属元素。
4.过渡元素的电负性值无明显规律。
贾-电负性表精编版
……………………………………………………………最新资料推荐…………………………………………………
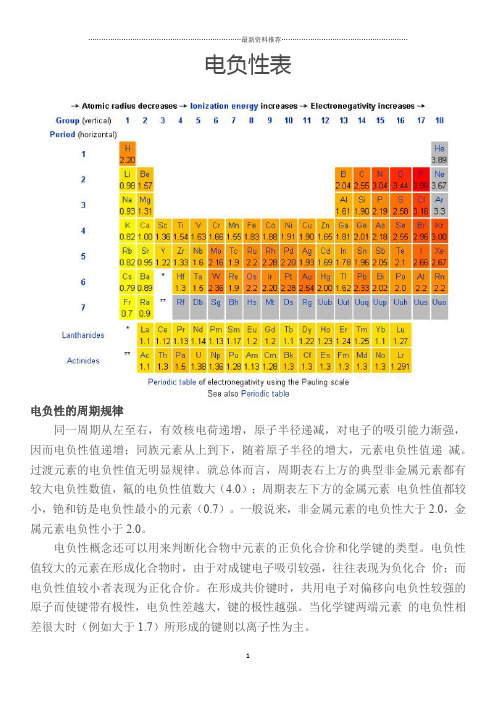
电负性表
电负性的周期规律
同一周期从左至右,有效核电荷递增,原子半径递减,对电子的吸引能力渐强,因而电负性值递增;同族元素从上到下,随着原子半径的增大,元素电负性值递减。
过渡元素的电负性值无明显规律。
就总体而言,周期表右上方的典型非金属元素都有较大电负性数值,氟的电负性值数大(4.0);周期表左下方的金属元素电负性值都较小,铯和钫是电负性最小的元素(0.7)。
一般说来,非金属元素的电负性大于2.0,金属元素电负性小于2.0。
电负性概念还可以用来判断化合物中元素的正负化合价和化学键的类型。
电负性值较大的元素在形成化合物时,由于对成键电子吸引较强,往往表现为负化合价;而电负性值较小者表现为正化合价。
在形成共价键时,共用电子对偏移向电负性较强的原子而使键带有极性,电负性差越大,键的极性越强。
当化学键两端元素的电负性相差很大时(例如大于1.7)所形成的键则以离子性为主。
1。
元素的电负性及其变化规律PPT课件(上课用)
109.每个人皆有连自己都不清楚的 潜在能 力。无 论是谁 ,在千 钧一发 之际, 往往能 轻易解 决从前 认为极 不可能 解决的 事。― ―[戴尔·卡内基 ]
4、无论你觉得自己多么了不起,也永 远有人 比更强 ;无论 你觉得 自己多 么不幸 ,永远 有人比 你更不 幸。 5、也许有些路好走是条捷径,也许有 些路可 以让你 风光无 限,也 许有些 路安稳 又有后 路,可 是那些 路的主 角,都 不是我 。至少 我会觉 得,那 些路不 是自己 想要的 。 6、在别人肆意说你的时候,问问自己 ,到底 怕不怕 ,输不 输的起 。不必 害怕, 不要后 退,不 须犹豫 ,难过 的时候 就一个 人去看 看这世 界。多 问问自 己,你 是不是 已经为 了梦想 而竭尽 全力了 ?
113.人生的目的有二:先是获得你 想要的 ;然后 是享受 你所获 得的。 只有最 明智的 人类做 到第二 点总与 幽默的 人相伴 ,健康 总与阔 达的人 相伴。 20、对所学知识内容的兴趣可能成 为学习 动机。 ——赞 科夫 21、游手好闲地学习,并不比学习游手 好闲好 。—— 约翰·贝 勒斯
22、读史使人明智,读诗使人灵秀,数 学使人 周密, 自然哲 学使人 精邃, 伦理学 使人庄 重,逻 辑学使 人善辩 。—— 培根 23、我们在我们的劳动过程中学习思考 ,劳动 的结果 ,我们 认识了 世界的 奥妙, 于是我 们就真 正来改 变生活 了。— —高尔 基 24、我们要振作精神,下苦功学习。下 苦功, 三个字 ,一个 叫下, 一个叫 苦,一 个叫功 ,一定 要振作 精神, 下苦功 。—— 毛泽东
元素的电负性及其变化规律
减 小
的 趋 电负性最小 势
2、电负性的递变规律: 同一周期从左到右,主族元素电负性逐 渐 增 大,表明其吸引电子的能力逐 渐 增 大。同一主族从上到下,元素电负性 呈现 减 小 趋势,表明其吸引电子的能力 逐渐 减 小 。
3、电负性的意义
反映了原子间的成键能力和成键 类型。 一般认为,电负性 大于 1.8的元 素为非金属元素,电负性 小于 1.8的 元素为金属元素。
规律与总结
一般认为,如果两个成键元素间 的电负性差值大于1.7,他们之间通常 形成 离 子 键;如果两个成键元素间 的电负性差值小于1.7,他们之间通常 形成 共 价 键。
概念应用
请查阅下列化合物中元素的电负 性值,判断他们哪些是离子化合物, 哪些是共价化合物
NaF HCl NO MgO KCl CH4
巩固练习
7、A、B、C、D四种元素,已知A元素是自然界中 含量最多的元素;B元素为金属元素,已知它的 原子核外K、L层上电子数之和等于M、N层电子数 之和;C元素是第3周期第一电离能最小的元素, D元素在第3周期中电负性最大。 (1)试推断A、B、C、D四种元素的名称和符号。 O Ca Na Cl (2)写出上述元素两两化合生成的离子化合物的 化学式。
CaO
Na2O
Na2O2 CaCl2
NaCl
元素的电负性及其变化规律
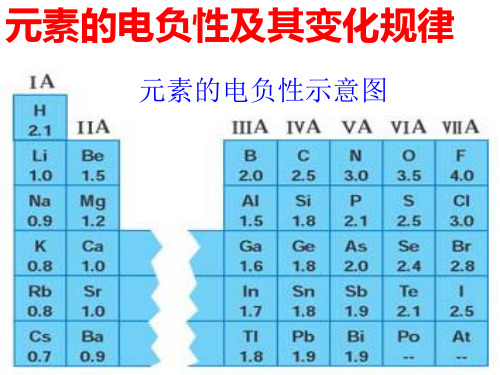
元素的电负性示意图
1、电负性的概念:
1932年鲍林引入电负性的概念,用来 表示当两个不同原子在形成化学键时 吸引电子能力的相对强弱。
电负性是元素的原子在化合物中 的 吸引电子能力的标度。元素的电负 性越大,表示其原子在化合物中吸引 电子的能力越强。
电负性逐渐 增 大 。 电负性最大 电 负 性 有
元素电负性表格

Theoretical Method Density Functional Electronegativity Formulation In DFT the electronegativity assumes the general form [37]: ∂E χ ( N ) = − ∂N V (1)
χM =
b + N −1 2 a
N −1 b + N +1 N + 1 C A − 1 a + ( N − 1) 2 arctan arctan − + 4 ln a + ( N + 1) 2 2 a a a
(4)
where in order to simplify the expression, the following definitions have been introduced:
*
Permanent address: Chemistry Department, West University of Timisoara, Str. Pestalozzi
No.16, Timisoara, RO-1900, Romania.
In the framework of the density functional theory a new electronegativity formulation via the Feynman-Kleinert path integral formalism in the markovian limit is proposed. The computation of the electronic density follows, in terms of partition function, the same procedure of the Levy’s constrained-search for the wave function. The obtained electronegativity scale seems to respect the main criteria largely used for its acceptability.
元素的电负性及其变化规律

这种趋势是由于在同一周期内 ,随着核电荷数的增加,原子 核对价电子的吸引力逐渐增强 ,使得元素的电负性增大。
例如,在第二周期中,从锂( Li)到氟(F),电负性逐渐增 大,氟的电负性最大。
同一主族内元素电负性变化趋势
在同一主族内,从上到下,随着原子序数的增加,元素的电负性逐渐减小 。
离子键性质
离子键具有较高的熔点和沸点 ,硬度大,且在水溶液中容易 导电。
共价键形成与电负性匹配
电负性相近
共价键通常发生在电负性相近的 元素之间。这些元素在成键时, 电子不是完全转移,而是共用。
共用电子对
在共价键中,原子间通过共用电 子对来达到稳定的电子构型。共 用电子对受两个原子核的吸引, 使得原子间形成稳定的化学键。
电负性与电子亲和能
电子亲和能是指气态原子获得一个电子形成气态阴离子所放出的能 量。元素的电负性越大,其电子亲和能通常也越大。
电负性与金属性、非金属性
金属元素的电负性较小,非金属元素的电负性较大。因此,电负性 可以作为判断元素金属性或非金属性的一个指标。
02
元素周期表中电负性变化规律
同一周期内元素电负性变化趋势
03
过渡元素的电负性比较复杂, 因为它们的核外电子排布比较 复杂,既有金属性又有非金属 性。
金属与非金属间差异分析
01
02
03
04
金属元素的电负性一般较弱, 非金属元素的电负性一般较强 。
金属元素的电负性一般较弱, 非金属元素的电负性一般较强 。
金属元素的电负性一般较弱, 非金属元素的电负性一般较强 。
共价键性质
共价键的熔点和沸点通常比离子 键低,硬度较小,且在水溶液中 不易导电。
电负性

电负性鲍林标度电负性表电负性的定义电负性(Electronegativity)又称为相对电负性,简称电负性。
电负性综合考虑了电离能和电子亲合能,首先由莱纳斯·卡尔·鲍林于1932年引入电负性的概念,用来表示两个不同原子形成化学键时吸引电子能力的相对强弱,是元素的原子在分子中吸引共用电子的能力。
通常以希腊字母χ为电负性的符号。
鲍林给电负性下的定义为“电负性是元素的原子在化合物中吸引电子能力的标度”。
元素电负性数值越大,表示其原子在化合物中吸引电子的能力越强;反之,电负性数值越小,相应原子在化合物中吸引电子的能力越弱(稀有气体原子除外)。
一个物理概念,确立概念和建立标度常常是两回事。
同一个物理量,标度不同,数值不同。
电负性可以通过多种实验的和理论的方法来建立标度。
计算方法首先需要说明,电负性是相对值,所以没有单位。
而且电负性的计算方法有多种(即采用不同的标度),因而每一种方法的电负性数值都不同,所以利用电负性值时,必须是同一套数值进行比较。
比较有代表性的电负性计算方法有3种:① L.C.鲍林提出的标度。
根据热化学数据和分子的键能,指定氟的电负性为4.0,锂的电负性1.0,计算其他元素的相对电负性。
②R.S.密立根从电离势和电子亲合能计算的绝对电负性。
③A.L.阿莱提出的建立在核和成键原子的电子静电作用基础上的电负性。
常见元素的电负性变化氟〉氧〉氮= 氯〉溴〉碘= 硫= 碳铝>铍>镁>锂=钙>钠>钾电负性的周期性变化氢 2.1 锂1.0铍 1.57 硼 2.04 碳 2.55 氮 3.04 氧 3.44 氟 4.0 钠 0.93 镁 1.31 铝 1.61 硅 1.90 磷 2.19 硫 2.58 氯 3.16 钾 0.82 钙 1.00 锰 1.55 铁 1.83 镍 1.91 铜 1.9 锌 1.65 镓1.81 锗2.01 砷 2.18 硒 2.48 溴 2.96铷 0.82 锶 0.95 银 1.93 碘 2.66 钡 0.89 金 2.54 铅 2.33一般来说,周期表从左到右,元素的电负性逐渐变大;周期表从上到下,元素的电负性逐渐变小。
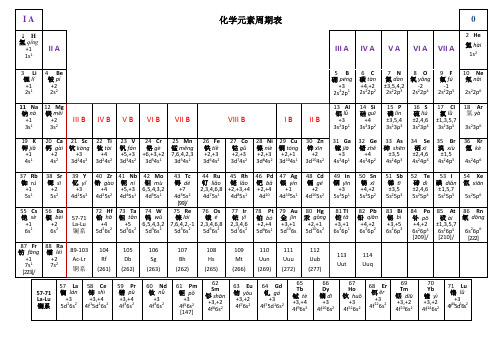
带读音、化合价、电负性的化学元素周期表
铒ěr
+3
4f126s2
69Tm
铥diū
+3,+2
4f136s2
70Yb
镱yì
+3,+2
4f146s2
71Lu
镥lǔ
+3
4f145d16s2
89-103
Ac-Lr
锕系
89Ac
锕ā
+3
6d17s2
90Th
钍tǔ
+4
6d27s2
91Pa
镤pú
+5,+4
5f26d17s2
92U
铀yóu
6,5,4,3
61Pm
钷pǒ
+3
4f56s2
[147]
62Sm
钐shān
+3,+2
4f66s2
63Eu
铕yǒu
+3,+2
4f76s2
64Gd
钆gá
+3
4f75d16s2
65Tb
铽tè
+3,+4
4f96s2
66Dy
镝dī
+3
4f106s2
67Ho
钬huǒ
+3
4f116s2
68Er
铒ěr
+3
4f126s2
69Tm
铥diū
4s24p5
36 Kr
氪kè
4s24p6
37 Rb
铷rú
+1
5s1
38 Sr
锶sī
+2
5s2
39 Y
钇yǐ
+3
