3.比较不同催化剂过氧化氢分解的影响
过氧化氢的催化分解

过氧化氢的催化分解一、实验目的1、了解不同催化剂对过氧化氢(H2O2)催化分解速率的影响。
2、认知能催化分解H2O2的不同催化剂。
二、实验原理过氧化氢催化分解是一级反应:H2O2→H2O+1/2O2.。
(凡是反应速度只与反应浓度的一次方成正比的反应称为一级反应。
)实验证明,过氧化氢的反应机理为一级反应.化学反应速度取决于反应物的浓度、温度、反应压力、催化剂、搅拌速度等许多因素。
许多催化剂如Pt、Ag、Cr、MnO2、FeCl3、CuO、血液、铁丝、炭粉、土豆丝等都能加速H2O2分解。
用土豆丝来催化分解H2O2溶液,说明生物体内不断产生的过氧化氢酶,可促使H2O2迅速分解,这种酶广泛存在于动植物组织中。
三、实验仪器与药品仪器:试管(2个)、具支试管(1个)、锈铁丝、气球、土豆丝、药品:H2O2溶液,四、实验步骤1,过氧化氢溶液的制备用移液管吸取30℅H2O2溶液5ml,置于50ml容量瓶中,稀释至刻度线,摇匀定容,即得实验用的H2O2溶液。
2,酶催化作用的验证实验取两只试管,在一支试管中放入切成细条状的土豆丝。
分别向两支试管中注入3%的H2O2 5ml,注意观察现象(放入土豆丝的试管中迅速产生大量的气泡,泡沫很快充满试管;用玻璃棒桶开泡沫,)插入带火星的木条,则木条立即复燃,而另一支试管中无明显现象。
3,用抽动法做“催化剂对H2O2分解速度的影响”的实验①取一支具支试管,在具支试管中加入10ml浓度30%H2O2溶液,在支管上装上小气球,通过橡皮塞插入一根已生锈的绕成螺旋状的粗铁丝。
②将螺旋状的锈铁丝向下插入H2O2溶液中是,注意观察现象的变化。
(H2O2迅速分解,锈铁丝表面上,有大量气泡产生。
气球鼓起;把铁丝向上拉,离开H2O2溶液,则反应不明显。
)③取下塞子,用带火星木条放在试管口,注意观察现象变化。
(则木条立即复燃,说明有O2生成。
)五、注意事项1、实验过程中注意安全2、玻璃仪器轻拿轻放六、思考题1,催化剂对反应速度有何影响?2,常用催化剂有哪些?。
不同催化剂对过氧化氢分解的催化速率探究

2H2O2 -> 2H2O + O2
为了提高过氧化氢的分解速率,科学家们研究了多种催化剂,并探索了它们对过氧化氢分解的催化作用。
铁盐是一种常见的催化剂,如Fe2+和Fe3+。这些催化剂可以促进过氧化氢分解反应的进行,提高催化速率。铁盐的催化机制被认为是通过与过氧化氢形成氢氧自由基(HO·)来实现的。氢氧自由基是一种高活性的物种,可以进一步参与其他反应,如氧化底物。因此,铁盐不仅可以加速过氧化氢的分解,还可以参与其他氧化反应。
除了铁盐外,过渡金属离子也被发现具有催化过氧化氢分解的能力。例如,铜离子(Cu2+)和钴离子(Co2+)都可以促进过氧化氢的分解。这些过渡金属离子通过与过氧化氢发生配位键的形式催化反应。通过改变过渡金属离子的种类和浓度,可以调控过氧化氢分解的催化速率。
还有一些非金属催化剂也可以催化过氧化氢的分解。例如,氧化剂如过氧化钠(Na2O2)和过氧化银(Ag2O2)都可以加速过氧化氢的分解反应。这些氧化剂通过与过氧化氢反应,产生氧气和水,并释放出大量的能量。因此,在特定条件下,氧化剂可以作为高效的催化剂,提高过氧化氢分解的催化速率。
除了上述催化剂外,还有许多其他的催化剂被应用于过氧化氢分解的研究中。例如,有机物如酶类(如过氧化氢酶)和有机过氧化物也显示出催化过氧化氢分解反应的能力。此外,一些纳米材料如金纳米颗粒和银纳米颗粒也被发现可以催化过氧化氢的分解。
催化剂对过氧化氢分解的催化速率有着重要的影响。铁盐、过渡金属离子、氧化剂、酶类和纳米材料都可以作为催化剂,促进过氧化氢的分解反应。通过调控催化剂的种类、浓度和反应条件,可以实现对过氧化氢催化速率的调控,从而提高过氧化氢的稳定性和安全性。未来的研究还可以进一步探索新的催化剂,并研究它们的催化机制,以提高过氧化氢分解的效率和选择性。
不同催化剂对过氧化氢的影响

Company Logo
1
选用的材料都具有催化性
2 催化剂的用量越大,产生气体越多
3 过氧化氢浓度对气体产生影响
方案制定与实施
❖ 【实验原理】 2H2O2 = 2H2O + O2 ❖ 【实验装置】
过氧化 氢
水 催化 剂
装置图
Company Logo
实物图
Company Logo
❖ 【实验材料】
市场选购肝脏 食堂后勤提供蔬菜类催化剂
10% 反应较温和而 且较快,产生 气泡,放热。
599 19.96
367
12.23
20% 反应剧烈, 产生大量气 泡,放出大
量热。 549
18.3
296
9.86
30% 反应剧烈难以 控制,产生大 量气泡,放出 大量热。
600
20
388
12.93
Company Logo
记录表3 探究肝脏的用量对其分解速率的影响
3肝脏的用量
通过这些平行实验 得出,室温、肝脏作 催化剂、过氧化氢 浓度为30%和同条 件下催化剂的用量 对分解速率的影响 为:0.9>0.6>0.3 。即催化剂的用量 越多,过氧化氢的 分解速率越快
Company Logo
实验反思
1
探究三中得出 的结论是,催化剂用 量越大,过氧化氢分 解速率越大。而事实 上催化剂的用量有一 个极限值。但是我们 的探究实验没有得出 这个结果,主要还是 因为设计探究条件的 不足。
最佳催化剂用量(g)
0.3
0.6
0.9
现象记录 时间(s/50mL)
反应较温和而且 反应较温和而且 反应剧烈难以控
较快,产生气泡, 更快,产生气泡, 制,产生大量气
3 催化剂对过氧化氢分解反应速率的影响的实验改进

试剂:6﹪H2O2 溶液、MnO2、Fe2O3、蒸馏水、其他可作催化剂的物质(自 选)。
可选土豆也可选红砖粉末。
计算 5mL6﹪H2O2 溶液在标况下大约产生约 100mL 氧气 实验方法
1、50mL 的氯化钠注射用液点滴瓶代替锥形瓶,
2、用一次性注射器准确量取 5mL6﹪H2O2 溶液,把催化剂放入 50mL 的氯化 钠注射液点滴瓶中。
4
这种实验的不足之处:
1.锥形瓶的底部表面积比较大,分液漏斗中的 H2O2 溶液在滴入锥形瓶中, 不能保证溶液与催化剂充分接触。
2.由于分液漏斗中的 H2O2 溶液不是一起落入锥形瓶中,而反应的速率有块 又慢,过氧化氢不是平缓的放出,当瓶内产生大量氧气时,瓶内压强过大,使溶
液很难往下滴。
3.量筒倒置在水槽中,在 15s、30s、45s、60s 时观察产生氧气的体积时不准 确。
需时间/s
收集 2 瓶氧气所
需时间/s
反应结束所需的
时间/s
3
实验改进的优点 1.用 50mL 的氯化钠注射用液点滴瓶代替锥形瓶,瓶底的面积小,可增大与 催化剂的接触面积。 2.用一次性注射器一次把溶液注入,在时间上能保证同步性。 3.记录收集一瓶气体、两瓶气体时间,会减小由上述观察带来的误差。 由于影响化学反应的因素有很多,如温度、浓度等,而上述反应又是一个放 热反应随着反应的进行,溶液温度升高,化学反应速率必然增快,而随着反应物 的浓度减小,其速率也必然减小,上述实验方法的改进,也是我的个人的一点看 法,还需与大家一起交流。
3、用一次性输液器代替另一导管。
4、把 5mL6﹪H2O2 溶液用注射器一次完全注入瓶中。 5、用排水法用另外两个 纪
录收集一瓶、收集两瓶及不再产生氧气所需的时间。
课题2催化剂对过氧化氢分解反应的影响

6、影响化学反应速率的客观因素有许多,如温度、浓度、 催化剂、表面积等。因此探究客观条件与化学反应速率关
系的实验设计及改进也就有许许多多。某同学设计如下实 验证明MnO2在H2O2的分解反应过程中起催化作用。 ①在粉末状的二氧化锰上滴加适量水制
二、实验操作要点及主要实验现象
课题方案设计 :
1、同一催化剂不同的状态对化学反应 速 率 的 影 响 , 采 用 MnO2 作 催 化 剂 , 用类比的方法进行实验,用粉末状和 颗粒状两种,且采取不振荡和振荡二 种形式,催化剂的用量均取0.1g。
2、用不同的催化剂对化学反应速率的影 响,采用CuO、活性炭、FeCl3 、KI等 作H2O2分解的催化剂,各物质的用量均 取0.1g。
生成25 mL气体所用的时间
待测数据
(2)若⑤⑥中待测数据分别为 10和7(单位相同),则__M_n_O__2 __ (填写化学式)催化效果好。 (3)为探究CuO在实验(5)中是 否起催化作用,需补做如下实验(无需写出具体 操作): a.__验__证__C_u_O__的__质__量__没__有__改__变________, b.验证CuO的化学性质没有改变。
3、实验装置可按教材P(49) 图4-4所示组装。实验时,在 50ml量筒中盛满水,倒置于 水槽中,通过分液漏斗把 5ml 6% H2O2溶液加入锥形 瓶中,记录各时间段收集到 的氧气的体积。
实验一 :
以二氧化锰作催化剂,进行三次 实验,其中前2组实验均使用粉末状 二氧化锰,但由于250ml锥形瓶底部 较大,而添加溶液仅为5ml,故反应 时接触面积有差异,第3组实验使用 颗粒状二氧化锰,对比前二次的粉末 状的二氧化锰。
最新年高中化学 专题4 课题2 催化剂对过氧化氢分解反应速率的影响教学案 苏教版选修6(考试必备)

课题2 催化剂对过氧化氢分解反应速率的影响[浙江选考·加试要求]—————————————————————————————————————1.不同的催化剂对同一反应的催化效果。
2.变量控制在实验研究中的应用。
1.通过比较不同的催化剂对过氧化氢分解速率的影响的差异,从中认识到催化剂的种类、用量等的选择对实验效果的影响。
2.认识实验方法的选择及反应条件的控制在实验研究中的重要作用,加深对化学反应条件控制的重要性的认识。
3.尝试用比较法来寻找实验的最佳方案,通过实验提高处理实验数据和分析实验结果的能力。
———————实验要素先知道1.催化剂和催化作用(1)能改变化学反应速率而本身的化学组成和质量在反应前后保持不变,这种物质叫做催化剂。
催化剂在反应中所起的作用叫催化作用。
(2)在化工生产中,常常加入催化剂以促进化学反应的进行。
例如,硫酸工业中,由二氧化硫制三氧化硫的反应常用五氧化二钒作催化剂;氮气与氢气合成氨的反应,使用的是以铁为主体的多成分催化剂;生物体内的化学反应也与催化剂有着密切的关系,生物体内的各种酶具有催化活性,是生物催化剂。
(3)催化剂只能加快反应的速率,不能使原来不能发生的反应得以进行。
在可逆反应中,催化剂只能缩短反应达到平衡的时间,而不能使化学平衡发生移动。
(4)催化剂一般有选择性,不同的化学反应要选用不同的催化剂。
同样的反应物选用不同的催化剂,可以发生不同的反应,从而得到不同的产物。
2.催化剂与反应活化能(1)催化剂虽然在反应前后的质量和化学性质没有发生变化,但有些催化剂却参与了化学变化过程,在参与反应的过程中其化学性质和质量均发生改变,即反应过程中必定既包括有催化剂参与的反应,又包括使催化剂再生成的反应。
(2)分子或离子间的碰撞是发生化学反应的先决条件,但不是每次碰撞都会引发反应。
能够引起反应的分子(或离子)间的相互碰撞叫做有效碰撞,能够发生有效碰撞的分子叫做活化分子。
活化分子具有较高的能量,因此活化分子所占分数的大小决定了反应速率的快慢。
5.1 实验比较过氧化氢在不同条件下的分解、影响酶活性的条件实验报告单-2023-2024 学年高一

探究酶的特性以及酶活性的影响因素实验姓名:班级:学号:实验一:比较过氧化氢在不同条件下的分解实验目的比较H2O2在常温、常压、H2O2酶、铁离子等条件下气泡产生的多少(O2产生速率)或卫生香燃烧的剧烈程度,比较二者的催化效率的高低,了解过氧化氢酶的作用。
实验原理材料用具实验材料:新鲜的质量分数为20%的肝脏(鸡肝)研磨液、体积分数为3%的过氧化氢溶液器材:试管,量筒,小烧杯,大烧杯,滴管,试管夹,恒温水浴锅,火柴,卫生香。
实验步骤试管编号1234第一步H2O2浓度3%3%3%3%剂量第二步温度添加试剂剂量实验现象气泡产生情况卫生香复燃情况实验结论酶在细胞代谢中有作用,同时还证明与相比,酶具有的特性。
A.必须使用新鲜的肝脏研磨液。
新鲜:若肝脏不新鲜,肝细胞内的过氧化氢酶等有机物就会在腐生细菌的作用下分解,使组织中酶分子数量减少且活性降低。
研磨液:可加大肝细注意事项胞内过氧化氢酶与试管中过氧化氢的接触面积,加速过氧化氢的分解过程。
B.滴加氯化铁溶液和肝脏研磨液不能合用同一支试管。
因为酶具有高效性,少量的酶带入氯化铁溶液中也会影响实验结果的准确性。
C.过氧化氢有一定的腐蚀性,使用时不要让其接触皮肤。
实验反思(1)如何判断过氧化氢被分解的快慢?(2)与1号试管相比,2号试管产生的气泡多,这一现象说明了什么?(3)3、4号试管未经加热,也有大量气泡产生,这说明了什么?(4)3号试管Fe3+数比4号试管H2O2酶高25万倍,但4号试管反应速率更快,这说明什么?(5)2号、3号、4号试管相比,哪支试管最终产生的氧气最多,为什么?实验二:探究淀粉酶对淀实验目的探究淀粉酶是否只能催化的化学反应。
实验原理①淀粉和蔗糖都是。
它们在酶的催化作用下都能水解成。
②在淀粉溶液和蔗糖溶液中分别加入淀粉酶,再用鉴定溶液中有无还原糖。
实验材料质量分数为2%的新配制的溶液。
质量分数为3%的溶液,质量分数为3%的溶液,斐林试剂,热水。
催化剂能改变化学反应速率

Fe(铁触媒)
氯酸钾分解制氧气: MnO2
催化剂: 过渡金属元素及其化合物
3.为什么使用催化剂一般可以加快化学反应速率?
分子或离子间的碰撞是发生化学反应的先决条件,但不是每次碰撞都会引发反应。 能够引起反应的分子 ( 或离子 )间的相互碰撞叫做有效碰撞 _________,能够发生有效碰撞 的分子叫做 _________。活化分子具有较高的能量,因此活化分子所占分数的大 活化分子 小决定了反应速率的快慢。活化分子的平均能量与所有分子的平均能量的差称为 活化能 ________。
思考1.如何判断H2O2分解速率的大小? 可以通过观察比较H2O2溶液中放出气泡的快慢程度, 或测定单位时间内H2O2分解放出的O2的体积或 测定收集等量的气体所需的时间。 思考2.你认为保存H2O2时要注意些什么? 双氧水稳定性较差、易分解,所以双氧水中不能 混入金属氧化物、各种脏东西。 应保存在棕色的试剂瓶或聚乙烯塑料瓶中,且放置 在阴凉处。另外,因工业品中含较多的金属离子杂质,应
实验一 以0.1g不同状态MnO2作催化剂进行对比实验:
催化剂(MnO20.1g) 前15s产生氧气的量(ml) 前30s产生氧气的量(ml) 前45s产生氧气的量(ml) 前60s产生氧气的量(ml) 第1组 7 9 12 15 第2组 11 21 35 49 第3组 8 11 18 26
课题2.
催化剂对过氧化氢分解反 应速率的影响
课题学习目标
1. 通过比较不同的催化剂对过氧化氢分解 速率的影响的差异,从中认识到催化剂的 种类、用量等的选择对实验效果的影响。 2. 认识实验方法的选择及反应条件的控制 在实验研究中的重要作用,加深对化学反 应条件控制的重要性的认识。 3.尝试用比较法来寻找实验的最佳方案, 通过实验提高处理实验数据和分析实验结 果的能力。
探究不同催化剂对过氧化氢分解反应速率的影响

课题:探究不同催化剂对过氧化氢分解反应速率的影响【学习目标】(一)知识与能力:1.探究不同催化剂对同一反应的催化效果,用比较法通过定性和定量实验,来寻找实验的最佳方案。
认识催化剂、有效碰撞、活化能等理论。
2.提高学生处理实验数据和分析实验结果的能力。
3. 常识性介绍不同催化剂对反应速率影响。
(二)过程与方法:1.先定量实验,后让学生更深的认识催化剂概念。
2. 要让学生在化学实验的探究中,体会“定量记时比较法”的实际应用3. 要培养学生把化学知识与日常化工生产中遇到的实际问题联系起来考虑,并由此提出问题,提高学生的抽象概括能力、形成规律性认识的能力。
【学习重点】建立催化剂的概念,通过定性观察实验现象和定量记时比较分析,认识不同催化剂对过氧化氢分解反应速率的影响【学习难点】正确理解催化剂对化学反应速率的影响,定量记时比较法在化学实验中的应用【学习过程】知识准备1、实验目的比较不同的催化剂对过氧化氢分解速率的影响的差异,从中认识到催化剂的种类、用量及其形状的选择对实验效果的影响。
2、实验原理(1)反应原理:2H2O2 == 2H2O + O2↑(2)实验方法:比较法(3)考虑实验设计依据:a、确定判断依据----相同时间内产生氧气的体积b、设计反应实验装置----测定相同时间产生氧气的体积c、排除干扰因素----控制好与实验相关的各项反应条件3、实验仪器及药品实验仪器:托盘天平、钥匙、具支试管、导管、橡胶管、水槽、10ml量筒、50ml量筒、计时器、试管实验试剂:6%H2O2溶液、MnO2、Fe2O3、CuCl2、蒸馏水【课堂探究】过氧化氢在一定条件下的分解的化学方程式是:思考:1、影响H2O2分解速率大小的因素有哪些?2、常用于H2O2分解的催化剂有哪些?3、猜测:影响催化剂催化效果的因素可能有哪些呢?活动探究:探究同质量不同种类催化剂对H2O2分解速率大小的影响。
小组讨论:如何设计实验方案呢?另外,这是一个多变量条件下的实验,在实验设计时应注意什么?思考:1、可以借助一些什么现象观察到一个反应发生的快慢?2、怎样去定量比较反应进行的快慢?有下列制氧气的装置,你选择哪一个呢?为什么?(讨论设计定量测量气体的装置)【实验探究一】现提供如下试剂:6%H2O2溶液、MnO2、Fe2O3、CuCl2请同学们动手实验:探究不同催化剂对H2O2分解速率的影响。
催化剂对过氧化氢分解反应速率的影响

2、酶是蛋白质,具有蛋白质的特性,酶能催
化很多化学反应,图中表示酶参加的反应 中,温度与反应速率的关系,解释曲线变化
原因
.
作业: 1、查阅资料,了解H2O2分解反应速率的因素。 2、作业本,P43
根据上述实验目的设计相关实验方案
实验 1:比较Leabharlann 2O2在不同催化剂作用下的分解情况:
H2O2 A B C
H2O2 D
向A试管中滴加2~3滴的FeCl3溶液,向B试管中 加少量MnO2粉末,向试管C中加入自选催化剂,D留 作对比用,观察四支试管中发生的实验现象.
你的结论?
ABC三支试管中均有气泡冒出,B试 管内的反应相对剧烈.
100多年前,有个化学魔术师“神杯”的故事:有一 天,瑞典化学家柏齐利阿斯在化学实验室忙碌地进行 着实验,傍晚,他的妻子玛利亚准备了酒菜宴请亲友, 祝贺他的生日。柏齐利阿斯沉浸在实验中,把这件事 全忘了。直到玛利亚把他从实验室拉出来,他才恍然 大悟,匆忙地赶回家。一进屋,客人们纷纷举杯向他 祝贺,他顾不上洗手就接过一杯蜜桃酒一饮而尽。当 他自己斟满第二杯酒干杯时,却皱起眉头喊着:“玛 课题 2 利亚,你怎么把醋拿给我喝!?”玛利亚和客人们都 催化剂对过氧化氢分解反应速率的影响 楞住了,仔细瞧着那瓶子,还倒出一杯来大家品尝, 一点儿没有错,确实是又甜又香的蜜桃酒呀!柏齐利 阿斯随手把自己倒的那杯酒递过去,玛利亚喝了一口, 酸得吐了出来,也说:“甜酒怎么一下子变成酸醋 海宁一中 了?”客人们纷纷凑近过来,观察着、猜测着这“神 周斌强 杯”发生的怪事。
实验步骤 向盛有5ml 15%的H2O2溶液 的试管中加入少量的 ________(某酸),然后把 带火星的木条伸入试管中。 向盛有5ml 15%的H2O2溶液 的试管中加入少量的 , 然后把带火星的木条伸入试 管中。 实验现象 实验结论
高中化学 课题2 探究不同催化剂对过氧化氢分解反应速率的影响教案高二化学教案

课题:探究不同催化剂对过氧化氢分解反应速率的影响【学习目标】(一)知识与能力:1.探究不同催化剂对同一反应的催化效果,用比较法通过定性和定量实验,来寻找实验的最佳方案。
认识催化剂、有效碰撞、活化能等理论。
2.提高学生处理实验数据和分析实验结果的能力。
3. 常识性介绍不同催化剂对反应速率影响。
(二)过程与方法:1.先定量实验,后让学生更深的认识催化剂概念。
2. 要让学生在化学实验的探究中,体会“定量记时比较法”的实际应用3. 要培养学生把化学知识与日常化工生产中遇到的实际问题联系起来考虑,并由此提出问题,提高学生的抽象概括能力、形成规律性认识的能力。
【学习重点】建立催化剂的概念,通过定性观察实验现象和定量记时比较分析,认识不同催化剂对过氧化氢分解反应速率的影响【学习难点】正确理解催化剂对化学反应速率的影响,定量记时比较法在化学实验中的应用【学习过程】知识准备1、实验目的比较不同的催化剂对过氧化氢分解速率的影响的差异,从中认识到催化剂的种类、用量及其形状的选择对实验效果的影响。
2、实验原理(1)反应原理:2H2O2 == 2H2O + O2↑(2)实验方法:比较法(3)考虑实验设计依据:a、确定判断依据----相同时间内产生氧气的体积b、设计反应实验装置----测定相同时间产生氧气的体积c、排除干扰因素----控制好与实验相关的各项反应条件3、实验仪器及药品实验仪器:托盘天平、钥匙、具支试管、导管、橡胶管、水槽、10ml量筒、50ml量筒、计时器、试管实验试剂:6%H2O2溶液、MnO2、Fe2O3、CuCl2、蒸馏水【课堂探究】过氧化氢在一定条件下的分解的化学方程式是:思考:1、影响H2O2分解速率大小的因素有哪些?2、常用于H2O2分解的催化剂有哪些?3、猜测:影响催化剂催化效果的因素可能有哪些呢?活动探究:探究同质量不同种类催化剂对H2O2分解速率大小的影响。
小组讨论:如何设计实验方案呢?另外,这是一个多变量条件下的实验,在实验设计时应注意什么?思考:1、可以借助一些什么现象观察到一个反应发生的快慢?2、怎样去定量比较反应进行的快慢?有下列制氧气的装置,你选择哪一个呢?为什么?(讨论设计定量测量气体的装置)【实验探究一】现提供如下试剂: 6%H2O2溶液、MnO2、Fe2O3、CuCl2请同学们动手实验:探究不同催化剂对H2O2分解速率的影响。
催化剂对过氧化氢分解反应速率的影响

量气管
精选课件
5
(2) 催化剂对过氧化氢分解的影响研究
1. 不同用量的同种催化剂对双氧水分解反应速率的影响
【实验操作】在250 mL锥形瓶中加入0.1g(0.2g) MnO2 ,用滴定管 加入5 mL10%的双氧水溶液,计时,反应进行中保持量气管两端液 面相平,记录不同时刻气体的体积,并填入相应的表格中。
催化剂(MnO2)
0.1g
前15s产生的O2的量(m)
6.1
前30s产生的O2的量(mL)
6.6
前45s产生的O2的量(mL)
7.0
前60s产生的O2的量(mL)
7.3
前75s产生的O2的量(mL)
7.6
前90s产生的O2的量(mL)
7.9
0.2g
结论
7.5
8.4
9.2
增大催化剂的 用量,反应速
10
一、根据上述实验目的设计相关实验方案
1. 首先从反应原理分析: 2H2O2 = 2H2O + O2↑ 2. 考虑实验设计依据: (1) 确定判断依据----单位时间内氧气产生的体积 (2) 设计反应实验装置----测定单位时间氧气产生的体积 (3) 排除干扰因素----比较法的前提条件
精选课件
4
3. 设计实验方案: (1) 装置设计:
催化剂:大多数是过渡金属元素及其化合物
(2) 有关催化剂的注意事项:
① 催化剂有正、副催化剂之分,没有说明一般都指正催化剂。
② 催化剂参与反应,但反应前后质量不变。
③ 催化剂能使反应的活化能降低,有利于增大反应速率。
④ 对于可逆反应,催化剂能同等程度的增大正、逆反应的速率,不 能改变平衡的移动。
⑤ 催化剂不能使不可能发生的反应发生。
过氧化氢催化分解实验报告

过氧化氢催化分解实验报告过氧化氢催化分解实验报告一、引言过氧化氢(H2O2)是一种常见的化学物质,具有氧化性和还原性。
在过氧化氢分解反应中,常使用催化剂来加速反应速率。
本实验旨在研究不同催化剂对过氧化氢分解反应的影响,探究催化剂对反应速率的促进作用。
二、实验方法1. 实验材料和仪器本实验所需材料包括过氧化氢溶液、催化剂、试管、滴管、计时器等。
2. 实验步骤(1)取一定量的过氧化氢溶液倒入试管中。
(2)加入不同的催化剂,如锰(IV)氧化物、二氧化锰等。
(3)观察反应过程中的气体释放情况,并记录下反应时间。
(4)重复以上步骤,使用不同催化剂进行实验。
三、实验结果通过实验观察和数据记录,我们得到了以下实验结果:1. 使用锰(IV)氧化物作为催化剂时,反应开始后迅速释放气体,反应时间较短。
2. 使用二氧化锰作为催化剂时,反应开始较缓慢,但随着反应的进行,气体释放速率逐渐增加,反应时间较长。
四、实验分析1. 催化剂的作用催化剂可以通过降低反应活化能,提高反应速率。
在过氧化氢分解反应中,锰(IV)氧化物和二氧化锰均起到了催化剂的作用。
锰(IV)氧化物能够提供活性位点,促进过氧化氢的分解反应。
而二氧化锰则能够吸附过氧化氢分子,使其分解为水和氧气。
因此,使用锰(IV)氧化物作为催化剂时,反应速率较快,而使用二氧化锰作为催化剂时,反应速率较慢。
2. 反应机理过氧化氢分解反应的机理较为复杂,其中涉及了氧气的释放、氢氧离子的生成等过程。
锰(IV)氧化物和二氧化锰作为催化剂,可能通过不同的机理促进了反应的进行。
锰(IV)氧化物可能通过提供活性位点,使过氧化氢分子发生氧化反应,生成氧气。
而二氧化锰则可能通过吸附过氧化氢分子,使其发生分解反应。
具体的反应机理还需要进一步研究。
五、实验总结通过本实验,我们研究了不同催化剂对过氧化氢分解反应的影响。
实验结果表明,锰(IV)氧化物和二氧化锰均能够促进过氧化氢的分解反应,但其反应速率和反应时间存在差异。
过氧化氢实验报告数据

过氧化氢实验报告数据过氧化氢实验报告数据引言:过氧化氢(H2O2)是一种常见的化学物质,具有强氧化性和漂白性。
在实验室中,我们进行了一系列关于过氧化氢的实验,以了解其性质和反应。
本文将介绍我们实验的数据结果,并探讨其中的一些有趣现象。
实验一:过氧化氢的分解速率与浓度的关系我们首先研究了过氧化氢的分解速率与其浓度之间的关系。
我们准备了不同浓度的过氧化氢溶液,并在相同的条件下进行实验。
我们记录了每个浓度下过氧化氢溶液的分解时间,并绘制了以下数据表格和图表:表1:不同浓度下过氧化氢的分解时间浓度(%)分解时间(秒)1 1202 903 754 605 50图1:过氧化氢浓度与分解时间的关系曲线从表1和图1中可以看出,过氧化氢的分解速率与其浓度呈负相关关系。
随着浓度的增加,分解时间逐渐减少,即分解速率增加。
这是因为过氧化氢分子之间的相互作用增强,导致分解反应加速。
实验二:过氧化氢的催化分解在实验二中,我们研究了过氧化氢在不同催化剂存在下的分解速率。
我们选择了几种常见的催化剂,包括铁离子、铜离子和酶催化剂。
我们记录了每种催化剂下过氧化氢溶液的分解时间,并绘制了以下数据表格和图表:表2:不同催化剂下过氧化氢的分解时间催化剂分解时间(秒)无催化剂 120铁离子 60铜离子 45酶催化剂 30图2:不同催化剂下过氧化氢的分解时间从表2和图2中可以看出,不同催化剂对过氧化氢的分解速率有显著影响。
在无催化剂的情况下,过氧化氢的分解时间最长。
而在铁离子、铜离子和酶催化剂存在下,过氧化氢的分解时间分别缩短了一半、三分之二和三分之一。
这是因为催化剂能够提供反应所需的活化能,加速反应速率。
实验三:过氧化氢的漂白性质在实验三中,我们研究了过氧化氢的漂白性质。
我们将过氧化氢溶液与含有色素的溶液混合,并观察颜色的变化。
我们记录了每个实验条件下的混合时间,并绘制了以下数据表格和图表:表3:不同实验条件下的混合时间实验条件混合时间(秒)过氧化氢+蓝色溶液 15过氧化氢+红色溶液 20过氧化氢+绿色溶液 10图3:不同实验条件下的混合时间从表3和图3中可以看出,过氧化氢对不同颜色的溶液具有不同的漂白效果。
催化剂对过氧化氢分解反应速率的影响

实验一 以0.1g不同状态MnO2作催化剂进行对比实验:
催化剂(MnO20.1g) 前15s产生氧气的量(ml) 前30s产生氧气的量(ml) 前45s产生氧气的量(ml) 前60s产生氧气的量(ml) 第1组 7 9 12 15 第2组 11 21 35 49 第3组 8 11 18 26
一.催化剂 1.定义: 在化学反应中能 改变 化学反应速率,本身化学性质 和质量保持不变的物质。 注意: (1). 催化剂的物理性质可能改变,催化剂可能参与中间反 应. 写出:乙醇在铜催化条件下催化氧化的反应过程是: 2Cu+O2==(加热)2CuO CH3CH2OH+CuO=
由此可见,某些催化剂参与化学反应的特点是“先消后生”。 但仅仅是改变始态到终态的途径,不改变反应的结果。
Fe(铁触媒)
氯酸钾分解制氧气: MnO2
催化剂: 过渡金属元素及其化合物
3.为什么使用催化剂一般可以加快化学反应速率?
分子或离子间的碰撞是发生化学反应的先决条件,但不是每次碰撞都 会引发反应。能够引起反应的分子(或离子)间的相互碰撞叫做 _________,能够发生有效碰撞的分子叫做 _________。活化分子具有 较高的能量,因此活化分子所占分数的大小决定了反应速率的快慢。 活化分子的平均能量与所有分子的平均能量的差称为________。
该反应是 放 热反应,有催化剂的曲线中出现 两个峰的意义是 催化剂参与反应,可能是两步完成的反应 .
列举为了减缓化学反应速率而使用的催化剂? 橡胶制品中的防老化剂,食品中的防腐剂。
4.过氧化氢分解的影响因素 过氧化氢(H2O2), 俗称双氧水 _______, 不稳定, 易分解。 溶液的酸碱性对 H2O2 的稳定性有较大的影响,如 在碱性溶液中, H2O2 分解较快。 另外,H2O2 见光、 金属氧化物 分解也会加速。在 遇热、遇到大多数 ____________ 催化剂存在下,H2O2 迅速分解,反应方程式为: 催化剂 2H2O2=====2H2O+O2↑ 。 _______________________ 除 MnO2 外,还可用 CuO、 Fe2O3 等作 H2O2 分解 的催化剂。
催化剂对过氧化氢溶液分解的影响分析

促进H2O2 分解的各类催化剂的实验探究江苏省江都中学田薇一、实验目的我们知道,往过氧化氢中加入二氧化锰,其分解速率会大大提高,这主要是催化剂(二氧化锰)的功劳。
那么,除了二氧化锰外,还有什么物质也能起到催化作用呢,不同催化剂的催化原理是否相同呢,其催化作用对实验环境有何要求呢?为此,我们利用手持技术设计了相关实验,从定量的角度探讨了不同类型和浓度的催化剂对过氧化氢反应速率快慢的影响,以揭示促进过氧化氢分解的催化剂的神秘面纱。
二、实验原理H2O2分解的表观反应为:2H2O2→2H2O + O2↑,温度、溶液浓度、催化剂等对这一分解过程均有不同程度的影响,本实验中着重分析催化剂这一因素的影响。
H2O2分解的催化剂有两类,一类是我们所熟悉无机催化剂(如二氧化锰),另一类就是生物酶(过氧化氢酶)。
H2O2同时具有氧化性和还原性的特点,因此在有可变价态金属(如二氧化锰、氧化铜、Fe3+、Fe2+)存在的情况下,过氧化氢可交替与金属发生氧化反应和还原反应,最终结果为过氧化氢被催化生成H2O和O2,而金属离子不发生变化。
例如:MnO2催化过氧化氢:MnO2被H2O2还原成Mn2+,同时H2O2被氧化产生O2,但Mn2+又可被氧化为MnO2,同时H2O2被还原成H2O,因而在反应前后似乎没有什么变化,如此往复循环,使反应得以继续进行。
另一方面,生物体中也存在催化过氧化氢分解的催化剂:过氧化氢酶。
过氧化氢酶是分子量约25万的血红素铁蛋白,分子结构中包含四个Fe(Ⅲ)原卟啉基团。
血红素中心的3价铁与卟啉的4个吡咯环上的N原子形成4个配位键,与血红素平面的近侧(朝向四聚体核心的一侧)Tyr的酚羟基形成第5个配位键。
过氧化氢酶广泛存在于生物组织中,具有催化分解H2O2为H2O和O2的功能。
许多植物如蓖麻子,番茄,菠菜,玉米,棉花等中存在着不同数目的CAT同工酶,少的有2种,多的达数10种。
酶催化反应的机理为:反应中酶的血红素卟啉环(Por)和铁先被H2O2氧化,生成Por·+ - Fe Ⅳ= O(大亚基酶) 或Por - FeⅣ-OH(小亚基酶),称为化合物Ⅰ(Cpd Ⅰ)。
催化剂对过氧化氢分解反应速率的影响

整理课件
6
总结
催化剂的种类、质量、与反应物间的接 触面积都会影响过氧化氢溶液的分解
除了催化剂能影响过氧化氢溶液的分解 之外,还有哪些因素会影响它的分解呢?
整理课件
7
催化剂对过氧化氢溶 液分解速率的影响
整理课件
1
回忆旧知 提出问题
我们已经学过二氧化锰可 以加快过氧化氢溶液的分 解,是该反应的催化剂, 那么作为二氧化锰本身, 又有哪些因素会影响过氧 化氢溶液的分解速率呢?
整理课件
2
结论
在其他条件相同的情况下,二氧化锰的用 量越多,过氧化氢溶液的分解速率越快; 二氧化锰与过氧化氢溶液的接触面积越大, 了二氧化锰可以作为该 反应的催化剂,还有哪些 物质也可以作为催化剂加 快过氧化氢溶液的分解呢?
整理课件
4
结论
许多物质都可以作为过氧化氢溶液的催化 剂,不同的催化剂催化效果不同。
整理课件
5
知识链接
过氧化氢的催化主要有以下几种: (1)重金属氧化物,会使过氧化氢立刻分解放出氧气。 (2)过氧化氢在碱性条件下容易分解为氧气和水,但 由于可溶性碱普遍有较强腐蚀性,难溶性碱不稳定且 成本较高,故一般不采用此做法。 (3) 过氧化氢酶的催化:用土豆丝来催化分解过氧化 氢溶液,说明生物体内不断产生的过氧化氢酶,可促 使过氧化氢迅速分解,这种酶广泛存在于动植物组织 中。 (4)金属盐溶液:硫酸铜溶液无明显催化现象,氯化 铁溶液现象明显,速率类似于氧化铁的催化。
题型03实验探究题(学生版) 备战2024-2025学年九年级化学上学期期中真题分类汇编(安徽专用)
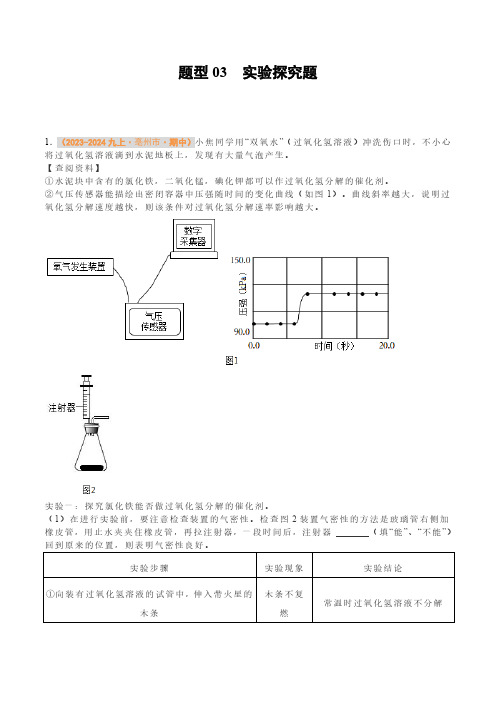
题型03 实验探究题1.(2023-2024九上·亳州市·期中)小焦同学用“双氧水”(过氧化氢溶液)冲洗伤口时,不小心将过氧化氢溶液滴到水泥地板上,发现有大量气泡产生。
【查阅资料】①水泥块中含有的氯化铁,二氧化锰,碘化钾都可以作过氧化氢分解的催化剂。
②气压传感器能描绘出密闭容器中压强随时间的变化曲线(如图1)。
曲线斜率越大,说明过氧化氢分解速度越快,则该条件对过氧化氢分解速率影响越大。
2.(2023-2024九上·安庆市·期中)为了探究影响化学反应速率(即反应快慢)的因素,化学学习小组以过氧化氢分解为研究对象进行实验。
三个小组均采用如图装置进行实验,记录收集20mL氧气所需的时间。
实验室可供选择的试剂有:2.5%、5%、10%三种浓度的过氧化氢溶液、二氧化锰、氧化铜和红砖粉末。
(1)A组:探究催化剂种类对化学反应速率的影响各取10mL10%过氧化氢溶液于注射器(此时注射器中无气体),在三支试管中分别加入二氧化锰、红砖粉末、氧化铜各0.5g,分别注入过氧化氢溶液进行如图所示的实验,记录数据如下:试剂二氧化锰红砖粉末氧化铜时间/s106020由此得出结论:二氧化锰、氧化铜对过氧化氢分解有催化作用,红砖粉末无催化作用。
某同学对该结论提出质疑,认为需要再补充一个对比实验,才能证明红砖粉末有没有催化作用,其操作为___________。
(2)B组:探究过氧化氢溶液的浓度对化学反应速率的影响甲同学:取10mL5%过氧化氢溶液,加入0.5g二氧化锰为催化剂,进行实验,记录时间t1。
乙同学:取10mL25%过氧化氢溶液,加入0.5g氧化铜为催化剂,进行实验,记录时间t2。
①实验结果t1___________t2(填“>”、“=”或“<”)。
乙反应的文字表达式为___________,基本反应类型为___________。
结论:过氧化氢溶液浓度越大,反应速率越快。
过氧化氢催化分解实验报告

过氧化氢催化分解实验报告一、实验目的本次实验旨在探究过氧化氢在不同催化剂作用下的分解速率,加深对化学反应速率和催化剂作用的理解。
二、实验原理过氧化氢(H₂O₂)在常温下分解缓慢,产生氧气(O₂)和水(H₂O),反应方程式为:2H₂O₂= 2H₂O + O₂↑。
加入合适的催化剂可以显著加快反应速率。
常见的催化剂有二氧化锰(MnO₂)、氧化铜(CuO)等。
通过测量在一定时间内产生氧气的体积,可以比较不同催化剂的催化效果。
三、实验仪器与药品1、仪器锥形瓶、分液漏斗、双孔橡皮塞、导气管、水槽、集气瓶、量筒、秒表。
电子天平。
2、药品质量分数为 5%的过氧化氢溶液。
二氧化锰粉末。
氧化铜粉末。
四、实验步骤1、检查装置气密性连接好实验装置,关闭分液漏斗的活塞,将导气管一端插入水中,用手捂住锥形瓶,若水中的导气管口有气泡冒出,松开手后导气管内形成一段水柱,则装置气密性良好。
2、称取催化剂分别用电子天平称取 02g 二氧化锰粉末和 02g 氧化铜粉末。
3、组装实验装置在锥形瓶中加入 50mL 5%的过氧化氢溶液,将称好的催化剂分别放入两个锥形瓶中,迅速塞上带有分液漏斗和导气管的双孔橡皮塞。
4、收集氧气将导气管插入装满水的集气瓶中,打开分液漏斗的活塞,让过氧化氢溶液滴入锥形瓶中,开始反应并收集氧气。
同时,使用秒表记录反应时间。
5、测量氧气体积当集气瓶中的水被排尽后,在水面下用玻璃片盖住集气瓶口,将集气瓶取出正放,用量筒测量收集到的氧气的体积。
6、重复实验为了减小实验误差,每种催化剂的实验重复三次,取平均值。
五、实验数据记录与处理1、二氧化锰催化分解过氧化氢实验数据|实验次数|反应时间(s)|收集氧气体积(mL)||||||1|_____|_____||2|_____|_____||3|_____|_____|平均反应时间:_____ s平均收集氧气体积:_____ mL2、氧化铜催化分解过氧化氢实验数据|实验次数|反应时间(s)|收集氧气体积(mL)||||||1|_____|_____||2|_____|_____||3|_____|_____|平均反应时间:_____ s平均收集氧气体积:_____ mL六、实验结果与分析1、通过比较二氧化锰和氧化铜催化过氧化氢分解的平均反应时间和收集到的氧气平均体积,可以得出哪种催化剂的催化效果更好。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
考号姓名成绩
四川省二〇一五年普通高中学业水平考试
生物学科实验操作考查试题(三)
比较不同催化剂对过氧化氢分解的影响
(考查时间:20分钟)
一、实验目的:
通过比较过氧化氢在不同催化剂作用下分解的快慢,了解过氧化氢酶的特性。
二、实验器材:
试管,试管架,试管夹,量筒,滴管,卫生香,火柴,新配制的体积分数为3%的H2O2溶液,新鲜的质量分数为20%的肝脏(如猪肝、鸡肝)研磨液,质量分数为3.5%的FeCl3溶液。
三、实验过程:
考号姓名成绩
四川省二〇一五年普通高中学业水平考试
生物学科实验操作考查试题(三)《比较不同催化剂对过氧化氢分解的影响》评分表
监考教师:。
