醇一分类和命名
醇的分类和命名

CH3 CH3 C CH2OH + HBr
CH3
+ H+
CH3
CH3
CH3 C CH2Br + CH2 C CH2CH3
CH3
Br
重排产物(主要产物)
CH3
CH3 C CH2OH2
Br-
CH3
+
+ Br -
CH3 CH3 C CH2
CH3
重排
CH3 CH2 C CH2CH3
2.与卤化磷或亚硫酰氯反应
CH3 CH3CHCHCH2CHCHCH3
C2H5 Cl OH
6-甲基-5-乙基-3-氯-2-庚醇
(2)不饱和醇的命名
选择含羟基及不饱和键的最长碳链作为主链,从离羟 基最近的一端开始编号。根据主链上碳原子的数目称为 “某烯醇”或“某炔醇”
12
4
CH3-CH-CH2-CH=CH2
OH
31 H3CH2CH2C CHCH2CH2OH
主链 碳数
CH2OH CH3CH2-C-CH2-OH
CH2OH
2,3-二甲基-1,2,3-丁三醇
羟基 数目
主链 羟基数
主链 碳数
醇的制法
Synthesis of Alcohols (一)由烯烃制备
1.烯烃水合 (1)直接水合 (2)间接水合
2.硼氢化-氧化反应
RCH
CH2 1) B2H6 2) H2O2 / OH-
乙二醇(bp=197℃)>丙三醇(bp=290℃)
3.在相同碳原子数的一元饱和醇中:
沸点:伯醇>仲醇>叔醇
(三)溶解度
低级醇可与水形成氢键
低级醇 与水互溶
C4以上烃基 醇的溶解度
醇的命名规则及举例

醇的命名规则及举例醇是一类含有羟基(-OH)的有机化合物,它们的命名规则是根据它们所含有的碳数、羟基数以及它们所属的官能团来进行命名的。
下面是关于醇的命名规则及举例的详细介绍。
一、根据碳数命名1. 甲醇(Methanol):由一个碳原子和一个羟基组成,化学式为CH3OH。
2. 乙醇(Ethanol):由两个碳原子和一个羟基组成,化学式为C2H5OH。
3. 丙醇(Propanol):由三个碳原子和一个羟基组成,化学式为C3H7OH。
4. 丁醇(Butanol):由四个碳原子和一个羟基组成,化学式为C4H9OH。
5. 戊醇(Pentanol):由五个碳原子和一个羟基组成,化学式为C5H11OH。
二、根据羟基数命名1. 一元醇(Monohydric alcohol):只含有一个羟基的醇,如甲醇、乙醇等。
2. 二元醇(Dihydric alcohol):含有两个羟基的醇,如乙二醇(Ethylene glycol)。
3. 三元醇(Trihydric alcohol):含有三个羟基的醇,如甘油(Glycerol)。
三、根据官能团命名1. 脂肪醇(Aliphatic alcohol):由直链或支链烷基和羟基组成的醇,如乙醇、丙醇等。
2. 芳香醇(Aromatic alcohol):由苯环和羟基组成的醇,如苯甲醇(Benzyl alcohol)。
3. 脂环醇(Heterocyclic alcohol):由含氧、氮、硫等杂原子的环和羟基组成的醇,如噻吩醇(Thiophenol)。
四、其他命名规则1. 根据主链命名:以含有羟基的碳链为主链,羟基作为官能团,如2-丙醇(2-Propanol)。
2. 根据位置命名:羟基的位置用数字表示,从主链的一端开始编号,如2-戊醇(2-Pentanol)。
3. 根据立体构型命名:如果醇分子中存在手性中心,需要用R/S命名法表示其立体构型,如(R)-2-丙醇。
以上是关于醇的命名规则及举例的详细介绍,希望能够对大家有所帮助。
醇的性质及分类

CH2 CHCH2 OH
(allyl alcohol) (methyl alcohol)
CH2OH
甲醇 木精
烯丙醇
异丁醇
(isopropyl alcohol)
OH
苯甲醇 苄醇 (menzyl alcohol)
环己醇
⑵ 系统命名法
a、选含羟基的最长碳链做主链; b、从最靠近羟基一端编号。
HX: HI > HBr > HCl R OH:
RCH CHCH2 , CH2
室温
> 3°> 2°> 1°> CH3
(CH3)3COH + HCl
(CH3)3CCl + H2O
ZnCl
2 CH3(CH2)3CH2OH + HCl 回流4h
CH3(CH2)3CH2Cl + H2O
OH + HBr 回流6h 74%
δ
-
CH3
X
伯醇按SN2机理反应。
+ R
OH2
X
R
δ
+
OH2
X R + H 2O
反应特点: • 用于伯醇、仲醇 醇与PX3、PX5 反应生成 RX: • 无重排产物
Cl RCH2 O H P Cl
⑵ 与卤化磷的反应
Cl RCH2 OH ( 1 or 2 ) P Cl Cl
Cl
-
RCH2Cl
RCH2 OH + Br P Br Br
RCH CH2 + Hg + CH3CO
CH3(CH2)3CH
① Hg(OAc)2/H2O CH2 ② NaBH4
CH3(CH2)3CHCH3 OH
alcohol概要
室温 (CH3)3COH + HCl
(CH3)3CCl 77%-88%
CH3CH2CH2OH + HCl(浓) ZnCl2 CH3CH2CH2Cl
(3) 卢卡斯(Lucas)试剂鉴别伯、仲、叔醇:
Lucas 试剂:HCl(浓)+ ZnCl2
ROH HCl/ZnCl2
RCl + H2O 不溶于Lucas试剂而产生混浊
OH OH 顺-1,2-环戊二醇 cis-1,2-cyclopentanediol
CH2CH3
H
OH
C6H5 (S)-1-苯基-1-丙醇
(S)-1-phenyl-1-propanol
CH(CH3)2
OH (1R,2S)-2-异丙基环己醇 (1R,2S)-2-isopropylcyclohexanol
RCH2O H + Br PBr2 RCH2-O PBr2 H+ Br-
RCH2-O PBr2 RCH2Br + HOPBr2 SN2
3) 醇与亚硫酰氯( SOCl2)作用
O Cl S Cl 亚硫酰氯(氯化亚砜)
R OH + SOCl2 醚
R Cl + SO2 + HCl
制备氯代物的好方法
注意: 醇与SOCl2反应的立体化学特征
第九章 醇和酚(Alcohols and Phenol)
通式:
R OH
OH
官能团: OH
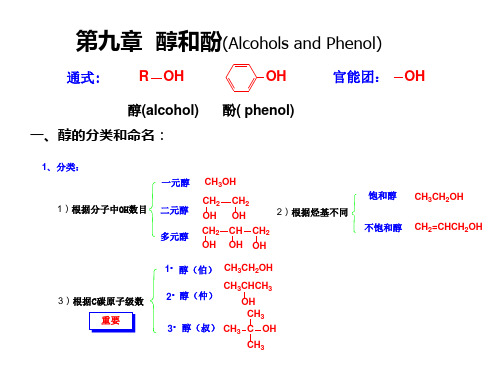
醇(alcohol) 一、醇的分类和命名:
酚( phenol)
1、分类:
一元醇 CH3OH
1)根据分子中OH数目
二元醇 多元醇
CH2 CH2 OH OH
2)根据烃基不同
CH2 CH CH2 OH OH OH
醇酚醚醇酚醚都是烃的含氧衍生物但他们是

四、醇的化学性质 亲核取代
H
C
O
H
作亲核试剂
酸性
1.与活泼金属作用 醇中羟基上的氢较活泼,能被金属所取代, 生成氢气和醇金属盐,醇能和Na,Mg,Al等反应。
ROH + Na
RONa + H2
反应速度: CH3OH>C2H5OH>CH3CH2CH2OH>(CH3)2CHOH>(CH3)3COH 由于醇的酸性比水弱,所以RO-的碱性比OHˉ强, 故醇化物遇水分解:
三、醇的光谱性质
IR:-OH 未缔合的在3640-3610cm- 1有尖峰;
缔合的在3600-3200cm- 1宽峰。以此可鉴定醇分子 中是否存在缔合。
C-O 吸收峰在1000-1200cm- 1(1060-1030cm-1 伯醇、1100cm- 1 仲醇、1140cm- 1 叔醇)。
NMR:-OHδH值0.5-4.5之间。-OH活泼氢的化学 位移与溶剂、溶液温度、浓度和形成氢键都有很大关 系。
1.状态:C1-C4是低级一元醇,是无色流动液 体,比水轻。C5-C11为油状液体,C12以上高级一 元醇是无色的蜡状固体。甲醇、乙醇、丙醇都带有 酒味,丁醇开始到十一醇有不愉快的气味,二元醇 和多元醇都具有甜味,故乙二醇有时称为甘醇 (Glycol)。 甲醇有毒,饮用10毫升就能使眼睛 失明,再多用就有使人死亡的危险。
(丙三醇)
2.醇的命名
1)普通命名法 将相应烷烃名称前的“烷”改为接受。
CH2 CHCH2OH 烯丙醇
CH2OH 苄醇
CH CH CH2 OH OH OH
甘油(丙三醇)
ClCH2CH2OH 氯乙醇
2)系统命名法 选取含羟基最长的碳链作主链,把支链看作取 代基,从离羟基最近的一端开始编号,按照主链所 含的碳原子数目称为"某醇",羟基在1位的醇,可 省去羟基的位次。
医用化学-第十一章-醇酚醚

3.俗名: 酒精、甘油
三.醇的物理性质
四.醇的化学性质
α-H
H
Rδ
+ C
δO
δH+
R'
㈠与活泼金属反应
H OH + Na
RO H + Na
NaOH + 1/2H2 剧烈反应,放热自燃
RONa + 1/2H2 反应缓和,放热不自燃
反应活性 : 伯醇>仲醇>叔醇 CH3OH > CH3CH2OH > (CH3)2CHOH &O>
O
(酚类化合物应避光保存)
对苯醌(黄色)
三、重要的酚
1.生育酚(维生素E)
2.抗氧化剂TBHQ(特丁基对苯二酚)
CH3 OH
C CH3 CH3
OH
第三节 醚
一.结构和命名:
(一)结构 两个烃基通过氧原子连接起来
ROR 单醚 ROR' 混醚 ROAr 芳香醚
(二)命名 1.单醚 在醚前面加上烃基名字即可
原因:
RO H 断键能力
RO-
稳定性
㈡醇的酯化反应
ROH + R'COOH H+ R'COOR + H2O
甘油+硝酸 醇+磷酸
硝酸甘油酯(缓解心绞痛的药) 磷酸酯(存在于生物分子中)
(三)与氢卤酸反应 R-OH + HX → R-X + H2O
反应活性顺序: HI >HBr>HCl 叔醇>仲醇>伯醇
第十一章 含氧有机化合物
第一节 醇
一、 醇的结构
HO H 水
RO H 醇
二、醇的分类和命名: (一)分类:
醇、酚、醚

170℃
OH
2
2
CH3
CH
2
H+
140℃
CH3
CH
2
O
CH
2
CH3
当酸过量,且反应温度升高时,有利于发生分子内脱水生 成烯烃,低温有利于分子间脱水生成醚。 若反应物含有二种类型的-H,当发生分子内脱水时服从查 依采夫规则。
H CH
2
OH CH
H CH
2
CH3
△
3HC
HC
HC
3HC
H+
4、氧化反应
H 3C O CH
2
CH3
H 2C
CH
O
CH
2
CH3
甲基乙基醚
O CH3
乙基乙烯基醚
CH3 H 3C O HC CH3
苯基甲基醚(苯甲醚)
甲基异丙基醚
结构复杂的混合醚,可将小的烃基与O原子在一起称
为”烷氧基“,以烃为母体。例:
C H 3 OCH H 3C CH CH
3
C H 3 OCH H 3C CH CH
OH C H 3 CH CH
2
CH C C
2
CH3
H
CH3
5-甲基-4-庚烯-2-醇
若烯烃有顺反异构,但没有写出其立体结构,则不必标 出其构型。例:
CH3 CH3 CH CH CH OH CH CH3 CH CH
2
CH3
3,7-二甲基-5-辛烯-4-醇
对于多元醇,编号时应使羟基的位次和较小,命名时,分别 标出羟基的位次。
H R C H H C H O H
从醇的结构可以看出:OH为极性键,因此H-O键可断裂
第10章_第一节 醇 (1)
O
CrO3 N 2 CH2Cl2
b. MnO2(选择性氧化烯丙位羟基, 对双键无影响。 )
HO CH2CH2CH
CHCH2OH
MnO2
HO CH2CH2CH
CHCHO
⑵脱氢剂
Cu C H OH 325℃ C O
+
H2
R CH2 OH
Cu,325oC
R CH
O 醛
1°醇
R R
2°醇 Cu,325oC CH OHຫໍສະໝຸດ H2C CH2 浓 H2SO4
β H OH
H2C CH2
① 反应历程:生成碳正离子的历程
(1) C C
H OH H +
慢 C C -H2O + H OH2
C
C C + H
(2)
C C C + 电子对转移 H
- H+
② 脱水反应活性: 叔醇 > 仲醇 > 伯醇 碳正离子稳定性: 3°C+> 2°C+ >1°C+
②
CH3
Cl
-
③
CH3CCH2CH3 +
三种重排可能
更稳定
+ CH3CHCHCH3 CH3
重排产物 相同
练习:335-25(2)
3. 制备卤代烃的反应
3 ROH + PX3
常用方法
3 RX + P(OH)3 X=Br, I
特点:不发生重排反应。
PBr3 R OH + PI3 or P, I2 R Br
OH
6. 氧化反应 具有α-H的醇,容易被氧化。 α
C OH [O] C O
或 脱氢
醇

问题:
CH3CH2CH2CH2OH 合成?
CH3CH2CH CH2 酸催化直接脱水易重排!
(2) 分子间脱水 —— 成醚
浓H2SO4 实验室制乙醚:C2H5-OH————> C2H5OC2H5 + H2O 140 ℃
反 应 机 理
A. N2 (伯醇与HX): 1)S
ROH + H+ 快 R H (质子化醇) δ− X R δ+ H O H O H
X- + R
O
H H
RX + H2O
B. SN1 (叔醇与HX)
R3COH + H+ R3C + X- 快 R3COH2 R3CX 慢 R3C + H2O
快
某些情况下,会发生碳正离子重排, 得到骨架改变的产物
活性:正丙醇> 异丙醇> 叔丁醇 碱性:叔丁醇钠> 异丙醇钠> 正丙醇钠
2. 羟基被卤原子取代
1)与氢卤酸反应
R OH + HX R X + H 2O
反应活性比较: 氢卤酸: 醇: HI>HBr>HCl>HF 烯丙式醇>叔醇>仲醇>伯醇>甲醇
常用无水氯化锌的浓盐酸溶液(Lucas 试剂)鉴别三类醇:
(三)醇的化学性质
醇的反应与结构关系一般描述如下:
亲核取代反应 ( 与HX、 PX3、 PX5、SOCl2反应) 作亲核试剂 (酯化反应)
H
H
••
R-C-C-O-H H β 消除(脱水) H
羟基断裂呈酸性 (与活泼金属反应)
脱氢、氧化
1. 与活泼金属反应——似水
醇与钠作用就 比较和缓,放出的 热不足以使生成的 氢气自燃。
醇类

在液相中,溶 剂化作用会对 醇的酸性强弱 产生影响。
H HC
R
O HH
O HO H
H
OH
溶剂化作用使 负电荷分散, 而使RO-稳定。
1oROH负离子 空间位阻小, 溶剂化作用大。
CH3
CH3
C
CH3
O
H OH
3oROH负离子 空间位阻大, 溶剂化作用小。
2、羟基被卤原子取代 (1)醇和氢卤酸的反应
3-羟甲基-1,7-庚二醇
同一个碳原子上连有两个羟基的结构是不能稳 定存在的
OH CH3CH
- H2O
OH
O CH3C
H
在多元醇中,只有当碳原子数多于羟基数目时, 才需标出羟基所在的位置。
CH3CH CH2 OH OH
1,2-丙二醇
三、结构和物理性质
::
H
C O
H
H sp3
H
H
CO
H H
1090 H
构型翻转
1oROH、2oROH 都能与 磺酰氯反应。
(3)醇与卤化磷的反应 常用的卤化试剂
PCl5 、PCl3 、 PBr3 、 P + I2
PI3
3ROH + PBr3 → 3RBr + H3PO4 5ROH + PX5 → RX + HX + POX3
适用范围
主要应用于1oROH, 2oROH 转化为卤代烷。3oROH很少使用。
CH3 +OH2
CH3
+
H2O CH3 C CH CH3
CH3
重排
CH3
CH3
CH3
= CH2 C CH CH3 +
醇的分类——精选推荐

CH3CH2CH(CH2)4CHO CH3
CH3
CH3
CH3 DCC, 吡 啶 , 三 氟 乙 酸
CHCH2CH(CH2)4OH 苯 ,二 甲 基 亚 砜 25℃ , 84%
CH3
CH3
H
CH3
CHCH2CH(CH2)4CHO
H
c. 醇的高温蒸气高温下通过活性铜催化剂(可逆反应)
CH3CH2OH
Cu 250~350℃
CH3CH2CH2CHCH3 OH
(3)硼氢化氧化反应
(BF3)2 THF CH3
CH3
H2O2 B OH-
3c
(4)直接水合法(工业制备低级醇)
CH3 OH
CH2
CH2 + H 2O
H3PO4 300℃ ,7~8MP
2.卤代烃水解
CH3CH2OH
CH2
CH CH2Cl
H2O NaOH
CH2 CH CH2OH
CH3 CH3 C CH
CH3
+ CH2
H2 O
5. 氧化与脱氢 醇分子中α氢较活泼,易被氧化或脱氢。
CH3CH2CH2CH2OH
K2Cr2O-7 稀H2SO4 △ 50%
CH3CH2CH2CHO
CH3CH(CH2)5CH3 OH
K2Cr2O7- 稀H2SO4 △ 96%
CH3C(CH2)5CH3 O
CH3 OH
CH3
CH3 C CH CH3 H3C + OH2
-H 2 O
CH3 + CH3 C CH
CH3
CH3
重排
CH3
-H+
CH3 C CH CH3 +
第十一章 醇、酚、醚

大量乙醇以饮料形式生产和 消费,血液中乙醇的正常含 量为0.001%,一般人当血液 中乙醇含量达到0.1%即处于 强烈兴奋状态,达到0.2%就 沉醉,超过0.3%就会引起酒 精中毒,昏迷甚至死亡。
乙醇是一种抗震性能好、无污染的理想燃料,用乙醇 代替汽油,有与汽油混用和单独使用两种方法,目前 应用较广的是与汽油混用法。一般在汽油中掺入10%-20%的酒精。这种混合燃料,由于酒精的抗震性能好, 不再加入四乙基铅,从而减少汽车尾气对环境的污染。
OH
OH
OH
CH3
NO2
苯酚
邻甲酚
邻硝基苯酚
化学工业出版社
化学工业出版社
命名二元酚时以“二酚”为母体,两个酚羟基间的相 对位置用阿拉伯数字或邻、间、对表示。命名多元酚时以 “三酚”为母体,酚羟基间的相对位置用阿拉伯数字或连、 均、偏表示。
OH
OH
OH
OH
OH 对苯二酚
OH
OH
OH
1,3,5 苯三酚 (均苯三酚)
从结构上看,芳香烃分子中苯环上的氢原 子被羟基取代后生成的化合物称为酚。结构 通式为Ar-OH。
OH
OH
OH
CH3
NO2
化学工业出版社
(二)酚的命名
命名:
以“酚”作为母体,芳环上其他原子、原子团或烃基 作为取代基,它们与酚羟基的相对位置可用阿拉伯数字 表示,编号从芳环上连有酚羟基的碳原子开始,也可用 邻、间、对表示取代基与酚羟基间的位置。
||
||
1400C
HH
HH
C2H5—O—C2H5 + H2O 乙醚
化学工业出版社
4.氧化反应
醇分子中与羟基相连的碳原子,称为α-碳原 子;α-碳原子上的氢,称为α-氢原子。α-氢原子由 于受官能团的影响而比较活泼。
醇的结构、分类、命名及物性(一)

醇的结构、分类、命名及物性(一)引言概述:醇是一类重要的有机化合物,广泛存在于自然界和人工合成中。
它们具有丰富的结构特点和多样的化学性质,对于化学工业和生物学领域有着重要的应用价值。
本文将从醇的结构、分类、命名和物性等方面进行探讨。
正文:一、醇的结构1. 醇的结构是由一个或多个羟基(-OH)与碳原子相连而形成的。
2. 羟基上的氢原子可以被其他官能团取代,形成不同的化学性质。
3. 醇分子中的碳原子可以形成链状、环状或支链结构。
二、醇的分类1. 醇可以根据碳原子数目来进行分类,包括甲醇、乙醇、丙醇等。
2. 醇也可以根据醇基的位置来进行分类,包括原位醇、次位醇、三位醇等。
3. 醇还可以按照官能团的类型进行分类,包括脂肪醇、环状醇、芳香醇等。
三、醇的命名1. 醇的命名主要依据碳原子数目和醇基的位置。
2. 对于醇的主链上存在其他官能团的情况,需要使用前缀来表示。
3. 在命名醇的时候,需要注意指定碳原子上的羟基位置。
四、醇的物性1. 醇的物理性质包括熔点、沸点、密度等。
一般来说,随着碳原子数目的增加,熔点和沸点也会增加。
2. 醇具有与水相溶的性质,但醇的溶解度随着碳链长度的增加而减小。
3. 由于醇分子中的羟基团可形成氢键,因此醇在分子间力中占据重要地位。
4. 醇的化学性质主要表现在它们与其他官能团之间的反应,包括酸碱中和反应、酯化反应等。
五、总结通过对醇的结构、分类、命名和物性的探讨,我们了解到醇是具有丰富多样性质和重要应用价值的有机化合物。
醇能够形成不同结构类型,并具有特定的化学性质。
正确的命名和了解醇的物性有助于我们更好地理解和应用这类化合物。
(正文内容可根据需要酌情增减和修改)。
8-1.醇和醚

2-甲基环戊醇
④ 芳香醇
CH2 CH CH3 OH 1-phenylpropan-2-ol
CH
CH CH2OH
3-phenylprop-2-en-1-ol
1-苯基-2-丙醇 ⑤ 多元醇
H3C CH CH2 OH HO propylene glycol
(1)常用催化剂:Pt、Pd、Ni
(2)分子中有碳碳重键同时被还原。
2、化学还原法 (1)LiAlH4
CH3 OH H3C C HC CH3 CH3 ( 1 )H
+
CH3 H3C C C H CH3 CH3
H3C C H3C C CH3 CH3
+
CH3 H3C C CH CH3 CH3
+
( 2 )--H2O
+
--H
但用Al2O3为催化剂时,醇在高温气相条件下脱水, 往往不发生重排。
H2SO4 CH3 CH2 CH2 CH2 OH Al 2O3 CH3 CH CH CH3 CH2
(1)O-H 键有极性,活性氢,有酸性。 (2)C-O 键有极性,-OH 被取代。 (3)α-H 有活性,发生氧化反应。 (4)β-H 有活性,消除反应。 .. .. (5)R-OH中氧的电子云密度高于H-OH ——作亲核试剂。
(一)酸性和与活泼金属的反应
与活泼金属(K、Na、Mg、Al)的反应
R OH
② 琼斯(Jones)试剂:三氧化铬溶于稀硫酸 (CrO3.H2SO4)
类似于沙瑞特试剂。 ③ 活性二氧化锰:新制备的二氧化锰 选择性地将烯丙位的醇氧化成相应的不饱和醛、酮。
H2C CH CH2OH 活性 MnO2 H2C CH CHO
醇的结构命名方式

醇的结构命名方式醇,是一种由碳、氢和氧元素组成的有机化合物。
它们的结构可以通过一系列命名规则进行描述。
本文将以醇的结构命名方式为题,为您介绍不同类型的醇及其命名规则。
一、一元醇一元醇是指只含有一个羟基(-OH)的醇。
根据碳原子数的不同,一元醇可以分为甲醇、乙醇、丙醇等。
甲醇的结构式为CH3OH,乙醇的结构式为CH3CH2OH,丙醇的结构式为CH3CH2CH2OH。
二、二元醇二元醇是指含有两个羟基(-OH)的醇。
根据羟基的位置不同,二元醇可以分为1,2-二醇和1,3-二醇。
1,2-二醇的结构式为HO-CH2-CH2-OH,1,3-二醇的结构式为HO-CH2-CH2-CH2-OH。
三、三元醇三元醇是指含有三个羟基(-OH)的醇。
根据羟基的位置不同,三元醇可以分为1,2,3-三醇和1,2,4-三醇。
1,2,3-三醇的结构式为HO-CH2-CH(OH)-CH2-OH,1,2,4-三醇的结构式为HO-CH2-CH(OH)-CH2-CH2-OH。
四、多元醇多元醇是指含有多个羟基(-OH)的醇。
根据羟基的位置和数量的不同,多元醇的结构可以多种多样。
例如,1,2,3,4-四醇的结构式为HO-CH2-CH(OH)-CH2-CH(OH)-CH2-OH。
在命名醇的时候,需要根据醇的碳原子数和羟基的位置进行命名。
醇的主链命名使用烷烃的命名法则,然后在烷烃名称前加上“醇”字。
如果有多个羟基,则在烷烃名称前用数字表示羟基的位置,并用逗号隔开。
例如,2-丙醇表示羟基位于丙烷分子的第二个碳上。
如果羟基位于主链的两端,则用“α”和“ω”表示。
例如,α,ω-己醇表示羟基位于己烷分子的两端。
通过以上的命名规则,我们可以准确描述不同类型醇的结构。
醇是一类重要的化合物,在化工、医药、食品等领域都有广泛应用。
了解醇的命名方式,有助于我们更好地理解和应用这些化合物。
希望本文对您有所帮助!。
醇的命名规则及分类

醇的命名规则及分类醇是有机化合物中常见的一类物质,广泛应用于医药、化妆品、染料、塑料和溶剂等领域。
醇的命名规则主要涉及化学结构和分子式,而分类则基于其分子结构和物理性质。
本文将详细介绍醇的命名规则和分类。
一、醇的命名规则醇的命名首先需要根据其分子结构确定主链,然后根据主链上的羟基数目进行编号,最后根据羟基位置和数目在主链名称前加上诸如“二”、“三”等的前缀。
具体的命名规则如下:1. 首先,确定醇的主链,主链包括最长的连续碳链,其中有羟基的碳原子被命名为醇的侧链。
2. 确定主链上的羟基数目,并给予适当编号,使羟基的编号尽可能小。
3. 根据羟基的编号,在主链的命名前加上诸如“二”、“三”等的前缀,表示羟基的位置和数目。
4. 记录完整的分子式。
举例来说,如果一个醇分子有两个羟基,命名规则如下:1,2-丙二醇其中,“1,2-”表示两个羟基在主链中的位置,而“二”表示这两个羟基的数目。
二、醇的分类醇根据其分子结构和物理性质可以分为以下几类:1. 一元醇:一元醇的分子结构中只含有一个羟基(-OH)。
常见的一元醇包括甲醇、乙醇和丙醇等。
2. 二元醇:二元醇是指分子中含有两个羟基的化合物。
例如,环己二醇是一种常见的二元醇。
3. 多元醇:多元醇是指分子中含有两个以上羟基的化合物。
多元醇的命名遵循相同的规则。
4. 脂肪醇:脂肪醇是指含有直链烷基基团的醇。
根据烷基基团的长度,可以进一步细分为甲基醇、乙基醇、丙基醇等。
5. 芳香醇:芳香醇是指含有芳香环结构的醇。
其中最常见的是苯甲醇和香豆醇等。
6. 醇醚:醇醚是指醇与醚基团(-O-)通过共价键结合形成的物质。
醇醚常作为有机溶剂使用。
三、醇的应用领域由于醇具有独特的化学性质和多样的物理性质,广泛应用于许多领域,包括:1. 制药工业:醇是很多药物的主要成分,常用于制造抗生素、镇痛药和抗血栓等药物。
2. 化妆品工业:醇常用于化妆品中的乳化剂、稠化剂和保湿剂等。
3. 染料工业:醇在染料工业中用作媒染剂和分散剂。
一、醇类

4-(正)丙基-5-己烯-1-醇
e. 芳醇的命名,可把芳基作为取代基:
1-苯乙醇 (-苯乙醇) 2-苯乙醇 (-苯乙醇)
2
1
CH2-CH2-OH
3-苯基-2-丙烯-1-醇 (肉桂醇)
f. 多元醇: 结构简单的常以俗名称呼,结构复杂的, 应尽可能选择包含多个羟基在内的碳链作为主链, 并把羟基的数目(以二、三、…表示)和位次(用 1,2,…表示)放在醇名之前表示出来. 例1:
五、醇的化学性质
•醇的性质主要是由它的官能团(-OH)决定的。 • 醇的化学反应中,根据键的断裂方式,主要有:
•氢氧键断裂和碳氧键断裂两种不同类型的反应。
1.羟基的酸性----------- 与活泼金属的反应
• 醇与水都含有羟基,都属于极性化合物,具有相
似的性质:如与活泼金属(Na,K,Mg,Al等)反应,放 出氢气:
醇钠
RCH2OH + Na (CH3)3COH + K
RCH2ONa + 1/2H2 (CH3)3COK + 1/2H2
醇钾
作碱性试剂 或亲核试剂 作消除反应试剂
2、氧化和脱氢
(1)伯醇、仲醇的氧化 •氧化剂:高锰酸钾、铬酸 • 伯醇氧化—醛—羧酸;仲醇氧化—酮。
例1:
例2:
(2)叔醇分子,只有在剧烈条件下发生氧化, 则碳链断裂,生成含碳原子较少的产物:
二、 醇的分类
一元醇:
伯醇:RCH2-OH 伯醇(第一醇)(1°醇) 仲醇:R2CH-OH 仲醇(第二)醇(2°醇)
叔醇:R3C-OH
叔醇(第三醇)(3°醇)
① 按-OH数 目分类:
二元醇: 多元醇:
CH2—CH2 OH OH
醇一分类和命名.pptx
CH2 ONO2 CH ONO2 CH2 ONO2 三硝酸甘油酯
Cl
碱
3 C4H9OH + Cl P O
Cl
(C4H9O)3P O + 3 HCl 磷酸三丁酯
第28页/共70页
(四) 氧化和脱氢反应
1、被K2Cr2O7-H2SO4 或 KMnO4 氧化
伯醇 RCH2OH 成酸
K2Cr2O7 / H2SO4 or KMnO4
苄醇、烯丙型醇、叔醇是按SN1历程进行
伯醇是按SN2历程进行 仲醇SN1、SN2都有可能
ROH
质子化的醇,其离去 基团H2O比醇本身的离 去基团HO-更易离去。
H+
+
ROH2
SX - RX
X-
第14页/共70页
RX + H2O
某些二级醇与HX的反应会发生重排:
CH3 CH CH CH3 HBr CH3 OH
醇在酸性条件下加热,是发生分子间的SN反应生成醚还 是发生分子内的消除反应生成烯烃,体现了两个反应的竞
争,与醇的结构以及反应的条件都有关。
叔醇主要得到烯烃,而伯醇主要得到醚
高温有利生成烯烃,较低温度则主要生成醚。
第26页/共70页
(三)生成酯的反应
O
C2H5OH
+ CH3COH
H
O CH3COC2H5 + H2O
K2Cr2O7 / H2SO4
RCHO
or KMnO4
CH3CH2CH2OH K2Cr2O7 / H2SO4 / H2O CH3CH2CH2CHO
RCOOH
K2Cr2O7 / H2SO4 / H2O
CH3CH2CH2COOH
醇的分类与命名.ppt

氧化脱氢:
Cu or Ag
CH3CH2OH 0.5O2
550℃Βιβλιοθήκη CH3CHOH2O
六、多元醇
1、多元醇的命名
H3C CH CHCH3 OH OH
2,3-丁二醇
H3C CH CH CH2 OH OH OCH3
HOH2C
CH2OH C CH2OH CH2OH
1-甲氧基-2,3-丁二醇 季戊四醇
2、多元醇的制备
CH3CHCH=CH2 OH
3-丁烯-2-醇
CH3CHCH2CH2CHCH2CH3
OH
OH
2,5-庚二醇
3-methyl-2-butanol 3-buten-2-ol
2,5-heptandiol
H3C OH
OH OH
H3C
CH3
1-甲基环戊醇 1-methylcyclopentanol
顺-4-甲基环己醇 cis-4-methycyclohexanol
73-75%
四、醇的物理性质: 沸点较高,低级醇易溶于水;
Hydrogen bond
五、醇的化学性质:
Nu:-
C OH
羟基质子化
H
弱酸性
C O H H
H O
H
O 氧化与脱氢
C
1. 醇的酸性(与金属反应)
H
R-O-H O
共轭酸
H
R-O-
+
H H-O-H
共轭碱
Relative Acidity:
H2O > ROH.>RC CH > H2 > NH3 > RH
1) 与氢卤酸反应
R OH + HX 反应活性顺序:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
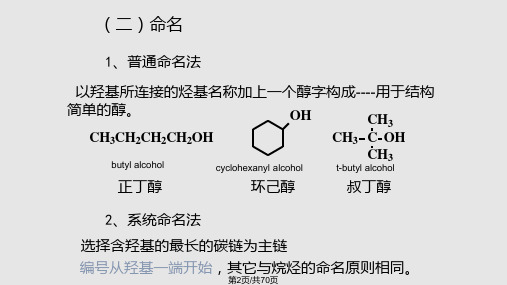
简单的醇。
OH
CH3
CH3CH2CH2CH2OH
CH3 C OH
butyl alcohol
CH3
cyclohexanyl alcohol t-butyl alcohol
正丁醇
环己醇
叔丁醇
2、系统命名法 选择含羟基的最长的碳链为主链 编号从羟基一端开始,其它与烷烃的命名原则相同。
CH3CH2CH CH CH2CH3 4-甲基-3-己醇
HBr(48%)
CH3CH2CH2CH2OH
CH3CH2CH2CH2Br
HCl(36%)
ZnCl2/ CH3CH2CH2CH2Cl
2)各类醇的相对活性:
CH2OH CH2 CH CH2OH 3。> 2。> 1。> CH3OH
浓HCl和无水ZnCl2配成的溶液称为卢卡斯(Lucas)试 剂。六个碳以下的低级醇可溶于Lucas试剂, 反应后生成
二)亲核取代反应(醇中C-O键的断裂)
1、与HX的反应 ROH + HX
RX + H2O
-OH不是好的离去基团,醇不能与 NaX 反应,反应需在
酸存在下进行。例如:
OH + NaBr H2SO4
Br
1)氢卤酸的相对活性:HI > HBr > HCl 与X-的亲核性大小次序一致
HI(57%)
CH3CH2CH2CH2I
异丙醇铝
说明:
1)ROH(如甲醇的pKa=16) 的酸性比H2O的(pKa=15.7)更弱 ,故ROH不能使石蕊变红。其共轭碱RONa的碱性比NaOH强。
酸性 ROH < H2O
碱性 RONa > NaOH
所以在通常情况下,ROH与NaOH反应的趋势很小;相反, RONa却很容易水解成ROH。
ROH + NaOH
根据含羟基的数目:一元醇、二元醇、多元醇
CH3CH2OH
H2C CH CH2
乙醇(一元醇)
OH OH OH 丙三醇(多元醇)
R1
RCH2OH
RCOHR1 R C R2
伯醇(1o醇) primary
OH
仲醇(2o醇) 叔醇(3o醇)
secondary
tertiary
(二)命名
1、普通命名法
以羟基所连接的烃基名称加上一个醇字构成----用于结构
低级醇与MgCl2’ CaCl2’ CuSO4等形成结晶醇.如:
CaCl2.C2H5OH
MgCl2.C2H5OH
用途:分离、提纯
分子量增大,烃基增大, R
R
R
阻碍了“氢键”的形成, O
O
O
醇分子间氢键缔合程度减 H H H H H
弱,沸点也与相应烃的沸
O
O
点越来越近。
R
R
H
H
H
分子量增大,烃基增
O
酯化
一)醇的弱酸性(醇中O-H键的断裂)
醇有弱酸性,能与活泼金属(如Na、K、Mg、Al 等)反 应,放出氢气。
C2H5OH + Na
C2H5ONa + H2
2C2H5OH &#)2Mg + H2
6(CH3)2CHOH + 2Al
HgCl2 或 AlCl3
2Al[OCH(CH3)2]3 + 3H2
苄醇、烯丙型醇、叔醇是按SN1历程进行
伯醇是按SN2历程进行 仲醇SN1、SN2都有可能
H+ ROH
质子化的醇,其离去 基团H2O比醇本身的离 去基团HO-更易离去。
O
O
H
H
H
H
H
O
O
R
R
大,阻碍了醇分子与水 分子形成 “氢键”。且 亲水部分(羟基)所占比 例减少,氢键缔合程度 减弱,溶解度也随之降
多元醇分子中羟基数目多,与水低形。成氢键的部位多,溶
解度更大。
三、化学反应
弱酸性(与金属反应)
H R βC H α C O H
羟基被取代(亲核取代)
HH
消除反应
氧化和脱氢
的RCl不溶于该试剂而出现混浊或分层现象。
CH2OH CH2 CH CH2OH 3。醇
立即浑浊
2。醇
1。醇 该反应可用于鉴别六个碳以下 的伯、仲、叔醇。
HCl/ZnCl2 室温
放置片刻 才浑浊
长时间不出 现浑浊,加 热后才浑浊
鉴别
OH OH
or
OH OH
OH
3)机理
CH2 CH CH2OH
该反应是酸催化下的亲核取代反应,一般认为:
H
0.143nm
0.1095nm
H H
C
H
..
H O
..
甲醇的成键轨道
2PX 2PY 2PZ 2S
杂化
SP3杂化轨道
二)物理性质
沸点: 高于同分子量的烃、卤代烃; 同分子量时,支链增加沸点降低(氢键的影响)。
溶解性:C1-C3与水混溶 同分子量时,支链多,水溶性好 良溶剂(氢键的影响) 醇也能溶于强酸(H2SO4,HCl)
OH
H H
CH3
(1R,3R)-3-甲基环己醇
(R)-1-phenyl-3-buten-2-ol (1R,3R)-3-methylcyclohexanol
二、结构和物理性质
一)结构
醇的官能团为醇羟基(-OH),O原子为 SP3杂化。分子具有较强的极性。
H
109
..
H
.. H C O 0.096nm
RONa + H2O
2)醇与金属反应比水与金属反应缓和一些。
3)不同类型的醇与金属钠反应的活性次序(即酸性大小 次序)为: 甲醇 > 伯醇 > 仲醇 > 叔醇
烷氧负离子稳定性减弱:
烷氧负离子稳定性减,碱性增强,其共轭酸的酸性减弱。
主要用途: 1)用于销毁残余的金属钠; 2)可制备醇金属;醇金属是一种强碱,强的亲核试剂等 3)利用金属与低级醇反应放氢气可鉴别醇。
第8章 醇和醚
第一节 醇
醇(alcohol): 烃分子中的一个或多个氢原子被羟基取代生成的化合物 也可看作是水分子中的氢原子被烃基取代生成的化合物。
可用ROH表示
一、分类和命名
(一)分类
根据羟基所连接的碳原子(只能是sp3杂化的饱和碳原子) 的种类:伯醇(一级醇)、仲醇(二级醇)、叔醇(三级醇)
—最常见的分类
OH CH3
4-methyo-3-hexanol
65 4 3 CH3CH CH CH
CH3 CH3 OH
2 CH
CH2CH3
4,5-二甲基-2-乙基-
1
CH2OH
1,3-己二醇
4,5-dimethyl-2-ethyl-1,3-hexanediol
CH2 CH2
OH OH
乙二醇(甘醇)
CH2 CH CH2 OH OH OH
丙三醇(甘油)
ethanediol(Glycol) propanetriol(Glycerol)
当同一个碳原子上连有两个羟基时,化合物是不能稳定存 在的。即
多元醇中,每个碳原子最多只能连接一个羟基。
CH3
OH CH
- H2O
O CH3C
OH
H
从羟基
CH=CH2
一端开 H OH
始编号
CH2C6H5
(R)-1-苯基-3-丁烯-2-醇
