化学反应工程课后习题
《化学反应工程》(第四版)课后习题答案详解

VR 1 V02 k 1 k 1 k1 k 2 1 2 2 2
V02 k1 k2 k1 / k2 1 2 1 1 V01 2k1 k2 2k1 / k2 1 4 1 3
1 V02 V01 3
加料速率减小到原来的1/3倍,可使转化 率达到0.5。
CA0 CB0 0.02mol/ L
2 rA kCACB 5.6CA
根据:t
x Af kCA0 (1 x Af )
3 3
当VR 1m 和2 时: (反应时间与反应体积无关) 0.95 t 169.64(min) 5.6 0.02(1 0.95)
习题3-3解答
3
(3)两个CSTR串联
VR C A0 x A1 C A0 ( x A2 x A1 ) 根据 V0 rA1 rA2
m 1 m2
C A0 x A1 C A0 ( x A2 x A1 ) kCA0 (1 x A1 )C A0 x A1 kCA0 (1 x A2 )C A0 x A2 1 ( x A2 x A1 ) ; (1 x A1 ) (1 x A2 ) x A2
x A2 0.98 x A1 0.85
VR1 1 1 V0 kCA0 (1 x A1 ) 0.01 2 (1 0.85)
VR1 333.33V0 333.33 0.002 0.67(m )
3
VR 2VR1 2 0.67 1.34(m )
(2)单个CSTR
VR C A0 x Af 根据 V0 rA
C A0 x Af VR V0 kCA0 (1 x Af )[C A0 C A0 (1 x Af )] 1 2500( s) 0.01 2 (1 0.98)
(完整版)化学反应工程习题

化学反应工程习题第一部分:均相反应器基本理论1、试分别写出N 2+3H 2=2NH 3中用N2、H 2、NH 3的浓度对时间的变化率来表示的该反应的速率;并写出这三种反应速率表达式之间的关系。
2、已知某化学计量式为S R B A 2121+=+的反应,其反应速率表达式为B AA C C r 5.02=,试求反应速率B r =?;若反应的化学计量式写成S R B A +=+22,则此时反应速率A r =?为什么?3、某气相反应在400 oK 时的反应速率方程式为221061.3AA P d dP -⨯=-τh kPa /,问反应速率常数的单位是什么?若将反应速率方程改写为21AA A kC d dn V r =⨯-=τh l mol ./,该反应速率常数k 的数值、单位如何?4、在973 oK 和294.3×103Pa 恒压下发生下列反应:C 4H 10→2C 2H 4+H 2 。
反应开始时,系统中含丁烷为116kg ,当反应完成50%时,丁烷分压以235.4×103Pa /s 的速率发生变化,试求下列项次的变化速率:(1)乙烯分压;(2)H 2的摩尔数;(3)丁烷的摩尔分率。
5、某溶液反应:A+B →C ,开始时A 与B 摩尔数相等,没有C ,1小时后A 的转化率为75%,当在下列三种情况下,2小时后反应物A 尚有百分之几未反应掉? (1)对A 为一级、B 为零级反应; (2)对A 、B 皆为一级反应; (3)对A 、B 皆为零级反应。
6、在一间歇反应器中进行下列液相反应: A + B = R A + R = S已知原料组成为C A0 = 2 kmol/m 3,C B0 = 4 kmol/m 3,C R0 = C S0 = 0。
反应混合物体积的变化忽略不计。
反应一段时间后测得C A = 0 .3 kmol/m 3,C R = 1.5 kmol/m 3。
计算这时B 和S 的浓度,并确定A 的转化率、生成R 的选择性和收率。
(完整版)化学反应工程课后习题答案.

积分之
2.10在催化剂上进行三甲基苯的氢解反应:
反应器进口原料气组成为66.67%H2,33.33%三甲基苯。在0.1Mpa及523K下等温反应,当反应器出口三甲基苯的转化率为80%时,其混合气体的氢含量为20%,试求:
(1)(1)此时反应器出口的气体组成。
(2)(2)若这两个反应的动力学方程分别为:
组分
摩尔分率yi0
摩尔数ni0(mol)
CH3OH
2/(2+4+1.3)=0.2740
27.40
空气
4/(2+4+1.3)=0.5479
54.79
水
1.3/(2+4+1.3)=0.1781
17.81
总计
1.000
100.0
设甲醇的转化率为XA,甲醛的收率为YP,根据(1.3)和(1.5)式可得反应器出口甲醇、甲醛和二氧化碳的摩尔数nA、nP和nc分别为:
组分
摩尔质量
摩尔分率yi
CO
28
15.49
H2
2
69.78
CO2
44
0.82
CH4
16
3.62
N2
28
10.29
总计
100
其中冷凝分离后气体平均分子量为
M’m=∑yiMi=9.554
又设放空气体流量为Akmol/h,粗甲醇的流量为Bkg/h。对整个系统的N2作衡算得:
5.38B/28×1000+0.1029A=2.92 (A)
20
30
40
50
60
70
试求当进口原料气体流量为50ml/min时CO的转化速率。
解:是一个流动反应器,其反应速率式可用(2.7)式来表示
化学反应工程课后习题答案

1 绪论1.1在银催化剂上进行甲醇氧化为甲醛的反应:进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1)(1)反应的选择性;(2)(2)反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),当进入反应器的总原料量为100mol设甲醇的转化率为X A,甲醛的收率为Y P,根据(1.3)和(1.5)式可得反应器出口甲醇、甲醛和二氧化碳的摩尔数n A、n P和n c分别为:n A=n A0(1-X A)=7.672 moln P=n A0Y P=18.96 moln C=n A0(X A-Y P)=0.7672 mol结合上述反应的化学计量式,水(n W)、氧气(n O)和氮气(n N)的摩尔数分别为:n W=n W0+n P+2n C=38.30 moln O=n O0-1/2n P-3/2n C=0.8788 moln N=n N0=43.28 mol所以,反应器出口气体组成为:1. 1.2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩机后与原料气混合返回合成塔中。
下图是生产流程示意图原料气Bkg/h 粗甲醇Akmol/h100kmol 放空气体原料气和冷凝分离后的气体组成如下:(mol )组分 原料气 冷凝分离后的气体 CO 26.82 15.49 H 2 68.25 69.78 CO 2 1.46 0.82 CH 4 0.55 3.62 N 22.9210.29粗甲醇的组成为CH 3OH 89.15%,(CH 3)2O 3.55%,C 3H 9OH 1.10%,H 2O 6.20%,均为重量百分率。
(完整版)反应工程课后答案完整版.
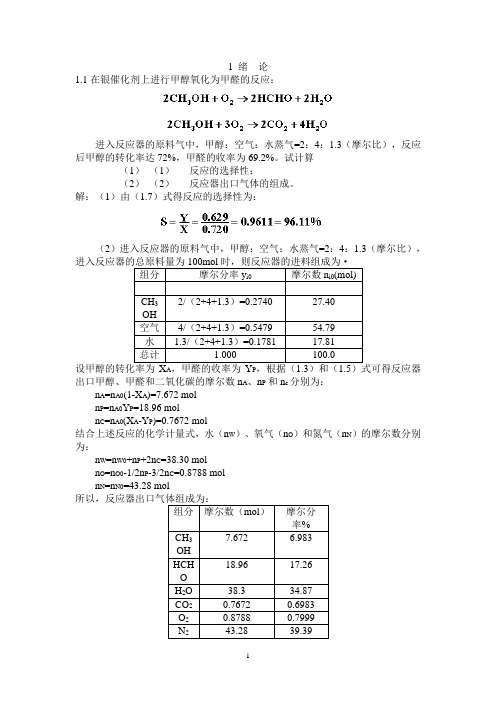
1 绪论1.1在银催化剂上进行甲醇氧化为甲醛的反应:进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1)(1)反应的选择性;(2)(2)反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),组分摩尔分率y i0 摩尔数n i0(mol)CH32/(2+4+1.3)=0.2740 27.40OH空气4/(2+4+1.3)=0.5479 54.79水 1.3/(2+4+1.3)=0.1781 17.81总计 1.000 100.0A P出口甲醇、甲醛和二氧化碳的摩尔数n A、n P和n c分别为:n A=n A0(1-X A)=7.672 moln P=n A0Y P=18.96 moln C=n A0(X A-Y P)=0.7672 mol结合上述反应的化学计量式,水(n W)、氧气(n O)和氮气(n N)的摩尔数分别为:n W=n W0+n P+2n C=38.30 moln O=n O0-1/2n P-3/2n C=0.8788 moln N=n N0=43.28 mol组分摩尔数(mol)摩尔分率%7.672 6.983CH3OH18.96 17.26HCHOH2O 38.3 34.87CO2 0.7672 0.6983O2 0.8788 0.7999N2 43.28 39.392 反应动力学基础2.4在等温下进行液相反应A+B→C+D,在该条件下的反应速率方程为:若将A和B的初始浓度均为3mol/l的原料混合进行反应,求反应4min时A的转化率。
解:由题中条件知是个等容反应过程,且A和B的初始浓度均相等,即为1.5mol/l,故可把反应速率式简化,得由(2.6)式可知代入速率方程式化简整理得积分得解得X A=82.76%。
2.6下面是两个反应的T-X图,图中AB是平衡曲线,NP是最佳温度曲线,AM是等温线,HB是等转化率线。
化学反应工程第二版课后习题

《化学反应工程》第二版习题0 第一章习题1 化学反应式与化学计量方程有何异同化学反应式中计量系数与化学计量方程中的计量系数有何关系2 何谓基元反应基元反应的动力学方程中活化能与反应级数的含义是什么何谓非基元反应非基元反应的动力学方程中活化能与反应级数含义是什么3 若将反应速率写成tcrddAA有什么条件 4 为什么均相液相反应过程的动力学方程实验测定采用间歇反应器5 现有如下基元反应过程请写出各组分生成速率与浓度之间关系。
1A2B??C AC?? D2A2B??C BC??D CD→E 32A2B??C AC??D 6 气相基元反应A2B→2P在30℃和常压下的反应速率常数kc2.65×104m6kmol-2s-1。
现以气相分压来表示速率方程即??rAkPpApB2求kP假定气体为理想气体7 有一反应在间歇反应器中进行经过8min后反应物转化掉80经过18min后转化掉90求表达此反应的动力学方程式。
8 反应Ag Bl→Cl气相反应物A被B的水溶液吸收吸收后A与B生成C。
反应动力学方程为??rAkcAcB。
由于反应物B在水中的浓度远大《化学反应工程》第二版习题1 于A在反应过程中可视为不变而反应物A溶解于水的速率极快以至于A在水中的浓度恒为其饱和溶解度。
试求此反应器中液相体积为5m3时C的生成量。
已知k1m3kmol-1hr-1cB03kmol·m-3cA饱和0.02 kmol·m-3水溶液流量为10m3hr-1。
9 反应O2HN2NO2H222在恒容下用等摩尔H2NO进行实验测得以下数据总压/MPa 0.0272 0.0326 0.0381 0.0435 0.0543 半衰期/s 265 186 135 104 67 求此反应的级数。
10 考虑反应3PA其动力学方程为VnktnVrAAAdd1试推导在恒容下以总压表示的动力学方程。
11 A和B在水溶液中进行反应在25℃下测得下列数据试确定该反应反应级数和反应速度常数。
《化学反应工程》教材课后习题答案 李绍芬 天津大学

其中 xi=yiMi/∑yiMi。进料的平均摩尔质量 Mm=∑yiMi=10.42kg/kmol。 经冷凝分离后的气体组成(亦即放空气体的组成)如下:
组分 摩尔质量 摩尔分率 yi CO H2 CO2 CH4 N2 总计 其中冷凝分离后气体平均分子量为 M’m=∑yiMi=9.554 又设放空气体流量为 Akmol/h, 粗甲醇的流量为 Bkg/h。 对整个系统的 N2 作衡算得: 5.38B/28×1000+0.1029A=2.92 对整个系统就所有物料作衡算得: 100×10.42=B+9.554A 联立(A) 、 (B)两个方程,解之得 A=26.91kmol/h 反应后产物中 CO 摩尔流量为 FCO=0.1549A+9.38B/(28×1000) 将求得的 A、B 值代入得 FCO=4.431 kmol/h 故 CO 的全程转化率为 B=785.2kg/h (B) (A) 28 2 44 16 28 15.49 69.78 0.82 3.62 10.29 100
dX A dX A C A0 dVR d (VR / Q0 )
用 XA~VR/Q0 作图,过 VR/Q0=0.20min 的点作切线,即得该条件下的 dXA/d(VR/Q0)值 α。 VR/Q0min 0.12 0.148 0.20 0.26 0.34 0.45 XA% 20.0 30.0 40.0 50.0 60.0 70.0
FCO,0 FCO 26.82 4.435 16.18% FCO,0 138.4
产物粗甲醇所溶解的 CO2、CO、H2、CH4 和 N2 总量 D 为
D
(9.82 9.38 1.76 2.14 5.38)B 0.02848Bkmol / h 1000
化学反应工程第二版课后答案

第一章习题1化学反应式与化学计量方程有何异同?化学反应式中计量系数与化学计量方程中的计量系数有何关系?答:化学反应式中计量系数恒为正值,化学计量方程中反应物的计量系数与化学反应式中数值相同,符号相反,对于产物二者相同。
2 何谓基元反应?基元反应的动力学方程中活化能与反应级数的含义是什么?何谓非基元反应?非基元反应的动力学方程中活化能与反应级数含义是什么?答:如果反应物严格按照化学反应式一步直接转化生成产物,该反应是基元反应。
基元反应符合质量作用定律。
基元反应的活化能指1摩尔活化分子的平均能量比普通分子的平均能量的高出值。
基元反应的反应级数是该反应的反应分子数。
一切不符合质量作用定律的反应都是非基元反应。
非基元反应的活化能没有明确的物理意义,仅决定了反应速率对温度的敏感程度。
非基元反应的反应级数是经验数值,决定了反应速率对反应物浓度的敏感程度。
3若将反应速率写成tc rd d AA -=-,有什么条件? 答:化学反应的进行不引起物系体积的变化,即恒容。
4 为什么均相液相反应过程的动力学方程实验测定采用间歇反应器?答:在间歇反应器中可以直接得到反应时间和反应程度的关系,而这种关系仅是动力学方程的直接积分,与反应器大小和投料量无关。
5 现有如下基元反应过程,请写出各组分生成速率与浓度之间关系。
(1)A+2B ↔C A+C ↔ D (2)A+2B ↔C B+C ↔D C+D →E(3)2A+2B ↔CA+C ↔D 解(1)D4C A 3D D 4C A 3C 22BA 1C C22B A 1B D 4C A 3C 22B A 1A 22c k c c k r c k c c k c k c c k r c k c c k r c k c c k c k c c k r -=+--=+-=+-+-=(2)E6D C 5D 4C B 3D E 6D C 5D 4C B 3C 22BA 1C D4C B 3C 22B A 1B C22B A 1A 22c k c c k c k c c k r c k c c k c k c c k c k c c k r c k c c k c k c c k r c k c c k r +--=+-+--=+-+-=+-=(3)D4C A 3D D 4C A 3C 22B2A 1C C22B 2A 1B D 4C A 3C 22B 2A 1A 2222c k c c k r c k c c k c k c c k r c k c c k r c k c c k c k c c k r -=+--=+-=+-+-=6 气相基元反应A+2B →2P 在30℃和常压下的反应速率常数k c =2.65×104m 6kmol -2s -1。
《化学反应工程》第三版(陈甘堂著)课后习题答案

《化学反应工程》第三版(陈甘堂著)课后习题答案第二章均相反应动力学基础2-4三级气相反应2NO+O22NO2,在30℃及1kgf/cm2下反应,已知反应速率常数2kC=2.65×104L2/(mol2 s),若以rA=kppApB表示,反应速率常数kp应为何值?解:原速率方程rA=dcA2cB=2.65×104cAdt由气体状态方程有cA=代入式(1)2-5考虑反应A课所以kp=2.65×104×(0.08477×303) 3=1.564后当压力单位为kgf/cm2时,R=0.08477,T=303K。
答p p 2rA=2.65×10 A B =2.65×104(RT) 3pApBRT RTp表示的动力学方程。
解:.因,wwnAp=A,微分得RTVdaw案24网pAp,cB=BRTRT3P,其动力学方程为( rA)=dnAn=kA。
试推导:在恒容下以总压VdtVδA=3 1=21dnA1dpA=VdtRTdt代入原动力学方程整理得wdpA=kpAdt设初始原料为纯A,yA0=1,总量为n0=nA0。
反应过程中总摩尔数根据膨胀因子定义δA=n n0nA0 nA若侵犯了您的版权利益,敬请来信通知我们!Y http://.cn.co(1)mol/[L s (kgf/cm2) 3]m(1)则nA=nA01(n n0)δA1(P P0)δA(2)恒容下上式可转换为pA=P0所以将式(2)和式(3)代入式(1)整理得2-6在700℃及3kgf/cm2恒压下发生下列反应:C4H10发生变化,试求下列各项的变化速率。
(1)乙烯分压;(2)H2的物质的量,mol;(3)丁烷的摩尔分数。
解:P=3kgf/cm2,(1)课MC4H10=58,(2)w.krC2H4=2( rC4H10)=2×2.4=4.8kgf/(cm2 s)PC4H10=PyC4H101 dpC4H10= P dt2.4-1==0.8 s 3w(3)nC4H10=nyC4H10=n0(1+δC4H10yC4H10,0xC4H10)yC4H10dnH2dtdnH2dt=hdaw后n0=nC4H10,0=δC4H10rC4H10=反应开始时,系统中含C4H*****kg,当反应完成50%时,丁烷分压以2.4kgf/(cm2 s)的速率dyC4H10dt答1rCH=2.4224wdnC4H10dt案116×1000=2000mol582+1 1==21网dyC4H10=n0(1+δC4H10yC4H10,0xC4H10) dt=2000×(1+2×1×0.5)×0.8=3200 mol/s若侵犯了您的版权利益,敬请来信通知我们!Y http://.cno2C2H4+H2,dP=k[(δA+1)P0 P]=k(3P0 P)dtm(3)dpA1dP= dtδAdt2-9反应APS,( r1)=k1cA , ( r2)=k2cp,已知t=0时,cA=cA0 ,cp0=cS0=0, k1/k2=0.2。
《化学反应工程》课后习题答案

1.0
2.0
3.0
4.0
5.0
6.0
7.0
8.0
9.0
CA(mol/L)
0.9
0.61
0.42
0.28
0.17
0.12
0.08
0.045
0.03
试求反应时间为3.5h的A的水解速率。
解:利用反应时间与组分A的浓度变化数据,作出CA~t的关系曲线,用镜面法求得t=3.5h时该点的切线,即为水解速率。
1绪论
1.1在银催化剂上进行甲醇氧化为甲醛的反应:
进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。试计算
(1)(1)反应的选择性;
(2)(2)反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:
(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),当进入反应器的总原料量为100mol时,则反应器的进料组成为
所以,甲醇的全程收率为
Y总=21.25/26.82=79.24%
甲醇的单程收率为
Y单=21.25/138.4=15.36%
2反应动力学基础
2.1在一体积为4L的恒容反应器中进行A的水解反应,反应前A的含量为12.23%(重量),混合物的密度为1g/mL,反应物A的分子量为88。在等温常压下不断取样分析,测的组分A的浓度随时间变化的数据如下:
切线的斜率为
由(2.6)式可知反应物的水解速率为
2.2在一管式反应器中常压300℃等温下进行甲烷化反应:
催化剂体积为10ml,原料气中CO的含量为3%,其余为N2,H2气体,改变进口原料气流量Q0进行实验,测得出口CO的转化率为:
化学反应工程第二版课后答案.word - 副本

化学反应工程第二版答第一章习题1何谓基元反应?基元反应的动力学方程中活化能与反应级数的含义是什么?何谓非基元反应?非基元反应的动力学方程中活化能与反应级数含义是什么?答:如果反应物严格按照化学反应式一步直接转化生成产物,该反应是基元反应。
基元反应符合质量作用定律。
基元反应的活化能指1摩尔活化分子的平均能量比普通分子的平均能量的高出值。
基元反应的反应级数是该反应的反应分子数。
一切不符合质量作用定律的反应都是非基元反应。
非基元反应的活化能没有明确的物理意义,仅决定了反应速率对温度的敏感程度。
非基元反应的反应级数是经验数值,决定了反应速率对反应物浓度的敏感程度。
2为什么均相液相反应过程的动力学方程实验测定采用间歇反应器?答:在间歇反应器中可以直接得到反应时间和反应程度的关系,而这种关系仅是动力学方程的直接积分,与反应器大小和投料量无关。
第二章习题1.动力学方程的实验测定时,有采用循环反应器的,为什么?答:循环反应器行为与全混流反应器相同,可以得到反应速率的点数据,而且反应器进出口浓度差比较大,对分析精度要求不很高。
2.平行液相反应A→P r P=1A→R r R=2c AA→S r S=c A2已知c A0=2kmol·m-3,c Af=0.2kmol·m-3,求下列反应器中,c P最大为多少?(1)平推流反应器;(2)全混流反应器;(3)两相同体积的全混流反应器串联,c A1=1 kmol·m-3。
解3-A0Af A 2A Af 0A p P AP AfA0p 2A 2A A S R P P P m kmol 5.02112.011)1(1)1(1d )1(1)(d 1PFR For )1(1211A0AfA Af⋅=+-+=+-+=+=-=-=+=++=++=⎰⎰c c c c c c S c c S c c S c c c r r r r S c c c c3-22Af Af A0Af A0p P m kmol 25.1)2.01(1)2.02()1(1)()(CSTRFor ⋅=+-=+-=-=c c c c c S c 3-22P2Af A1P1A1A0P m kmol 81.056.025.0)2.01(1)2.01()11(1)12()()(Series in CSTR For two ⋅=+=+-++-=-+-=S c c S c c c3. A 进行平行分解反应,其速率式为 ↗R r R =1 kmol ·m -3min -1A →S r S =2c A kmol ·m -3min -1↘T r T =c A kmol ·m -3min -1其中R 是所要求的目的产物,c A0=1kmol ·m -3。
化学反应工程_习题集(含答案)

《化学反应工程》课程习题集一、单选题1.某反应的速率常数k=0.0462-1,又知初始浓度为0.1mol.dm-3,则该反应的半衰期为:(A) 1/(6.93×10-2×0.12) (B) 15分(C) 30分 (D) 1/(4.62×102×0.1)分2.某一级反应, 当反应物的浓度降为起始浓度的1%时,需要t1秒, 若将反应物的浓度提高一倍, 加快反应速率, 当反应物浓度降低为起始浓度的1%时, 需时为t2, 则:(A ) t1﹥t2 (B) t1=t2(C) t1﹤t2 (D) 不能确定二者关系3.某反应物反应掉7/8所需的时间恰好是它反应掉1/2所需时间的3倍, 则该反应的级数是:(A) 零级 (B) 一级反应 (C) 三级反应 (D) 二级反应4.若两个相同类型的气相双分子反应的△H⊙值相等, 又在400k时,它们的活化熵之差△S1⊙-△S2⊙=10 J.mol-1,则两反应的速率常数之比为:(A) K1/K2=0.300 (B) K1/K2=0.997(C) K1/K2=1.00 (D) K1/K2=3.335.对反应A+B→C, 由下列数据C A0/mol.dm-3 C B0/mol.dm-3 r0/ mol.dm-31.0 1.0 0.152.0 1.0 0.301.02.0 0.15则该反应的速率方程为:(A) r=K C B (B) r=K C A C B(C) r=K C A (D) r=K C A C B26.一个反应的活化能是33kJ·mol-1, 当 T = 300K 时,温度每增加1K,反应速率常数增加的百分数约是___。
A. 4.5%B. 90%C. 11%D. 50%7.下列叙述正确的是_ 。
A. 吸热反应的活化能比放热反应的活化能高B. 一个反应的反应速率与化学方程式中出现的所有作用物浓度都有关C. 催化反应的速率与催化剂的浓度无关D. 反应速率常数与作用物浓度无关8.关于催化剂的使用,下列叙述中不正确的是_ 。
化学反应工程课后习题

当 1时t cA0
xA
0
xA dx 1 2 2 kcA kcA0 (1 xA ) 0 (1 x A ) ( xA ) dxA 1 ln kc 2 A0 (1 xA )( xA ) kcA0 ( 1) (1 xA )
18 (1 0.9)1n 1 8 (1 0.8)1n 1
n=2
xA cA 0 kt 1 xA
k 0.5 L / (mol min)
3-8 在间歇反应器中进行二级反应
AP
,反应速率为
(-rA )=0.01c2 A mol / s
所需反应时间。并对计算结果进行讨论。
1 2 C kt 2 1 (1 xA ) 1 2 A0
t2 30 1 (1 xA 2 ) 1 t1 10 1 (1 0.75) 2
假设xA=1时,时间为t3
1 2 1 2
1 2
xA2无解
t3 1 (1 xA3 ) 1 (1 1) 1 1 t1 1 (1 xA1 ) 2 1 (1 0.75) 2
xA 0.534
循环操作 0.635
m w * mtotal n M M
第2章 化学反应动力学
2-4 间歇反应器:CA0和xA相同(T1=20℃时,反应时间t1=8d;
T2=120 ℃时,反应时间t2=10min),试估算 Ea
反应转化量 rA =kCAn 反应时间 反应区
xAe k1 0.2 K xAe 0.286 k2 1 xAe 0.5
若要使xA=0.9,可以降温或者移除产物。
K1 H 1 1 ln ( ) K2 R T1 T2
化学反应工程原理第二版课后练习题含答案

化学反应工程原理第二版课后练习题含答案第一章:化学反应及其动力学1.1 选择题1.在一个二级反应中,反应物消耗的速率是:A. 指数级B. 线性级C. 平方级D. 无法确定答案:A2.在实验室里,观察到以下两个过程:I、反应物浓度显著降低时,反应速率也随之降低;II、加热环境下反应速率明显提高。
从以上两个过程可以推断:A. 反应是随机过程,和反应物数量无关B. 反应是由反应物占据的活性中心引发,活性中心数量随反应物浓度升高而增多C. 反应是由温度升高引起反应物动能升高而加快反应速率D. 反应是由催化剂引发的,加热可提高催化剂效率答案:C1.2 填空题1.在单级分步反应中,反应速率方程为 r=kC_A^m C_B^n ,其中,m+n=……答案:22.在第一级反应中,半衰期的定义为反应物浓度减少到初值的……答案:一半1.3 计算题1.在气相反应 A+B=C 中,当初浓度均为 2mol/L 时,反应速率为0.1mol/L*s,求 5s 后反应物含量(假设反应一级)。
答案:k = r/C_A = r/2 = 0.1/2 = 0.05kt = 0.05 5 = 0.25C_A = C_A0 * e^{-kt} = 2 * e^{-0.25} = 1.22mol/LC_B = C_B0 * e^{-kt} = 2 * e^{-0.25} = 1.22mol/LC_C = C_C0 + (C_A0-C_A) = 2 + (2-1.22) = 2.78mol/L2.在二级反应A+B→C 中,初时只有 A,它以 0.1mol/L的浓度存在;目标是 10min 之后浓度为 0.05mol/L。
反应速率常数为 0.0002L/mol∙min,计算 B 的增长者代表反应物的摩尔量。
答案:k = r/(C_AC_B)r = kC_AC_BdC_A/dt = -r = -kC_AC_BdC_B/dt = -r = -kC_AC_BC_A(t) = C_A0/(1+C_A0C_B0kt)C_B(t) = C_B0/(1+C_A0C_B0kt)10min = 600sC_A(600s) = 0.05mol/L = 0.1mol/L/(1+0.1mol/LC_B00.0002L/mol∙min600s)0.1mol/LC_B00.0002L/mol∙min600s = 1C_B0 = 5mol/L反应物摩尔量 = C_B0t = 5mol/L*600s = 3000mol。
化学反应工程习题课1、2

1-1在银催化剂上进行甲醇的氧化反应:进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算 (1) 反应的选择性;(2) 反应器出口气体的组成。
1-1.解:(1)反应的选择性为:(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),当进入反应器的总原料量为100mol 时,则反应器的进料组成为:设甲醇的转化率为XA ,甲醛的收率为YP ,反应器出口CH3OH 、CH3CHO 和CO2的摩尔数nA 、nP 和nC 分别为:结合上述反应的化学计量式,H2O (nW )、O2(nO )和N2(nN )的摩尔数分别为:所以,反应器出口气体组成为:32222C H O H 3O2C O4H O +→+3222C H O H O 2H C H O 2H O+→+96.11%0.96110.7200.629X YS ====mol x n n A A A 672.7)1(00=-=mol Y n n P A P 96.180=⨯=molY x n n P A A C 7672.0)(0=-⨯=mol n n n n C P W W30.3820=++=mol n n n n C PO O 8788.023210=--=moln n N N 28.430==1-3.在银催化剂上进行乙烯氧化反应以生产环氧乙烷,进入催化反应器的气体组成(摩尔分数)为:反应器出口气体中含(摩尔分数)为:试计算乙烯的转化率、环氧乙烷收率的反应选择性。
1-3解:以100mol 进料为基准,并设x 和y 分别表示环氧乙烷和二氧化碳的生成量,根据题目给的进料组成和化学计量关系列式:(1)(2)可列出下表:由于反应器出口气体中乙烯和氧的摩尔分数已知,所以可列出下面两个方程:及解得:x=1.504mol y=0.989mol乙烯的转化量为:1.504+0.989/2=1.999mol所以,乙烯的转化率为:1.999/15=13.33% 环氧乙烷的收率为:1.504/15=10.03%反应的选择性为:S=0.1003/.1333=75.24%1-5:丁二烯是制造合成橡胶的重要原料。
化学反应工程课后习题答案

化学反应工程课后习题答案化学反应工程课后习题答案化学反应工程是化学工程学科中的重要分支之一,它研究的是化学反应在工业生产中的应用。
通过对反应过程的分析和优化,可以提高反应的产率、选择性和经济性。
在学习化学反应工程的过程中,我们经常会遇到一些习题,下面我将为大家提供一些常见习题的解答。
1. 习题一:对于一个一级反应A→B,初始浓度为C0的A,经过一段时间t后,浓度为Ct。
求该反应的速率常数k。
解答:根据一级反应的速率方程,可以得到d[A]/dt = -k[A],其中d[A]/dt表示A的浓度随时间的变化率。
根据题意,我们可以得到d[A]/dt = (Ct - C0)/t。
将这两个式子相等,可以得到(Ct - C0)/t = -k[A]。
由于初始浓度为C0的A,所以[A] = C0。
将这个值代入上式,可以得到(Ct - C0)/t = -kC0。
整理一下,就可以得到k = (C0 - Ct)/C0t。
2. 习题二:对于一个二级反应A + B→C,初始浓度分别为C0的A和C1的B,经过一段时间t后,浓度分别为Ct的A和Ct+1的B。
求该反应的速率常数k。
解答:根据二级反应的速率方程,可以得到d[A]/dt = -k[A][B],d[B]/dt = -k[A][B]。
根据题意,我们可以得到d[A]/dt = (Ct - C0)/t,d[B]/dt = (Ct+1 - C1)/t。
将这两个式子相等,可以得到(Ct - C0)/t = (Ct+1 - C1)/t = -k[A][B]。
由于初始浓度分别为C0的A和C1的B,所以[A] = C0,[B] = C1。
将这两个值代入上式,可以得到(Ct - C0)/t = (Ct+1 - C1)/t = -kC0C1。
整理一下,就可以得到k = (C0- Ct)/(C0C1t) = (Ct+1 - C1)/(C0C1t)。
3. 习题三:对于一个零级反应,初始浓度为C0的A,经过一段时间t后,浓度为Ct。
化学反应工程梁斌习题答案

化学反应工程(梁斌)习题答案化学反应工程是研究和优化化学反应过程的学科,涉及到反应的热力学、动力学、传质和传热等方面。
在化学工程中,反应工程是一个非常重要的环节,它直接关系到产品质量、产量和能源消耗等方面。
下面是一些化学反应工程的习题及其答案:1. 对于以下反应:A → B + C,饱和蒸汽中的A浓度为0.1 mol/L。
在一连续流动反应器中,反应速率常数k为0.02 min^-1。
求当反应器长度为10 m时,反应程度的变化。
答案:反应程度可以通过反应物的浓度变化来表示。
根据连续流动反应器的质量平衡方程,可以得到:dC/dL = -kCA其中,C为B的浓度,L为反应器长度,CA为A的浓度。
将该方程进行积分,得到:∫dC/C = -k∫dLln(C/C0) = -kL其中,C0为初始反应物A的浓度。
代入相关数值,可以得到反应程度随反应器长度的变化。
2. 某一反应的活化能为50 kJ/mol,温度升高10 K时,反应速率增加2倍。
求该反应在298 K时的速率常数。
答案:根据阿累尼乌斯方程,可以得到:k1/k2 = exp[(Ea/R) * (1/T2 - 1/T1)]其中,k1和k2分别为温度T1和T2下的速率常数,Ea为活化能,R为气体常数。
代入相关数值,可以求得该反应在298 K时的速率常数。
3. 某一反应的反应速率方程为r = kCACB。
当CA = 0.1 mol/L,CB = 0.2 mol/L时,反应速率为0.05 mol/(L·min)。
求该反应的速率常数。
答案:根据反应速率方程,可以得到:r = kCACB代入相关数值,可以求得该反应的速率常数。
化学反应工程第三版课后答案

化学反应工程第三版课后答案【篇一:化学反应工程第二版课后习题】> 2何谓基元反应?基元反应的动力学方程中活化能与反应级数的含义是什么?何谓非基元反应?非基元反应的动力学方程中活化能与反应级数含义是什么? 345现有如下基元反应过程,请写出各组分生成速率与浓度之间关系。
(1)a+2b?c a+c? d (2)a+2b?c b+c?d c+d→e (3)2a+2b?ca+c?d10mkmols。
现以气相分压来表示速率方程,即(?ra)=kppapb,求kp=?(假定气体为理想气体)46-2-12化学反应式与化学计量方程有何异同?化学反应式中计量系数与化学计量方程中的计量系数有何关系?若将反应速率写成?ra??dcadt,有什么条件?为什么均相液相反应过程的动力学方程实验测定采用间歇反应器? 78反应a(g) +b(l)→c(l)气相反应物a被b的水溶液吸收,吸收后a与b生成c。
反应动力学方程为:?ra=kcacb。
由于反应物b在水中的浓度远大有一反应在间歇反应器中进行,经过8min后,反应物转化掉80%,经过18min后,转化掉90%,求表达此反应的动力学方程式。
反应2h2?2no?n2?2h2o,在恒容下用等摩尔h2,no进行实验,测得以下数据总压/mpa 半衰期/s10 考虑反应a?3p,其动力学方程为?ra??容下以总压表示的动力学方程。
11 a和b在水溶液中进行反应,在25℃下测得下列数据,试确定该反应反应级数和反应速度常数。
116.8 319.8 490.2 913.8 1188 时间/s-312 丁烷在700℃,总压为0.3mpa的条件下热分解反应:c4h10→2c2h4+h2 (a) (r)(s)起始时丁烷为116kg,当转化率为50%时?dprdnsdya,?。
dtdtdtdpadt?0.24mpa?s?13-1-1-3-33-10.0272265 0.0326 186 0.0381 135 0.0435 104 0.0543 67求此反应的级数。
《化学反应工程》(第五版)第二、第三章部分课后习题答案

2-13 乙烯直接水合制乙醇可视为对乙烯的一级不可逆反应, 300 7.09M 在300 ℃ 、7.09MPa下,k=0.09s-1,Deff=7.04 10-4cm2/s,采用直 =7.04×10 5 径与高均为5mm的圆柱形催化剂,求内扩散有效因子。 解: 由已知条件:
T = 300 + 273.15 K = 573.15 K ; P = 7.09 MPa; kVC = 0.09 s −1 ; Deff = 7.04 × 10 − 4 cm 2 / s
P
∗ C4 H 8
⇒P
∗ C4 H 8
=
PC4 H6 PH 2 KP
−5
ka = ,并令ka = k,可得: kd
rC4 H8=
k pC4 H8-pC4 H6 pH 2 / K p) (
1+bC4 H(pC4 H6 pH 2 / K p)+bC4 H6 pC4 H6 8
(1)C为控制步骤
n
rC4 H6=kdθC4 H6 − ka pC4 H6 (1 − ∑θi ) − − − 1
2-12 用空气在常压下烧去催化剂上的积碳,催化剂颗粒直径为 e 1molO 5nm 5nm,颗粒有效导热系数λe=0.35J/(m.s.K),每燃烧1molO2放出 5.4 760 热量5.4 108J,燃烧温度760 ,时,氧在催化剂颗粒内的有效 5.4×10 760℃, 5 10 扩散系数为5×10-7cm2/s /s。试估计定态下,催化剂颗粒表面与中 心的最大温差。 解: 由已知条件:
θ 0.50 1 = DNH 3e = × = 2.54 × 10−4 cm 2 / s δ 2.5 787.32
2-11 求下述情况下,催化剂孔道中的CO的有效扩散系数。已知 气体混合物中各组分的摩尔分数:yH2O=0.50 yCO=0.1 =0.50, =0.1, 400 0.709MPa yCO2=0.06 yN2=0.24; =0.06, =0.24;温度400 400℃,压力0.709MPa 0.709MPa。催化剂平均 10nm 0.50 2.06 直径10nm 10nm,孔隙率0.50 0.50,曲折因子2.06 2.06。 解: d = 2ra = 10 nm = 10 −9 m ⇒ ra = 5 × 10 −9 m = 5 × 10 −7 cm
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1-5 2HCHO C2H2 C4H6O2 ,原料分离回收循环操作,
甲醛初始浓度10%(质量比),出反应器1.6%,丁炔二醇
初浓度0,出口浓度7.65%,求 xA, ,,
xA
nA0 nA nA0
10% 1.6% 10%
0.84
(nP nP0 ) / p (7.65% 0) / (1* MC4H6O2 ) 0.635
ln k2 Ea ( 1 1 ) k1 R T1 T 2
(1)T T 2 T1 8.4oC
T2
1
1 R
ln k 2
T 1 Ea k1
(2)T T 2 T1 12.7o C
若使反应速率提高一倍,活化能愈大,所需提高的温度愈小
2-6 反应温度上升10℃,反应速率加倍,Ea与T之间的关系? 当T1(K)=300、400、600、800和1000K时,求Ea
ln k2 E ( 1 1 ) k1 R T1 T 2
T(K)
300
ln 2 Ea ( 1 1 ) R T T 10
Ea 0.5763T (T 10)
400
600
800
1000
Ea(kJ/mol) 53.59 94.51 210.92 373.43 582.05
第3章 理想间歇反应器
3-1 间歇反应器,n=2,t1=5min时,转化率xA=50%;
3-4 间歇反应器,cA0=1mol/L,t=8min后,xA=0.8;
t=18min后,xA=0.9,求该反应的动力学关系?
cAn01kt
1 n 1
(1
x )1n A
1
t (1 x )1n 1
2
A2
t (1 x )1n 1
1
A1
18 8
(1 (1
0.9)1n 0.8)1n
1 1
n=2
x
c kt A
1 kt ln
1 x A
E
k k exp( a )
0
RT
等温时,k 一定
t 2
ln 1
1 x A2
ln
1
1 99.9%
10
t 1
ln 1
ln 1
1 x
1 50%
A1
3-3 n=1/2,10 min后xA=0.75, 30 min后转化率xA=?
CAn01kt
1 n 1
(1
x )n1 A
xA
dxA
0 kc2A0 (1 xA )( xA )
kcA0
1 (
1)
ln
( xA) (1 xA)
当 5时txA0.5 0.78h, txA0.9 2.78h , txA0.99 5.81h
(令 cB0 ) cA0
当C B0 /C A0 =β 越大,达到相同转化率所需的时间越短; 当C B0 /C A0 不变时,随x A 的增大,所需t 增大,且 x A 越高,t 增加越快
rA
反应转化量 反应时间 反应区
=kCAn
ktcAn01
1 n 1
(1
xA)1n
1
ln k2 Ea ( 1 1 ) k1 R T1 T 2 Ea 67.55 kJ / mol
k2 t1 k1 t2
2-5 C2H4二聚反应:(1) T=200℃,Ea=156.9 kJ/mol; C2H6二聚反应:(2) T=200℃,Ea=104.6 kJ/mol。为使反应 速率加倍,要提高多少温度?
A0
1 x
k 0.5 L / (mol min)
A
3-8 在间歇反应器中进行二级反应 A P ,反应速率为 (-rA )=0.01c2Amol / s
当 c A0 分别为1,5,10 mol/L时,求反应到 cA=0.01 mol/L时,
所需反应时间。并对计算结果进行讨论。
kt 1 1 cA cA0
In
CA0 (CT 0 CA ) CA (CT 0 CA0 )
(CA )opt
CT 0 2
CA0
CP0 2
=
0.65+0.05 = 2
0.35kmol/m3
293K
:0.7k1
2.4=In
0.65(0.7 0.35(0.7
0.35) 0.65)
k1,同理K
求k2
In k2 E ( 1 1 ) E 65.94kJ / mol k1 R T1 T2
t1 9900s
t5 9980s
t10 9990s
对于二级反应,若1/CA>>1/CA0
,
kt
1 cA
反应时间t与反应物初始浓度无关。
3-10
生物化工中胰蛋白原转化成胰蛋白酶时,
dcA dt
kcAcS
在间歇反应实验中测得不同温度下反应速率于某时刻 tMAX
达到最大值
CT 0kt
(CA0
CP0 )kt
1
1
t 30 1 (1 x )2
2 t 10
A2
1
1
1 (1 0.75)2
1
1
C
2 A0
kt
2
1
(1
x )2 Aຫໍສະໝຸດ xA2无解假设xA=1时,时间为t3
1
1
t 1 (1 x )2 1 (11)2
3 t
A3 1
1
1 1 (1 x )2 1 (1 0.75)2
A1
t 20 min 3
30 min后反应物A完全转化,xA=100%
(nA0 nA) / a (10% 1.6) / (2* M HCHO )
xA 0.534 循环操作 0.635
n m w* mtotal MM
第2章 化学反应动力学
2-4 间歇反应器:CA0和xA相同(T1=20℃时,反应时间t1=8d;
T2=120 ℃时,反应时间t2=10min),试估算 Ea
xA )(cB0
cA0xA)
kc
2 A0
(1
x
A
)(
cB0 cA0
xA)
kcA20 (1
xA )(
xA)
当
1时t cA0
xA
dx
0 kcA20 (1 xA )2
1 kcA0
xA (1 xA)
txA0.5 5.31h, txA0.9 47.7h,txA0.99 524.4h
当 1时t cA0
若要xA=75%,需增加多长时间?
x
c kt A
A0
1 x
A
c kt A0 1
x A1
c kt 1 x
A0 2
A1
x A2
1 x A2
t1 1 t2 3
t2 15min
t t2 t1 10min
3-2 n=1,等温,证明xA=99.9%时所需反应时间是xA=50%
时所需反应时间的10倍
3-12 在间歇釜式反应器中进行液相反应 A B P ,测得二级 反应速率常数:61.5102 L / (molgh) , cA0 0.307mol / L,计算当 cB0 / cA0 1和5时,转化率分别为0.5,0.9,0.99时所需的反 应时间,并对计算结果进行讨论。
rA
kcAcB
kcA0 (1
