《动物病毒学实验》课件:实验五 血清中和试验2016-04-12
免疫学课件——第十一章 中和试验PPT幻灯片

免疫学原理与技术
中和指数>50为阳性,10-49为可疑,<10为阴性 3.空斑减少试验
免疫学原理与技术
半数计量的计算:
将病毒液10倍稀释,选择4-6个稀释度接种 试验动物(细胞培养物,鸡胚),每组3-6只(管),观 察一定时间内的死亡(或细胞病变)情况,绘制 表格,计算半数计量.
病毒毒价滴定(接种计量0.1毫升)
病毒稀
观察结果
累计结果
释
CPE数 无CPE
%
CPE数 无CPE CPE率
本法应用空斑技术,使空斑数减少50%的血 清稀释度作为中和滴度.
先将病毒稀释成每一接种计量含100空斑 单位(PFU),加等量稀释的血清,37℃1小时.每一 稀释度接种3个已形成单层细胞的空斑瓶,同时 用同样稀释的病毒加等量的Hanks液作为对照.
免疫学原理与技术
空斑减少法中和试验
病毒稀释液
100PFU/0.5毫升
病毒或毒素与相应的中和抗体结合后,可使 其失去致病能力,此种中和反应有严格的种,型 特异性,而且还可以定量,所以可以定性,定量检 测病毒,毒素或抗体.
中和试验是以病毒或毒素对生物系统的毒 力为基础的,所以首先根据病毒,毒素特性选择 合适的细胞,鸡胚或试验动物,测病毒,毒素对其 毒价,再测抗体中和后的毒价,如果毒价有较明 显的变化,说明抗原,抗体发生了反应,即抗体对 病毒或毒素发生了中和.而且还可以根据毒价 的变化,来判断血清中抗体中和病毒或毒素的 能力—中和价(抗体的定量)
(动物传染病学实验课件)5 临床血清学快速检测技术
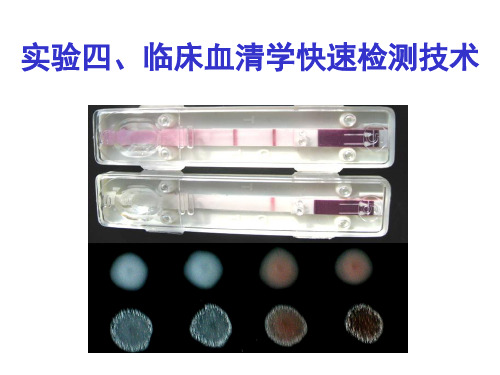
2020/7/25
(四)操作方法
1.在一洁净的玻片的不同位置滴加3滴致敏 乳胶(每滴约20μl)。
2.用移液器分别取20μl的待检血清,滴加到 上述3滴致敏乳胶中,并用枪头混匀。
3.轻轻摇晃玻片,使抗原和血清充分混匀, 静置1-2分钟,观察结果。
2020/7/25
(五)实验注意事项
乳胶凝集试验
一、实验目的 二、实验原理 三、实验材料 四、操作步骤 五、实验注意事项 六、实验结果处理
2020/7/25
(一)实验目的
1.了解并掌握乳胶凝集试验的基本原理。 2.掌握乳胶凝集试验检测细小病毒抗体快速
检测方法的操作方法和结果判定方法。
2020/7/25
(二)基本原理
乳胶凝集试验是以聚苯乙烯乳胶颗粒作为 载体,吸附特定的抗原或抗体,当遇到 血清中相应的抗体或处理过的病料中相 应的抗原成份时,会形成肉眼可见的凝 集颗粒。
1.取不同试剂时应注意更换枪头,防止交叉 污染。
2.混匀过程中,避免阳性对照、阴性对照和 被检样品之间的交叉污染。
2020/7/25
(六)结果判定
乳胶凝集的阴性和阳性反应
2020/7/25
判定标准
++++ 为全部乳胶凝集,颗粒聚集于液#43;+ 为大部分乳胶凝集,颗粒明显,液体稍混浊; ++ 为50%乳胶凝集,但颗粒较细,液体较混浊; + 有极少量的凝集,液体呈混浊; - 呈原有的均匀乳状。
2020/7/25
测定
3.过剩的免疫金复合物继续前 行,至参照区与固相抗小鼠 IgG 结 合 ( 免 疫 金 复 合 物 中 的 单 克 隆 抗 体 为 小 鼠 IgG), 而 显出红色质控线条(R)。
《动物病毒学实验》课件:实验四 病毒TCID50的测定2016-04-05

lgTCID50=距离比例×稀释度对数之间的差 +高于50%病变率的稀释度的对数
=0.8×(-1)+(-6)
=-6.8 TCID50=10-6.8/0.1ml 含义:将该病毒稀释106.8倍接种96孔细胞
培养板,每孔100µl,可使50%接种孔的 细胞发生病变。
问题1:B和C点的距离?
(B-C)
E
F
G
H
2、加100μL稀释后的病毒液
23 4 56 7
89
加100μL维持液
10 11 12
3、加100μL细胞悬液
六、TCID50的计算方法 (Calculation of TCID50)
10-1 10-2 10-3 10-4 10-5 10-6 10-7 10-8
1、Reed-Muench法
如果怀疑病料中有可能有细菌污染建议收毒过程中过滤除菌首先是细胞的透明度降低随后质内颗粒增加且收缩由梭形细胞逐渐变为圆形细胞与细胞之间仅由纤细的细胞间桥连接细胞单层呈网状结构进一步细胞间桥也随之消失细胞脱落
实验四 病毒TCID50的测定
一、实验目的
➢ 了解病毒感染力测定的几种方法 ➢ 掌握病毒接种方法及收毒方法 ➢ 掌握半数细胞培养物感染量(TCID50 )的
病毒液 出现 无CPE 累 计
出现CPE孔
稀释度 CPE孔数 孔数 CPE孔数 无CPE孔数 所占的%
10-1
8
0
51
0
100(51/51)
10-2
8
0
43
0
100(43/43)
10-3
8
0
35
0
100(35/35)
10-4
8
病毒—病毒感染的检测方法(动物微生物课件)
病
毒
红
颗
细
粒
胞
(二)血凝抑制试验(HI)原理:
当病毒悬液(抗原)中加入特异性抗体,且这种抗体的量足以抑制病毒颗 粒的血凝素时,则红细胞表面的受体就不能与病毒颗粒或血凝素直接接触 。这时红细胞的凝集就被抑制,称为红细胞凝集抑制(HI)反应,也称血 凝抑制反应。
(1)免疫凝集电镜技术
抗原与抗体凝集反应后,可使标本中病毒颗粒聚集成 团,再经负染直接在电镜下观察,提高了敏感性,确 定病毒的血清学性质。
(2)免疫电镜定位技术
特异性抗体用电子致密物质,如铁蛋白、过氧化物酶等标 记后,使之与组织超薄切片中的抗原结合,在电镜下观察 到标记物所在位置,即为抗原抗体反应的部位。
++:约有半数红细胞凝集,凝集的红细胞在孔壁上铺成薄膜,面积较 小;未凝集的红细胞(约50%)沉积在孔底中心聚成小圆点。如第一排 第9孔。 +:只有少数红细胞凝集;未凝集的红细胞(约75%)沉积在孔底中心聚 集形成小圆盘状,凝集的红细胞在此小圆盘周围。如第一排第10孔。 -:红细胞不凝集,沉积于孔底,形成一圆盘状或钮扣状,边缘整齐。 如第12孔、11孔。
死体积 液样
活塞 套筒
吸嘴(一次性)
外置活塞式移液器
外置活塞式移液器
这种移液器是采用外置式活塞,活塞设计在吸 头内部,直接与液体接触,活塞与液体之间没 有空气段。
三、 电子显微镜检查
病毒的很多特征如大小、形态、结构等必须借助电 子显微镜进行检查。对于目前尚难培养而形态又非 常典型的病毒,可直接从感染组织或分泌液,或者 接种病料的鸡胚和细胞培养收获的材料作电子显微 镜检查,直接观察病毒粒子。
中和试验

中和试验中和试验是病毒或毒素与相应的抗体结合后,失去对易感动物的致病力的试验方法。
所属分类:免疫学概述动物受到病毒感染后,体内产生特异性中和抗体,并与相应的病毒粒子呈现特异性结合,因而阻止病毒对敏感细胞的吸附,或抑制其侵入,使病毒失去感染能力。
中和试验(Neutralization Test)是以测定病毒的感染力为基础,以比较病毒受免疫血清中和后的残存感染力为依据,来判定免疫血清中和病毒的能力。
两种试验方法介绍中和试验常用的有两种方法:一种是固定病毒量与等量系列倍比稀释的血清混合,另一种是固定血清用量与等量系列对数稀释(即十倍递次稀释)的病毒混合。
(一) 定血清-稀释病毒法(病毒中和试验)1.病毒毒价的测定毒价单位:衡量病毒毒价(毒力)的单位过去多用最小致死量(MLD),即经规定的途径,以不同的剂量接种试验动物,在一定时间内能致全组试验动物死亡的最小剂量。
但由于剂量的递增与死亡率递增不呈线性关系,在越接近100%死亡时,对剂量的递增越不敏感。
而一般在死亡率越接近50%时,对剂量的变化越敏感,故现多改用半数致死量(LD50)作为毒价测定单位,即经规定的途径,以不同的剂量接种试验动物,在一定时间内能致半数试验动物死亡的剂量。
用鸡胚测定时,毒价单位为鸡胚半数致死量(ELD50)或鸡胚半数感染量(EID50)。
用细胞培养测定时,用组织细胞半数感染量(TCID50)。
在测定疫苗的免疫性能时,则用半数免疫量(IMD50)或半数保护量(PD50)。
(1) LD50的测定(以流行性乙型脑炎病毒为例)。
测定方法:将接种病毒,并已发病濒死的小鼠,无菌法取脑组织,称重、加稀释液充分研磨,配制成10-1悬液,3 000r/min离心20分钟,取上清液,以10倍递次稀释成10、10、10……10,每个稀释度分别接种5只小鼠,每只脑内注射0.03ml,逐日观察记录各组的死亡数。
本例高于50%病毒稀释度的对数-6,距离比例为0.5,称释系数的对数为-1。
《动物病毒学》课件:第八章 病毒病的实验室诊断
A
C
O
SAT1
SAT2
SAT3
Asia
serotypes of FMD virus
receptor
receptor binding protein on viral surface
antibodies against receptor binding protein of serotype A will neutralize viruses of serotype A but not of serotype C
病毒理化特性测定的判断标准
➢以试验组的TCID50 (或PFU),比对照组低2个 对数以上判为阳性,1-2个对数之间判为可疑,1
个对数以上判为阴性。
试验组 对照组 结果判定
TCID50/0.1mL 10-2
10-5
10-3.5 10-5
阳性 可疑
10-4.1
10-5
阴性
病毒的数量与感染性的测定
➢ 半数组织培养感染剂量 (50% tissue culture infectious dose ,TCID50 ) 测定病毒能使50%的组织培养细胞发生感染的 最小量
― SDS-PAGE & western blot
针对病毒的 不同编码蛋 白进行检测
―Western-Blotting分子杂交
➢电子显微镜----形态学观察
猪流行性腹泻病毒
Porcine Epidemic Diarrhea Virus (PEDV)
病毒理化特性的测定
➢病毒核酸类型鉴定(药物抑制试验) ➢病毒囊膜的确定(脂溶剂敏感性试验) ➢胰蛋白酶敏感试验 ➢耐酸性试验 ➢耐热性试验 ➢病毒粒子大小测定
中和试验(serum neutralization test,SNT) 补体结合试验(complement fixation test) 血凝抑制试验(Inhibition of hemagglutination) 凝集试验(Agglutination test) 酶联免疫吸附试验
《动物传染病实验》课件:6 快速血清学检测技术

(四)实验方法
1. 在 一 洁 净 玻 片 的 3 个 位 置 滴 加 3滴 致 敏 乳 胶 ( 每 滴 约
20μl)。 2.用移液器分别取20μl的乙型脑炎病毒阳性血清、阴性血
清和被检血清分别滴加到上述3滴致敏乳胶中,并用枪 头混匀。 3.轻轻摇晃玻片,使抗原和血清充分混匀,静置1~2分钟, 观察结果。
溶血反应:将红细胞多次注射于动物(如将绵 羊红细胞多次免疫家兔)可使之产生相应的抗 体(溶血素),这种抗体与红细胞结合,若有 补体存在,则红细胞被溶解,这种现象称为溶 血反应。红细胞和溶血素被称为溶血系统,常 在补体结合反应中用作测定有无补体游离存在 的指示剂。
补体结合反应中的抗体主要是IgG和IgM。该反 应的特点在于补体本身没有特异性,能与任何 抗原抗体复合物结合。
间接凝集反应:将可溶性抗原(或抗体)先吸附于一种与免疫无关的、 一定大小的颗粒状载体的表面,然后与相应抗体(或抗原)作用。在有 电解质存在的适宜条件下,即可发生凝集。(如:乳胶凝集)
补体结合反应:可溶性抗原,如蛋白质、多糖、 类脂质和病毒等,与相应抗体结合后,抗原抗 体复合物可以结合补体,但这一反应肉眼不能 察觉,如再加入红细胞和溶血素,即可根据是 否出现溶血反应来判定反应系统中是否存在相 应的抗原或抗体,称之为补体结合反应。
参与凝集反应的抗原称为凝集原,抗体称为凝集素。
可分为直接凝集反应和间接凝集反应两类。
直接凝集反应 :颗粒状抗原(如细菌、红细胞等)与相应抗体直接结合 所出现的凝集现象。分为玻片法和试管法。 玻片法---定性---用已知抗体检测未知抗原 试管法---定量---用已知抗原来检测受检血清中有无某抗体及抗体的含量
免疫标记技术:是将已知抗体或抗原标记上容易显示的物质,通过检 测标记物来反应抗原抗体反应的情况,从而间接地测出被检抗原或抗 体的存在与否或量的多少。
《动物病毒学实验》课件:实验五 血清中和试验2016-04-12

(4)将培养板放入37℃ 5%CO2培养箱中作用30min60min (5)感作完成后每孔加入100µl细胞悬液,继续置37℃ 5%CO2培养箱培养,逐日观察并记录结果,一般要观察45天,按Reed-Muench两氏法或Karber法进行结果计算
每孔加入100µl细胞悬液
终点法中和试验三分类固定病毒稀释血清法固定血清稀释病毒法蚀斑减数试验交叉保护试验实验动物主动免疫被动免疫根据动物的保护情况进行结果的判定四用途1疫苗免疫原性的评价2免疫血清的质量评价3测定实验动物血清中是否存在抗体4从待检血清中检出抗体或从病料中检出病毒从而诊断病毒性传染病5病毒分离株的鉴定6不同病毒株的抗原关系研究五材料1细胞悬液1瓶2310个ml生长液296孔细胞培养板3加样器移液器吸头4200tcid5001ml病毒液prv5待检血清阴阳性对照血清六固定病毒稀释血清法将不同稀释度的血清与固定量的病毒液50ul200个tcid50eid50或ld5001ml病毒液混合置适当的条件下感作一定时间以后再将血清病毒混合物接种于敏感细胞鸡胚或实验动物测定被检血清阻止组织培养细胞鸡胚或实验动物发生病毒感染的能力及其效价
• 再将血清-病毒混合物接种于敏感细胞、鸡胚或实验 动物,测定被检血清阻止组织培养细胞、鸡胚或实验 动物发生病毒感染的能力及其效价。
• 以能保护50%组织培养细胞、鸡胚或实验动物不发生 病变、感染或死亡的血清最高稀释倍数,作为该血清 的50%中和效价(PD50)
(1)在96孔板上将不同实验组用记号笔进行标记
了多少病毒液(200TCID50 or 100TCID50),为什 么?
每孔用50ul病毒(200 TCID50/0.1ml)接种至各试验孔内 每孔用50ul病毒(100 TCID50/0.05ml)接种至各试验孔内 每孔用100ul病毒(100 TCID50/0.1ml)接种至各试验孔内
动物实验与血清学试验课件

较好的方法。 化学药物致死法
通过注射一定量的化学药物而使动物迅速致死。 例如: 10%氯化钾溶液:静脉注射,用量为犬20~30ml/只,兔5~10ml/只
第二十七页,本课件共有34页
血清学试验
第二十八页,本课件共有34页
第八页,本课件共有34页
豚鼠抓取方法
动物的抓取
家兔的捉持
用一手抓住家兔颈背部皮肤,将兔提 起,另一手托其臀部,使兔呈坐位 姿势。
犬抓取注意点
不要轻易使用长柄铁钳,钳伤造成的伤 害会使它对你更加恐惧,影响以后实验 的进行。
抓取后用绳子将嘴绑住。
第九页,本课件共有34页
家兔的抓取
狗嘴的捆绑方法
二、实验动物的麻醉方 法
第二十五页,本课件共有34页
实验动物的处死方法
1、大鼠小鼠处死方法
颈椎脱臼法
急性失血法
麻醉致死法
断头法
击打法
第二十六页,本课件共有34页
实验动物的处死方法
2、犬、兔、豚鼠处死方法
空气栓塞法
优点:方法简单、迅速, 缺点:动物死于急性循环衰竭,各脏器凝血十分明显。 急性失血法
先行麻醉,再分离颈动脉或股动脉,将一根较粗的塑料管插入动脉内放血。动物在
3. 大动物犬、猴、羊等麻醉前半小时应注射麻醉前给药如阿 托品和苯巴比妥钠。
4. 静脉注射麻醉药是必须缓慢,边注射边观察动物。
5. 在麻醉过程中密切观察动物的反应,动物在麻醉期间体温下降, 应注意保温。
第十四页,本课件共有34页
三、实验动物血液的采集方 法
第十五页,本课件共有34页
实验动物血液的采集方法
血清总补体活性检测(CH50)PPT教案课件(临床免疫学)

1.15
7
0.40
1.10
8
0.45
1.05
9
0.50
1.00
10
--
1.50
溶血素 (ml)
0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5
2.5ml体系
2%SRBC CH50 (ml) (U/ml)
0.5
200
0.5
133
0.5
100
0.5
80
0.5
实验五 血清总补体活性检测 (CH50)
溶血反应
SRBC
+
兔抗SRBC抗体 (溶血素)
+
新鲜血清 (提供补体)
启动经典激活途径
溶血
CH50实验原理
绵羊红细胞(Ag)与溶血素(Ab),在补体(新鲜血清) 的作用下,绵羊红细胞可被溶解,出现溶血现象。
溶血程度与血清中补体量正相关,呈一S形曲线。 在50%溶血附近,稍微改变补体量,溶血程度变化明
⒋ CH50测定
按下表加各试剂→摇匀→37℃水浴30min→离心→ 与50%溶血标准管进行目视及比色比较→计算出 每ml血清中总补体活性(u)。
血清总补体溶血活性测定
管号 1:20稀释血清 B.B液
(ml)
(ml)
1
0.10
1.40
2
0.15
1.35
3
0.20
1.30
4
0.25
1.25
5
0.30
待检血清标本应无溶血、无乳糜、无污染。 缓冲液、致敏SRBC均应新鲜配制,缓冲液若被细
菌污染,会导致自发溶血。 实验所用玻璃器皿,一定要清洁,酸碱均能影响
中和试验(兽医微生物第三版)

中和试验根据抗体能否中和病毒的感染性而建立的免疫学实验称为中和试验。
中和试验极为特异性和敏感,主要用于病毒感染的血清学诊断、病毒分离株的鉴定、不同病毒株的抗原关系研究、疫苗免疫性的评价、免疫血清的质量评价和测定动物血清抗体的检测等。
中和试验的基本过程是,先将抗血清与病毒混合,经适当时间作用。
然后接种于宿主系统检测混合液中的病毒感染力。
宿主系统可以是鸡胚、动物或细胞培养,根据病毒性质而定,目前大多采用细胞中和试验。
最后根据其产生的保护效果差异,可判断该病毒释放已被中和,并根据一定的方法计算出中和的程度(中和指数),即代表抗体的效价。
根据测定方法的不同,中和试验主要有两种。
一是测定能使动物或细胞死亡数目减少至50%(半数保护率,PD50)血清稀释度,即终点法中和实验。
二是测定是病毒在细胞上形成的空斑数目减少至50%时的血清稀释度,即空斑减少法中和试验。
毒素和抗毒素亦可进行中和试验,其方法与病毒的中和试验基本相同。
终点法中和试验本法是滴定使病毒感染力减少至50%的血清中和效价或中和指数。
有固定病毒稀释血清及固定血清稀释病毒两种滴定方法。
固定病毒稀释血清法将抑制的病毒量固定,血清作倍比稀释,常用于测定抗血清的中和抗体效价。
病毒的毒价测定毒力或毒价单位过去多用最小致死量(MLD),即病毒接种实验动物后在一定时间内全部致死的最小病毒剂量。
此法比较简单,但由于剂量递增与死亡率递增的关系不是一条直线,而是呈S形曲线,在愈接近100%死亡时,对剂量的递增愈不敏感。
而死亡率愈接近50%时,剂量与死亡率呈直线关系,故现基本上采用半数致死量(LD50)表示毒价单位。
而且LD50的计算应用了统计学方法,减少了个体差异的影响,因此比较正确。
以感染发病作为指标的,可用半数感染量(ID50);以体温反应作指标者,可用半数反应量(RD50)。
用鸡胚测定时,可用鸡胚的半数致死量(ELD50)或鸡胚半数感染量(EID50);在细胞培养上测定时,则用组织培养半数感染量(TCID50)。
兽医病毒学课件:兽医病毒学实验室技术

• 注意:冻存的细胞在-10℃~-20℃阶段能 在细胞浆内形成冰晶,易损伤细胞,复 苏时要尽快。
• 二、传代细胞的培养
原代细胞长成细胞单层后,将细胞自 玻璃表面消化下来,分装几瓶,可扩大 培养,成为次代细胞。传代细胞也可以 用相同的方法传代和扩大培养。不同类 型的细胞操作步骤基本相同。
• 1 将细胞单层用hank’s液洗涤2次。
• 2 加入0.25%胰酶液和0.2%的EDTA液, 以淹没单层为度。
• 3 在37℃放置8~15min,中途取出,肉眼 或低倍显微镜观察,如细胞单层边缘有 卷起,或细胞间有缝隙,表明消化适度。
• 4 将细胞培养瓶到置,使细胞不接触胰酶, 继续在37℃消化几分钟。
第三讲 原代细胞的培养
• 常用胚胎或幼小动物的组织来制备细胞, 其分裂旺盛,容易生长。应用最广泛的 组织为肾脏、睾丸、肺、皮肤等,鸡胚 组织应用亦十分普遍。
一、鸡胚成纤维细胞
1 鸡胚的处理 (1)取9~11日龄的鸡胚,在气室部位用5%碘 酊消毒,剪去该部位的蛋壳和卵膜。(2)用 眼科弯头镊子撕破尿囊膜和羊膜,取出鸡胚, 至平皿内。 (3)剪去头、脚、翅、内脏,以Hank’s液洗 去血液。 (4)移入25ml的三角烧瓶内,用外科剪剪成 1~2mm3的小块。
• 使用前要灭能,55℃水浴作用30min即可。
• 使用量:多数细胞用10%,维持液用 2~5%即可。
九 、抗生素
主要抑制细菌等微生物的生长。
1 青霉素 主要抑制革兰氏阳性菌。一般 配成10000u/ml,使用时在营养液中加入 1%,使最终浓度为100u/ml。
2 链霉素 主要抑制革兰氏阴性菌。一般 配成10000ug/ml,使用时在营养液中加 入1%,使最终浓度为100ug/ml。
《动物传染病学》课件:快速血清学检测技术

HA NA NP
型
普通乳胶:依靠物理吸附发生致敏。
羧化乳胶:通过化学发应在乳胶颗粒和致 敏原之间形成酰氨键,发生化学偶联致敏 乳胶,从而更稳定。
双色乳胶:缓冲液和乳胶颗粒为不同的颜 色,结果更易于观察。
(三)实验材料
1.洁净玻片 2.枪头 3. 乙型脑炎病毒致敏乳胶 4. 乙型脑炎阳性、阴性血清 5.被检血清
乳胶凝集检测乙型脑炎抗体
一、实验目的 二、实验原理 三、实验材料 四、实验方法 五、注意事项 六、结果判定
(一)实验目的
1.了解并掌握乳胶凝集试验的基本原理。 2.掌握乳胶凝集试验检测乙型脑炎病毒抗体
的操作方法和结果判定。
(二)实验原理
乳胶凝集试验是以聚苯乙烯乳胶颗粒作 为载体,吸附特定的抗原或抗体,当遇到血 清中相应的抗体或处理过的病料中相应的抗 原时,会形成肉眼可见的凝集颗粒。
3.特异性好:因为该技术大多用于单克隆抗体标 记,这决定了它具有很好的特异性。
胶体金快速诊断技术的应用
1.病毒性疾病:传染性法氏囊病、禽流感、新 城疫、犬细小病毒、猪瘟等。
2.寄生虫疾病:血吸虫病、旋毛虫病、囊虫病、 恙虫病。
3.细菌性疾病:霍乱弧菌、类鼻疽。
思考题
如何通过免疫胶体金层析技术检测H5 或H9亚型禽流感病毒?
Nitrocellulose Membrane
Backing
将特异性的抗体以条带状固定在膜上,胶体金标 记试剂(抗体或单克隆抗体)吸附在结合垫上;
当待检样品加到试纸条一端的样本垫上后,通过 毛细作用向前移动,溶解结合垫上的胶体金标记 试剂后相互反应;
再移动至固定的抗体的区域时,待检物与金标试 剂的结合物又与之发生特异性结合而被截留,聚 集在检测带上,可通过肉眼观察到显色结果。
动物病毒学讲稿(内附5种实验具体步骤)

《动物病毒学》实验课讲稿任课教师:方六荣讲课对象:2002级动物医学专业1-4班讲课时刻:2004.09-2005.01目录实验一鸡胚接种 (1)实验二传代细胞培育与病毒在传代细胞中的培育 (6)实验三原代细胞培育 (9)实验四病毒TCID50的测定 (11)实验五中和实验 (13)实验一鸡胚接种一、实验目的了解鸡胚的大体结构与功能及鸡胚接种的方式,把握经常使用的鸡胚接种方式。
二、鸡胚接种的作用要紧用于:①分离病毒,并依照病变初步鉴定病毒②培育病毒,制造抗原和疫苗③测定各毒株之间的抗原关系(用鸡胚作中和实验和交叉爱惜实验)④测定病毒毒力三、材料1、鸡胚10日龄2、病毒鸡传染性支气管炎病毒(IBV)3、照蛋灯4、打孔器5、石蜡6、注射器7、蛋座8、酒精棉球、碘酊棉球四、鸡胚用于病毒培育的优缺点(一)优势1、组织分化程度低2、可选择不同的日龄和接种途径3、病毒易于增殖4、感染病毒的组织和液体中含大量病毒5、容易搜集和处置6、来源充沛7、设备和操作简便易行(二)缺点1、胚内可能污染细菌和病毒沙门氏菌、禽白血病病毒、新城疫、禽脑脊髓炎病毒2、母源抗体3、许多病毒在鸡胚中增殖缺乏特异性的感染指针五、鸡胚的结构与功能1、卵壳上有细孔,进行气体互换2、壳膜使气体分子和液体分子在内外两方面进行互换。
3、气室呼吸和调剂压力4、绒毛尿囊膜起胚胎呼吸器官的功能,氧气的互换是在膜的血管内通过卵壳孔而进行的。
5、尿囊腔胚胎的排泄器官,内含有尿囊液,初为透明液体,是单纯生理盐溶液,以后尿囊液中尿酸盐迅速增加,胚胎发育到第12-13天后,尿囊液开始变得混浊。
6、羊膜与羊膜腔其中盛有羊水,胎体浸泡于其中7、卵黄在胚胎发育初期供给鸡胚营养。
8、卵白在胚胎发育晚期供给鸡胚营养。
六、受精卵的选择1、最好是来自SPF鸡群,以降低母源抗体的阻碍。
2、受精卵的壳最好是白色的,以便于检卵。
3、受精卵必需新鲜,保留在5-20℃不要超过10天,保留一个月的受精卵,孵化率快要于零。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
三、分类
➢终点法中和试验
✓固定病毒—稀释血清法 ✓固定血清—稀释病毒法
➢蚀斑减数试验
➢交叉保护试验
实验动物
主动免疫 被动免疫
攻毒
根据动物的保护情况进行结果的判定
四、用途 1、疫苗免疫原性的评价 2、免疫血清的质量评价 3、测定实验动物血清中是否存在抗体 4、从待检血清中检出抗体,或从病料中检
出病毒,从而诊断病毒性传染病 5、病毒分离株的鉴定 6、不同病毒株的抗原关系研究
注意:第5、1112列不加病毒, 补加生长液
(4)将培养板放入37℃ 5%CO2培养箱中作用30min60min (5)感作完成后每孔加入100µl细胞悬液,继续置37℃ 5%CO2培养箱培养,逐日观察并记录结果,一般要观察45天,按Reed-Muench两氏法或Karber法进行结果计算
每孔加入100µl细胞悬液
五、材料 1、细胞悬液1瓶(2-3×105个/ml)、生长
液 2、96孔细胞培养板 3、加样器/移液器、吸头 4、200TCID50/0.1mL病毒液(PRV) 5、待检血清、(阴阳性对照血清)
六、固定病毒—稀释血清法
• 将不同稀释度的血清与固定量的病毒液(50ul 200 个TCID50、EID50或LD50/0.1mL病毒液)混合,置 适当的条件下感作一定时间以后
七、结果判定
A
B
接种PRV后不同时间的PK-15
首先是细胞的透明度降低,随后质内颗粒增加且收缩, 由梭形细胞逐渐变为圆形,细胞与细胞之间仅由纤细的细 胞间桥连接,细胞单层呈网状结构,进一步细胞间桥也随 之消失,细胞脱落。
Reed-Muench两氏法
lgPD50=高于50%保护率的血清稀释度的对数+距离比例×稀释度对数的差 =-1.2+0.33×(-0.3)=-1.299
了多少病毒液(200TCID50 or 100TCID50),为什 么?
每孔用50ul病毒(200 TCID50/0.1ml)接种至各试验孔内 每孔用50ul病毒(100 TCID50/0.05ml)接种至各试验孔内 每孔用100ul病毒(100 TCID50/0.1ml)接种至各试验孔内
➢ 如何判断接种病毒量是否正确?
实验五 血清中和试验
一、实验目的 了解中和试验的基本原理和几种不同的
测定方法,掌握固定病毒—稀释血清法的 操作步骤和计算方法及含义。
二、原理
中和抗体与相应的病毒粒子特异性地结合, 使后者丧失感染能力。
中和抗体是当病原微生物侵入机体时会产 生相应的抗体,能够与病原微生物表面的抗 原结合,从而阻止该病原微生物黏附靶细胞 受体,防止侵入细胞。
(2)每孔加入50µl生长液 每孔加入50µl生长液
(3) A1-A5每孔加入50 µl待检血清(同一份血清), 分别倍比稀释至H1-5(一排一排稀释,不用换吸头)
(3)将200个TCID50的病毒液十倍稀释至0.2个TCID50,第1-4列 每孔加入50 µl 200个TCID50的病毒液,第6-9列分别加入50 µl 200/20/2/0.2 TCID50病毒液,第5、11、12列补加50 µl 生长液。
➢蚀斑减数试验
PD50=-1.299的反对数=0.05=1/20
即1:20稀释的待检血清可保护50%的组织培养细胞免于出现 CPE
八、注意事项
➢ 无菌操作,生物安全,移液器使用规范 ➢ 病毒稀释要换吸头,从低浓度病毒液加到高浓度
病毒液 ➢ 细胞一定要混匀,悬空加入,不要碰到待检血清
或者病毒液 ➢ 96孔板放入含5%CO2的培养箱 ➢ 5个孔的待检血清必须要来自一份血清样品,血
• 再将血清-病毒混合物接种于敏感细胞、鸡胚或实验 动物,测定被检血清阻止组织培养细胞、鸡胚或实验 动物发生病毒感染的能力及其效价。
• 以能保护50%组织培养细胞、鸡胚或实验动物不发生 病变、感染或死亡的血清最高稀释倍数,作为该血清 的50%中和效价(PD50)
(1)在96孔板上将不同实验组用记号笔进行标记
清一般需要56℃灭活30min
待检血清毒性对照
serum 1:2 1:4 1:8 1:16 1:32 1:64 1:128 1:256
待检血清
病毒对照
0.2TCID50 2TCID50 20TCID50 200TCID50
阳阴 性性 血血 清清 对对
细 胞 对 照
照照
九、思考题
➢ 血清中和实验的原理及用途 ➢ 血清中和实验要设置哪些对照?其意义是什么? ➢ 以下三种表述有区别吗?实验组中每孔实际加入
