氮的氧化物溶于水的计算
氮氧化物溶于水的计算

考试指导
氮 的氧化物或 氮氧化物 与其他气 体混 合物溶于 水, 涉及多步反应叠加或循环反应 , 是化学 中的难 点 内容 , 现将有关氮氧化物 溶于水 的计算 规律 总结 如
下:
“ O + 0 0 型 或“ O +x(x为不 参加 反 N . 2” z N2 应 的气 体 ) 2 ” +H 0 型 有 关 反 应 :N . H 0 = 2 N  ̄ N 3O + e z HO+ O
解析 : 因混 合气体 中 N 不 参与 反应 , 2 故可依 据 下列反应计算 , 设总体积为 ,
3N 2 2 o +H 0:2 N 3 O AV H 0 +N
3 3 4 / 3一 l x/ 2
则 N 为 : / , 氮 气 和二 氧化 氮 的体积 比为 2 x4 故 13选 C :, 。
A B c D . . . . { 号 吉 詈
: 设原混合气体 总体 积为 8 , 按反应④ , V 为 0, 2体积 为 , C 选 。 ( 作者 单位 : 河南省范县第一 中学)
一
、
计算方法 : 差量法。 、 例 1 一定条件下 , . 将盛 有氮气和二氧化氮 混合 气体 的试管倒立 于水 中 , 经过足够时间后 , 试管 内气 体体积缩小为原体 积 的一半 , 混合 气体 中氮气 和 则 二氧化氮 的体积 比是 ( )
A. : 1l B. : 12 C. : 13 D. l 3:
ቤተ መጻሕፍቲ ባይዱ
全反 应 , 无气体剩余 ;
() ( O/ 0) :, 2 V N ) ( 2 <4 3 按反应 ④ , 2 0 过量 , 剩
( ) ( O / 0 ) : , 反 应 ④ , O过 量 , 3 V N ) ( 2 >4 3按 N 剩
(完整word)关于氮的氧化物溶于水的计算小节

关于氮的氧化物相关计算总结摘要:NO 2、NO 、O 2混合气体,通入水中充分反应后求剩余气体的体积,或根据反应前后气体的体积变化求原混合气体的组成,是高考中气体的计算的重点、难点、热点。
计算时应抓住反应规律,依据具体反应,利用关系式法、差量法、电子守恒法等方法进行求解。
关键词:氮的氧化物 NO 2 NO 关系式法 差量法 电子守恒法NO 2、NO 、O 2混合气体,通入水中充分反应后求剩余气体的体积,或根据反应前后气体的体积变化求原混合气体的组成,是高考中气体的计算的重点、难点、热点。
计算时应抓住反应规律,依据具体反应,利用关系式法、差量法、电子守恒法等方法进行求解。
1。
关系式法计算时经常用到的四个重要化学方程式:3NO 2+H 2O==2HNO 3+NO ① 2NO+O 2==2NO 2 ②将化学方程式①、②叠加得:4NO 2+O 2+2H 2O==4HNO 3 ③ 4NO+3O 2+2H 2O==4HNO 3 ④利用化学方程式③解答NO 2、O 2混合气体溶于水的计算有三种类型: (1)当V NO2∶V O2=4∶1,完全反应,无气体剩余;(2)当V NO2∶V O2<4∶1,O 2过量,剩余O 2; (3)当V NO2∶V O2>4∶1,NO 2过量,剩余NO.利用化学方程式④解答NO 、O 2混合气体溶于水的计算也有三种类型:(1) 当V NO ∶V O2<4∶3时,O 2过量,剩余O 2; (2) 当V NO ∶V O2=4∶3时,完全反应,无气体剩余; (3)当V NO ∶V O2>4∶3时,NO 过量,剩余NO.2。
差量法NO 2溶于水转变成硝酸时体积会减小,利用期反应前后体积的变化量可进行计算。
例1 将盛有N 2和NO 2混合气体25mL 的量筒倒立于水槽里,过一段时间后,气体体积缩小到15mL ,后不再变化(同温同压下),原混合气体中N 2和NO 2的体积比是 [ ] A .4∶1 B .2∶3 C .1∶4 D .2∶1解析 :混合气体中的N 2既不溶于水,也不与水反应,只有NO 2溶于水 3NO 2+H 2O==2HNO 3+NO △V 3 1 3—1=2 x 25—15=10答案为B 。
氮的氧化物溶于水的计算

氮的氧化物溶于水的计算氮的氧化物指的是氮与氧元素形成的化合物,包括一氧化氮(NO)、二氧化氮(NO2)和三氧化二氮(N2O3)。
这些化合物在大气中存在,并且会溶解于水中,通过以下计算可以了解氮的氧化物在水中的溶解性和相关的化学反应。
首先,我们来讨论一氧化氮(NO)。
一氧化氮是一种无色气体,其溶解度随温度和帕斯卡定律成正相关。
根据Henry定律,气体在液体中的溶解度与气体分压成正比。
换句话说,溶解度可以通过气体的分压来确定。
NO在水中的溶解度可以通过以下公式计算:溶解度(mol/L) = K * P其中,K是Henry定律的Henry常数,P是NO的分压。
当NO的分压为1 atm时,其在25°C下的溶解度约为0.0013 mol/L。
随着温度的升高,溶解度会增加,因为温度升高会使气体分压增加。
接下来,我们转向二氧化氮(NO2)。
二氧化氮是一种红棕色气体,其在水中会发生一系列复杂的反应。
首先,二氧化氮会与水反应生成硝酸(HNO3)和亚硝酸(HNO2):2NO2+H2O->HNO3+HNO2其中,硝酸是一种强酸,亚硝酸是一种较弱的酸。
此外,二氧化氮还可以通过以下反应转化为一氧化氮:2NO2<->2NO+O2最后,我们来讨论三氧化二氮(N2O3)。
N2O3+H2O->2HNO2与二氧化氮类似,硝酸是一种强酸,亚硝酸是一种较弱的酸。
总结起来,氮的氧化物在水中会发生一系列的化学反应,包括一氧化氮的溶解、二氧化氮和三氧化二氮的与水反应。
这些反应导致水溶液中存在硝酸和亚硝酸,这些化合物在环境中有重要的生物地球化学循环作用。
然而,需要注意的是以上只是理论计算,实际情况可能受到多种因素的影响,包括温度、压力、其他溶质的存在等。
因此,在实际实验中需要综合考虑这些因素来确定氮的氧化物在水中的溶解度和化学反应行为。
高中化学必修1:微专题八 氮氧化物与氧气和水反应相关计算的三种类型

一、NO 2和O 2的混合气体通入水中的计算由3NO 2+H 2O===2HNO 3+NO 和2NO +O 2===2NO 2可得总反应式4NO 2+O 2+2H 2O===4HNO 3,由此可知:V (NO 2)∶V (O 2)⎩⎪⎨⎪⎧=4∶1,恰好完全反应,无气体剩余<4∶1,O 2过量,剩余气体为O 2>4∶1,NO 2过量,剩余气体为NO1.在标准状况下,将O 2和NO 2按1∶4的体积比充满干燥烧瓶,把烧瓶倒置于水中,瓶内液体逐渐上升,假设烧瓶内溶液不扩散,最终烧瓶内溶液里溶质的物质的量浓度为( ) A.114mol·L -1 B.45mol·L -1 C.128 mol·L -1 D.142mol·L -1 [答案] C[解析] 设烧瓶的体积为V L ,由4NO 2+O 2+2H 2O===4HNO 3以及O 2和NO 2的体积比为1∶4,知NO 2的体积为45V L ,所以最终液体充满整个烧瓶,溶液的体积为V L ,NO 2的物质的量为45V L 22.4 L·mol -1=128V mol ,所以硝酸的物质的量浓度为128V mol V L =128 mol·L -1。
2.一定条件下,将充满二氧化氮和氧气的试管倒立于水槽中,充分反应后,剩余气体体积为原混合气体体积的18,则原混合气体中二氧化氮和氧气的体积之比可能是( )A.8∶1B.7∶3C.7∶2D.4∶1 [答案] B[解析] 反应为4NO 2+O 2+2H 2O===4HNO 3,设原气体体积为8 L ,则剩余气体为1 L ;若剩余1 L 气体为氧气,V (NO 2)=⎝⎛⎭⎫45×7L ,V (O 2)=⎝⎛⎭⎫15×7+1L ,二者体积比为7∶3。
若剩余1 L 气体为一氧化氮,上述反应后应剩余3 L 二氧化氮,可得V (NO 2)=⎝⎛⎭⎫3+45×5L ,V (O 2)=⎝⎛⎭⎫15×5L ,二者体积比为7∶1。
氮的氧化物溶于水的计算

V(NO):V(O2) > 4︰3,NO过量剩余气体为 过量剩余气体为NO ︰ , 过量剩余气体为
<4︰3, O2过量,剩余气体为 2 ︰ , 过量,剩余气体为O
氮 的 氧 化 物 溶 于 水 的 计 算
值得注意的是: 4NO2+O2和4NO+3 O2从组成上均相当与 值得注意的是: 的组成。 )、(3 2N2O5的组成。即(2)、(3)两种情况中的总反应式都 等效。这不仅是记忆( )(3 与N2O5+ O2 2HNO3等效。这不仅是记忆(2)(3)二式的 方法,也为上述问题的解决提供了新的思路。 方法,也为上述问题的解决提供了新的思路。即利用混合 气体中N 原子个数比进行分析判断: 气体中N、O原子个数比进行分析判断:
<2︰5 ︰ N︰O ︰ =2︰5 ︰ <2︰5 ︰
O2剩余 完全反应 NO剩余 剩余
氮 的 氧 化 物 溶 于 水 的 计 算
练习1. NO2装满一 练习 烧瓶,倒置于水槽中, 烧瓶,倒置于水槽中, 所得溶液的物质的量 浓度是多少? 浓度是多少?
氮 的 氧 化 物 溶 于 水 的 计 算
标准状况下, 例2. 标准状况下,将盛有等 体积的NO2与O2的试管,倒立 的试管, 体积的 于水槽中,反应后, 于水槽中,反应后,试管内液 体上升的高度大约是试管体积 的几分之几? 的几分之几?得到溶液的物质 的量浓度为多少? 的量浓度为多少?
氮的氧化物溶于水的计算
(1) NO2或NO2与N2(非O2)的混合气体溶于水时 可依据: 可依据:3NO2+H2O = 2HNO3+NO利用气体体 利用气体体 积变化差值进行计算。 积变化差值进行计算。 (2) NO2和O2的混合气体溶于水时, 的混合气体溶于水时, 由 4 NO2+ O2 +2H2O =4HNO3可知,当体积比 可知, =4︰1,恰好完全反应 =4︰1,恰好完全反应
氮的循环(一)

氮的循环(一)一、氮在自然界中循环1、氮的固定使空气中游离态的氮转化为含氮化合物的过程叫氮的固定,简称固氮。
正是通过氮的固定,开始了氮在自然界中的循环,氮的固定有自然固氮和人工固氮两种方式。
2、自然固氮(1)生物固氮:大豆、蚕豆等豆科植物的根部含有根瘤菌,能把空气中的N2转变为硝酸盐,被植物吸收。
故豆类植物不需要施用氮肥,这种固氮方式占整个自然固氮的90%。
(2)高能固氮:通过闪电等高能量途径把N2固定的方式为高能固氮。
涉及到的反应主要有:N2+O22NO 2NO+O2=2NO2 3NO2+H2O=2HNO3+NO可知,N2最终变成HNO3,即正常的雨水略呈酸性。
HNO3与土壤中的矿物作用,得到硝酸盐,被植物吸收,这就是“雷雨发庄稼”的科学道理。
3、人工固氮人们在工业生产中把N2转化为氮的化合物的方法为人工固氮,又叫工业固氮。
常见的方法有:(1)N2与H2合成NH3:,该反应为工业制HNO3的基础反应。
(2)仿生固氮:用某些金属有机化合物做催化剂,实现常温、常压固氮,这些金属有机物类似于根瘤菌,故又叫仿生固氮,这是目前科学界较为关注的研究性课题。
4、氮在自然界中的循环人们在生产活动中也涉及到了氮的循环,其中主要是利用N2与H2合成工业中重要的生产原料——NH3,即人工固氮。
涉及到两种很重要的物质:NH3、HNO3。
二、氮循环中的重要物质及其变化1、氮气,常况下是一种无色无味的气体,难溶于水,通常无毒。
氮气占空气体积总量的78.12%,是空气的主要成份。
氮气的化学性质很不活泼,只在特殊条件下,才能以下反应。
①与氧气反应:通常状况下氮气和氧气不反应,但在放电条件下,却可以直接化合生成NO 。
反应的化学方程式为:★N 2+O 2闪电2NO反应的化学方程式为:★N 2+ 3H 2 2NH 3 此反应是工业合成氨的反应③与金属镁反应:金属镁可以在氮气中燃烧,生成氮化镁。
反应的化学方程式为:★3Mg+N 点燃 Mg 3N 2(氮化镁)2、氮的氧化物(1)氮的氧化物简介:氮元素有+1、+2、+3、+4、+5五种正价态,对应有六种氧氮氧化物都具有不同程度的毒性,它们也是是常见的大气污染物,以一氧化氮和二氧化氮为主的氮氧化物是形成光化学烟雾和酸雨的一个重要原因。
2021-2022学年人教版化学必修一课时训练24氮和氮的氧化物大气污染 Word版含答案

课时训练24氮和氮的氧化物大气污染一、NO、NO2的性质1.下列关于NO的叙述中正确的是()A.NO是红棕色气体B.常温常压下,NO不能与空气中的氧气直接化合C.含等质量氧元素的NO和CO的物质的量相等D.NO易溶于水,不能用排水法收集解析:本题考查的是NO的性质,要留意分清NO与NO2性质的差异。
答案:C2.农业上有一句俗语“雷雨发庄稼”,该过程发生的下列变化中不正确的是()A.N2+2O22NO2B.3NO2+H2O2HNO3+NOC.2NO+O22NO2D.HNO3与土壤中的矿物作用生成硝酸盐解析:在放电条件下,N2和O2反应生成NO,不是NO2。
答案:A3.下列说法中,正确的是()A.NO2能与水反应生成硝酸,故NO2为酸性氧化物B.可用排空气法收集NO和NO2C.NO2与溴蒸气的鉴别可用NaOH溶液,溶于NaOH溶液得无色溶液的是NO2,得橙色溶液的为溴蒸气D.NO2是大气污染物之一解析:NO2与水反应生成硝酸和NO,NO2不是酸性氧化物,A错误;NO与空气的密度接近且NO能与氧气反应,不能用排空气法收集,B错误;NO2、溴蒸气分别与NaOH溶液作用均得无色溶液,所以NaOH溶液无法将NO2与溴蒸气区分开,C错误。
答案:D4.关于二氧化硫和二氧化氮的叙述正确的是()A.两种气体都是无色、有毒的气体,且都可用NaOH溶液吸取以消退对空气的污染B.二氧化硫与过量的二氧化氮混合后通入水中能得到两种常用的强酸C.两种气体都具有强氧化性,因此都能够使品红溶液褪色D.两种气体溶于水都可以与水反应,且只生成相应的酸解析:二氧化氮和二氧化硫都是酸性氧化物,均能与NaOH溶液反应。
二氧化硫的漂白原理是SO2能与有机色质发生化合反应。
二氧化硫不具有强氧化性。
答案:B二、氮的氧化物溶于水的计算5.将15 mLNO和15 mLNO2的混合气体,通入倒置水槽布满水的试管中,最终在试管中能收集到的气体体积为()A.20 mLB.15 mLC.10 mLD.5 mL解析:本题涉及的化学反应为3NO2+H2O2HNO3+NO,15mLNO2溶于水生成5mLNO,故最终在试管中收集到20mLNO。
氮的氧化物溶于水的计算
B.NO2:27mL;O2:3mL
C.NO2:15mL;O2:15mL
D.NO2:25mL;O2:5mL
三、合作探究(时间9分钟)
(先独立思考,之后小组合作完成)
探究1、
(2011年邵阳模拟)如图所示,相同条件下,两个容积相同的试管分别装满NO2和NO气体,分别倒置于水槽中,然后通过导管缓慢通入氧气,边通边慢慢摇动试管,直到两个试管内充满液体。假设试管内的溶质不向水槽中扩散,则两个试管内溶液物质的量浓度之比为()
N(N)∶N(O)
知识点3:电子守恒法
当NO2或NO转化为HNO3时要失去电子,若上述两种气体与O2混合通入水中时,O2得电子,且得失电子数必然相等,这是电子守恒法解答此类题目的依据。
典例1:
将30mL NO2和O2的混合气体通入倒置于水槽且装满水的量筒中,充分反应后,量筒内剩余5mL气体,则原混合气体的体积组成是()
A.1∶1B.5∶7
C.7∶5 D.4∶3
探究2、
在一定条件下,将充满NO2和O2的试管倒立于水槽中,充分反应后,剩余气体的体积为原混合气体体积的1/8,则原混合气体中NO2和O2的体积之比是()
A.8∶1B.7∶3
C.7∶1D.4∶1
探究3:(1)无色的混合气体A,可能含有NO、CO2、NO2、NH3、N2中的某几种。将100 mL A气体经过如图实验处理,结果得到酸性溶液,而几乎无气体剩余。
②A气体的体积是____________。
③V的取值范围:____________。
解析:(1)无色气体故无NO2,最后水充满集气瓶,无气体剩余,则无N2。通过浓H2SO4气体减少20 mL(NH3),通过Na2O2气体变红棕色,则含NO和CO2且由6CO2~3O2~4NO可求பைடு நூலகம்体积。
关于氮氧化物溶于水

7、将amLNO、bmLNO2、xmLO2混 合于同一试管里,将试管口倒插入水 中,充分反应后试管内气体消失,则 x对a、b的函数关系式f[x(a、b)]是 A. (a+b)/2 C. (3a+b)/4 B. (2a+b)/3 D. (4a+b)/5
C(HNO3)=1/39.2 mol/L
例4 将体积为10mL的试管倒置于盛水的水槽中, 先向试管中注入一定量的NO,再通入O2,两种气 体共为10mL,水面逐渐上升,至余3mL气体时为 止。求 (1)原混合气体中NO和O2各多少毫升? (2)通入O2为多少毫升时,使管内的气体仍为 10mL? (3)通入O2为多少毫升时,使管内的气体与原 N现用向上排空气法收集 NO2,并将收集 NO2后的集气瓶倒置于水槽中,反应停 止后,一部分水进入集气瓶,形成稀硝酸(假设溶质不 向外扩散)(气体体积在标准状况下测定,空气中N2、 O2体积比为4:1,其他成分忽略不计,不计2NO2 N2O4) (1)当收集到的NO2为amL时,所得HNO3的物质的量浓度 为_____。 (2)若与水作用后,集气瓶中余下的气体全部是N2时, 原来收集到的NO2的体积为__________。 (3)若与水作用后,集气瓶中余下的气体是N2和O2时, 则原来收集到的NO2的体积V的范围是__________。 (4)若收集到的NO2体积为3a/4mL,计算所得硝酸的物质 的量浓度。
例题
把10mLNO、NO2的混合气体通 入倒立在水槽的盛满水的量筒中,
片刻以后量筒里留下5mL气体。求
原混合气体中NO、NO2的体积。
V(NO2)=7.5mL V(NO)=2.5mL
氮的氧化物溶于水生成硝酸的浓度计算

杨香涛
24 4 2 11
2 NO和 O 2混合 溶 于水 生成 硝 酸 例 2 在 标 准 状 况 下 将 NO与 O ,以 4: 3 的体 积 比充 人 一 干 燥 烧 瓶 后 倒 立 水 槽 中 , 液 体 逐 渐 上 升 至 烧 瓶 底 部 , 最 后 进 入 烧 瓶 中 求 溶 液 的物 质 的 量浓 度 ? 解析 : 标 准 状 况 下 气 体 的 体 积 比 等 于 在 其 物 质 的量 之 比 , 因此 设 NO 的 物 质 的 量 为 4 则 O2 物 质 的量 为 3 又 根 据 2 x, 的 X, NO +
河 北理 科 教 学研 究
问题 讨 论
( HN03 ):4X +2X :6Xmo l
因 为 硝 酸 溶 液 的体 积 等 于 气 体 体 积 的减 少 , 以 C( 所 HNO )= i s
o‘ lL
根 据 题 意 : 瓶 的体 积 等 于 溶 液 的体 积 , 烧
得
C Na 第 2 = 。l ( O= H ) _ m_ 4 l 『
说明 :
1 的体 积 比充 人 一 干燥 烧 瓶 后 倒 立 于 水 槽
中, 液体 逐 渐 上 升 至 烧 瓶 底部 , 最 后 进 入 烧 求
瓶 中溶 液 的物 质 的 量 浓 度 ?
( ) 2气 体 中 如 果 混 有 如 N2 NO 稀 1 NO 、
有气 体等不溶 于 水 的气体 , 们生 成 硝酸 溶 它 液的物质的量浓度不 变 , 为 仍 mn‘ ~. L I
=
44 8 × 1 3 0 L
说 明 : 要 是 NO 与 0 只 2混 合 溶 于 水 , 不 管 是 NO 过 量 , 是 0 还 2过 量 , 们 生 成 硝 酸 它
氮氧化物溶于水的计算
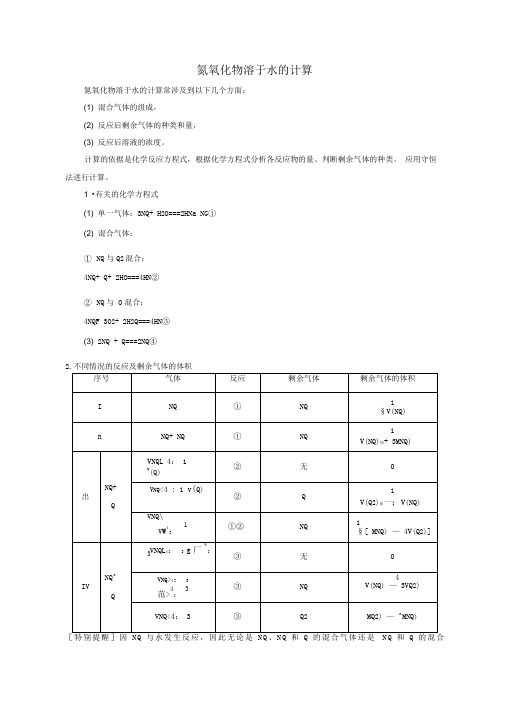
氮氧化物溶于水的计算氮氧化物溶于水的计算常涉及到以下几个方面:(1) 混合气体的组成,(2) 反应后剩余气体的种类和量,(3) 反应后溶液的浓度。
计算的依据是化学反应方程式,根据化学方程式分析各反应物的量、判断剩余气体的种类。
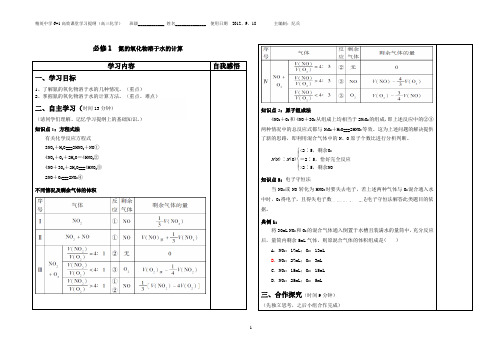
应用守恒法进行计算。
1 •有关的化学方程式(1) 单一气体:3NQ+ H2O===2HNa NG①(2) 混合气体:①NQ与Q2混合:4NQ+ Q+ 2HO===4HN②②NQ与 O混合:4NQF 3O2+ 2H2Q===4HN③(3) 2NQ + Q===2NQ④2.不同情况的反应及剩余气体的体积气体通入水中,最终剩余气体都不能是NQ。
[例]用排水法收集12 mL NO 于试管中,然后向倒立于水槽中的该试管内间歇地通入 Q 共12 mL,下面的说法中,正确的是 ()A 剩余NO B. 剩余NOC. 试管中气体为红棕色D. 试管内气体先变为红棕色,后红棕色消失,反复几次,最后剩余无色气体 [解析]向NO 中间歇通入 Q 发生的反应为 2NOF Q===2NO ① 3NO+ H2O===2HNa NO ②由①X 3 + ②X 2 得:4NO^ 3Q + 2H 2O===4HNO 等体积的NO 和Q 反应最终剩余Q 。
[答案]D(无色)(红棕色)(无色)1.在NO 被水吸收的反应中,发生还原反应的物质和发生氧化反应的物质的质量比为 ()A 3 : 1B . 1 : 3 C. 1 : 2D . 2 : 3+4 +5+2解析:3NQ+ HO===2HJO>+ NO,3 mol NO 中,有2 mol 氮的价态升高,1 mol 氮的价态降低, 所以发生还原反应的 NO 与发生氧化反应的 NO 的质量比为1 : 2。
答案:C2 .标准状况下,将 NO 和Q 按体积比4: 3混合后充入干燥烧瓶中,然后将烧瓶倒立于水中 使其充分反应,则烧瓶内溶液中溶质的物质的量浓度为( )解析:此类题目可用赋值法来解。
氮的氧化物溶于水的有关计算

反馈练习1: 把试管中装有的9mL NO气体倒立于水槽中,逐 渐通入O2,当试管中剩余气体为3mL时,通入O2的体 积可能是(BD ) A.9ml B.4.5ml C.3ml D.9.75ml
反馈练习2:在标况下,把一个50mL量筒装满水, 倒 置于水槽中,先通入10mLNO,然后通入20mLO2,问最 后剩余气体为多少? 解:4NO + 3O2 + 2H2O = 4HNO3 4mL 3mL X=7.5mL 10mL x 现有氧气20mL,所以O2过量, 应根据NO的体积计算,剩余氧气有12.5mL.
二、NO2 和 O2 混和气体溶于水的反应 4NO2+2H2O+O2=4HNO3 V(NO2):V(O2) = 4:1 时,完全反应,无气体剩余 V(NO2):V(O2) < 4:1 时,O2过量,剩余气体为O2
V(NO2):V(O2) > 4:1 时,NO2过量,
3NO2+H2O=2HNO3+NO 剩余气体为NO 例2.把30mLNO2和O2的混合气体充满试管倒立于水槽中, 最后剩余5mL气体,试求原混合气体中NO2和O2的体积 各是多少? NO2 20mL,O2 10mL或 NO2 27mL,O2 3mL
反馈练习5 :一容积为10mL的试管,充满NO2和O2 的混合气体,把试管倒立在水槽中,若充分反应后, 试管中尚有1mL气体,则原混合气体中各为几毫升?
NO2 7.2mL 或NO2 8.6mL O2 2.8mL O2 1.4mL
气体溶于水浓度计算
1. 标况下,收集一试管HCl倒置于水槽,假设试管内溶 液不向水槽扩散,求所得溶液浓度:( 1/22.4 mol/L ) 2. 标况下,收集一试管NO2倒置于水槽,假设试管内溶 液不向水槽扩散,求所得溶液浓度:( 1/22.4 mol/L ) 3. 标况下, 收集一试管NO2和O2倒置于水槽,最后无气 体剩余,假设试管内溶液不向水槽扩散,求所得溶液浓 度:( 1/28 mol/L ) 4. 标况下,收集一试管NO和O2倒置于水槽,最后无气体 剩余,假设试管内溶液不向水槽扩散,求所得溶液浓 度:( 1/39.2 mol/L )
氮的氧化物溶于水的计算

a
a
A.b
B.2b
a C.a+2b
a D.2a+b
人教版化学·必修1
返回导航 上页 下页
解析:由质量守恒可知,反应前后氮原子数和氧原子数不变。 答案:C
人教版化学·必修1
返回导航 上页 下页
2.将盛有12 mL NO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2
mL无色气体,则原混合气体中O2的体积是________。
氮的氧化物溶于水的计算
氮的氧化物溶于水的计算 氮的氧化物溶于水的计算 1.相关反应原理 3NO2+H2O===2HNO3+NO① 2NO+O2===2NO2② 由方程式①×2+②得: 4NO2+O2+2H2O===4HNO3③ 由方程式①×2+②×3 得: 4NO+3O2+2H2O===4HNO3④
答案:1.2 mL或4 mL
答案:C
3.将盛有N2和NO2混合气体的试管倒立于水中,经 过足够长的时间后,试管内气体的体积缩小为原来的
一半,则原混合气体中N2和NO2的体积比是( )
A.1∶1
B.1∶2
C.1∶3
D.3∶1
解析:设NO2的体积为x,N2的体积为 (1-x),由题意结合化学方程式
3NO2+H2O===2HNO3+NO↑,可得x +(1-x)=1/2,x=3/4,1-x=1/4,N2 和NO2的体积比为1∶3。
mL;
所以原混合气体中V(NO)=40 mL-30 mL=10 mL,
则V(NO2)∶V(NO)=30 mL∶10 mL=3∶1。 [答案] C
返回导航 上页 下页
人教版化学·必修1
[题组训练]
返回导航 上页 下页
1.在体积为V L的密闭容器中,通入a mol NO和b mol O2。反应后容器内氮原子数 和氧原子数之比为( )
高中化学氮的计算

(2)NO和O2的混合气体通入水中,总关系式: ①×3+②×2 4NO+3O2+2H2O = 4HNO3
二、重点精讲
归纳总结 氮的氧化物溶于水的计算
有关化学反应方程式 3NO2+H2O===2HNO3++3O2+2H2O===4HNO3③ 2NO+O2===2NO2④
差量法是依据化学反应前后的某些“差量”(固体质量差、溶液质量差、气体体积 差、气体物质的量之差等)与反应物或生成物的变化量成正比而建立的一种解题法。
(3)NO2和O2的混合气体通入水中,总关系式:
①+②×2
4NO2+O2+2H2O = 4HNO3
1.在一定条件下,将NO2和O2的混合气体12 mL通入足量水中, 充分反应后剩余2 mL气体(同温同压下),则原混合气体中氧气的
体积为( D) ①1.2 mL ②2.4 mL ③3 mL ④4 mL
A.①② B.②③ C.③④
D.①④
氮氧化合物的计算++课件++2022-2023学年高一下学期化学人教版(2019)必修第二册

当堂检测(15min):
3.将体积12 mL的试管,充满 NO2与O2混合气体倒置与水槽中,发现剩余 2mL气体,原混合气体体积各为多少? ①O2过量 V(O2) = 4 mL ,V(NO2) = 8 mL ②NO2过量, V(O2) =1.2 mL ,V(NO2) =10.8 mL
4.将V mL NO和NO2的混合气体通过水吸收后,得到a mL无色气体A,将此无 色气体A与等体积O2混合,再通过水充分吸收后,收集到5 mL无色气体B。试 回答:(1)A气体是_N__O__,B气体是_O__2_。(2)A气体的体积是_2_0___m__L__。
【例4】在一定条件下,将6体积的NO2和一定体积的NO置于试管中,并将 试管倒置于水中,当通入4.5体积的O2充分反应后,剩余1.5体积气体,则原
NO体积可能为 (双选)( CE )
A.4体积 B.5体积 C.5.5体积 D.3体积 E. 2体积
课堂小结(1min):
第5课时 氮的氧化物溶于水的相关计算
10mLNO,然后通入20mLO2,问最后剩余气体为多少?
解:X=V(NO)/V(O2) = 10ml/20ml =1/2<4/3 因此,反应中O2过量,
NO完全反应,设消耗的O2为xml
4NO + 3O2 +2 H2O = 4 HNO3
43 10ml xml
4:3 = 10ml : xml
解得x=7.5ml 因此剩余的V(O2) = 20 -7.5 =12.5ml
V=20-5=15 ml, 设原混合气体中V(NO2)= x ml
4 NO2 + O2 + 2 H2O = 4 HNO3 △V=5
4
5
Xml
有关氮氧化物溶于水的计算技巧

氮的氧化物溶于水的计算方法对有关氮的氧化物溶于水的计算,同学们在学习中往往感到困难。
其原因是这一溶解过程是通过循环往复的变化才达到平衡的。
但仔细分析可知:这些过程所涉及的化学反应不外乎就是下面两个:3NO2+H2O=2HNO3+NO…..①2NO+O2=2NO2………………②所以,解答这类习题的关键就在对这两个方程的处理上。
解答时可以采用消中间量法,将其中与前后反应相关的中间量消去,得到一总的反应式即可简便地解题。
为此,本文就谈谈利用总反应式解答这类习题的方法。
一、总反应式的推导按照混和气体的种类可以分两大类。
一类是互不反应的两种气体混和溶于水,如N2和NO2、NO和NO2等,由于它们之间并不发生反应,因此,解这类习题时是比较简单的,不需对方程式进行合并,故本文不打算再赘述。
另一类是相互要发生反应,如NO 和O2;NO2和O2;NO、NO2和O2的混和气等,其情况就比较复杂,下面着重讨论如下:1.NO和O2混和溶于水此时可将前述①式×2,②式×3,将NO2从反应体系中消掉,即得总反应式:3NO2+H2O=2HNO3+NO ×2+) 2NO+O2=2NO2 ×3——————————————4NO+3O2+2H2O=4HNO3……③2.NO2和O2混和溶于水此时,NO2与水反应生成的NO是反应的中间产物,照第1种办法处理,将①式x2与②式合并即得总反应式:4NO2+O2+2H2O=4HNO3……④3.NO、NO2和O2混和溶于水这时的情况就更复杂,一般可将①、②两式相加即得总反应式:NO+NO2+O2+H2O=2HNO3…⑤运用上述五个反应式,即可方便地进行有关氮的氧化物的计算习题的解答。
二、总反应式的应用1.判断反应体系中气体间量的关系(1)由③式可知:①当VNO∶VO2=4∶3 时,两种气体恰好完全反应,此时体系中没有气体剩余。
②当VNO∶VO2<4∶3 时,O2过量,剩余为气体O2。
氮的氧化物(NOx)和O2、H2O混合反应的计算方法

氮的氧化物(NO x)和O2、H2O混合反应的计算方法1.关系式法(1)NO和O2的混合气体通入水中由2NO+O2===2NO2和3NO2+H2O===2HNO3+NO得总反应为4NO+3O2+2H2O===4HNO3。
(2)NO2和O2的混合气体通入水中由3NO2+H2O===2HNO3+NO和2NO+O2===2NO2得总反应为4NO2+O2+2H2O===4HNO3。
(3)NO、NO2和O2三种混合气体通入水中先按3NO2+H2O===2HNO3+NO计算出生成NO的体积,再加上原来混合气体中NO体积,再按(1)计算。
2.电子守恒法NO x转化为硝酸时失去电子,如果是NO x与O2的混合气体,则反应中O2得到的电子数与NO x 失去的电子数相等。
4NO2+O2和4NO+3O2从组成上均相当于2N2O5,都与N2O5+H2O===2HNO3等效;当NO、NO2、O2的混合气体溶于水时利用混合气体中N、O原子个数比进行分析判断。
1.有一充有20 mL NO和NO2混合气体的试管,倒置于盛有水的水槽中,充分反应后,仍有12 mL 无色气体,则原混合气体中NO和NO2体积比为(气体体积均在相同状况下测得)() A.2∶3 B.3∶2 C.1∶4 D.4∶1答案A解析二氧化氮和水反应生成硝酸和一氧化氮,一氧化氮和水不反应,所以,剩余的气体为一氧化氮,设混合气体中二氧化氮的体积为V,则:3NO 2+H 2O===2HNO 3+NO 气体体积减少3 1 2V 20 mL -12 mL =8 mL所以V =3×8 mL 2=12 mL ,即二氧化氮的体积为12 mL ,则原混合气体中一氧化氮的体积为20 mL -12 mL =8 mL ,则原混合气体中NO 和NO 2体积比为8 mL ∶12 mL =2∶3。
2.将盛有12 mL NO 2和O 2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2 mL 无色气体,则原混合气体中O 2的体积和剩余的2 mL 气体分别是( )A .1.2 mL ,NOB .2.4 mL ,O 2C .3.5 mL ,O 2D .4 mL ,NO 答案 A解析 解题依据的化学方程式:4NO 2+O 2+2H 2O===4HNO 3;3NO 2+H 2O===2HNO 3+NO 。
专题:有关氮的氧化物溶于水的计算

2NO+O2 = 2NO2 设原试管内NO的体积为 x
由 4NO+ 3O2 +2H2O = 4HNO3 43 x 3/4 x
28mL – 3/4 x = x
x = 16 mL
4. NO2+O2+H2O 例5:由O2和NO2组成的混合气40mL,通过足量的水吸收 后剩下5mL。求原混合气体中NO2和O2的体积。
A. N2、NO2
B. NH3、NO2
C. O2、NO2
D. O2、NO
4.将充满 O2和 NO2的混合气体的量筒倒置于盛有足量 水的水槽中,一段时间后,水位上升至量筒的一半 就停止了。则,原混合气体中
V( NO2 ): V( O2 )= _________________
5.一定条件下,将等体积的NO和O2的混合倒立于水槽 的试管中,则
2.装有等体积的NO、NO2、O2的混合气体的试管倒置 于盛有足量水的水槽中,最后水位上升的体积百分数 为____________________
3.将分别充满下列四组混合气体(每组中的2种气体按 等体积充入)的集气瓶倒扣在盛有足量水的水槽中, 待液面平稳后,按所剩余气体体积由多到少的顺序 是_____________________
3
1
XmL
4mL
解得X=12mL
答:原试管中NO2的体积为12mL。
2. NO+NO2+H2O
例2:将30mLNO和NO2的混合气,通入倒立在水槽中的盛 满水的量筒里,片刻后,量筒里剩下16mL的气体。求原混 合气体中NO和NO2的体积。
解:设原有NO2的体积为xmL
突破03 氮的氧化物与氧气溶于水的计算-高一化学同步重难点专项突破(人教版2019必修第二册)

A.V(NO2)∶V(O2)=2∶1 B.V(NO)∶V(O2)=2∶1
C.V(NH3)∶V(O2)=2∶1 D.V(NO2)∶V(NO)∶V(O2)=1∶1∶1
D
解析:假设试管体积都是 12 mL。A.V(NO2)∶V(O2)=2∶1,混合气体的体积为 12 mL,则二氧化氮、
氧气体积分别是 8 mL、4 mL,根据化学方程式 4NO2+O2+2H2O
应 3NO2+H2O
2HNO3+NO 计算出参与反应的 V(NO2)=30 mL,原气体中 V(NO)=10 mL,
所以原混合气体的体积比为 V(NO2)∶V(NO)=3∶1,故 C 符合题意。
3.相同状况下,将分别盛满如下体积比的混合气体的四支相同的试管倒立于
水槽中,最后试管内液面上升的高度最高的是(
收,故 C 错误;根据分析可知,8 mL NO 和 6 mL O2 完全和水反应生成硝酸,试管内剩余 2 mL NO,试管
内液面上升,故 D 正确。
知识点3
三、有关NO、NO2和O2的混合气体通入水中的计算
1.其实质是 NO2 和 H2O 反应, 的 NO2 转化为 NO,然后按 4NO+3O2+2H2O
[跟踪训练2]在一大试管中装入10 mL NO倒立于水槽中,然后向其中缓慢通
入6 mL O2(气体体积均在相同条件下测定)。下列有关实验最终状态的描述
正确的是(
)
A.试管内气体呈红棕色
D
C.试管内气体呈无色,是2 mL O2
解析:根据 4NO+3O2+2H2O
B.试管内气体呈无色,是1 mL NO
4HNO3 可知,氧气有剩余且剩余 2 mL,
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
山东省冠县一中高一化学学案:第三节硫和氮的氧化物学案A 第二课时
氮
[学习目标定位]
认识一氧化氮、二氧化氮的性质,熟知氮的氧化物溶于水反应的化学方程式,知道氮的氧化物(NO2)、硫的氧化物(SO2)是主要的大气污染物及防治措施。
【知识回顾】
下图是实验室制取SO2并验证SO2的某些性质的装置,试回答:
(1)在⑥中发生反应的化学方程式为_______________________________________。
(2)①中的实验现象为紫色石蕊试液__________,此实验证明SO2是__________气体。
(3)②中的品红溶液__________________________________________________,证明SO2有________
性。
(4)③中的实验现象是___________________________________________________,
证明SO2有______性。
(5)④中的实验现象是____________________________________________________,
证明SO2有______性。
(6)⑤的作用是________________,反应的化学方程式为_____________________。
[引入]1.空气的主要成分是氮气和氧气。
氮气是一种气体,溶于水。
(1)氮气的化学性质,通常情况下与氧气,但是在放电或高温条件下氮气和氧气能直
接化合生成NO,反应的化学方程式是,该反应的还原剂是。
(2)氮气在高温、高压、催化剂的情况下,能与氢气化合生成NH3,反应的化学方程式
是,该反应的氧化剂是。
探究点一一氧化氮和二氧化氮
1.两支大试管,分别集满NO和NO2气体,观察他们的颜色状态,嗅闻他们的气味,比较他们密度
2.2.将盛满一氧化氮的试管打开塞子,置于空气中观察到的现象
是,反应的化学方程式是,实验室收集一氧化氮气体的方法是。
课堂小结课堂练习
1.在元旦联欢会上,某同学给同学们表演了一段魔术:首先收集一瓶红棕色的气体,用玻
璃片盖好,然后向其中加入少量水,振荡后变为无色,然后轻轻移动玻璃片使少量空气进入
集气瓶,气体又变为红棕色,振荡,又变为无色……(1)集气瓶中红棕色的气体是______;
(2)气体颜色变化的原因是_________
______________________________;
写出有关反应的化学方程式为____________________________
______________________;
(3)做魔术时操作者要注意什么问题?为什么?
________________________________________ __。
2.下列过程没有起到氮的固定作用的是( )
A.N2与O2反应生成NO B.N2与H2在一定条件下合成氨
C.NH3经催化氧化生成NO D.豆科植物的根瘤菌将空气中的氮气转化为含氮化合
物
3.硝酸工业尾气中含有高浓度的NO和NO2,它们都是大气的重要污染物。
已知某厂排放的
尾气中NO、NO2的体积比为1∶1,该厂采用NaOH溶液来处理该尾气,处理后所得溶液中只有
一种含氮的钠盐。
则该含氮的钠盐中,氮元素的化合价为 ( )
A.-3 B.+1 C.+3 D.+5
4.按图进行实验。
试管中装有12 mL NO,然后间歇而又缓慢地通入8 mL O2,
下列是有关最终状态的描述:
①试管内气体呈红棕色②试管内气体呈无色③试管内液面不变
④试管内液面上升⑤试管内气体是O2⑥试管内气体是NO。
其中正确的是( )
A.①③ B.②④⑤ C.②④⑥ D.②③⑤
5. 对含有氮氧化物的废气进行处理。
(1)用氢氧化钠溶液可以吸收废气中的氮氧化物,
反应的化学方程式如下:NO2+NO+2NaOH===2NaNO2+H2O① 2NO2+2NaOH===NaNO2+
NaNO3+H2O②
在反应①中,氧化剂是__________________,还原剂是__________________。
在反应②中,氧化剂和还原剂的物质的量之比为______。
(2)汽车尾气中含有CO和NO,消除这两种物质对大气的污染的方法是安装催化转化器,
使它们发生反应生成N2和CO2,该反应的化学方程式为_______ _________________
(3)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质。
写出氨气和二氧化氮在
一定条件下反应的化学方程式:_______________________________________ __。
