慢病毒简介
慢病毒使用操作指南

慢使用操作指南慢使用操作指南1.慢简介1.1 定义:慢是一种特殊的,能够在细胞中长期存活并进行复制。
1.2 用途:慢广泛应用于基因转导、基因敲除和基因表达等实验研究中。
2.慢使用前准备工作2.1 实验室准备工作2.1.1 实验室空间准备:确保实验室内有足够的操作空间和合适的消毒设备。
2.1.2 材料准备:准备好所需的培养基、细胞培养物、慢载体等。
2.1.3 设备准备:确保离心机、冰箱等设备正常工作,并准备好相关的仪器和器材。
2.2 人员准备工作2.2.1 人员培训:对参与慢操作的人员进行培训,了解操作步骤和安全风险。
2.2.2 个人防护:提供必要的防护装备,如实验服、手套、面罩等。
3.慢操作步骤3.1 细胞培养3.1.1 细胞培养物准备:根据实验需求选择合适的细胞培养物,并进行细胞的预处理和培养。
3.1.2 细胞密度调整:根据实验要求,调整细胞培养物的密度,以保证细胞的正常生长。
3.2 慢感染3.2.1 慢载体注射:将慢载体注射到培养好的细胞中。
3.2.2 感染条件控制:根据实验需求,控制慢感染的时间、浓度和温度等条件。
3.3 细胞培养和检测3.3.1 细胞培养:将感染好的细胞进行培养,并观察细胞的生长状态。
3.3.2 细胞检测:使用相关实验方法,对感染细胞进行检测和分析。
4.实验安全措施4.1 操作环境控制:确保实验室内通风良好,避免慢的扩散和污染。
4.2 废液处理:将产生的废液经过正确处理,避免对环境和人体造成污染和伤害。
4.3 事故应急处理:在发生事故或意外情况时,立即采取应急措施,并及时报告相关人员。
5.附件本文档所涉及的附件,包括但不限于实验记录表格、实验数据文件等。
6.法律名词及注释6.1 慢:指一种具有长周期和潜伏期的。
7.结束语感谢您阅读本文档,如有任何疑问或意见,请随时与我们联系。
慢病毒的简介

慢病毒载体系统的另一个特征是携带病毒微粒 的表面蛋白,包含HIV受体和共受体,从而改变或 扩大的细胞类型的范围,使得该载体可以结合并 且进入。这个模型涉及取代的HIV-1包膜糖蛋白与 另一种病毒的包膜糖蛋白,如疱疹性口腔炎病毒 糖蛋白(VSV-G)。
14
1.3. Lentiviral Vector Production
质粒一携带了gag/ pol编码序列及RRE ; 质粒二包含了编码rev的序列; 质粒三是载体质粒; 质粒四表达env。
6
3.4自身失活型(SIN)慢病毒载体 SIN载体的构建是在原病毒载体基础上删 除了病毒3’端LTR的U3区增强子和启动子序 列的片段。该区域出现突变则在HIV-1载体 转录后,其5’LTR会因为缺失HIV-1所需要 的启动子和增强子序列而无法复制出完整 长度的病毒基因组。
In SIN vectors, viral promoter activity is deleted
from the inte-grated provirus by deletions in the
U3 region of the 3’ long terminal repeat (LTR)
《慢病毒简介》课件

利用慢病毒感染宿主细胞的特点,将抗病毒基因 导入细胞中,增强细胞对病毒的抵抗力,预防和 治疗病毒感染性疾病。
慢病毒与其他基因转移技术的比较
慢病毒与质粒DNA的比较
质粒DNA的基因转移效率相对较低,而慢病毒可以将外源基因高 效整合到宿主细胞基因组中,实现长期表达。
慢病毒与纳米材料的比较
通过构建基因敲除或敲入细胞系,可 以研究特定基因对细胞生长、分化和 凋亡等过程的影响。
基因治疗研究
慢病毒载体可以用于将正常基因导入到缺陷基因中,以纠正或补偿缺陷基因的功 能,为基因治疗提供了新的手段。
在基因治疗研究中,慢病毒载体被广泛应用于将治疗基因导入到患者体内,以治 疗遗传性疾病和恶性肿瘤等疾病。
慢病毒的基因组结构简单,易于操作和控制,降低了潜在的基因突变风 险。
慢病毒的包装和生产过程经过严格的质量控制,确保产品的安全性和稳 定性。
慢病毒的免疫原性
在某些情况下,慢病毒载体可能触发机体免疫系统对 载体抗原的免疫应答,但这种免疫反应通常较弱且可 控。
单击此处添加正文,文字是您思想的提一一二三四五 六七八九一二三四五六七八九一二三四五六七八九文 ,单击此处添加正文,文字是您思想的提炼,为了最 终呈现发布的良好效果单击此4*25}
慢病毒包装细胞选择
慢病毒包装需要选择特定的细胞 系作为包装细胞,常用的包装细 胞有293T、Hela和HepG2等。
这些细胞系能够表达慢病毒所需 的gag、pol和env基因,从而产 生具有感染能力的慢病毒颗粒。
在选择包装细胞时,需要考虑细 胞的生长特性和对转基因的兼容 性,以确保慢病毒的包装效率和
探索慢病毒与其他基因转移技术(如质粒、纳米材料等)的联
合应用,实治疗领域的应用前景
慢病毒原理

慢病毒原理慢病毒,又称慢性病毒,是一类感染机体后具有长期潜伏期的病毒。
与急性病毒不同,慢病毒具有较长的潜伏期和慢性发展过程,因此对人类和动物健康造成了长期的威胁。
慢病毒的原理主要包括传播途径、感染过程和致病机制。
首先,慢病毒的传播途径多样,主要包括血液传播、性传播、母婴传播和空气传播等。
其中,血液传播是慢病毒最为常见的传播途径之一,例如艾滋病病毒(HIV)通过血液传播是造成艾滋病的主要原因之一。
另外,慢病毒还可以通过性接触、母婴垂直传播和呼吸道飞沫传播等途径传播,因此在预防和控制慢病毒感染方面需要采取多种有效的措施。
其次,慢病毒的感染过程相对复杂。
一般来说,慢病毒感染后会经历潜伏期,这段时间内病毒在宿主体内进行潜伏和复制,但并不引起明显的临床症状。
随着时间的推移,病毒逐渐破坏宿主的免疫系统和器官组织,最终导致慢性疾病的发生。
以乙型肝炎病毒为例,感染者在潜伏期内往往没有明显症状,但长期感染会导致肝脏损伤,甚至引发肝硬化和肝癌等严重后果。
最后,慢病毒的致病机制涉及多个方面,包括病毒的侵入、复制和传播,以及宿主免疫系统的应答和病理损伤等。
病毒侵入宿主细胞后,利用细胞内的生物合成机制进行复制,不断增加病毒颗粒的数量。
同时,病毒的复制和蛋白质的表达会诱导宿主免疫系统的应答,但慢病毒往往能够逃避宿主的免疫攻击,导致病毒长期存在于宿主体内。
此外,慢病毒的复制和病理变化还会引起宿主组织的炎症反应和器官功能损伤,最终导致慢性疾病的发生和发展。
综上所述,慢病毒的原理涉及传播途径、感染过程和致病机制等多个方面,对于预防和控制慢病毒感染具有重要意义。
因此,加强对慢病毒的研究和监测,制定科学有效的防控策略,对于维护人类和动物健康具有重要意义。
慢病毒使用手册

慢病毒使用手册慢病毒(Lentivirus)是一类非常常见的病毒,它属于逆转录病毒家族。
与其他病毒相比,慢病毒具有一些特殊的特征,使其在生物研究领域和基因治疗等应用中变得非常重要。
本文将介绍慢病毒的基本特征、制备和使用方法,以及慢病毒在基因转染、基因表达和基因治疗中的应用。
一、慢病毒的基本特征慢病毒是一类具有外包膜的病毒,其基因组由一条单链正义RNA组成。
慢病毒具有较大的基因载量能力,可携带长达9kb的外源DNA序列。
另外,慢病毒具有高度的细胞性选择性,能够感染多种哺乳动物细胞,并将外源基因稳定地集成到细胞基因组中。
二、慢病毒的制备方法慢病毒的制备包括构建慢病毒载体和包装慢病毒。
构建慢病毒载体通常采用三元质粒系统,其中包括基因载体、包装载体和包衣载体。
基因载体负责携带外源基因序列,而包装载体负责表达与慢病毒复制有关的基因,如gag、pol和env等。
包衣载体则负责表达包衣蛋白,使慢病毒能够正常装配和释放。
包装慢病毒的方法通常采用转染细胞的方式。
将构建好的慢病毒载体与包装载体和包衣载体一同转染到特定的细胞中,通过包装载体表达的基因来启动慢病毒的复制和包装过程。
经过适当的培养和处理后,可以获得高效包装的慢病毒颗粒。
三、慢病毒的使用方法慢病毒主要通过基因转染、基因表达和基因治疗等方式应用于生物研究和医学领域。
1. 基因转染:慢病毒可以用于将外源基因导入到细胞中,实现基因转染。
通过选择性的感染特定细胞或细胞系,可以研究和探索特定基因的功能和调控机制。
2. 基因表达:慢病毒可以被用作基因表达工具。
外源基因在细胞内被稳定地整合到基因组中,从而实现长期稳定的基因表达。
慢病毒可以用于产生稳定的细胞株,并通过基因敲入或敲除等方法研究基因功能。
3. 基因治疗:慢病毒在基因治疗中的应用非常广泛。
通过将修正后的基因导入到患者体内的细胞中,可以实现对某些慢病毒引起的遗传疾病的基因治疗。
此外,慢病毒载体还可以用于制备疫苗和用于癌症免疫治疗等领域。
慢病毒载体构建原理

慢病毒载体构建原理
慢病毒(lentivirus)是一类病毒,属于反转录病毒的一种。
慢病毒可以作为基因转移的工具,被广泛应用于基因治疗、基因编辑、干细胞研究等领域。
慢病毒载体构建是利用慢病毒作为基因传递的载体,将外源基因导入慢病毒基因组中,并通过慢病毒的复制和转录机制,将外源基因稳定地表达在宿主细胞中的过程。
慢病毒载体构建的原理主要包括以下几个步骤:
1. 选择适当的慢病毒载体,慢病毒载体通常由慢病毒的基因组和外源基因组成。
在构建慢病毒载体时,需要选择适当的慢病毒载体,通常选择已经经过改造的慢病毒载体作为基础,然后将需要表达的外源基因插入到载体中。
2. 插入外源基因,将需要表达的外源基因插入到慢病毒载体的适当位置。
通常采用限制性内切酶切割和连接酶连接的方法,将外源基因与慢病毒载体连接起来,形成重组的慢病毒载体。
3. 构建重组慢病毒载体,将插入了外源基因的慢病毒载体导入到适当的宿主细胞中,利用宿主细胞的复制和转录机制,使重组慢
病毒载体在宿主细胞中稳定复制和表达外源基因。
4. 验证慢病毒载体的稳定性和表达效果,对构建的重组慢病毒
载体进行验证,包括验证慢病毒载体在宿主细胞中的稳定性和外源
基因的表达效果。
通常采用PCR、Western blot等方法对慢病毒载
体进行验证。
总之,慢病毒载体构建是利用慢病毒作为基因传递的载体,将
外源基因导入慢病毒基因组中,并通过慢病毒的复制和转录机制,
使外源基因稳定地表达在宿主细胞中的过程。
这一技术在基因治疗、基因编辑、干细胞研究等领域具有重要的应用前景,对于疾病治疗
和生命科学研究具有重要意义。
慢病毒的生物学特性及其致病机制

慢病毒的生物学特性及其致病机制慢病毒是一类具有强烈致病性的病毒,它们以极慢的速度破坏宿主正常生理功能、繁殖和分化能力,导致疾病的发展和进展。
与普通病毒比较不同的是,慢病毒在宿主体内可以持续存在很长时间,这增加了患者治疗和康复的难度。
1. 慢病毒的分类和基本结构特征慢病毒广泛存在于自然界中的哺乳动物、鸟类等多种生物中。
它们属于反转录病毒,具有某些细菌和动物毒素中没有的结构和特征。
慢病毒的病原体和感染机理十分复杂,不同种类的慢病毒具有不同的结构和基因组组成。
慢病毒的基本结构特征是具有外包膜和筛状结构的核糖体。
它们的外包膜包裹着一个内接膜,在其表面上伸出胞外糖蛋白,使得它们能够识别和与宿主细胞表面的特定受体相互作用。
同时,慢病毒的筛状结构既可以作为病毒基因组RNA的质朴,也可依赖于宿主细胞核酸酶所合成的DNA同步繁殖。
2. 慢病毒在宿主体内的繁殖和扩散慢病毒的开发依赖于它们能够在宿主体内生存并繁殖。
它们通过感染宿主细胞,利用细胞自身的生物合成机制,表示复杂的病毒蛋白和合成病毒基因组。
慢病毒得以在宿主细胞质中主导细胞代谢活动。
慢病毒在宿主体内的繁殖过程是长期缓慢的。
一些类型的慢病毒的复制可以生产DNA和RNA亚基,并且它们需要通过激活受体和核糖体的复杂机制,才能使病毒基因组复制或转录。
这使得慢病毒可以长期依赖于宿主细胞,使宿主体内病毒基因组的拷贝数目不断增加。
3. 慢病毒的致病机制慢病毒的致病机理十分复杂,它们具有多个不同的致病因素,并经常与宿主免疫反应的效应器相互作用。
慢病毒的感染机理包括直接细胞毒性和免疫调节。
慢病毒的直接毒性是指病毒和细胞直接交互可能造成毒性作用。
这是因为慢病毒感染宿主后,其基因组可以和宿主基因组相互作用导致细胞质发生持续性的炎症反应,此时会释放出任何病毒产物。
慢病毒的免疫调节机制是指病毒通过干预宿主免疫反应而导致的病理反应。
慢病毒感染后,会通过感染细胞的多个组织,使得免疫细胞进入炎症灶。
慢病毒的基本原理和应用

慢病毒的基本原理和应用慢病毒(Slow Virus)是指一种具有长期潜伏期或长期进展的病毒,在宿主体内繁殖较慢,而病程较长的感染性疾病。
慢病毒以肝炎病毒、感能病毒、人免疫缺陷病毒(HIV)等为代表。
慢病毒是一种特殊的病毒,其感染机制、致病机理和治疗方法都与其他病毒不同。
一、慢病毒的基本原理慢病毒的基本原理可以简单地分为以下几个方面。
1. 慢病毒的潜伏期长。
以艾滋病毒为例,患者感染后,可潜伏多年,甚至10年以上,其间没有任何症状表现。
这就给治疗患病的时机带来了难度,也使得艾滋病具有了很强的传染性。
2. 慢病毒可以长期影响人体的免疫系统。
慢病毒比其他病毒更加复杂,可以在人体内长期生存。
慢病毒通过影响人体的免疫系统,消耗人体的免疫力,使得患者陷入易感染、易发病、病程较长的状态。
3. 慢病毒的感染难以被查明。
由于慢病毒繁殖较慢,对人体产生的毒性较小,因此在感染初期难以快速检测出来。
这也是慢病毒传染性强的原因之一。
二、慢病毒的应用虽然慢病毒对人体的危害不小,但科学家也发现慢病毒也具有较大的疗效。
下面我们来看看慢病毒的应用领域。
1. 肿瘤治疗。
慢病毒呈现的长期作用和稳定的表达是其治疗肿瘤的重要特点之一。
利用载了有效目标基因的慢病毒病毒载体,经过基因修饰而改变其发病机制,可以将慢病毒载体作为介导治疗的载体,将其放置在肿瘤细胞中,从而减少肿瘤细胞的生长。
2. 神经退行性疾病的治疗。
神经退行性疾病是指一类慢性神经系统疾病,常常由于神经元死亡导致,如阿尔茨海默症、帕金森病等。
慢病毒通过基因修饰可帮助人体产生某种神经元离子通道,通过将离子通道放在感觉神经元和中枢神经元上,减少神经元死亡,保护人体神经系统的健康。
3. 病毒基因敲除治疗。
利用了慢病毒的基因敲除能力,将慢病毒转化成人体行为控制器,将慢病毒病毒载体作为载体,递送到患者体内,进行病毒治疗。
通过这种治疗方式,可以更加有效地处理患病问题,避免上述疾病的出现,并显著提高生命质量。
慢病毒的生物学特性与传播途径

慢病毒的生物学特性与传播途径慢病毒是一组与疾病长时间紧密相关的病原体。
它们的特点是在长时间内不造成可见的病征,却悄然侵害宿主身体的神经组织和免疫系统。
例如,人类免疫缺陷病毒(HIV)和狂犬病病毒(Rabies Virus)就属于慢病毒。
它们导致的疾病需要长期的时间来发展,往往没有有效的治疗方法。
慢病毒的生物学特性是不稳定性。
这主要表现在两个方面:一是慢病毒的基因组特殊复杂,其中包含了许多不同的表达形式和捆绑的功能因子;二是慢病毒在宿主中繁殖的方式很不稳定,这常导致其变异和突变。
然而,慢病毒也具有高度的传播能力。
它们能够利用它们的不稳定性来适应新的宿主细胞,并在破坏免疫系统时躲避宿主的免疫反应。
它们在生长时,可以自我複製几乎无限,最终会导致宿主的死亡。
慢病毒的传播主要包括三种途径:性传播、血液传染和母婴传播。
首先是慢病毒的性传播途径。
感染者通过性接触传播慢病毒。
尽管这种传播是最常见的,但是以性传播方式感染到慢病毒病毒的人群仍然相当有限。
最常见的慢病毒病毒——HIV,就可以通过性交传播。
身体上的性接触本身并不会传染病毒,但在人体器官的软组织中,容易产生微小的创口,从而被病毒感染。
其次是慢病毒的血液传染途径。
这种传播方式是最容易感染的方式之一。
这也就是为什么在世界各地的医院、诊所、血液中心中,都必须进行血液的安全性检测。
如果血液或注射物中含有病毒,人们就会被感染病毒,因为这种病毒通过血液进入宿主的免疫系统。
其中最常见的慢病毒病毒是HIV。
最后是垂直传染。
在母体临产、哺乳和受孕的过程中,慢病毒病毒大量的存在,易感染到胎儿、新生儿或哺乳期的婴儿。
在这些过程中,病毒会通过感染的母亲传染给接触到体液的婴儿。
这种传染方式一般被称作垂直传播,重点在于在产前、产后和哺乳期间(如果母亲是感染者),需要进行检测和隔离。
总之,慢病毒的生物学特性和传播途径已经被深入研究。
虽然预防和治疗仍不完美,但与慢性病毒的愈发严峻所形成的问题相比,我们需要加强对其途径和毒性的理解,以期稳定和加强我们社会的健康。
慢病毒

梅迪/维斯纳病毒是最早归入慢病毒亚科的动物病毒
慢病毒属
ห้องสมุดไป่ตู้灵长类慢病毒
人类免疫缺陷病毒1 型、2型( HIV-1、 HIV-2 )
猿猴免疫缺陷病毒(SIV) 马传染性贫血病毒(EIAV)
慢病毒病
主要是由于慢病毒感染引起的一些疾病。
慢病毒感染引起人和动物肺、关节、神经、造血及免疫 系统的疾病。病毒侵入机体后, 潜伏期往往较长,通过某些 血液细胞散播刊其它组织,机体虽然存在着细胞及体渡免疫
应答,但难以把病毒杀灭。
1967年,我国新疆的于田羊场首次报道绵羊慢病毒病 ( 张福等,1998 ) , 后来相继发现猫和牛的慢病毒病。
1.病毒在体内的潜伏、散播及激活
动物慢病毒主要潜伏在巨噬细胞中由这类细胞通过血液或 脑脊液 ( CSF)将其散播到其它组织处,HIV感CD4+淋巴细胞, 当受感染的细胞处于G。期时病毒的复制受到限制,该期细 胞对于病毒来讲属 于非允许性细胞,病毒感染这些静止期细 胞便形成了其潜伏态(或称晦暗期) 。随着细胞被活化,受限 制的病毒就能复制和表达。
Gudnadottir(1974)提出的“抗原漂移”(Antigenic drift)解释 了维古那病毒为何能在宿主体中长期寄生。 Narayan等[2-5] 试验证明和发展了此设想。他们从维古那病毒持续感染绵羊 体中分离出抗原性不同的变异株,发现这些变异由env基因 点突变引起的。
HIV和动物慢病毒一样,抗原也存在着变异。其中包膜糖蛋 白gP120高度可变,序列中古有高可变区( H )和恒定区(c), Hy区变异并非只由氨基酸取代引起,小片段重复、欢失也有 发生。gP120序列中和病毒存活有关的区域(CD结合区,融 台区t转膜锚状结构域) 高度保守,诱导机体产生中和抗体的 氨基酸区易发生改变,固此,慢病毒利此种机制逃脱了机体
慢病毒使用操作指南

慢病毒使用操作指南慢病毒是一种常用的实验工具,广泛应用于细胞和分子生物学研究。
本文档旨在提供慢病毒使用的操作指南,帮助研究人员更好地利用慢病毒进行实验研究。
第一部分:慢病毒基本知识1. 什么是慢病毒?慢病毒是一种具有RNA基因组的病毒,属于反转录病毒。
它能够将自身的RNA基因组逆转录成DNA,再与宿主细胞的基因组融合,长期稳定地存在于宿主细胞中。
2. 利用慢病毒进行基因转染的优势相比其他常用的基因转染方法,慢病毒具有以下优势:- 高效性:慢病毒能够高效地转染多种类型的细胞,包括非分裂细胞。
- 长期稳定性:慢病毒转染的基因能够长期稳定地存在于宿主细胞中。
- 遗传稳定性:慢病毒转染的基因可以遗传给后代细胞,因此适用于长期实验研究。
第二部分:慢病毒使用的关键步骤1. 选择合适的慢病毒载体慢病毒载体是慢病毒的基础构建单元,其中包含转录启动子、报告基因等必要的元件。
根据实验需要选择合适的载体。
2. 包装慢病毒慢病毒的包装是将慢病毒载体与包装载体共转染至特定细胞株,通过包装载体中的包装酶,将慢病毒的RNA基因组逆转录成DNA,形成可复制的慢病毒。
3. 提取慢病毒经包装后的细胞培养基中含有包装好的慢病毒。
可通过超速离心等方法,将细胞培养物离心,提取慢病毒。
4. 病毒滴定病毒滴定是用来确定病毒滴度的重要步骤。
通过适当稀释提取的慢病毒,将其感染指定细胞株,计算出感染单位的浓度。
5. 慢病毒感染及筛选将提取的慢病毒添加至目标细胞中,通过细胞培养和筛选,筛选出具有所需基因的细胞株。
第三部分:慢病毒使用的注意事项1. 安全操作慢病毒具有一定的传染性,进行实验时需要遵守生物安全操作规范,佩戴一次性手套、口罩等个人防护装备,避免直接接触慢病毒。
2. 避免交叉感染实验室中使用慢病毒时,应尽可能避免交叉感染。
定期对实验室环境进行消毒,使用一次性材料,避免共享器械等措施可以减少交叉感染的风险。
3. 合理控制病毒滴度对于不同类型的细胞,需要确定合适的病毒滴度,以避免过度感染或感染不足的情况。
慢病毒

慢病毒(Lentivirus)载体是以HIV-1(人类免疫缺陷I型病毒)为基础发展起来的基因治疗载体。
区别一般的逆转录病毒载体,它对分裂细胞和非分裂细胞均具有感染能力。
慢病毒载体的研究发展得很快,研究的也非常深入。
该载体可以将外源基因有效地整合到宿主染色体上,从而达到持久性表达。
在感染能力方面可有效地感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,从而达到良好的的基因治疗效果,在美国已经开展了临床研究,效果非常理想,因此具有广阔的应用前景。
目前慢病毒也被广泛地应用于表达RNAi的研究中。
由于有些类型细胞脂质体转染效果差,转移到细胞内的shRNA半衰期短,体外合成shRNA对基因表达的抑制作用通常是短暂的,因而使其应用受到较大的限制。
采用事先在体外构建能够表达shRNA的载体, 然后转移到细胞内转录shRNA的策略,不但使脂质体有效转染的细胞种类增加,而且对基因表达抑制效果也不逊色于体外合成shRNA,在长期稳定表达载体的细胞中,甚至可以发挥长期阻断基因表达的作用。
在所构建的shRNA表达载体中,是由RNA聚合酶Ⅲ启动子来指导RNA合成的,这是因为RNA聚合酶Ⅲ有明确的起始和终止序列,而且合成的RNA不会带poly A尾。
当RNA聚合酶Ⅲ遇到连续4个或5个T时,它指导的转录就会停止,在转录产物3’端形成1~4个U。
U6和H1 RNA启动子是两种RNA聚合酶Ⅲ依赖的启动子,其特点是启动子自身元素均位于转录区的上游,适合于表达~21ntRNA 和~50ntRNA茎环结构(stem loop)。
在shRNA表达载体中,构成shRNA的正义与反义链,可由各自的启动子分别转录,然后两条链互补结合形成shRNA;也可由载体直接表达小发卡状RNA(small hairpi n RNA, shRNA),shRNA 短发夹RNAshRNA包括两个短反向重复序列,中间由一茎环(loop)序列分隔的,组成发夹结构,由polⅢ启动子控制。
慢病毒原理

慢病毒属于逆转录病毒科,为RNA病毒。
慢病毒(Lentivirus)载体是以HIV-1(人类免疫缺陷I型病毒)为基础发展起来的基因治疗载体。
它对分裂细胞和非分裂细胞均具有感染能力。
该载体可以将外源基因有效地整合到宿主染色体上,从而达到持久性表达。
可有效地感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞. Lentiviral vectors can mediate the efficient delivery, integration and stable expression of transgenes in dividing as well as nondividing cells, either in vitro or in several organs in vivo. As such, they open exciting possibilities for both basic research and the genetic treatment of human diseases.Lentivector particles are generated by co-expressing the virion packaging elements and the vector genome in a cell used as producer, for instance a 293 or 293T human embryonic kidney cell. Inthe case of HIV-1-based vectors, the core and enzymatic components of the virion come fromHIV-1, while the envelope is derived from a heterologous virus, most often vesicular stomatitis virus (VSV) due to the high stability and broad tropism of its G protein. By convention, we designate the former elements as the LV packaging system the latter as the envelope.In order to produce lentivectors you need 3 components:∙vector, e.g. pWPTS, pWPXL, pWPI, pLVTHM∙packaging system, e.g. pCMV-dR8.91, pCMV-dR8.74psPAX2 (2nd generation)∙envelope plasmid, e.g. pMD2GThree generations of HIV-based LV packaging systems have been successively developed for production of lentivectors by transient transfection.∙The first generation LV packaging system encompasses all HIV-1 genes besides the envelope.∙The second generation LV packaging system is additionally deleted in all viral auxilliary genes, i.e. vpr, vif, vpu and nef. Examples: pCMV-dR8.91, pCMV-dR8.74, psPAX2The third generation LV packaging system comprises only gag, coding for the virion main structural proteins, pol, responsible for the retrovirus-specific enzymes, and rev,which encodes a post-transcriptional regulator necessary for efficient gag and polexpression. a cDNA encoding rev is provided on a separate plasmid. The third generation packaging system offers maximal biosafety but is more cumbersome, involving thetransfection of four different plasmids in the producer cells. Example of the 3rdgeneration packaging combo: pMDL g/p RRE + pRSV-Rev.All our lentivectors contain wt 5'LTR and can be packaged only using 2nd generation packaging system (as wt 5'LTR requires TAT for activation). If you wish to use 3rd generation packaging system you need to have a lentivector with a chimeric 5'LTR e.g. CCL-, RRL-, etc, in which HIV promoter was replaced with CMV or RSV, thus making them TAT-independent. The lentivectors carrying the chimeric 5'LTR can be packaged into both, 2nd or 3rd generation packaging system.The production of vector particles by transient transfection of 293T cells with the second generation packaging system will satisfy most applications.The vector itself is the only genetic material transferred to the target cells. It typically comprises the transgene cassette flanked by cis-acting elements necessary for its encapsidation, reverse transcription and integration. As previously done with oncoretroviral vectors, advantage was taken of the gymnastics of reverse transcription to engineer self-inactivating (SIN) HIV-1-derived vectors, which lose the transcriptional capacity of the viral long terminal repeat (LTR) once transferred to target cells. This minimizes the risk of emergence of replication competent recombinants (RCR) and avoids problems linked to promoter interference.。
《慢病毒简介》课件
早期诊断和及时治疗
对于慢病毒疾病,早期诊断和治疗至关重要,同时要坚持长期规范治疗。
效果展示
慢病毒的结构
慢病毒感染
慢病毒的结构和其它病毒不同, 非常独特。
慢病毒在人体内的繁殖过程十 分复杂,可以通过细胞表面的 蛋白质进入宿主细胞。
病毒疫苗
慢病毒的疫苗研制一直是医学 界努力的方向,但目前尚未形 成可行的疗法。
慢病毒的特点
远距离传播
慢病毒可以通过血液、乳汁、 精液、唾液等途径传播。
难以治愈
慢病毒疾病的治疗难度大, 时间长,费用高,并且很多 疾病目前只有控制不治。
多系统受侵
慢病毒感染后,病毒会向不 同的组织和器官迁移,导致 疾病涉及多个系统。
慢病毒的分类
病毒名称 人类免疫缺陷病毒 人类T细胞白血病病毒 家牛难病毒
主要疾病 艾滋病 成人T细胞白血病 嗜酸性胞细胞增多症
慢病毒的传播途径
注射毒品
通过使用共用针头、注射器等 器具,易传播病毒。
性行为传播
通过性器官传播病毒,性接触 时使用避孕套可以有效防护。
母婴传播
孕期感染、分娩和哺乳时均有 传播的可能。
慢病毒的主要疾病
1
艾Байду номын сангаас病
发病率高,反复发作,会导致严重的免疫缺陷,终致死亡。
慢病毒简介
慢病毒是一类致病性病毒,常常引起多种慢性疾病。本PPT将对慢病毒的定 义、特点、分类、传播途径、主要疾病、预防和控制进行详细介绍。
慢病毒的定义
1 长潜伏期
慢病毒具有长达数年乃 至十年以上的潜伏期。
2 慢性持续感染
慢病毒一旦侵入宿主体 内,便会持续不断地繁 殖,长期感染宿主。
3 变异性强
《慢病毒简介》课件

通过慢病毒将特定基因导入动物体内,建立人类疾病的动物 模型,用于药物筛选和疾病机制研究。
THANKS
感谢观看
REPORTING
慢病毒载体可以携带特定疾病相关的 突变基因,用于建立疾病突变模型, 有助于深入了解疾病的发病机制和潜 在的治疗方法。
通过慢病毒感染,可以在动物模型中 过表达或敲除特定基因,以探究其在 疾病发生和发展中的作用。
PART 04
慢病毒的安全性
REPORTING
慢病毒的安全性评价
慢病毒在宿主细胞内的复制能力较弱,不会引起宿主细胞的恶性转化。
降低免疫原性。
在慢病毒基因治疗过程中,可以采取适 当的免疫抑制措施,以进一步降低免疫
排斥反应的风险。
慢病毒的致瘤性
尽管慢病毒具有较低的致瘤性,但仍存在一定 的风险。这主要是由于病毒基因组整合到宿主 细胞基因组中,可能导致细胞恶性转化。
在慢病毒基因治疗过程中,应选择适当的细胞 和组织类型,以降低致瘤性风险。同时,应密 切监测治疗过程中的细胞生长和分化情况。
包装过程中,细胞会合成重组 慢病毒的各组分,组装成完整 的病毒颗粒,并释放到培养液 中。
慢病毒滴度测定
慢病毒滴度测定是评估病毒液中病毒颗粒数目的过程,是慢病毒制备过程中的重要 环节。
滴度测定通常采用定量PCR、病毒计数或感染性滴度等方法进行。
通过滴度测定可以了解病毒液的浓度和纯度,为后续实验提供可靠的实验材料。
慢病毒在基因治疗领域的应用前景
罕见病治疗
利用慢病毒作为基因传递工具,将正常基因导入罕见病患者体内,实现基因治 疗。
遗传性疾病治疗
通过慢病毒将正常基因导入患者的造血干细胞或肝细胞等,实现遗传性疾病的 长期治疗。
慢病毒、腺相关病毒及腺病毒特点比较
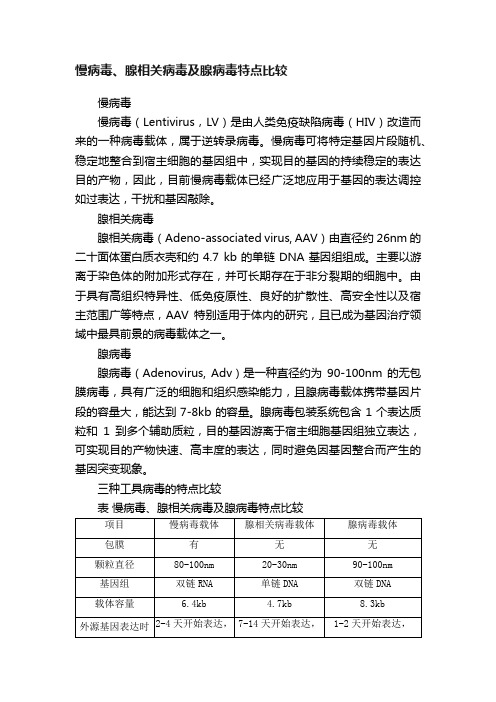
表 慢病毒、腺相关病毒及腺病毒特点比较
项目
慢病毒载体
腺相关病毒载体
腺病毒载体
包膜
有
无
无
颗粒直径
80-100nm
20-30nm
90-100nm
基因组
双链RNA
单链DNA
双链DNA
载体容量
6.4kb
4.7kb
8.3kb
外源基因表达时效
2-4天开始表达,
长时间稳定表达
7-14天开始表达,
腺相关病毒
腺相关病毒(Adeno-associated virus, AAV)由直径约26nm的二十面体蛋白质衣壳和约4.7 kb的单链DNA基因组组成。主要以游离于染色体的附加形式存在,并可长期存在于非分裂期的细胞中。由于具有高组织特异性、低免疫原性、良好的扩散性、高安全性以及宿主范围广等特点,AAV特别适用于体内的研究,且已成为基因治疗领域中最具前景的病毒载体之一。
慢病毒、腺相关病毒及腺病毒特点比较
慢病毒
慢病毒(Lentivirus,LV)是由人类免疫缺陷病毒(HIV)改造而来的一种病毒载体,属于逆转录病毒。慢病毒可将特定基因片段随机、稳定地整合到宿主细胞的基因组中,实现目的基因的持续稳定的表达目的产物,因此,目前慢病毒载体已经广泛地应用于基因的表达调控如过表达,干扰和基因敲除。
长达2个月
1-2天开始表达,
作用时间约为14天
体内扩散能力
一般
强
强免疫原性ຫໍສະໝຸດ 中等极低强
整合方式
高频随机整合
不整合
不整合
腺病毒
腺病毒(Adenovirus, Adv)是一种直径约为90-100nm的无包膜病毒,具有广泛的细胞和组织感染能力,且腺病毒载体携带基因片段的容量大,能达到7-8kb的容量。腺病毒包装系统包含1个表达质粒和1到多个辅助质粒,目的基因游离于宿主细胞基因组独立表达,可实现目的产物快速、高丰度的表达,同时避免因基因整合而产生的基因突变现象。
慢病毒使用操作手册

慢病毒使用操作手册简介:慢病毒(Lentivirus)是一种常用于生命科学研究中的病毒载体,其具有较强的基因转染能力和稳定的基因表达特性。
本操作手册旨在向研究者提供一个详细的慢病毒使用指南,帮助他们顺利进行慢病毒基因转染实验并获得准确可靠的研究结果。
一、慢病毒基本原理慢病毒属于反转录病毒,其基因组为单链RNA。
慢病毒在寄主细胞内通过逆转录过程将RNA转录为DNA,随后将DNA插入宿主基因组中。
这使得慢病毒成为将外源基因稳定集成到宿主基因组中的理想工具。
二、慢病毒使用前准备1. 实验室条件准备:确保工作台面干净整洁,并准备好所需的培养物、培养器具和试剂。
2. 慢病毒载体制备:根据实验需要,选择合适的慢病毒载体,并通过慢病毒包装系统将目标基因插入载体中。
三、慢病毒转染实验步骤1. 细胞培养:将目标细胞接种在培养皿中,并选择合适的培养基进行细胞培养。
2. 慢病毒感染:将预制的慢病毒悬液加入培养皿中,控制感染浓度和时间,以实现最佳的感染效果。
3. 筛选标记:根据实验需要,在感染后适当的时间点添加筛选标记物,如抗生素或荧光标记剂。
4. 选择和扩增:将受筛选标记影响的细胞单克隆分离,扩增和保存。
5. 验证表达:使用合适的实验方法,如western blot或PCR等,来确认目标基因的表达情况。
6. 结果分析:对实验结果进行统计学分析,并绘制适当的图表。
四、注意事项和常见问题解决方案1. 实验前应认真阅读文献,了解慢病毒的基本原理和实验操作流程。
2. 制备慢病毒载体时,应仔细验证目标基因的序列和正确插入。
3. 慢病毒感染时应注意控制感染浓度和时间,避免细胞毒性和非特异性感染。
4. 筛选标记物的选择应根据实验需要和细胞类型进行合理选择。
5. 实验过程中,注意严格遵守实验室安全和生物安全操作规范。
6. 常见问题解决方案:如遇到感染效率低或细胞毒性问题,可以尝试优化感染条件或调整细胞培养条件。
如果基因表达不稳定,可以尝试选择合适的筛选标记物或优化基因载体。
慢病毒

1、慢病毒的简介:Lentivirus是逆转录病毒的一种,具有逆转录病毒的基本结构和特性;能整合入宿主细胞基因组,长期表达,可用于转基因动物制备;但也有不同于逆转录病毒的组分和特性;比逆转录病毒具有更高的滴度,不仅可以感染分裂细胞,更重要的是还能感染非分裂的细胞。
利用Lentivirus构建的shRNA表达载体,与化学合成的siRNA和基于瞬时表达载体构建的shRNA相比,一方面可以替代后者,另一方面,Lentivirus-shRNA载体经包装系统包装后,可用于感染依靠传统转染试剂难于转染的细胞(如原代细胞、悬浮细胞等),并且在感染后可以整合到受感细胞的基因组,进行长时间的稳定表达,是制备稳定表达shRNA细胞株和进行体内实验(in vivo)的最有效手段。
2、慢病毒载体构建包装实验流程如下:1. 根据目的基因相关信息(序列,基因序列号等),构建含有外源基因或序列的重组载体;2. 对于测序正确的重组质粒,提取和纯化高质量(不含内毒素)的重组质粒;3. 使用高效重组载体和慢病毒包装质粒共转染293T细胞,进行病毒包装并收集上清液;4. 通过超滤和超速离心浓缩和纯化病毒;5. 用病毒液感染293T细胞,测定病毒滴度;用高质量的病毒液感染靶细胞,通过定量PCR或者Westenblot检测目的基因表达,也可以进一步进行稳定细胞株的筛选用于长期的功能学研究。
3、RNAi与慢病毒载体技术近年来的研究表明,将与mRNA对应的正义RNA和反义RNA组成的双链RNA(dsRNA)导入细胞,可以使mRNA发生特异性的降解,导致其相应的基因沉默。
这种转录后基因沉默机制(PTGS)被称为RNA干扰(RNAi)。
通过构建RNAi 表达载体制备shRNA(发卡结构小干扰RNA),已成为进行RNA干扰实验的常用手段之一。
而目前为了感染原代细胞和难感染的细胞系或者在动物水平进行RNAi,研究科学家更多的选择了慢病毒载体。
在RNAi的研究中,为了感染原代细胞和难感染的细胞系,科学家开始借助于病毒载体实现RNAi;由于慢病毒可以同时感染分裂和非分裂细胞、整合性以及免疫原性低等优点,目前在RNAi的研究中,基于慢病毒构建的shRNA被最广泛的使用。
慢病毒的病原学及其防治策略研究

慢病毒的病原学及其防治策略研究慢病毒(Slow Virus)是指一类病毒,其复制和感染速度较慢。
慢病毒可以引起较长时间的慢性感染,严重威胁着人类和动物的健康。
慢病毒病的病原学及其防治策略是当前医学和生物学研究的重点之一。
1. 慢病毒的病原学慢病毒主要分为三类:脑炎毒、免疫抑制毒和神经退行性毒。
其中,脑炎毒主要感染中枢神经系统,引起脑炎和脑膜炎等疾病;免疫抑制毒会抑制机体免疫功能,使机体容易感染其他病原体,引发各种慢性疾病;神经退行性毒则会引起神经系统退行性疾病,如痴呆和帕金森等。
慢病毒的病原学主要涉及慢病毒的复制和传播机制。
慢病毒的生命周期非常长,可以在宿主体内长期潜伏。
宿主感染慢病毒后,慢病毒会进入宿主的细胞中,经过一系列的复制和转录,在宿主体内慢慢扩散。
传播方式多种多样,可以通过血液、唾液、粪便等途径传播,也可以通过性传播和垂直传播传染给下一代。
2. 慢病毒的防治策略目前,预防慢病毒感染的最好方法是接种疫苗。
疫苗接种可以刺激机体产生免疫反应,增强机体免疫力,从而有效地预防慢病毒感染。
早期的乙肝疫苗接种就是一个典型的例子。
通过乙肝疫苗接种,全球乙肝病毒感染人数已经大幅度降低,降幅达到了90%以上。
另外,定期对宠物进行疫苗接种也是预防慢病毒感染的重要手段。
此外,强化宣传和教育也是预防慢病毒感染的有效途径。
我们可以通过各种媒体宣传慢病毒的预防知识,让人们了解如何预防慢病毒感染。
此外,定期组织大众参加健康讲座、义诊等活动,提高人们对慢病毒的认识水平和健康意识,积极推广健康生活方式,预防慢病毒感染。
另外,慢病毒的治疗主要是针对症状进行治疗。
因为慢病毒的治疗比较困难,迄今没有有效的特异性治疗方法,主要是对症下药。
例如,治疗免疫抑制毒感染的患者,重点是增强机体免疫力,通过增加细胞因子的产生和提高抗体水平等方法来治疗;而治疗神经退行性毒感染的患者,则主要是采用药物对症处理,缓解症状、延缓病情发展。
3. 思考与展望随着对慢病毒的研究深入,我们发现慢病毒的病原学和防治策略仍然存在很多未知的领域,需要我们继续深入研究。
慢病毒安全培训
纲要
1. 慢病毒概述 2. 实验室个人防护与安全操作 3. 废弃物处理 4. 实验室安全事故处理
3DbiopharmG&D
一、慢病毒是什么--慢病毒的结构
• 慢病毒(Lentivirus)载体是以HIV-1(人类免疫缺陷I型病毒)为基 础发展起来的基因治疗载体。
• 慢病毒是一种RNA病毒,因其潜伏期较长而被称为慢病毒。
2.穿戴防护衣服,轻轻地用10%的漂白剂(5%的酚,或2.5%的碘伏)从外围 开始向 中心覆盖。在清理之前确保足够的接触灭活时间(20分以上);
3.将浸泡过的纸巾丢进生物安全柜中生化危险袋中。擦干净残留的脏污。再 用70% 的酒精擦拭表面,将毛巾丢在生物危险品袋中。
4.降低视窗5分钟,使用鼓风机通过HEPA过滤器通风
3DbiopharmG&D
4
➢ 《病原微生物实验室生物安全管理条例》中规定HIV活病毒为 第二类病原微生物,培养、分离要在BSL-3中操作的;抗体、 血清检测在BSL-2级别实验室进行;
➢ 《慢病毒生物安全手册》中规定所有与慢病毒载体有关的工 作必须在BSL2实验室进行。这包括但不限于一间具有负压 和门封闭的特点用于组织培养的房间,并配备认证的二级生 物安全柜(BSC)和专用的细菌培养箱。
3DbiopharmG&D
二、个人防护与实验室安全操作
个人防护
人员:专人负责,未经许可, 禁止进入。细胞房的门应保持常闭状 态
穿戴:戴两双手套,穿实验室外套,建议穿连体无菌服,并把实验 服外套袖子的袖口塞进手套里; 戴口罩,戴护目镜或面罩;
注意事项: 1、禁止任何皮肤暴露, 2、避免带伤、病工作; 3、禁止在实验区域进食、饮水、化妆和处理隐形眼镜,储存食品和饮 料等; 4、避免戴着未经消毒的手套触碰物品; 5、禁止穿着实验室防护服离开实验室;
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
编码 病毒 的基 本结 构
调节 基因
3.慢病毒载体历史与构建
3.1第一代HIV-1来源的慢病毒载体 以Naldini及Kafri构建的三质粒系统为代表,该系统由包 装质粒、包膜质粒及载体质粒3种质粒组成。 包装质粒是HIV-1前病毒基因组5’端LTR由巨细胞病毒早期 启动子取代,3’LTR由SV40 polyA序列取代。包装成分分 别构建在两个质粒上,一个表达gag和pol,另一个表达 env。 载体质粒携带了5’端LTR,和全部5’端非翻译区域,另外 还带有rev应答元件(RRE)。 包膜表达质粒使用水疱性口炎病毒糖蛋白G基因(VSV-G) 用来代替了原病毒的env基因。
Lentivirus preintegration complexes interact with the nuclear pore and undergo active transport into the nucleus of nondividing cells, where the proviral DNA is integrated into the genomic DNA of the host cell. This feature is the primary reason why lentiviruses are being developed as gene-transfer vectors for postmitotic cells in the CNS. 慢病毒整合前复合物与核孔相互作用进入细胞 核分裂的细胞,其中的前病毒DNA整合到宿主细 胞的基因组DNA并进行主动运输。此功能是为什 么慢病毒在有丝分裂后的细胞在中枢神经系统的 基因转移载体的主要原因。
质粒一携带了gag/ pol编码序列及RRE ; 质粒二包含了编码rev的序列; 质粒三是载体质粒; 质粒四表达env。
6
3.4自身失活型(SIN)慢病毒载体 SIN载体的构建是在原病毒载体基础上删 除了病毒3’端LTR的U3区增强子和启动子序 列的片段。该区域出现突变则在HIV-1载体 转录后,其5’LTR会因为缺失HIV-1所需要 的启动子和增强子序列而无法复制出完整 长度的病毒基因组。
7
4.重组慢病毒的产生
常用瞬时转染法,即将包膜质粒,包装 质粒和载体质粒共转染人胚肾293T细胞直 接产生生产细胞。最后慢病毒分泌到培养 基中进行培养而得到大量载体慢病毒。
8
慢病毒在中枢神经系统中的应用
9
1. Introduction
Recombinant viral vectors have been used to study a variety of fundamental issues in developmental neurobiology, as well as pathogenesis and treatments for various neurodegenerative diseases. Lentiviral vectors are valuable tools for neurobiology research owing to their ability to transduce nondividing cells, such as neurons, and to introduce therapeutic or reporter genes into central nervous system (CNS) cells in vivo and in vitro.
重组病毒载体已被用于研究各种发育神经生物学 中的基础问题,以及各种神经退行性疾病的发病机 理和治疗。慢病毒载体能转导分裂的细胞,如神经 元,并介导中枢神经系统(CNS)细胞在体内和体 外基因治疗或报道基因而作为神经生物学研究的有 价值的工具。
10
1.1. Lentiviral Gene Delivery to CNS Cells
2
2.HIV-1的基因结构
HIV-1为双链RNA病毒,共有9个基因。 gag基因编码病毒的核心蛋白,包括基质蛋白、衣壳蛋 白、核衣壳蛋白。 pol基因编码病毒复制所需的酶,如反转录酶、整合酶、 蛋白酶。 env基因编码病毒的包膜糖蛋白,决定病毒感染宿主的 靶向性。 rev编码的蛋白调节gag、pol、env的表达水平。 tat编码的蛋白参与RNA转录的控制。 4个辅助基因vif、vpr、vpu、nef编码的蛋白则作为毒力 因子参与宿主细胞的识别和感染。两端为长末端重复序 列(LTR),内含复制所需的顺式作用元件。
4
3.2第二代HIV-1来源的慢病毒载体 1997年,Zufferey等将包装质粒上的vif、 vpr、vpu和nef基因(即辅助基因)敲除,从而 得到的三代HIV-1来源的慢病毒载体 为减少复制型病毒的产生,可通过减少辅助质 粒与载体质粒的同源性,或者将gag/ pol和rev编 码序列隔离,分散在不同的质粒上。这样的包装系 统由四质粒代替原有的三质粒包装系统。
11
Self-inactivating (SIN) vectors reduce the probability of oncogenesis by pro-moter insertion. In SIN vectors, viral promoter activity is deleted from the inte-grated provirus by deletions in the U3 region of the 3’ long terminal repeat (LTR) that are copied during reverse transcription to the 5’LTR. 自身失活型(SIN)慢病毒载体3’端LTR的U3区 启动子发生失活突变后,在逆转录过程中转移至 5’LTR。这样的载体整合入靶细胞,将不会产生完 整长度的载体RNA,因此命名为“自身失活型载 体”。
慢病毒载体概况 HIV-1的基因结构 慢病毒载体历史与构建 重组慢病毒的产生 慢病毒在中枢神经系统中的应用 慢病毒在造血干细胞系统中的应用 慢病毒在眼科疾病治疗中的应用
1
1.慢病毒载体概况
慢病毒是逆转录病毒科亚科之一,分为灵长类和 非灵长类慢病毒。灵长类慢病毒包括HIV-1,HIV2,猴免疫缺陷病毒(SIV),非灵长类慢病毒包 括猫免疫缺陷病毒(FIV),牛免疫缺陷病毒 (BIV),马免疫缺陷病毒(EIAV)等,其中HIV 研究最为透彻。 研究表明慢病毒核蛋白质前整合复合物具有噬核 特性,病毒基因组运输至细胞核,从而使慢病毒 可以感染和在非有丝分裂细胞中复制。这一特性 是慢病毒成为基因治疗的转移载体。
