第四章 分子轨道理论(1) ppt课件
合集下载
第四章 晶体场、分子轨道理论 PPT

分裂能:中心离子的d轨道的简并能级因配位场
的影响而分裂成不同组能级之间的能量差。 分裂能的大小与下列因素有关:
1 配位场 亦即几何构型类型 如△t=(4/9)△o
2 金属离子
(1) 金属离子的电荷
中心金属离子电荷增加,△值增加。这是由于随着金 属离子的电荷的增加,金属离子的半径减小,因而配体更 靠近金属离子,从而对 d 轨道产生的影响增大之故,三价 离子的分裂能 比二价离子要大40~60%。
八面体场中的d轨道
若改变负电荷在球壳上的分布,
把它们集中在球的内接正八面体的 六个顶点上, 且这六个顶点均在x、 y、z轴上, 每个顶点的电量为1个单 位的负电荷, 由于球壳上的总电量 仍为6个单位的负电荷, 因而不会改 变对d电子的总排斥力, 即不会改变 d轨道的总能量, 但是那个单电子处 在不同的d轨道上时所受到的排斥 作用不再完全相同。
3 配体的本性
将一些常见配体按光谱实验测得的分裂能从小到大次
序排列起来,便得光谱化学序:
这个化学序代表了配位场的强度顺序。由此顺序可见 ,对同一金属离子,造成△值最大的是CN-离子,最小的
是I-离子,通常把CN-、NO2-等离子称作强场配位体, I-、Br-、F-离子称为弱场配位体。
须指出的是, 上述配体场强度顺序是纯静电理 论所不能解释的。例如OH-比H2O分子场强度弱, 按 静电的观点OH-带了一个负电荷, H2O不带电荷, 因 而OH-应该对中心金属离子的d轨道中的电子产生较 大的影响作用, 但实际上是OH-的场强度反而低, 显 然这就很难纯粹用静电效应进行解释。这说明了
t2
e
由于在四面体场中,这两组轨道都在一定程度下避 开了配体、没有像八面体中d轨道与配体迎头相撞的情 况,可以预料分裂能△t将小于△o,计算表明
的影响而分裂成不同组能级之间的能量差。 分裂能的大小与下列因素有关:
1 配位场 亦即几何构型类型 如△t=(4/9)△o
2 金属离子
(1) 金属离子的电荷
中心金属离子电荷增加,△值增加。这是由于随着金 属离子的电荷的增加,金属离子的半径减小,因而配体更 靠近金属离子,从而对 d 轨道产生的影响增大之故,三价 离子的分裂能 比二价离子要大40~60%。
八面体场中的d轨道
若改变负电荷在球壳上的分布,
把它们集中在球的内接正八面体的 六个顶点上, 且这六个顶点均在x、 y、z轴上, 每个顶点的电量为1个单 位的负电荷, 由于球壳上的总电量 仍为6个单位的负电荷, 因而不会改 变对d电子的总排斥力, 即不会改变 d轨道的总能量, 但是那个单电子处 在不同的d轨道上时所受到的排斥 作用不再完全相同。
3 配体的本性
将一些常见配体按光谱实验测得的分裂能从小到大次
序排列起来,便得光谱化学序:
这个化学序代表了配位场的强度顺序。由此顺序可见 ,对同一金属离子,造成△值最大的是CN-离子,最小的
是I-离子,通常把CN-、NO2-等离子称作强场配位体, I-、Br-、F-离子称为弱场配位体。
须指出的是, 上述配体场强度顺序是纯静电理 论所不能解释的。例如OH-比H2O分子场强度弱, 按 静电的观点OH-带了一个负电荷, H2O不带电荷, 因 而OH-应该对中心金属离子的d轨道中的电子产生较 大的影响作用, 但实际上是OH-的场强度反而低, 显 然这就很难纯粹用静电效应进行解释。这说明了
t2
e
由于在四面体场中,这两组轨道都在一定程度下避 开了配体、没有像八面体中d轨道与配体迎头相撞的情 况,可以预料分裂能△t将小于△o,计算表明
[课件]第四章 休克尔(Hückel) 分子轨道理论PPT
![[课件]第四章 休克尔(Hückel) 分子轨道理论PPT](https://img.taocdn.com/s3/m/1cf29dc819e8b8f67c1cb992.png)
* Sij i j d
18
上式中E 代替了 ,因为求解上述方程可以得到E的 一组解,其中最小的一个就是体系基态能量的近似值。
2018/11/30 16/93
量子化学
为0,称此行列式为久期行列式。
第四章
ci 不全为零的条件是它们的系数构成的行列式
由此可求出E的一组解,将各个E值代入久期方 程(1), 结合Ψ归一化特性,即 就可以求出该E值对应的一套系数c1 , c2 ,…, c k, 由此可构建相应的波函数Ψ。
第四章
?
0 真实波函数 变分原理
2018/11/30 8/93
量子化学
变分过程 不断试探的过程
第四章
试探函数Ψ
反复这一过程, 越低越好
2018/11/30 9/93
量子化学
第四章
通常, 趋于E0的速度比趋于0的速度快,因
此,一个不太理想的 可能给出了较好的E0近似
值,所以,现代分子轨道计算方法中更多采用波函
数逼近法。
应用变分法,试探函数的选择是极其重要的, 在解决量子化学问题时,常用线性变分法。
2018/11/30 10/93
量子化学
2. 线性变分法
第四章
变分法中变分函数的选取广泛采用线性 变分法,变分函数 采用k个线性无关的函 数
的线性组合, 即: , , , 1 2 k
量子化学
第四章
第四章 休克尔(Hückel) 分子 轨道理论
2018/11/30 1/93
量子化学
第四章
4.1 变分法
4.2 休克尔分子轨道法 4.3 分子对称性在HMO方法中的应用 4.4 电荷密度 4.5 键级、成键度和自由价 4.6 共轭分子的稳定性和反应性 4.7 前线轨道理论及其在化学反应中的应用
4第四章 分子轨道理论

云。聚集在核间的电子云同时受到两个原子核的吸引,
即核间的电子云把两个原子核结合在一起,这就是 H 2 的成键本质。
2 分子轨道理论 4.2.1 分子轨道理论要点
(1)单电子近似
对 m 个核和 n 个电子组成的分子体系,体系总的波函数
为
(1, 2 n) 。在 B-O 近似并采用原子单位后,体
j ci i c11 c2 2 cn n
i 1
n
n个原子轨道的参与组合,组成n个分子轨道。一般地,n n n 为偶数时,其中 个为成键轨道, 为反键轨道(也可能出 2 2 现非键轨道);n 为奇数时,肯定会出现非键轨道。
(3)成键原则
对称性一致原则
成 键 三 原 则
n
ij
Sij ) 0
i 1, 2, , n
上式是一个关于 ca , cb 的二元一次方程组,要使 ca , cb 有 非零解,必须使其系数行列式为零。
H aa E H ba ESba H ab ES ab H bb E 0
ˆ 只要 H 是厄米的, a 和 b 是实函数,则必有 H ab Hba , Sab Sba
Sab=Saa=Sbb=1。R=∞时 Sab=0
说明Sab是单调递减函数
dSab R ( R 1)e R 0 dR 3
所以,0≤Sab≤1。Sab 的大小与两核的距离或 a与 b 的重叠有关,顾名思义称为重叠积分。
B.库仑积分Haa(coulomb integral)
1 1 1 1 H aa a H a d a [( 2 ) ] a d 2 ra rb R 1 2 1 1 1 a ( ) a d a a d a a d 2 ra rb R
第4章 休克尔(Hückel) 分子轨道理论

31
量子化学
第四章
具有对称性质的原子在分子轨道中贡献相同,因此,
在分子轨道中,这些原子的轨道系数的绝对值相等。
根据对称与反对称的关系,有:
(1) c1 c 4 ;
c 2 c3 (2) c1 c 4 ; c 2 c3
注:波函数的形式为:
c11 c 2 2 c33 c 4 4
内)+4(+)=6+8
27
量子化学
Fronst图 向上,轨道成对出现 能量最低轨道+2 电子数目 4m+2 体系稳定,有芳香性 休克尔4m+2规则 例1:苯, 6e,满足4m+2,芳香性
第四章
m=0,1,2,3,4
28
量子化学
例2:环丁二烯, 4e -2
32
量子化学
例1:丁二烯,基态分子 Hü ckel行列式为: x 久期方程为:
1 0 1 x 1 0 0 1 x 1
第四章
0 0 1 x 0
c1 x c 2 0 0 c1 c 2 x c3 0 c 2 c3 x c 4 0 c3 c 4 x 0
综上,丁二烯的4个分子轨道为:
1 0.37171 0.6015 2 0.60153 0.3717 4
2 0.60151 0.3717 2 0.3717 3 0.6015 4
E 3 0.618
3 0.60151 0.3717 2 0.3717 3 0.6015 4
17
量子化学
第四章
2. 电子近似 考虑大П键是参与共轭的各原子的p轨道(i, i=1, 2, 3,…)肩并肩形成的。应用LCAO-MO, 则分子 轨道可写成 c11 c 2 2 c m m ,其中i 为参与共轭的各原子的p轨道。
量子化学
第四章
具有对称性质的原子在分子轨道中贡献相同,因此,
在分子轨道中,这些原子的轨道系数的绝对值相等。
根据对称与反对称的关系,有:
(1) c1 c 4 ;
c 2 c3 (2) c1 c 4 ; c 2 c3
注:波函数的形式为:
c11 c 2 2 c33 c 4 4
内)+4(+)=6+8
27
量子化学
Fronst图 向上,轨道成对出现 能量最低轨道+2 电子数目 4m+2 体系稳定,有芳香性 休克尔4m+2规则 例1:苯, 6e,满足4m+2,芳香性
第四章
m=0,1,2,3,4
28
量子化学
例2:环丁二烯, 4e -2
32
量子化学
例1:丁二烯,基态分子 Hü ckel行列式为: x 久期方程为:
1 0 1 x 1 0 0 1 x 1
第四章
0 0 1 x 0
c1 x c 2 0 0 c1 c 2 x c3 0 c 2 c3 x c 4 0 c3 c 4 x 0
综上,丁二烯的4个分子轨道为:
1 0.37171 0.6015 2 0.60153 0.3717 4
2 0.60151 0.3717 2 0.3717 3 0.6015 4
E 3 0.618
3 0.60151 0.3717 2 0.3717 3 0.6015 4
17
量子化学
第四章
2. 电子近似 考虑大П键是参与共轭的各原子的p轨道(i, i=1, 2, 3,…)肩并肩形成的。应用LCAO-MO, 则分子 轨道可写成 c11 c 2 2 c m m ,其中i 为参与共轭的各原子的p轨道。
第四章 分子轨道理论

r − a0
1 Ψ1s = e 3 πa0
当这个电子在 B 核附近运动时,受 A 核影响很小,相 对于氢原子 B 的状态,其基态为
而一般情况下,即不是氢原子 A 的状态,也不是氢原 子 B 的状态,可以认为即具有 A 的状态,又具有 B 的 状态,因此可取两者的线性组合做为变分函数,即 (4-37) 依据线性变分法,有
(4-27) 或写作
(4-28) 其中 〈E〉 为未知数,是此行列式的特征值。展开此 行列式,可得以 〈E〉 为未知数的一元 n 次方程,解 之可得 n 个 〈E〉 值,且有
由变分原理知
若 ϕ1, ϕ2, …彼此正交,还有
将 n 个能量 〈E〉i 分别代入方程组(4-26),结合归一化 条件,可得 n 套系数。其中每套系数都和一个能量 值 〈E〉i 相对应,将其代入展开式 (4-22) 中,就得到 一个相应于该能量 〈E〉i 的量为 (4-48) 这里多算了一次电子间的排斥能。两个氢原子形成氢 分子时,能量的降低值为
其中 ΔE 即为 H2 中共价键的键能。实验测得 ΔE = 104 kcal⋅mol-1,所以 β= -52 kcal⋅mol-1。
3.3 氢分子的波函数和能量
(1)氢分子的完整波函数 式(4-46)和(4-47)中 Ψ1 和 Ψ2 是单电子薛定 谔方程(4-34)的解,是描写氢分子中单个电子的运 动状态的波函数。将其代入式(4-35)就得到氢分子 薛定谔方程(4-29)的近似解。对于氢分子的基态, 两个电子都应当在能量最低的轨道上运动,即
分子中电子从哈密顿算符式(4-7)可写成
(4-12)
式中
(4-13)
所以分子的电子薛定谔方程(4-8)就可近似地分离 为 n 个单电子的薛定谔方程
1 Ψ1s = e 3 πa0
当这个电子在 B 核附近运动时,受 A 核影响很小,相 对于氢原子 B 的状态,其基态为
而一般情况下,即不是氢原子 A 的状态,也不是氢原 子 B 的状态,可以认为即具有 A 的状态,又具有 B 的 状态,因此可取两者的线性组合做为变分函数,即 (4-37) 依据线性变分法,有
(4-27) 或写作
(4-28) 其中 〈E〉 为未知数,是此行列式的特征值。展开此 行列式,可得以 〈E〉 为未知数的一元 n 次方程,解 之可得 n 个 〈E〉 值,且有
由变分原理知
若 ϕ1, ϕ2, …彼此正交,还有
将 n 个能量 〈E〉i 分别代入方程组(4-26),结合归一化 条件,可得 n 套系数。其中每套系数都和一个能量 值 〈E〉i 相对应,将其代入展开式 (4-22) 中,就得到 一个相应于该能量 〈E〉i 的量为 (4-48) 这里多算了一次电子间的排斥能。两个氢原子形成氢 分子时,能量的降低值为
其中 ΔE 即为 H2 中共价键的键能。实验测得 ΔE = 104 kcal⋅mol-1,所以 β= -52 kcal⋅mol-1。
3.3 氢分子的波函数和能量
(1)氢分子的完整波函数 式(4-46)和(4-47)中 Ψ1 和 Ψ2 是单电子薛定 谔方程(4-34)的解,是描写氢分子中单个电子的运 动状态的波函数。将其代入式(4-35)就得到氢分子 薛定谔方程(4-29)的近似解。对于氢分子的基态, 两个电子都应当在能量最低的轨道上运动,即
分子中电子从哈密顿算符式(4-7)可写成
(4-12)
式中
(4-13)
所以分子的电子薛定谔方程(4-8)就可近似地分离 为 n 个单电子的薛定谔方程
《分子轨道理论》课件

1 分子轨道能级的定义 2 分子轨道能级的计算 3 电子在分子轨道中的
我们将学习分子轨道能级
方法
分布
的概念和定义。了解它们
我们将探讨计算分子轨道
我们将研究分子轨道中电
是如何描述分子中电子的
能级的方法,如分子轨道
子的分布规律和性质。了
能量和分布。
的线性组合和量子化学计
解电子在不同分子中的行
算方法。
为。
原子轨道的定义
我们将学习原子轨道的基本概念和定义。了解它们是如何描述原子中电子的运动状态和能量 分布。
原子轨道的分类
我们将讨论原子轨道的不同类型,例如s轨道,p轨道,d轨道和f轨道。每种轨道有不同的形 状和能量。
原子轨道的数量
我们将研究不同原子中轨道的数量。了解不同原子的电子排布和轨道填充规则。
第三章:分子轨道
结论
通过这个课件,我们总结了分子轨道理论的主要内容和意义。理解了它对化 学领域的重要作用,并学习了如何应用这一理论解释分子的行为和性质。
《分子轨道理论》PPT课 件
在这个课件中,我们将学习分子轨道理论的基本概念和应用。我们将了解它 对化学领域的重要性以及如何使用这一理论来解释分子的性质和行为。
第一章:引言
本章将介绍分子轨道理论的背景和意义。我们将探讨为什么要发展这一理论 以及它对我们理解化学反应和分子结构的重要性。
第二章:原子轨道
1
分子轨道的定义
我们将学习分子轨道的概念和定义。了解它们是如何描述分子中电子的运动和分布。
2
分子轨道的分类
我们将讨论分子轨道的不同类型,如σ轨道和π轨道。每种轨道对分子的性质和化学反应起着 不同的作用。
3
分子轨道的数量
分子轨道(课堂PPT)

43
44
45
46
47Leabharlann 33CF和CF+的键能分别为 548kJ/mol和753kJ/mol。试用 MOT解释。
CF的键级为2.5、CF+的键级为3 键级越大,键能越大。
34
分子极性 偶极矩
在任何一个分子中都可以找到一个正电荷中心和一个负电荷中心。 正、负电荷中心不重合的分子为极性分子。 正、负电荷中心重合的分子为非极性分子
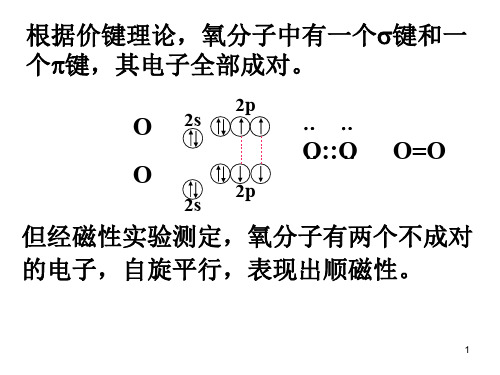
iii) O2 分子有两个成单电子,所以氧分子有顺磁性。
21
F2 分子,含18个电子
[(1s)2 (1s*)2 (2s)2 (2s*)2 (2px)2 (2py)2 =(2pz)2 (2py*)2 =(2pz*)2]
KK 能量抵消
能量抵消 能量抵消
i) F2 分子中有一个 键。
ii)
F2 分子键级=
13
(b) 适用于 1~7 号元素形成的分子或离子
对于 N,B,C原子,2s 和 2p 轨道间能量差小, 相互间排斥作用大,形成分子轨道后,σ2s和σ2Px之间 的排斥也大,结果,出现 B图中σ2Px 的能级反比 π2Py, π2Pz 的能级高的现象。
(Be2)(2py)(2pz) (2px) (2py*)(2pz*) (2px*) KK(2s)(2s*) (2py)(2pz) (2px) (2py*)(2pz*) (2px*) (1s)(1s*) (2s)(2s*) (2py)(2pz) (2px) (2py*)(2pz*) (2px*)14
偶极矩还可帮助判断分子可能的空间构型。例如NH3和BCl3 都是由四个原子组成的分子,可能的空间构型有两种,一种是平 面三角形,一种是三角锥形,根据
(NH3)=5.001030 Cm (BCl3)= 0.00 Cm
分子轨道理论教学课件

密度泛函理论
01
密度泛函理论是一种更高效的计算方法,它将多电子系统的薛 定谔方程简化为单电子系统的方程。
02
它通过电子密度而不是波函数来描述多电子系统,从而大大减
少了计算量。
密度泛函理论在计算化学中得到了广泛应用,可以用于预测分
03
子的电子结构和性质。
分子力学方法
1
分子力学方法是一种基于经典力学原理的计算方 法,它通过势能面来描述分子的运动。
分子轨道理论认为分子中的电子是在一系列的分子轨道上运 动,每个分子轨道都由一个波函数表示,描述了电子在分子 中的运动状态。
分子轨道理论的发展历程
分子轨道理论的起源可以追溯到20世纪初,当时科学家开始尝试用量子力学来描述 分子中的电子行为。
在20世纪30年代,德国物理学家马克思·玻恩和英国化学家罗伯特·玻恩等人发展了 分子轨道理论的基本框架,为后续的研究奠定了基础。
或能级表。
分子轨道能级与化学反应的关系
03
分子轨道能级与化学反应的活化能、反应速率和反应机理等密
切相关,是理解和预测化学反应的重要依据。
03
分子轨道的计算方法
哈特里-福克方法
01
哈特里-福克方法是分子轨道理论 中最早的数值计算方法,它基于 变分原理,通过求解薛定谔方程 来计算分子轨道。
02
该方法适用于较小的分子,但对 于较大的分子和复杂的化学环境 ,计算量会变得非常大。
原子轨道有特定的形状和取向,如球 形、哑铃形、纺锤形等,这些形状和 取向决定了原子中电子云的分布。
分子轨道的形成
1 2 3
分子轨道的概念
分子轨道是指由两个或多个原子轨道相互作用形 成的能量状态,是分子整体的运动状态。
分子轨道理论ppt课件
1、s-s重叠。两个轨道相加成为成键轨道σ,
两者相减则成为反键轨道σ*。若是1s轨道,
则分子轨道分别为σ1s、σ1s*,若是2s轨道,
则写为 σ2s、σ2s*。
节面
σ *ns 能
量
σ ns 11
2、 s-p重叠:形成一个成键轨道 s-p 一个反键轨道 s-p*
2s
2p
σ* s-p
σs-p
12
3、p-p重叠。两个原子的p轨道可以有两 种组合方式,其一是“头碰头”,两个原 子的px轨道重叠后,形成一个成键轨道σp 和一个反键轨道σp*。其二是两个原子的py 或pz轨道垂直于键轴,以“肩并肩”的形 式发生重叠,形成的分子轨道称为π分子轨 道,成键轨道πp,反键轨道πp*。两个原子 各有3个p轨道,可形成6个分子轨道,即 σpx 、σpx* 、πpy 、πpy* 、πpz 、πpz* 。
22
Be2 2s
1s
σ *2s 2s
σ 2s σ *1s
1s σ 1s
(
1s
)
2
(
1s
)
2
(
2s
)
2
(
2s
)
2
KK
(
2
s
)2
(
2s
)2
键级为0,所以Be2不存在。 23
B2
(
1s
)
2
(
1s
)
2
(
2
s
)
2
(
2s
)
2
2 2
1 py
1 pz
键级为0,故不能稳定存在。
18
(3)第二周期,同核双原子分子的分子轨道
《分子轨道理论》PPT课件

O2~F2:σ1s<σ*1s<σ2s<σ*2s <σ2pz<π2py=π2px<π*2py=π*2px<σ*2pz
异核双原子分子: 1σ<2σ<3σ<4σ<5σ<1π<2π<6σ
分子轨道理论(MOT)
三十年代,MOT不仅解决了VBT不能解决的许多 问题,并且提出了“单电子键”、“三电子键”等新 化学键,有效地处理多原子的π键体系,解释了诱导 效应、离域效应等。 从三十年代到五十年代,MOT只能作近似的计算, 主要是借助于半经验的方法来总结和探索各种分子中 化学键的本质。 由于计算机的引入,MOT在五十年代得到较快的 发展。 六十年代,定量的分子轨道研究方法(包括从头计 算的自洽场法和半经验法)得到发展。
Hˆ n
E E1 E2 En
分子的波函数
11 n
2 原子轨道线性组合
Linear Combination of Atomic Orbitals(LCAO)
j C j1 1 C j22
分子轨道
n
C jn n C ji i i 1
原子轨道
py、pz、dxy、dxz、dyz py、pz、dxy、dxz、dyz s、px、pz、dyz、dx2-y2、dz2 s、px、py、dxy、dyz、dx2-y2 s、px、pz、dyz、dxz 、dx2-y2 、dz2 s、px 、py 、pz、dxy、dxz 、dx2-y2 、dz2 s、px、py、pz、dxz、dyz、dzy
第三章
结构化学 ——第三章 双原子子的结构
三 分子轨道理论
分子轨道近似 原子轨道线性组合 分子轨道的成键三原则 分子轨道的表示方法
1 分子轨道近似
分子轨道理论假定分子中每个电子是在原子核 形成的库仑场和其它电子形成的平均势场中运 动,其运动状态可用单电子波函数-分子轨道 ψ来描述。
异核双原子分子: 1σ<2σ<3σ<4σ<5σ<1π<2π<6σ
分子轨道理论(MOT)
三十年代,MOT不仅解决了VBT不能解决的许多 问题,并且提出了“单电子键”、“三电子键”等新 化学键,有效地处理多原子的π键体系,解释了诱导 效应、离域效应等。 从三十年代到五十年代,MOT只能作近似的计算, 主要是借助于半经验的方法来总结和探索各种分子中 化学键的本质。 由于计算机的引入,MOT在五十年代得到较快的 发展。 六十年代,定量的分子轨道研究方法(包括从头计 算的自洽场法和半经验法)得到发展。
Hˆ n
E E1 E2 En
分子的波函数
11 n
2 原子轨道线性组合
Linear Combination of Atomic Orbitals(LCAO)
j C j1 1 C j22
分子轨道
n
C jn n C ji i i 1
原子轨道
py、pz、dxy、dxz、dyz py、pz、dxy、dxz、dyz s、px、pz、dyz、dx2-y2、dz2 s、px、py、dxy、dyz、dx2-y2 s、px、pz、dyz、dxz 、dx2-y2 、dz2 s、px 、py 、pz、dxy、dxz 、dx2-y2 、dz2 s、px、py、pz、dxz、dyz、dzy
第三章
结构化学 ——第三章 双原子子的结构
三 分子轨道理论
分子轨道近似 原子轨道线性组合 分子轨道的成键三原则 分子轨道的表示方法
1 分子轨道近似
分子轨道理论假定分子中每个电子是在原子核 形成的库仑场和其它电子形成的平均势场中运 动,其运动状态可用单电子波函数-分子轨道 ψ来描述。
第四章 分子轨道理论(1)

第四章 分子轨道理论 _
σu
+
σg
1
第四章 分子轨道理论
4.1 氢分子离子 4.2 分子轨道理论 分子轨道的类型、 4.3 分子轨道的类型、符号和能级顺序 4.4 双原子分子的结构和性质 4.5 休克尔分子轨道理论和共轭分子 4.6 分子轨道对称守恒原理
2
引言
化学键:原子间的强烈相互作用。大致分为共价键、 离子键、金属键。
e2
= 1.60219 × 10-19C
1a.u.= 4πε 0 a0 =27.2166 eV 1a.u.= h = 1.0545887 × 10-34 J·s ·
1 2 1 1 1 (− ∇ − − + )ψ = Eψ 2 ra rb R
6
4.1.2 变分原理与线性变分法
变分原理:对任意一个 品优波函数 用体系的Ĥ 变分原理 对任意一个品优波函数 ψ , 用体系的 对任意一个 算符求得的能量平均值,将大于或接近于体系基 算符求得的能量平均值 , 将大于或接近于 体系基 态的能量E0: 态的能量
1.4 Linear Combination of 1.2 1 0.8 0.6 0.4 0.2 0 0 0.2
∂<E> 令 = 0,得: ∂c
⇒
7 133 c1 = − + 4 4 7 133 c2 = − − 4 4
E1 = 4.93
y
0.4
0.6
0.8
1
(最低能量) E2 = 51.1 (舍去此值)
20
(5) 态函数
氢分子离子波函数是单电子空间波函数 。 氢分子离子波函数是 单电子空间波函数。 在 单电子空间波函数 分子中,单电子空间波函数称为分子轨道 分子轨道(简写为 分子中 , 单电子空间波函数称为 分子轨道 简写为 MO)。 。
σu
+
σg
1
第四章 分子轨道理论
4.1 氢分子离子 4.2 分子轨道理论 分子轨道的类型、 4.3 分子轨道的类型、符号和能级顺序 4.4 双原子分子的结构和性质 4.5 休克尔分子轨道理论和共轭分子 4.6 分子轨道对称守恒原理
2
引言
化学键:原子间的强烈相互作用。大致分为共价键、 离子键、金属键。
e2
= 1.60219 × 10-19C
1a.u.= 4πε 0 a0 =27.2166 eV 1a.u.= h = 1.0545887 × 10-34 J·s ·
1 2 1 1 1 (− ∇ − − + )ψ = Eψ 2 ra rb R
6
4.1.2 变分原理与线性变分法
变分原理:对任意一个 品优波函数 用体系的Ĥ 变分原理 对任意一个品优波函数 ψ , 用体系的 对任意一个 算符求得的能量平均值,将大于或接近于体系基 算符求得的能量平均值 , 将大于或接近于 体系基 态的能量E0: 态的能量
1.4 Linear Combination of 1.2 1 0.8 0.6 0.4 0.2 0 0 0.2
∂<E> 令 = 0,得: ∂c
⇒
7 133 c1 = − + 4 4 7 133 c2 = − − 4 4
E1 = 4.93
y
0.4
0.6
0.8
1
(最低能量) E2 = 51.1 (舍去此值)
20
(5) 态函数
氢分子离子波函数是单电子空间波函数 。 氢分子离子波函数是 单电子空间波函数。 在 单电子空间波函数 分子中,单电子空间波函数称为分子轨道 分子轨道(简写为 分子中 , 单电子空间波函数称为 分子轨道 简写为 MO)。 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
( 1 2 1 1 1 ) E
2
ra rb R
PPT课件
6
4.1.2 变分原理与线性变分法
变分原理:对任意一个品优波函数,用体系的Ĥ
算符求得的能量平均值,将大于或接近于体系基
态的能量E0:
E
*Hˆd *d E0
0*Hˆ 0d 0* 0d
1.2
1
0.8
令 E 0,得:
0.6 0.4
c
0.2
c1
7 4
133 4
c2
7 4
133 4
E1 4.93 (最低能量) E2 51.1 (舍去此值)
0
0
0.2
0.4
0.6
0.8
1
x Calculated wave function
Linear Combination of trial function
变分原理的意义:设想一系列尝试变分函数,逐个
求其能量平均值,其中能量最低的那个函数一定最
接近体系的真实波函数。
PPT课件
7
4.1.2 变分原理与线性变分法
【例】利用变分函数ψ=x(l-x)求一维势箱中粒子基 态能量的近似值,波函数。(0<x<l;在箱外f=0)
解:据变分法原理:
E
* Hˆd *d
8
归一化态函数
y y
30 x(l x)
CalcuVlaartieatdiownafvuencftuinocntixo(nl-x)
2
Variation function x(l-x)
1.6
Variation function x^2*(l-x)^2
1L.4inear Combination of trial function
0.8
1
x
Variation function x^2*(l-x)^2
ΔE / E 1.3%
ΔE / E 21.6%
变分法的成功应用取决于尝试变分函数的选择。
PPT课件
9
尝试函数的线性组合的变分方法
x(l x) cx2 (l x)2
E *Hˆd *d
共价键 理论
路易斯理论1916
现代共价键 理论
现代价键理论 分子轨道理论
价键理论 (VB 法) 杂化轨道理论
价层电子对 互斥理论
分子轨道理论是原子轨道理论在分子体系中的
自然推广。
PPT课件
3
4.1 氢分子离子
4.1.1 H2+ 的Schrödinger方程 4.1.2 变分原理与线性变分法 4.1.3 线性变分法解H2+ Schrödinger方程 4.1.4 主要结果分析
ΔE / E 0.00147%
PPT课件
10
线性变分法
选择一组已知线性无关的函数1,2,…m(基函数),
进行线性组合,作为尝试变分函数
m
c11 c22 ...... cmm cii
i1 m
m
( cii )Hˆ ( cii )d
利用求变分积分,可得
2 ra rb R
a
1 era
l
0
x(x
l)(
2 2m
d2 dx2
)x(x
l)dx
l
0 x(x l) x(x l)dx
10
2
h2 8ml 2
与一维势箱解法相比
ΔE E
10 / 2
h2 / 8ml 2 h2 h2 / 8ml 2
/ 8ml 2
(102
1)%
1.3%
PPT课件
1.2
1
0.8
0.6
0.4
0.2
0
0
0.2
0.4
x
Calculated wave function
0.6
0.8
1
Variation function x(l-x)
3 70 x2 (l x)2
CalcuVlaartieatdiownafvuencftuinocntixo^n2*(l-x)^2
3
Variation function x(l-x)
1.8
Variation function x^2*(l-x)^2
1L.6inear Combination of trial function
1.4
1.2
1
0.8
0.6
0.4
0.2
0
0
2
0.4
Calculated wave function
0.6
(4) 单位能量 (5) 单位角动量
1a.u.= a0 = 0.529177A=52.9177pm 1a.u.= me =9.109510-28g 1a.u.= e = 1.6021910-19C
e2
1a.u.= 4 0a0 =27.2166 eV
1a.u.= = 1.054588710-34 J·s
E i1 m
i 1 2
E E ...... E 0
(cii ) d i 1
c1
c2
cm
得 m个关于ci的联立方程——久期方程!
PPT课件
11
4.1.3 线性变分法解H2+ Schrödinger方程
( 1 2 1 1 1 ) E
c2 c 1 105 15 6 c2 c 1
630 70 30
y
CalculLaitneeadrwCaomvbeinfautnicontioonf trial function 4 Variation function x(l-x)
1.6
Variation function x^2*(l-x)^2 1L.4inear Combination of trial function
PPT课件
4
4.1.1 H2+ 的Schrödinger方程
三质点体系, 基于Born-Oppenheimer近似:
Hˆ 2 2 e2 e2 e2
Hˆ E
2m 4 0ra 4 0rb 4 0R
PPT课件
5
原子单位制(Atomic Unit)
(1) 单位长度 (2) 单位质量 (3) 单位电荷
第四章 分子轨道理论
_ +
PPT课件
u
g
1
第四章 分子轨道理论
4.1 氢分子离子 4.2 分子轨道理论 4.3 分子轨道的类型、符号和能级顺序 4.4 双原子分子的结构和性质 4.5 休克尔分子轨道理论和共轭分子 4.6 分子轨道对称守恒原理
PPT课件
2
引言
化学键:原子间的强烈相互作用。大致分为共价键、 离子键、金属键。
