第九章热力学2
大学物理-热力学基础必考知识点

第九章 热力学基础主要内容一.准静态过程(理想过程,在P-V 图中代表一条线) 系统从一个平衡态到另一个平衡态,中间经历的每一状态都可以近似看成平衡态(平衡态在P-V 图中代表一个点)过程。
二.理想气体状态方程:112212PV PV PV C T T T =→=; m PV RT M'=; P nkT = 8.31J R k mol =;231.3810J k k -=⨯;2316.02210A N mol -=⨯;A R N k =三.热力学第一定律Q E W =∆+;dQ dE dW =+…1.气体做功 21V V W Pdv =⎰ (规定气体对外做功>0 )2.Q (规定气体从外界吸收热量>0,过程量,只有在某个过程中才有意义)3.2121()V m V m m m dE C dT E E C T T M M ''=-=- 或 (状态量,理想气体内能只取决于温度,内能变化公式适用于任意的过程。
),2V m i C R =,=,P +22m i C R (i 为自由度,单原子分子自由度为3,双原子分子为5,多原子分子为6), =+,P ,m V m C C R ,气体比热容比:γ=>,,1P m V m C C四.热力学第一定律在理想气体的等值过程和绝热过程中的应用1. 等体过程-2(V m T 2. 等压过程⎧=⋅-=-⎪⎪⎪=∆+=-=⋅∆⎨⎪⎪∆=-∆⎪⎩21212121()()+2()2()=2p m V m m W P V V R TT M m i Q E W C T T P VM mi E C T T P V M;3.等温过程212211T T E E m V m p Q W RTln RTlnM V M p -=⎧⎪''⎨===⎪⎩1. 绝热过程210()V m Q W E C T T ν=⎧⎪⎨=-∆=--⎪⎩绝热方程1PV C γ=, -12V T C γ= ,13P T C γγ--= 。
统计热力学基础第九章2
l l al e 3 h
e
N Z1
Z1 V (
2m 3 / 2 ) 2 h
al
V
dxdydzdp x dpy dpz h
1
3
e
l
N 2m 3 / 2 V( 2 ) h
2 2 ( p2 1 x p y pz ) 3/ 2 N( ) e 2 mkT dpx dpy dpz 2mkT
配分函数的分离
根据配分函数的定义,将 i 和 i 的表达式代入,得:
q i exp(
i
i
kBT
)
i ,ti ,ri ,vi ,ei ,n exp(
i
i ,t i ,r i ,v i,e i,n
kBT
)
从数学上可以证明,几个独立变数乘积之和等于
f (v) m 3/ 2 [4 N ( ) e v v 2 kT [e v
mv 2 2 kT
mv2 2 kT
v2 ] 0
v2] 0
e
mv m 2 2 kT
mvm 2 [( )vm 2v m ] 0 kT
2kT m 2 RT M
vm
用分布函数计算与速率有关的物理量 在速率 0 ~ 区间内的平均值
SV Nk B ln qV Nk BT
d ln qV dT
d ln qe Se Nk B ln qe Nk BT dT d ln qn Sn Nk B ln qn Nk BT dT
的不可分辨性是与平动相联 系的。
§9.4 平动配分函数
1. 一维平动子:
0
2
大学物理第九章热力学讲解

i C R
V2
单 i 3 双 i 5 多 i 6
i 气体分子的自由度
ν摩尔理想气体在等体过程中, 温度从T1升高到 T2(或降低) ,吸收的热量为
Q V
E - E
2
1
i RT - T
2
2
1
CV T2 - T1
2
1
2
2
1
V
Q E - E + pV V
p
2
1
2
1
C DT + RDT V
定压摩尔热容: 1mol 理想气体在等压过程中吸
收的热量dQp ,温度升高 dT,其定压摩尔热容为
dQ C p
dT p ,m
dQ C dT
p
p ,m
定压摩尔热容另一表述: 1mol 理想气体在等压
p
等 p2 体
升 压
p1
o
2 ( p2,V ,T2 )
1 ( p1,V ,T1)
V
V
T1 T2 Q 0 DE 0
QV
E1
E2
p
等 p1
体
降 压
p2
o
Q E - E i RT - T
V
2
1
2
2
1
1( p1,V ,T1)
2( p2,V ,T2 )
V
V
T1 T2 Q 0 DE 0
2 公式适用条件 气体压强不太大,温度不太低,密度不太高
例1 一容器内贮有氧气 0.10kg,压强为10atm, 温度为 470C。因容器漏气,过一段时间后,压强 减到原来的 5/8,温度降到 270C。问: (1)容器体积为多大? (2)漏去了多少氧气?
第九章相变——精选推荐

第九章相变第九章相变前⼋章我们重点讨论了⽓体的各种性质,也介绍了液体、固体的基本热学性质。
可以说,我们基本上研究了所有的物质。
到此为⽌,我们对热学这门课的梗概应该有⼀个轮廓了。
但是事物之间是普遍联系的,普遍联系的原则是⾃然界最基本的原则。
⾃然界中许多物质都以固、液、⽓三种集聚态存在,然⽽物质的三态可以互相转化并为物质本的性所决定。
例如,常态下液体的⽔可变成⽔蒸汽,也可变成冰,⽽且冰可直接变成汽。
都⾮常形象地说明了这种联系。
显然,这⼀系列转化都与物质内部微粒的热运动有着密切关系。
因此,作为普通物理的热学,⾄少应当对这个问题有⼀个简明的回答,哪怕是最肤浅的。
物质为什么会发⽣物态变化?物态变化的条件什么?物态变化的规律是什么?这些都是我们必须回答的基本问题。
这正是本章的内容。
§1单元第⼀级相变的主要特征教学⽬的和要求:理解“相变”等概念,理解“相变潜热”的物理意义。
掌握单元系⼀级相变的普遍特点和简单规律。
教学时间:⼀课时教学内容:⼀.预备知识:1.何谓相?物理性质均匀的部分,它和其它部分之间有⼀定的分界⾯隔离开来。
例如:冰和⽔的混合物,冰块和⽔有分界⾯,冰块⾥⽔物理性质三均匀的,液体中的⽔物理性质也是均匀的。
那么,冰释⼀个相,⽔也是⼀个相。
2.单元复相系(1)单元:⼀种学化物质(2)单元单相:⼀种化学物质⼀个相的体系例如:冰总是⽔的单元单相系⽔、⽔蒸汽没有混合,是两个单元相性(3)单元复相系:⼀种化学物质,有两个或以上的相。
这样的体系为单元复相系例如,冰⽔混合物是⽔的单元:相系开着的⽔也是⽔的⼀个单元⼆相系固体中不同的点阵结构可视为不同的相。
本书只研究单元系3.相变:物体的相变发⽣变化叫相变相变是在⼀定的温度和压强下进⾏的。
例如,在1atm和100℃时,⽔由液体相变成汽相,但若P不是1atm时,沸点也不再是100℃。
⾼压锅就是这样。
4.⼆级相变:没有什么积的变化,也没有相变潜热,⼈有热容易膨胀系数,⾼温压缩系数发⽣突变。
热力学第二定律ppt课件

从单一热源吸收热量,全 部用来做功而不引起其它 变化叫做第二类永动机。
热力学第二定律的另一种表述就是: 第二类永动机不可能制成。
P61
对宏观过程方向的说明,都可以作为热二的表述。 例如:气体向真空的自由膨胀不可逆;
一切宏观自然过程的进行都具有方向性。
P61
柴薪时期
煤炭时期
石油时期
P61-62
Q2=Q1+W Q1=Q2+W
热机工作时能否将从高温热 库吸收的热量全部用来做功?
不能,从高温热库吸收的热量的一部分 用来做功,剩余的部分释放到低温热库。
Q1
热机工作:
P60
燃料燃烧 冷凝器或大气
漏气热损 散热热损 摩擦热损
燃料产生的 热量Q
输出机械功W
W< Q
P60
P61
对周围环境不产生 热力学方面的影响, 如吸热、放热、做 功、压强变化等。
P59
适用于宏观过程对微观过程不适用
P59
电冰箱通电后箱内温度低于箱外温度,并且还会 继续降温,直至达到设定的温度。显然这是热量从低 温物体传递到了高温物体。这一现象是否违背热力学 第二定律呢?
不违背。电冰箱能实现热量从低温物体传给高温 物体,但这不是自发地进行的,需要消耗电能。
制冷机工作时热量是自发地 从低温热库传到高温热库吗? 不是,有外界做功。
3.4 热力学第二定律
P59
可能发生这样的逆过程吗? 热量自发地由高温物体向低温物体传递的过程是不可逆的
可能发生这样的逆过程吗?
功可以自动转化为热 , 但热却不能自动转化为功。 通过摩擦而使功转变为热的过程是不可逆的。
热现象
物体间的传热 气体的膨胀
0-第9章-2-热力学第二定律

低温
反应CO(g) + H2O(g) CO2(g) + H2(g) 的平衡常 数与温度关系
Marine Chemistry, 70, 23-35, 2000
Fe3+(aq) + H2O FeOH2+(aq) + H+(aq)
DH = 42.7 kJ/mol(吸热)
高温
低温
Marine Chemistry, 70, 23-35, 2000
标准态, C =1
Clapeyron-Clausis 方程
适合许多种类的物理和化学过程:
气-液, 气-固, 液-液, 液-固
Trouton规则 非极性液体的正常沸点与蒸发焓(热)有关:
F.T. Trouton (爱,1863-1922)
极性液体, 比值增高.
如, 水, ~109 J mol-1 K-1
可逆反应
m
pA + qB ƒ
n
mC + nD
平衡常数 [C] [D] = K 浓度(单位)平衡常数 C p q [A] [B]
p p p p
m C p A
m C p A
n D q B n D q B
= KP
压力(单位)平衡常数
x x x x
= K X 摩尔分数(单位)平衡常数
K 有量纲!
(产物)/(反应物)
NO2
离解反应
N2O4 2 NO2
平衡
平衡
各组分的浓度不 再随时间变化
最后化学平衡
如何理解
动态平衡?
N 2O 4
NO2
静态平衡 动态平衡
非平衡
反应没停止
化学平衡 “动态平衡”
第9章 热力学第二定律(简化基础版2009)

3 4 5 6 7 8 9 1 0 10 总数
10 9 8 7 6 5 4 3 2
一定的宏观条件下,有多种可能的宏观状态, 一定的宏观条件下,有多种可能的宏观状态, 哪一种宏观状态是实际观察到的呢? 哪一种宏观状态是实际观察到的呢? 统计假设:对于孤立系统, 统计假设:对于孤立系统,各个微观状态出现的可 能性(概率 是相同的。 概率)是相同的 能性 概率 是相同的。
火车刹车,叶片在水中转动水温升高。 火车刹车,叶片在水中转动水温升高。
逆过程:热自动地转换为功。或者说, 逆过程:热自动地转换为功。或者说,不引起
其它变化,唯一效果是一定量的内能(热)全 其它变化,唯一效果是一定量的内能( 部转换成了机械能( 不可能发生) 部转换成了机械能(功) (不可能发生) 车轮自动冷却,车子启动; 车轮自动冷却,车子启动; 水温自动降低,产生水流, 水温自动降低,产生水流,推动叶片转动
热量可自动地通过某种假想装置全部转变为功
A
Q
热库T 热库 0 T>T0
由温度为T 由温度为 0 的热库 吸热Q全部转化为 吸热 全部转化为 A, 功A,并用于转动 叶片使温度为 的水升温— T(>T0)的水升温 的水升温 —热量由低温物体 热量由低温物体 传向了高温物体! 传向了高温物体!
2、热量由高温物体传向低温物体的不可逆性消失 热量可自动地通过某种假想装置从低温传向高温
结论 各种宏观自然过程的不可逆 性都是互相联系在一起或者 说是相互依存的。 说是相互依存的。只需承认 其中之一的不可逆性, 其中之一的不可逆性,便可 论证其他过程的不可逆性! 论证其他过程的不可逆性!
§9.3 热力学第二定律及其微观意义
一、热力学第二定律
克劳修斯表述(1850年 1、克劳修斯表述(1850年) 热量不可能自动地从低温物体传到高温物体。 热量不可能自动地从低温物体传到高温物体。 开尔文表述(1851年 2、开尔文表述(1851年) 不可能制成一种循环动作的热机, 循环动作的热机 不可能制成一种循环动作的热机,它只从一个从 单一热源吸取热量 吸取热量, 单一热源吸取热量,并使之完全变成有用的功而 不引起其他变化。 不引起其他变化。(唯一效果是热全部转变为功 的过程是不可能的) 的过程是不可能的) 另一表述:第二类永动机( 另一表述:第二类永动机(从单一热源吸热并全 部变为功的热机)是不可能实现的。 部变为功的热机)是不可能实现的。
物理化学第九章 统计热力学初步

统计热力学的基本任务
根据对物质结构的某些基本假定,以及实 验所得的光谱数据,求得物质结构的一些基本常 数,如核间距、键角、振动频率等,从而计算分 子配分函数。再根据配分函数求出物质的热力学 性质,这就是统计热力学的基本任务。
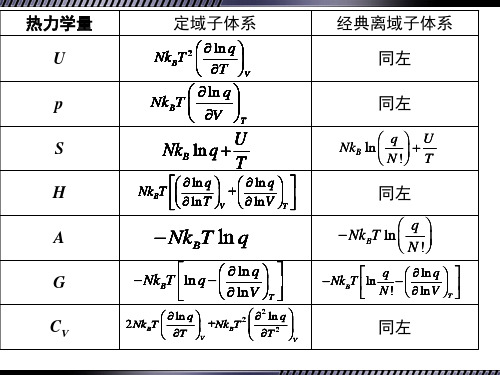
定域子系统和离域子系统
粒子(子)(particles) ——聚集在气体、液体、固 体中的分子、原子、离子等。
t r v e n
同时,其简并度等于各独立运动形式的简并度之 积:
g gt gr gv ge gn
运动自由度
对于一个具有n个原子的分子,通常有3n个自 由度,分别为: 3个平动自由度(xyz轴方向的平动) 3个转动自由度(围绕三个轴的旋转) 3n-6个振动自由度 对于线型分子,转动自由度为2(围绕线轴的 旋转可忽略),振动自由度为3n-5
系统的可能的能级分布方式有:
能级分布数
能级分布 n0
n1
n2 n3
Σni
Σniεi =9hν/2
Ⅰ 0 3 0 0 3 3×3 hν/2=9hν/2
Ⅱ 2 0 0 1 3 2×hν/2+1×7hν/2=9hν/2
Ⅲ 1 1 1 0 3 1×hν/2+1×3hν/2 +1×5hν/2=9hν/2
2.状态分布
1.分子的平动
t
h2 8m
(
nx2 a2
n2y b2
nz2 c2
)
对立方容器a=b=c,V=a3
t
h2 8mV 3 / 2
( nx2
n2y
nz2
)
量子力学中把能级可能有的微观状态数称为该 能级的简并度(degeneration),用符号g表示。 简并度亦称为退化度或统计权重。
工程热力学知识点笔记总结

工程热力学知识点笔记总结第一章热力学基本概念1.1 热力学的基本概念热力学是研究能量与物质的转化关系的科学,它关注热与功的转化、能量的传递和系统的状态变化。
热力学中最基本的概念包括系统、热力学量、状态量、过程、功和热等。
1.2 热力学量热力学量是描述系统的性质和状态的物理量,包括内能、焓、熵、自由能等。
内能是系统的总能量,焓是系统在恒压条件下的能量,熵是系统的无序程度,自由能是系统进行非体积恒定的过程中能够做功的能量。
1.3 热力学第一定律热力学第一定律是能量守恒的表达形式,在闭合定容系统中,系统的内能变化等于系统所接受的热量减去系统所做的功。
1.4 热力学第二定律热力学第二定律是描述系统不可逆性的定律,它包括开尔文表述和克劳修斯表述。
开尔文表述指出不可能将热量完全转化为功而不引起其他变化,克劳修斯表述指出热量自然只能从高温物体传递到低温物体。
根据第二定律,引入了熵增大原理和卡诺循环。
1.5 热力学第三定律热力学第三定律是指当温度趋于绝对零度时,系统的熵趋于零。
这一定律揭示了绝对零度对热力学过程的重要意义。
第二章热力学系统2.1 定态与非定态定态系统是指系统的性质在长时间内不发生变化,非定态系统是指系统的性质在长时间内发生变化。
2.2 开放系统与闭合系统开放系统是指与外界交换物质和能量的系统,闭合系统是指与外界不交换物质但可以交换能量的系统。
2.3 热力学平衡热力学平衡是指系统内各部分之间的温度、压力、化学势等性质达到一致的状态。
系统处于热力学平衡时,不会产生宏观的变化。
第三章热力学过程3.1 等温过程在等温过程中,系统的温度保持不变,内能的变化全部转化为热量输给外界。
3.2 绝热过程在绝热过程中,系统不与外界交换热量,内能的变化全部转化为对外界所做的功。
3.3 等容过程在等容过程中,系统的体积保持不变,内能的变化全部转化为热量。
3.4 等压过程在等压过程中,系统的压强保持不变,内能的变化转化为对外界所做的功和系统所吸收的热量。
工程热力学与传热学-§9-2 稳态导热

作业
P230-233 习题 9-2、4、6、7
12
13
r = r2 : t = tw1
6
§9-2 稳态导热
对导热微分方程式进行两次积分, 可得通解为
t C 1 ln r C 2
圆筒壁内的温度分布为对数曲线。代入边界条件,可得
t
tw1
tw1
tw
2
ln r ln r2
r1 r1
温度沿r 方向的变化率为
dt dr
tw1 tw2
定的温度tw1、tw4。
显然,通过此三层平壁的导热为稳态 导热, 各层的热流量相同。
4
§9-2 稳态导热
三层平壁稳态导热的总导热热阻为各层导热热阻之和, 由单层平壁稳态导热的计算公式可得
tw1 tw4
R1 R 2 R3
1
tw1 tw4
2
3
A1 A2 A3
tw1 tw2 1 ln r2
tw1 tw2 1 ln d2
tw1 tw2 R
2l r1
2l d1
R为整个圆筒壁的导热热阻, 单位是K/W。
单位长度圆筒壁的热流量为
l
l
tw1 tw2 tw1 tw2
1 ln d2
Rl
2 d1
Rl为单位长度圆筒壁的导热热阻, 单位是m·K/W。
内热源,两侧表面分别维持均匀恒定的温度
tw1、tw2,且tw1 > tw2 。
选取坐标轴x与壁面垂直,如图所示。
2
§9-2 稳态导热数学Fra bibliotek型:d2t 0
dx2
《工程热力学》学习资料 (2)

连续的,转速高,输出功率大。
34
燃气轮机(gas turbine)装置简介
35
q2
排气
燃烧室
4
q1
3
2
泵
压气机
汽轮机
燃料
1 进气
燃 气 轮 机 装 置 示 意 图
36
循环示意图
2 燃烧室 3
压气机
燃气轮机
1
4
理想化: 1)工质:数量不变,定比热理想气体 2)闭口 循环 3)可逆过程
作业:结合思考题看书。9-1、9-15
66
本章结束
67
思考
同样是柴油机 为什么有混合加热循环和定压加热循环之分?
p
3 2
4
5 1
v
p 2(3)
4 5 1 v
29
高速柴油机与低速柴油机循环图示
p 34
p
tp
1
k 1
k1k 1
2
2(3) 4 1
5
5
1
v
高速柴油机,压燃式、轻 柴油、高压油泵供油。
1
v
低速柴油机,压燃式、重柴 油、压缩空气喷油。
30
四冲程高速柴油机工作过程
3—4 边喷油,边膨胀
p3 4
近似 p 膨胀
t4可达1700~1800℃
2 2'
4 停止喷柴油
4—5 多变膨胀
p0
p5=0.3~0.5MPa
0
t5500℃ 5—1‘ 开阀排气
,V
降压
1‘—0 排气,完成循环。
5 1'
1 V
17
四冲程高速柴油机的理想化
热力学统计物理-统计热力学课件第九章-49页PPT文档资料

N,V
22
系统热平衡条件 : 1 2
热力学中类似的两个系统达到热平衡的条件:
US11
N1,V1
US22
N2,V2
比较可得:
1 kT
Skln
S U
N ,V
1 T
——熵与微观状态数的关系—玻耳兹曼关系。
•不仅适用于近独立粒子系统,也适用于粒子间存在相
01.12.2019
1 E (E 11) 2(E 2) 1(E 1) 2 E (E 22) E E 1 20
ln E 11(E1)N1,V1 ln E 22 (E2)N2,V2 ——系统热平衡条件
lnE(E)
ln V
N
,E
lnN 11E1,V1 lnN 22E2,V2
ln N
E,V
1 1
1 2 1 2
01.12.2019
24
•参量的物理意义
全微分: d ln d E d V d N
开系的热力学基本方程:
dSdUpdVdN
TT T 比较可得:
01.12.2019
1 kT
p kT
kT
1 1
1 2 1 2
T1 T2 p1 p2
1 2
25
经典理想气体——确定常量k
(N,E,V)VN
在经典理想气体中,粒子的位置是互不相关的。一个 粒子出现在空间某一区域的概率与其它粒子的位置无关。 一个粒子处在体积为V的容器中,可能的微观状态数与V 成正比,N个粒子处在体积为V的容器中,可能的微观状 态数将与VN成正比。
《工程热力学》第九章 气体动力循环

9-4 活塞式内燃机各种理想循环的热力学比较
一、压缩比相同、吸热量相同时的比较 压缩比相同,1-2重合
吸热量相同,q1v q1m q1p
q2v q2m q2 p
tv tm tp
或
T 2v T 2m T 2 p
T 1v T 1m T 1p
tv
tm
tp
二、循环最高压力和最高温度相同时的比较
放热量相同:
又称萨巴德循环 12 等熵压缩;23 等容吸热; 34 定压吸热;45 等熵膨胀; 51 定容放热
特性参数:
压缩比(compression ratio) v1
v2 定容增压比(pressure ratio) p3
p2
定压预胀比 (cutoff ratio) v4
v3
反映气缸容积 反映供油规律
热效率
t
wnet q1
t
1
1
1
1
1
(9 7)
讨论:
v1 p3
v2
p2
v4
v3
a)循环1-2’-3’-4’-5-1
压缩比
Tm1 t
b)循环1-2-3”-4”-5-1
定容增压比
Tm1 t
c)循环1-2-3’”-4’”-5-1
定压预胀比
Tm1 t
二、定压加热理想循环(狄塞尔循环) 柴油机定压加热过程
3-4 等熵膨胀(燃气轮机内) 4-1 定压放热(排气,假想换热器)
热效率ηt
q1 h3 h2
cpm
t3 t2
T3 T2
cp
T3 T2
q2
h4
h1
c pm
t4 t1
T4 T1
cp T4 T1
第9章 热力学 (习题、参考答案)

第9章 热力学基础一. 基本要求1. 理解平衡态、准静态过程的概念。
2. 掌握内能、功和热量的概念。
3. 掌握热力学第一定律,能熟练地分析、计算理想气体在各等值过程中及绝热过程中的功、热量和内能的改变量。
4. 掌握循环及卡诺循环的概念,能熟练地计算循环及卡诺循环的效率。
5. 了解可逆过程与不可逆过程的概念。
6. 解热力学第二定律的两种表述,了解两种表述的等价性。
7. 1. 内能 E 仅为温度T 功 在p —V 热量 2. 3. (1)(2) 系统吸收的热量 12M P m o lP式中R C C V P +=为等压摩尔热容。
(3)等温过程 温度不变的过程,其特点是温度T =常量;其过程方程为pV =常量在等温过程中,系统内能无变化,即(4)绝热过程 不与外界交换热量的过程,其特点是dQ=0,其过程方程pV γ=常量在绝热过程中,系统对外做的功等于系统内能的减少,即7. 循环过程 系统从某一状态出发,经过一系列状态变化后又回到了初始状态的整个变化过程。
其特点是内能变化为零,即在循环过程中,系统吸收的净热量(吸收热量1Q 与放出热量2Q 之差。
注意这里及以后的2Q 均指绝对值)与系统对外做的净功(系统对外作的功1A 与外界对系统作的功2A 之差)相等,即若循环沿过程曲线的顺时针方向进行(称为热循环),则其效率8. 卡诺循环 由两个等温过程和两个绝热过程组成的循环,其效率习 题9-1有两个相同的容器,容积固定不变,一个盛有氦气,另一个盛有氢气(看成刚性分子的理想气体),它们的温度和压强都相等,现将5J 的热量都传给氢气,使氢气温度升高,如果使氦气也升高同样的温度,则应向氦气传递的1)绝程在V—T a 和由初态a ′cb b ,如P (A)Q 1<0,Q 1>Q 2 (B )Q 1 >0,Q 1>Q 2(C )Q 1<0,Q 1<Q 2 (D )Q 1>0,Q 1<Q 2 [ ]9-8设高温热源的热力学温度是低温热源的热力学温度的n 倍,则理想气体在一次卡诺循环中,传给低温热源的热量是从高温热源吸取的热量的(A )n 倍 (B )n -1倍 (C )n1倍 (D )n n 1+倍 [ ]9-10如图所示的两个卡诺循环,第一个沿A 、B 、C 、D 、A 进行,第二个沿A 、B 、C /、D ?、A 进行,这两个循环的效率?1和?2的关系及这两个循环所作的净功A 1和A 2的关系是(A )?1=?2,A 1=A 2 (B )?1>?2,A 1=A 2 (C )?1=?2,A 1>A 2(D )?1=?2,A 1<A 2 [ ] 9-14 一定量的理想气体,分别经历如图(1)所示的abc 过程,(图中虚线ac 为等温线),和图(2)所示的def 过程(图中虚线df 为绝热线)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
温度读 数不变
打开阀门
ห้องสมุดไป่ตู้
Q E A
得 E 0
c
E E(T )
气体内能仅是温度 的函数,与体积无关。
— 焦耳定律
a
b
焦耳试验
山东轻工业学院 数理学院
2
第九章 热力学
说明
1.焦耳实验是在1845年完成的,当时温 度计的精度为 0.01 ℃, 没有测出水温的微小 变化。
2.通过改进实验或其它实验方法(焦耳 - 汤姆孙实验),证实仅理想气体有上述结 论。
V
V
QV
E1
E2
P
等 P1 体 降 压 P2
o
1 ( p1,V ,T1)
2 ( p2,V ,T2 )
V
V
QV
E1
E2
山东轻工业学院 数理学院
13
第九章 热力学
二、等压过程
在等压过程中, 理想气体的压强保持不变。
1. 特征 p = C, dP = 0
2. 过程方程
p1V1 p2V2 V1 V2
求把中间隔板抽去后,达
到新平衡时气体的压强。
p0
解 绝热
Q0
自由膨胀过程 A 0
热力学第一定律 Q E A
山东轻工业学院 数理学院
7
第九章 热力学
所以 E 0
p0
即 T1 T2
又 初、末两态遵守理想气体状态方程 (过程方程),所以有
p0 (V0 2) pV0 达到新平衡时气体的压强 p p0
理想气体内能的变化仅与系统起始和终 了状态的温度有关,与状态变化过程无关。
m 摩尔理想气体内能变化
M
dE
m M
CVm dT
E
m M
CVm
(T2
T1)
(适应于理想气体的一切过程)
山东轻工业学院 数理学院
12
第九章 热力学
判断内能变化
P
等 P2 体 升 压 P1
o
2 ( p2,V ,T2 )
1 ( p1,V ,T1)
实际气体,内能与温度和体积有关
E E(T、V ) 只有理想气体的内能是温度的单值函数
E E(T )
山东轻工业学院 数理学院
3
第九章 热力学
二、定压摩尔热容Cpm与定体摩尔热容 CVm的关系
Cpm
dQ dT
dE dA dT
dE dT
p
dV dT
CVm
p
dV dT
由理想气体物态方程
pV m RT M
2. 过程方程
p1V1 p2V2
T1
T2
p1V1 p2V2 pV C(玻意耳定律)
3. 过程曲线
P A( p1,V1,T )
p1
在P-V 图上,每一 个等温过程对应一条双 曲线,称为等温线。
p2
O V1
T B( p2,V2,T ) V
V2
山东轻工业学院 数理学院
18
第九章 热力学
4. 功 dA = pdV
= CPm / CVm
在一般问题所涉及的温度范围内,气体
的CPm、CVm和 都近似常数。
单原子分子
CVm
3 2
R
,
1.67
双原子分子
CVm
5 2
R
,
1.40
山东轻工业学院 数理学院
6
第九章 热力学
例如图,一绝热密封容器,体积为V0,中间 用隔板分成相等的两部分。左边盛有一定量
的氧气,压强为 p0,右边一半为真空。
山东轻工业学院 数理学院
4
第九章 热力学
摩尔数 m 1 M
等压过程 p C pV RT
两边求导 pdV RdT
或 代入 得
p dV R
dT
Cpm
CVm
p
dV dT
Cpm CVm R
山东轻工业学院 数理学院
5
第九章 热力学
或 Cpm CVm R — 迈耶公式
摩尔热容比
定压摩尔热容与定体摩尔热容的比值
第九章 热力学
9.5 理想气体的内能和CVm ,Cpm
一、 理想气体的内能 问题:内能 E 与 p, V,
温度读 数不变
打开阀门
T 关系如何?
焦耳试验(1845年 )
c
膨胀前后气体 温度不变
a
b
T2 T1
焦耳试验
山东轻工业学院 数理学院
1
第九章 热力学
气体在绝热自由膨胀过程中
A0 , Q0 由热力学第一定律
P A( p1,V1,T )
A V2 PdV V1
p1 p2
(等温线下面的面积) O
T B( p2,V2,T ) V
V1 pdV V2
5. 热力学第一定律
dQ = dA = pdV
QT
A
V2 PdV
V1
6. 内能变化 dE = 0
气体等温膨胀时,对
外作功,内能减少,温度 降低,热源传给汽缸热量, 使温度保持不变。
气体等温压缩时,外 界对气体作功,温度上升, 气体传给热源热量,使温 度保持不变。
恒温热源恒温热源 T 汽缸恒温热源T接触
山东轻工业学院 数理学院
17
第九章 热力学
1. 特征 T = C, dT = 0 ( dE = 0 )
2
山东轻工业学院 数理学院
8
第九章 热力学
9.5 热力学第一定律对理想气体在 典型准静态过程中的应用
计算各过程的热量、功和内能的理论基础:
(1) pV RT (理想气体的共性)
dQ dE pdV
(2) Q E V2 pdV
解决过程中能 量转换的问题
V1
(3) E E(T ) (理想气体的状态函数)
(4) 各等值过程的特性。
山东轻工业学院 数理学院
9
第九章 热力学
一、等体过程
在等体过程中,理想气体的体积保持不变。
1. 特征 V = C,dV = 0
2. 过程方程
P
p1V1 p2V2 p1 p2
P2
T1
T2
T1 T2
P1
p C (查理定律)
o
T
V V
3. 过程曲线 平行于p 轴的等体线。
等压过程中,理想气体吸收的热量一部分 用来增加其内能,另一部分用来对外作功。
6. 内能变化
E
m M
CVm
(T2
T1)
由第一定律 Q E W 得
m M
Cpm (T2
T1)
m M CVm (T2 T1) p(V2 V1)
山东轻工业学院 数理学院
16
第九章 热力学
三、等温过程 在等温过程中, 理想气体的温度保持不变。 等温过程的实现
T1
T2
T1 T2
V C
(盖-吕萨克定律)
T
山东轻工业学院 数理学院
14
第九章 热力学
3. 过程曲线 平行于V 轴的等压线。
4. 功
A
pdV
p
V2 V1
dV
p(V2
V1 )
(A 等于等压线下的面积 )
P
P
O
V1
V V2
P
P
A
O
V
V1
V2
山东轻工业学院 数理学院
15
第九章 热力学
5. 热力学第一定律 dQp dE pdV
山东轻工业学院 数理学院
10
第九章 热力学
4. 功 A = 0
5. 热力学第一定律
由 dQ dE pdV
得 dE = dQ
等体过程中理想气体吸收的热量全部 用来增加其内能。
山东轻工业学院 数理学院
11
第九章 热力学
6. 内能变化 由等体过程第一定律 dE = dQ
得 dE dQV CVmdT
