美国FDA计算机系统验证
FDA认证检查的六大系统

3.9
3.10 拒绝任何组件,容器,封闭不满足接受要求。
容器和密封件的拒绝3.11 组件,
/复查3.12 先入先出,使用组件,
3.13 quarantine of rejected materials拒绝物
3.14 水和工艺气体供应,设计,维护,验证和操
3.15
3.16 计算机化或自动化
2.6 照明,饮用水,洗手间设施,
2.7 建筑物的卫生,杀鼠剂,杀真菌剂,杀
清洁剂和消毒剂的使用厂房卫生,灭鼠剂,杀真菌剂,
2.8 drawing(as built)布
II设备设备 设备安装和运行确认 设备设计,
适当使用设备操作物质
/容器等。适当的设
/容器等物质的使用(例如,润滑剂,冷却
清洁程序和清洁验证控制以防止污染,
6.6 参考标准; 来源,纯度和
6.7 系统适用性检查色谱系统(如GC或HPLC)有
6.8
6.9 遵守书面的分析方法遵守书面的分析方法
分析方法的验证/确认6.11 实验室操作变更控制系统
6.12 对正
6.13 文件调查任何意外的差异记录任何未期望的不一致
6.14 所有测试的完整分析记录和结果摘要来自所有
认证检查的六大系统
翻译:bjlidi 来自:蒲公英
质量保证体系1.1 产品评论(每年)产品审查(年度)
投诉审查(质量和医疗)1.3 差异和失败调查不一致
1.4 文件控制文件控制1.5 批量释放1.6
1.7 再加工/返工1.8 退货/补救退回/
1.9 拒绝拒绝1.10 稳定性失败1.11 隔离待验1.12
/验证和安全3.17 成品分销记录由批最终产品按
3.18 文件调查任何意外的差异记录任何未期
FDA GAMFDA GAMP验证和临床数据转换

• CDISC培训
Business & Decision: 生命科学纵观
第 14 页
我们的优势
CDISC标准的参与者、CDISC官方培训机构
• 我们的CDISC专家是 • 全世界第一个CDISC实施项目的负责人(Tibotec) • CDISC标准制定成员 • CDISC国际会议主讲者之一
Chester Oxford London Manchester Sunderland
法国 西班牙
摩洛哥 突尼斯
比利时、荷兰、卢森堡
德国
俄国 南斯拉夫
瑞士
Petach Tikva 意大利
印度
毛里求斯
北京
跨行业的专业知识
金融服务
生命科学
制造
电讯和媒体 大众消费产业
公共机关
公共设施及 服务
Business & Decision: 生命科学纵观
• 由于ERP系统的复杂性,对验证水平和经验的要求就很高 • 验证需要把计算机技术概念用FDA的标准词汇来解释,就需要同时对计算机系统和
FDA标准有深刻的理解 • 在欧美国家中,FDA检查成熟的ERP系统时,找出问题的比例不算高(20%找出小
问题),但这些公司已有至少15年的经验。 • 对没有经验的医药公司,找出大问题的可能为50%,而被拒绝发照 • 对新医药公司的检查要严格得多 • FDA总是选派最有经验的检查员到国外检查,他们知道哪里最可能出现问题,而且知
第 21 页
与市场领袖的强势合作
通用软件
商业智能
客户关系管理
Business & Decision: 生命科学纵观
制药企业计算机系统验证方法

制药企业计算机系统验证方法药品生产厂家在工业4.0、中国制造2025的影响下,逐步开始尝试实施自动化系统,但制药企业实施自动化系统有其特殊性,系统不但要满足用户所需要的功能,并且需要对系统实施计算机化系统验证,目前计算机系统验证在国内药企来说都没有太多经验,本文将介绍如何运用将系统实施与验证结合的方法,来进行计算机系统验证。
标签:EMS系统;计算机化系统验证;CSV;GAMP5[Abstract] The drug manufacturer in industrial 4.0,China manufacturing 2025,and gradually began to try to implement automation system,but pharmaceutical companies implementation of automation system has its particularity,system is not only to meet user needs the function,and the need for the implementation of computerized system validation of the system,at present the computer system validation in the domestic pharmaceutical companies are not too much experience. This paper introduces how to use the method of system implementation and validation in combination with,to verify the computer system.[Key words] EMS system;Computerized system validation;CSV;GAMP5中国GMP附录二《计算机化系统》自2015年12月1日颁布以来,不但给制药企业使用自动化系统提供法规依据,而且加大了制药企业使用自控系统的决心,目前有一些制药企业已经在使用EMS系统来实现生产洁净区的温湿度、压差、尘埃粒子等的在线监控和记录,但在实施EMS系统时,制药企业就必须要考虑到计算机系统验证问题,那么该文就以EMS系统为例,介绍如何采用目前国际通用的GAMP5所建议的方法,来实施EMS系统验证。
GMP法规附录《计算机化系统》那些事儿-Waters

GMP 法规附录法规附录《《计算机化系统计算机化系统》》那些事儿2015年5月26日,CFDA 正式发布了2010版GMP 法规的新附录之一《计算机化系统》,引起了国内制药行业的广泛讨论和高度关注。
其实许多制药企业对它的内容并不陌生,因为这则法规于2013年作为征求意见稿已经添加到新版GMP 法规附录中。
而现在,它将作为正式的法规于2015年12月1日起执行。
这则法规附录将给国内制药企业带来什么新的挑战?从近两年来CFDA 的一系列举措(频繁的飞行检查,2014年至今已取消近100家药企的GMP 证书)来看,国内GMP 的监管力度是显著增强的。
所以届时如果企业不能满足《计算机化系统》法规的要求,将可能面临十分严重的后果。
CFDA 为何要发布这则法规为何要发布这则法规??国内外GMP 法规有许多差异,而对计算机化系统的要求差异尤为明显。
CFDA 所执行的2010版GMP 法规内容与国际上其他法规机构的cGMP 法规是对等的,如FDA 21 CFR Part 211。
但美国的制药企业除了执行 21 CFR Part 211以外,同时还要遵守21 CFR Part 11法规;欧盟国家的制药企业除了执行欧盟GMP 以外,还要遵循Annex 11法规。
FDA 的21 CFR Part 11与欧盟的Annex 11的内容是类似的,都是针对于制药企业使用计算机化系统的法规要求。
新颁布的《计算机化系统》法规附录是国内法规与国际接轨的重要一步,将填补国内对于计算机化系统要求的法规空白,是实现与国际法规监管机构之间相互认可的前提条件之一。
法规到底讲了些什么法规到底讲了些什么??《计算机化系统》法规附录究竟讲了哪些内容?其实,我们发现内容并不多,全文共24条要求、6页,共计2500字。
我们尝试对这些法规条文作了初步的解读,把所理解的核心内容概括如下:1.CFDA 明确提出进行计算机化系统验证的要求以往,法规对于仪器的确认是一直有要求的,但对计算机软件验证的要求不明确。
计算机系统验证中文版

确认系统在规定的运行环境中运行时,全部生产工艺活动所发挥的执 行、控制等性能,满足事先批准的规格的要求,并文件化的行为。
2021/4/2
22
GAMP4 (7)
ISPE GAMP4: 规格与确认的基本框架
用户需求标准 (URS)
验证
功能标准 (FS)
验证
设计标准 (DS)
验证
系统构建
2021/4/2
ISPE
International Society for Pharmaceutical Engineering GAMP4:
Good Automation Manufacturing e Guide
GAMP5:
A Risk-Based Approach to Compliant GxP Computerized Systems
用户作业
(1) 系统确认
(2) URS的制定
⇒ D1 用户需求标准的制定
(3) 验证战略的决定
・风险评估
⇒ M3 风险评估
・系统构建评估
⇒ M4 SW/HW的分类
・供应商评估
⇒ M2 供应商审核
(4) 验证计划书的制定
(5) 系统规格的审核
⇒ M5 设计复核与需求追踪能力矩阵
与批准
(6) 系统开发过程的监控
计算机系统验证的实施与要点
2021/4/2
2009年1月19日 日挥株式会社 樱井 国幸
1
讲师介绍
樱井 国幸 (Sakurai Kuniyuki) 日挥株式会社 第2工程本部 医药服务事业部 GMP技术部主管 ・1976年进日挥公司。从事石油精制、石油化学、原料药等仪器设计方 面的工作。 ・之后,从事安全系统、研究所网络以及基础设施系统的设计工作,从 1992年开始从事药品生产设备等生产管理系统(MES)的设计。 ・1996年到1999年为止,负责LNG工厂综合信息系统(ERP,分析信息系 统、厂房信息系统、电子文件管理系统、维护管理系统,等等)的建立。
计算机化系统验证-风险评估

计算机化系统验证—风险评估今天我们继续聊聊当下不热门的几个话题之一——计算机化系统验证。
(当下比较热门的几个话题:质量量度、计算机化系统、数据完整性、一致性评价及药包材关联审评制)背景上次我们推送了两个与数据完整性及计算机化系统相关的两个话题:“如何开启Excel审计追功能”与“如何启动Excel安全模式”,想看这两篇文章的朋友请关注我们后转到历史消息中进行阅读。
这两篇文章均提及到了计算机化系统的类别及验证,但没有告我们如何进行管理及验证,那么今天我们就跟大家分享如何进行计算机化系统的验证,下面正式开始我们今天的话题。
CFDA与2015年发布了《国家食品药品监督管理总局关于发布《药品生产质量管理规范(2010年修订)》计算机化系统和确认与验证两个附录的公告(2015年第54号)》((这个目前几年不管是FDA还是欧盟基本上都是先严查实验室,对于生产类的大家好像都共识一样可能有2年的过渡期)并告知于12月1日开始实施,随后大家就开始了关于如何让计算机化系统合规的工作,开始进行差距分析、流程改进、软件升级、验证等一系列的工作。
现在为什么开始重视计算机化系统了呢:首先我们认为主要是因为现在科技手段的不断进步,工厂里的生产自动化程度越来越高(人工成本高及人为差错、污染的风险高),为了让制品在通过自动化生产过程中的可控及可追溯性,要先从法规的角度进行管理,这样就来了这个神奇的东西;其次国家工业4.0的升级,自动化的普及迫使我们要保证在这个智能的生产环境中能够持续稳定的生产出符合要求的产品;最后就是我们要融入国际轨道,像欧美等国家很早以前就已经开始了计算机化系统的管理。
关于这里的差距分析、流程改进软件升级一类的今天这里不涉及,我们会在以后的推送中进行细说,这里只介绍计算机化系统的验证,我们该如何对一个计算机化系统进行验证?在说这个话题之前,我们还是赘述以下什么是计算机化系统,下面我来一个比对:计算机系统计算机化系统自动化系统名词Computer Systems Computerised Systems Automation Systems定义由硬件、系统软件、应用软件指受控系统、计算机控制系统指在没有人直接参与的情况以及相关外围设备组成的,可执行某一功能或一组功能的系统以及人机接口的组合体系下,利用外加的设备或装置,使机器、设备或生产过程的某个工作状态或参数自动地按照预定的规律运行的软件通过以上表格的对比你是不是已经知道这几个系统的区别?千万不要把计算机系统和计算机化系统弄混淆,虽只是一字之差,但完全不一样的东东。
计算机化系统验证流程-MES系统
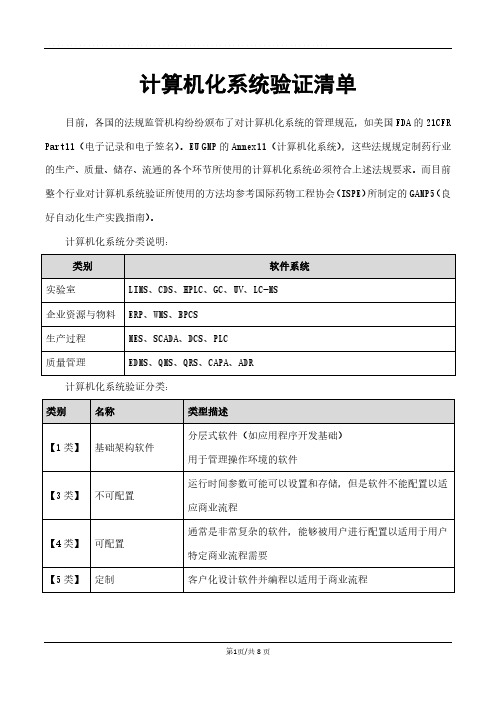
计算机化系统验证清单
目前,各国的法规监管机构纷纷颁布了对计算机化系统的管理规范,如美国FDA的21CFR Part11(电子记录和电子签名)。
EU GMP的Annex11(计算机化系统),这些法规规定制药行业的生产、质量、储存、流通的各个环节所使用的计算机化系统必须符合上述法规要求。
而目前整个行业对计算机系统验证所使用的方法均参考国际药物工程协会(ISPE)所制定的GAMP5(良好自动化生产实践指南)。
计算机化系统分类说明:
计算机化系统验证分类:
1.1计算机化系统验证流程
1.2计算机化系统验证清单
序号验证阶段内容框架类别
【1】计划阶段
01
用户需求说明
(URS)
【编写用户需求】
【审核用户需求】
【批准用户需求】
用户需求(URS)是从用户的角度描述系统的需求。
它应当
根据系统的工艺需求,描述系统所需具备的功能、控制参
数、数据采集、数据存储、数据输出、数据备份、数据还
原、权限控制、电子签名等各项要求,确保系统的功能满
足法规要求及符合预定用途。
用户需求(URS)主要内容:
1、文件的整体介绍,内容包括:
文件内容摘要
目的:阐述写该项目URS的目的。
适用范围:要确定文件用在项目建设中哪个阶段,指导
什么工作。
参考文献:主要列出在描述URS时引用的文献资料名
称、版本、章节等。
2、项目简介、背景
这部分内容应该摘自项目计划书。
3、文件内容,包括:
甲方编写。
FDA计算机化系统确认与验证中文版

FDA计算机化系统确认与验证中文版在FDA(美国食品药品监督管理局)的监管中,计算机化系统确认与验证是保障药品研发、生产和销售质量的重要环节。
本文将对FDA计算机化系统确认与验证进行介绍,以及其在药品监管中的重要性。
计算机化系统确认与验证是指通过系统分析、测试和文档审核等手段,确保计算机化系统在规定的操作条件下能够正确运行,以及能够满足其预期的使用目的。
计算机化系统是指在药品研发、生产和销售过程中使用的软件和硬件等设备,例如药物研发软件、生产数据管理系统和销售订单处理系统等。
在FDA的监管中,计算机化系统确认与验证主要有以下几个方面:第一,确保计算机化系统满足法规要求。
计算机化系统在药品研发、生产和销售过程中需要满足一系列法规要求,例如21 CFR Part 11(电子记录和电子签名规则)、cGMP(当前药品生产规范)等。
通过系统确认与验证,可以保证计算机化系统符合这些法规要求,从而确保药品的质量和安全。
第二,确保计算机化系统能够正确运行。
计算机化系统的错误或故障可能导致药品数据的丢失、操纵或干扰等问题。
因此,对计算机化系统进行确认与验证可以确保系统在各种操作条件下能够正确运行,从而减少错误和故障的发生。
第三,确保计算机化系统的数据准确性和完整性。
计算机化系统在药品研发、生产和销售过程中产生了大量的数据,例如实验数据、生产记录和销售订单等。
通过确认与验证,可以验证这些数据的准确性和完整性,从而确保药品数据的可靠性。
第四,确保计算机化系统的保密性和数据安全性。
在药品研发、生产和销售过程中,计算机化系统涉及到很多敏感信息,例如药品配方、生产工艺和销售渠道等。
通过确认与验证,可以确保这些敏感信息的保密性和数据安全性,从而防止信息泄露和非法访问。
在药品监管中,计算机化系统确认与验证的重要性不言而喻。
通过确认与验证,可以有效地保障药品研发、生产和销售的质量和安全,减少错误和故障的发生,提高药品数据的可靠性,以及防止信息泄露和非法访问。
制药机械(设备)计算机化系统验证指南

制药机械(设备)计算机化系统验证指南本指南旨在为制药机械(设备)计算机化系统的验证提供指导和建议。
在本指南中,计算机化系统包括所有利用计算机技术控制和监测设备操作的设备。
计算机化系统的验证是确保计算机化系统满足其预期用途、符合所有适用法规和标准要求、并且能够在其整个生命周期内保持有效性和完整性的一项重要活动。
2.法规及标准要求对于制药机械(设备)计算机化系统,通常需要遵守以下法规和标准要求:•美国食品药品监督管理局(FDA)的《21 CFR 食品及药品》第11 部分:电子记录;电子签名•欧洲药品管理局(EMA)的《规范药物品质》(GMP)指南•国际卫生组织(WHO)的《药品质量控制:生产及创新指南》•国际电气和电子工程师协会(IEEE)的标准,如IEEE 1012 标准3.验证活动针对制药机械(设备)计算机化系统的验证活动通常可以分为以下步骤:3.1 需求确认需求确认是验证计算机化系统是否符合其预期用途的重要步骤。
在这一步骤中,应确定系统的功能和性能要求,以及其预期用途。
此外,这一步骤还应确认适用的法规和标准。
3.2 设计确认设计确认是验证计算机化系统是否满足其设计要求的步骤。
在这一步骤中,应对计算机化系统的设计进行评估,以确认它满足预期要求。
此外,这一步骤还应确认计算机化系统的技术规格和其它设计细节。
3.3 安装确认安装确认是验证计算机化系统是否正确安装的步骤。
在这一步骤中,应确认所有必要设备和资源已正确安装和配置,此外还应评估计算机化系统是否能够与其它设备和系统进行良好的集成和交互。
3.4 初步操作验证初步操作验证是验证计算机化系统是否能够正确操作的重要步骤。
在这一步骤中,应评估计算机化系统在受控条件下的性能和操作,以证明它能够按照预期的方式进行操作。
3.5 性能验证性能验证是验证计算机化系统是否满足其功能和性能要求的步骤。
在这一步骤中,应评估计算机化系统的性能和功能,以确保它能够按照预期的方式运行,并满足适用法规和标准。
GMP GLP SOP 计算机系统验证

<GMP GLP SOP 计算机系统验证>GMPGMP自1962年在美国实施以来,已历经了四十多个春秋,在世界各国得到推广。
GMP是适应药品生产质量管理的需求而产生的,是当今国际社会通行的药品生产必须实施的制度,是药品全面质量管理(TQC)的重要组成部分;同时也是在药品生产的全过程中,把发生差错、混药和各种污染的可能性降到最低程度的最可靠的办法。
药品GMP认证是国际间贸易通行的许可证。
我国目前有药品生产企业6300多家,国家已经下发了其它有关文件,具体规定了各剂型实施GMP认证的最后期限。
许多条件好的企业已经抢先一步申报了GMP认证,而另一些企业也开始了GMP认证的准备工作。
这种时候,选择一家实力强、信誉好的咨询公司协助企业进行GMP改造和软件体系的建立就成为一些企业,特别是股份制企业和私营企业避免多花钱、走弯路的一个明智的举措。
GLPGLP是Good Laboratory Practice of Non-clinical Laboratory Study的简称。
我国称之为药品非临床安全性研究工作质量管理规范。
GLP制度是美国FDA于1978年12月22日发布的一套新药安全性研究质量管理规范,列入美国联邦法规。
凡不符合GLP标准的实验室没有资格从事为新药报批而进行的药理试验,其所提供的安全性试验资料,FDA概不受理。
20世纪80年代以来,GLP制度成为国际上从事新药安全性研究实验室共同遵循的质量管理规范,在国际GLP实施过程中,国家之间施行试验资料相互认可协议,并签订谅解备忘录。
ICH 成员之间承认对方各处对其GLP实验室核查的有效性,试验数据相互认可,对方不必进行验证性实验;所以GLP规范进行的安全性评价是新药进入国际市场必需的"通行证"。
我国自92年以来逐渐认识到GLP制度的重要性,"八五"期间,我国政府为了适应知识产权国际化原则,切实提高新药安全性研究的质量,确保广大患者的用药安全,同时推进我国创新药物顺利向商品化、产业化、国际化方向发展,使我国自主研制的新药可以参与国际市场竞争,在医药行业发展规划中,提出"建立与国际接轨的新药研究发展体系"的课题。
GMP附录《计算机化系统》那些事儿

GMP附录《计算机化系统》那些事⼉GMP法规附录《计算机化系统》那些事⼉?2015年5⽉26⽇,CFDA正式发布了2010版GMP法规的新附录之⼀《计算机化系统》,引起了国内制药⾏业的⼴泛讨论和⾼度关注。
其实许多制药企业对它的内容并不陌⽣,因为这则法规于2013年作为征求意见稿已经添加到新版GMP法规附录中。
⽽现在,它将作为正式的法规于2015年12⽉1⽇起执⾏。
这则法规附录将给国内制药企业带来什么新的挑战?从近两年来CFDA的⼀系列举措(频繁的飞⾏检查,2014年⾄今已取消近100家药企的GMP证书)来看,国内GMP的监管⼒度是显著增强的。
所以届时如果企业不能满⾜《计算机化系统》法规的要求,将可能⾯临⼗分严重的后果。
CFDA为何要发布这则法规??国内外GMP法规有许多差异,⽽对计算机化系统的要求差异尤为明显。
CFDA所执⾏的2010版GMP法规内容与国际上其他法规机构的cGMP法规是对等的,如FDA?21?CFR?Part? 211。
但美国的制药企业除了执⾏?21?CFR?Part?211以外,同时还要遵守21?CFR?Part?11法规;欧盟国家的制药企业除了执⾏欧盟GMP以外,还要遵循Annex?11法规。
FDA的21?CFR? Part?11与欧盟的Annex?11的内容是类似的,都是针对于制药企业使⽤计算机化系统的法规要求。
新颁布的《计算机化系统》法规附录是国内法规与国际接轨的重要⼀步,将填补国内对于计算机化系统要求的法规空⽩,是实现与国际法规监管机构之间相互认可的前提条件之⼀。
法规到底讲了些什么??《计算机化系统》法规附录究竟讲了哪些内容?其实,我们发现内容并不多,全⽂共24条要求、6页,共计2500字。
我们尝试对这些法规条⽂作了初步的解读,把所理解的核⼼内容概括如下:?1.CFDA明确提出进⾏计算机化系统验证的要求?以往,法规对于仪器的确认是⼀直有要求的,但对计算机软件验证的要求不明确。
中英文-美国FDA_GMP检查

More Records 更多的记录
• Process Validation 工艺验证 • Equipment Qualification 设备确认 • Computer System Validation 计算机系统验证 (Protocol and Executed Protocol) (方案和已执行方案)
Objectives of Inspection 检查的目标
• Conduct the inspection in accordance with FD&C Act and Current Good Manufacturing Practice (CGMP) Regulations 检查的执行依据《联邦食品,药品和化妆品法》(FD&C Act) 及现行 药品生产管理规范(CGMP) 条例 • Accomplish what is necessary per the established, supporting Compliance Policy Guidance Manual 检查执行的程度依据 符合性方针指导手册 – 7356.002 “Drug Manufacturing Inspections” 7356.002 “药品生产检查” • “Systems Approach” “系统化方法” • Accomplish necessary, additional questions/concerns listed in the inspection assignment (“For Cause” Inspection) 要完成必要的检查、其它问题/额外关注点见“追因”检查的检查任务 分配
The CGMP Regulation CGMP 法规
FDA即将从CSV to CSA

FDA即将从CSV to CSA
CSV(computerized system validation)的概念作为我们执行计算机系统验证与合规的基石已经有很长一段时间了,而且也越来越被大家感觉到方法虽好,但是负担也很重,某种意义上跟不上目前制药行业日新月异的新技术的应用。
在这种背景下,CSA(computerized system assurance)应运而生。
自从1997年,FDA发布了21 CFR Part 11及2002年FDA发布software validation guidance。
相关的法规一直没有进行太大的更新,但是数字化的浪潮确认蓬勃的发展,比如AI,RPA,AGV,Robot,VR/AR 等新技术以及越来越多的用来支持制药行业的生产运营。
FDA 也认识到这个问题,因此一直在寻找新的方法,进行各种各样的尝试,经过长达十年的摸索,宣布将在今年发布新的指南“ComputerSoftware Assurance for Manufacturing, Operations, and Quality System Software”。
估计未来几个月大家就会看到正式版本的发布。
下面一起看下FDA的探索之路。
来看下CSV到CSA后的对比图:
从CSV到CSA后会有什么区别呢?
简答一句话总结:减少无效的paperwork.
传统的CSV中,文件是关键的证明compliance的证据。
需要详
细的测试脚本来记录系统的每一个功能,甚至是每个按键。
在CSA过程中,critical thinking 将会是关键,如何更加从系统的功能的角度出发完成测试。
计算机化系统验证 V1

89
V-model 验证生命周期和文件架构
GAMP是由国际制药工程协会(ISPE)主编的实践指南。自90年代以来,不断 改版的良好自动化生产实践指南被广泛使用并得到国际监管部门的公认。它是 计算机化系统验证的指导方针。GAMP5是GAMP的第5版本。
计算机化系统 由硬件、软件、网络组件和可控的功能和相关文件组成
软件 硬件 固件
控制系统
操作规程与人 员 设备
功能说明(FS)中描述了如何来实现用户需求说明(URS)中所述的要求和目标。本文件
FS
明确说明了预期系统的实现方式。FS由项目执行方编写,由客户进行审查是否有与URS中
所述要求有冲突之处及是否确实能够实现此类要求。FS必须由客户来批准。经过批准之后
,FS即作为客户和项目执行方在实现及管理本项目方面具有约束力的协议。
2, Custom Built Hardware Components 定制制造的硬件部件
Typical Approach典型方法
•Document manufacturer or supplier detail, serial number and version number •通过文件记录下生产厂家或供应商的详情、序列号和版本号 •Correct installation to be verified •确认正确的安装
所有要求都必须在说明文件及测试中得以考虑,不能有任何遗漏项。 可追溯性矩阵可帮助项目团队在整个项目过程中审查所有与要求相关的项目。它可以在项 目生命周期中双向检查并追踪要求的处理情况
6实验室计算机化系统验证

提供测量值的标准仪器和设备, 仪器可通过需要校准的物理参数 (如温度、压力或流量)进行控制。 B (类别1) 仪器提供的功能和操作限制与用户 要求一致。 没有用户界面,产生原始数据及 测试结果但不存储及处理 用户对于功能、运行和操作的限 定性要求与实际的分析应用相关。 C (类别1) 配置参数可存储并再使用, 没有用户界面,产生原始数据及 测试结果但不存储及处理
计算机验证相关的法规和行业指南 计算机系统的生命周期和软硬件分类及验证
GxP环境下的电子表格 计算机系统的退役
Q&A
GMP《计算机化系统》附录
• 第三条 风险管理应当贯穿计算机化系统的生命周 期全过程,应当考虑患者安全、数据完整性和产 品质量。作为质量风险管理的一部分,应当根据 书面的风险评估结果确定验证和数据完整性控制 的程度。
氮气发生器、氢气发生器、水蒸气蒸馏装置、电 没有测量能力或没有常规校验要求 子干燥箱、冰箱、显微镜、均质器、超声波清洗 机、水浴锅、磁力搅拌器、涡旋搅拌器、离心机、 摇床、菌落计数器、微波消解仪等。
A
的标准设备。
温度计、水浴锅、硬度仪、崩解仪、脆碎度仪、
提供测量值的标准仪器和设备,仪
器可通过需要校准的物理参数(如
实验室计算机化系统验证
目录
计算机验证相关的法规和行业指南 计算机系统的生命周期和软硬件分类及验证
GxP环境下的电子表格 计算机系统的退役
Q&A
计算机化系统的相关法规
中国的法规 计算机化系统的相关法规 中国GMP 2015年5月26日颁布的中国GMP 附录《计算机 化系统》 中华人民共和国电子签名法
G
(类别5)
定制系统,有复杂的逻辑功能,编
程,包括Macro
计算机化系统验证的法规要求要点

我们谈一谈计算机化系统验证的那些法规要求。
在法规上,主要与以下十一部有关:1.(US FDA) 21CFR Partll美国联邦法规21篇第11部分电子记录与电子签名2.(US FDA)工业指南11部分电子记录与电子签名-范围和应用3.(US FDA)联邦法规第21篇第210 211部分,成品药的现行生产质量管理规范4.(ISPE)良好自动化生产实践指南,遵从GxP计算机化系统监管的风险管理方法5.(ISPE)GAMP GPG良好实践指南,GAMP架构下的系列良好实践指南6.(EU)欧盟药事法规第4卷GMP,附录11《计算机化系统》7.(PIC/S)GMP指南,药用产品良好生产实践指南(TGA)GMP,药用产品良好生产实践指南8.(PIC/S)在“GxP”监管环境下的计算机化系统良好实践(检察官指南)9.(WHO)GMP 2003, Annex 4 (WHO TechnicalReport Series, No. 908)10.(CFDA) 2010年版GMP及征求意见稿《计算机化系统》11.(CFDA)GSP附录二附录三《药品经营企业计算机系统》当使用密码或其他方式来控制系统的登录;关键数据输入后, 应当由他人独立进行复核。
用电子方法保存的批记录,应当 采用磁带、缩微胶卷、纸质副本或其他方法进行备份,以确 保记录的安全,且数据资料在保存期内便于查阅。
附录1第七十条 采用自控和监测系统的,应当经过验证,保 证符合关键工艺的要求。
实践指南生成 与应用FDA21CFR Parti 1EU GMP Annex11 WHOGMPPIC/S GMP CFDA 《计算机化 系统》征求意见稿我们讲一讲相关的详细条款,摘录其中主要最关键的部分,供大 家参考:一、CFDA GMP 及附录:第一百六十三条 使用电子数据处理系统的,只有经授权的 人员方可输入或更改数据,更改和删除情况应当有记录;应自控操作代替 人工操作电子记录签名代替 手写记录签名PAT 应ISPE GAM PIC/S PIO FDA Part CFDA 药fii科学技术进步法规变更5二、CFDA GMP 征求意见稿《计算机化系统》O 第四条应使用科学的风险评估方法来决定计算机化系统验 证的范围与程度。
FDACFRPart–电子记录和电子签名要求

FDACFRPart–电子记录和电子签名要求FDACFR Part 21–电子记录和电子签名要求引言:随着科技的迅猛发展,电子记录和电子签名在各行业中的应用越来越广泛。
美国食品药品监督管理局(FDA)制定了一系列的规定,旨在确保电子记录和电子签名的合法有效。
本文将详细介绍FDACFRPart 21中关于电子记录和电子签名的要求。
一、背景1.1 电子记录和电子签名的定义根据FDACFR Part 21中的规定,电子记录指通过计算机系统或其他电子手段产生、记录或存储的信息。
而电子签名则是用于验证电子记录的一种电子标识。
1.2 规范的目的和适用范围FDACFR Part 21的目的是确保电子记录和电子签名的真实性、完整性和可靠性,以替代传统的纸质记录和手写签名。
该规范适用于所有FDA监管的行业,包括但不限于食品、药品、医疗器械等。
二、电子记录要求2.1 系统验证和审核使用电子记录的企业应确保其计算机系统符合FDA的规范要求,包括进行恰当的验证和审核。
企业应确保该系统具备记录数据的准确性、完整性和可靠性,并能有效防止非授权访问和篡改。
2.2 记录保留电子记录应保存在可靠的介质上,并按照FDA的规定进行保留。
企业应确保保存的文件完整无缺、难以篡改,并能在需要时快速检索和提取。
2.3 数据完整性和一致性企业应确保电子记录的一致性和完整性。
所有对数据的修改和删除都必须有记录,并有相应的电子签名进行验证和授权。
三、电子签名要求3.1 签名标识电子签名应由唯一且不可复制的标识符生成,并与签名人的身份相关联。
签名标识应具备防护措施,以确保私密性和防止非授权使用。
3.2 签名验证和授权企业应建立验证和授权的过程,以确保电子签名的真实性和有效性。
所有签名都应包含必要的签名属性信息,如签名时间、地点等。
3.3 签名记录和审核企业应实施电子签名记录和审批程序,确保签名记录的保留和审核,并能提供相应的审计跟踪。
四、合规要求的验证和审计4.1 系统验证为了确保计算机系统符合规范要求,企业应实施系统验证计划,并进行周期性的验证测试。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
√ √ √ √ √ √ √ √ √ √ √ √ √ √
人员培训 释放通知 使用和维护 问题报告 变更控制 系统管理 安全程序 备份/存档/灾难恢复 维护日志 周期性回顾 人员持续培训
和
维 护 引 退
系统引退
工程计划(引退系统) 系统引退报告
√ √ √ √ √ √ √ √ √ √ √ √
√ √ √ √ √ √ √ √ √ √ √ √ √ √ √
• 计算机系统验证是建立文件来证明计算机
系统的开发符合质量工程的原则,能够提 供满足用户需求的功能并且能够稳定长期 工作的过程。
计算机系统的理解
• 工艺验证中的“工艺”相当于计算机的“输入”
过程和“内部处理’’过程(软件),工艺中用到 的设备相当于计算机主机、外围设备(硬件)以及 与其相关的生产设备或质量控制设备,工艺的 “产品”相当于计算机的“输出”或对另一台设 备的控制等 。 计算机系统验证与工艺验证不同之处是:术语上 的不同(如数据处理概念)和由于软件的特性,使 一般用户对软件和软件的开发相对不熟悉。
• 系统设计文件一般由供户制订,但必须经过用户审核及认可后方可实施。证实施过程• 系统测试
• • • • • •
该阶段的主要任务是发现并排除在分析、设计、编程各阶段中产生的各种类型的错误, 以得到可运行的计算机系统。系统测试和确认过程与系统的需求定义、设计及编程阶 段相对应,如图6-3 所示。单元测试及组装测试一般在供户处进行。 一、单元测试 单元测试是对系统的每一个模块进行独立测试,其目的是找出与模块的内部逻辑有关 的错误。单元测试一般以白盒法为主。 二、集成测试 集成测试根据系统设计中各功能模块的说明及制定的组装测试计划,将经过单元测试 的模块逐步进行组装和测试。每并人一个模块,都要找出由此产生的错误。集成测试 一般以黑盒法为主。 注:测试的难点在于如何选择测试用例,选择一个好的测试用例,可以最大限度的发 现系统中所存在的错误,以对重要数据结构的正确性进行全面检查。白盒法一般根据 程序内部结构设计测试用例,亦称逻辑覆盖法,包括语句覆盖(使每一个语句至少执行 一次)、判定覆盖(使程序中的每一个判定至少出现一次“真值”和一次“假值”)、条 件覆盖(使每一个判定中的每一个条件都取得各种可能的结果)等。黑盒法则是根据系统 功能需求来构造测试用例,常用如下4 种方法:等价划分法(将系统的输入区域划分为 若干等价类,用每个等价类中的一个具有代表性的数据作为测试数据)、边界值分析法 (尽可能选取边界值作为测试数据)、因果图法(在系统功能说明中找出各种因果关系, 设计测试用例)、错误推测法(推测系统容易发生的各种错误,设计能检查出这些错误的 测试用例)。
两个法规
• FDA Final Guidance for Industry and FDA
Staff,2002 • GAMP Guide for Validation of Automated Systems Ver.4
FDA Final Guidance for Industry and FDA Staff, 2002
计
计算机系统发展及验证生命周期
SDLC阶段不同类型的计算机系统所应交付的验证工作(续表)
分类 1 2 3 4 5 系统验收及 可行性研究报告安装确认(IQ)方案和报告 确认 操作确认(OQ)方案和报告 工艺/性能确认(PQ)方案和报告
接
收 使 用
√
√ √ √ √ √ √ √ √ √ √ √ √ √ √
计算机系统验证定义及范围
• 计算机化系统(computerized System)
• 包括硬件、软件、外围设备、操作人员、
相关文件资料如操作手册、SOP等。
CVS的构成
计算机化系统 Computerized System
控制系统 Computer System
可控的功能工艺
硬件
软件
操作系统
设备
计算机系统的理解
美国FDA计算机系统验证 Computer System Validation (CSV)
2007.5
内容简介
• • • • • • • • •
1.计算机系统验证定义及范围 2.计算机系统分类 3.计算机系统发展及验证生命周期 4.验证实施过程 5.系统验收及确认 6.系统使用及维护 7.系统引退 8.验证分工与职责 9.计算机系统验证举例(PLC 系统验证)
验证实施过程
• 验证计划
• • • • • • • • • • • • • • • •
验证计划伴随着工程计划一起,用于指导整个计算机系统验证活动。验证计划包括 (1)系统描述/构造 (2)适用的政策、程序及指导方针 (3)责任 (4)供户评价/审计 (5)设想/排除/局限性 (6)文件—系统、技术和操作 (7)验证文件的保持 (8)测试程序 (9)可接受标准 (10)偏差处理 (11)变更控制 (12)安全线 (13)备份/存档/灾难恢复 (14)人员培训 (15)验证草案和报告(IQ、OQ 及PQ)
可行性研究 可行性研究报告
计 划
√ √
√ √ √
√ √
√ √ √ √
√ √
√ √ √
√ √ √ √
√ √ √ √ √
√ √ √ √
√ √ √ √ √ √
工程计划
工程计划 供户评估 验证计划 费用申请
需求定义 系统设计
用户需求说明(URS) 系统设定 源代码和配置
设
系统测试
单体测试(白盒测试) 集成测试(黑盒测试)
验证方法
确认名称及版本 号
标准设备、微控制 器、灵敏仪器
这些系统是由非用户设计的固件驱动的,此固件可以插入 确认构造及配置 在一个应用软件特定集成电路(ASIC)中、只读存贮器(ROM)、 短暂存贮器或有时在可编程逻辑控制器(PLC)中。如条形码 解调器、单循环控制器、填充器、检重仪、温度控制器等 商业现成的软件包(COTS),如电子制表软件、标准化学分 析软件等 验证应用过程
GAMP 的V模式
用户要求定义 确认
PQ
确认 设备规格 确认 IQ 确认 软硬件的制作 OQ
设计
计算机系统发展及验证生命周期
验证生命周期(SVLC) • 计算机系统的验证不只局限于系统的使用 过程,新系统的验证应始于系统初期的定 义和设计阶段,终止于系统无使用价值阶 段。验证生命周期应伴随着系统发展的整 个生命周期(SDLC)。
该系统是根据客户的需求进行修改或开发的
供户审核、验证 应用过程和一些 预定码
客户自设计系统
实施计算机系 统验证的全过程
计算机系统发展及验证生命周期
计划
培训
SOP
• 系统的生命周期和CSV活动
要件分析
供货商 审查
变更 控制
维护(运行)
PQ
引退
解决 问题
设计
安装
OQ IQ 汇总
DQ
编码
测试
计算机系统发展及验证生命周期
验证实施过程
• 工程计划
• • • • • • • • • • • • • • •
一、工程计划 工程计划用于规划所有工程及验证活动,包括计算机化工程的组织结构、各部门/个 人的职责、工程进度表(包括所有SDLC 阶段和相应的SVLC 阶段)、文件交付、审核和 批准要求等。 二、供户评估 应对计算机系统供户进行评价,以确保其系统能力及所提供的产品满足计算机系统验 证要求。供户评价包括以下内容。 (1)根据系统概念定义及判断选择供户,注意评估外部资料对标准要求的符合化及与系 统要求文件的一致程度。 (2)对供户质量体系进行审计,审计内容包括 ①系统开发者的内部质量管理程序。 ②技术能力评估。 ③软件开发标准及软件测试能力。 ④程序编制人员的资格审定。 ⑤硬件开发及制造能力。 ⑥变更控制。 ⑦售后服务。 ⑧系统安全性。 供户审计报告应纳入验证档案。
• 针对行业和FDA官员的指导(非强制性) • 主要内容
软件验证的原则
要求规格、故障预防、评估的独立性等
工作和任务
验证的主要任务 计划~维护/变更管理
自动化工艺设备和质量系统软件的验证
需要多少证据? 明确用户需求 零售的软件、自动化设备的认证
GAMP Guide for Validation of Automated Systems Ver.4
• 计算机系统(computer system)
• • • • •
具有特定功能的计算机系统是 由1台或数台计算机、外围输出输入设备以及软件构成; 全部或部分程序及运行程序所需的全部或部分数据使用共同的存储器; 运行用户编写的程序或用户指定的程序; 根据用户的指定模式进行数据处理,如数值运算或逻辑运算;运行过 程中可以自我修正程序; • 计算机系统可以是独立的单机,也可以是由几台单机联机组成;
标准软件包
可配置软件包
该系统允许用户通过配置预先确定的软件模块及开发新的 应用软件模块来发展他们自己的应用软件,如人—机对话 接口(HMl)、管理控制及数据获得系统(SCADA)、实验室自 动控制系统(LAS)、实验室信息管理系统、物料需求计划系 统(MRP)、系统/应用及产品数据处理系统(SAP)、部分可 编程序逻辑控制器(PLC)等
GAMP Form发展 主要内容
验证概要 验证的生命周期 IT系统的验证 工艺控制系统的验证 良好规范的定义(GDP/GTP/GEP) 范例及针对各主题的指南
管理(验证计划、风险评估、文件管理) 运用(安全、变更管理等) 开发(要素定义、测试等)
计算机系统验证定义及范围
物料控制
物料状态控制及隔离 先进先出(或先近效期先 出) 批次追逐 物料平衡 发货查询
基础数据控制
生产处方 批生产文件 产品及包装形式信息 鉴别产品名称、编码、批号 等信息 数据监控
