pd催化偶联
SuzukiandHeck

偶联反应取得了非常好的结果.这个方法号称清洁生产, 对大规模生
产具有很大的意义.
HO
HO 0.3% mol%Pd/C, 3 equiv K2CO3
ArB(OH)2
X
H2O, r.t., 12h, 77-99%
Ar
J. Org. Chem.; 2002, 67, 2721
2. Suzuki 偶联的应用
O O
Br
N
Pd(PPh3)4
BEt2
aq. NaOH/Bu4NCl, THF
O O
N
Synthesis 1984, 936
2. Suzuki 偶联的应用
2.5 烷基硼烷参与Suzuki反应
对于芳卤和甲基硼酸(酯)参与的Suzuki反应, 收率一般很低. 一个改进 的方法是用剧毒的TlOH或Tl2CO3 做碱, Suzuki反应的收率有所提高,近来 有报道用甲基三氟硼酸酯代替甲基硼酸取得了较好的结果. 这种方法突 出的优点是 试剂易于制备, 对空气稳定, 并且用于Suzuki偶联反应一般可 以得到较好的结果.
(尤其是甲酯) 、氰基等, 这时也可以应用这种方法, 实验证明在无水的条件下,
即使碱不溶解, 很多底物也可以进行Suzuki偶联反应.
2. Suzuki 偶联的应用
芳基硼酸频哪酯和芳基卤代物的Suzuki偶联示例
O O NH
Br
F
O
O
F
Pd(PPH3)4
O NH
BO
K2CO3, H2O/dioxane, reflux
10mol% of Ni(dppf )Cl2, 4 equiv BuLi
B(OH)2 Cl
K3PO4, dioxane, 80
金属催化反应在有机合成中的应用

金属催化反应在有机合成中的应用随着有机化学的发展,金属催化反应成为了有机合成中不可或缺的一部分。
金属催化反应可以提供高效、高选择性、经济的合成方法,已成为有机合成中不可或缺的一部分。
在本文中,我们将会探讨金属催化反应在有机合成中的应用。
一、Pd催化反应1. Suzuki偶联反应Suzuki偶联反应是一种重要的碳-碳键形成反应。
它利用了Pd 的具有活性的交叉耦合机制,通过芳芯片内的针对芳芯片和芳基和芳芯片和芳酯化合物反应来形成碳-碳键。
Suzuki偶联反应已被广泛地应用于糖化学、生命有机化学和天然产物合成领域等。
使用催化剂和底物的种类以及反应条件、配体等条件的优化是Suzuki偶联反应成功的关键。
2. Heck反应Heck反应是一种发现于1972年的碳-碳键形成反应。
它利用Pd为催化剂,在氧气存在下将芳基溴化物和烯烃偶联。
Heck反应可以合成许多化合物,包括药物、担体、香料等。
3. 点击化学点击化学是21世纪最激动人心的新领域之一。
它是由Sharpless教授等人发明的,利用Pd催化百里醇和炔烃的化学反应,构成环状化合物。
这种反应具有高效性、高选择性和优良的底物范围等特点,成为抗癌药物和治疗癌症的前沿技术。
二、Ru催化反应1. 环氧化环氧化是一种在有机合成中应用广泛的方法,也是一种重要的氧化反应。
Ru是一种高效的催化剂,可以实现对基因环戊烷环氧化反应。
2. 吡啶脱氢在化学学科中,吡啶脱氢是一种在有机合成中广泛应用的反应。
这种反应可以通过氧气替代常用的氢气,来具有绿色和环保的特点。
使用Ru催化剂和新型配体可以高效实现吡啶脱氢。
三、其他金属催化反应1. Cu催化偶联反应Cu催化偶联反应是一种具有极大应用潜力的反应,其使用成本低、操作温和。
Cu催化偶联反应可以实现碳-碳键、键和碳-氮键等多种键合成。
2. Fe催化环化Fe催化环化是一种非常受欢迎的反应方式,是一种新型环化方法,具有底物范围广、环化度高、反应数量大等优点。
Part 10 Pd 催化的偶联反应

Oxidation addition
Reductive elimination
2.
3.
Transmetalation
Reductive elimination diaryl- > (alkyl)aryl- > diethylpalladium(II)
transmetalation
General cycle for cross coupling
Pd(0)Ln ROTf [R-Pd( Ⅱ)][TfO]Ln PPh3 LiBr R-Pd-BrnL2
[Ph3PR] [Tfo]
Pd(0)
Application of Suzuki coupling
1.5 coupling with Aryl iodide
For Aryl idiode, the reaction could be performed under mild condition without ligand of phosphine. Such as PdCl2, Pd(OAc)2, Pd/C which makes the purification easier.
HO ArB(OH)2 I 0.3% mol%Pd/C, 3 equiv K2CO3 H2O, r.t., 12h, 77-99%
J. Org. Chem.; 2002, 67, 2721
HO
OH B OH I OMe
Pd(OAc) 2 K2 CO 3, acetone/H2O
OMe
Org. Syn., Coll.V ol. 10, P501; vOL. 75, P61
Pd/C N O I (HO)2B COOH Na2CO3, MeOH/H2O, reflux, 91% O
钯催化交叉偶联反应

钯催化交叉偶联反应什么是钯催化交叉偶联反应?钯催化交叉偶联反应(Palladium-Catalyzed Cross-Coupling Reaction)是一种重要的有机合成反应。
它是一类碳-碳键构造的反应,是通过将两种不同的碳基官能团或碳碳键连接在一起,以形成新的C-C化合物。
反应机理在钯催化交叉偶联反应中,两个分子的有机基团进行偶联,然后由钯离子起催化作用,生成新的碳碳键。
催化剂形式上是Pd(0)配合物,反应机理如下:1.钯催化剂先通过脱对氢化学计量通常分配Pdcatalyst (I)。
2.钯催化剂进一步和配体形成配合物(PdL2)。
3.配合物和卤代烃发生交换生成过渡态PdL2(RX)。
过渡态中,钯离子与亲电吸引剂的卤素原子形成键;此过程中C-X钩体断裂,形成第一级碳中间体。
4.结合第二个有机基团生成PdL2(RY)介于新的物种。
5.最后的反应产物通常通过还原反应,将钯催化剂还原为Pd(0)。
应用钯催化交叉偶联反应已经成为有机合成中的重要反应之一,广泛应用于制药、化工、材料科学等领域。
其重要应用包括:•制备非对映选择性或对映选择性的C-C连接化合物。
•制备有机材料。
•合成复杂天然产物的合成方法研究。
反应类型钯催化交叉偶联反应可以根据反应物和类型进行分类。
最常用的交叉偶联反应类型是官能团反应 (Functional Group Coupling) 和碳-碳双键偶联反应 (Carbon-Carbon Double Bond Coupling),这些反应分类包括下列:1.骨架化反应 (Fragmentation Reaction)2.偶联反应 (Cross-Coupling Reaction)3.代换反应 (Substitution Reaction)4.重排反应 (Rearrangement Reaction)反应优点由于钯催化交叉偶联反应具有高效性、选择性、重复性和收率高的特点,它已经成为有机化学领域极为重要的反应之一。
Pd 催化偶联反应
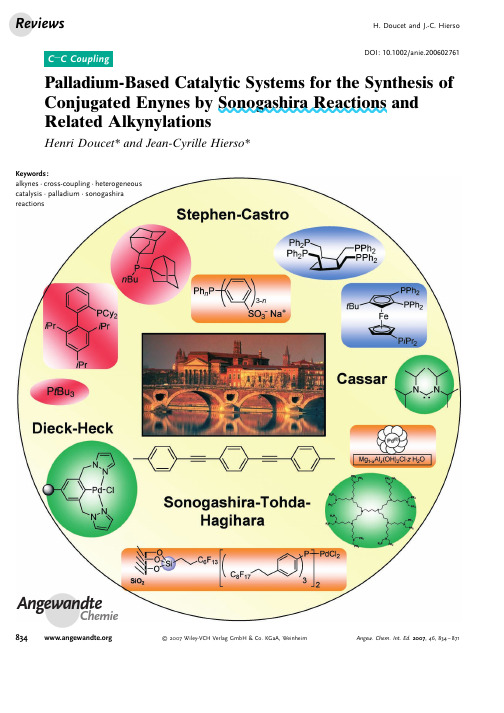
DOI:10.1002/anie.200602761Palladium-Based Catalytic Systems for the Synthesis of Conjugated Enynes by Sonogashira Reactions and Related AlkynylationsHenri Doucet*and Jean-Cyrille Hierso*AngewandteChemieKeywords:alkynes ·cross-coupling ·heterogeneous catalysis ·palladium ·sonogashira reactions8342007Wiley-VCH Verlag GmbH &Co.KGaA,WeinheimAngew.Chem.Int.Ed.2007,46,834–8711.IntroductionThe palladium-catalyzed cross-coupling between sp 2-hybridized carbon atoms (C(sp 2))aryl,heteroaryl,and vinyl halides and sp-hybridized carbon atoms of terminal acety-lenes (C(sp))pertains to the family of modern and extremely powerful synthetic methods for the synthesis of important organic intermediates.The conjugated p systems resulting from alkynylation reactions—conducted either with alkynyl-metal reagents or directly with terminal alkynes—are build-ing blocks often encountered within natural products,phar-maceutical molecules,synthetic agrochemicals,and molecular materials.The palladium/copper co-catalyzed alkynylation of aryl and vinyl halides is probably the most widely employed methodology to yield enynes;a simpler version of the reaction requires exclusively a palladium catalyst (widely known as copper-free alkynylation).Collectively,the seminal works by Stephens and Castro (1963),[1]Dieck and Heck (1975),[2]Cassar (1975),[3]and Sonogashira,Tohda,and Hagihara (1975)[4]have initiated an outstanding number of studies in the fields of organic chemistry,organometallic chemistry and catalysis,total syn-thesis,and material science.[5–8]The original reactions and their experimental conditions,as disclosed by the pioneering authors (Scheme 1),reveal both a straightforward applicabil-ity and a very large substrate range,which is probably at the origin of their success.Sonogashira and related alkynylation reactions have been covered in the last few years by several relevant reviews,inresearch.[5–19]Table 1lists these and other pertinent review articles related to the palladium-catalyzed synthesis of con-jugated enynes and the various applications of these reactions.In 2006Tykwinski and Shi Shun reviewed the synthetic efforts directed towards the synthesis of polyyne natural products,together with a highlight of the natural sources and biological relevance of some selected examples.[9]The impor-tant role of palladium-catalyzed alkynylations in total syn-thesis has been covered in a recent review by Nicolaou et al.[7]The performances of the current palladium catalysts with the highest turnover numbers (TONs)or turnover frequen-cies (TOFs)in homogeneous phase cross-coupling,including Sonogashira and related reactions,were critically examined by Farina in 2003;[10]Fu and Littke had previously covered the palladium-catalytic systems able to activate the relatively inert chloride substrates.[11]Several reviews have surveyed the results obtained for alkynylation reactions carried out in the presence of carbene ligands [12–15]or palladacyle com-plexes.[13,16]Conceptual advances by Tykwinski,[17]cross-coupling in water by GenÞt and Savignac,[18]and advances on mechanistic aspects by Jutand [19]have also been covered.In light of these recent reviews it appears that a critical discussion specifically devoted to all the different classes of catalytic systems proposed to date for homogenous andC onjugated alkynes are recurring building blocks in natural products,a wide range of industrial intermediates,pharmaceuticals and agro-chemicals,and molecular materials for optics and electronics.The palladium-catalyzed cross-coupling between sp 2-hybridized carbon atoms of aryl,heteroaryl,and vinyl halides with sp-hybridized carbon atoms of terminal acetylenes is one of the most important develop-ments in the field of alkyne chemistry over the past 50years.The seminal work of the 1970s has initiated an intense search for more general and reliable reaction conditions.The interest in the catalytic activation of demanding substrates,the need to minimize theconsumption of depletive resources,and the search for easy access to an increased variety of functionalized enynes has led to the current generations of high-turnover catalysts.This Review gives an overview of the highly efficient palladium catalyst systems for the direct alky-nylation of C(sp 2)halides with terminal alkynes,both in homogeneous and heterogeneous phases.From the Contents1.Introduction 8352.Sonogashira–Heck Alkynylations in the Homogeneous Phase 8363.Recyclable Systems for Sonogashira–Heck Alkynylations8504.Miscellaneous and Connected Studies8615.Summary and Outlook868[*]Dr.H.DoucetInstitut Sciences Chimiques de Rennes UMR 6226CNRS-UniversitØde Rennes “Catalyse et Organometalliques”Campus de Beaulieu,35042Rennes (France)Fax:(+33)2-23-23-69-39E-mail:henri.doucet@univ-rennes1.frDr.J.-C.HiersoLaboratoire de Synth se et Electrosynth se OrganomØtalliques associØau CNRS (UMR 5188)FacultØdes sciences Mirande UniversitØde Bourgogne9avenue Alain Savary,21078Dijon (France)Fax:(+33)3-8039-3682E-mail:jean-cyrille.hierso@u-bourgogne.frHomepage:http://www.u-bourgogne.fr/LSEO/Equipes/PagesEquipes/EquipeMEUNIER/JeanCyrHIERSO.html835Angew.Chem.Int.Ed.2007,46,834–871 2007Wiley-VCH Verlag GmbH &Co.KGaA,Weinheimheterogeneous Sonogashira–Heckalkynylation reactions would be timely and useful.Herein we compare the highly efficient palladium catalyst systems reported for the direct alkynylation of C(sp 2)halides with terminal alkynes in the presence (Sonogashira—Tohda–Hagihara reaction)and without (Dieck–Heck–Cassar alky-nylation)a copper co-catalyst.The advantages of the reactions being carried out in a homogeneous phase are covered in the first part,notably:1)high turnover numbers,2)the coupling of the widely available and low-cost aryl chlorides,3)milder reaction conditions and the minimization of the consumption of depletive resources.The second part isdevoted to the recyclable catalytic systems both in homoge-neous and heterogeneous phases:1)biphasic (and/or ther-momorphic)systems,2)colloidal and solid-supported cata-lysts,and 3)systems using unusual solvents,such as ionic liquids.The last part is a discussion on other closely related research in this field,especially:1)new activation processes (microwaves and sonication),2)catalytic systems using other metals and the so-called “metal-free”systems,and 3)recently disclosed unusual coupling partners.The remaining chal-lenges in the field as well as the desirable developments are outlined in the conclusion.In this Review,the literature cut-off on this very productive topic in organic chemistry and catalysis was the beginning of 2006.2.Sonogashira–Heck Alkynylations in the Homogeneous PhaseIn the last three decades a large number of palladium–ligand complexes (and even ligand-free catalytic systems)have been tested on homogeneous-phase Sonogashira–Heck–Cassar reactions.These studies have shown that virtually any palladium source is capable of reaching high TONs for facile reactions—such as the coupling of aryl iodides with phenyl-acetylene—provided appropriate reaction conditions are found.On the other hand,with less-reactive substrates—such as electron-rich or sterically congested aryl bromides,aryl chlorides,propargyl alcohols,or propargylamines—much lower TONs are generally obtained,and the ligands have a large influence on the outcome of the reactions.Therefore,the systematic study of TONs in palladium-catalyzed C ÀC bond-formation processes is an important area of research for future industrial applications.For this reason the focus herein is placed upon the TONs of the reactions rather than on the yields,which are generally high.The factors that affect the rates of the Sonogashira reaction are not completely understood,however,the steric and electronic properties of the ligands and catalysts are determining parameters.In the following,we discuss succes-sively the results of studies carried out on systems incorpo-rating either monophosphanes,carbenes,and di-,tri-,and tetradentate ligands,as well as palladacycles;herein emphasis is placed upon the alkynylation reactions which employed vinyl and aryl bromides or chloride substrates.Henri Doucet was born in Paris in 1967.He received his PhD in chemistry with Prof.P.H.Dixneuf and Dr.C.Bruneau at Rennes University.After postdoctoral positions at Oxford University (J.M.Brown)andNagoya University (R.Noyori),he moved to the University of Marseille as a CNRS researcher.His research interests include organic synthesis by metal-catalyzed process-es and ligand synthesis.At the end of 2006he joined Rennes University.Jean-Cyrille Hierso was born in Toulouse in 1971.He studied physical chemistry at the UniversitØP.Sabatier,where he worked on Pd nanochemistry (MS 1994,Dr.B.Chau-dret,LCC-CNRS)and on CVD for heteroge-neous catalysis (PhD 1997,Prof.P.Kalck).After postdoctoral research on scorpionate organometallic complexes (Prof.M.Etienne,LCC)and paints chemistry (Prof.J.Reedijk,Netherlands),in 2001he was appointed Maître de ConfØrences in Dijon.In 2006he was awarded his Habilitation on the syn-thesis of ferrocenyl polyphosphanes and their application in homogeneous catalysis.Scheme 1.Original conditions reported in pioneering works on alkynylation reactions of C(sp 2)halides.2007Wiley-VCH Verlag GmbH &Co.KGaA,Weinheim Angew.Chem.Int.Ed.2007,46,834–8712.1.High-Turnover Palladium–Ligand Catalyst Systems2.1.1.Palladium–Monophosphane SystemsThe Sonogashira–Heck coupling was originally carried out using amines as solvents.Thorand and Krause found that good yields were obtained when this reaction was carried out using2mol%[PdCl2(PPh3)2],4mol%CuI,and1.5equiv-alents of triethylamine in THF(Scheme2).For example,4-bromobenzaldehyde or4-bromoacetophenone gave the expected products with yields of99%and92%,respectively, when trimethylsilylacetylene was used.Moreover,these reactions were performed at room temperature.[20]Two years later,Fu,Buchwald,and co-workers deter-mined that[PdCl2(PhCN)2]/P(t Bu)3serves as an efficient and a versatile catalyst for a wide range of Sonogashira reactions of electron-poor or electron-rich aryl bromides at room temperature(Scheme3):4-bromoanisole couples with high efficiency,even the very electron-rich4-bromo-N,N-dimethylaniline reacts cleanly at room temperature,and Sonogashira couplings of sterically hindered aryl bromides can be achieved at room temperature.This study provided evidence of the usefulness of bulky,electron-rich phosphanes in palladium-catalyzed Sonogashira reactions.[21]The efficiency of the[Pd2(dba)3]/P t Bu3system in the absence of a copper co-catalyst was reported concomitantly by Böhm and Herrmann(Scheme4).[22]This system promotes the alkynylation of electron-rich,electron-poor,and sterically congested aryl bromides equally at room temperature,with-out the need for a CuI co-catalyst.This catalyst is highly active—only0.5mol%palladium and ligand are required. Both Et3N and THF can be employed as the solvent;Et3N plays an additional role of an organic base.The practical utility of trialkylphosphanes such as P t Bu3 can be compromised by their sensitivity to oxidation,which can render them difficult to handle.To address this problem, Netherton and Fu examined the conversion of air-sensitive trialkylphosphanes into storable,air-stable phosphonium salts by protonation of the phosphorus atom(Scheme5).The authors demonstrated that these robust salts can serve as direct alternatives to the corresponding phosphanes:a simple deprotonation by a Brønsted base under the reaction conditions releases the trialkylphosphane.[23]Table1:Review articles relating to the synthesis and application of enynes and polyynes,as well as to the catalytic systems developed for the alkynylation of halides(published after1999).Title Authors Ref. Synthesis of Naturally Occurring Polyynes R.R.Tykwinski,A.L.K.Shi Shun[9] Palladium-Catalyzed Cross-Coupling Reactions in Total Synthesis K.C.Nicolaou,P.G.Bulger,D.Sarlah[7] High-Turnover Palladium Catalysts in Cross-Coupling and Heck Chemistry:A Critical Overview V.Farina[10] Recent homogeneous catalytic applications of chelate and pincer N-heterocyclic carbenes E.Peris,R.-H.Crabtree[12] Dual role of nucleophiles in palladium-catalyzed Heck,Stille,and Sonogashira reactions A.Jutand[19] Palladium-Catalyzed Alkynylation E.-I.Negishi,L.Anastasia[6] Evolution in the Palladium-Catalyzed Cross-Coupling of sp-and sp2-Hybridized Carbon Atoms R.R.Tykwinski[17]Phospha-palladacycles and N-heterocyclic carbenes palladium complexes: efficient catalysts for CÀC coupling reactions W.A.Herrmann,K.Öfele,D.von Preysing,S.K.Schneider[13]N-Heterocyclic Carbenes:A New Concept in Organometallic Catalysis W.A.Herrmann[14] Palladium-Catalyzed Coupling Reactions of Aryl Chlorides A.F.Littke,G.C.Fu[11] Catalytic cross-coupling reactions mediated by palladium/nucleophilic carbene systems S.Nolan et al.[15] Development of Pd/Cu-catalyzed cross-coupling of terminal acetylenes with sp2carbon halides K.Sonogashira[5] Poly(arylethynylene)s:Syntheses,Properties,Structures,and Applications U.H.F.Bunz[8] Application of palladacycles in Heck-type reactions W.A.Herrmann,V.P.W.Böhm,C.-P.Reisinger[16] Recent developments of palladium(0)catalyzed reactions in aqueous medium J.-P.GenÞt,M.Savignac[18]Scheme2.Alkynylations of aryl bromides in THF.Scheme3.Sonogashira coupling of aryl bromides using a Pd/P t Bu3system.Scheme4.Heck coupling(copper-free)of aryl bromides using aPd/P t Bu3system.dba=trans,trans-dibenzylideneacetone.837Angew.Chem.Int.Ed.2007,46,834–871 2007Wiley-VCH Verlag GmbH&Co.KGaA,Weinheim Following the reports by Fu,Buchwald,and Herrmann (Schemes 3and 4)Soheili et al.developed a copper-free alkynylation procedure for aryl bromides with P t Bu 3at room temperature (Scheme 6).With acetonitrile as the solvent and1,4-diazabicyclo[2.2.2]octane (DABCO)as the base,the reaction of activated and electron-rich aryl bromides with aromatic and aliphatic acetylenes proceeded in good yields.A lower conversion was obtained using 4-chloroacetophe-none.[24]The efficiency of bulky,electron-rich phosphane ligands was also developed by Köllhofer and Plenio.They obtained high TONs for the alkynylation of a wide variety of aryl bromides at higher temperatures than those employed before;Na 2[PdCl 4]/P t Bu 3was used as the catalyst while HN i Pr 2was used as the solvent and the base (Scheme 7).For example,a TON of 18600was obtained for the reaction of the deactivated aryl bromide N ,N -dimethyl-4-bromoaniline with phenylacetylene at 808C.[25]By using this catalytic system,the sterically congested 1-bromo-2,6-dimethylbenzene reacted with phenylacetylene to give the expected product with a TON of 16800.They also explored the potential of (1-Ad)2PBn (1-Ad =1-adamantyl)as the ligand for this coupling instead of P t Bu 3.The coupling of various aryl bromides with phenylacetylene at catalyst loadings as low as 0.005mol %occurred in excellent yields;P t Bu 3was found to be the superior ligand for most of the substrate combinations.These two sterically hindered and electron-rich phos-phane ligands were also found to be efficient for the coupling of aryl chlorides (Scheme 8).A variety of electron-poor,electron-rich,and sterically congested aryl chlorides were successfully alkynylated in good yields and TONs using 2mol %of the catalyst.The choice of the base was decisive for the success of this reaction.While alkynes and aryl bromides couple efficiently in the presence of HN i Pr 2,reactions with aryl chlorides were troublesome.The best solvents were toluene,xylene,and DMSO,and the best base Na 2CO 3.[26]The recycling possibilities using modified ligands of this kind has also been examined (see Section 3.1.1).[27–31]Probably the most impressive results for the activation of aryl have been reported by Gelman and Buchwald using dicyclohexyl(2’,4’,6’-triisopropylbiphenyl-2-yl)phos-phane as the ligand.They have developed a general protocol for the coupling of aryl chlorides and alkynes using a low catalyst loading in the presence of this sterically congested electron-rich ligand (Scheme 9).This method requires only 0.1mol %catalyst,moderate temperatures (70–958C),and tolerates electron-rich,electron-poor,and sterically con-gested aryl chlorides.They have also observed that the addition of CuI as a co-catalyst can inhibit the coupling reaction or lead to a decrease in the yield.A good functional group compatibility and a broad range of compatible alkynes characterize this new catalytic system.[32]For example,the reaction of 2-chloroanisole with phenylacetylene gave the coupling product with a TON of 950and in 95%yield.A sulfonated version of this ligand for a Sonogashira reaction in water has also been described (see Section 2.3).[33]A few other bulky and electron-rich phosphane ligands have been prepared and tested in the Sonogashira reaction.A palladium complex of 1,3,5,7-tetramethyl-2,4,8-trioxa-6-phenyl-6-phosphaadamantane has been shown to beanScheme 5.Air-stable phosphonium salts used in Sonogashira alkynyl-ations of arylbromides.Scheme 6.Heck alkynylation of aryl bromides and chlorides using a Pd/P t Bu 3system.Scheme 7.Sonogashira coupling of aryl bromides using Pd/P t Bu 3and Pd/(1-Ad)2PBnsystems.Scheme 8.Sonogashira alkynylation of aryl chlorides using Pd/P t Bu 3and Pd/(1-Ad)2PBn systems.2007Wiley-VCH Verlag GmbH &Co.KGaA,WeinheimAngew.Chem.Int.Ed.2007,46,834–871effective catalyst for the alkynylation of aryl bromides, including electron-rich or sterically congested ones(Scheme10).[34]Capretta and co-workers have also demonstrated that the phosphorinane family of trialkylphosphane ligands can be used in the Sonogashira reaction of aryl bromides (Scheme11).[35]The reactions were performed at room temperature in dioxane with HN(i Pr)2as the base and CuI as the co-catalyst.Wolf and Lerebours developed a combination of a palladium source and a phosphinous acid as the catalyst for a Sonogashira reaction that proceeds in water and in air without the need for an organic cosolvent(Scheme12,see also Section2.3).Disubstituted alkynes have been prepared in up to91%yield by the coupling of various aryl halides in the presence of tetrabutylammonium bromide and pyrroli-dine or NaOH using10mol%catalyst.[36]Zhang and co-workers have developed a copper-and amine-free Sonogashira reaction using readily prepared,air-stable aminophosphane ligands.The mild reaction conditions and the utilization of an inorganic base are the most attractive features of this reaction(Scheme13).The use of electron-rich and bulky ligands might make both the oxidative addition and the reductive elimination steps easier.However,these ligands have not yet been tested in the activation of aryl chlorides.[37] Martensson and co-workers have attempted to optimize the copper-free alkynylation reaction through careful choice of the solvent and base.Several reactions were conducted using4-trifluoromethyliodobenzene to examine the depend-ence of the alkynylation on the solvent,base,and ligand(such as AsPh3or P(OEt)3,Scheme14;see also Section4.3).[38][PdCl2(PCy3)2]showed high catalytic activity in the cross-coupling of aryl chlorides with a variety of terminal alkynes in DMSO at100–1208C under copper-free conditions and with Cs2CO3as the base(Scheme15).The advantages of this copper-free procedure include the availability and ease of handling of the catalyst,and a high catalytic activity for bothScheme9.Heck alkynylation(copper-free)of aryl chlorides using a Pd/PCy2(triisopropylbiphenylyl)system.Scheme10.Heck alkynylation of aryl bromides using a Pd/phospha-adamantane system.Scheme11.Sonogashira coupling of aryl bromides using a Pd/phos-phorinane system.Scheme12.Alkynylation in water employing a palladium–phosphinousacid complex as catalyst.Scheme13.Palladium/aminophosphane-catalyzed alkynylation of aryl bromides.Scheme14.Coupling of an aryl iodide using Pd/AsPh3and Pd/P(OEt)3 systems.839Angew.Chem.Int.Ed.2007,46,834–871 2007Wiley-VCH Verlag GmbH&Co.KGaA,Weinheim electron-poor and electron-rich aryl chlorides.[39]A variety of functional groups including alcohols,esters,and ketones were tolerated under these conditions.Of the relevant useful procedures,a low temperature (À208C)Sonogashira reaction of aryl iodides has also been described in which tris(2,4,6-trimethylphenyl)phosphane was used as the ligand.[40]Catalytic protocols involving a combination of a palla-dium source and monophosphane ligands emerged as very powerful systems in the Sonogashira–Heck–Cassar alkynyl-ation reactions of demanding aryl bromide and chlorides.Some of the ligands in this category,especially the sterically congested and electron-rich P t Bu 3,(1-Ad)2PBn,dicyclo-hexyl(2’,4’,6’-triisopropylbiphenyl-2-yl)phosphane,and PCy 3have led to reactions with impressive TONs,even with deactivated aryl bromides or aryl chlorides.These palladium catalysts will likely play a leading role in the development of Sonogashira–Heck alkynylation reactions in the coming years;particularly if properties such as air-and moisture-insensitivity are developed,they could replace traditional systems with PPh 3ligands.2.1.2.Systems Incorporating CarbenesCarbene ligands have also been employed for homoge-neous-phase Sonogashira–Heck reactions (Schemes 16-18).[41–48]In all cases the alkynylation products were obtained,however,generally with low TON values.The highest TON of 540was reported by McGuiness and Cavell using a carbene–pyridine ligand for the coupling of 4-bromoacetophenone with phenylacetylene (complex A in Scheme 16).[41]Bulky phenanthracenyl-substituted imidazolium-derived carbene ligands have been investigated for the copper-free alkynylation of aryl bromides and iodides (Scheme 17).A remarkable dependence on the size of the ligand was found.[44]Palladium complexes of acyclic diaminocarbenes ligands were also found to catalyze the alkynylation of aryl bromides such as 2-bromotoluene or 2-bromoanisole in high yields (Scheme 18).[45]A palladium/imidazolium chloride system has been used to mediate the coupling reaction of aryl halides with alkynylsilanes.The combination of 3mol %Pd(OAc)2and 6mol %imidazolium chloride in the presence of Cs 2CO 3as the base proved to be an efficient system for the coupling of para -and ortho -substituted aryl bromides with alkynylsilanes in high yields and with TONs of 14to 33(Scheme 19).[46]It is noteworthy that the coupling of primary and secondary alkyl bromides with terminal alkynes using palla-dium–carbene complexes as catalysts has also recently been described (see Section 4.3).[47,48]Scheme 15.Copper-free alkynylation of aryl chlorides using the complex [PdCl 2(PCy 3)2].Cy =cyclohexyl.Scheme 16.Alkynylation reactions of 4-bromoacetophenone using Pd/carbenesystems.Scheme 17.Phenanthracenylimidazolium-derived carbene ligands for the Heck alkynylation of arylbromides.Scheme 18.Heck alkynylation of ortho -substituted bromoarenes with a Pd/diaminocarbene acyclicligand.Scheme 19.A palladium/imidazolium chloride system for the coupling of aryl bromides and alkynylsilanes.2007Wiley-VCH Verlag GmbH &Co.KGaA,WeinheimAngew.Chem.Int.Ed.2007,46,834–871To date,carbene ligands do not appear to be highly efficient catalysts for the coupling of aryl chlorides.In addition,more mechanistic studies are needed to reach a better understanding of the only moderate efficiency of these catalytic systems for aryl alkynylation reactions.2.1.3.Chelating Diphosphanes,Diamines,and P,N LigandsDidentate ligands such as diphosphanes or diamines are also efficient at catalyzing Sonogashira–Heck alkynylation reactions.A polymer-supported copper-free system with a bispyrimidine ligand resulted in the efficient alkynylation of aryl iodides with high TONs(Scheme20).The use of the less reactive bromobenzene gave a satisfactory yield of up to 85%,even with Pd amounts as low as0.006mol%.The reaction of chlorobenzene can be accelerated effectively by the addition of n Bu4NBr to the reaction mixture.Under these conditions the TON was similar to those obtained with iodo-or bromobenzene.[49]A di(pyridin-2-ylmethyl)amine-derived palladium chlo-ride complex is also an efficient catalyst for the coupling of aryl iodides or bromides with alkynes(Scheme21,see also Section2.3).With this catalyst,the alkynylation can be performed under copper-free conditions in N-methylpyrroli-dine(NMP),with TONs up to200000and TOFs up to67000 for aryl iodides,and TONs up to900for aryl bromides.[50,51] The coupling of2-bromothiophene with phenylacetylene in the presence of0.1mol%catalyst led to the product in90% yield.This ligand was also anchored to a polymer for heterogeneous catalysis studies(see Section3.2.2).[51,52]The efficiency of bulky electron-rich diphosphane ligands for Sonogashira reactions with iodobenzene,bromobenzene, or activated aryl chlorides has been investigated by Astruc and co-workers(Scheme22).A TON of100was obtained for the reaction of bromobenzene with phenylacetylene.How-ever,these catalysts gave low TONs of0–15and yields of0–30%with aryl chlorides.A bis(tert-butylphosphane)was generally found to be more efficient than a bis(cyclohexyl-phosphane)ligand.[53]The efficiency of a dendrimer deriva-tive of this catalyst and a resin-supported bis(diphenylphos-phanylmethyl)aminopolystyrene complex have also been tested(see Section3.1.1).[54,55]Among the ligands used for Sonogashira–Heck alkynyl-ations,bulky phosphanes with poor s-donating ability have attracted much less attention.Their efficiency is a pleasant surprise since poor s-donor ligands would not be expected to facilitate the oxidative addition step,but rather would be assumed to be powerful inhibitors.The didentate ligand1,1’-bis[di(5-methyl-2-furyl)phosphanyl]ferrocene catalyzed the arylation of phenylacetylene efficiently(Scheme23).4-Bro-moacetophenone and4-bromoanisole were employed as the activated and deactivated substrates,respectively.The reac-tion of4-bromoacetophenone in the presence of10À4mol% catalyst gave a TON of920000,which is among the highest reported TONs for aryl bromides.4-Bromoanisole was also quantitatively converted,but with a lower TON of1000.[56] As the authors noted,a decisive advantage of the ferrocenylphosphane ligands such as1,1’-bis[di(5-methyl-2-furyl)phosphanyl]ferrocene is their robustness towards air,Scheme20.Coupling of aryl halides to phenylacetylene using a supported palladium–bispyrimidine complex.Scheme21.Alkynylation of aryl halides using a palladium–bispyridine complex.Scheme22.Alkynylations of aryl halides using palladium and anelectron-rich aminobisphosphane.Scheme23.A Pd/[bis(furyl)phosphanyl]ferrocene system for thealkynylation of aryl bromides at low concentration.841Angew.Chem.Int.Ed.2007,46,834–871 2007Wiley-VCH Verlag GmbH&Co.KGaA,Weinheim moisture (no phosphorus oxidation),and elevated reaction temperatures,which allows them to be used in substantially lower concentration.The palladium(II)complex of a ferrocene-based phosphinimine-phosphane ligand was also applied to the amine-and copper-free Sonogashira coupling of aryl iodides and aryl bromides with terminal alkynes by using one equivalent of tetrabutylammonium acetate as an activator (Scheme 24).The corresponding disubstituted alkynes were obtained in high yields and good TONs by using 0.1mol %of the Pd catalyst.[57]The combination of an iminophosphane ligand and Pd-(OAc)2was found to be more effective than a Pd(OAc)2/PPh 3complex for the coupling of some aryl bromides with alkynes (Scheme 25).[58]The efficiency of a Pd(OAc)2/pyrimidine catalyst has also been evaluated (Scheme 26).This system gave satisfactory results in terms of yields of product,however,low TONs were reported.[59]A dinuclear palladium–tetraphenyl oxalic amidinate com-plex has been used as a precatalyst in the copper-free Sonogashira reaction of 4-bromoacetophenone with phenyl-acetylene,and gave moderate TONs (Scheme 27).[60]Yoshifuji and co-workers have reported the use of didentate P ,P [61]and P ,S ligands [62]with 1,3-diphosphapropene skeletons for the coupling of iodobenzene with phenylacety-lene using 2.5mol %catalyst.The P ,P ligand was inactive for the coupling of bromobenzene.Several didentate ligands provided efficient catalytic systems for the alkynylation of aryl substrates.Three of them led to very good TONs:22300(bispyrimidine ligand,Scheme 20),200000(bipyridine ligand,Scheme 21),and 71000(bis-tert -butylphosphane ligand,Scheme 22)in the coupling of simple aryl iodide substrates.Some were even efficient at activating more demanding aryl bromides:the bispyrimidine and bipyridine ligands (Schemes 20and 21)allow the coupling of aryl bromides (TONs of 15500and 700,respectively),while the ferrocene-based didentate ligands (Schemes 23and 24)gave the arylated alkynes in fairly good to remarkably high TONs (920000and 990,respectively).Conversely,most of these ligands were found to be less efficient in the activation of aryl chlorides.2.1.4.Tri-and Tetradentate LigandsOnly a few multidentate ligands (tri-,tetradentate,or more)have been tested for Sonogashira–Heck alkynylations.This is all the more surprising since,most of the time,a threefold or more excess of the monodentate ligands are used under conventional conditions.Thus,multidentate ligands might be of great interest in the future development of catalytic alkynylations.The potential of a tridentate C,N,C-dicarbene pincer ligand has been evaluated in the reaction of iodobenzene and 4-bromoacetophenone with phenylacetylene (Scheme 28).Iodobenzene and phenylacetylene can be coupled in 92%yield in pyrrolidine using 1mol %of this catalyst and CuI as a promoter.On the other hand,a 10%yield was obtained after 19h from 4-bromoacetophenone.[63]Recently,this complex has been immobilized onto clays (see Section 3.2.3).[64]Scheme 24.A ferrocene-based phosphinimine-phosphane ligand for the copper-free alkynylation of arylbromides.Scheme 25.Coupling of aryl bromides to phenylacetylene using a Pd/iminophosphanesystem.Scheme 26.Coupling of aryl halides to phenylacetylene using a palladium–pyrimidinesystem.Scheme 27.Coupling of 4-bromoacetophenone to phenylacetylene using a dinuclear [Pd(acac)]complex.Scheme 28.Sonogashira alkynylation with the palladium complex of a tridentate C,N,C-dicarbene pincer ligand.2007Wiley-VCH Verlag GmbH &Co.KGaA,WeinheimAngew.Chem.Int.Ed.2007,46,834–871。
钯催化偶联反应氧气的作用

钯催化偶联反应氧气的作用
钯催化偶联反应是一种有机合成反应,其中钯催化剂促使两个有机分子之间发生偶联反应,形成新的有机化合物。
在这类反应中,氧气(O2)可以起到多种作用,其中一些可能包括:
1.氧化还原反应:在某些钯催化的偶联反应中,氧气充当氧化剂,
参与氧化还原反应。
它可以帮助将底物从一种氧化态转化为另
一种,促使反应的进行。
2.再氧化钯催化剂:钯催化反应中,催化剂钯(Pd)通常在反应
中被还原为Pd^0状态。
氧气可以在反应过程中重新氧化钯催
化剂,使其恢复到Pd^2+或其他活性状态,从而保持催化剂的
活性。
3.溶剂或反应介质:氧气可以用作反应的溶剂或介质,有助于溶
解底物和催化剂,促进它们之间的相互作用。
4.氧气途径:在某些反应中,氧气可能直接与底物或中间体反应,
产生活性中间体,进一步参与偶联反应。
总之,氧气在钯催化偶联反应中的作用可以是多方面的,通常取决于具体的反应类型和底物。
它可以作为氧化剂、催化剂再生剂、反应溶剂或参与反应的底物之一。
这些作用有助于促进偶联反应的进行,并控制所得产物的选择性。
这种氧气的使用是许多重要有机合成反应中的关键步骤之一。
药明康德Pd催化的偶联反应MA070818精品PPT课件

在钯催化下,有机硼化合物与有机卤素化合物进行的 偶联反应,称之为Suzuki偶联反应,或Suzuki-Miyaura 偶联反应。
R1 BY2
+
R2 X
[P d ] base
R1 R2
BY2 = B(OR)2, 9-BBN, B(CHCH3CH(CH3)2) X = I, Br, Cl, OSO2(CnF2n+1), n = 0,1,4
合成反应讲座(五)
Pd催化的偶联反应
化学合成部执行主任:
药明康德版权所有
1
内容简介
Pd 催化的偶联反应有较多类型,目前用途最广泛 的主要有以下三类:
1. Suzuki 反应 2. Heck 反应 3. Sonogashira 反应
2
第一部分: Suzuki 反应
3
1. 前 言
1.1 Suzuki反应的通式
TMS 1.nBuLi,THF -78oC, 15min
TMS
2. B(OMe)3
I
-78oC-25oC,30min (HO)2B
3. H+/HCl
Chem. Eur. J. 2003, 9, 4430-4441
8
2. 有机硼试剂的合成
2.2 通过二硼烷频哪酯制备芳基硼酸酯
对于分子中带有酯基、氰基、硝基、羰基等官能团的芳香卤代物来 说, 无法通过有机金属试剂来制备相应的芳基硼酸。1995年由 Ishiyama率先取得了突破: 通过二硼烷频哪酯和芳基卤发生偶联反应 制备相应的芳基硼酸酯 (yield: 60-98%)。这个方法还有一个突出的优 点就是还可以原位制备硼酸酯, 然后“一锅法”和芳基卤反应用于芳基芳基偶联反应。
4
1. 前 言
1,1'-双二苯基膦二茂铁二氯化钯催化的偶联反应的机理

1'-双二苯基膦二茂铁二氯化钯催化的偶联反应的机理
1,1'-双二苯基膦二茂铁二氯化钯(Pd(Ph)2P(O)CH2CH2P(Ph)2)催化的偶联反应是一种形成C-C键的反应。
该反应的机理可以分为三个阶段:氧化加成、亲核置换和还原消除。
1. 氧化加成:
在反应过程中,1,1'-双二苯基膦二茂铁二氯化钯(Pd(II))与卤代烃(X-R)和烯烃(R)发生氧化加成反应。
在这个过程中,Pd(II)催化剂被卤代烃的活泼氢原子(X-R)还原为Pd(0),同时生成相应的有机钯中间体。
2. 亲核置换:
在亲核置换阶段,Pd(0)催化剂与烯烃(R)发生配位,形成一个有机钯中间体。
随后,
该中间体在钯催化下,将烯烃的氢原子(b-H)移位,生成一个新的碳-碳键。
3. 还原消除:
最后,在还原消除阶段,催化剂Pd(0)与生成的有机钯中间体发生还原反应,生成Pd(II)催化剂。
同时,释放出反应产物(R-X)和HX。
总之,1,1'-双二苯基膦二茂铁二氯化钯催化的偶联反应通过氧化加成、亲核置换和还原
消除三个阶段,实现了卤代烃和烯烃之间的碳-碳键形成。
这种反应具有较高的立体和区
域选择性,且基团兼容性好,因此在有机合成中具有广泛的应用。
Pd催化下Suzuki偶联反应合_省略__硝基_2_2_联噻吩_5_甲醛_郭琳

!!!!!!!!!!!!!!!!!!!!功能材料Pd 催化下Suzuki 偶联反应合成5'-硝基-[2,2'-联噻吩]-5-甲醛郭琳,安忠维*,谢倩,陈新兵,陈沛(陕西师范大学材料科学与工程学院,陕西省西安市710100)摘要:以2-溴-5-硝基噻吩(BNT )和5-甲酰基-2-噻吩硼酸(FTBA )为原料,通过Suzuki 偶联反应合成了5'-硝基-[2,2'-联噻吩]-5-甲醛,考察了碱、溶剂、催化剂及加料顺序对该Suzuki 偶联反应的影响。
结果显示:优化条件为以1,2-二甲氧基乙烷(DME )为溶剂,氟化钠为碱,Pd /C 为催化剂,一锅加料。
关键词:Pd /C ;Suzuki 偶联反应;2-溴-5-硝基噻吩;5-甲酰基-2-噻吩硼酸中图分类号:O626.12文献标志码:A文章编号:1009-9212(2012)02-0060-04Synthesis of 5'-Nitro-[2,2'-bithiophene ]-5-carbaldehyde by Pd-catalyzed Suzuki Coupling Reaction GUO Lin ,AN Zhong-wei *,XIE Qian ,CHEN Xin-bing ,CHEN Pei(College of Materials Science and Engineering ,Shanxi Normal University ,Xi'an 710100,China )Abstract :5'-Nitro-[2,2'-bithiophene ]-5-carbaldehyde was synthesized via Suzuki coupling reaction using 5-nitro -2-bromothiophene and 5-formyl -2-thiopheneboronic acid as the starting materials.The influences of various bases ,solvents ,catalysts and addition sequence of materials on the coupling reaction were investigated.The results showed that the optimum reaction conditions were using DME as the solvent ,NaF as the base ,Pd /C as the catalyst and all were in one-pot.Key words :Pd /C ;Suzuki coupling reaction ;5-nitro-2-bromothiophene ;5-formyl-2-thiopheneboronic acid 第42卷第2期2012年4月精细化工中间体FINE CHEMICAL INTERMEDIATESVol.42No.2April 2012作者简介:郭琳(1986-),女,河南南阳人,硕士研究生,主要从事有机染料敏化剂的合成与性能研究。
PDⅡ催化碘代芳烃的ULLMANN偶联反应

Pd(II)催化碘代芳烃的Ullmann偶联反应摘要联芳烃结构广泛存在于天然产物、药物和有机导体以及有机半导体等物质中。
在上个世纪初,Ullmann发现了在计量的铜存在下,及高温(超过200 o C)条件下卤代芳烃经自身偶联反应合成联芳烃化合物。
近几十年来,发展为可以用过渡金属催化剂,但必须要有外加的还原剂同时作用下的催化偶联反应。
同时,更有意义的通过交叉偶联反应生成不对称的联芳烃,对化学家而言也一直是个挑战。
虽然有关不同的卤代芳烃之间,如碘代芳烃和溴代芳烃、溴代芳烃和氯代芳烃等,实现交叉偶联已有报导,但是仅在碘代芳烃之间实现交叉偶联反应的研究成果,还非常少见。
这需要开发较高反应选择性的催化体系来实现。
在此,我们介绍一个新的有效的催化体系(Pd(OAc)2 / MeCOEt / K2CO3),实现无外加还原剂条件下的碘代芳烃的Ullmann催化自身和交叉偶联反应,可以分别得到对称联芳烃和不对称联芳烃的产物,收率在53-88%之间。
特别是对于交叉偶联反应,我们发现选择不同活性的反应底物对以及控制反应底物对的投入比,可以保证反应主要生成不对称联芳烃。
另外,我们也对此无外加还原剂的二价钯催化的偶联反应提出新的反应机理假设,并通过一系列试验,证明了该反应的溶剂没有还原作用,而是碘代芳烃自身作为还原剂,起始催化剂为二价钯,由此可以合理地推断反应中存在四价钯中间体。
总之,我们发现了一个由二价钯催化的碘代芳烃在不需额外添加还原剂的条件下经偶联反应合成对称联芳烃和不对称联芳烃的新方法。
这个方法简便、有效,不仅符合合成化学对绿色化学的要求,而且对新反应的开发也有启示的意义。
关键词:钯、Ullmann反应、碘代芳烃、交叉偶联、联芳烃PALLADIUM(II)–CATALYZED ULLMANNREACTION OF ARYL IODIDESABSTRACTBiaryl motifs are easily found in many natural products, medicines and organic electronical materials. One century ago, Ullmann discovered successfully that biaryls were prepared through homocoupling reactions of aryl halides in the presence of stoichiometric copper under high temperature. After that, transition metal-catalyzed couplings of aryl halides were developed, but additional reductants were also necessary in these reactions.On the other hand, the formation of unsymmetrical biaryls, the more important products in organic synthesis by cross-coupling reactions is always a challenge to chemists. Although a few examples on the cross-couplings between two different aryl halides have been disclosed, the catalytic cross-couplings of only aryl iodides are rarely reported because enhancing the reaction selectivity on the formation of unsymmetrical products is not easy using the current systems.Herein, we describe a novel Pd(II)-catalyzed Ullamnn coupling reaction of various aryl iodides in the absence of special reductants to afford symmetrical or unsymmetrical biaryls respectively. Especially inthe cross-coupling reactions, both selecting a pair of aryl iodides with different reactivity and tuning the ratio of them are crucial to obtain the unsymmetrical biaryls as major products. Furthermore, a new mechanism of these Pd(II)-coupling reactions is also proposed. In a series of tests to investigate the actual reductants in these processes, we found that the aryl iodides could play the role of reductant and the initial catalysts should be Pd(II) complexes. Thus, Pd(IV) species involved in the catalytic cycles of these couplings are reasonable.In summary, a new effective and convenient method has been established for the preparation of symmetrical and unsymmetrical biaryls through Pd(II)-catalyzed coupling reactions of various aryl iodides without additional reductants. This process is not only green in organic synthesis but also significant in basic chemistry for exploring more new reactions.Key word: palladium, the Ullmann reaction, aryl iodides, cross-coupling, biaryls.学位论文原创性声明本人郑重声明:所呈交的学位论文,是本人在导师的指导下,独立进行研究工作所取得的成果。
pdcl2催化苯基膦酸与卤代芳烃偶联的suzuki反应机理 -回复

pdcl2催化苯基膦酸与卤代芳烃偶联的suzuki反应机理-回复【主题】pdcl2催化苯基膦酸与卤代芳烃偶联的suzuki反应机理【文章内容】一、引言Suzuki反应是一种重要的偶联反应,可用于合成各种复杂的有机化合物。
其核心步骤是苯基膦酸和卤代芳烃之间的偶联反应,该反应通常由pdcl2(二茂铁-二氯化钯)等钯催化剂催化进行。
本文将一步一步解析pdcl2催化苯基膦酸与卤代芳烃偶联的Suzuki反应的机理。
二、pdcl2与苯基膦酸的配体交换反应Suzuki反应的第一步是苯基膦酸与pdcl2催化剂之间的配体交换反应。
此反应通常在碱存在下进行,碱可促进配体交换反应的进行。
苯基膦酸作为配体与pdcl2发生配体交换反应,生成[pd(II)](II代表氧化态)中间体。
该中间体具有较高的反应活性,可继续参与Suzuki反应的下一步。
三、卤代芳烃的氧化加成反应在苯基膦酸与pdcl2发生配体交换反应后,卤代芳烃参与反应。
首先,pd(II)中间体与卤代芳烃发生氧化加成反应,生成[pd(II)-L-Ar-X](L代表苯基膦酸,Ar代表芳基,X代表卤素)中间体。
该中间体中pd(II)与卤代芳烃之间形成一个新的碳-碳键,同时断裂了卤素-碳键。
这一步骤是反应的关键步骤,也是pdcl2催化剂发挥作用的关键步骤。
四、膦酸配体的脱离反应在pd(II)-L-Ar-X中间体形成后,溶液中的膦酸会与pd(II)发生部分脱离反应。
该反应使pd(II)-L-Ar-X中间体得到进一步激活,增强了反应的可能性。
五、膦酸钯中间体的形成在膦酸配体脱离后,pd(II)-L-Ar-X中间体会发生进一步变化,生成[pd(0)-L-Ar-X]中间体。
由于该中间体中的pd是零价,使得pd与苯基膦酸形成了一个稳定的化学键。
六、苯基膦酸的消旋反应生成的[pd(0)-L-Ar-X]中间体经历苯基膦酸的消旋反应,生成[pd(II)-L-Ar]中间体。
消旋反应过程中,苯基膦酸的手性中心会发生改变。
钯催化胺化偶联反应(四):反应机理

钯催化胺化偶联反应(四):反应机理
2016-08-14 13:20来源:内江洛伯尔材料科技有限公司作者:研发部
钯催化芳胺化反应机理解析
用于芳胺化反应的催化体系随着芳胺化反应机理的发展而逐渐发展。
因此芳胺化反应的机理研究有利于催化体系的改进。
Pd催化芳胺化反应的机理表明芳胺化反应包含3个历程: (1)卤代芳烃与钯化合物氧化加成; (2)胺与加成产物配位; (3)用碱去质子和还原消除产生芳胺。
最近几个机理研究都集中于催化循环中间物的性质及不同配体的影响。
Hartwig认为用DPPF为配体时,卤芳烃的氧化加成产物能与碱反应,生成Pd-醇化物,这个化合物与胺反应生成胺基芳烃钯化合物, 然后还原消除。
Amator对于ArI等量加成到(dba)Pd(BINAP)的详细动力学研究表明,消去dba的Pd比没有消去的更快。
Singh用原位实验研究监控Pd/BINAP催化溴苯与伯胺和仲胺偶联的整个过程:在过量胺存在时,动力学模型说明在卤芳烃氧化加成前,胺与Pd直接配位;卤芳烃氧化加成到(R(R′)NH)Pd(BINAP)比氧化加成到Pd(BINAP)更快。
Pd催化交叉偶联P_C键形成反应

2 机理
虽然对 Pd 催化交叉偶联形成P—C键的反应机 理研究的报道很少,但 是 一 般 认 为 反 应 经 过 如 下 历 程( 以H—P* 亲 核 试 剂 为 例 ) :RX 首 先 与 Pd (0 ) L2 氧化加成生成 RPdL2 X,然 后 H—P* 与 RPdL2 X 发 生 取代反应,消去 HX,生 成 的 RPdL2 P* 还 原 消 除 生 成 偶联产物 R—P* 并再生出 Pd(0) L2 ,开始下一循环, 从而使 偶 联 反 应 循 环 进 行 下 去[5—9]。 如 Scheme 1 所示。
Abstract Over the past three decades,palladium-catalyzed cross-coupling P—C bonds formation reactions attracted much attention in synthesis of medicines,catalyst-ligands,flame-retardants and polymer materials. The recent progress in phosphorus-carbon bond formation via palladium catalyzed cross-coupling reactions to synthesize organophosphorus compounds is reviewed in this paper. Different classes of phosphorus-based nucleophiles used as substrates in these reactions include dialkylphosphites, hypophosphonous esters, hypophosphites, phosphine oxides, primary / secondary phosphines, triaryl phosphines, trialkyl phosphites, phosphorus-silicon / stannum compounds,phosphine-borane complexes, etc. At the same times, electrophiles used in these cross-coupling reactions include alkenyl halides,aryl halides,alkenyltriflate,aryltriflate,vinylboronates and so on. The reaction mechanism,conditions and influence factors is also described in this paper.
药明内部讲义

Pd催化的偶联反应内容简介Pd 催化的偶联反应有较多类型,目前用途最广泛的主要有以下三类:1. Suzuki 反应2. Heck 反应3. Sonogashira 反应第一部分: Suzuki 反应1. 前 言1.1 Suzuki反应的通式在钯催化下,有机硼化合物与有机卤素化合物进行的偶联反应,称之为Suzuki偶联反应,或Suzuki-Miyaura 偶联反应。
R1BY2R2X [Pd]R1R2+BY2 = B(OR)2, 9-BBN, B(CHCH3CH(CH3)2)X = I, Br, Cl, OSO2(C n F2n+1), n = 0,1,4R1 = aryl, alkenyl, alkylR2 = aryl, alkenyl, alkynyl, benzyl, allyl, alkyl[Pd] = Pd(PPh3)4, Pd(dppf)Cl2base = Na2CO3, NaOCH2CH3, TIOH, N(CH2CH3)3, K3PO41.2 Suzuki反应的机理Suzuki 偶联反应的催化循环过程通常认为先是Pd(0)与卤代芳烃发生氧化-加成反应生成Pd(II) 的络合物,然后与活化的硼酸发生金属转移反应生成Pd(II)的络合物,最后进行还原-消除而生成产物和Pd(0)。
1.3 Suzuki反应的特点及研究方向这类偶联反应有一些突出的优点:1.反应对水不敏感;2.可允许多种活性官能团存在;3.可以进行通常的区域和立体选择性的反应,尤其是,这类反应的无机副产物是无毒的并且易于除去,这就使得其不仅适用于实验室而且可以用于工业化生产。
其缺点是氯代物(特别是空间位阻大的氯代物)及一些杂环硼酸反应难以进行。
目前,Suzuki 偶联反应的研究主要在以下几个方向:1. 合成并筛选能够在温和的条件下高效催化卤代芳烃(特别是氯代芳烃)的配体;2. 多相催化体系的Suzuki偶联反应研究;3. 应用于Suzuki 偶联反应的新合成方法研究。
有机硅试剂参与Pd催化的交叉偶联反应及反应机理
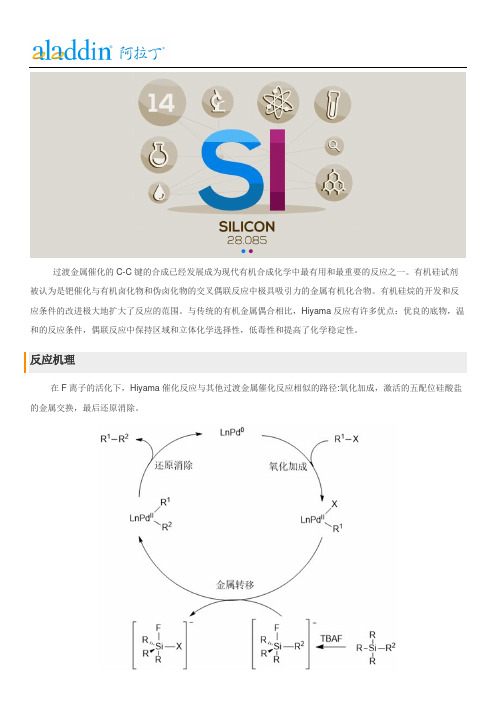
过渡金属催化的C-C键的合成已经发展成为现代有机合成化学中最有用和最重要的反应之一。
有机硅试剂被认为是钯催化与有机卤化物和伪卤化物的交叉偶联反应中极具吸引力的金属有机化合物。
有机硅烷的开发和反应条件的改进极大地扩大了反应的范围。
与传统的有机金属偶合相比,Hiyama反应有许多优点:优良的底物,温和的反应条件,偶联反应中保持区域和立体化学选择性,低毒性和提高了化学稳定性。
反应机理
在F离子的活化下,Hiyama催化反应与其他过渡金属催化反应相似的路径:氧化加成,激活的五配位硅酸盐的金属交换,最后还原消除。
氟激活的有机硅烷和有机卤化物的偶联反应机理
对烯基硅醇Hiyama偶联反应的深入研究表明,用亲核碱激活的反应与氟激活的反应通过不同的机制进行。
有机卤化物的氧化加成后,去质子化的硅醇盐或直接是硅醇,迅速加入到钯中,形成四配位的钯-硅醇盐络合物,然后通过还原消除放音形成交叉偶联产物。
四配合物的分解是催化循环反应中限速的步骤。
碱活化的烯烃硅醇盐的无氟交叉偶联反应机理
*三甲基硅烷
* 三烯丙基硅烷
* 卤代硅烷
* 硅氧烷
* 硅醇
* 环硅氧烷。
钯的置换反应

钯的置换反应
钯的置换反应是指将钯(Pd)作为催化剂参与有机化合物的转化反应。
钯具有良好的催化活性和选择性,广泛应用于有机合成中的各种置换反应。
钯的常见置换反应包括:
1. 氢化反应:钯催化的氢化反应是将不饱和化合物(如烯烃、炔烃、芳香化合物)与氢气反应,添加氢原子以饱和化合物。
这是一种重要的加氢反应,常用于合成醇、醛、胺等化合物。
2. 碘化反应:钯催化的碘化反应可以将有机物中的氢原子取代为碘原子。
这种反应在药物合成和有机化学中广泛应用,例如合成碘代芳烃和碘代酮等。
3. 氨基化反应:钯催化的氨基化反应是将有机物中的氢原子取代为氨基基团(-NH2)。
这种反应在合成胺类化合物和药物中具有重要应用。
4. 烷基化反应:钯催化的烷基化反应可以将有机物中的氢原子取代为烷基基团。
这种反应可用于合成烷基化产物,广泛应用于有机合成和药物化学领域。
5. 偶联反应:钯催化的偶联反应是将两个不同的有机分子连接在一起形成新的键。
其中最著名的是钯催化的Suzuki偶联和Heck偶联反应,广泛应用于构建碳-碳键和碳-氮键的合成中。
这些钯催化的置换反应具有高效、高选择性和广泛的底物适用性。
它们在有机合成中起着重要的作用,为合成化学家提供了强大的工具和方法。
贵金属钯Pd催化的偶联反应

通过调整钯催化剂的反应条件(温度、溶剂、配体、碱和其他添加剂),可使钯催化成为有机化学合成中用途广泛的工具。
其中,钯催化的交叉偶联反应彻底改变了分子的构造方式。
从有机合成和药物化学领域,到材料科学和聚合物化学,交叉耦合已经影响到多个科学领域。
在偶联反应中,钯催化剂不但可以形成C-C、C-O、C-N和C-F等碳键,而且对各种官能团具有很高的耐受性,通常能够提供良好的空间和区域特异性,可以不用引入保护基团。
常用的偶联反应包括Heck偶联、Suzuki偶联、Stille偶联、Hiyama偶联、Sonogashira偶联、Negishi偶联、Buchwald-Hartwig胺化等等。
具体反应如下所示:1、Negeshi偶联反应(C-C) [1](其中,R/R’可以是烷基、烯基、芳基、烯丙基、炔基或炔丙基,X/X’可以是氯、溴、碘或其他基团,催化剂是钯)2、Suzuki偶联反应(C-C) [2](其中,R可以是烯基,芳基或烷基,R’可以是烯基,芳基、炔基或烷基,Y可以是烷基,羟基或者氧烷基,X可以是氯、溴、碘或三氟甲磺酸)3、Stille偶联反应(C-C) [3](其中,R可以是烯基、芳基、酰基,R’可以是烯基、芳基或者烷基,R’’可以是烷基,X可以是氯、溴、碘或者三氟甲磺酸)4、Buchwald–Hartwig偶联反应(C-N/C-O)[4](其中,R是芳基,R’可以是邻、间芳基或烷基,R”可以是烷基或芳基,X可以是氯、溴、碘或者三氟甲磺酸)5、Heck偶联反应(C-C) [5](其中,R可以是烯基、芳基和不含有β氢的烷基,R’可以是烯基,芳基和烷基,X可以是氯、溴、碘、三氟甲磺酸、对甲基苯磺酰氯或者N2+)6、Sonogashira偶联反应(C-C) [6](其中,R可以是烯基或者芳基,R’可以是H、炔基、芳基、烷基或者硅烷基,X可以是氯、溴、碘或者三氟甲磺酸)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
20
分子内Heck反应
多烯大环的合成
Zeigler 利用Heck反应成功合成十六元环的大环多烯化合物
21
分子间Heck反应
常规分子间Heck反应
末端烯烃与卤代芳香烃发生分子间Heck反应,是研究最早的一类 反应。
该类反应在卤代物中,卤代芳烃、卤代杂环、卤化苄、卤代乙烯等
都能较好的反应。
该类反应常用碘代物和溴代物为反应底物,碘代物相对溴代物反应 活性要高。氯代物反应活性很差。
早期Sonogashira反应的局限性
局限性之二:通常使用的磷配体大多对水和空气敏感,反应 条件苛刻,反应中含磷配体在升温过程中易发生分解生成磷 酸盐等,反应要在惰性气体氛围下进行。
局限性之三:现有Sonogashira偶联反应的催化体系对反应底 物也是有限制的,一般是芳基碘化物、溴化物和活化的芳基 氯化物。
杂环芳基硼酸参与Suzuki偶联反应
杂环芳基硼酸参与Suzuki偶联反应同样可以得到好的结果。
13
Suzuki偶联的应用
烯基溴参与Suzuki偶联反应
14
Suzuki偶联的应用
D. S. Ennis等用Pd /C 做催化剂大批量的进行Suzuki-coupling反应,以 生产抗抑郁药物。
直接Pd(OAc)2用于Suzuki偶联反应示例
酸,甚至三烷基硼,因此反应须在低温下进行。解决这个问题
的一个有效的办法是使用硼酸三异丙酯和有机锂试剂反应, 可 以避免二烷(芳)基硼烷和三烷(芳)基硼烷的产生,反应后加入
HCl酸化得到芳基硼酸酯。
有机硼试剂的合成
通过Grinard试剂制备单取代芳基硼酸示例
通过有机锂试剂制备单取代芳基硼酸示例
Suzuki偶联的应用
1. 在Suzuki反应循环中,Pd(0)与卤代芳烃发生氧化-加成反应生成 Pd(II)的络合物这一步是起决定作用的步骤。底物卤代芳烃中离去 集团的相对活性有如下特征:I > TfO > Br >> Cl 2. 芳基和烯基上若带有集团,则吸电子集团对氧化-加成的促进 作用要比给电子集团强。 3. 应用于Suzuki反应的催化剂最经典的是Pd(PPh3)4,其它的有 PdCl2、PdCl2(dppf)、Pd(OAc)2、Pd(PPh3)2Cl2等。
28
新配体的引入
Li等用叔胺作为钯催化Sonogashira偶联反应的配体的研究,发 现以DABCO为配体时,不同碘代芳烃和较活泼的溴代芳烃均可以与 末端炔发生Sonogashira偶联反应,而且醋酸钯的用量可以降低至 0.0001mol%。
29
新型催化体系的发现
无铜的钯催化体系
它是由钯催化剂和碱组成,其中常用的钯催化剂主要 有Pd(OAc)2, Pd2(dba)3, PdCl2(dppf), PdCl2(PPh3)2, PdCl2(PCy)2, PdCl2, PdCl2(CH3CN)2等; 常用的碱有:TEA, Cs2CO3, Bu4NOAc, Pyrrolidine等
22
分子间Heck反应
决定烯烃活性的主要因素是烯烃双键碳原子取代基的大小和 数目。取代基越大,数目越多,反应速度越小,收率越低。
23
第三部分:Sonogashira 反应
24
Sonogashira 反应
Sonogashira偶联反应指有机亲电试剂与末端炔烃之间 的反应,是形成碳-碳键,合成不同炔烃(尤其是中 间炔烃)的最重要方法之一。广泛应用在天然产物和 生物活性化合物的合成和材料科学等领域。
25
早期Sonogashira反应的局限性
Sonogashira交叉偶联反应普遍采用的催化体系是钯(II)、 膦和CuI组成的共同体系。最常用的配体为单齿、高位阻和 供电子能力强的三芳基膦。
局限性之一:在氧化剂或空气存在下,CuI可导致铜-乙炔 络合物的形成,进一步引起末端炔的自身偶联反应。
27
无铜盐助催化剂的钯催化体系的优点是对空气不 敏感,仅有微量的端炔的自身偶联产物形成。
30
无铜的钯催化体系示例
31
无铜的钯催化体系示例
32
底物的种类增多
乙烯基卤代烃与末端炔的偶联反应
33
底物的种类增多
脂肪基卤代烃与末端炔的偶联反应
34
15
第二部分: Heck 反应
16
Heck 反应
通常把在碱性条件下钯催化的芳基或乙烯基卤代物和活性 烯烃之间的偶联反应称为Heck反应。反应是构成C-C键的 重要反应之一。
17
Heck 反应机理
Heck反应的机理,通常认 为反应共分四步: 1)氧化加成(Oxidative addition): RX (R为烯基或 芳基,X=I > TfO > Br >> Cl) 与Pd0L2的加成,形成PdⅡ 配合物中间体; 2)配位插入 Cordinationinsertion):烯键插入Pd-R 键的过程; 3)β-H的消除; 4)催化剂的再生:加碱催 化使重新得到Pd0L2。
9
Suzuki偶联的应用
普通的芳卤和芳基硼酸的Suzuki偶联
这一类反应是最常碰到的,所用的方法即为Suzuki偶联反应的普通 操作:在水的存在下,加入催化剂、碱和有机溶剂,加热回流一段合理 的时间完成反应,反应体系必须全程严格控制无氧。 碱多用K2CO3,也有K3PO4、Na2CO3、CsF、Cs2CO3等。溶剂体系 toluene/EtOH/H2O, 也有CH3CN /H2O或dioxane/H2O。
Suzuki反应的机理
Suzuki 偶联反应的催化循环过程通 常认为先是Pd(0)与卤代芳烃发生 氧化-加成反应生成Pd(II) 的络合物, 然后与活化的硼酸发生金属转移反
应生成Pd(II)的络合物,最后进行
还原-消除而生成产物和Pd(0)。
Suzuki反应的特点
这类偶联反应有一些突出的优点:反应对水不敏感,可允许
多种活性官能团存在;可以进行立体选择性的反应,这类反 应的无机副产物是无毒且易除去,可以用于工业化生产。 其缺点是氯代物(空间位阻大的氯代物)及一些杂环硼酸反 应难以进行。
6
有机硼试剂的合成
通过金属有机试剂制备单取代芳基硼酸
合成单取代芳基硼酸(酯)的方法是用格氏试剂或锂试剂和硼 酸酯反应来制备。
这种方法的缺点是单取代芳基硼酸酯有进一步生成二取代硼
18
Heck 反应分类
Heck反应可以分为两大类:分子内反应和分子间反应
第一篇分子间该反应的报道是Heck 在1972年发表
Mori 和 Ban于1977年首次报道了分子内的Heck反应:
19
分子内Heck反应
生成烯基取代பைடு நூலகம்反应
该类反应主要用于生成环外双键。目前已有很多报道。
该反应还被Danishefsky应用到全合成Taxol上。
10
Suzuki偶联的应用
大位阻芳基硼酸参与Suzuki偶联反应
当芳基硼酸的邻位是二取代物时, 反应的速率很慢, 收率很 低。加入强碱水溶液如NaOH或Ba(OH)2,以苯和DME为溶剂对反 应有显著的加速作用。
11
Suzuki偶联的应用
芳基硼酸频哪酯和芳基卤代物的Suzuki偶联示例
12
Suzuki偶联的应用
Pd催化的偶联反应
梁端韦 1411110085
Pd催化的偶联反应
Pd 催化的偶联反应有较多类型,目前用途最广 泛的主要有以下三类:
1. Suzuki 反应
2. Heck 反应
3. Sonogashira 反应
第一部分: Suzuki 反应
Suzuki反应的通式
在钯催化下,有机硼化合物与有机卤素化合物进行的偶联反应, 称为Suzuki偶联反应
