配位平衡及其影响因素39页PPT
合集下载
溶液中的化学平衡-配位平衡

工业废水处理
工业废水中的重金属离子常通过配位反应进行沉 淀或吸附,从而达到净化废水的目的。
环境化学中的配位平衡问题
土壤污染修复
土壤中的重金属离子与有机配体发生配位反应,影响重金属的迁移 和生物有效性,从而影响土壤污染修复效果。
水质监测与净化
水体中的重金属离子、有机污染物等可通过配位反应进行转化和去 除,确保水质安全。
02
在化学分析中,可以利用配位平衡常数来计算溶液中各组分的浓度。
03
在生物学中,配位平衡常数可以用来描述生物体内的金属离子与蛋白 质、酶等生物大分子之间的相互作用。
04
在环境科学中,配位平衡常数可以用来研究重金属离子在土壤、水等 环境介质中的迁移转化行为。
04
配位平衡在化学反应中的作 用
配位反应的速率影响
由能变化等参数,从而预测反应结果。
05
实际应用中的配位平衡问题
工业生产中的配位平衡问题
1 2 3
金属冶炼
在金属冶炼过程中,配位平衡对于控制金属离子 的溶解度和稳定性至关重要,直接影响金属的提 取率和纯度。
化学品的合成与分离
许多化学品的合成和分离涉及到配位平衡,如利 用配位反应合成有机金属化合物、分离稀有元素 等。
03
配位平衡的计算与表示方法
配位平衡的计算
配位平衡是溶液中一种重要的化学平衡, 主要涉及配位体和中心离子之间的相互 作用。
配位平衡的计算通常需要使用平衡常数,如 稳定常数和不稳定常数,来描述配位体和中 心离子之间的结合和解离程度。
平衡常数的值取决于温度、压力和 溶液的组成,可以通过实验测定或 计算得出。
形成配合物的条件
金属离子和配位体需要在一定的条件下形成配合物,如温度、压 力、浓度等。
工业废水中的重金属离子常通过配位反应进行沉 淀或吸附,从而达到净化废水的目的。
环境化学中的配位平衡问题
土壤污染修复
土壤中的重金属离子与有机配体发生配位反应,影响重金属的迁移 和生物有效性,从而影响土壤污染修复效果。
水质监测与净化
水体中的重金属离子、有机污染物等可通过配位反应进行转化和去 除,确保水质安全。
02
在化学分析中,可以利用配位平衡常数来计算溶液中各组分的浓度。
03
在生物学中,配位平衡常数可以用来描述生物体内的金属离子与蛋白 质、酶等生物大分子之间的相互作用。
04
在环境科学中,配位平衡常数可以用来研究重金属离子在土壤、水等 环境介质中的迁移转化行为。
04
配位平衡在化学反应中的作 用
配位反应的速率影响
由能变化等参数,从而预测反应结果。
05
实际应用中的配位平衡问题
工业生产中的配位平衡问题
1 2 3
金属冶炼
在金属冶炼过程中,配位平衡对于控制金属离子 的溶解度和稳定性至关重要,直接影响金属的提 取率和纯度。
化学品的合成与分离
许多化学品的合成和分离涉及到配位平衡,如利 用配位反应合成有机金属化合物、分离稀有元素 等。
03
配位平衡的计算与表示方法
配位平衡的计算
配位平衡是溶液中一种重要的化学平衡, 主要涉及配位体和中心离子之间的相互 作用。
配位平衡的计算通常需要使用平衡常数,如 稳定常数和不稳定常数,来描述配位体和中 心离子之间的结合和解离程度。
平衡常数的值取决于温度、压力和 溶液的组成,可以通过实验测定或 计算得出。
形成配合物的条件
金属离子和配位体需要在一定的条件下形成配合物,如温度、压 力、浓度等。
配合物在稳定常数和配位平衡PPT资料(正式版)

首先,应明确影响pH值的是NH3的浓度 设Cl-的允许浓度为y, 则:
交界酸、交界碱
1 mol的NaCl(s)后已经有部分AgCl 生成
(b) 软硬酸碱原则:硬亲硬,软亲软,软硬交界就不管 [Cu(NH3)4]2+ ==== Cu2+ + 4NH3
加入含10 g水的浓度为15 mol·kg-1的氨水,求
现已证实多种顺铂([Pt(NH3)2Cl2])及其一些类似物对子宫癌、肺癌、睾丸癌有明显疗效。
但是配离子却不同, 存在
因此, 应假设平衡后浓度很小的为变量, 方可避免此困难
见p371 表 11-4 771×10-11 < Ksp
无AgCl
C(NH3)=10×15/50=3
对于配位平衡: Ag+ + 2NH3 == [Ag(NH3)2]+
(4) 求不生成AgCl 时,最多可加入NaCl的量
Ag+ + 2NH3 [Ag(NH3)2]+
11.3 配位平衡的移动
配离子之间的平衡 MLn + nL’ ML’n + nL
当 ML’n 的稳定性 大于 MLn的稳定性 时,反应可正向进行 两者稳定性相差越大,反应越完全
• (二) 配离子解离平衡的移动
11.2 影响配离子在溶液中稳定性的因素
2. 配体性质对配合物稳定性的影响
(a)配位原子的电负性 (b)配位体的碱性 (c )鳌合效应 (d)空间位阻和邻位效应
11.2 影响配离子在溶液中稳定性的因素
3. 配位原子合中心离子的关系对配合物稳定性的影响
ቤተ መጻሕፍቲ ባይዱ
且一般还都是易溶强电解质
8[C56u×(N1H03-)140],2+C=(=N(=H=3Cau2)+ +酸4NH碱3 的分类:硬酸、软酸、硬碱、软碱
无极分析化学配合物和配位平衡 PPT资料共66页

[配离子]+ 复杂负离子 某酸某
[Cu(NH3) 4]SO4 硫酸四氨合铜(Ⅱ)
2019/10/1
正离子[配离子] 某酸某
K4[Fe(CN)6 ] 六氰合铁(Ⅱ)酸钾
16
第九章 配合物与配位平衡
§9-1 配合物的基本概念
配合物内层的命名原则:
配体数 配体名称 合 中心原子名称(氧化态值)
以二、 三、四 表示
§9-1 配合物的基本概念
乙二酸根(草酸根)C2O42-
O
O 2-
C-C
O..
O..
乙二胺四乙酸EDTA(Y4-)
.. OOCH2C
O.. OCH2C
2019/10/1
.. NCH2-CH2-N..
.. CH2-COO
4-
CH2-COO..
8
第九章 配合物与配位平衡
[Ca(EDTA)]2-或CaY2-
组成的复杂分子,如[Fe(CO)5]。
2019/10/1
4
第九章 配合物与配位平衡
§9-1 配合物的基本概念
(3)配合物 (Coordination Compounds)
含配离子或配位分子的化合物称之为 配合物,如 [Ag(NH3)2]Cl。
(4)形成体
(Central Atom)
配合物的中心原子或中心离子。
§9-1 配合物的基本概念
配位原子分别 是4个O,2个N。
2019/10/1
9
第九章 配合物与配位平衡
§9-1 配合物的基本概念
(7)配位数 (Coordination Number)
配合物中直接与中心原子配位的原子的 总数,如 [Ag(NH3)2]+,配位数为 2 。
配位平衡和配位滴定法PPT课件
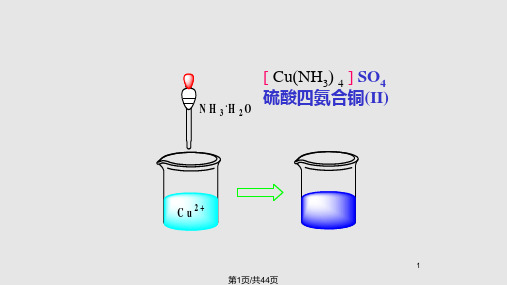
第2页/共44页
形成配合物的条件
配位键是配合物与其它物质最本质的区别
第3页/共44页
第4页/共44页
(1)中心原子:
中心原子又称中心体。根据配位化合物的 定义,中心原子是配合物中具有接受孤对 电子或能提供空轨道的离子或原子。
例: [SiF6]2-
[FeF6]3- Fe(CO)5 Ni(CO)4
22
第22页/共44页
4.无外界的配合物
[Ni(CO)4] 四羰基合镍 [Pt(NH3)2Cl2] 二氯•二氨合铂(Ⅱ)
第23页/共44页
练习:命名下列配合物
Cu(3)N 4SH O 4 硫酸四氨合铜(Ⅱ) K3Fe(NC 6S) 六异硫氰根合铁(Ⅲ)酸钾
Cu(3)N 4(H O2H)氢氧化四氨合铜(Ⅱ) Co2)(3(N N 3)O 3H三硝基•三氨合钴(Ⅲ)
EDTA配合物的结构
第10页/共44页
第11页/共44页
不是配体
(3) 配位数(coordination number) 的数目 配合物中,直接与中心原子配合的配位原 子的数目称为中心原子的配位数。
单齿配体: 配位数 = 配体的总数 多齿配位体:配位数 = 配体数*齿数
第12页/共44页
[Ca(EDTA)]2-或CaY2-
④同一金属离子,配体离子半径越大,配位数越小
如[AlF6]3- , [AlCl4]-
第16页/共44页
4、 配离子的电荷
配离子的电荷数 = 中心离子与配位体电荷的 代数和
如[Fe(CN)6]x x = 3 + (-1) 6 = 3
可由外界离子所带的电荷总数求得
[Co(en)3]Cl3
[Co(en)3]3+
形成配合物的条件
配位键是配合物与其它物质最本质的区别
第3页/共44页
第4页/共44页
(1)中心原子:
中心原子又称中心体。根据配位化合物的 定义,中心原子是配合物中具有接受孤对 电子或能提供空轨道的离子或原子。
例: [SiF6]2-
[FeF6]3- Fe(CO)5 Ni(CO)4
22
第22页/共44页
4.无外界的配合物
[Ni(CO)4] 四羰基合镍 [Pt(NH3)2Cl2] 二氯•二氨合铂(Ⅱ)
第23页/共44页
练习:命名下列配合物
Cu(3)N 4SH O 4 硫酸四氨合铜(Ⅱ) K3Fe(NC 6S) 六异硫氰根合铁(Ⅲ)酸钾
Cu(3)N 4(H O2H)氢氧化四氨合铜(Ⅱ) Co2)(3(N N 3)O 3H三硝基•三氨合钴(Ⅲ)
EDTA配合物的结构
第10页/共44页
第11页/共44页
不是配体
(3) 配位数(coordination number) 的数目 配合物中,直接与中心原子配合的配位原 子的数目称为中心原子的配位数。
单齿配体: 配位数 = 配体的总数 多齿配位体:配位数 = 配体数*齿数
第12页/共44页
[Ca(EDTA)]2-或CaY2-
④同一金属离子,配体离子半径越大,配位数越小
如[AlF6]3- , [AlCl4]-
第16页/共44页
4、 配离子的电荷
配离子的电荷数 = 中心离子与配位体电荷的 代数和
如[Fe(CN)6]x x = 3 + (-1) 6 = 3
可由外界离子所带的电荷总数求得
[Co(en)3]Cl3
[Co(en)3]3+
《化学反应教学课件》第六节配位平衡

配位平衡的建立和变化受反应 条件的影响,如温度、压力、 浓度等。
配位平衡的原理可以通过配位 平衡常数来描述,该常数反映 了配位化合物稳定性的大小。
02
配位平衡的原理及应用
配位平衡的原理
配位平衡常数
表示配位反应达到平衡状态时,配位 体与中心离子生成配合物的浓度比值 ,是反应平衡常数的一种形式。
影响因素
实验环境
保持实验室整洁,避免交叉污 染。
实验记录
及时记录实验数据和现象,以 便后续分析。
实验结果分析
数据处理
对实验数据进行处理,计算配位平衡常数。
结果分析
根据计算结果分析配位平衡常数的变化趋势,探究配位平衡的影 响因素。
结论总结
总结实验结论,为实际应用提供理论支持。
05
配位平衡的教学建议
教学重点与难点
配位平衡的重要性
01
配位平衡在化学反应中具有重要地位,许多化学反应都涉及到 配位平衡的建立和变化。
02
配位平衡对物质的性质、分离和提纯等方面具有重要影响。
配位平衡理论在化学、生物学、环境科学等领域有广泛应用。
03
配位平衡的原理
配位平衡的原理是中心原子或 离子的空轨道与配位体的孤电 子对之间的相互作用,形成稳 定的配位键。
重点
配位平衡的基本概念、原理及其应用。
难点
如何引导学生理解配位平衡的原理,以及如何在实际问题中应用配位平衡的知识 。
教学策略与方法
策略
采用实例教学、实验演示和小组讨论 相结合的方法,帮助学生深入理解配 位平衡的概念和应用。
实例教学
通过具体的化学反应实例,解释配位 平衡的形成和影响。
实验演示
通过实验演示,让学生观察配位平衡 的变化,加深理解。
8.3 配位平衡及其影响因素

正反应单向. 用于解除Pb2+中毒.
例2. 鉴定Co2+:
Co2++ 4 SCN- = [Co(NCS)4]2-
四异硫氰合钴(Ⅱ) 蓝紫色
Fe3+共存时干扰: Fe3+ + 4 SCN- = [Fe(NCS)x](x-3)- (x = 1- 6)
血红色
可加NH4F掩蔽: [Fe(NCS)]+ + 3F- = FeF3 + SCN- K
N CH2 CH2 N
HOOCH2C -OOCH2C
H N CH2 CH2 +
+ N
H
CH2COOCH2COOH
EDTA络合物的特点
● 广泛,EDTA几乎能与所有的金属 离子形成络合物;
● 稳定, lgK稳 θ; 15
● 络合比简单, 一般为1:1; ● 络合反应速度快,水溶性好; ● EDTA与无色的金属离子形成无色 的络合物,
[MLn ] [ML(n1) ][ L]
→累计稳定常数:cumulative stability constant
第一级累积稳定常数 1 K稳1
第二级累积稳定常数 ......
2 K稳1 K稳2
第 n 级累积稳定常数 n K稳1 K稳2...K稳n
n
n (K稳i ) i 1
n
lg n (lg i ) i 1
与有色的金属离子形成颜色更深的络合物。
表 3-1 有色 EDTA 螯合物
螯合物
颜色
CoY
紫红
Cr YCr(OH) Y2CuY2-
深紫 蓝(pH>10) 蓝
螯合物
Fe(OH) Y2FeYMn Y2NiY2-
例2. 鉴定Co2+:
Co2++ 4 SCN- = [Co(NCS)4]2-
四异硫氰合钴(Ⅱ) 蓝紫色
Fe3+共存时干扰: Fe3+ + 4 SCN- = [Fe(NCS)x](x-3)- (x = 1- 6)
血红色
可加NH4F掩蔽: [Fe(NCS)]+ + 3F- = FeF3 + SCN- K
N CH2 CH2 N
HOOCH2C -OOCH2C
H N CH2 CH2 +
+ N
H
CH2COOCH2COOH
EDTA络合物的特点
● 广泛,EDTA几乎能与所有的金属 离子形成络合物;
● 稳定, lgK稳 θ; 15
● 络合比简单, 一般为1:1; ● 络合反应速度快,水溶性好; ● EDTA与无色的金属离子形成无色 的络合物,
[MLn ] [ML(n1) ][ L]
→累计稳定常数:cumulative stability constant
第一级累积稳定常数 1 K稳1
第二级累积稳定常数 ......
2 K稳1 K稳2
第 n 级累积稳定常数 n K稳1 K稳2...K稳n
n
n (K稳i ) i 1
n
lg n (lg i ) i 1
与有色的金属离子形成颜色更深的络合物。
表 3-1 有色 EDTA 螯合物
螯合物
颜色
CoY
紫红
Cr YCr(OH) Y2CuY2-
深紫 蓝(pH>10) 蓝
螯合物
Fe(OH) Y2FeYMn Y2NiY2-
影响化学平衡的因素ppt课件

成与解离平衡的移动。
配位平衡常数
配位平衡常数是衡量配合物生成 与解离平衡的重要物理量,其大 小可以反映配合物生成与解离平
衡的移动情况。
05
实验探究:影响化学平 衡的因素
实验设计
01
02
03
设计思路
通过控制变量法,探究温 度、浓度、压强等因素对 化学平衡的影响。
实验原理
利用勒夏特列原理,分析 各因素对化学平衡的影响 。
通过实验可以验证不同因素对沉淀溶 解平衡的影响,并得出相应的结论。
沉淀生成和溶解的过程是可逆的,当 条件改变时,平衡会向生成沉淀或溶 解沉淀的方向移动。
研究不足与展望
本研究仅初步探讨了影响化学平衡的因素,对于其他可能的影响因素尚 未进行深入探讨。
在实验过程中,可能存在一些误差和干扰因素,对实验结果产生一定的 影响。
电极电势是衡量氧化还原反应进行程度的物理量,电极电势的变化 可以反映氧化还原平衡的移动情况。
催化剂的作用
催化剂能够加速氧化还原反应的速率,从而影响氧化还原平衡的移 动。
配合物生成与解离平衡的移动
配合物的生成
金属离子与配体结合生成配合物 的过程会影响配合物生成与解离
平衡的移动。
配合物的解离
配合物在溶液中解离成金属离子 和配体的过程也会影响配合物生
光化学反应
在光照条件下进行的化学反应称为光化学反应,这类反应中光照可 以提供反应所需的能量,从而影响反应的平衡。
光照强度的影响
光照强度可以影响光化学反应的速率和平衡常数,一般来说,光照 强度越强,反应速率越快,平衡常数也可能发生改变。
表面效应
01
表面效应的定义
表面效应是指发生在固体表面或液体表面的化学反应,这类反应受到表
配位平衡常数
配位平衡常数是衡量配合物生成 与解离平衡的重要物理量,其大 小可以反映配合物生成与解离平
衡的移动情况。
05
实验探究:影响化学平 衡的因素
实验设计
01
02
03
设计思路
通过控制变量法,探究温 度、浓度、压强等因素对 化学平衡的影响。
实验原理
利用勒夏特列原理,分析 各因素对化学平衡的影响 。
通过实验可以验证不同因素对沉淀溶 解平衡的影响,并得出相应的结论。
沉淀生成和溶解的过程是可逆的,当 条件改变时,平衡会向生成沉淀或溶 解沉淀的方向移动。
研究不足与展望
本研究仅初步探讨了影响化学平衡的因素,对于其他可能的影响因素尚 未进行深入探讨。
在实验过程中,可能存在一些误差和干扰因素,对实验结果产生一定的 影响。
电极电势是衡量氧化还原反应进行程度的物理量,电极电势的变化 可以反映氧化还原平衡的移动情况。
催化剂的作用
催化剂能够加速氧化还原反应的速率,从而影响氧化还原平衡的移 动。
配合物生成与解离平衡的移动
配合物的生成
金属离子与配体结合生成配合物 的过程会影响配合物生成与解离
平衡的移动。
配合物的解离
配合物在溶液中解离成金属离子 和配体的过程也会影响配合物生
光化学反应
在光照条件下进行的化学反应称为光化学反应,这类反应中光照可 以提供反应所需的能量,从而影响反应的平衡。
光照强度的影响
光照强度可以影响光化学反应的速率和平衡常数,一般来说,光照 强度越强,反应速率越快,平衡常数也可能发生改变。
表面效应
01
表面效应的定义
表面效应是指发生在固体表面或液体表面的化学反应,这类反应受到表
《配位平衡教学》课件

登录
课件界面:熟悉课件界面,了 解各个功能模块的位置和作用
课件操作流程
打开PPT课件,选择“开 始”选项卡
点击“新建幻灯片”按钮, 选择“空白”或“标题和 内容”模板
在幻灯片中输入标题和内 容,使用“插入”选项卡 添加图片、表格等元素
使用“动画”选项卡为幻 灯片添加动画效果
点击“幻灯片放映”按钮, 预览课件效果
实验目的:了解配位平衡的 基本原理和实验方法
实验步骤:配制溶液、滴定、 记录数据、分析结果等
实验注意事项:注意安全、 准确操作、认真记录等
配位平衡应用实例
化学实验:配位 平衡在化学反应 中的应用
生物医学:配位平 衡在药物设计和生 物医学中的应用
环境科学:配位 平衡在环境污染 治理中的应用
材料科学:配位平 衡在新材料设计和 合成中的应用
配位平衡教学 PPT课件内容
配位平衡基本概念
配位平衡:指在化学反应中,一种物质与另一种物质形成稳定的化学键的过程 配位平衡常数:描述配位平衡状态的常数,用于衡量配位平衡的程度 配位平衡反应:指在配位平衡状态下,一种物质与另一种物质形成稳定的化学键的反应 配位平衡原理:指在配位平衡状态下,一种物质与另一种物质形成稳定的化学键的原理
教学方法效果评估
学生参与度:观察学生在课堂上的参与程度,如回答问题、讨论等 学习成果:通过测试、作业等方式评估学生的学习成果 教学方法适用性:根据学生的反馈和教师的观察,评估教学方法的适用性
教学方法创新性:评估教学方法的创新性和独特性,是否对学生的学习产生积极影响
教学方法改进建议
采用互动式教学, 增加学生参与度
感谢您的观看
汇报人:
在播放过 程中,可 以通过点 击“结束” 按钮来结 束播放
课件界面:熟悉课件界面,了 解各个功能模块的位置和作用
课件操作流程
打开PPT课件,选择“开 始”选项卡
点击“新建幻灯片”按钮, 选择“空白”或“标题和 内容”模板
在幻灯片中输入标题和内 容,使用“插入”选项卡 添加图片、表格等元素
使用“动画”选项卡为幻 灯片添加动画效果
点击“幻灯片放映”按钮, 预览课件效果
实验目的:了解配位平衡的 基本原理和实验方法
实验步骤:配制溶液、滴定、 记录数据、分析结果等
实验注意事项:注意安全、 准确操作、认真记录等
配位平衡应用实例
化学实验:配位 平衡在化学反应 中的应用
生物医学:配位平 衡在药物设计和生 物医学中的应用
环境科学:配位 平衡在环境污染 治理中的应用
材料科学:配位平 衡在新材料设计和 合成中的应用
配位平衡教学 PPT课件内容
配位平衡基本概念
配位平衡:指在化学反应中,一种物质与另一种物质形成稳定的化学键的过程 配位平衡常数:描述配位平衡状态的常数,用于衡量配位平衡的程度 配位平衡反应:指在配位平衡状态下,一种物质与另一种物质形成稳定的化学键的反应 配位平衡原理:指在配位平衡状态下,一种物质与另一种物质形成稳定的化学键的原理
教学方法效果评估
学生参与度:观察学生在课堂上的参与程度,如回答问题、讨论等 学习成果:通过测试、作业等方式评估学生的学习成果 教学方法适用性:根据学生的反馈和教师的观察,评估教学方法的适用性
教学方法创新性:评估教学方法的创新性和独特性,是否对学生的学习产生积极影响
教学方法改进建议
采用互动式教学, 增加学生参与度
感谢您的观看
汇报人:
在播放过 程中,可 以通过点 击“结束” 按钮来结 束播放
配位平衡及其影响因素

休息
K
不稳1 =
[Cu(NH3)32+][NH3]
2+]
=1/K
稳4
= 10-2.18
2011-6-3
8
7.2.1配位平衡与平衡常数 配位平衡与平衡常数
K
意义及作用: 稳意义及作用
衡量稳定性高低; ①衡量稳定性高低 比较同型配合物稳定性相对高低; ②比较同型配合物稳定性相对高低 平衡计算. ③平衡计算 2.application of stability constant: (1)平衡组成的计算 平衡组成的计算: 平衡组成的计算 室温下,0.010mol的AgNO3 (s)溶于 溶于1.0L 0.030 例1:室温下 室温下 的 溶于 设体积不变),计算该溶液中游 mol·L-1的NH3·H2O中(设体积不变 计算该溶液中游 中 设体积不变 离Ag+、NH3和[Ag(NH3)2]+ 的浓度. 的浓度 查得:K 解: 查得 稳 = 107.40.
休息
2011-6-3
11
7.2.1配位平衡与平衡常数 配位平衡与定性大的 配离子转化 通常是稳定性小的向稳定性大的 转化.转化的完全程度可用转化反应常数衡量 转化的完全程度可用转化反应常数衡量. 转化 转化的完全程度可用转化反应常数衡量 如:[Ag(NH3)2]+ + 2CN- ⇌ [Ag(CN)2]- + 2NH3 K = [Ag(CN)2-][NH3]2 [Ag+] [Ag(NH3)2+][CN-]2 [Ag+] = K 稳([Ag(CN)2]-)/K 稳([Ag(NH3)2]+)
2011-6-3
2
7.2.1配位平衡与平衡常数 配位平衡与平衡常数
1.dissociation equilibrium and stability constant: 配离子在水溶液中具一定的稳定性 稳定性. 配离子在水溶液中具一定的稳定性 配合物在水中的形成一般也是逐级进行的: 配合物在水中的形成一般也是逐级进行的 的形成: 如:[Cu(NH3)4]2+的形成 [Cu(NH3)4]2+ 形成 2+ + NH ⇌ [Cu(NH )]2+ Cu 3 3 [Cu(NH3)]2+ + NH3 ⇌ [Cu(NH3)2]2+ [Cu(NH3)2]2+ + NH3 ⇌ [Cu(NH3)3]2+ [Cu(NH3)3]2+ + NH3 ⇌ [Cu(NH3)4]2+ 配离子在水溶液中形成达到平衡时的平衡 常数又称配离子的稳定常数 稳定常数. 常数又称配离子的稳定常数
K
不稳1 =
[Cu(NH3)32+][NH3]
2+]
=1/K
稳4
= 10-2.18
2011-6-3
8
7.2.1配位平衡与平衡常数 配位平衡与平衡常数
K
意义及作用: 稳意义及作用
衡量稳定性高低; ①衡量稳定性高低 比较同型配合物稳定性相对高低; ②比较同型配合物稳定性相对高低 平衡计算. ③平衡计算 2.application of stability constant: (1)平衡组成的计算 平衡组成的计算: 平衡组成的计算 室温下,0.010mol的AgNO3 (s)溶于 溶于1.0L 0.030 例1:室温下 室温下 的 溶于 设体积不变),计算该溶液中游 mol·L-1的NH3·H2O中(设体积不变 计算该溶液中游 中 设体积不变 离Ag+、NH3和[Ag(NH3)2]+ 的浓度. 的浓度 查得:K 解: 查得 稳 = 107.40.
休息
2011-6-3
11
7.2.1配位平衡与平衡常数 配位平衡与定性大的 配离子转化 通常是稳定性小的向稳定性大的 转化.转化的完全程度可用转化反应常数衡量 转化的完全程度可用转化反应常数衡量. 转化 转化的完全程度可用转化反应常数衡量 如:[Ag(NH3)2]+ + 2CN- ⇌ [Ag(CN)2]- + 2NH3 K = [Ag(CN)2-][NH3]2 [Ag+] [Ag(NH3)2+][CN-]2 [Ag+] = K 稳([Ag(CN)2]-)/K 稳([Ag(NH3)2]+)
2011-6-3
2
7.2.1配位平衡与平衡常数 配位平衡与平衡常数
1.dissociation equilibrium and stability constant: 配离子在水溶液中具一定的稳定性 稳定性. 配离子在水溶液中具一定的稳定性 配合物在水中的形成一般也是逐级进行的: 配合物在水中的形成一般也是逐级进行的 的形成: 如:[Cu(NH3)4]2+的形成 [Cu(NH3)4]2+ 形成 2+ + NH ⇌ [Cu(NH )]2+ Cu 3 3 [Cu(NH3)]2+ + NH3 ⇌ [Cu(NH3)2]2+ [Cu(NH3)2]2+ + NH3 ⇌ [Cu(NH3)3]2+ [Cu(NH3)3]2+ + NH3 ⇌ [Cu(NH3)4]2+ 配离子在水溶液中形成达到平衡时的平衡 常数又称配离子的稳定常数 稳定常数. 常数又称配离子的稳定常数
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
7.2配位平衡及其影响因素
7.2.1配位平衡与稳定常数 7.2.2影响配位平衡的主要因素
05.05.2020
上节 返回章 下节
1
7.2.1配位平衡与平衡常数
1.dissociation equilibrium and stability constant:
配离子在水溶液中具一定的稳定性.
配合物在水中的形成一般也是逐级进行的:
[Ag(S2O3)2]3- K稳 = 1013.5
[Ag(NH3)2]+ + 2S2O32 - ⇌ [Ag(S2O3)2]3- + 2NH3
反应前c 0.10
1.0
0
1.0
平衡时c x
0.80+2x 0. 10-x 1.2-2x
05.05.2020
休息
12
7.2.1配位平衡与平衡常数
K = K稳([Ag(S2O3)2]3-)/K稳([Ag(NH3)2]+) 1013.5/107.40 = {(0.10 - x)(1.2 - 2x)2}/x(0.80 + 2x)2 解得: x = 1.8 10-7 = [Ag(NH3)2+];
Ag+ + 2NH3 ⇌ 反应前c/mol·L-1 0.010 0.030
平衡时c/mol·L-1 x 0.010+2x
K稳=
[Ag(NH3)2+] = 107.40 [Ag+][NH3]2
= (0.010 - x)/x(0.010 + 2x)2
解得: x = 4.010-6 mol·L-1 = [Ag+]
[Ag(CN)2]- K稳 = 1021.1 同型配离子,一般是稳定性大的配离子先形成. 故[Ag(CN)2]-会先形成.
05.05.2020
休息
10
7.2.1配位平衡与平衡常数
配离子转化,通常是稳定性小的向稳定性大的 转化.转化的完全程度可用转化反应常数衡量. 如:[Ag(NH3)2]+ + 2CN- ⇌ [Ag(CN)2]- + 2NH3
[Ag(NH3)2]+ 0.0
0.010-x
[NH3] = [Ag(NH3)2+]≈0.010 mol·L-1
05.05.2020
休息
9
7.2.1配位平衡与平衡常数
(2)判断两种配离子间转化的可能性: 例2:在含有NH3和CN-的溶液中加入Ag+,可能会形 成[Ag(NH3)2]+和[Ag(CN)2]-. 试问哪种配离子先 形成? 若在[Ag(NH3)2]+溶液中加入KCN,问否能 发生配离子的转化? 解: 由附录可查得: [Ag(NH3)2]+ K稳 = 107.40
1 = K稳1
2 = K稳1 K稳2
3 = K稳1 K稳2 K稳3
4 =
K稳1
K稳2
K稳3
K稳4
=
K Байду номын сангаас(总)
05.05.2020
休息
7
7.2.1配位平衡与平衡常数
K稳意义及作用: ①衡量稳定性高低; ②比较同型配合物稳定性相对高低; ③平衡计算.
2.application of stability constant:
再如[Cu(NH3)4]2+的第四级形成平衡: [Cu(NH3)3]2+ + NH3 ⇌ [Cu(NH3)4]2+
K 稳4
=
[Cu(NH3)42+] [Cu(NH3)32+] [NH3] =102.18
另2级形成常数分别为:K稳2 = 103.55;K稳3 = 102.90
05.05.2020
休息
4
[NH3] ≈ 1.2 mol·L-1 (3)判断是否有沉淀产生: 例4:在1L含1.0 mol·L-1游离NH3及1.010-3 mol·L-1 [Cu(NH3)4]2+溶液中 加入1.010-3mol Na2S,问是否 有CuS沉淀生成? 若是加入NaOH 1.010-3 mol,问 是否有Cu(OH)2沉淀?
如:[Cu(NH3)4]2+的形成: Cu2+ + NH3 ⇌ [Cu(NH3)]2+ [Cu(NH3)]2+ + NH3 ⇌ [Cu(NH3)2]2+ [Cu(NH3)2]2+ + NH3 ⇌ [Cu(NH3)3]2+ [Cu(NH3)3]2+ + NH3 ⇌ [Cu(NH3)4]2+
[Cu(NH3)4]2+ 形成
(1)平衡组成的计算: 例1:室温下,0.010mol的AgNO3 (s)溶于1.0L 0.030 mol·L-1的NH3·H2O中(设体积不变),计算该溶液中游 离Ag+、NH3和[Ag(NH3)2]+ 的浓度. 解: 查得:K稳 = 107.40.
05.05.2020
休息
8
7.2.1配位平衡与平衡常数
7.2.1配位平衡与平衡常数
K稳1、K稳2 称为逐级形成常数或逐级稳定 常数(或分步稳定常数).
一般来说K稳1 >K稳2 > K稳3 > 逐级稳定常数随配位数的增加而减小. 配离子在水溶液中也会发生解离. 如:[Cu(NH3)4]2+的第一级解离平衡: [Cu(NH3)4]2+ ⇌ [Cu(NH3)3]2+ + NH3 配离子在水溶液中解离达平衡时的平衡常数称 为不稳定常数 .
K = [Ag(CN)2-][NH3]2 [Ag+] [Ag(NH3)2+][CN-]2 [Ag+]
= K稳([Ag(CN)2]-)/K稳([Ag(NH3)2]+) = 1021.1 / 107.40 = 1013.7 能发生配离子的转化.
05.05.2020
休息
11
7.2.1配位平衡与平衡常数
例3:25℃时[Ag(NH3)2]+溶液中c([Ag(NH3)2]+) = 0.10 mol·L-1, c(NH3) = 1.0 mol·L-1. 现加入Na2S2O3 , 使 c(S2O32-) = 1.0 mol·L-1.计算平衡时溶液中NH3、 [Ag(NH3)2]+的浓度. 解: 由附录可查得: [Ag(NH3)2]+ K稳 = 107.40
配离子在水溶液中形成达到平衡时的平衡
常数又称配离子的稳定常数.
05.05.2020
休息
2
7.2.1配位平衡与平衡常数
配离子的稳定性:
7.2.1配位平衡与平衡常数
如[Cu(NH3)4]2+的第一级形成平衡: Cu2+ + NH3 ⇌ [Cu(NH3)]2+
K 稳1
=
[Cu(NH3)2+] =104.27 [Cu2+] [NH3]
05.05.2020
休息
5
7.2.1配位平衡与平衡常数
配离子在水溶液中的解离:
7.2.1配位平衡与平衡常数
K 不稳1
=
[Cu(NH3)32+][NH3] [Cu(NH3)42+]
累积稳定常数:
=1/K稳4
= 10-2.18
将逐级稳定常数依次相乘所得到的稳定常数.
一般用i表示.
对[Cu(NH3)4]2+:
7.2.1配位平衡与稳定常数 7.2.2影响配位平衡的主要因素
05.05.2020
上节 返回章 下节
1
7.2.1配位平衡与平衡常数
1.dissociation equilibrium and stability constant:
配离子在水溶液中具一定的稳定性.
配合物在水中的形成一般也是逐级进行的:
[Ag(S2O3)2]3- K稳 = 1013.5
[Ag(NH3)2]+ + 2S2O32 - ⇌ [Ag(S2O3)2]3- + 2NH3
反应前c 0.10
1.0
0
1.0
平衡时c x
0.80+2x 0. 10-x 1.2-2x
05.05.2020
休息
12
7.2.1配位平衡与平衡常数
K = K稳([Ag(S2O3)2]3-)/K稳([Ag(NH3)2]+) 1013.5/107.40 = {(0.10 - x)(1.2 - 2x)2}/x(0.80 + 2x)2 解得: x = 1.8 10-7 = [Ag(NH3)2+];
Ag+ + 2NH3 ⇌ 反应前c/mol·L-1 0.010 0.030
平衡时c/mol·L-1 x 0.010+2x
K稳=
[Ag(NH3)2+] = 107.40 [Ag+][NH3]2
= (0.010 - x)/x(0.010 + 2x)2
解得: x = 4.010-6 mol·L-1 = [Ag+]
[Ag(CN)2]- K稳 = 1021.1 同型配离子,一般是稳定性大的配离子先形成. 故[Ag(CN)2]-会先形成.
05.05.2020
休息
10
7.2.1配位平衡与平衡常数
配离子转化,通常是稳定性小的向稳定性大的 转化.转化的完全程度可用转化反应常数衡量. 如:[Ag(NH3)2]+ + 2CN- ⇌ [Ag(CN)2]- + 2NH3
[Ag(NH3)2]+ 0.0
0.010-x
[NH3] = [Ag(NH3)2+]≈0.010 mol·L-1
05.05.2020
休息
9
7.2.1配位平衡与平衡常数
(2)判断两种配离子间转化的可能性: 例2:在含有NH3和CN-的溶液中加入Ag+,可能会形 成[Ag(NH3)2]+和[Ag(CN)2]-. 试问哪种配离子先 形成? 若在[Ag(NH3)2]+溶液中加入KCN,问否能 发生配离子的转化? 解: 由附录可查得: [Ag(NH3)2]+ K稳 = 107.40
1 = K稳1
2 = K稳1 K稳2
3 = K稳1 K稳2 K稳3
4 =
K稳1
K稳2
K稳3
K稳4
=
K Байду номын сангаас(总)
05.05.2020
休息
7
7.2.1配位平衡与平衡常数
K稳意义及作用: ①衡量稳定性高低; ②比较同型配合物稳定性相对高低; ③平衡计算.
2.application of stability constant:
再如[Cu(NH3)4]2+的第四级形成平衡: [Cu(NH3)3]2+ + NH3 ⇌ [Cu(NH3)4]2+
K 稳4
=
[Cu(NH3)42+] [Cu(NH3)32+] [NH3] =102.18
另2级形成常数分别为:K稳2 = 103.55;K稳3 = 102.90
05.05.2020
休息
4
[NH3] ≈ 1.2 mol·L-1 (3)判断是否有沉淀产生: 例4:在1L含1.0 mol·L-1游离NH3及1.010-3 mol·L-1 [Cu(NH3)4]2+溶液中 加入1.010-3mol Na2S,问是否 有CuS沉淀生成? 若是加入NaOH 1.010-3 mol,问 是否有Cu(OH)2沉淀?
如:[Cu(NH3)4]2+的形成: Cu2+ + NH3 ⇌ [Cu(NH3)]2+ [Cu(NH3)]2+ + NH3 ⇌ [Cu(NH3)2]2+ [Cu(NH3)2]2+ + NH3 ⇌ [Cu(NH3)3]2+ [Cu(NH3)3]2+ + NH3 ⇌ [Cu(NH3)4]2+
[Cu(NH3)4]2+ 形成
(1)平衡组成的计算: 例1:室温下,0.010mol的AgNO3 (s)溶于1.0L 0.030 mol·L-1的NH3·H2O中(设体积不变),计算该溶液中游 离Ag+、NH3和[Ag(NH3)2]+ 的浓度. 解: 查得:K稳 = 107.40.
05.05.2020
休息
8
7.2.1配位平衡与平衡常数
7.2.1配位平衡与平衡常数
K稳1、K稳2 称为逐级形成常数或逐级稳定 常数(或分步稳定常数).
一般来说K稳1 >K稳2 > K稳3 > 逐级稳定常数随配位数的增加而减小. 配离子在水溶液中也会发生解离. 如:[Cu(NH3)4]2+的第一级解离平衡: [Cu(NH3)4]2+ ⇌ [Cu(NH3)3]2+ + NH3 配离子在水溶液中解离达平衡时的平衡常数称 为不稳定常数 .
K = [Ag(CN)2-][NH3]2 [Ag+] [Ag(NH3)2+][CN-]2 [Ag+]
= K稳([Ag(CN)2]-)/K稳([Ag(NH3)2]+) = 1021.1 / 107.40 = 1013.7 能发生配离子的转化.
05.05.2020
休息
11
7.2.1配位平衡与平衡常数
例3:25℃时[Ag(NH3)2]+溶液中c([Ag(NH3)2]+) = 0.10 mol·L-1, c(NH3) = 1.0 mol·L-1. 现加入Na2S2O3 , 使 c(S2O32-) = 1.0 mol·L-1.计算平衡时溶液中NH3、 [Ag(NH3)2]+的浓度. 解: 由附录可查得: [Ag(NH3)2]+ K稳 = 107.40
配离子在水溶液中形成达到平衡时的平衡
常数又称配离子的稳定常数.
05.05.2020
休息
2
7.2.1配位平衡与平衡常数
配离子的稳定性:
7.2.1配位平衡与平衡常数
如[Cu(NH3)4]2+的第一级形成平衡: Cu2+ + NH3 ⇌ [Cu(NH3)]2+
K 稳1
=
[Cu(NH3)2+] =104.27 [Cu2+] [NH3]
05.05.2020
休息
5
7.2.1配位平衡与平衡常数
配离子在水溶液中的解离:
7.2.1配位平衡与平衡常数
K 不稳1
=
[Cu(NH3)32+][NH3] [Cu(NH3)42+]
累积稳定常数:
=1/K稳4
= 10-2.18
将逐级稳定常数依次相乘所得到的稳定常数.
一般用i表示.
对[Cu(NH3)4]2+:
