流-固相非催化反应动力学模型研究共63页文档
合集下载
第6章非均相流固反应器

❖固定床反应器: 固体催化剂颗粒 堆积起来静止不 动,反应气体自 上而下流过床层;
3
❖流化床反应器:
流化床
固体催化剂颗粒被
自下而上流动的气 体反应物夹带而处 于剧烈运动的状态。
4
绝热式固定床反应器
① 结构简单 ② 高空速 ③ 很少催化剂损耗 ④ 很小气固返混 ⑤ 较长的扩散时间及距离 ⑥ 高床层压降 ⑦ 床内取热供热困难 ⑧ 催化剂取出更新困难
① 外扩散 ② 内扩散 ③ 吸附 ④ 表面反应 ⑤ 脱附 ⑥ 内扩散 ⑦ 外扩散
12
外扩散、内扩散是物理过程; 吸附、脱附和表面反应则是化学过程,又称 为动力学过程或表面过程。 以上七个步骤是前后串联的。
外扩散 内扩散 吸附表面反应脱附 内扩散 外扩散 表面过程
13
七个步骤中,速率特别慢的一步称为控制 步骤。该速率决定实际反应所达到的速率。 控制步骤是一个扩散过程,则称为扩散控 制,又称传质控制;控制步骤是吸附、表 面反应或脱附,则称为动力学控制。动力 学控制又可分为吸附控制、表面反应控制 和脱附控制。
第6章 非均相流固催化反应器
1
6.1 概述
流固催化反应器是气相或/和液相反应物借助 于固相催化剂进行反应的设备,包括气-固、 气-液-固、液-固三类催化反应器。
气固相催化反应器可分两大类:固定床反应 器和流化床反应器。
由于这两类反应器中固体催化剂颗粒运动状 态不同,其反应性能也有显著差别。
本章主要叙述气-固相反应的概念、特征及反应器计算 2
③ 反应器操作弹性与容积生产能力较大。
7
相对于流化床反应器,固定床反应器 缺点:
① 催化剂颗粒较大,有效系数较低; ② 催化剂床层传热系数较小,容易产生局
部过热; ③ 催化剂的更换费事,不适于容易失活的
固相反应动力学

dG k n F (1 G ) n k n A(1 G ) 2 / 3 (1 G ) n dt
积分并考虑到初始条件:t = 0,G = 0,得 :
G
dG K 0dt 2/3 (1 G ) 0 0
t
F0(G) = 1-(1-G) 2/3 = K0t 球形或立方体颗粒: F0(G) = 1-(1-G) 1/3 = K0t 园柱形颗粒: F0(G) = 1-(1-G) 1/2 = K01t 平板状颗粒: F0(G) = G= K02t
V R0 ( R0 x)3 x 3 1 (1 ) 3 V1 R0 R0
3
代入抛物线速度方程式得 x2= R02[1-(1-G)1/3]2=K4t F 5(G)=[1-(1-G) 1/3]2 = K4 /R。2 = K4 t
微分得:
dG (1 G) 2 / 3 K5 dt 1 (1 G)1/ 3
R0
R0—x = R0 (1—G)1/3 或 x = R0[1-(1-G)1/3]
相应于每个颗粒的反应表面积F’ 与转化程度G 的关系:
F’=A’(1—G)2/3 对于单位质量的物系, F=A(1—G)2/3
18 3 其中对于球形颗粒A = ,对于立方形A = 。 R0 R0
5.化学反应控制范围的动力学方程 将上式反应级数n代入数值,就可求出不同级数反 应的微积分形式: 1)零级反应n=0 d G/dt= K A(1-G)2/3 (1-G)0=K 0(1-G)2/3
图11 反应产物层增厚速率与x/R0关系
图12 金斯特林格方程与杨德方程之比较
表1 部分重要的固相反应动力学方程
控 制 范 围 界 面 化 学 反 应 控 制 扩 散 控 制 范 围 反应类别 动力学方翟的积分式 A值 对应于图 13 的曲线
积分并考虑到初始条件:t = 0,G = 0,得 :
G
dG K 0dt 2/3 (1 G ) 0 0
t
F0(G) = 1-(1-G) 2/3 = K0t 球形或立方体颗粒: F0(G) = 1-(1-G) 1/3 = K0t 园柱形颗粒: F0(G) = 1-(1-G) 1/2 = K01t 平板状颗粒: F0(G) = G= K02t
V R0 ( R0 x)3 x 3 1 (1 ) 3 V1 R0 R0
3
代入抛物线速度方程式得 x2= R02[1-(1-G)1/3]2=K4t F 5(G)=[1-(1-G) 1/3]2 = K4 /R。2 = K4 t
微分得:
dG (1 G) 2 / 3 K5 dt 1 (1 G)1/ 3
R0
R0—x = R0 (1—G)1/3 或 x = R0[1-(1-G)1/3]
相应于每个颗粒的反应表面积F’ 与转化程度G 的关系:
F’=A’(1—G)2/3 对于单位质量的物系, F=A(1—G)2/3
18 3 其中对于球形颗粒A = ,对于立方形A = 。 R0 R0
5.化学反应控制范围的动力学方程 将上式反应级数n代入数值,就可求出不同级数反 应的微积分形式: 1)零级反应n=0 d G/dt= K A(1-G)2/3 (1-G)0=K 0(1-G)2/3
图11 反应产物层增厚速率与x/R0关系
图12 金斯特林格方程与杨德方程之比较
表1 部分重要的固相反应动力学方程
控 制 范 围 界 面 化 学 反 应 控 制 扩 散 控 制 范 围 反应类别 动力学方翟的积分式 A值 对应于图 13 的曲线
第八章流固相非催化反应及反应器PPT课件

高等反应工程
第八章 流固相非催化反应及反应器
流体和固体发生多相反应且固体不是催化剂, 称这类反应为流固相非催化反应。
矿石的焙烧(冶金工业)、矿石的浸取(用酸或碱)、煤的气 化、煤的燃烧、离子交换过程、催化裂化中结焦催化剂的 再生、固体催化剂的还原再生等均属于流固相非催化反应。
与催化反应过程的重要区别:固体状态随反应进行而发生变化。
颗粒的外表面就立即反应完。 C. 随着反应进行,固体反应组分不断消耗,反应面不断沿颗
粒径向减小的方向收缩,未反应颗粒半径慢慢缩小。
2020/2/15
可编辑
6
两种情况:
1) 反应有新的固体产生,可 近似地认为反应前后固体颗 粒大小不变。
2) 反应无固体产物生成,只生 成流体,若无惰性固体物质存 在下,固体颗粒逐渐缩小。
2020/2/15
可编辑
9
B. 第二种情况:当固体颗粒内和产物层内流体的扩 散阻力可忽略不计时,即化学反应相对于扩散的速 率慢得多的情况,颗粒内外流体组分浓度相同,固 体物各处以相同的速率消耗。
颗粒动力学在忽略外扩散 阻力情况下为本征动力学控制。 也称为“真均相模型”。
此时,反应使固体颗粒各 处反应物的密度以相同的速率 减小,产物密度以相同的速率 增加,反应结束时固体反应物 同时在各处消失而生成产物。
整体反应区模型根据反应进程按动力学特征可分成两个情 况:
2020/2/15
可编辑
8
A. 第一种情况:整体反应区模型,动力学过程可分 为两个阶段。
1) 无固体完全反应层阶段: 此阶段整个颗粒均为反应区。 流体通过颗粒外层滞流膜Biblioteka , 在整个颗粒内扩散与反应同 时进行。
2) 形成固体完全反应层阶 段:由于流体浓度由颗粒外 到内逐步下降,反应速率受 此影响,最终颗粒外层先形 成产物层区,中间为反应区 域,和无流体存在的固体反 应物核心区。
第八章 流固相非催化反应及反应器
流体和固体发生多相反应且固体不是催化剂, 称这类反应为流固相非催化反应。
矿石的焙烧(冶金工业)、矿石的浸取(用酸或碱)、煤的气 化、煤的燃烧、离子交换过程、催化裂化中结焦催化剂的 再生、固体催化剂的还原再生等均属于流固相非催化反应。
与催化反应过程的重要区别:固体状态随反应进行而发生变化。
颗粒的外表面就立即反应完。 C. 随着反应进行,固体反应组分不断消耗,反应面不断沿颗
粒径向减小的方向收缩,未反应颗粒半径慢慢缩小。
2020/2/15
可编辑
6
两种情况:
1) 反应有新的固体产生,可 近似地认为反应前后固体颗 粒大小不变。
2) 反应无固体产物生成,只生 成流体,若无惰性固体物质存 在下,固体颗粒逐渐缩小。
2020/2/15
可编辑
9
B. 第二种情况:当固体颗粒内和产物层内流体的扩 散阻力可忽略不计时,即化学反应相对于扩散的速 率慢得多的情况,颗粒内外流体组分浓度相同,固 体物各处以相同的速率消耗。
颗粒动力学在忽略外扩散 阻力情况下为本征动力学控制。 也称为“真均相模型”。
此时,反应使固体颗粒各 处反应物的密度以相同的速率 减小,产物密度以相同的速率 增加,反应结束时固体反应物 同时在各处消失而生成产物。
整体反应区模型根据反应进程按动力学特征可分成两个情 况:
2020/2/15
可编辑
8
A. 第一种情况:整体反应区模型,动力学过程可分 为两个阶段。
1) 无固体完全反应层阶段: 此阶段整个颗粒均为反应区。 流体通过颗粒外层滞流膜Biblioteka , 在整个颗粒内扩散与反应同 时进行。
2) 形成固体完全反应层阶 段:由于流体浓度由颗粒外 到内逐步下降,反应速率受 此影响,最终颗粒外层先形 成产物层区,中间为反应区 域,和无流体存在的固体反 应物核心区。
固相反应动力学

dtdgdtdgdtdgdtdg图11反应产物层增厚速率与xr关系图12金斯特林格方程与杨德方程之比较反应类别动力学方翟的积分式对应于图13的曲线零级反应对于球形颗粒f0g1一1g13k0t02063tt0502063零级反应对于圆柱形颗粒f1g1一1g12k1t02929tt0502929零级反应对于乎板试样f2gk2t05000tt0505000一级反应球形颗粒f3gln1gk3t06931tt0506931抛物线速度方程干板试样f4gk4t02500tt0502500对圆柱形试样f7g1gln1ggk7t01534tt050
1/2
0.2063 0.2929 0.5000 0.6931 0.2500
7 6 5 9 1 2 3 4
零级反应(对于乎板试样) 一级反应(球形颗粒)
抛物线速度方程(干板试样)
对圆柱形试样 杨德方程(球形试样)
金斯特林格方程(球形试样)
F7(G)= (1--G)ln(1-G)+G =K7t=0.1534(t/t0.5) 0:1534 F5(G)=[1 一(1--G)1/3]2=K5t=0.0426(t/t0.5) F6(G)=1 一 2/3G-(1--G)2/3=K6t=0.0367(t/t0.5) 0.0426 0.0367
V R0 ( R0 x)3 x 3 1 (1 ) 3 V1 R0 R0
3
代入抛物线速度方程式得 x2= R02[1-(1-G)1/3]2=K4t F 5(G)=[1-(1-G) 1/3]2 = K4 /R。2 = K4 t
微分得:
dG (1 G) 2 / 3 K5 dt 1 (1 G)1/ 3
‘ 4
实验验证: 图7示出的金属镍氧化时的增重曲线就是一个例证。
1/2
0.2063 0.2929 0.5000 0.6931 0.2500
7 6 5 9 1 2 3 4
零级反应(对于乎板试样) 一级反应(球形颗粒)
抛物线速度方程(干板试样)
对圆柱形试样 杨德方程(球形试样)
金斯特林格方程(球形试样)
F7(G)= (1--G)ln(1-G)+G =K7t=0.1534(t/t0.5) 0:1534 F5(G)=[1 一(1--G)1/3]2=K5t=0.0426(t/t0.5) F6(G)=1 一 2/3G-(1--G)2/3=K6t=0.0367(t/t0.5) 0.0426 0.0367
V R0 ( R0 x)3 x 3 1 (1 ) 3 V1 R0 R0
3
代入抛物线速度方程式得 x2= R02[1-(1-G)1/3]2=K4t F 5(G)=[1-(1-G) 1/3]2 = K4 /R。2 = K4 t
微分得:
dG (1 G) 2 / 3 K5 dt 1 (1 G)1/ 3
‘ 4
实验验证: 图7示出的金属镍氧化时的增重曲线就是一个例证。
固相反应动力学

1/2
0.2063 0.2929 0.5000 0.6931 0.2500
7 6 5 9 1 2 3 4
零级反应(对于乎板试样) 一级反应(球形颗粒)
抛物线速度方程(干板试样)
对圆柱形试样 杨德方程(球形试样)
金斯特林格方程(球形试样)
F7(G)= (1--G)ln(1-G)+G =K7t=0.1534(t/t0.5) 0:1534 F5(G)=[1 一(1--G)1/3]2=K5t=0.0426(t/t0.5) F6(G)=1 一 2/3G-(1--G)2/3=K6t=0.0367(t/t0.5) 0.0426 0.0367
dG k n F (1 G ) n k n A(1 G ) 2 / 3 (1 G ) n dt
积分并考虑到初始条件:t = 0,G = 0,得 :
G
dG K 0dt 2/3 (1 G ) 0 0
t
F0(G) = 1-(1-G) 2/3 = K0t 球形或立方体颗粒: F0(G) = 1-(1-G) 1/3 = K0t 园柱形颗粒: F0(G) = 1-(1-G) 1/2 = K01t 平板状颗粒: F0(G) = G= K02t
图11 反应产物层增厚速率与x/R0关系
图12 金斯特林格方程与杨德方程之比较
表1 部分重要的固相反应动力学方程
控 制 范 围 界 面 化 学 反 应 控 制 扩 散 控 制 范 围 反应类别 动力学方翟的积分式 A值 对应于图 13 的曲线
零级反应(对于球形颗粒)
零级反应(对于圆柱形颗粒)
F0(G)=1 一(1--G)1/3=K0t=0.2063(t/t0.5) F1(G)=1 一(1--G) =K1t=0.2929(t/t0.5) F2(G)= G) =K2t=0.5000(t/t0.5) F’3(G)=ln(1--G) =-K3t=0.6931(t/t0.5) F4(G)= G2=K4’t=0.2500(t/t0.5)
0.2063 0.2929 0.5000 0.6931 0.2500
7 6 5 9 1 2 3 4
零级反应(对于乎板试样) 一级反应(球形颗粒)
抛物线速度方程(干板试样)
对圆柱形试样 杨德方程(球形试样)
金斯特林格方程(球形试样)
F7(G)= (1--G)ln(1-G)+G =K7t=0.1534(t/t0.5) 0:1534 F5(G)=[1 一(1--G)1/3]2=K5t=0.0426(t/t0.5) F6(G)=1 一 2/3G-(1--G)2/3=K6t=0.0367(t/t0.5) 0.0426 0.0367
dG k n F (1 G ) n k n A(1 G ) 2 / 3 (1 G ) n dt
积分并考虑到初始条件:t = 0,G = 0,得 :
G
dG K 0dt 2/3 (1 G ) 0 0
t
F0(G) = 1-(1-G) 2/3 = K0t 球形或立方体颗粒: F0(G) = 1-(1-G) 1/3 = K0t 园柱形颗粒: F0(G) = 1-(1-G) 1/2 = K01t 平板状颗粒: F0(G) = G= K02t
图11 反应产物层增厚速率与x/R0关系
图12 金斯特林格方程与杨德方程之比较
表1 部分重要的固相反应动力学方程
控 制 范 围 界 面 化 学 反 应 控 制 扩 散 控 制 范 围 反应类别 动力学方翟的积分式 A值 对应于图 13 的曲线
零级反应(对于球形颗粒)
零级反应(对于圆柱形颗粒)
F0(G)=1 一(1--G)1/3=K0t=0.2063(t/t0.5) F1(G)=1 一(1--G) =K1t=0.2929(t/t0.5) F2(G)= G) =K2t=0.5000(t/t0.5) F’3(G)=ln(1--G) =-K3t=0.6931(t/t0.5) F4(G)= G2=K4’t=0.2500(t/t0.5)
第九章 非催化流(气)固相反应动力学

续降低。
图6.1 无孔颗粒上反应物的浓度分布
7
第二节 气固相反应步骤及固体颗粒中的反应物浓度分布
气固反应是在颗粒内的一个相当 宽的反应带中进行,整个颗粒沿 径向由反应带和尚未反应的内核 两部分组成。CA在颗粒内一直下 降到二者接触面为止,界面上CA 可视为零。
固体反应物浓度CS变化类似于气 体反应物浓度CA,但在颗粒内部 的变化方向相反。
排除外(或称气膜)扩散阻力的方法:固定其他条件,变更气体线速度直至某一线速,转 化率不再增大为止;反应一般要在高于此线速的工况下进行。
视研究的目的不同,实验可采用两种温度制度和颗粒粒度。
恒温温度可给出不同温度下的一束x-t热重曲线;程序升温可同时给出一宽温区下的x-t热重 曲线。
大粒度实验用于宏观动力学研究,小颗粒实验可消除内扩散阻力,用于微观反应动力学研 究。
图6.1 无孔颗粒上反应物的浓度分布
8
东南大学能源与环境学院
第二节 气固相反应步骤及固体颗粒中的反应物浓度分布
在颗粒中心及还没有来得及反 应的内核中,固体反应物浓度 CS保持为原始值CS0,而在反应 带中则沿径向由里向外浓度递 减,直到外表面浓度下降为 CSS 。 如有足够时间反应,CSS 趋近为 零,即颗粒最外层的固体反应 物已消耗殆尽,形成产物层, 产物层全部由固体产物B构成, 其中固体S浓度为零。
实验条件:热解工况中实验气体为99.999% 的高纯氮气,氮气流量为100mL/min;气化 工况实验气体为水蒸气与99.999%的高纯氮 气,反应温度由环境温度至950℃,并恒温 30min,升温速率20℃/min,水蒸气流量为 0.04g/min,氮气流量为40mL/min,水蒸气 浓度约55%。选用CaO(分析纯)或工业 NiO作催化剂(NiO含量23.6%,Al2O3为载 体)。
第三章 非均相反应ppt课件

p Vp AsA
p
pAs As
反应速度快,而且流体流速较高,过程阻 力取决于颗粒内部的传递。
η:内表面利用率、效率因子或有效因子
整理版课件
12
3.1气固催化反应过程的控制步骤 与速率方程
对于一级不可逆反应:
η=有内扩散影响时的实际反应速率/以颗粒外 表面反应条件按本征速率式计算的反应速率。
η表明内扩散 对化学反应的 影响程度
η <<1,内扩散影响大 η =1,无内扩散影响
η>1,温度影响
整理版课件
13
3.1气固3.催1气化固反催应化过反程应的过控程制的步控骤制与步速骤率 与方速程率方程
⑷当内外扩散影响均 无法忽略时,对于稳 态过程,依据物料平 衡,有:
rA=kGa(CAg-CAs)
一 级
不
可
逆
rA=ηkCAs
反
应
rA 1/kGaC A g1/k
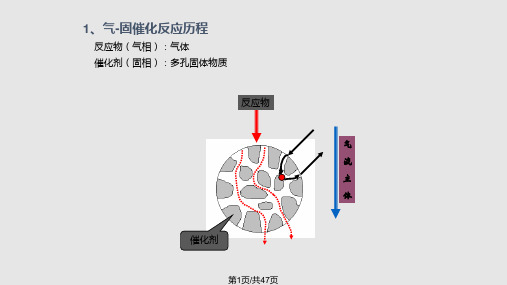
气固催化反应过程气相主体扩散至催化剂外表面
内扩散
反应物由催化剂外表面扩散至内表面
吸附 反应 脱附
内扩散 外扩散
反应物在催化剂内表面发生吸附
反应物在活性中心上进行化学反应生成产物
产物从催化剂内表面发生脱附
产物从催化剂内表面向外表面扩散
产物从催化剂外表面扩散至气相主体
整理版课件
7
3.1气固催化反应过程的控制步骤 与速率方程
总体归结为:
扩散
吸附
表面 反应
脱附
扩散
核心
包含扩散、吸脱附、表
面反应三大过程,即物
理和化学过程
整理版课件
8
3.1气固催化反应过程的控制步骤 与速率方程
层流区
第6章非均相流固反应器

❖固定床反应器: 固体催化剂颗粒 堆积起来静止不 动,反应气体自 上而下流过床层;
3
❖流化床反应器:
流化床
固体催化剂颗粒被
自下而上流动的气 体反应物夹带而处 于剧烈运动的状态。
4
绝热式固定床反应器
① 结构简单 ② 高空速 ③ 很少催化剂损耗 ④ 很小气固返混 ⑤ 较长的扩散时间及距离 ⑥ 高床层压降 ⑦ 床内取热供热困难 ⑧ 催化剂取出更新困难
在实际工业反应器中,等温反应器是不常有的, 所以,等温固定床反应器计算只能对事实上的 不等温反应器作一粗略估计。
35
例: rA' (1 xA ) kmol / hr kg
FA0 1kmol / hr xA 0.8
W ?
W
FA0
W dW 0 FA0
xA 0
dxA (rA' )
0.8 dxA 0 (1 xA )
W dW
xA
dxA
FA0 0 FA0 0 (rA' )
34
W W dW xA dxA
FA0 0 FA0 0 (rA' ) • 只要有了反应速度(rA' ) f xA 的函数或者
(rA' ) ~xA的对应数值,就可以用积分法求得所 需的催化剂的重量,然后利用W S L B 关系,求得催化剂床层高度L。
• 幂数型速率方程的形式
(rA ) k ' pA pB
同一套动力学数 据可以处理成不 同的方程形式, 其精确程度也差 不多。
15
催化剂内的流动传递现象
混合与分散 平推流流动
扩散-反应传递现象
16
• 气体分子从颗粒为表面向微孔内部扩散 过程中有阻力,使微孔内外存在浓度梯 度。微孔内部反应物分压较低,表面吸 附量减小,活化分子浓度降低,反应速 率相应变小。因此在等温催化剂颗粒中, 微孔内部的催化活性常得不到充分发挥 和利用,使得以单位重量催化剂计算的 宏观反应速率比本征反应速率低。这两 种反应速率的比值称为有效系数,又称 内表面利用系数,以η表示: η=宏观反应速率/本征反应速率
化学反应工程第五章非均相反应动力学

在众多的反应过程中,按化工热力学的观点是能够进行 的,但由于反应速度极慢,即使进行较长时间的反应, 生成的产物量也很少,无法进行工业生产。
例如CO的变换反应:
CO+H2O(g)=CO2+H2 (5-1)
如果反应过程中有活性物质的参与,则该反应的历程变 为: 这样总反应式可以写成:
(5-2)
5.1.1 催化过程及特征
(5-22)
(5-23) (5-24) 相应的吸附等温方程为: (5-25)
5.2.3 表面化学反应
化学反应从一个体积空间被转移到一个面上,此时表示 反应组分组成的浓度或分压被覆盖率或空位率代替,反 应速率的规律是类似的,如下基元反应:
(5-11)
表面反应的正反应速率为: rS k S A B 逆反应的速率为: 表面反应速率:
Cu、Zn、Al CH3OH Ni CH4 Fe、Co CO+H2 Rh络合物 CH2OHCH2OH 烃类混合物
Ru
固体石蜡
图5-1 不同催化剂的产物
5.1.2 固体催化剂的组成
(1)活性组分 (2)载体 (3)助催化剂(促进剂) (4)抑制剂
5.1.2 固体催化剂的组成
表5-1 种类 活性炭 硅胶 SiO2-Al2O3(裂化用) 活性白土 活性Al2O3 一些常用载体的比表面积 种类 硅藻土 Al2O3-V2O5 Fe(合成氨用) 骨架镍 CuO,熔融Al2O3 比表面/(m2/g) 4~20 30~160 4~11 25~60 0.0026~0.30
K A p A (K B K S ) pB pR 1 K A p A K B pB
5.2.4 反应本征动力学
②吸附控制 本征速率为: 表面反应达平衡则: (5-42) (5-43)
例如CO的变换反应:
CO+H2O(g)=CO2+H2 (5-1)
如果反应过程中有活性物质的参与,则该反应的历程变 为: 这样总反应式可以写成:
(5-2)
5.1.1 催化过程及特征
(5-22)
(5-23) (5-24) 相应的吸附等温方程为: (5-25)
5.2.3 表面化学反应
化学反应从一个体积空间被转移到一个面上,此时表示 反应组分组成的浓度或分压被覆盖率或空位率代替,反 应速率的规律是类似的,如下基元反应:
(5-11)
表面反应的正反应速率为: rS k S A B 逆反应的速率为: 表面反应速率:
Cu、Zn、Al CH3OH Ni CH4 Fe、Co CO+H2 Rh络合物 CH2OHCH2OH 烃类混合物
Ru
固体石蜡
图5-1 不同催化剂的产物
5.1.2 固体催化剂的组成
(1)活性组分 (2)载体 (3)助催化剂(促进剂) (4)抑制剂
5.1.2 固体催化剂的组成
表5-1 种类 活性炭 硅胶 SiO2-Al2O3(裂化用) 活性白土 活性Al2O3 一些常用载体的比表面积 种类 硅藻土 Al2O3-V2O5 Fe(合成氨用) 骨架镍 CuO,熔融Al2O3 比表面/(m2/g) 4~20 30~160 4~11 25~60 0.0026~0.30
K A p A (K B K S ) pB pR 1 K A p A K B pB
5.2.4 反应本征动力学
②吸附控制 本征速率为: 表面反应达平衡则: (5-42) (5-43)
第五讲 非均相反应动力学

3)积炭(覆盖,堵塞孔)
2020/5/4
48
中毒均孔匀口中中毒毒::有有毒毒物物质质的的吸吸附附速速率率〈〉组组分分在在孔孔内内扩扩散散
失活因体系不同有很大差别 失活速率因子:
r
r0
2020/5/4
49
对于A→R的n级反应
反应速率
dC A dt
kCAn .
失活速率
d
dt
kd Cim . d
kd-—失活速率常数。 i-—是指与失活相联系的气相组分
2020/5/4
23
对于等分子反应: A→B
NB NA
0
D
1
1 DAB
1 (DK ) A
孔径颇大时 DK
D DAB
孔径甚小时
D DK
2020/5/4
24
有效扩散系数De
De
NRAT p
l
[
]
( yA )2 ( yA )1
De是一重要参数
微孔的截面积和长度不相同,为此,
用与扩散方向的颗粒长度l成某种比
1
M) 2
a是微孔半径
cm2 / s
对于圆筒形微孔
a 2Vg 2 p Sg Sgp
p — —孔隙率
p — —粒子密度
DK
19400
p Sgp
T M
cm2 / s
2020/5/4
22
3.当分子扩散与努森扩散同时存在时
综合扩散系数
D
1
(1 y A )
DAB
1 (DK ) A
1 NB
NA
♀
S 大时,tanhS
1,
3
S
, 扩散慢,浓度梯度大。
2020/5/4
48
中毒均孔匀口中中毒毒::有有毒毒物物质质的的吸吸附附速速率率〈〉组组分分在在孔孔内内扩扩散散
失活因体系不同有很大差别 失活速率因子:
r
r0
2020/5/4
49
对于A→R的n级反应
反应速率
dC A dt
kCAn .
失活速率
d
dt
kd Cim . d
kd-—失活速率常数。 i-—是指与失活相联系的气相组分
2020/5/4
23
对于等分子反应: A→B
NB NA
0
D
1
1 DAB
1 (DK ) A
孔径颇大时 DK
D DAB
孔径甚小时
D DK
2020/5/4
24
有效扩散系数De
De
NRAT p
l
[
]
( yA )2 ( yA )1
De是一重要参数
微孔的截面积和长度不相同,为此,
用与扩散方向的颗粒长度l成某种比
1
M) 2
a是微孔半径
cm2 / s
对于圆筒形微孔
a 2Vg 2 p Sg Sgp
p — —孔隙率
p — —粒子密度
DK
19400
p Sgp
T M
cm2 / s
2020/5/4
22
3.当分子扩散与努森扩散同时存在时
综合扩散系数
D
1
(1 y A )
DAB
1 (DK ) A
1 NB
NA
♀
S 大时,tanhS
1,
3
S
, 扩散慢,浓度梯度大。
化学反应工程 第9章 流固非催化反应动力学

B、反应表面由表及里不断向颗粒中心缩小; C、流体通过固相产物层到达反应界面与未反应的固相反 应,固相产物层不断向内扩展,未反应芯逐渐缩小,反应 界面也不断由外向内移动。
2021/4/3
2021/4/3
缩芯模型又有二种情况: ①颗粒大小不变,即有固相产物层存在; ②颗粒不断缩小,即无固相产物层,产物仅为流体。
气膜阻力》其他步骤的阻力,Y1Y2值很大, (18)变为
t*
1
Rc RS
Y1Y2 3
Rc RS
2
Rc RS
1
k 3kg
1
Rc RS
3
由式(15)及(20)可得
t
B RS k
3bM BkgcAg
1
Rc RS
3
当固相反应物 B 完全反应时,Rc 0, xB 1 时的完全反应时间为
固相产物层控制时,反应速率随有效扩散系数的增大和颗 粒尺寸的减小而增大。
2021/4/3
3 化学反应控制 如果气流速度很 高和固相产物层孔隙 率很大,此时化学反 应的阻力比其他步骤 大,就成为化学反应 控制,其浓度分布见 图5-8。
2021/4/3
cAg cAS cAc ,反应过程速率与固体产物层的存在无关,只 取决于气相反应物A与固相反应物B的反应速率,显然与反
而Y2很大,此时式(18)变为
t*
1
Rc RS
Y2 6
1
Rc RS
2
Rc RS
2
Y2 6
1 3
Rc RS
2
2
Rc RS
3
(24)
t
B RS2
6Deff bM BcAg
1 3
Rc RS
2021/4/3
2021/4/3
缩芯模型又有二种情况: ①颗粒大小不变,即有固相产物层存在; ②颗粒不断缩小,即无固相产物层,产物仅为流体。
气膜阻力》其他步骤的阻力,Y1Y2值很大, (18)变为
t*
1
Rc RS
Y1Y2 3
Rc RS
2
Rc RS
1
k 3kg
1
Rc RS
3
由式(15)及(20)可得
t
B RS k
3bM BkgcAg
1
Rc RS
3
当固相反应物 B 完全反应时,Rc 0, xB 1 时的完全反应时间为
固相产物层控制时,反应速率随有效扩散系数的增大和颗 粒尺寸的减小而增大。
2021/4/3
3 化学反应控制 如果气流速度很 高和固相产物层孔隙 率很大,此时化学反 应的阻力比其他步骤 大,就成为化学反应 控制,其浓度分布见 图5-8。
2021/4/3
cAg cAS cAc ,反应过程速率与固体产物层的存在无关,只 取决于气相反应物A与固相反应物B的反应速率,显然与反
而Y2很大,此时式(18)变为
t*
1
Rc RS
Y2 6
1
Rc RS
2
Rc RS
2
Y2 6
1 3
Rc RS
2
2
Rc RS
3
(24)
t
B RS2
6Deff bM BcAg
1 3
Rc RS
非均相反应动力学PPT课件
控制步骤的类型,写出该步骤的速率方程; (3)非控制步骤均达到平衡,如为吸附或脱附,则使用吸附等温式
;若为化学反应,则为化学反应平衡式; (4)将(2)中所写的速率方程式中各项表面浓度利用(3)式中的
各平衡关系式转换成气相分压或浓度的函数; (5)若为均匀吸附模型,则由(4)可得到最终能够实际使用的动力
真
m V骨
空隙率:堆密度倒数与假密度倒数之差。
V空 1 1
m 堆 假
孔容或比孔容:假密度倒数与真密度倒数之差。
Vg
V孔 m
1
假
1
真
孔隙率:
P
V孔 V孔 V骨
1
假 真
假Vg
0.4 ~ 0.6
第18页/共47页
Vg
平均孔径:
rPdV
;
rP
0
Vg
如缺乏数据(孔径分布数据),可以用下式近似计算:r P
实际上,由于孔径存在分布,孔内两种类型扩散同时存在。
扩散系数的求取(包括:分子扩散和努森扩散) 费克(Fick)定律:沿Z方向上的一维扩散,扩散通量N(kg or mol.s1.m-2)与浓度梯度(也叫扩散推动力)成正比, 其比例常数即为扩散系数D
第20页/共47页
A、分子扩散系数的求取:
以A、B两组分混合物为例,则DAB:
定 态 法
dx 0
dt
第3页/共47页
Return
2、吸附等温方程式
吸附温度恒定后,则吸附量取决于吸附压力。 等温吸附模型包括:
Langmuir模型 Temkin模型 Freundlich模型 BET模型
(1)Langmuir型: 四个基本假定: I)表面均匀; II)单分子层吸附; III)被吸附分子互不影响,也不影响别的分子的吸附; IV)具有相同的吸附机理。
;若为化学反应,则为化学反应平衡式; (4)将(2)中所写的速率方程式中各项表面浓度利用(3)式中的
各平衡关系式转换成气相分压或浓度的函数; (5)若为均匀吸附模型,则由(4)可得到最终能够实际使用的动力
真
m V骨
空隙率:堆密度倒数与假密度倒数之差。
V空 1 1
m 堆 假
孔容或比孔容:假密度倒数与真密度倒数之差。
Vg
V孔 m
1
假
1
真
孔隙率:
P
V孔 V孔 V骨
1
假 真
假Vg
0.4 ~ 0.6
第18页/共47页
Vg
平均孔径:
rPdV
;
rP
0
Vg
如缺乏数据(孔径分布数据),可以用下式近似计算:r P
实际上,由于孔径存在分布,孔内两种类型扩散同时存在。
扩散系数的求取(包括:分子扩散和努森扩散) 费克(Fick)定律:沿Z方向上的一维扩散,扩散通量N(kg or mol.s1.m-2)与浓度梯度(也叫扩散推动力)成正比, 其比例常数即为扩散系数D
第20页/共47页
A、分子扩散系数的求取:
以A、B两组分混合物为例,则DAB:
定 态 法
dx 0
dt
第3页/共47页
Return
2、吸附等温方程式
吸附温度恒定后,则吸附量取决于吸附压力。 等温吸附模型包括:
Langmuir模型 Temkin模型 Freundlich模型 BET模型
(1)Langmuir型: 四个基本假定: I)表面均匀; II)单分子层吸附; III)被吸附分子互不影响,也不影响别的分子的吸附; IV)具有相同的吸附机理。
固相反应动力学

6.实验验证
如何验证上述动力学是正确的?如果我们能够使扩散 阻力很小,这时扩散很快,反应为化学反应所控制。实 验上常采取降低反应物颗粒度,再加入助熔剂来使反应 处于化学动力学范围。如NaCO3:SiO2=1:1,进行固 相反应,其动力学是化学反应控制的一级反应。
三 扩散动力学范围
1.过程特点 扩散速度很慢,起控制作用,为整个固相反应中 速度最慢的一步。 在多数情况下,扩散速度往往起控制作用。
‘ 4
实验验证: 图7示出的金属镍氧化时的增重曲线就是一个例证。
局限性:
但是,由于采用的是平板模型,忽略了反应物间接触 面积随时间变化的因素,使方程的准确度和适用性都 受到局限。
图7 金属镍的氧化增重曲线
(2)杨德方程——球体模型 在材料生产中通常采用粉状物料作为原料,这时, 在反应过程中,颗粒间接触界面积是不断变化的。 为此,扬德在抛物线速度方程基础上采用了“球体 模型”导出了扩散控制的动力学关系。 A.扬德假设:
其中k5(c是常数,q是活化能,R是气体常数),也 称杨德速度常数。
C)实验验证
对于反应BaCO3 + SiO2→ BaSiO3+CO2的实测结 果示于图9。由图可见,随着反应温度的升高,反 应强度规律也提高了,但都很好地符合杨德方程。
0.016 [1-(1-G)1/3]2
0.012
890℃
870℃ 0.008 0.004 830℃
0
t dX K n dt n 0 (c X )
c (c X ) K nt n 1 n 1 (n 1)(c X ) c
n 1
n 1
或
1 1 1 n 1 K nt n 1 n 1 (c X ) c
流固相非催化反应

实验设备
实验设备是用来进行流固相非催化反应实验的关键设备,包括固定床反应器、流化床反应器、高温高压釜等。这些设备能够模拟实际工业生产中的反应条件,为研究流固相非催化反应提供支持。
Байду номын сангаас
反应动力学实验研究
流固相非催化反应的工程应用
03
工业废气处理
01
流固相非催化反应在工业废气处理中有广泛应用。通过使用特定的催化剂,可以促进废气中的有害成分分解,将其转化为无害的物质,实现废气的净化。
探索反应机理
流固相非催化反应在废弃物处理、大气污染控制等领域也有广泛应用,研究该反应有助于开发新型环保技术和设备。
环境保护
初期研究
流固相非催化反应的研究始于20世纪初,早期研究主要集中在简单的物理吸附和化学吸附过程。
快速发展
自20世纪70年代以来,随着化学工业和环保技术的发展,流固相非催化反应的研究和应用得到了快速发展。
发展新型应用领域
发展在环保领域的应用
流固相非催化反应可以实现环境友好的合成方法,未来可以进一步研究其在环保领域的应用,如合成环境友好材料、治理环境污染等。
探索在生物医药领域的应用
流固相非催化反应可以应用于生物医药领域,如合成药物、生物材料等,未来可以进一步探索其在生物医药领域的应用。
加强基础研究
流固相非催化反应的机理研究是进一步发展的基础,需要深入研究反应机理,探索反应过程中的化学键断裂与生成过程,揭示反应的本质。
工业废气处理
活性炭吸附
02
活性炭具有高吸附性能,可以有效地吸附废气中的有害物质。通过与流固相非催化反应相结合,可以进一步提高活性炭的吸附效果,提高废气处理的效率。
生物过滤
03
生物过滤是一种利用微生物降解有机污染物的技术。通过与流固相非催化反应相结合,可以加速污染物的降解过程,提高净化效果。
实验设备是用来进行流固相非催化反应实验的关键设备,包括固定床反应器、流化床反应器、高温高压釜等。这些设备能够模拟实际工业生产中的反应条件,为研究流固相非催化反应提供支持。
Байду номын сангаас
反应动力学实验研究
流固相非催化反应的工程应用
03
工业废气处理
01
流固相非催化反应在工业废气处理中有广泛应用。通过使用特定的催化剂,可以促进废气中的有害成分分解,将其转化为无害的物质,实现废气的净化。
探索反应机理
流固相非催化反应在废弃物处理、大气污染控制等领域也有广泛应用,研究该反应有助于开发新型环保技术和设备。
环境保护
初期研究
流固相非催化反应的研究始于20世纪初,早期研究主要集中在简单的物理吸附和化学吸附过程。
快速发展
自20世纪70年代以来,随着化学工业和环保技术的发展,流固相非催化反应的研究和应用得到了快速发展。
发展新型应用领域
发展在环保领域的应用
流固相非催化反应可以实现环境友好的合成方法,未来可以进一步研究其在环保领域的应用,如合成环境友好材料、治理环境污染等。
探索在生物医药领域的应用
流固相非催化反应可以应用于生物医药领域,如合成药物、生物材料等,未来可以进一步探索其在生物医药领域的应用。
加强基础研究
流固相非催化反应的机理研究是进一步发展的基础,需要深入研究反应机理,探索反应过程中的化学键断裂与生成过程,揭示反应的本质。
工业废气处理
活性炭吸附
02
活性炭具有高吸附性能,可以有效地吸附废气中的有害物质。通过与流固相非催化反应相结合,可以进一步提高活性炭的吸附效果,提高废气处理的效率。
生物过滤
03
生物过滤是一种利用微生物降解有机污染物的技术。通过与流固相非催化反应相结合,可以加速污染物的降解过程,提高净化效果。
流-固相非催化反应动力学模型研究

气+气→固+气
TiCl 4 +O2 TiO2 +2Cl 2
2. 液-固相非催化反应
固+液→固+气
2Ca5F(PO4 )3 +7H2SO4 +3H2O 3Ca(H2 PO4 )2 H2O+7CaSO4 +2HF
固+液→固+液+ 气
2Ca5F(PO4 )3 +5H2SO4 +10H2O 5CaSO4 2H2O+3H3PO4 +HF
2.第二阶段 1)A作外扩散,CAf→CAS; 2)A从颗粒外表面扩散通过“产物层”外壳到达反应区边 界Rm; 3)A进入反应区进行扩散―反应, “产物层”不断增厚,反应区逐渐 收缩,直至反应结束。
第一阶段:未形成固体产物层,反应区为整个颗粒; 第二阶段:形成固体产物层,且不断扩展;与此同时,反 应区则不断缩小。
流-固相非催化反应 动力学模型研究
目
第一节
录
流固相非催化反应的分类及特点
第二节
第三节 第四节 第五节
流固相非催化反应模型
粒径不变时缩芯模型的总体速率及控制 颗粒缩小时缩芯模型的总体速率 流—固相非催化反应器及其计算
概述
流–固相非催化反应简称流–固相反应,是一 类重要的化学反应。这类反应中有流体 ( 气体 或液体),有固体,可表示为: A(流体)+B(固体)→C(流体)+D(固体) 这是一个普遍式,实际反应按A、B、C、D 物相组合方式具有多种类型,但其中的固体不 是催化剂,而是反应物或者产物。
1. 外扩散速率、内扩散速率与表面反应速率
CAC
CAS
CAg
rA g
dnA - =外扩散速率=内扩散速率=化学反应速率 dt
固相反应动力学

V R0 ( R0 x)3 x 3 1 (1 ) 3 V1 R0 R0
3
代入抛物线速度方程式得 x2= R02[1-(1-G)1/3]2=K4t F 5(G)=[1-(1-G) 1/3]2 = K4 /R。2 = K4 t
微分得:
dG (1 G) 2 / 3 K5 dt 1 (1 G)1/ 3
讨论:
零级反应:n=0,
X = K0t
1 1 二级反应:n=2, K 2t c X c
或
X K 2t c(c X)
一级反应:n=1,可求得:
d (c x ) k1t cx cx ln k1t c d (c x ) dx cx 0
x
求解得: dG (1 G)1/ 3 (1 G)1/ 3 K6 Kr 1/ 3 dt 1 (1 G) 1 (1 G)1/ 3 F6(G)=1—2/3G—(1-G)2/3=K6t
许多试验研究表明,金斯特林格方程具有更好的普遍性。
杨德方程与金斯特林格方程之比较,得:
dG ( )r 1/ 3 K ( 1 G ) 1 / 3 dt r ( 1 G ) 2/3 dG K ( 1 G ) i ( )i dt
由于A 物质迁移量 dm 是比例于 sdx ,故
dm 1 DS dt x
dx K D dt x
积分得: F 4(G)= x2= 2K 4 ’Dt = K 4 t 上式即为抛物线速度方程的积分式。说明反应产物层厚度与时 间的平方根成比例。这是一个重要的基本关系,可以描述各种 物理或化学的控制过程并有一定的精确度。
R0
R0—x = R0 (1—G)1/3 或 x = R0[1-(1-G)1/3]
