细胞转染Cell Transfection_PPT幻灯片
合集下载
细胞转染PPT课件
蛋白转染
Adherent cell lines
3T3 L1 A549 BHK-21 CaSki CHO CV-1 HEK-293
60-80% 80% 30-40% 80-90% 80-90% 50% 45-55%
HeLa HepaRG MCF-7 MLE-15 NIH-3T3 RAW 264.7 Si Ha
• Release
第11页/共73页
技术原理
蛋白转染
PULSin™: cationic amphiphilic-based formulation
第12页/共73页
操作步骤
蛋白转染
For 24-well plate:
细胞融合度:70-80%
1 稀释蛋白:1µg of protein/100µl Hepes 2 加 4 µl PULSin™ 3 孵育 15 min
第3页/共73页
-
-
-
细胞转染难易比较
体外转染
Adherent > Suspension
Problem: Membrane
E.g.:
THP1, Jurkat…
Fast dividing cell > non dividing cell
Problem: Access to the nucleus
E.g.:
k562gapdh788thp1gapdh818sirna转染转染第32页共73页原代细胞的高效沉默24wellplatebrancheddnaassay20406080100120nmsirnaconcentrationsirnagapdhsirnamm20406080100120nmsirnaconcentrationsirnagapdhsirnamm96人原代肝实质细胞人原代纤维原细胞82sirna转染转染第33页共73页interferin优势低浓度sirna甚至pmol级别就能达到高效的基因沉默在反向操作转染中的效率高sirna转染转染第34页共73页sirna转染竞争对手lipofectamine2000invitrogenolgofectamineinvitrogenhiperfectqiagensilentfectbioradlargestsirnatransfectionmarketdangerousoutsiderhiperfectsirna转染转染第35页共73页nterferinvslipofectamine2000interferinlipofectamine2000sirna浓度nmsirna降低成本20100nmsirna40nm血清和抗生素不受血清和抗生素影响不能加入抗生素基因沉默效率90以上操作即用型简单需稀释复杂细胞毒性无细胞毒性细胞毒性大sirnareagentwell24well06pmol13ul1050pmol0515ul价格第36页共73页nterferinvsoligofectamineinterferinoligofectaminesirna浓度nmsirna100nmsirna血清和抗生素不受血清和抗生素影响不能加入抗生素基因沉默效率90以上一般操作即用型简单需稀释复杂细胞毒性无细胞毒性细胞毒性大sirnareagentwell24well06pmol13ul60pmol3ul价格第37页共73页nterferinvshiperfectsilentfectinterferinhiperfectsilentfectsirna浓度nmsirna5nmsirna10nmsirna细胞融合度305050805090基因沉默效率高见表见表见表细胞毒性无细胞毒性细胞毒性较小细胞毒性大sirnareagentwell24well06pmol84ng13ul375ng3ul价格
细胞转染技术 PPT

脂质体介导法(目前应用最广泛)
原理:阳离子脂质体试剂与DNA混合后,形成一 种稳定的脂质双层复合物,DNA被包在脂质体中 间,这种脂质双层复合物可直接加到培养的细胞 中,脂质体粘附到细胞表面并与细胞膜融合, DNA被释放到胞浆中。
【主要应用】:瞬时转染 稳定转染.
【特点】:使用方法简单,可携带大片段DNA, 通用于各种类型的裸露DNA或RNA,能转染 各种类型的细胞,没有免疫原性。虽在体外基 因转染中有很高的效率,但在体内,能被血清 清除,并在肺组织内累积,诱发强烈的抗炎反 应,导致高水平的毒性,很大程度上应用受限 制。
将细胞稀释到1000个细胞/mL ,每孔100μl加 入有培养基的24孔板,将每孔中的G418浓度稀释至0, 100, 200,300, 400,500, 600,700,800, 900, 1000,1100μg/ml等12个级别,选择出在 10~14天内使细胞全部死亡的最低G418浓度来进行 下一步的筛选试验。一般400-800 μg/ml左右。
最常见的载体上带有新霉素抗性基因neo, 所以筛选的时候用G418 。G418是目前获 得稳转最常用的试剂之一。
ห้องสมุดไป่ตู้
G418是一种氨基糖苷类抗生素,其结构与 新霉素,庆大霉素,卡那霉素相似,通过 影响干扰核糖体功能而阻断蛋白质合成, 对原核和真核细胞等产生毒素,包括细菌 ,酵母,植物和哺乳动物细胞,也包括原 生动物和蠕虫。
鉴定之后
一般经过4周左右的筛选,得到的阳性克隆都 比较稳定。但是外源基因如果没有整合到基因组中 的话,目的基因还是很容易丢失的。但是外源基因 整合到基因组中的概率太小了,而且是随机整合, 会导致表达的目的蛋白的量产生很大差异。随着培 养时间的延续,那些丢失了外源基因的细胞和很少 表达目的基因的细胞会占据优势,强表达目的蛋白 的细胞会越来越少。这样再次筛选是必不可少的。 只有经过2次以上的筛选之后才能找到那种我们想 要的遗传稳定的细胞克隆。
生理学细胞转导PPT课件

A:失活型G蛋白的亚单位是与GDP结合的,但 未结合在受体上。
B:当细胞外信号分子(配体) 与受体结合后,受体活化并与G 蛋白亚单位结合,使之发生构 象变化,亚单位随之与GDP解 离而与胞浆中的GTP结合,形成 激活型G蛋白。
D:由于亚单的GTP酶活性,可将与它结合的GTP 水解生成GDP, 并与GDP和-亚单位再结合,回到失 活型G蛋白状态,从而终止信号转导过程。
16
三、酶联型受体介导的信号转导
酶联型受体(enzyme-linked receptor)也是一种跨膜蛋白,但每个受体分子只有1次穿膜,是一种 单穿膜受体。
受体蛋白结合配体的结构域(受体部分)位于质膜的外表面,而其面向胞质的结构域具有酶活性,
或者能与酶分子直接结合。因此,酶联型受体可分成两大类:
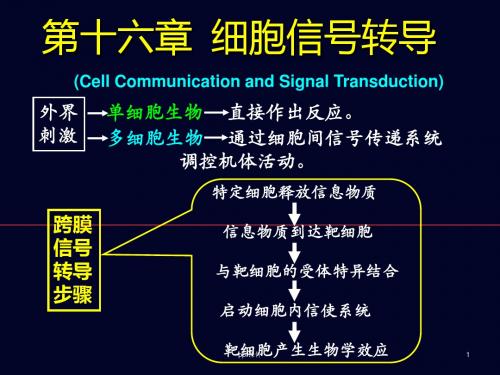
第二节 细胞的信号转导
多细胞生物体为适应内、外环境变化所进行的任何一种生命活动,都需要许多细胞的相互协调和相互 配合,这就要求在不同细胞之间建立起信号交流机制,而信号转导(signal transduction)就是细胞实 现彼此之间信息交流和功能协调的手段,也是细胞最基本和最重要的功能之一。
信号转导的本质是:细胞受到来自于其周围环境的不同理、化刺激(信号)之后,通过质膜上和胞浆
• 与PKA一样,PKC也是丝氨酸/苏氨酸蛋白激酶,激活的PKC可使底物蛋白磷酸化而产生多种生物学效 应。
15
(三)G蛋白耦联受体的信号转导特点
转导速度慢:G蛋白耦联受体介导的信号转导需 要多级信号分子的中继,因而需要较长的反应时 间(从几百毫秒到几分钟),较离子通道受体介 导的信号转导慢得多。
活后可引起离子的跨膜流动,所以又称为促离子型受体(iontropic receptor)。
细胞转染技术 PPT

人的微孔。电穿孔技术可用于瞬时转染和稳定转染,可方便 地用于悬浮细胞,重现性好,但需要较多的细胞。影响转染 效率的主要因素是脉冲强度和持续时间。必须找到能够使核 酸有效释放而又不杀死细胞的最佳平衡点。
(2)显微注射法 该法虽然费力,但却是非常有效的将核酸导入细
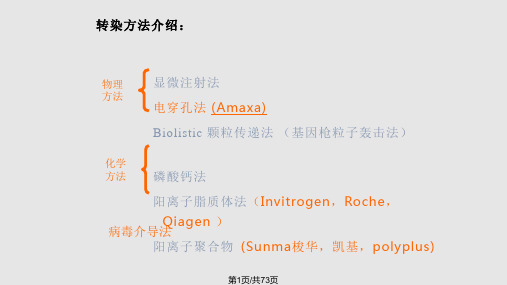
胞或细胞核的方法。这种方法常用来制备转基因动物, 但不适用于需要大量转染细胞的研究。 (3)基因枪法
最常见的载体上带有新霉素抗性基因neo, 所以筛选的时候用G418 பைடு நூலகம்G418是目前获 得稳转最常用的试剂之一。
G418是一种氨基糖苷类抗生素,其结构与 新霉素,庆大霉素,卡那霉素相似,通过 影响干扰核糖体功能而阻断蛋白质合成, 对原核和真核细胞等产生毒素,包括细菌 ,酵母,植物和哺乳动物细胞,也包括原 生动物和蠕虫。
当neo基因被整合进真核细胞基因组合适的 地方后,则能启动neo基因编码的序列转录 为mRNA,使细胞获得抗性而能在含有 G418的选择性培养基中生长。目前G418 的这一特性已在基因转移,敲除,抗性筛 选以及转基因动物等方面得以广泛应用。
筛选之前
由于每种细胞对G418的敏感性不同,而且不同的 厂家生产的相同浓度的G418的活性不尽相同,所以在 筛选之前,一定要确定G418的最佳筛选浓度。具体如 下:
加药时间
由于基因转染到细胞内之后要一段时间才能表达出 蛋白质。所以筛选不能太早;但是也不能太晚,因为转 染了外源基因的细胞代谢负荷较大,增殖较慢,时间长 了就会被没有外源基因转入的细胞所淹没,最终导致筛 选不出阳性克隆,一般要在转染24小时之后才开始加 G418筛选。随着细胞的代谢G418的浓度和活性都会下 降,所以每2~3天都要更换一次含有G418的筛选液。
将细胞稀释到1000个细胞/mL ,每孔100μl加 入有培养基的24孔板,将每孔中的G418浓度稀释至0, 100, 200,300, 400,500, 600,700,800, 900, 1000,1100μg/ml等12个级别,选择出在 10~14天内使细胞全部死亡的最低G418浓度来进行 下一步的筛选试验。一般400-800 μg/ml左右。
(2)显微注射法 该法虽然费力,但却是非常有效的将核酸导入细
胞或细胞核的方法。这种方法常用来制备转基因动物, 但不适用于需要大量转染细胞的研究。 (3)基因枪法
最常见的载体上带有新霉素抗性基因neo, 所以筛选的时候用G418 பைடு நூலகம்G418是目前获 得稳转最常用的试剂之一。
G418是一种氨基糖苷类抗生素,其结构与 新霉素,庆大霉素,卡那霉素相似,通过 影响干扰核糖体功能而阻断蛋白质合成, 对原核和真核细胞等产生毒素,包括细菌 ,酵母,植物和哺乳动物细胞,也包括原 生动物和蠕虫。
当neo基因被整合进真核细胞基因组合适的 地方后,则能启动neo基因编码的序列转录 为mRNA,使细胞获得抗性而能在含有 G418的选择性培养基中生长。目前G418 的这一特性已在基因转移,敲除,抗性筛 选以及转基因动物等方面得以广泛应用。
筛选之前
由于每种细胞对G418的敏感性不同,而且不同的 厂家生产的相同浓度的G418的活性不尽相同,所以在 筛选之前,一定要确定G418的最佳筛选浓度。具体如 下:
加药时间
由于基因转染到细胞内之后要一段时间才能表达出 蛋白质。所以筛选不能太早;但是也不能太晚,因为转 染了外源基因的细胞代谢负荷较大,增殖较慢,时间长 了就会被没有外源基因转入的细胞所淹没,最终导致筛 选不出阳性克隆,一般要在转染24小时之后才开始加 G418筛选。随着细胞的代谢G418的浓度和活性都会下 降,所以每2~3天都要更换一次含有G418的筛选液。
将细胞稀释到1000个细胞/mL ,每孔100μl加 入有培养基的24孔板,将每孔中的G418浓度稀释至0, 100, 200,300, 400,500, 600,700,800, 900, 1000,1100μg/ml等12个级别,选择出在 10~14天内使细胞全部死亡的最低G418浓度来进行 下一步的筛选试验。一般400-800 μg/ml左右。
细胞信号转导异常与疾病培训资料(ppt 48页)

Cell signaling
Signaling cell Target cell
1. Synthesis 2. Release 3. Transport 4. Binding 5. Signaling 6. Desensitization
细胞信号转导的构成
细胞外信号分子 受体 细胞内信号分子
细胞外信号过程 细胞内信号转导
Signaling Events
❖Specificity ❖Amplification ❖Transient ❖Reversible ❖Regulation ❖Network
Stage II
❖Proliferation ❖Differentiation ❖Transformation ❖Apoptosis ❖Activation ❖Migration ❖Aging
核受体
甾体激素受体
Transmembrane receptors
❖ 酪氨酸激酶受体,如PDGF受体、胰岛素受体、 EGF受体、FGF受体;
❖ 酪氨酸磷酸酶受体,如T细胞和巨噬细胞的CD45 蛋白;
❖ 鸟嘌呤环化酶(GC)受体,如心房肽受体; ❖ 丝氨酸/苏氨酸激酶受体,如activin和TGF-b受体;
血管紧张素受体、缓激肽受体、血管加压素受 体
❖光子受体:第二信使cGMP
G蛋白转导素
核受体
➢ 这类受体在细胞内与配基结合后移入细胞 核,配基受体复合物在核内直接影响基因 表达。
➢ 包括糖皮质激素受体、维生素D受体、视 黄酸受体、甲状腺素受体等。
信号转导级联
激酶
p
磷酸酶 p
p
细胞反应
❖ 基因表达 ❖ DNA合成激活 ❖ 蛋白质合成改变 ❖ 细胞骨架重排 ❖ 离子通透性变化 ❖ 细胞代谢酶变化
细胞转染技术课件

细胞转染技术的应用
研究基因功能
基因表达调控
通过转染特定基因,研究其在细胞内的表达调控机制,有助于深入 了解基因的功能和作用。
基因敲除与敲入
利用转染技术将特定基因敲除或敲入细胞中,以探究基因对细胞生 长、分化等过程的影响。
表观遗传学研究
通过转染特定因子或抑制剂,研究表观遗传修饰对基因表达的调控作 用。
与合作。
降低对细胞的毒性
寻找低毒性的转染试剂
研发和选用对细胞毒性更低的转染试剂,减轻对细胞的损伤。
控制转染条件
优化转染条件,如降低转染浓度、减少转染时间等,以减轻对细胞的毒性。
细胞株的选择
选用对转染更具有耐受性的细胞株,降低转染过程中的毒性。
发展新型的转染技术与方法
非病毒载体转染技术
研究和发展非病毒载体转染技术,如纳米材料、基因 编辑技术等,以实现更高效、安全的基因转移。
体内转染技术
探索和发展体内转染技术,提高基因治疗在临床应用 中的效果和安全性。
跨物种转染技术
研究和发展跨物种转染技术,拓宽基因功能研究和基 因治疗的应用范围。
CHAPTER 06
案例分析:某基因的功能研 究
研究背景与目的
某基因在肿瘤发生发展中的重要作用
近年来,研究发现某基因在多种肿瘤中高表达,可能与肿瘤的发生、发展、转移等过程 密切相关。
提高转染效率的方法
预处理细胞
通过药物处理、电穿孔等方式预处理细胞,可以提高细胞膜的通 透性,有利于转染试剂进入细胞。
共转染
同时转染多个基因或质粒,可以提高转染效率和基因表达水平。
筛选稳定转染细胞株
通过药物筛选或克隆选择等方法,筛选出稳定表达目的基因的细胞 株,可以长期保存和应用。
研究基因功能
基因表达调控
通过转染特定基因,研究其在细胞内的表达调控机制,有助于深入 了解基因的功能和作用。
基因敲除与敲入
利用转染技术将特定基因敲除或敲入细胞中,以探究基因对细胞生 长、分化等过程的影响。
表观遗传学研究
通过转染特定因子或抑制剂,研究表观遗传修饰对基因表达的调控作 用。
与合作。
降低对细胞的毒性
寻找低毒性的转染试剂
研发和选用对细胞毒性更低的转染试剂,减轻对细胞的损伤。
控制转染条件
优化转染条件,如降低转染浓度、减少转染时间等,以减轻对细胞的毒性。
细胞株的选择
选用对转染更具有耐受性的细胞株,降低转染过程中的毒性。
发展新型的转染技术与方法
非病毒载体转染技术
研究和发展非病毒载体转染技术,如纳米材料、基因 编辑技术等,以实现更高效、安全的基因转移。
体内转染技术
探索和发展体内转染技术,提高基因治疗在临床应用 中的效果和安全性。
跨物种转染技术
研究和发展跨物种转染技术,拓宽基因功能研究和基 因治疗的应用范围。
CHAPTER 06
案例分析:某基因的功能研 究
研究背景与目的
某基因在肿瘤发生发展中的重要作用
近年来,研究发现某基因在多种肿瘤中高表达,可能与肿瘤的发生、发展、转移等过程 密切相关。
提高转染效率的方法
预处理细胞
通过药物处理、电穿孔等方式预处理细胞,可以提高细胞膜的通 透性,有利于转染试剂进入细胞。
共转染
同时转染多个基因或质粒,可以提高转染效率和基因表达水平。
筛选稳定转染细胞株
通过药物筛选或克隆选择等方法,筛选出稳定表达目的基因的细胞 株,可以长期保存和应用。
细胞转染Cell Transfection

细胞培养
• HeLa, HepG-2, NIH /3T3 细胞培养于含 10% 新生小牛血清的 DMEM 高糖培养液, 37 C , 5% CO2, 90% 相对湿度培养箱中 . 在解冻小鼠 ES 细胞前, 先培养饲养层细胞 C57BL, 待长满后, 用 含 10 ug /mL 的mitomycin C处理 2 ~ 2. 51h, 用 37 C 预热的 PBS 漂洗两次, 加普通培养液过夜培养 . 第二天, 解冻小鼠 ES 细胞, 在含 10% 胎牛血清7 . 175 X 109 pmoI /L LIF饲养层上培养 .
•
转染试剂
细胞状态 转染方法
载体构建
•
细胞培养物 细胞密度 血清
抗生素
氮磷比 DNA质量
1. 转染试剂
• 不同细胞系转染效率通常不同, 但细胞系的选择通常是根据实验 的需要, 因此在转染实验前应根据实验要求和细胞特性选择适合 的转染试剂。 每种转染试剂都会提供一些已经成功转染的细胞株 列表和文献, 通过这些资料可选择最适合实验设计的转染试剂。 当然, 最适合的是高效、 低毒、 方便、 廉价的转染试剂。
• 小鼠 ES 细胞, 用 冰预冷的 PBS 将处于对数生长期的细胞重悬为 1 X 107 个 /mL, 取 0. 8 mL 细胞悬液与 25 ug 线性化的 Target Vector 混合, 加到 4 mm 电击池, 冰上放置 5 min (对照组室温放置) • 用 电压 240 V,电阻 ,电容 500 uF 和 950 uF 分别进行电穿孔转染, 电击 后冰上放置 5 mi n (对照组室温放置) • 将细胞转移到装有预热培养液的 15 mL 离心管中 , 轻轻吸打均匀后, 将 细胞悬液平均分到 6 个装有预热培养液( 含 7 . 175 X109 pmoI /L LIF)铺 好饲养层的 10 cm 培养皿中 , 摇匀, 常规条件培养 • 24 h后换新鲜培养液, 电击后 48 h,加250ug /mL G418 及 2 umoI /L gancycIovir 进行选择, 每天更换选择培养液
细胞生物学技术课件GFP细胞转染实验讲义

Chemical-based transfection:calcium phosphate ; liposomes Non chemical methods: Electroporation Particle-based methods:gene gun Viral methods:viral transduction Other (and hybrid) methods: nucleofection; heat shock.
这些特殊的结构可以实现目的基因在靶细胞内的稳 定表达
back
载体名称:pEYFP-C1 载体类型:哺乳动物细胞表达载体
载体大小:4.7kb 载体宿主:大肠杆菌,哺乳动物细胞(E.coli, Mammalian cells) 细菌抗性:卡纳(kan) 真核筛选标记:新霉素(Neomycin) 5' 测序引物:EGFP-N Sequencing Primer (#6479-1) 3' 测序引物:EGFP-C Sequencing Primer (#6478-1) 载体描述:encodes an enhanced yellow-green variant of the Aequorea victorioiled plasmid DNA or siRNA constructs), or even proteins such as antibodies, may be transfected.
Transfection of animal cells typically involves opening transient pores or "holes" in the cell membrane, to allow the uptake of material.
这些特殊的结构可以实现目的基因在靶细胞内的稳 定表达
back
载体名称:pEYFP-C1 载体类型:哺乳动物细胞表达载体
载体大小:4.7kb 载体宿主:大肠杆菌,哺乳动物细胞(E.coli, Mammalian cells) 细菌抗性:卡纳(kan) 真核筛选标记:新霉素(Neomycin) 5' 测序引物:EGFP-N Sequencing Primer (#6479-1) 3' 测序引物:EGFP-C Sequencing Primer (#6478-1) 载体描述:encodes an enhanced yellow-green variant of the Aequorea victorioiled plasmid DNA or siRNA constructs), or even proteins such as antibodies, may be transfected.
Transfection of animal cells typically involves opening transient pores or "holes" in the cell membrane, to allow the uptake of material.
细胞转染简介ppt课件

3.DNA片断的重组连接
粘端连接方法要点
平端连接方法要点
①单酶单切点 防自身环化, ①平端,平端连接;
希望定向插入;
②Linker连接酶切产生粘端连接;
③Adaptor衔接目的基因和载体;
②双酶双切点 定向克隆,构
④同源同聚尾,克隆cDNA的最好
建表达载体的最好用此法; 方法
③利用同裂解酶产生相同粘 ⑤T载体,PCR产物T/A克隆法连
(1)逆转录病毒 (2)腺病毒
28
四 转染后筛选
• 筛选所选用的抗生素跟转染所用的质粒上 所带的真核筛选抗性基因有关的 。
• 标有neo(实际上应该是neo resistance) 的载体,指载有降解新霉素的基因,新霉 素作用于原核和真核细胞,对两者都有杀 伤作用。用于转染后,稳定表达外源基因 细胞的阳性筛选。
(1)电穿孔法
利用高压电脉冲对细胞膜的干扰,使其 形成利于核酸进人的微孔。电穿孔技术可用于 瞬时转染和稳定转染,可方便地用于悬浮细胞, 重现性好,但需要较多的细胞。影响转染效率 的主要因素是脉冲强度和持续时间。必须找到 能够使核酸有效释放而又不杀死细胞的最佳平 衡点。
26
(2)显微注射法 该法虽然费力,但却是非常有效的将核
A. 典型的哺乳动物细胞表达载体需要以下顺式作用元 件:
a.启动子 b.增强子 c. 多聚腺苷酸化信号 d. 药物选择 标记基
e. 报告基因 f.表位标签
11
B.常用的哺乳动物表达质粒载体 a. pcDNA3.l b. pSI c. pCMV-HA d. pBudCE4.1 e. pTRE
12
2)病毒型载体
38
• 6 时间进度 • 一般原则提示:要确保最终结果的成功;
细胞信息转导共196页

(adenylate cyclase,AC)(guanylate cyclase,GC)
• 包括:跨膜离子通道型受体(环行受体 )、G蛋白偶联型受体、单跨膜受体、鸟 苷酸环化酶活性受体等
28.03.2020
12
信号转导图示
28.03.2020
13
三、信号转导网络工作的基础
• 受体介导的信号向细胞内、尤其是细胞核的 转导过程需要多种分子参与,形成复杂的信 号转导网络系统。
• 细胞内信号分子包括:
• 细胞通过细胞膜表面的蛋白质、糖蛋白 、蛋白聚糖与相邻细胞的膜表面分子特 异性地识别和相互作用,达到功能上的 相互协调。
• 这种细胞通讯方式称为膜表面分子接触 通讯,也是一种细胞间直接通讯。
28.03.2020
7
属于这一类通讯 的有:
• 相邻细胞间粘 附因子的相互 作用
• T淋巴细胞与B 淋巴细胞表面 分子的相互作 用等
28.03.2020
5
可溶性化学信号的分类
化学信号 的名称
作用距离 受体位置
举例
神经分泌 内分泌
自分泌及 旁分泌
神经递质
激素
细胞因子
nm 膜受体
乙酰胆碱 谷氨酸
m 膜或胞内受体
胰岛素 生长激素
m 膜受体
表皮生长因子 神经生长因子
28.03.2020
6
(三)细胞表面分子也是重要的细胞 外信号
• 细胞与细胞直接相互作用也属于细胞外 信号。
②该分子类似物可模拟细胞外信号的作用; ③阻断该分子的变化可阻断细胞对外源信号的反应。 ④作为别位效应剂在细胞内有特定的靶蛋白分子。
28.03.2020
18
(一)环核苷酸
细胞转染PPT课件

稳定转染子的选择
• 成功完成稳定转染需要高效DNA输送和筛选获得DNA的细胞的 方法。
• 筛选稳定表达转染DNA的细胞的最可靠方法之一是在用于转 染的DNA重组体或共转染至细胞的独立载体中加入选择标记 物,然后经过短暂的恢复期后,在细胞中应用适当的选择压 力。当共转染载体上表达选择标记物时,携带目的基因的载 体与携带选择标记物的载体的摩尔比应在5:1至10:1范围内, 以确保包含选择标记物的细胞也含有目的基因。
2019/8/2
尽管转染效率因细胞类型的不同而异,在104个转染 细胞中只有大约一个细胞可以稳定整合DNA (不论使用 的是线性还是环状DNA)。
没有一种方法可以适用于所有细胞和所有实验。必须 根据您的细胞类型和实验要求选择理想的方法,必须具 有高转染效率、低血细胞毒性、对正常生理学的影响最 小,且使用简单、可重复。
3、物理方法:将核酸直接导入细胞质或细胞核内。 显微注射、激光介导的转染
阳离子脂质体介导的输送
• 特殊设计的阳离子脂质体(如LipofectamineR转染试剂)可促进 DNA和siRNA进入细胞。基本结构包括带正电荷的头基和一个或 两个碳氢链。
• 采用阳离子脂质体试剂时,带负电荷的DNA与带正电荷的脂质 体自发结合,形成DNA-阳离子脂质体试剂复合物。一般认为, 转染复合物通过内吞作用进入细胞。
• 低毒性:病毒载体应尽量不对其感染的细胞的生理学造 成影响。
• 稳定性:一些病毒具有遗传不稳定性,会迅速重排基因 组。这会对使用病毒载体的操作的可预测性和可重复性产 生不利影响。
• 选择性:病毒载体应包含选择标记物,如特定的抗生素抗 性,从而可以分离出摄取了病毒载体的细胞。
SUCCESS
THANK YOU
细胞信息转导 ppt课件
信号分子A
激动型受体 GDP- αs γ
β
信号分子B 抑制型受体 γ
β
(+) GTP- αs (+) ATP
(+) αi -GTP
γ
β α i
-GDP
AC
ppt课件
(-) cAMP (+) PKA
生物学效应
10
H (2)AC与cAMP的生成
腺苷酸环化酶
R R
β β γ
GTP
α
γ
A A C C
GDP
(2)例如:白介素(IL)、干扰素(IFN) 等。 5.无机物 如Ca2+ 、NO、CO等。
ppt课件
3
(二)信号分子的传递方式
1. 内分泌信号传递 通过血液循环到达靶细胞的传递方式。
2.旁分泌信号传递 到达临近的靶细胞的传递方式。 3.自分泌信号传递 到达自身作为靶细胞的传递方式。
二、受体的种类和作用特点
受体(recepter) 是细胞膜上或细胞内能识别生 物活性分子并与之结合的特殊蛋白质或糖脂等。 配体(ligand)是能与受体呈特异性结合的生物 活性分子。
ppt课件 4
(一)受体的种类
膜受体 分类
离子通道受体 G 蛋白偶联受体 单跨膜 受体
胞内受体 1.细胞膜受体(cell membrane receptor)
ppt课件 7
2.细胞内受体(intracellular receptor) 主要分布于细胞核,多为转录因子,故称为 转录因子受体或核受体。这类受体与相应的配 体结合后,能与DNA的顺式作用元件结合,在 转录水平调节基因表达。如固醇激素受体、甲 状腺激素受体和维生素D受体等。
(二)受体作用的特点
激动型受体 GDP- αs γ
β
信号分子B 抑制型受体 γ
β
(+) GTP- αs (+) ATP
(+) αi -GTP
γ
β α i
-GDP
AC
ppt课件
(-) cAMP (+) PKA
生物学效应
10
H (2)AC与cAMP的生成
腺苷酸环化酶
R R
β β γ
GTP
α
γ
A A C C
GDP
(2)例如:白介素(IL)、干扰素(IFN) 等。 5.无机物 如Ca2+ 、NO、CO等。
ppt课件
3
(二)信号分子的传递方式
1. 内分泌信号传递 通过血液循环到达靶细胞的传递方式。
2.旁分泌信号传递 到达临近的靶细胞的传递方式。 3.自分泌信号传递 到达自身作为靶细胞的传递方式。
二、受体的种类和作用特点
受体(recepter) 是细胞膜上或细胞内能识别生 物活性分子并与之结合的特殊蛋白质或糖脂等。 配体(ligand)是能与受体呈特异性结合的生物 活性分子。
ppt课件 4
(一)受体的种类
膜受体 分类
离子通道受体 G 蛋白偶联受体 单跨膜 受体
胞内受体 1.细胞膜受体(cell membrane receptor)
ppt课件 7
2.细胞内受体(intracellular receptor) 主要分布于细胞核,多为转录因子,故称为 转录因子受体或核受体。这类受体与相应的配 体结合后,能与DNA的顺式作用元件结合,在 转录水平调节基因表达。如固醇激素受体、甲 状腺激素受体和维生素D受体等。
(二)受体作用的特点
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(5) 氮磷(N/P) 比
• N/P 比是转染效率的关键(为了换算方便, 一般以 DNA/转染试 剂质量比表示) , 在一定比例范围内转染效率随 N/P 比成比例 增高, 之后达到平值, 但毒性也随之而增加, 因此在实验之前 应根据推荐比例, 确定本实验的最佳转染比例。
(6) DNA 质量
• DNA 质量对转染效率影响非常大。 一般的转染技术(如脂质体等) 基于电 荷吸引原理,如果 DNA 不纯, 如带少量的盐离子, 蛋白, 代谢物污染都会 显著影响转染复合物的有效形成及转染的进行。
细胞培养
• HeLa, HepG-2, NIH /3T3 细胞培养于含 10% 新生小牛血清的 DMEM 高糖培养液, 37 C , 5% CO2, 90% 相对湿度培养箱中 . 在解冻小鼠 ES 细胞前, 先培养饲养层细胞 C57BL, 待长满后, 用 含 10 ug /mL 的mitomycin C处理 2 ~ 2. 51h, 用 37 C 预热的 PBS 漂洗两次, 加普通培养液过夜培养 . 第二天, 解冻小鼠 ES 细胞, 在含 10% 胎牛血清7 . 175 X 109 pmoI /L LIF饲养层上培养 .
2. 细胞状态
• 一般低的细胞代数(<50) 能确保基因型不变。 最适合 转染的细胞是经过几次传代后达到指数生长期的细胞, 细胞生长旺盛, 最容易转染。 同一种系的细胞株, 在各 实验室不同培养条件下, 其生物学性状发生不同程度的 改变, 导致其转染特性也发生变化。 因此, 如果发现转 染效率降低, 可以试着转染新鲜培养的细胞以恢复最佳 结果。
• •
转染效率的因素影响
• 转染试剂 细胞状态 转染方法 载体构建
• 细胞培养物 细胞密度 血清 抗生素 氮磷比 DNA质量
1. 转染试剂
• 不同细胞系转染效率通常不同, 但细胞系的选择通常是根据实验 的需要, 因此在转染实验前应根据实验要求和细胞特性选择适合 的转染试剂。 每种转染试剂都会提供一些已经成功转染的细胞株 列表和文献, 通过这些资料可选择最适合实验设计的转染试剂。 当然, 最适合的是高效、 低毒、 方便、 廉价的转染试剂。
稳定转染(stable transfection)
• 稳定转染,外源DNA既可以整合到宿主染色体中,也可能作为一 种游离体(episome)存在。尽管线性DNA比超螺旋DNA转入量 低但整合率高。外源DNA整合到染色体中概率很小,大约1/104 转染细胞能整合,通常需要通过一些选择性标记,如来氨丙基转 移酶(APH;新霉素抗性基因),潮霉素B磷酸转移酶(HPH), 胸苷激酶(TK)等反复筛选,得到稳定转染的同源细胞系。
(4) 抗生素
• 细胞培养过程中往往会添加抗生素来防止污染, 但是这些添加剂可能对转 染造成麻烦。 比如青霉素和链霉素, 就是影响转染的培养基添加物。 这 些抗生素一般对于真核细胞无毒, 但有些转染试剂增加了细胞的通透性, 使抗生素可以进入细胞。 这可能间接导致细胞死亡, 造成转染效率低。 目 前转染试剂因为全程都可以用有血清和抗生素等添加剂的完全培养基来 操作, 非常方便, 省去了污染等麻烦
细胞转染条件的材料
真核表达质 粒 PEGFP-N 带有表达绿色荧光蛋白 的 EGFP 基因,用 于细胞转染 后衡量转基因的表达水平, 打靶载体( Target Vector, 如图 2 所示) 在靶基 因的同源序列之间插入新霉素抗性基因( NEO)作为正筛选的标志, 在同源 序列的 3'端插有疱疹病毒胸苷激酶( HSV-tk)基因作为负选择, 反复筛选后 得到的细胞克隆数用 于衡量转基因的表达水平 .
(2) 细胞密度
• 细胞密度对转染效率有一定的影响。 转染时过高或者过低的细胞密度会导 致转染效率降低, 乃至表达水平偏低。 因此如果选用新的细胞系或者新的 转染试剂,最好能够进行优化实验并为Байду номын сангаас后的实验建立一个稳定方法, 包 括适当的接种量和培养时间等等, 总之是尽量在细胞最适的生理状态下转 染, 以求最佳的转染效果。
4. 载体构建
• 转染载体的构建(病毒载体, 质粒 DNA, RNA, PCR 产物, 寡核苷酸等) 也影响转染结果。 病毒载体对特定宿主细胞感染效率较高, 但不同病毒载 体有其特定的宿主, 有的还要求特定的细胞周期 。 除载体构建外, 载体的 形态及大小对转染效率也有不同的影响, 如超螺旋及线性 DNA 对瞬时和稳 定转染的影响。 如果基因产物对细胞有毒性作用, 转染也很难进行, 因此 选择组成或可调控, 强度合适的启动子也很重要, 同时做空载体及其它基 因的相同载体构建的转染正对照可排除毒性影响的干扰。
• 外源DNA/RNA不整合到宿主染色体中,因此一个宿主细胞中可存 在多个拷贝数,产生高水平的表达,但通常只持续几天,多用于 启动子和其它调控元件的分析。一般来说,超螺旋质粒DNA转染 效率较高,在转染后24-72小时内(依赖于各种不同的构建)分 析结果,常常用到一些报告系统如荧光蛋白,β半乳糖苷酶等来 帮助检测
细胞转染
• 随着分子生物学和细胞生物学研究的不断发展, 转染已经成为研究和控制真核细胞基因功能的常 规工具。在研究基因功能、调控基因表达、突变 分析和蛋白质生产等生物学试验中,其应用越来 越广泛。
• 转染(transfection):真核细胞由于外源DNA掺入 而获得新的遗传标志的过程。
瞬时转染(transient transfection)
3. 转染方法
•不同转染试剂有不同的转染方法, 但大多大同小异。 应根据实验室的具 体条件来确定最佳转染条件。
(1) 细胞培养物
•健康的细胞培养物是成功转染的基础。 不同细胞有不同的培养基, 血清 和添加物。 高的转染效率需要一定的细胞密度。 推荐在转染前 24 小时分 细胞, 这将提供正常细胞代谢, 增加对外源 DNA 摄入的可能。 一定要避 免细菌, 支原体或真菌的污染。
(3) 血清
• 血清一度曾被认为会降低转染效率, 血清的存在会影响 DNA—转染复合 物的形成, 但只要在 DNA-转染复合物形成时用无血清培养基或 PBS 来稀
• 释 DNA 和转染试剂就可以了, 在转染过程中是可以使用血清的。 不过要 特别注意: 对于 RNA转染, 如何消除血清中潜在的 RNase 污染是值得关 注的。 通常的, 血清是一种包含生长因子及其它辅助因子的不确切成分 的添加物, 对不同细胞的生长作用有很大的差别。 血清质量的变化直接 影响细胞生长, 因此也会影响转染效率。
