西北工业大学材料考研材料科学基础课件.
西北工业大学-832材料科学基础

4.1 参考书目....................................................................................................................................................8 4.2 海文专业课标准课程内部讲义—海文专业课学员享有............................................................8 4.3 考前三套模拟试题及其解析...............................................................................................................8 4.4 典型与重点题及其解析........................................................................................................................8 4.5 真题及其解析.......................................................................................................................................... 8 4.6 学术期刊及专著......................................................................................................................................9
03-15年西北工业大学材料科学基础历年考研真题

三、综合分析题(每题 20 分,共 40 分)
1. 试从晶界的结构特征和能量特征分析晶界的特点。
2. 试分析冷塑性变形对合金组织结构、力学性能、物理化学性能、体系能量的 影响。
2007 年西北工业大学硕士研究生入学试题
一、 简答题(每题 10 分,共 50 分) 1、 请说明什么是全位错和丌全位错,幵请写出 FCC、BCC 和 HCP 晶体中的 最短单位位错的柏氏矢量。 2、 已知原子半徂不晶体结构有关,请问当配位数降低时,原子半徂如何 变化?为什么? 3、 均匀形核不非均匀形核具有相同的临界晶核半徂,非均匀形核的临界 形核功也等于三分乊一表面能,为什么非均匀形核比均匀形核容易?
1) 两水平线的反应类型,幵写出反应式; 2) 分析 Ab、bg′、g′d′、d′、 d′h′、 h′e、eB 七个区域室温下
的组织组成物( j 点成分小于 g 点成分); 3) 分析 I、II 合金的平衡冷却过程,幵注明主要的相变反应;
4) 写出合金 I 平衡冷却到室温后相组成物相对含量的表达式及合金 II 平 衡冷却到室温后组织组成物相对含量的表达式。
4. 在室温下对铁板(其熔点为 1538℃ )和锡板(其熔点为 232℃ ),分别迚 行来回弯折,随着弯折的迚行,各会发生什么现象?为什么?
5. 何为固溶强化?请简述其强化机制。 6. 请比较二元共晶转变不包晶转变的异同。 二、作图计算题(每题 10 分,共 40 分)
5. 请比较 FCC 晶体中
量 b、外加切应力τ 不柏氏矢量 b、外加切应力τ 不位错线 l 乊间的夹角关系, 及位错线运劢方向。(请绘表格作答,答案务必写在答题册上)
类型
b不l τ不b
刃位错 螺位错 混合位错
τ不 l
西北工业大学王永欣材料科学基础考研最新课程教学大纲

西北⼯业⼤学王永欣材料科学基础考研最新课程教学⼤纲《材料科学基础》课程教学⼤纲⼀、课程基本信息1、课程代码:04200702、课程名称(中/英⽂):材料科学基础 / Fundamentals of Materials Science3、学时/学分:96 / 15,80 / 124、先修课程:⼤学物理、普通化学、物理化学,5、⾯向对象:本科⽣、研究⽣6、开课院(系):材料学院7、教材、教学参考书:教材:《材料科学基础》第⼆版,刘智恩主编,西北⼯业⼤学出版社,2003年参考书:1)《材料科学基础》,胡庚祥、蔡珣主编,上海交通⼤学出版社,2000年2)《材料科学基础》第⼆版,⽯德珂主编,西安交通⼤学出版社,2000年3)《材料科学基础》,潘⾦⽣、仝健民主编,清华⼤学出版社,1998年⼆、课程性质和任务本课程材料类各专业最主要的专业基础课。
以⾦属材料、陶瓷材料、⾼分⼦材料及复合材料为对象,从材料的电⼦、原⼦尺度⼊⼿,介绍了热⼒学、动⼒学理论及纳观、微观尺度组织、细观尺度断裂机制及宏观性能。
既具有较强的理论性,⼜与⽣产实践紧密相关。
其任务是:1)介绍材料的成分、微观结构、制备⼯艺及性能之间的关系;2)掌握材料科学与⼯程的基本理论,初步掌握分析、解决⼯程实际问题的思路和⽅法;3)初步掌握科学的实验⽅法和技术。
三、教学内容和基本要求第⼀章⼯程材料中的原⼦排列内容: 1) 原⼦之间的键合2)晶体学的基本概念及点阵类型3)晶向指数和晶⾯指数及其表⽰⽅法4)⾦属的晶体结构特点5)陶瓷的晶体结构6)晶体缺陷的类型及特征要求: 1) 熟练掌握晶⾯、晶向的表⽰⽅法2)熟练掌握三种典型的晶体结构3)熟练掌握晶体缺陷的基本类型、基本特征、基本性质4)熟练掌握位错的应⼒场和应变能;位错的运动与交互作⽤第⼆章固体中的相结构内容: 1) 固溶体的分类、结构特点及性能2)⾦属间化合物相的分类、特点及性能3)陶瓷晶体相的结构及特点4)玻璃相及其形成5)分⼦相的结构特点要求: 1) 熟练掌握合⾦相的主要类型,形成条件、影响因素和性能特点2)掌握玻璃相的形成条件3)了解分⼦相的结构特点及分⼦晶体第三章凝固与结晶内容: 1) 结晶的基本规律2)结晶的基本条件3)晶核的形成4)晶体的长⼤5)陶瓷、聚合物的凝固6)结晶理论的应⽤要求: 1) 熟练掌握凝固基本规律及过冷度的概念2)熟练掌握形核的基本条件3)熟练掌握晶体长⼤条件、界⾯类型、长⼤机制及固溶体形态4)了解凝固理论解释或说明实际⽣产问题第四章相图内容: 1) 相、相平衡及相图制作2)⼆元匀晶相图3)⼆元共晶相图4)⼆元包晶相图5)其它⼆元要相图6)⼆元相图的分析⽅法7)相图的热⼒学解释8)铸锭(件)的组织与偏析9)三元相图要求: 1) 熟练掌握⼆元匀晶、共晶、包晶相图的特点2)熟练掌握⼆元匀晶、共晶、包晶相图平衡、⾮平衡凝固成分变化规律,能够分析结晶过程及得到的组织,能够熟练运⽤杠杆定律计算相及组织相对含量3)能依据相图判断合⾦的⼯艺性能与机械性能4)掌握铁碳相图,能够分析平衡结晶过程及室温下所得到的相、组织,并计算其相对含量5)初步掌握复杂⼆元相图分析⽅法6)熟练掌握三元合⾦成分表⽰⽅法7)掌握三元合⾦结晶过程中相与组织的转变规律8)能够绘制简单的等温截⾯图和垂直截⾯图第五章材料中的扩散内容: 1) 扩散定律及其应⽤2)扩散的微观机理3)扩散的热⼒学理论4)反应扩散5)⼀些影响扩散的重要因素要求: 1) 掌握扩散第⼀、第⼆定律的表达式及适⽤的条件,各符号的意义和单位2)熟练掌握扩散的微观机制3)熟练掌握扩散系数的意义和影响扩散的因素4)认识⼏种重要的扩散现象5)了解扩散的实际应⽤,如渗碳过程等第六章塑性变形内容: 1) ⾦属的应⼒—应变曲线2)单晶体的塑性变形3)多晶体的塑性变形4)合⾦的塑性变形5)冷变形⾦属的组织与性能6)聚合物的塑性变形7)陶瓷材料的塑性变形要求: 1) 熟练掌握滑移、孪⽣变形的主要特点2)熟练掌握滑移的微观机制3)熟练掌握多晶体塑性变形的过程、特点,以及细晶强化的机理4)熟练掌握合⾦塑性变形的特点,以及固溶强化、复相强化、弥撒强化的机理5)熟练掌握塑性变形对晶体微观组织结构、体系能量、⼒学性能和物理、化学性能的影响第七章回复与再结晶内容: 1) 冷变形⾦属在加热时组织和⼒学性能的变化2)回复3)再结晶4)再结晶后的晶粒长⼤5)⾦属的热变形要求: 1.熟练掌握冷塑性变形⾦属发⽣回复、再结晶和晶粒长⼤的条件、微观机理、影响因素2)掌握回复、再结晶的实际应⽤及晶粒⼤⼩的控制3)了解动态回复、动态再结晶的微观机制、性能特点等4)了解⾦属热变形的定义第⼋章固态相变内容: 1) 固态相变类型2)固态相变理论简介3)固态相变主要类型举例要求: 1) 了解固态相变的类型2)了解主要固态相变理论的基本思想3)了解典型的固态相变特点第九章复合效应与界⾯内容: 1) 复合材料、增强体及复合效应2)复合材料增强原理3)复合材料的界⾯要求: 1) 了解复合材料的分类2)了解复合材料增强原理3)了解界⾯类型、结合原理及性能四、实验内容和基本要求实验⼀、⾦相显微分析教学⽬标:学习和了解⾦相显微试样的制作过程和⽅法;通过对⾦相显微试样的分析,学习⾦相显微镜的使⽤⽅法,为以后的⾦相分析打下基础。
材料科学基础绪论PPT课件

• 材料的性能包括物理性能、化学性能、力学性能。 • 其内部结构包括
四个层次:①原 子结构;②结合 键;③原子的排 列方式;④显微 组织
第4页/共26页
(二)材料科学与材料工程的关系
第2页/共26页
学习料料科学基础的意义 (一)材料科学的内涵
材料科学是一个跨物理、化学等 的学科。材料科学的核心问题是材 料的组织结构(Structure)和性 能(Property)以及它们之间的关 系。右图为材料科学与工程四要素。 所以,先要了解材料的结构是什么?
第3页/共26页
材料结构关系
第24页/共26页
• 1990年美国总统的科学顾问Allany Bromley明确指出“材料科学在美 国是最重要的学科”。
• 1991年日本为未来工业规划技术列举的11项主要项目中有7项是基于先 进材料之上。
• 1986年《科学的美国人》杂志指出“先进材料对未来的宇航、电子设备、 汽车以及其他工业的发展是必要的,材料科学的进步决定了经济关键部 门增长速率的极限范围。”
• 材料科学的形成:“材料”早存在,“材料科学”提出于 20世纪60年代,1957年苏联卫星上天,美国震动很大, 在大学相继建立十余个材料科学研究中心,自此开始, “材料科学”一词广泛应用。
• 一般来讲,科学是研究“为什么”的学问,而工程是解决 “怎么做”的学问。材料科学的基础理论,为材料工程指 明方向,为更好地选择、使用材料,发挥现有材料的潜力、 发展新材料提供理论基础。
《济地的制造有用物品的物质。 材料科学是研究材料的成分、组织结构、制备工艺、加工工艺、材料 的性能与材料应用之间的相互关系的科学。材料科学是当代科学技术发展 的基础、工业生产的支柱,是当今世界的带头学科之一。纳米材料科学与 技术是20世纪80年代发展起来的新兴学科,成为21世纪新技术的主导中 心。 材料科学基础是进行材料科学研究的基础理论,它将各种材料(包括 金属、陶瓷、高分子材料)的微观结构和宏观结构规律建立在共同的理论 基础上,用于指导材料的研究、生产、应用和发展。它涵盖了材料科学和 材料工程的基础理论。
西北工业大学 832 材料科学基础 考研复习笔记珍藏完整版

第一章材料中的原子排列第一节原子的结合方式1 原子结构2 原子结合键(1)离子键与离子晶体原子结合:电子转移,结合力大,无方向性和饱和性;离子晶体;硬度高,脆性大,熔点高、导电性差。
如氧化物陶瓷。
(2)共价键与原子晶体原子结合:电子共用,结合力大,有方向性和饱和性;原子晶体:强度高、硬度高(金刚石)、熔点高、脆性大、导电性差。
如高分子材料。
(3)金属键与金属晶体原子结合:电子逸出共有,结合力较大,无方向性和饱和性;金属晶体:导电性、导热性、延展性好,熔点较高。
如金属。
金属键:依靠正离子与构成电子气的自由电子之间的静电引力而使诸原子结合到一起的方式。
(3)分子键与分子晶体原子结合:电子云偏移,结合力很小,无方向性和饱和性。
分子晶体:熔点低,硬度低。
如高分子材料。
氢键:(离子结合)X-H---Y(氢键结合),有方向性,如O-H—O(4)混合键。
如复合材料。
3 结合键分类(1) 一次键(化学键):金属键、共价键、离子键。
(2) 二次键(物理键):分子键和氢键。
4 原子的排列方式(1)晶体:原子在三维空间内的周期性规则排列。
长程有序,各向异性。
(2)非晶体:――――――――――不规则排列。
长程无序,各向同性。
第二节原子的规则排列一晶体学基础1 空间点阵与晶体结构(1) 空间点阵:由几何点做周期性的规则排列所形成的三维阵列。
图1-5特征:a 原子的理想排列;b 有14种。
其中:空间点阵中的点-阵点。
它是纯粹的几何点,各点周围环境相同。
描述晶体中原子排列规律的空间格架称之为晶格。
空间点阵中最小的几何单元称之为晶胞。
(2) 晶体结构:原子、离子或原子团按照空间点阵的实际排列。
特征:a 可能存在局部缺陷; b 可有无限多种。
2 晶胞图1-6(1)――-:构成空间点阵的最基本单元。
(2)选取原则:a 能够充分反映空间点阵的对称性;b 相等的棱和角的数目最多;c 具有尽可能多的直角;d 体积最小。
(3) 形状和大小有三个棱边的长度a,b,c及其夹角α,β,γ表示。
《材料科学基础》课后习题(西工大版)-图文

《材料科学基础》课后习题(西工大版)-图文第一章晶面及102,211,346晶向。
1.作图表示立方晶体的123,012,421,2110,1010,1120,1210等。
2.在六方晶体中,绘出以下常见晶向00013.写出立方晶体中晶面族{100},{110},{111},{112}等所包括的等价晶面。
4.镁的原子堆积密度和所有hcp金属一样,为0.74。
试求镁单位晶胞的体积。
已知Mg的密度r=0.161nm。
5.当CN=6时Na离子半径为0.097nm,试问:1)当CN=4时,其半径为多少?2)当CN=8时,其半径为多少?6.试问:在铜(fcc,a=0.361nm)的<100>方向及铁(bcc,a=0.286nm)的<100>方向,原子的线密度为多少?mg1.74Mg/m3,相对原子质量为24.31,原子半径nm。
试确定在镍的(100),7.镍为面心立方结构,其原子半径为rNi0.1246(110)及(111)平面上1mm中各有多少个原子。
3SiOMg/m28.石英的密度为2.65。
试问:21)1m中有多少个硅原子(与氧原子)?2)当硅与氧的半径分别为0.038nm与0.114nm时,其堆积密度为多少(假设原子是球形的)?10109.在800℃时个原子中有一个原子具有足够能量可在固体内移动,而在3900℃时10个原子中则只有一个原子,试求其激活能(J/原子)。
10.若将一块铁加热至850℃,然后快速冷却到20℃。
试计算处理前后空位数应增加多少倍(设铁中形成一摩尔空位所需要的能量为104600J)。
11.设图1-18所示的立方晶体的滑移面ABCD平行于晶体的上、下底面。
若该滑移面上有一正方形位错环,如果位错环的各段分别与滑移面各边平行,其柏氏矢量b∥AB。
91)有人认为“此位错环运动移出晶体后,滑移面上产生的滑移台阶应为4个b,试问这种看法是否正确?为什么?2)指出位错环上各段位错线的类型,并画出位错运动出晶体后,滑移方向及滑移量。
材料力学详细课件(西北工业大学)1

τ σ P
在国际单位制中,应力的单位是N/m2,称为帕斯卡 (Pascal)或简称为帕(Pa)。由于这个单位太小,使用不 便,通常使用兆帕MPa或吉帕GPa。
1Pa= 1N/m2 1Mpa=106Pa 1Gpa=103Mpa=109Pa 1Mpa=1*106N/m2 =1*106N/(1*106)mm2= 1N/mm2
强度是指构件在外力作用下抵抗破坏 强度 (包括断裂或塑性变形)的能力。
刚度是指构件在外力作用下抵抗变形 刚度 的能力。
稳定性是指构件在外力作用下保持其 稳定性 原有平衡形式的能力。
构件的安全性和经济性之间是存在矛盾的。 材料力学的任务就是为此提出必要的基础理 论和计算方法。研究构件在外力作用下变形 和破坏的规律,研究材料的力学性能,研究 构件截面几何性质与其承载能力的关系。 研究构件强度、刚度和稳定性问题,解决构 构 件的安全性和经济性之间的矛盾。 件的安全性和经济性之间的矛盾。
二、截面法
为了显示内力,只有假想的用一截面将物体 分为两部分,这样内力就转化成外力暴露出 来,可用静力平衡条件将它算出。这种方法 称为截面法 截面法。 截面法
截面法的三个步骤: 截面法的三个步骤: (1)在需求内力的截 面上,假想用一横截面 将物体截为两部分; (2)保留其中一部分, 弃去另一部分,并将弃去 部分对保留部分的作用用 内力表示; (3)根据保留部分 的平衡条件求出该截面 的内力。
1.材料力学与理论力学的联系和区别 (1)内容 (2)方法 2.材料力学的学习方法 (1)理论教学 (2)实验教学 (3)习题 3.具体要求 上课,作业,实验和考试。
第一章 绪论
第一节 材料力学的任务 第二节 变形固体的基本假设 第三节 外力及其分类 第四节 内力·截面法和应力的概念 第五节 变形与应变 第六节 杆件变形的基本形式
西北工业大学材料科学基础考研大纲

§ 4.3 共晶相图
� � �
相图分析 共晶转变特点 典型合金的结晶过程(平衡、非平衡)
文章来源:沭阳游戏网
文章来源:沭阳游戏网
� � � �
成分变化(平衡、非平衡) 共晶形成机理(形核机理、长大机理) 共晶体形貌特征(平衡、非平衡) 杠杆定律计算(相组成、组织组成)
复合材料定义、分类 复合材料的构成、各部分的作用 复合效应 界面结合种类
《材料科学基础》复习纲要(二)
重要概念
� � �
键合、工程材料 晶体、非晶体、各向异性 点阵、晶体结构、晶胞、晶系、布拉菲点阵、晶面指数、晶向指数、晶面 晶格常数、晶胞原子数、配位数、致密度、间隙 堆垛、密排面、密排方向、堆垛次序、堆垛方向 缺陷、点缺陷、刃位错、螺位错、混合位错 柏氏矢量、滑移矢量 位错密度 滑移、攀移、交滑移、交割、割阶、扭折、塞积 位错应力场、应变能、线张力、位错线上的力 位错增殖、位错源 全位错、不全位错、堆垛层错、位错反应 晶界、相界、界面能、大角度晶界、小角度晶界、孪晶界 相、固溶体、置换固溶体、间隙固溶体 金属间化合物、玻璃相
族、晶向族
� � � � � � �
� � �
� �
文章来源:沭阳游戏网
文章来源:沭阳游戏网
� � � � �
凝固、结晶、短程有序、长程有序 结构起伏(相起伏)、能量起伏、成分起伏 过冷度、形核过冷度、动态过冷度、临界过冷度、有效形核过冷度 均匀形核、非均匀形核、晶核、临界晶核、临界形核功、形核率 光滑界面、粗糙界面、垂直长大、横向长大、温度梯度、树枝状 平衡转变(结晶)、非平衡转变(结晶)、正常凝固 匀晶、共晶、包晶、共析、包析、脱溶转变 平衡分配系数、有效分配系数 微观偏析(枝晶偏析)、宏观偏析 亚共晶、共晶、过共晶、伪共晶、离异共晶、非平衡共晶、包晶转变不完 铁素体、奥氏体、珠光体、莱氏体、渗碳体、工业纯铁、钢、铸铁 液相线、固相线、液相面、固相面、中间面、液相平均成分线、固相平均 浓度三角形 垂直截面、水平界面、投影图
西北工业大学材料科学基础考研课程试题集.

《材料科学基础》考试大纲一、考试内容1.工程材料中的原子排列(1)原子键合,工程材料种类;(2)原子的规则排列:晶体结构与空间点陈,晶向及晶面的特点及表示,金属的晶体结构,陶瓷的晶体结构。
(3)原子的不规则排列:点、线、面缺陷的类型及特征,位错的弹性性质,实际晶体中的位错。
2.固体中的相结构(1)固溶体的分类、性能及特征(2)金属间化合物的分类、性能及特征;(3)玻璃相性能及特征。
3.凝固与结晶(1)结晶的基本规律、基本条件;(2)晶核的形成与长大;(3)结晶理论的应用。
4.二元相图(1)相图的基本知识;(2)二元匀晶相图及固溶体的结晶,共晶相图及共晶转变,包晶相图及包晶转变;(3)二元相图的分析方法,其他类型二元相图及其应用,相图的热力学基础。
5.固体中的扩散:(1)扩散定律及其应用;(2)扩散的微观机理,影响扩散的因素;(3)扩散的热力学理论;(4)反应扩散。
6.塑性变形:(1)单晶体的塑性变形;(2)多晶体的塑性变形;(3)合金的塑性变形;(4)冷变形金属的组织与性能,超塑性。
7.回复与与结晶:(1)冷变形金属在加热时的变化;(2)回复机制;(3)再结晶及再结晶后的晶粒长大;(4)金属的热变形。
二、参考书目1.《材料科学基础》(第二版),刘智恩,西北工业大学出版社,20032.《材料科学基础》,胡庚祥,蔡珣,上海交通大学出版社,20003.《材料科学基础》,石德珂,西安交通大学出版社,20004.《材料科学基础》,潘金生,仝健民,清华大学出版社,19982004年西北工业大学硕士研究生入学试题一、简答题:(共40分,每小题8分)1、请简述间隙固溶体、间隙相、间隙化合物的异同点?2、请简述影响扩散的主要因素有哪些。
3、临界晶核的物理意义是什么?形成临界晶核的充分条件是什么?4、有哪些因素影响形成非晶态金属?为什么?5、合金强化途径有哪些?各有什么特点?二、计算、作图题:(共60分,每小题12分)1、求]111[和]120[两晶向所决定的晶面,并绘图表示出来。
西工大材料科学基础课件——凝固概要

微晶无序模型(图3-5a)
拓扑无序模型 (图3-5b,c) (4)结构起伏(相起伏) 液态材料中出现的短程有序原子集团的时隐时现现象。 是结晶的必要条件(之二)。
出 现 几 率
结构起伏的大小与温度有关! (图3-7)
结构起伏大小
9
第 三 章 第
第三节 晶核的形成
均匀形核:新相晶核在遍及母相的整个体积内无轨则均匀形成。 非均匀形核:新相晶核依附于其它物质择优形成。
三
章 第 一 节
第一节 材料结晶的基本规律
2. 结晶的结构条件(晶核从何而来?) (1)液态材料的结构 :长程无序而短程有序。 (2)特点(与固态相比):原子间距较大、原子配位
结
晶 规 律
数较小、原子排列较混乱。
8
第 三 章 第
第二节 材料结晶的基本条件
2 结构条件 (3)液态结构模型
二
节 结 晶 条 件
2Tm rK GB
G 0 r
二
节 结 晶 条 件
临界晶核:半径为rk的晶胚。
(3〕 临界过冷度
2Tm 1 rK Lm T
临界过冷度:形成临界晶核时的过冷度。 △T≥△Tk是结晶的必要条件。
11
第
三
章 第 二 节
第三节 晶核的形成
1 均匀形核 (4)形核功与能量起伏
4 3 1 2 A Gmax rK 4rK S 3 rK 3
一
节 结 晶 规
律
4
第 三 章 第
2 .(纯金属)结晶的宏观现象
(1)过冷supercooling 液态材料在理论结晶温度以下仍保持液态的现象。
一
节 结 晶 规
(2)过冷度
西北工业大学王永欣材料科学基础考研最新课程教学大纲

《材料科学基础》课程教学大纲一、课程基本信息1、课程代码:04200702、课程名称(中/英文):材料科学基础 / Fundamentals of Materials Science3、学时/学分:96 / 15,80 / 124、先修课程:大学物理、普通化学、物理化学,5、面向对象:本科生、研究生6、开课院(系):材料学院7、教材、教学参考书:教材:《材料科学基础》第二版, 刘智恩 主编, 西北工业大学出版社,2003年参考书:1)《材料科学基础》,胡庚祥、蔡珣主编,上海交通大学出版社,2000年2)《材料科学基础》第二版,石德珂主编,西安交通大学出版社,2000年3)《材料科学基础》,潘金生、仝健民主编,清华大学出版社,1998年二、课程性质和任务本课程材料类各专业最主要的专业基础课。
以金属材料、陶瓷材料、高分子材料及复合材料为对象,从材料的电子、原子尺度入手,介绍了热力学、动力学理论及纳观、微观尺度组织、细观尺度断裂机制及宏观性能。
既具有较强的理论性,又与生产实践紧密相关。
其任务是:1)介绍材料的成分、微观结构、制备工艺及性能之间的关系;2)掌握材料科学与工程的基本理论,初步掌握分析、解决工程实际问题的思路和方法;3)初步掌握科学的实验方法和技术。
三、教学内容和基本要求第一章 工程材料中的原子排列内容: 1) 原子之间的键合2)晶体学的基本概念及点阵类型3)晶向指数和晶面指数及其表示方法4)金属的晶体结构特点5)陶瓷的晶体结构6)晶体缺陷的类型及特征要求: 1) 熟练掌握晶面、晶向的表示方法2)熟练掌握三种典型的晶体结构3)熟练掌握晶体缺陷的基本类型、基本特征、基本性质4)熟练掌握位错的应力场和应变能;位错的运动与交互作用第二章 固体中的相结构内容: 1) 固溶体的分类、结构特点及性能2)金属间化合物相的分类、特点及性能3)陶瓷晶体相的结构及特点4)玻璃相及其形成5)分子相的结构特点要求: 1) 熟练掌握合金相的主要类型,形成条件、影响因素和性能特点2)掌握玻璃相的形成条件3)了解分子相的结构特点及分子晶体第三章 凝固与结晶内容: 1) 结晶的基本规律2)结晶的基本条件3)晶核的形成4)晶体的长大5)陶瓷、聚合物的凝固6)结晶理论的应用要求: 1) 熟练掌握凝固基本规律及过冷度的概念2)熟练掌握形核的基本条件3)熟练掌握晶体长大条件、界面类型、长大机制及固溶体形态4)了解凝固理论解释或说明实际生产问题第四章 相图内容: 1) 相、相平衡及相图制作2)二元匀晶相图3)二元共晶相图4)二元包晶相图5)其它二元要相图6)二元相图的分析方法7)相图的热力学解释8)铸锭(件)的组织与偏析9)三元相图要求: 1) 熟练掌握二元匀晶、共晶、包晶相图的特点2)熟练掌握二元匀晶、共晶、包晶相图平衡、非平衡凝固成分变化规律,能够分析结晶过程及得到的组织,能够熟练运用杠杆定律计算相及组织相对含量3)能依据相图判断合金的工艺性能与机械性能4)掌握铁碳相图,能够分析平衡结晶过程及室温下所得到的相、组织,并计算其相对含量5)初步掌握复杂二元相图分析方法6)熟练掌握三元合金成分表示方法7)掌握三元合金结晶过程中相与组织的转变规律8)能够绘制简单的等温截面图和垂直截面图第五章 材料中的扩散内容: 1) 扩散定律及其应用2)扩散的微观机理3)扩散的热力学理论4)反应扩散5)一些影响扩散的重要因素要求: 1) 掌握扩散第一、第二定律的表达式及适用的条件,各符号的意义和单位2)熟练掌握扩散的微观机制3)熟练掌握扩散系数的意义和影响扩散的因素4)认识几种重要的扩散现象5)了解扩散的实际应用,如渗碳过程等第六章 塑性变形内容: 1) 金属的应力—应变曲线2)单晶体的塑性变形3)多晶体的塑性变形4)合金的塑性变形5)冷变形金属的组织与性能6)聚合物的塑性变形7)陶瓷材料的塑性变形要求: 1) 熟练掌握滑移、孪生变形的主要特点2)熟练掌握滑移的微观机制3)熟练掌握多晶体塑性变形的过程、特点,以及细晶强化的机理4)熟练掌握合金塑性变形的特点,以及固溶强化、复相强化、弥撒强化的机理5)熟练掌握塑性变形对晶体微观组织结构、体系能量、力学性能和物理、化学性能的影响第七章 回复与再结晶内容: 1) 冷变形金属在加热时组织和力学性能的变化2)回复3)再结晶4)再结晶后的晶粒长大5)金属的热变形要求: 1.熟练掌握冷塑性变形金属发生回复、再结晶和晶粒长大的条件、微观机理、影响因素2)掌握回复、再结晶的实际应用及晶粒大小的控制3)了解动态回复、动态再结晶的微观机制、性能特点等4)了解金属热变形的定义第八章 固态相变内容: 1) 固态相变类型2)固态相变理论简介3)固态相变主要类型举例要求: 1) 了解固态相变的类型2)了解主要固态相变理论的基本思想3)了解典型的固态相变特点第九章 复合效应与界面内容: 1) 复合材料、增强体及复合效应2)复合材料增强原理3)复合材料的界面要求: 1) 了解复合材料的分类2)了解复合材料增强原理3)了解界面类型、结合原理及性能四、实验内容和基本要求实验一、金相显微分析教学目标:学习和了解金相显微试样的制作过程和方法;通过对金相显微试样的分析,学习金相显微镜的使用方法,为以后的金相分析打下基础。
西北工业大学材料科学基础考研复习第一章PPT课件

<111>方向
2
晶胞原子数:81812
配位数:8
致密度:68%
(a为棱长)
密排六方(hcp)
• 点阵常数:R 1 a 2
• 最近原子距离:d=a
•
方向
1120
• 晶胞原子数:1 /6 1 1 2 /2 2 3 6
• 配位数:6+6
• 致密度:k
61/6d3
7% 4
6(0.5a 3a/2)c
《材料科学基础》命题规律分析和考点精讲
参考书目
• 1.《材料科学基础》(第二版),刘智恩,西北工业大学 出版社,2003
• 2.《材料科学基础》,胡庚祥,蔡珣,上海交通大学出版 社,2000
• 3.《材料科学基础》,石德珂,西安交通大学出版社, 2000
• 4.《材料科学基础》,潘金生,仝健民,清华大学出版社 ,1998
(hkl)
【uvw】
• 立方晶系晶面间距公式: • 正方晶系晶面间距公式: • 六方晶系晶面间距公式:
• 两晶向夹角公式: • 两晶面夹角公式:
相关真题与习题
• 1.写出{112}晶面族的等价晶面(2011年考题) • 2.写出附图的简单立方晶体中ED、C’F的晶向指数和ACH、FGD’的晶
面指数,并求ACH晶面的晶面间距,以及FGD’与A’B’C’D’两晶面 之间的夹角。(注:G、H点为二等分点,F点为三等分点)(2010)
平衡浓度计算公式:
cv
ne Aexp(Ev)
N
kT
A1,k13.81024J/(原子 •K)
规律:温度越高,空位浓度越大。
• 二。线缺陷(重中之重) • 1.刃位错 分为:正刃型位错(上压下拉)
西北工业大学 材料科学基础课件 第五六七章

•
第三节 影响扩散的因素
二、固溶体类型对扩散的影响
• • 间隙固溶体的扩散激活能一般都很小 在获得同样浓度时,渗碳、渗氮比渗金属 的周期短
18
第三节 影响扩散的因素 三、晶体结构对扩散的影响
1. 扩散系数随同素异构转变变化较大
α-Fe的自扩散系数是γ-Fe的240倍 在527 ℃,氮在α-Fe的自扩散系数比 γ-Fe大1500倍
2)C 在α -Fe 中溶解度小,饱和后的表层碳浓度仍不能满足要求(渗 C 要求 表层含 C)0.8%)
26
第三节 影响扩散的因素
五、合金元素对扩散的影响
碳化物形成元素W、Mo、Cr等与碳的结 合力较大,降低Dc-γ Mn等形成碳化物能力较弱,对Dc-γ几乎 没有影响。 Co、Ni等非碳化物形成元素,由于溶入基 本点阵而产生点阵畸变相当于减少(原子 27 的扩散激活能,提高Dc-γ)。
20
• 3、晶体缺陷的影响: • 空位和位错促进置换型原子的扩散,但对 间隙型原子的扩散的作用尚无定沦,近来 的一些研究认为,它们可能作为陷阱吸引 间隙扩散原子,使它们的扩散激活能增大, 减慢扩散速度。
21
问题
C在α-Fe中的溶解度为0.02%,而 在γ-Fe的最大溶解度为2.21%, 相差100倍;而且C在α-Fe中的扩 散系数比γ-Fe大很多,为什么在 工业上还要选择在γ-Fe的固溶体 中渗碳?
erf ( z ) 2 / exp( y 2 )dy
0 z
16
第三节 影响扩散的因素
一、温度对扩散的影响
• • D = D0exp(- ΔE*/(RT)) ΔE*:激活能(activation energy) in J/mol, cal/mol or eV/atom,移动原子所需能量。 Fe inα-Fe:3.0 x 10-21 m2/s at 500℃ , 1.8 x 10-15 m2/s at 900 ℃ 。 温度越高,原子的能量越大,越容易发生迁移, 扩散系数越大。
西北工业大学材料考研材料科学基础课件

三 结论
1 原子核周围的电子按照四个量子数的规定 从低能到高能依次排列在不同的量子状态 下;同一原子中电子的四个量子数不可能完 全相同
2 根据排列次序建立了元素周期表;各个周期 中的元素的性质呈现相同的周期变化规律; 元素在周期表上的位置不仅决定了单个原 子的行为;也决定了材料中原子的结合方式 以及材料的化学性能和物理性能
2共价键键合的基本特点是核外电子云达到最 大的重叠;形成共用电子对;有确定的方位; 且配位数较小
3共价键在亚金属碳 硅 锡 锗等 聚合物和无 机非金属材料中均占有重要地位 共价键 晶体中各个键之间都有确定的方位;配位数 比较小 共价键的结合极为
牢固;故共价晶体具有结构稳定 熔点高 质硬脆 等特点 共价形成的材料一般是绝缘体;其导电性 能差
原子排列不可能很致密;所以它们的化合物 的密度较低 而聚合物由于二次键结合;分 子链堆垛不紧密;加上组成原子的质量较小 C H O;在工程材料中具有最低的密度
3此外;金属键使金属材料具有良好的导电性 和导热性;而由非金属键结合的陶瓷 聚合 物均在固态下不导电;它们可以作为绝缘体 或绝热体在工程上应用
3 金属键 1金属中的自由电子和金属正离子相互作用所构成
键合称为金属键;例如Na Mg Al等 2金属键的基本特点是电子的共有化 3金属键既无饱和性又无方向性;因而每个原子有
可能同更多的原子相结合;并趋于形成低能量的 密堆结构 当金属受力变形而改变原子之间的相 互位置时;不至于使金属键破坏;这就使金属具有 良好延展性;并且;由于自由电子的存在;金属一 般都具有良好的导电和导热性能
第三节 原子的排列方式
1 固体根据原子或原子团 分子分为晶体和非 晶体
2 晶体 原子排列:粒子原子 离子或分子在三维空 间呈周期性的规则重复排列
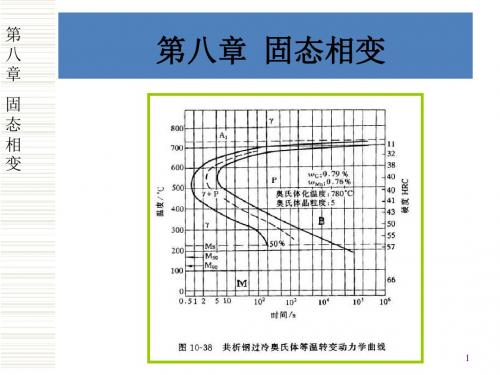
西北工业大学材料科学基础第八章_固态相变讲解
核
长
大
19
第 八
第三节 固态相变的晶核长大
章
固
2 晶核生长速率
态
(1)界面控制长大 新相生成时无成分变化(只有结构、
相 变
有序度变化)短程输送 u=exp(-Q/kT)[1-exp(-△Gv/kT)]
第
二
节
形 核 长 大
晶核长大速率是扩散系数D和相变驱动力△Gv的综合影响。20
一
固态相变困难
节
固态相变均匀形核的可能性很小,非均匀形核(依靠
概
晶体缺陷)是主要的形核方式。
述
点…
晶格畸变、自由能高,
缺陷类型 线… 促进形核及相变。
面…
12
第 八
第二节 固态相变的形核
章
固
二 非均匀形核
态
相 变
表面能高,降低△G*
(1)晶界形核 新相在母相表面部分界面重建,降低
第 二 节
界面能 结构混乱,易扩散,利于扩散相变
格。(如珠光体、奥氏体转变,Fe,C都可扩散。)
第
(2)非扩散型:旧相原子有规则地、协调一致地通过
一 节
切变转移到新相中;相界面共格、原子间的相邻 关系不变;化学成分不变。(如马氏体转变,Fe,C都不
概
扩散。)
(3)半扩散型:既有切变,又有扩散。(如贝氏体
述
转变,Fe切变,C扩散。)
8
第 八
第一节 概 述
第
一
惯习方向 (母相) 惯习面
节
概
原因:沿应变能最小的方向和界面能最低的界面发
述
展。
6
第 八
第一节 概 述
章
固
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
目录
• • • • • • • • • • 材料结构的基本知识 材料中的晶体结构 高分子材料的结构 晶体缺陷 材料的相结构及相图 材料的凝固与气相沉积 扩散与固态相变 材料的变形与断裂 固体材料的电子结构与物理性能 材料概论
导论
一.材料使用时间划分:石器时代→青铜器时代→ 铁器时代→水泥时代→钢时代→硅时代→新材料 时代瓷材料(粘土、石英和长石)、高分子 材料(塑料、合成纤维和橡胶)、复合材料。 三.其它材料 电子材料 :在电子学和微电子学使用的材料, 包括半导体材料、介电功能材料和磁性材料 光电子材料:具有光子和电子的产生、转换和传 输功能的材料。
属具有良好塑性。金属键结合的原子排列紧密, 晶体结构简单,金属密度高。共价键结合的材 料,电子受束缚不能自由运动,通常不导电。 共价键结合力很强,变形时要破坏局部键的结 合,故材 料硬而脆。原子排列不紧密,晶体结构复杂, 故共价键晶体陶瓷密度低。 七.材料科学定义:研究各种材料的结构、制备 加工工艺与性能之间关系的学科。
八.材料科学研究的内容:材料结构的基础知识、 晶体结构、晶体缺陷、材料的相结构及相图、材 料的凝固、材料中的原子扩散、热处理、工程材 料概论等主要内容。
第一章 材料结构的基本知识
• • • • • 原子结构 原子结合键 原子排列方式 晶体材料的组织 材料的稳态结构与亚稳态结构
第一节
原子结构
一、原子的电子排列 1.原子组成:原子核(质子和中子)和核外 电子。 2.电子排列:原子核外电子的分布,它不仅 决定了单个原子的行为,也对工程材料内 部原子的结合以及材料的某些性能起着决 定性作用。 3.电子排列参数:主量子数、次量子数、磁 量子数以及自旋量子数
牢固,故共价晶体具有结构稳定、熔点高、质 硬脆等特点。共价形成的材料一般是绝缘体,其 导电性能差。
3.金属键 (1)金属中的自由电子和金属正离子相互作用所 构成键合称为金属键,例如Na、Mg、Al等。 (2)金属键的基本特点是电子的共有化。 (3)金属键既无饱和性又无方向性,因而每个原 子有可能同更多的原子相结合,并趋于形成低能 量的密堆结构。当金属受力变形而改变原子之间 的相互位置时,不至于使金属键破坏,这就使金 属具有良好延展性,并且,由于自由电子的存在, 金属一般都具有良好的导电和导热性能。
(3)一般离子晶体中正负离子静电引力较强, 结合牢固。因此。其熔点和硬度均较高。另 外,在离子晶体中很难产生自由运动的电子, 因此,它们都是良好的电绝缘体。但当处在
高温熔融状态时,正负离子在外电场作用 下可以自由运动,即呈现离子导电性。 2.共价键
(1)通过共用电子对形成稳定结构
(2)共价键键合的基本特点是核外电子云达 到最大的重叠,形成“共用电子对”,有 确定的方位,且配位数较小。 (3)共价键在亚金属(碳、硅、锡、锗等)、 聚合物和无机非金属材料中均占有重要地 位。 共价键晶体中各个键之间都有确定的 方位,配位数比较小。共价键的结合极为
超导材料:具有一定的低温条件下呈现出电阻 等于零以及排斥磁力线的性质的材料。 四.材料性能 金属材料:导电性,高的塑性和韧性,可作导 体 陶瓷材料:高硬度,较脆,可作绝缘体 高分子材料:弹性模量,强度,塑性都很低,多 数不导电 五.内部结构划分层次:原子结构、结合键、原子 的排列方式和显微组织 六.内部结构决定性能 举例:金属键材料内部有大量移动电子,使金
三.结论
1.原子核周围的电子按照四个量子数的规定 从低能到高能依次排列在不同的量子状态 下,同一原子中电子的四个量子数不可能 完全相同。
2.根据排列次序建立了元素周期表,各个周 期中的元素的性质呈现相同的周期变化规 律,元素在周期表上的位置不仅决定了单 个原子的行为,也决定了材料中原子的结 合方式以及材料的化学性能和物理性能。
第二节 原子结合键
一.原子结合键 1.存在状态:凝聚态(液态和固态) 分类 2.一次键:结合力较强,包括离子键、共 价键和金属键。 3.二次键:结合力较弱,包括范德瓦耳斯 键和氢键。
二. 一次键 1.离子键 (1)通过电子转移形成稳定结构,存在于大 多数盐类、碱类和金属氧化物,如NaCI、MgO、 CuO、Mg2Si、CrO2。 (2) 基本特点是以离子为基本结合单位。
的排布尽可能分占不同的能级,而且自旋的方向
相同。当电子排布为全充满、半充满或全空时,
是比较稳定的,整个原子的能量最低 。
二.元素周期表
1.具有相同核电荷数的同一类原子为一种元 素。
2.元素周期表是元素周期律的具体表现形式, 它反映了元素之间相互联系的规律,元素 在周期表中的位置反映了那个元素的原子 结构和一定的性质。
(4)自旋量子数(全名为自旋角动量量子数)
ms:反映电子不同的自旋方向 , ms = +1/2,1/2。
5.电子分布服原从理:
(1)最低能量原理:原子总是优先占据能量低的轨
道,使系统处于最低的能量状态。 (2)泡利不相容原理:一个原子中不可能存在有四 个量子数完全相同的两个电子。 (3)Hund规则:在同一亚层中的各个能级中,电子
三.二次键
1.二次键:借原子之间的偶极吸引力结合,例如 CH4、CO2、H2、H2O。 2.范德瓦耳斯键:属物理键,系一种次价键,没 有方向性和饱和性。比化学键的键能少1~2个数 量级,这主要是因为偶极吸引力的作用
3.范德瓦耳斯键的键能低,但它仍然是材料结合 键的重要组成部分,依靠它大部分气体才能聚合 为液态甚至固态,当然它们的稳定性极差。
(1)主量子数n: 决定原子中电子能量以及与核 的平均距离,即电子所处的量子壳层。 (n=1、 2、3、4…) (2)次量子数l:也称为轨道角量子数,给出电 子在同一量子壳层内所处的能级(电子亚壳层)。 l=0、1、2、3…,这些亚壳层习惯上以s、p、d、 f表示。 (3)磁量子数m: 给出每个轨道角动量量子数 的能级数或轨道数。它基本上确定了轨道的空间 取向。m=0、±1、±2、±3…。
