还原反应机理40页
还原反应的机理探索

还原反应的机理探索还原反应是化学中常见的一种反应类型,它指的是物质从氧化态转变为还原态的过程。
在该过程中,电子会从氧化剂转移到还原剂上,从而使还原剂发生还原反应。
本文将探索还原反应的机理,从宏观层面到微观层面,详细解释还原反应发生的原因和过程。
一、还原反应的概述还原反应是指发生氧化还原反应时,电子从氧化剂转移到还原剂上的过程。
在还原反应中,氧化剂接受了电子,而还原剂失去了电子。
还原反应不仅存在于化学实验中,也广泛应用于工业生产和自然界中。
例如,金属与非金属离子的反应以及氧气与金属的反应都属于还原反应。
二、还原反应的机理1. 电子转移理论还原反应中电子的转移是关键步骤之一。
根据电子转移的理论,氧化剂具有较高的氧化态,能够吸引和接受电子,而还原剂具有较低的氧化态,能够失去电子。
当还原剂与氧化剂接触时,电子从还原剂转移到氧化剂上,从而完成还原反应。
2. 过渡态与活化能在还原反应中,物质从氧化态到还原态的过程包括多个中间步骤,其中存在着反应物到产物的过渡态。
过渡态的形成需要克服活化能障碍,只有克服了活化能障碍,才能实现反应的进行。
因此,还原反应的速率取决于活化能的大小。
三、还原反应的实例分析1. 金属与非金属反应金属与非金属之间的反应是还原反应中常见的一种类型。
例如,氧气与铁反应产生氧化铁的过程即为还原反应。
在该反应中,铁失去了电子,被氧气氧化为氧化铁,而氧气则接受了电子,被还原为氧化铁。
2. 还原剂的应用还原剂在化学实验和工业生产中有着广泛的应用。
例如,亚硫酸氢钠常被用作还原剂。
它能将某些物质中的氧化剂还原为非氧化剂的形式,起到去除氧化剂的作用。
四、还原反应的微观机制1. 电子转移的研究从微观层面上观察,还原反应的机理主要包括电子的转移过程。
现代化学研究技术,如红外光谱和质谱等,可以帮助我们更加深入地理解电子转移的机制。
2. 中间物的形成还原反应发生时,常常会形成一些中间物。
这些中间物在反应前后扮演着重要的角色。
lw-还原反应2014

Lindlar 催化剂:以硫酸钡为载体,将钯黑吸附在其上, 抑制催化氢化活性的钯催化剂。
Lindlar 炔 Lindlar(林德拉)催化剂 Pd/BaSO4/喹啉
14
烯
③ 铂催化剂:铂黑、载体铂、铂碳、Adams 试剂
范围:除Raney镍所能应用范围,还用于酯基、酰胺基 氢化还原,苄位氢解。 特点:易中毒,不宜于有机硫化物、有机胺还原,对苯 环、共轭双键的氢化能力较钯强。
Pd - CaCO3 / H2 / 喹啉 CH2OH OH 9.81 * 104 Pa, 30~37 ℃ OH CH2OH
17
⑵ 影响氢化反应速度和选择性的因素
③反应条件的影响 a. 反应温度
O 25 ℃ Raney Ni / H2 9.81 * 106 Pa 260 ℃ 120 ℃
O
OH
OH
b. 反应压力
15
⑵ 影响氢化反应速度和选择性的因素
① 底物的结构 ② 催化剂因素的影响
③ 反应条件的影响
16
② 催化剂因素的影响 毒剂 poisons 和抑制剂 inhibitors
A. 催化剂中毒:在催化剂的制备或氢化反应过程中,
由于引入少量杂质,使催化剂的活性大大降低或完全丧 失,并难以恢复到原有活性的现象。 B. 阻化:使催化剂活性在某方面受到抑制,经过适当 活化处理可以再生的现象。 C. 毒剂:使催化剂中毒的物质。 指硫、磷、砷、铋、碘等离子及有机硫、有机胺类 D. 抑制剂:使催化剂阻化的物质。 使催化剂部分中毒,降低催化活性,提高选择性。
①还原范围广,反应活性高,速度快 ②选择性好 ③反应条件温和,操作方便 ④经济适用 ⑤后处理方便,干净无污染。
11
1. 多相催化氢化法 (1)常用催化剂
还原反应机理-PPT精品文档40页

9
二、锌粉其它还原
(1) 锌粉将硝基还原为氨基
NH2
NO 2 Zn/NaOH
C2H5O H,re1hf lux,
NH2 NH2
抗组胺药奥沙米特(oxatomide)中间体
(2)锌还可将醛或酮还原成醇
O C
Zn/ NaO H
C 2 H 5 O H ,7 0 ~ 7 4 C ,2 h
O H CH
钙拮抗剂盐酸马尼地平(manidipine)中间体
HO
N
CH3
CN O H2
HN S
06.11.2019
KBH4/NaOH/EtOH
H3C CH3
N CH3
H2 CN OH
HN S
21
9.1.4 硼烷还原剂
亲电性氢负离子转移还原剂 易还原羧基 与双键发生硼氢化反应
O 2 N
O
B 2 H 6 /T HF
C N3 ( )2 CH
,1 h
O 2 N
06.11.2019
27
二、催化剂
种类
常用金属 制法概要
举例
还原型 Pt , Pd , 金属氧化物用氢还原 铂黑,钯黑
Ni
甲酸型 Ni,Co 金属甲酸盐热分解
镍粉
骨架型 Ni,Cu 金属与铝的合金用碱溶 骨架镍
沉淀型 Pt , Pd , 金属盐水溶液用碱沉淀 胶体钯
Rh
硫化物型 Mo
金属盐用硫化氢沉淀 硫化钼
三、影响因素 (1) 原料: 中毒物质
(2) 温度和压力 (3 ) 物料的混和 (4) 反应介质
06.11.2019
30
常见用途
(1) 硝基化合物加氢还原制胺
COO 3 CH
化学氧化还原反应的机理

化学氧化还原反应的机理化学氧化还原反应是化学反应的一种重要类型,其机理涉及物质间电子的转移。
本文将深入探讨化学氧化还原反应的机理,并阐述其在化学领域的重要性。
一、氧化还原反应的基本概念氧化还原反应是指在化学反应中,某个物质失去电子而被氧化,同时另一物质获得同等数量的电子而被还原的过程。
在这类反应中,电子转移是至关重要的。
二、氧化还原反应的机理氧化还原反应的机理可以通过以下几个步骤来说明:1. 氧化剂和还原剂的反应在氧化还原反应中,通常会有一个物质起到氧化剂的角色,而另一个物质则扮演还原剂的角色。
氧化剂可以接受电子,而还原剂则可以捐赠电子。
这种电子的转移导致物质的氧化与还原。
2. 电子的转移氧化还原反应中,电子的转移是至关重要的。
当氧化剂与还原剂反应时,氧化剂会接受还原剂的电子,而对应的还原剂则会失去电子。
这种电子的转移可以通过电子传递过程或离子传递过程来实现。
3. 形成新的化学键在氧化还原反应中,电子的转移会导致化学键的形成或断裂。
当氧化剂接受电子时,它的氧化态会减少,形成新的化学键。
与此同时,还原剂失去电子,其还原态会增加,也形成新的化学键。
4. 反应的平衡氧化还原反应的机理中,为了保持原子总数和电荷守恒,氧化剂和还原剂之间的电子转移必须满足酸碱中子数平衡。
因此,氧化还原反应常会伴随着其他类型的反应,如酸碱中和反应等。
三、化学氧化还原反应的重要性化学氧化还原反应在化学领域具有广泛的应用和重要性,其主要体现在以下几个方面:1. 能源转化许多重要的能源转化过程都涉及氧化还原反应,如燃烧、电池反应等。
通过氧化还原反应,化学能转化为电能或其他形式的能量,为人类提供了便捷的能源来源。
2. 化学分析许多化学分析方法都利用了氧化还原反应的原理。
例如,氧化还原滴定法可以用于测定溶液中某种物质的含量,从而实现定量分析。
3. 金属和非金属的提取氧化还原反应在金属和非金属的提取过程中发挥重要作用。
例如,冶金过程中的还原反应可以将金属氧化物还原为相应的金属,从而实现金属的提取。
还原反应及其工艺PPT课件

O
H N
C
N H
O
C
Zn/HCl C2H5
S
C
C6H5 C
O
H N
CH2
N H
扑痫酮
• 选择性还原C=O成亚甲基,而不影响其它羰基。
O
C2H5
1 Fe/CH3CO2H
C2H5
O 2N
C HC O O H O
N
C HC O O H
O
2
O
O Zn/HCl(g)
N
C2H5 C HC O O H
O 吲哚布芬
冷凝器
第7页/共54页
• 铁粉还原适用范围:
• 硝基还原为氨基:铁粉还原法生产维生素B6,可避免发生氯的
脱落、氰基还原、酯基的水解等副反应,收率达到90%。加氢
还 原 , 收 率 只 有 5 0 % 。CO 2C2H5
O 2N
CN Fe/HCl H2N
CO 2C2H5 CN
H3C
N
Cl CH3CO2H H3C
第21页/共54页
• 碱度的影响:用硫化钠还原硝基苯,反应速度常数随碱的浓度 增加而增加,存在下述评衡。
• 硝基部分还原时,硫化碱用量超过理论值的5-10%,温度为4080℃(不超过100℃),避免完全还原。
• 硝基全部还原时,硫化碱用量超过理论值的10-20%,温度为60110℃,甚至可在高压釜中进行。
第6页/共54页
搅拌的影响:
铁粉比较重,需要良好的搅拌,否则容易沉到反应器底部。 衬有耐酸砖的平底钢槽和铸铁慢速耙式搅拌器。 新式反应器:衬耐酸砖的球底钢槽和不锈钢快速螺旋桨式搅拌器。
耙式搅拌器
耙臂上安装多 组可调节刮板, 搅拌物质可从 弧线形刮板的 间隙通过,搅 拌阻力小,降 低搅拌电机的 功耗。
化学反应中的氧化还原反应机理

化学反应中的氧化还原反应机理氧化还原反应(简称氧化反应和还原反应)是化学反应中最重要的一类反应。
它涉及到电子的转移过程,其中一个物质失去电子而被氧化,而另一个物质获得电子而被还原。
本文将针对氧化还原反应的机理进行讨论。
一、氧化还原反应的基本概念在化学反应中,氧化还原反应是指电子从一个物质转移到另一个物质的过程。
其中一个物质的氧化态增加,称为被氧化剂或氧化剂,它接受了另一个物质失去的电子;而另一个物质的氧化态降低,称为被还原剂或还原剂,它失去了电子。
在氧化还原反应中,电子的转移伴随着氧化剂和还原剂之间的化学键的形成和断裂。
氧化反应和还原反应总是同时进行,即使在方程式中只显示其中一个反应。
例如,当铜与氧气发生反应生成氧化亚铜(Cu2O)时,铜被氧化,氧气被还原。
反之,当焦炭还原二氧化锰时,焦炭被氧化,二氧化锰被还原。
二、氧化还原反应机理的描述氧化还原反应机理可以通过电子转移的过程来描述。
在氧化反应中,氧化剂从被氧化剂中接受电子,被氧化剂失去电子的同时转变为了其高一级的氧化态。
相反,在还原反应中,还原剂向氧化剂传递电子,还原剂的氧化态降低。
以铜和氧气的反应为例,可以描述其氧化还原反应机理如下:1. 氧气分子(O2)接受两个来自铜原子的电子,转变为氧化亚铜(Cu2O)。
这是氧化剂接受电子的过程。
2. 铜原子失去两个电子,转变为Cu2+离子。
这是被氧化剂失去电子的过程。
三、氧化还原反应的影响因素氧化还原反应的进行受到多种因素的影响,以下是几个常见的影响因素:1. 温度:通常情况下,随着温度的升高,氧化还原反应的速率也会增加,这是因为高温下分子的活动性增强,有利于电子的转移。
2. 浓度:反应物的浓度越高,反应速率越快。
这是因为更高的浓度意味着更多的分子之间碰撞的机会,进而促进反应的进行。
3. 催化剂:某些物质可以加速氧化还原反应,这些物质被称为催化剂。
催化剂通过提供反应物之间的新途径,降低了反应的活化能,从而加速了反应速率。
化学反应中的还原反应机理

化学反应中的还原反应机理化学反应是物质转化的过程,其中还原反应是一种重要的反应类型。
还原反应发生时,原本被氧化的化合物会接受电子从而还原。
本文将探讨还原反应的机理以及一些常见的还原反应类型。
1. 还原反应的机理还原反应中涉及到电子转移的过程。
当一种物质失去电子,它被氧化;而当一种物质获得电子,它被还原。
在还原反应中,存在还原剂和氧化剂两种物质。
还原剂是指通过给予电子而将其他物质还原的物质;而氧化剂则是通过接受电子而将其他物质氧化的物质。
还原反应的机理可以通过半反应方程式来描述。
例如,对于锌和硫酸反应生成氢气的反应:Zn + H2SO4 → ZnSO4 + H2↑可以分解为两个半反应:还原反应半反应:Zn → Zn2+ + 2e^-氧化反应半反应:H2SO4 + 2e^- → H2↑ + SO42-在上述反应中,锌为还原剂,它被氧化为离子形式,而硫酸则为氧化剂,它接受锌释放的电子从而被还原为硫酸根离子。
2. 还原反应的类型还原反应可以分为多种类型,下面介绍其中几种常见的类型。
2.1 金属的还原反应金属的还原反应是最常见的还原反应类型之一。
在金属与非金属或金属离子发生反应时,金属往往会失去电子被氧化,同时非金属或金属离子会接受电子被还原。
例如,铜与硝酸反应生成亚硝酸盐和氮气的反应:3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O其中铜被氧化为铜离子,而硝酸则被还原为亚硝酸盐和氮气。
2.2 氧化物的还原反应氧化物的还原反应是指氧化物与还原剂发生反应,氧化物被还原为它们的原始形式。
例如,二氧化锰与盐酸反应生成氯化锰和水:MnO2 + 4HCl → MnCl2 + 2H2O + Cl2↑在这个反应中,二氧化锰作为还原剂,它被还原为氯化锰和水。
2.3 有机化合物的还原反应除了无机化合物,有机化合物也可以参与还原反应。
例如,酮类化合物可以被还原为相应的醇。
这种还原反应通常采用氢气和催化剂作为还原剂,如下所示:R2C=O + H2 → R2CHOH在这个反应中,酮被氢气还原为醇。
有机化学基础知识点还原反应的机理和规律

有机化学基础知识点还原反应的机理和规律有机化学是研究有机物(含碳元素的化合物)的合成、结构、性质以及反应机理的学科。
在有机化学中,还原反应是一类重要的反应类型。
本文将探讨有机化学基础知识点还原反应的机理和规律。
一、还原反应的基本概念还原反应是指有机化合物中含有高价态的碳、氮、氧等元素与还原剂作用,使其氧化数降低的反应。
还原反应中的还原剂一般是能够提供电子的化合物。
在有机化学中,还原反应常见的有氢化反应、金属还原、氢化铝锂还原等多种反应。
下面我们将逐个介绍这些还原反应的机理和规律。
二、氢化反应的机理和规律氢化反应是指有机化合物与氢气作用,将其中的氧化数降低,形成对应的氢化物的反应。
氢化反应常用催化剂如铂、钯等金属催化剂催化进行。
氢化反应的机理是通过催化剂提供的氢气分子中的氢原子与有机化合物中的氧化剂发生直接的氢原子迁移反应。
氢化反应的规律是氧化数越高的化合物,其对应的氢化反应越容易发生。
三、金属还原的机理和规律金属还原是指有机化合物中的氧化剂与金属反应,形成金属与对应的氧化物的反应。
金属还原常用的金属有锌、铝等。
金属还原的机理是通过金属作为还原剂,被氧化剂氧化形成阳离子,然后与有机化合物发生反应。
金属还原的规律是氧化剂的氧化能力越强,其与金属的反应越容易发生。
四、氢化铝锂还原的机理和规律氢化铝锂还原是指有机化合物中的氧化剂与氢化铝锂反应,形成对应的氢化物和铝锂氧化物的反应。
氢化铝锂还原是一种常用的有机合成方法。
氢化铝锂还原的机理是通过氢化铝锂作为强还原剂,提供电子给有机化合物的氧化剂,从而实现氧化数的降低。
氢化铝锂还原的规律是氧化剂的氧化能力越强,其与氢化铝锂的反应越容易发生。
五、还原反应的应用还原反应在有机化学中有着广泛的应用。
它可用于有机物的合成、功能团的转化以及化学反应的控制等方面。
通过了解还原反应的机理和规律,可以帮助化学家设计和优化合成路线,提高反应的选择性和效率。
六、结语还原反应是有机化学中的重要反应类型,具有广泛的应用价值。
药物合成反应还原反应1

Wilkinson cat.
• (Ph3P)RhCl-通常只还原位阻最小的双键; • 加入Ph3P不但能够促进催化剂在有机溶剂中的溶解度,而且使其更具空间效应。
第22页/共142页
• 2. 溶解金属还原 • 金属+酸: Clemmensen reduction
第23页/共142页
Blanc Reduction
• 溶解金属还原的一般过程:双电子化,双质子化。 第27页/共142页
伯奇还原
金属钠溶解在液氨中可得到一种蓝色的溶液,它 在醇的存在下,可将芳香化合物还原成1,4-环己二烯 化合物,该还原反应称为伯奇还原。
Na NH3(l) C2H5OH
1 K、Li能代替Na,乙胺能代替氨; 2 卤素、硝基、醛基、酮羰基等对反应有干扰。
第56页/共142页
Myers’ Aldehyde Syn.
第57页/共142页
第58页/共142页
(3) Zn-Hg
第59页/共142页
5(1. )ODitimhieder RReedudcutiocntion Methods
第60页/共142页
第61页/共142页
Formation (generation) of reagents (diimide)
第28页/共142页
反应机理:
Na + NH3
Na+ + (e-) NH3
溶剂化电子
金属钠溶解在液 氨中可得到一种 蓝色的溶液,这 是由钠与液氨作 用生成的溶剂化 电子引起的
(e-)NH3
CH3OH
-CH3O-
自由基负离子
(e-) NH3
CH3OH
负离子
还原反应机理

(7) 还原芳烃
COOH
H2 / 5%Pd C
145 ~ 160C,3.92MPa
COOH
(8)还原烯键或炔键
H3CO 2019/10/13
CH CHCOOH
H2 / 5%Pd C
NaH 2PO 2
H3CO
CH 2 CH 2COOH
心血管药物艾司洛尔(Esmolol)中间体
34
9.2.2 均相催化氢化
• 铑、钌、铱的三苯膦络合物等,如氯 化三苯膦络铑(Ph3P)3RhCl,磷可以和这 些金属形成牢固的配位键
C6H5CH
C H
NO2
(Ph3P)3RhCl,C6H6 H2
C6H5CH2CH2NO2
2019/10/13
35
(Ph3P)3RhCl + S + H2
C
H
Ph3P
Rh
C
Ph3P
H Cl
(II)
3. 实例分析
NH2 F
F
F
CH3(CH2)4COCH3
Na CH3(CH2)4CHCH3 OH
Sn/HCl
O2N
COOH
H2N
COOH
2019/10/13
13
9.1.2 含硫化合物还原剂
一、用硫化碱的还原
硫化钠 硫氢化钠 多硫化钠 铵类硫化物 硫化铁
还原芳香族硝基 ——齐宁(Zinin)还原
ArNO2
氢化偶氮化合物
联苯胺系化合物
C6H5 N H2 N H2C6H5 slow NH2C6H4 C6H4 NH2
k[ ArNHNHAr][H ]2
2019/10/13
还原反应课件
H3COCHC PhC C
C H COCH3
Hg-Zn H3CH2CH2CH2C HCl
Hg-Zn HCl
PhHC
C H
CH2CH3
α,β-不 饱 和 醛 酮 同 时 被 还 原
COCH2CH2COOH Hg-Zn HCl
CH2CH2CH2COOH
羧基不被还原
2024/6/15
第27页/共50页
2 . 黄鸣龙还原(碱性条件下还原)
第30页/共50页
二、 还原成醇的反应
1. 金属复氢化合物还原剂(LiAlH4 KBH4)
O
OH
R C R' [H]
R C R' H
(1)LiAlH4为还原剂
R
C O + AlH4 R'
H2O R C
R'
H
R CO
R'
H-AlH3
OH
R C
R'
H
OAlH3
2024/6/15
第31页/共50页
特点:①还原能力强,除 C C , C X 外,都被还原,选择性弱
—— is called as a dissolving metal reduction ——可被还原的化合物主要有炔烃、苯和酮
Байду номын сангаас
2024/6/15
第8页/共50页
反应机理
H3C C C CH3 + Na
H H3C C C
CH3
Na - Na
a vinylic radical
- Na
H3C C C CH3 H NH2
亚当斯1889年生于美国波士顿,1908年毕业于哈佛大学,曾在 柏林E·费歇尔实验室从事博士后研究工作。这一年的国外学习为 他以后一生的事业奠定了基础,使他成长为美国化学界最有代表性 的人物之一。
化学反应的还原机理

化学反应的还原机理在化学领域中,我们经常会遇到各种各样的反应,其中包括氧化和还原反应。
还原反应是指物质在某些条件下获得电子,减少其价态的过程。
本文将探讨化学反应的还原机理,并解释为什么某些物质能够发生还原反应。
一、还原反应的定义和基本概念在化学中,还原是指某个物质失去氧化态以获得更多电子的过程。
还原的过程涉及到两个关键概念:氧化态和还原态。
氧化态是指物质中的原子所能得到的电子数,而还原态则是相反的过程,即物质中原子所能失去的电子数。
二、还原反应的发生条件还原反应的发生需要满足以下几个条件:1.有足够的还原剂:还原反应中的物质称为还原剂,它能够提供所需的电子以实现还原。
常见的还原剂包括金属、还原性非金属和亚稳态化合物等。
2.存在氧化剂:氧化剂是能够接受还原剂提供的电子的物质。
在还原反应中,氧化剂得到了电子,它本身被还原,从而促进了还原反应的进行。
三、还原机理还原反应的机理主要涉及电子转移和氧化态的变化。
在还原反应中,还原剂失去电子,其氧化态减小,而氧化剂获得电子,其氧化态增加。
还原反应可以通过两种方式进行:直接还原和间接还原。
1.直接还原:直接还原是指还原剂直接给予氧化剂电子,使其发生氧化,还原剂本身则发生了还原。
这种反应常见于某些金属的腐蚀、还原性非金属与氧化物的反应等。
例如,金属铁在湿气中会发生腐蚀反应,即Fe + O2 -> Fe2O3,铁失去电子被氧化成了三价铁离子,而氧气则被还原成了氧化物。
2.间接还原:间接还原是指还原剂先与氧化剂反应生成复合物,然后再释放出电子给予氧化剂。
这种反应常见于有机化合物的还原反应中。
例如,酮类化合物可以通过还原剂氢气在催化剂的作用下发生还原反应。
反应方程式为R-C=O + H2 -> R-CHO,在此反应中,酮被还原成醛,而氢气则是还原剂。
通过以上例子可以看出,化学反应的还原机理是基于物质之间电子转移和氧化态的变化。
还原反应的机理不仅适用于单个反应,也适用于复杂的化学反应过程。
1,4还原和1,2还原反应机理

1. 1,4还原和1,2还原反应的概念在化学领域,还原和氧化是非常重要的概念。
还原反应指的是一种化学反应,其中某个物质失去氧化态,而另一个物质在同一时间获得了氧化态。
相反,氧化反应是指发生氧化作用的化学反应,其中某个物质获得了氧化态,而另一个物质在同一时间失去了氧化态。
2. 1,4还原反应机理1,4还原反应指的是一种有机化学反应,其中含有碳-碳双键的α, β-不饱和酮或羰基化合物与某些还原剂反应,发生亲核加成反应,形成相邻两个碳原子之间的醇类产物。
1,4还原反应的机理主要分为三个步骤:步骤1:亲核加成亲核加成是指有亲核试剂攻击不饱和键,形成新的化学键。
在1,4还原反应中,亲核试剂通常为硫醇、硒醇、酚类或亚砜。
这些亲核试剂中的亲核试剂会攻击不饱和键上的碳原子,形成一个中间体离子。
步骤2:质子转移在亲核试剂攻击不饱和键后,会形成一个中间体离子。
接下来,质子(H+)会从某个位置转移到另一个位置,形成一个新的离子。
步骤3:质子脱除在1,4还原反应的最后一个步骤中,水分子或其他质子脱除剂会去除中间体离子中的质子,形成最终的醇类产物。
3. 1,2还原反应机理1,2还原反应是另一种有机化学反应,指的是α, β-不饱和酮或羰基化合物在某些还原剂作用下,发生亲电加成反应,生成相邻两个碳原子之间的醇类产物。
1,2还原反应的机理和1,4还原反应类似,也可以分为亲核加成、质子转移和质子脱除三个步骤。
4. 1,4还原和1,2还原反应的应用1,4还原和1,2还原反应都是有机合成中常用的重要反应,可以制备出各种醇类化合物。
这些醇类化合物在药物、香料、杀虫剂等化工领域具有重要的应用价值。
这些反应也在食品工业中用于酮类化合物的还原制备过程中。
5. 结语在有机化学中,1,4还原和1,2还原反应是非常重要的反应,对于合成醇类化合物具有重要的意义。
深入理解这些反应的机理和应用,有利于进一步探索有机合成的新方法和新领域。
希望本文对读者有所帮助,欢迎探讨和交流。
石油化工技术《8还原反应机理》
A r
.. -+H+
NO H
A r N . H O H --OH-
. Fe0
Ar NH +e
A r
.. - +H+
NH
Ar NH2
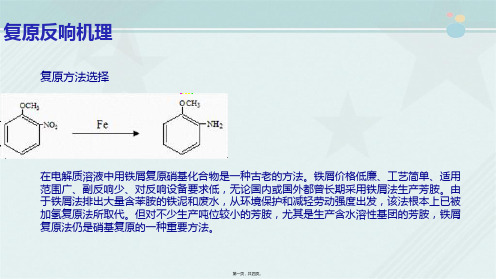
在电解质溶液中的铁屑复原反响是个电子得失的转移过程。铁屑是电子的供给者,电子向硝基转移,
使硝基化合物产生负离子自由基,然后与质子供给者如水提供的质子结合形成复原产物。N原子得到
电子,其化合价由3→1→-1→-3变化,中间产物ArNO、ArNOH比底物ArNO2更容易被复原,所以 不易别离,难以检测。
第二页,共四页。
谢谢观看
课程:化工产品合成 知识点:复原反响的机理
第三页,共四页。
江苏高校品牌专业——石油化工技术
内容总结
复原反响机理。铁屑价格低廉、工艺简单、适用范围广、副反响少、对反响设备要求低,无论国内或国外都曾长期采用铁屑法
生产芳胺。由于铁屑法排出大量含苯胺的铁泥和废水,从环境保护和减轻劳动强度出发,该法根本上已被加氢复原法所取代。
4ArNO2+9Fe+4H2O
4ArNH2+3Fe3O4。+H+。+H+。-OH-。在电解质溶液中的铁屑复原反响是个电子得失的转移过程。谢谢观看
第四页,共四页。
第一页,共四页。
复原反响机理
铁屑复原硝基反响历程:
4ArNO2+9Fe+4H2O
AAArrr
..OOO-H
NNN
OOO
Fe0 +e
+H+
FeCl2
4ArNH2+3Fe3O4
Fe0 +e
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Sn/HCl
8 5 C
H 2 N
C H 3 C H 3 NCN
C H 3
驱虫药甲氨基苯脒中间体
HO
NN
OH
SnCl2/HCl
H2N
OH
05.05.2020
11
NO2 F
3. 实例分析
NH2 F
F
F
CH3(CH2)4COCH3
Na CH3(CH2)4CHCH3 OH
Sn/HCl
O2N
COOH
H2N
NO 2
S3 N O S3 a N Oa
NHS 3NO a
第一阶段: 100~105℃
12~13%NaOH 还原
第二阶段: 90~95℃
9%NaOH
还原
第三阶段: 50℃
稀盐酸
转位
第四阶段:
稀硫酸及硫酸钠 成盐析出
05.05.2020
8
二、锌粉其它还原
(1) 锌粉将硝基还原为氨基
NH2
NO 2 Zn/NaOH
C2H5O H,re1hf lux,
NH2 NH2
3
(2)钠和钠汞齐作为还原剂
Birch反应 芳香族化合物
液氨
H3C OH
非共轭二烯
H3C OH
Li/N 3/E H 2O t
40C,30min
H
H3CO
H3CO
Bouveault-Blanc反应: 羧酸酯 金属钠+无水乙醇 伯醇
Ph
Na/EtOHP /A hcOEt
CH C 2 C HOOEt
CH C 2 C H 2 O HH
氢化偶氮化合物
联苯胺系化合物
C 6 H 5 N H 2 N H 2 C 6 H 5 s l o w N H 2 C 6 H 4 C 6 H 4 N H 2
k[A rN H N H A r][H ]2
05.05.2020
7
2 A r N O 2 5 Z n H 2 O A r N H N H A r 5 Z n O
COOH
05.05.2020
12
9.1.2 含硫化合物还原剂
一、用硫化碱的还原
硫化钠 硫氢化钠 多硫化钠 铵类硫化物 硫化铁
还原芳香族硝基 ——齐宁(Zinin)还原
A r N O 2 6 S 2 7 H 2 O 4 A r N H 2 3 S 2 O 3 2 6 O H
电子供给者 硫化物
O
N O
Z n 2 H ,5 )(O C CH COOH
HC0 l(C g)
C2 C H 3H
N O
CH CO C2 C H 3H
抗凝血药吲哚布芬(Indobufen)
05.05.2020
10
(4)锡和二氯化锡作为还原剂
在酸性条件下可还原硝基成氨基
O 2 N
C H 3 C H 3 NCN
C H 3
9.1 化学还原反应
• 9.1.1 金属还原剂
• 1. 底物与进攻试剂
• ▲活泼金属
• ▲合金
• ▲其盐类。
• 一般用于还原反应的活泼金属有碱金属、 碱土金属、以及铝、锡、铁等。合金包括钠汞 齐、锌汞齐、铝汞齐、镁汞齐等。金属盐有硫 酸亚铁、氯化亚锡等。
05.05.2020
1
2. 反应机理及影响因素
CO+ M
M-e CO M
H CO M
H C OH
O Ar N
O
Fe-e
O Ar N
H
O
Ar N
Fe-e
O
Ar N
O
OH
OH
H _H2O
Fe-e
H
Ar N O
Ar N O
Fe-e Ar N OH
A05r.05.N2020O H
H
Ar
H N
Fe-e OHArHNHFe-e Ar
NH
H
Ar NH2
2
(1)铁和低价铁盐为还原剂
05.0P 5.202h 0
8 5 ~ 9 0 C ,1 ~ 2 h
Ph
4
(3)锌和锌汞齐作为还原剂
一、强碱性介质中锌粉还原 亚硝基、羟胺化合物
氧化偶氮化合物
+ + ArNOArNHOH ArN=NHA 2Or
副反应
O
+ 3 ArNHOH ArN=NArN2H
O
+ + ArNHOH2 H
ArN 2 HH2O
4 A r N O 2 9 F e 4 H 2 O 4 A r N H 2 3 F e 3 O 4 电解质 介质 化学结构与反应活性
铁的品质和用量 过程与特点
O 2 N 05.05.2020
Fe4 C /N l H
CHCN
9 5 C ,1 .5 h
C H 3
H 2 N
CH C H 3
消炎药苯恶洛芬中间体
抗组胺药奥沙米特(oxatomide)中间体
(2)锌还可将醛或酮还原成醇
O C
Zn/ NaO H
C 2 H 5 O H ,7 0 ~ 7 4 C ,2 h
O H CH
钙拮抗剂盐酸马尼地平(manidipine)中间体
05.05.2020
9
酸性条件下
还原醛基、酮基为甲基或亚甲基
Clemmensen反应
碱度的影响 取代基的影响
OCH3
NO2
OCH3 NH2
NO2
NO2
还原过程 05.05.2020
部分还原、完全还原
15
二、用含氧硫化物的还原
亚硫酸盐 连二亚硫酸钠
(1) 亚硫酸盐还原
亚硫酸盐可将硝基、亚硝基、羟胺基、偶氮基还原成 氨基,将重氮盐还原成肼。
A rN 2H S O 4 2 N H a 2 H S O S O 4 3ArN N H 2 A H c i2 d O ,h y 2 d N ro a lH y s S iO s 4 A rN H N H 2
C2H N
K4 B /N HaOH/EtOH C2H N
O H N S
O H H N S
05.05.2020
驱虫药左旋咪唑中间体
14
还原剂的影响:
4 A r N O 2 6 N a 2 S 7 H 2 O 4 A r N H 2 3 N a 2 S 2 O 3 6 N a O H
A r N O 2 N a 2 S 2 H 2 O A r N H 2 N a 2 S 2 O 3
05.05.2020
5
一、强碱性介质中锌粉还原
亚硝基、羟胺化合物
氧化偶氮化合物
氢化偶氮化合物
+ ArN=N2H A 2r
O
+ ArNHNHH2 A Or
副反应:
+ ArN=3 N H 2Ar
05.05.2020
O
+ 2Ar2 NH H 2O
6
一、强碱性介质中锌粉还原
亚硝基、羟胺化合物
氧化偶氮化合物
质子供给者 水或醇
S
2 2
S0S2S22
05.05.2浓020 度较稀时是一个双分子反应过程
13
OH CH3
CH
OH CH3
CH
O
C l
KB4/H EtOH
reflux
HO
避孕药炔诺酮中间体
O
Na 4 /B C 3 O H HH
C2 C Hl
r.t.,2h
C l
O H C2 C Hl
C l
抗真菌药芬替康唑中间体 C l
